
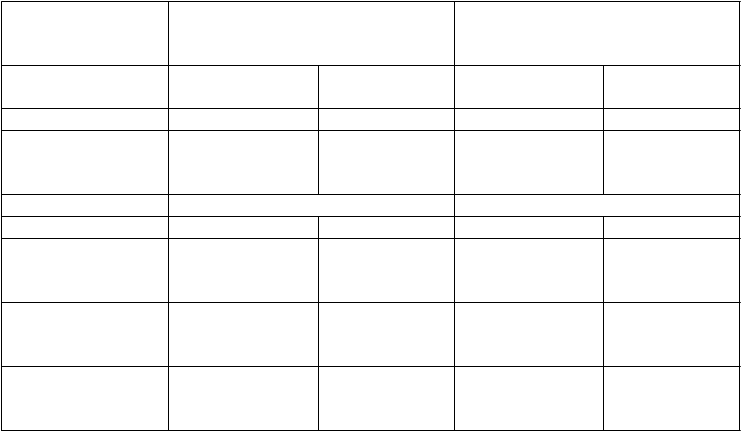
Nežiaduce reakcie 4. stupňa (okrem klinicky nepodstatných laboratórnych abnormalít)
Úprava dávky sa zvyčajne nevyžaduje.
Zvážte pridanie podpornej starostlivosti podľa indikácie. Prerušte liečbu, kým sa nežiaduca reakcia nezníži na stupeň
≤ 1.
Pridajte podpornú starostlivosť podľa indikácie. Zvážte opätovné začatie liečby s nižšou dávkou.
Prerušte liečbu, kým sa nežiaduca reakcia nezníži na stupeň
≤ 1.
Pridajte podpornú starostlivosť podľa indikácie. Opäť začnite liečbu s nižšou dávkou.
Prerušte liečbu.
Poskytnite vhodnú lekársku starostlivosť.
Ak sa nežiaduca reakcia zníži na stupeň ≤ 1, opäť začnite liečbu s nižšou dávkou.
Ak sa nežiaduca reakcia nezníži, trvale zastavte liečbu
CABOMETYXOM.
Poznámka: Stupne toxicity sú v súlade s bežnými terminologickými kritériami pre nežiaduce udalosti Národného inštitútu pre výskum rakoviny verzie 4.0 (National Cancer Institute Common Terminology Criteria for Adverse Events – NCI-CTCAE v4).
Súčas ne uží vané li eky Súčasne užívané lieky, ktoré sú silnými inhibítormi CYP3A4, sa majú užívať s opatrnosťou a dlhodobému užívaniu súčasne užívaných liekov, ktoré sú silnými induktormi CYP3A4, sa treba vyhnúť (pozri časti 4.4 a 4.5).
Treba zvážiť voľbu alternatívnych súčasne užívaných liekov, ktoré nemajú žiadny alebo majú minimálny potenciál indukovať či inhibovať CYP3A4.
Osobitné populácie St arší pacienti Pri použití cabozantinibu u starších osôb (≥ 65 rokov) sa neodporúča žiadna osobitná úprava dávky.
RasaSkúsenosti s cabozantinibom u iných ako belošských pacientov sú malé.
Pacienti s poruc hou f unkcie obli či ek U pacientov s miernou až stredne závažnou poruchou funkcie obličiek sa má cabozantinib používať opatrne. Cabozantinib sa neodporúča používať u pacientov so závažnou poruchou funkcie obličiek, pretože v tejto
populácii nebola dosiaľ stanovená jeho bezpečnosť a účinnosť.
Pacienti s poruc hou f unkcie pe čene U pacientov s miernou až stredne závažnou poruchou funkcie pečene je odporúčaná dávka 40 mg jedenkrát denne. Pacienti majú byť monitorovaní kvôli výskytu prípadných nežiaducich udalostí a úprava dávky alebo
prerušenie dávkovania majú byť podľa potreby zvážené (pozri časť 4.2). Cabozantinib sa neodporúča
používať u pacientov so závažnou poruchou funkcie pečene, pretože v tejto populácii nebola dosiaľ
stanovená jeho bezpečnosť a účinnosť.
Pacienti s poruchou funkcie srdca
O pacientoch s poruchou funkcie srdca sú len obmedzené údaje. K dávkovaniu nie je možné dať žiadne osobitné odporúčania.
Pediatrická populácia
Bezpečnosť a účinnosť cabozantinibu u detí a dospievajúcich vo veku < 18 rokov neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Spôsob podávania
CABOMETYX je určený na perorálne použitie. Tablety sa majú prehltnúť celé a nerozdrvené. Pacienti majú
byť poučení, aby nič nejedli aspoň 2 hodiny pred užitím a 1 hodinu po užití CABOMETYXU.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Keďže väčšina udalostí sa môže vyskytnúť na začiatku liečby, lekár má počas prvých ôsmich týždňov liečby pozorne hodnotiť stav pacienta s cieľom stanoviť, či je potrebná úprava dávky. Udalosti, ktoré sa zvyčajne prejavia na začiatku liečby, zahŕňajú hypokalcémiu, hypokaliémiu, trombocytopéniu, hypertenziu, palmárno- plantárny erytrodyzestetický syndróm (PPES), proteinúriu a gastrointestinálne (GI) udalosti (abdominálnu bolesť, zápal sliznice, zápchu, hnačku, vracanie).
Ku zníženiu dávky a prerušeniu dávkovania z dôvodu výskytu nežiaducich udalostí došlo u 59,8%, resp. u
70% pacientov liečených cabozantinibom v pivotnej klinickej štúdii. Zníženie dávky dvakrát bolo nutné u
19,3% pacientov. Medián času do prvého zníženia dávky bol 55 dní, do prvého prerušenia dávky 38 dní.
Perforácie a fistuly
Pri užívaní cabozantinibu boli pozorované závažné perforácie a fistuly gastrointestinálneho traktu, ktoré boli
niekedy smrteľné. Pred začatím liečby cabozantinibom je potrebné starostlivo vyhodnotiť pacientov, ktorí majú zápalové črevné ochorenie (napr. Crohnovu chorobu, ulceróznu kolitídu, peritonitídu, divertikulitídu
alebo apendicitídu), infiltrácie tumoru do gastrointestinálneho traktu alebo komplikácie z predchádzajúceho
chirurgického zákroku v gastrointestinálnom trakte (najmä ak sú spojené s predĺženým alebo neúplným hojením). Následne je nutné týchto pacientov pozorne sledovať, či sa u nich nevyskytnú príznaky perforácií a fistúl vrátane abscesov. Pretrvávajúca alebo recidivujúca hnačka počas liečby môže byť rizikovým faktorom tvorby análnej fistuly. Cabozantinib sa má vysadiť u pacientov s perforáciou gastrointestinálneho traktu alebo fistulou, ktorá sa nedá primerane zvládnuť.
Tromboembolické príhody
Pri užívaní cabozantinibu boli pozorované príhody venózneho tromboembolizmu vrátane pľúcneho
embolizmu a príhody arteriálneho tromboembolizmu. Cabozantinib sa má používať s opatrnosťou
u pacientov s rizikom takýchto príhod alebo u pacientov, ktorí majú takéto príhody v anamnéze. Podávanie
cabozantinibu sa má zastaviť u pacientov, u ktorých došlo k akútnemu infarktu myokardu alebo inej klinicky významnej arteriálnej tromboembolickej komplikácii.
Hemorágia
Pri užívaní cabozantinibu sa pozorovala závažná hemorágia. Pacientov, ktorí majú pred začiatkom liečby
v anamnéze závažné krvácanie, je nutné pred začiatkom liečby cabozantinibom dôkladne vyhodnotiť. Cabozantinib sa nemá podávať pacientom so závažnou hemorágiou alebo s rizikom závažnej hemorágie.
Komplikácie hojenia rán
Pri užívaní cabozantinibu boli pozorované komplikácie hojenia rán. Ak je to možné, liečba cabozantinibom
sa má zastaviť aspoň 28 dní pred plánovaným chirurgickým zákrokom vrátane dentálneho zákroku. Rozhodnutie o pokračovaní v liečbe cabozantinibom po chirurgickom zákroku sa má urobiť na základe klinického posúdenia dostatočného hojenia rany. Cabozantinib sa má vysadiť u pacientov s komplikáciami hojenia rán, ktoré si vyžadujú lekársky zásah.
H
y
pertenzia
Pri užívaní cabozantinibu bola pozorovaná hypertenzia. Pred začatím liečby cabozantinibom je nutné riadne kontrolovať krvný tlak. Počas liečby cabozantinibom, všetkých pacientov treba sledovať, či sa u nich nevyskytne hypertenzia, a podľa potreby liečiť štandardnou antihypertenznou liečbou. Ak napriek použitiu antihypertenzív hypertenzia pretrváva, dávka cabozantinibu sa má znížiť. Ak je hypertenzia závažná
a pretrváva aj napriek antihypertenznej liečbe a zníženiu dávky cabozantinibu, cabozantinib sa má vysadiť.
V prípade hypertenznej krízy sa má cabozantinib vysadiť.
Palmárno-plantárny erytrodyzestetický syndróm
Pri užívaní cabozantinibu bol pozorovaný palmárno-plantárny erytrodyzestetický syndróm (PPES). V prípade závažného PPES sa má zvážiť prerušenie liečby cabozantinibom. Liečba s nižšou dávkou
cabozantinibu sa má znovu začať až po zlepšení PPES na 1. stupeň.
Proteinúria
Pri užívaní cabozantinibu bola pozorovaná proteinúria. Počas liečby cabozantinibom sa majú pravidelne sledovať proteíny v moči. Ak sa u pacienta vyvinie nefrotický syndróm, cabozantinib sa má vysadiť.
Syndróm reverzibilnej posteriórnej leukoencefalopatie
Pri užívaní cabozantinibu bol pozorovaný syndróm reverzibilnej posteriórnej leukoencefalopatie (RPLS), známy aj ako syndróm posteriórnej reverzibilnej encefalopatie (PRES). O tomto syndróme je nutné uvažovať u všetkých pacientov s viacerými príznakmi, ako sú záchvaty, bolesť hlavy, poruchy videnia, zmätenosť
alebo zmenená duševná funkcia. U pacientov s RPLS sa má cabozantinib vysadiť.
PredĺženieQTintervalu
Cabozantinib sa má používať s opatrnosťou u pacientov s anamnézou predĺženia QT intervalu, u pacientov užívajúcich antiarytmiká alebo u pacientov s relevantným preexistujúcim srdcovým ochorením,
bradykardiou alebo výkyvmi hladín elektrolytov. Počas používania cabozantinibu sa má zvážiť pravidelné
sledovanie EKG a elektrolytov (sérového vápnika, draslíka a horčíka).
Induktory a inhibítory CYP3A4
Cabozantinib je substrátom pre CYP3A4. Súbežné podávanie cabozantinibu so silným inhibítorom CYP3A4 ketokonazolom viedlo k zvýšeniu expozície cabozantinibu v plazme. Pri podávaní cabozantinibu spolu so silnými inhibítormi CYP3A4 sa vyžaduje opatrnosť. Súbežné podávanie cabozantinibu so silným
induktorom CYP3A4 rifampicínom viedlo k zníženiu expozície cabozantinibu v plazme. Preto sa treba
vyhnúť dlhodobému podávaniu liekov, ktoré sú silnými induktormi CYP3A4, spolu s cabozantinibom (pozri
časti 4.2 a 4.5).
Substráty P-glykoproteínu
Cabozantinib bol inhibítorom (IC50 = 7,0 μM), ale nie substrátom P-glykoproteínových (P-gp) transportných aktivít v dvojsmernom testovacom systéme, ktorý používal bunky MDCK-MDR1. Cabozantinib preto môže
mať potenciál zvýšiť koncentrácie súbežne podávaných substrátov P-gp v plazme. Pri užívaní cabozantinibu musia byť pacienti upozornení na užívanie substrátov P-gp (ako je fexofenadín, aliskirén, ambrisentan,
dabigatran etexilát, digoxín, kolchicín, maravirok, posakonazol, ranolazín, saxagliptín, sitagliptín, talinolol,
tolvaptan) (pozri časť 4.5).
Inhibítory MRP2
Podávanie inhibítorov MRP2 môže spôsobiť zvýšenie koncentrácie cabozantinibu v plazme. Preto sa má k súčasnému užívaniu inhibítorov MRP2 (napr. cyklosporínu, efavirenzu, emtricitabínu) pristupovať
s opatrnosťou (pozri časť 4.5).
Upozornenie v súvislosti s pomocnými látkami
Pacienti so zriedkavými dedičnými problémami intolerancie galaktózy, Lapp laktázovej deficiencie alebo glukózo-galaktózovej malabsorpcie nemajú užívať tento liek.
4.5 Liekové a iné interakcie
Ú
činok iných liekovnacabozantinib
Inhibítory a induktory CYP3A4
Podávanie silného inhibítora CYP3A4 ketokonazolu (400 mg denne počas 27 dní) zdravým dobrovoľníkom znížilo klírens cabozantinibu (o 29 %) a zvýšilo expozíciu cabozantinibu v plazme po jednorazovej dávke (AUC) o 38 %. Preto sa má k súčasnému podávaniu silných inhibítorov CYP3A4 (napr. ritonaviru, itrakonazolu, erytromycínu, klaritromycínu, grapefruitového džúsu) s cabozantinibom pristupovať opatrne.
Podávanie silného induktora CYP3A4 rifampicínu (600 mg denne počas 31 dní) zdravým dobrovoľníkom zvýšilo klírens cabozantinibu (4,3-krát) a znížilo expozíciu cabozantinibu v plazme po jednorazovej dávke (AUC) o 77 %. Preto sa treba vyhnúť dlhodobému súbežnému podávaniu induktorov CYP3A4 (napr. fenytoínu, karbamazepínu, rifampicínu, fenobarbitalu alebo rastlinných prípravkov obsahujúcich ľubovník bodkovaný [Hypericum perforatum]) s cabozantinibom.
Látky meniace pH žalúdka
Súbežné podávanie inhibítora protónovej pumpy (PPI) ezomeprazolu (40 mg denne počas 6 dní) spolu
s jednorazovou dávkou cabozantinibu 100 mg zdravým dobrovoľníkom neviedlo ku klinicky významnému účinku na expozíciu cabozantinibu v plazme (AUC). Pri podávaní látok meniacich pH žalúdka (t. j. PPI, antagonistov receptorov H2 a antacíd) súbežne s cabozantinibom nie je indikovaná úprava dávky.
Inhibítory MRP2
Údaje in vitro preukázali, že cabozantinib je substrátom MRP2. Podávanie inhibítorov MRP2 preto môže spôsobiť zvýšenie koncentrácie cabozantinibu v plazme.
Sekvestranty žlčových solí
Sekvestranty žlčových solí, napríklad cholestyramín a cholestagel, môžu interagovať s cabozantinibom a môžu ovplyvniť absorpciu (alebo reabsorpciu), čo môže viesť k zníženej expozícii (pozri časť 5.2). Klinický význam týchto potenciálnych interakcií nie je známy.
Účinokcabozantinibunainélieky
Účinok cabozantinibu na farmakokinetiku antikoncepčných steroidov sa neskúmal. Keďže nie je možné zaručiť nezmenený antikoncepčný účinok, odporúča sa používať ďalšiu antikoncepčnú metódu, napríklad bariérovú.
Substráty P-glykoproteínu
Cabozantinib bol inhibítorom (IC50 = 7,0 μM), ale nie substrátom transportných aktivít P-gp v dvojsmernom
testovacom systéme, ktorý používal bunky MDCK-MDR1. Cabozantinib preto môže mať potenciál zvýšiť koncentrácie súbežne podávaných substrátov P-gp v plazme. Pri užívaní cabozantinibu musia byť pacienti upozornení na užívanie substrátov P-gp (ako je fexofenadín, aliskirén, ambrisentan, dabigatran etexilát, digoxín, kolchicín, maravirok, posakonazol, ranolazín, saxagliptín, sitagliptín, talinolol, tolvaptan).
4.6 Fertilita, gravidita a laktácia
Ženyvofertilnomveku/mužskáaženskáantikoncepcia
Ženy vo fertilnom veku musia byť poučené, aby sa vyhli tehotenstvu, kým užívajú cabozantinib. Partnerky
pacientov užívajúcich cabozantinib sa takisto musia vyhnúť tehotenstvu. Pacienti aj pacientky a ich partneri a partnerky majú počas liečby a aspoň 4 mesiace po jej skončení používať účinné metódy antikoncepcie.
Keďže perorálnu antikoncepciu nie je možné považovať za „účinnú metódu antikoncepcie“, je nutné ju
používať spolu s ďalšou metódou, napríklad bariérovou (pozri časť 4.5).
Gravidita
Štúdie s tehotnými ženami užívajúcimi cabozantinib sa neuskutočnili. Štúdie na zvieratách preukázali embryofetálne a teratogénne účinky (pozri časť 5.3). Potenciálne riziko u ľudí nie je známe. Cabozantinib sa nemá užívať počas gravidity, pokiaľ klinický stav ženy nevyžaduje liečbu cabozantinibom.
D
ojčenie
Nie je známe, či sa cabozantinib a/alebo jeho metabolity vylučujú do ľudského mlieka. Z dôvodu možného poškodenia dieťaťa má matka prerušiť dojčenie počas liečby cabozantinibom a počas aspoň 4 mesiacov po
jej skončení.
Fertilita
Nie sú k dispozícii údaje o fertilite u človeka. Podľa neklinických zistení týkajúcich sa bezpečnosti sa fertilita mužov aj žien môže liečbou cabozantinibom zhoršiť (pozri časť 5.3). Muži aj ženy musia byť
poučení, aby vyhľadali odborníka a pred liečbou zvážili zachovanie fertility.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Cabozantinib má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. S cabozantinibom sa spájajú nežiaduce reakcie ako únava a slabosť. Preto sa odporúča opatrnosť pri vedení vozidiel a obsluhovaní strojov.
4.8 Nežiaduce účinky
Súhrnbezpečnostného profilu
Najčastejšie závažné nežiaduce reakcie spojené s cabozantinibom sú abdominálna bolesť (3 %), pleurálny výpotok (3 %), hnačka (2 %) a nauzea (2 %). Najčastejšie nežiaduce reakcie všetkých stupňov (postihujúce aspoň 25 % pacientov) zahŕňali hnačku (74 %), únavu (56 %), nauzeu (50 %), zníženú chuť do jedla (46 %), palmárno-plantárny erytrodyzestetický syndróm (PPES) (42 %), hypertenziu (37 %), vracanie (32 %), zníženie hmotnosti (31 %) a zápchu (25 %).
Tabuľkanežiaducichreakcií
Nežiaduce reakcie sú uvedené v tabuľke 2 podľa triedy orgánových systémov podľa databázy MedDRA a frekvencie výskytu. Frekvencie sú založené na všetkých stupňoch a sú definované takto: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100). V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
T
abuľka 2: Nežiaduce reakcie hlásené pri cabozantinibe
T
rieda orgánových systémov podľa databázy MedDRA
V
eľmi časté Časté Menej časté
Infekcie a nákazy absces
Poruchy krvi
a lymfatického systému
Poruchy endokrinného systému
Poruchy metabolizmu a výživy
Poruchy nervového systému
Poruchy ucha a labyrintu
anémia
hypotyreóza
znížená chuť do jedla, hypofosfatémia, hypoalbuminémia, hypomagneziémia, hyponatrémia, hypokaliémia, hyperkaliémia, hypokalcémia, hyperbilirubinémia
dysgeúzia, bolesť hlavy,
závraty
dehydratácia
tinitus
kŕče
Poruchy ciev hypertenzia pľúcna embólia
Poruchy dýchacej
sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy pečene
a žlčových ciest
Poruchy kože
a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
dysfónia, dyspnoe, kašeľ
hnačka, nauzea, vracanie, stomatitída, zápcha, abdominálna bolesť, dyspepsia
palmárno-plantárny erytrodyzestetický syndróm, vyrážka, suchá koža
bolesť v končatine,
svalové kŕče, artralgia
abdominálna bolesť v hornej časti, gastroezofageálna refluxná choroba, hemoroidy
pruritus, alopécia
análna fistula, pankreatitída
cholestatická hepatitída
osteonekróza čeľuste
Poruchy obličiek
a močových ciest
proteinúria
T
rieda orgánových systémov podľa databázy MedDRA
V
eľmi časté Časté Menej časté
Celkové poruchy
a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
únava, zápal sliznice, asténia
znížená telesná hmotnosť, zvýšená hladina ALT, AST a ALP v sére, zvýšená hladina kreatinínu, zvýšená hladina triglyceridov, hyperglykémia, hypoglykémia, lymfopénia, neutropénia, trombocytopénia, zvýšená hladina GGT, zvýšená hladina amylázy, zvýšená hladina cholesterolu
v krvi, zvýšená hladina lipázy
periférny edém
 O
pis
vybraných
nežiaducich
reakcií
O
pis
vybraných
nežiaducich
reakcií
Údaje o nasledujúcich reakciách pochádzajú od pacientov, ktorí dostávali Cabometyx 60 mg perorálne raz denne v úvodnej štúdii RCC (časť 5.1).
Perforácia gastrointestinálneho traktuPerforácie gastrointestinálneho traktu boli hlásené u 0,9 % pacientov s RCC liečených cabozantinibom
(3/331). Udalosti boli 2. alebo 3. stupňa. Medián času do nástupu bol 10,0 týždňa. V klinickom programe s cabozantinibom sa vyskytli aj smrteľné perforácie.
FistulyFistuly boli hlásené u 1,2 % (4/331) pacientov liečených cabozantinibom a zahŕňali análne fistuly u 0,6 %
(2/331) pacientov liečených cabozantinibom. Jedna udalosť bola 3. stupňa, ostatné boli 2. stupňa. Medián času do nástupu bol 30,3 týždňa.
HemorágiaVýskyt závažných hemoragických udalostí (stupeň ≥ 3) bol 2,1 % u pacientov s RCC liečených cabozantinibom (7/331). Medián času do nástupu bol 20,9 týždňa. V klinickom programe s cabozantinibom
sa vyskytli aj smrteľné hemorágie.
Syndróm reverzibilnej posteriórnej leukoencefalopatie (RPLS)V tejto štúdii nebol hlásený žiadny prípad RPLS, ale RPLS bola hlásená v iných klinických štúdiách.
Hláseniepodozrenínanežiaducereakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNeexistuje špecifická liečba predávkovania cabozantinibom a neboli stanovené možné príznaky
predávkovania.
V prípade podozrenia na predávkovanie sa má cabozantinib vysadiť a má sa začať s podpornou starostlivosťou. Na posúdenie možných zmien vývoja sa musia sledovať hodnoty metabolických klinických laboratórnych parametrov aspoň raz týždenne, alebo keď to vyžaduje klinický stav. Nežiaduce reakcie spojené s predávkovaním sa majú liečiť symptomaticky.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antineoplastiká, inhibítory proteínkinázy, ATC kód: L01XE26.
Mechanizmusúčinku
Cabozantinib je malá molekula, ktorá inhibuje viacero receptorových tyrozínkináz (RTK) zapojených do rastu tumorov a angiogenézy, patologického remodelovania kostí, liekovej rezistencie a metastatickej progresie rakoviny. Hodnotila sa inhibičná aktivita cabozantinibu proti rôznym kinázam, pričom cabozantinib bol identifikovaný ako inhibítor receptorov MET (receptorový proteín rastového faktora hepatocytov) a VEGF (rastový faktor vaskulárneho endotelu). Cabozantinib navyše inhibuje iné tyrozínkinázy vrátane receptora GAS6 (AXL), RET, ROS1, TYRO3, MER, receptora faktora kmeňových buniek (KIT), TRKB, tyrozínkinázy-3 podobnej Fms (FLT3) a TIE-2.
Farmakodynamickéúčinky
Cabozantinib vykazuje od dávky závislú inhibíciu rastu tumoru, regresiu tumoru a/alebo inhibuje metastázy v širokom spektre predklinických modeloch tumorov.
Elektrofyziológia srdca
V kontrolovanej klinickej štúdii s pacientmi s medulárnym tyreoidálnym karcinómom sa po začatí liečby
cabozantinibom (s dávkou 140 mg raz denne) pozorovalo predĺženie korigovaného intervalu QT podľa Fridericiu (QTcF) o 10 – 15 ms v 29. deň (ale nie v 1. deň) v porovnaní s východiskovým stavom. Tento účinok nebol spojený so zmenou morfológie tvaru srdcovej krivky ani s novými rytmami. U žiadnych účastníkov tejto štúdie liečených cabozantinibom ani u pacientov liečených cabozantinibom v štúdii RCC (s dávkou 60 mg) sa nepotvrdil interval QTcF > 500 ms.
Klinickáúčinnosťabezpečnosť
Klinické údaje o karcinóme z renálnych buniek
Bezpečnosť a účinnosť CABOMETYXU sa hodnotili v randomizovanej, otvorenej, multicentrickej štúdii fázy 3. Pacienti (N = 658) s pokročilým RCC s komponentom zo svetlých buniek, ktorí predtým dostali aspoň 1 inhibítor receptorovej tyrozínkinázy VEGF (VEGFR TKI), boli randomizovaní (1:1) do skupiny
s CABOMETYXOM (N = 330) alebo everolimusom (N = 328). Pacienti mohli dostávať iné predchádzajúce liečby vrátane cytokínov a protilátok proti VEGF, receptoru pre programovanú smrť 1 (PD-1) alebo jeho
ligandom. Zúčastniť sa mohli aj pacienti s liečenými metastázami v mozgu. Prežívanie bez progresie (PFS)
posudzoval zaslepený nezávislý výbor pre rádiologické preskúmanie, pričom primárna analýza sa uskutočnila na prvých 375 randomizovaných účastníkoch. Sekundárnymi sledovanými parametrami
účinnosti boli miera objektívnej odpovede (ORR) a celkové prežívanie (OS). Tumory sa posudzovali
každých 8 týždňov počas prvých 12 mesiacov a potom každých 12 týždňov.
Východiskové demografické charakteristiky a charakteristiky ochorenia boli medzi ramenami
s CABOMETYXOM a everolimusom podobné. Väčšina pacientov boli muži (75 %) s mediánom veku 62 rokov. Sedemdesiatjeden percent (71 %) pacientov dostalo len jeden predchádzajúci VEGFR TKI, 41 % pacientov dostalo ako jediný predchádzajúci VEGFR TKI sunitinib. Podľa kritérií onkologického centra Memorial Sloan Kettering Cancer Center pre kategórie prognostického rizika, 46 % prognóz bolo priaznivých (0 rizikových faktorov), 42 % stredných (1 rizikový faktor) a 13 % nepriaznivých (2 alebo 3 rizikové faktory). Päťdesiatštyri percent (54 %) pacientov malo 3 alebo viac orgánov s metastatickým ochorením, a to vrátane pľúc (63 %), lymfatických uzlín (62 %), pečene (29 %) a kostí (22 %). Medián trvania liečby bol 7,6 mesiaca (rozsah 0,3 – 20,5) u pacientov dostávajúcich CABOMETYX a 4,4 mesiaca (rozsah 0,21 – 18,9) u pacientov dostávajúcich everolimus.
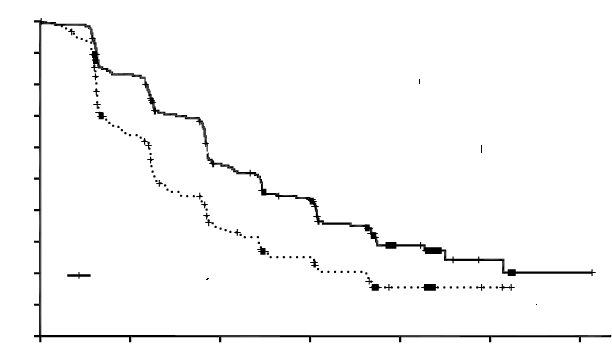
Preukázalo sa štatisticky významné zlepšenie PFS u pacientov s CABOMETYXOM v porovnaní
s everolimusom (obrázok 1 a tabuľka 3). V čase analýzy PFS sa uskutočnila plánovaná predbežná analýza
OS, ktorá nedosiahla predbežnú hranicu pre štatistickú významnosť (HR = 0,68 [0,51, 0,90], p = 0,006).
V následnej neplánovanej predbežnej analýze OS sa preukázalo štatisticky významné zlepšenie u pacientov randomizovaných do skupiny s CABOMETYXOM v porovnaní s everolimusom (medián 21,4 mesiaca oproti 16,5 mesiaca; HR = 0,66 [0,53, 0,83], p = 0,0003; obrázok 2).
Prieskumné analýzy PFS a OS v ITT populácii takisto priniesli stabilné výsledky v prospech CABOMETYXU v porovnaní s everolimusom v rôznych podskupinách podľa veku (< 65 oproti ≥ 65), pohlavia, rizikovej skupiny MSKCC (priaznivá, stredná, nepriaznivá prognóza), stavu ECOG (0 oproti 1), času od diagnózy po randomizáciu (< 1 rok oproti ≥ 1 rok), stavu MET tumoru (vysoká, nízka, neznáma), metastáz v kostiach (prítomnosť oproti neprítomnosti), viscerálnych metastáz (prítomnosť oproti neprítomnosti), viscerálnych metastáz a metastáz v kostiach (prítomnosť oproti neprítomnosti), počtu predchádzajúcich VEGFR-TKI (1 oproti ≥ 2), trvania prvej liečby VEGFR-TKI (≤ 6 mesiacov oproti > 6 mesiacov).
Výsledky mier objektívnej odpovede sú zhrnuté v tabuľke 4.
Obrázok 1: Kaplanova-Meierova krivka prežívania bez progresie podľa nezávislého výboru prerádiologické preskúmanie (prvých 375 randomizovaných účastníkov)1,0
0,9
0,8
0,7
0,6
1 . 0
0 . 9
0 . 8
0 . 7
0 . 6
0 . 5
0 . 4
0 . 3
0 . 2
0 . 1
0 . 0
|
|
0,5
0,4
0,3
0,2

0,1
0,0
Počet pacientov'
s rizikom:CABOMETYX Everolimus
CABOMETYX Everolimus
0 3 6 9 1 2 1 5 1 8
Mesiace187 152 92 68 20 6 2
188 99 46 29 10 2 0
T
abuľka 3: Zhrnutie zistení o PFS podľa nezávislého výboru pre rádiologické preskúmanie
P
opulácia s primárnou analýzou
 PFS
P
opulácia s úmyslom liečby
PFS
P
opulácia s úmyslom liečby
Sledovaný parameter
Medián PFS (95 % IS), mesiace
HR (95 % IS), hodnota p1
CABOMETYX Everolimus CABOMETYX Everolimus
N = 187 N = 188 N = 330 N = 328
7,4 (5,6, 9,1) 3,8 (3,7, 5,4) 7,4 (6,6, 9,1) 3,9 (3,7, 5,1)
0,58 (0,45, 0,74) p < 0,0001 0,51 (0,41, 0,62) p < 0,0001
1 rozvrstvený log-rank test
O
brázok 2: Kaplanova-Mayerova krivka celkového prežívania
1,0
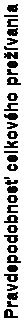
0,9
0,8
0,7
0,6
1 . 0
0 . 9
0 . 8
0 . 7
0 . 6
0 . 5
0 . 4
0 . 3
0 . 2
0 . 1
0 . 0
|
|
0,5
0,4

0,3
0,2
0,1
0,0
CABOMETYX Everolimus
P
očet pacientov
s rizikom:
CABOMETYX Everolimus
0 3 6 9 1 2 1 5 1 8 2 1 2 4 2 7 3 0
Mesiace
330 318 296 264 239 178 105 41 6 3 0


328 307 262 229 202 141 82 32 8 1 0
T
abuľka 4: Súhrn výsledkov ORR podľa nezávislého výboru pre rádiologické preskúmanie (IRC)
a preskúmania skúšajúceho
P
r
i
m
árna analýza ORR, populácia s úmyslom liečby (IRC)
O
R
R podľa preskúmania skúšajúceho, populácia
s úmyslom liečby
Sledovaný parameter
CA
B
O
METYX Everolimus CABOMETYX Everolimus
N = 330 N = 328 N = 330 N = 328
ORR (len čiastkové odpovede) (95 % IS)
17 % (13 %,
22 %)
3 % (2 %, 6 %) 24 % (19 %,
29 %)
4 % (2 %, 7 %)
Hodnota p1 p < 0,0001 p < 0,0001
Čiastková odpoveď 17 % 3 % 24 % 4 %
Medián času do prvej odpovede, mesiace (95 % IS) Stabilné ochorenie ako najlepšia odpoveď Progresívne ochorenie ako najlepšia odpoveď
1 chí-kvadrátový test
1,91 (1,6, 11,0) 2,14 (1,9, 9,2) 1,91 (1,3, 9,8) 3,50 (1,8, 5,6)
65 % 62 % 63 % 63 %
12 % 27 % 9 % 27 %
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s CABOMETYXOM vo
všetkých podskupinách pediatrickej populácie pre liečbu karcinómu obličiek a obličkovej panvičky (okrem
nefroblastómu, nefroblastomatózy, sarkómu zo svetlých buniek, mezoblastového nefrómu, medulárneho
karcinómu obličky a rabdoidného tumoru obličky) (informácie o použití v pediatrickej populácii, pozri časť
4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Po perorálnom podaní cabozantinibu sa maximálna koncentrácia cabozantinibu v plazme dosiahne 2 až 3
hodiny po užití. Profily koncentrácie v plazme v závislosti od času ukázali druhú maximálnu hodnotu absorpcie približne 24 hodín po podaní, čo nasvedčuje možnej enterohepatálnej recirkulácii cabozantinibu.
Podávanie opakovanej dennej dávky cabozantinibu 140 mg počas 19 dní viedlo k približne 4-násobku až
5-násobku priemernej akumulácie cabozantinibu (na základe hodnoty AUC) v porovnaní s podaním
jednorazovej dávky. Rovnovážny stav sa dosiahol približne v 15. deň.
Jedlo bohaté na tuky stredne výrazne zvýšilo hodnoty Cmax a AUC (41 %, resp. 57 %) v porovnaní so stavom na lačno u zdravých dobrovoľníkov, ktorým sa cabozantinib podal v jednorazovej perorálnej dávke 140 mg. Informácie o presnom účinku jedla požitého 1 hodinu po podaní cabozantinibu nie sú k dispozícii.
Nebolo možné preukázať biologickú rovnocennosť kapsuly a tablety cabozantinibu po jednorazovej dávke
140 mg zdravým účastníkom. V prípade tabletovej formy (CABOMETYX) sa pozoroval 19 % nárast
hodnoty Cmax v porovnaní s kapsulovou formou (COMETRIQ). Medzi tabletou (CABOMETYX) a kapsulou
(COMETRIQ) cabozantinibu sa pozoroval menej než 10 % rozdiel v hodnote AUC.
Distribúcia
Cabozantinib je v ľudskej plazme in vitro silne viazaný na proteíny (≥ 99,7 %). Na základe populačného
farmakokinetického (FK) modelu sa stanovil distribučný objem (Vz) približne 319 l (SE: ± 2,7 %).
U pacientov s miernou až stredne závažnou poruchou funkcie obličiek alebo pečene nebola zmenená väzba
na proteíny.
Biotransformácia
Cabozantinib sa metabolizoval in vivo. V plazme boli prítomné štyri metabolity s expozíciou (AUC) vyššou ako 10 % materskej látky: XL184-N-oxid, štiepny produkt XL184-amidu, hydroxysíran XL184 a štiepny produkt 6-desmetyl-amidu síran. Oba nekonjugované metabolity (XL184-N-oxid a štiepny produkt XL184- amidu), ktoré majú < 1 % schopnosť inhibície cieľovej kinázy v porovnaní s materským cabozantinibom, predstavujú < 10 % celkovej expozície v plazme spojenej s liekom.
Cabozantinib je in vitro substrátom metabolizmu CYP3A4, keďže neutralizačná protilátka proti CYP3A4 inhibovala tvorbu metabolitu XL184-N-oxidu o > 80 % pri inkubácii katalyzovanej NADPH v ľudských pečeňových mikrozómoch (HLM). Naproti tomu neutralizačné protilátky proti CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C19, CYP2D6 a CYP2E1 nemali žiadny účinok na tvorbu metabolitov cabozantinibu. Neutralizačná protilátka proti CYP2C9 mala minimálny účinok na tvorbu metabolitov cabozantinibu (t. j. < 20 % zníženie).
Eliminácia
V populačnej FK analýze cabozantinibu s použitím údajov získaných od 318 pacientov s RCC a 63
normálnych zdravých dobrovoľníkov po perorálnom podaní dávok 60 mg, 40 mg a 20 mg je koncový polčas
cabozantinibu v plazme približne 99 hodín. Priemerný klírens (CL/F) v rovnovážnom stave bol odhadnutý na
2,2 l/h. Počas 48-dňového obdobia zberu po jednorazovej dávke 14C-cabozantinibu zdravým dobrovoľníkom bolo zachytených približne 81 % celkovej podanej rádioaktivity, a to 54 % v stolici a 27 % v moči.
Farmakokinetika v osobitných populáciách pacientov
Porucha f unkc ie obl i či ek
Výsledky štúdie s pacientmi s poruchou funkcie obličiek ukazujú, že pomery geometrického priemeru
cabozantinibu v plazme metódou najmenších štvorcov, Cmax a AUC0-inf boli o 19 % a 30 % vyššie
u pacientov s miernou poruchou funkcie obličiek (90 % IS pre Cmax 91,60 % až 155,51 %; AUC0-inf 98,79 %
až 171,26 %) a o 2 % a 6 – 7 % vyššie u pacientov so stredne závažnou poruchou funkcie obličiek (90 % IS pre Cmax 78,64 % až 133,52 %; AUC0-inf 79,61 % až 140,11 %) než u pacientov s normálnou funkciou obličiek. Pacienti so závažnou poruchou funkcie obličiek sa neskúmali.
Porucha f unkc ie peče ne
Výsledky štúdie s pacientmi s poruchou funkcie pečene ukazujú, že expozícia (AUC0-inf) sa zvýšila o 81 %
u pacientov s miernou poruchou funkcie pečene a o 63 % u pacientov so stredne závažnou poruchou funkcie
pečene (90 % IS pre AUC0-inf: 121,44 % až 270,34 % pre miernu a 107,37 % až 246,67 % pre stredne
závažnú poruchu). Pacienti so závažnou poruchou funkcie pečene sa neskúmali.
Rasa
V populačnej FK analýze neboli neidentifikované klinicky podstatné rozdiely vo FK cabozantinibu na
základe rasy.
5.3 Predklinické údaje o bezpečnosti
Nežiaduce reakcie, ktoré sa nepozorovali v klinických štúdiách, ale pozorovali sa u zvierat pri expozíciách podobných klinickým a s možným významom pre klinické použitie, boli tieto:
V štúdiách toxicity po opakovanej dávke u potkanov a psov v trvaní až 6 mesiacov boli cieľovými orgánmi
toxicity gastrointestinálny trakt, kostná dreň, lymfoidné tkanivá, obličky, tkanivá nadobličiek
a reprodukčného systému. Hodnota, pri ktorej sa nepozorovali žiadne nežiaduce účinky (NOAEL), bola pri týchto nálezoch nižšia ako hladiny klinickej expozície u človeka pri zamýšľanej terapeutickej dávke.
V štandardnej súprave genotoxických testov cabozantinib nevykazoval žiadny mutagénny ani klastogénny potenciál. V myšacom modeli rasH2 cabozantinib nebol karcinogénny pri mierne vyššej expozícii než je predpokladaná expozícia pri terapii u ľudí.
Štúdie fertility u potkanov preukázali zníženú samčiu aj samičiu fertilitu. U samcov psov sa navyše pozorovala hypospermatogenéza pri hladinách expozície nižších ako hladiny klinickej expozície u človeka pri zamýšľanej terapeutickej dávke.
Štúdie embryofetálneho vývinu sa vykonali u potkanov a králikov. U potkanov spôsoboval cabozantinib postimplantačné straty, fetálny edém, rázštep podnebia/pier, dermálnu apláziu a deformovaný alebo rudimentárny chvost. U králikov cabozantinib spôsoboval zmeny fetálneho mäkkého tkaniva (zmenšená veľkosť sleziny, malé alebo chýbajúce stredné laloky pľúc) a zvýšený fetálny výskyt celkových malformácií. Hodnota NOAEL pre embryofetálnu toxicitu a teratogénne nálezy bola nižšia ako hladiny klinickej expozície u človeka pri zamýšľanej terapeutickej dávke.
Mláďatá potkanov (porovnateľné s pediatrickou populáciou > 2 roky), ktorým bol podaný cabozantinib, vykazovali zvýšené hodnoty leukocytov, zníženú hematopoézu, pubescentný/nevyzrelý samičí reprodukčný systém (bez oneskoreného otvárania vagíny), abnormality zubov, znížený obsah minerálov v kostiach
a kostnú denzitu, pigmentáciu pečene a lymfoidnú hyperpláziu lymfatických uzlín. Nálezy na
maternici/vaječníkoch a zníženie hematopoézy sa zdali prechodné, zatiaľ čo účinky na kostné parametre
a pigmentáciu pečene boli trvalé. Mláďatá potkanov (porovnateľné s pediatrickou populáciou < 2 roky) mali podobné nálezy súvisiace s liečbou, ale zdali sa citlivejšie na toxicitu súvisiacu s cabozantinibom pri
porovnateľných dávkach.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah tablety mikrokryštalická celulóza bezvodá laktóza hydroxypropylcelulóza
sodná soľ kroskarmelózy
bezvodý koloidný oxid kremičitý
magnéziumstearát
Filmový obal hypromelóza
oxid titaničitý (E171)
triacetín
žltý oxid železitý (E172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Blistre z PVC/PCTFE s pretlačovacou hliníkovou fóliou na zadnej strane, obsahujúce 7 filmom obalených
tabliet. Každá škatuľa obsahuje 4 blistrové stripy s 28 filmom obalenými tabletami.
Fľaša z HDPE s polypropylénovým uzáverom s detskou poistkou a tromi 1-gramovými nádobkami so
silikagélovým vysúšadlom. Každá fľaša obsahuje 30 filmom obalených tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Ipsen Pharma
65 quai Georges Gorse
92100 Boulogne-Billancourt
Francúzsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
Cabometyx 20 mg filmom obalené tablety
EU/1/16/1136/001
EU/1/16/1136/002
Cabometyx 40 mg filmom obalené tablety
EU/1/16/1136/003
EU/1/16/1136/004
Cabometyx 60 mg filmom obalené tablety
EU/1/16/1136/005
EU/1/16/1136/006
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.