
ľa (informáciu určenú pre lekárov a zdravotníckych pracovníkov).
Podanie do deltového svalu
Odporúčaná veľkosť ihly na začiatočné a udržiavacie podávanie Paliperidónu Janssen-Cilag
International do deltového svalu závisí od pacientovej hmotnosti. Pre pacientov vážiacich ³ 90 kg sa odporúča 1½-palcová ihla veľkosti 22 G (38,1 mm x 0,72 mm). Pre pacientov vážiacich < 90 kg sa odporúča 1-palcová ihla veľkosti 23 G (25,4 mm x 0,64 mm). Podanie injekcie do deltového svalu sa má striedať, raz do jedného a raz do druhého svalu.
Podanie do sedacieho svalu
Odporúčaná veľkosť ihly na udržiavacie podávanie Paliperidónu Janssen-Cilag International do sedacieho svalu je 1½-palcová ihla veľkosti 22 G (38,1 mm x 0,72 mm). Dávku je potrebné podať do
vonkajšieho horného kvadrantu sedacej časti. Podanie injekcie do sedacieho svalu sa má striedať, raz
do jedného a raz do druhého svalu.
4.3 Kontraindikácie
Precitlivenosť na liečivo, na risperidón alebo na ktorúkoľvek z pomocných látok uvedených v časti
6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Použitie u pacientov akútne agitovaných alebo vo vážnom psychotickom stave
Paliperidón Janssen-Cilag International sa nemá používať na zvládanie akútnych stavov agitovanosti
ani vážnych psychotických stavov, keď sa vyžaduje okamžitá kontrola príznakov.
QT interval
Opatrnosť je potrebná pri predpisovaní paliperidónu pacientom so známym kardiovaskulárnym
ochorením alebo s rodinnou anamnézou predĺženého QT intervalu a pri súbežnom užívaní s inými liekmi, o ktorých sa predpokladá, že predlžujú QT interval.
Neuroleptický malígny syndróm
Pri liečbe paliperidónom sa vyskytol neuroleptický malígny syndróm (NMS), ktorý je
charakterizovaný hypertermiou, svalovou rigiditou, vegetatívnou nestabilitou, poruchami vedomia a zvýšením sérových hladín kreatínfosfokinázy. Ďalšie klinické prejavy môžu zahŕňať myoglobinúriu (rabdomyolýzu) a akútne zlyhanie obličiek. Ak sa u pacienta objavia prejavy alebo príznaky indikujúce NMS, je potrebné vysadiť paliperidón.
Tardívna dyskinéza/extrapyramídové príznaky
Liečba antagonistami dopamínových receptorov sa spája so vznikom tardívnej dyskinézy, ktorá je
charakterizovaná rytmickými, mimovoľnými pohybmi, najmä jazyka a/alebo tváre. Ak sa objavia prejavy a príznaky tardívnej dyskinézy, je potrebné zvážiť vysadenie všetkých antipsychotík, vrátane paliperidónu.
U pacientov dostávajúcich súbežne psychostimulanciá (napr. metylfenidát) a paliperidón sa vyžaduje opatrnosť, pretože sa pri úprave jedného alebo oboch liekov môžu objaviť extrapyramídové príznaky. Odporúča sa postupné ukončenie liečby stimulantom (pozri časť 4.5).
Leukopénia, neutropénia a agranulocytóza
Pri liečbe Paliperidónom Janssen-Cilag International boli hlásené prípady leukopénie, neutropénie
a agranulocytózy. V priebehu postmarketingového sledovania bola agranulocytóza hlásená veľmi zriedkavo (< 1/10 000 pacientov). Pacientov s klinicky významným nízkym počtom leukocytov
v anamnéze alebo s liekom indukovanou leukopéniou/neutropéniou treba sledovať prvých niekoľko
mesiacov liečby a treba zvážiť prerušenie liečby Paliperidónom Janssen-Cilag International pri prvých prejavoch klinicky významného poklesu počtu leukocytov, ak nie sú prítomné iné kauzálne faktory.
U pacientov s klinicky významnou neutropéniou treba starostlivo sledovať horúčku a iné príznaky
alebo prejavy infekcie a ihneď ich liečiť, ak sa takéto príznaky alebo prejavy objavia. U pacientov so závažnou neutropéniou (absolútny počet neutrofilov < 1 x 109/l) sa má liečba Paliperidónom Janssen- Cilag International prerušiť a sledovať počet leukocytov až do zotavenia.
Reakcie z precitlivenosti
Počas postmarketingových skúseností boli u pacientov, ktorí predtým tolerovali perorálny risperidón
alebo perorálny paliperidón, zriedkavo hlásené anafylaktické reakcie (pozri časti 4.1 a 4.8).
Ak sa vyskytnú reakcie z precitlivenosti, ukončite používanie Paliperidónu Janssen-Cilag International; začnite so všeobecnými podpornými opatreniami podľa klinickej potreby a sledujte pacienta, kým prejavy a príznaky nezmiznú (pozri časti 4.3 a 4.8).
Hyperglykémia a diabetes mellitus
Počas liečby paliperidónom bola hlásená hyperglykémia, diabetes mellitus a exacerbácia existujúceho
diabetu, vrátane diabetickej kómy a ketoacidózy. Odporúča sa vhodné klinické sledovanie v súlade
s používanými smernicami pre antipsychotiká. U pacientov liečených Paliperidónom Janssen-Cilag International, treba sledovať príznaky hyperglykémie (ako polydipsia, polyúria, polyfágia a slabosť) a u pacientov s diabetes mellitus treba pravidelne sledovať zhoršenie kontroly glukózy.
Zvýšenie telesnej hmotnosti
Pri užívaní Paliperidónu Janssen-Cilag International bolo hlásené významné zvýšenie telesnej
hmotnosti. Hmotnosť je potrebné pravidelne kontrolovať.
Použitie u pacientov s prolaktín-dependentnými nádormi
Štúdie s tkanivovými kultúrami naznačujú, že rast buniek v nádoroch prsníka u ľudí môže byť
stimulovaný prolaktínom. Hoci sa v klinických a epidemiologických štúdiách zatiaľ nepreukázalo jasné spojenie s podávaním antipsychotík, u pacientov s relevantnou lekárskou anamnézou sa
odporúča opatrnosť. Paliperidón sa má používať opatrne u pacientov s preexistujúcim nádorom, ktorý
môže byť prolaktín-dependentný.
Ortostatická hypotenzia
Vzhľadom na alfa-blokujúci účinok môže paliperidón u niektorých pacientov vyvolať ortostatickú
hypotenziu.
Zo zlúčených údajov získaných z troch placebom kontrolovaných 6-týždňových štúdií s fixnou dávkou perorálnych tabliet paliperidónu s predĺženým uvoľňovaním (3 mg, 6 mg, 9 mg a 12 mg) vyplýva, že
ortostatická hypotenzia sa vyskytla u 2,5 % pacientov liečených perorálnym paliperidónom
v porovnaní s 0,8 % pacientov užívajúcich placebo. Paliperidón Janssen-Cilag International sa má používať opatrne u pacientov so známym kardiovaskulárnym ochorením (napr. srdcové zlyhanie,
infarkt myokardu alebo ischémia, poruchy prevodu vzruchu), cerebrovaskulárnym ochorením alebo
stavmi, ktoré predisponujú pacienta k hypotenzii (napr. dehydratácia a hypovolémia).
Kŕče
Paliperidón Janssen-Cilag International sa má používať opatrne u pacientov s anamnézou kŕčov alebo
iných stavov, ktoré môžu znižovať prah pre vznik kŕčov.
Porucha funkcie obličiek
U pacientov s poruchou funkcie obličiek sú plazmatické hladiny paliperidónu zvýšené, a preto sa
u pacientov s miernou poruchou funkcie obličiek odporúča úprava dávky. Paliperidón Janssen-Cilag International sa neodporúča u pacientov so stredne závažnou alebo závažnou poruchou funkcie obličiek (klírens kreatinínu < 50 ml/min.) (pozri časti 4.2 a 5.2).
Porucha funkcie pečene
O pacientoch so závažnou poruchou funkcie pečene (Childova-Pughova trieda C) nie sú k dispozícii
žiadne údaje. Pri používaní paliperidónu u týchto pacientov je potrebná zvýšená opatrnosť.
Starší pacienti s demenciou
Paliperidón Janssen-Cilag International nebol študovaný u starších pacientov s demenciou. Paliperidón
Janssen-Cilag International má byť podávaný s opatrnosťou u starších pacientov s demenciou s rizikovými faktormi pre cievnu mozgovú príhodu.
Skúsenosti s risperidónom uvedené nižšie sú považované za platné tiež pre paliperidón.
Celková úmrtnosť
Pri metaanalýze 17 kontrolovaných klinických štúdií sa u starších pacientov s demenciou, ktorí boli liečení inými atypickými antipsychotikami, vrátane risperidónu, aripiprazolu, olanzapínu a kvetiapínu,
zistilo vyššie riziko úmrtia v porovnaní s placebom. U pacientov liečených risperidónom bola mortalita 4 % v porovnaní s 3,1 % u pacientov užívajúcich placebo.
Cerebrovaskulárne nežiaduce reakcie
V randomizovaných, placebom kontrolovaných klinických štúdiách sledujúcich pacientov
s demenciou, ktorí boli liečení niektorými atypickými antipsychotikami, vrátane risperidónu, aripiprazolu a olanzapínu, sa pozorovalo približne 3-násobne vyššie riziko cerebrovaskulárnych nežiaducich reakcií. Príčina tohto vyššieho rizika nie je známa.
Parkinsonova choroba a demencia s prítomnosťou Lewyho teliesok
Pri predpisovaní Paliperidónu Janssen-Cilag International pacientom s Parkinsonovou chorobou alebo
demenciou s prítomnosťou Lewyho teliesok (DLB) je potrebné, aby lekári zvážili pomer prínosu a rizika liečby, pretože obe skupiny pacientov môžu byť ohrozené zvýšeným rizikom vzniku neuroleptického malígneho syndrómu, resp. môžu mať vyššiu citlivosť na antipsychotiká. Zvýšená citlivosť na antipsychotiká sa môže prejaviť zmätenosťou, otupenosťou, posturálnou nerovnováhou vrátane častých pádov a extrapyramídovými príznakmi.
Priapizmus
Zaznamenalo sa, že antipsychotiká (vrátane risperidónu) s α-adrenergickými blokujúcimi účinkami
vyvolávajú priapizmus. Po uvedení lieku na trh sa priapizmus zaznamenal tiež pri perorálnom paliperidóne, ktorý je aktívnym metabolitom risperidónu. Pacientov treba poučiť, aby vyhľadali
urgentnú lekársku pomoc v prípade, že priapizmus pretrváva viac ako 4 hodiny.
Regulácia telesnej teploty
Antipsychotikám sa pripisuje úloha pri poruche schopnosti organizmu znížiť teplotu telesného jadra.
Pri predpisovaní Paliperidónu Janssen-Cilag International pacientom, ktorí sa dostávajú do situácií vedúcich k zvýšeniu teploty telesného jadra, napr. namáhavé cvičenie, pobyt vo veľkých horúčavách,
súbežné užívanie liekov s anticholínergickým účinkom alebo dehydratácia, sa odporúča náležitá starostlivosť.
Venózny tromboembolizmus
Pri užívaní antipsychotík sa vyskytli prípady venózneho tromboembolizmu (VTE). Keďže sa
u pacientov liečených antipsychotikami často objavujú získané rizikové faktory pre vznik VTE, pred liečbou Paliperidónom Janssen-Cilag International a počas nej treba zistiť všetky možné rizikové
faktory VTE a prijať preventívne opatrenia.
Antiemetický účinok
V predklinických štúdiách s paliperidónom sa pozoroval antiemetický účinok. V prípade, že sa tento
účinok vyskytne u ľudí, môže zakrývať prejavy a príznaky predávkovania niektorými liekmi alebo stavov, ako napr. obštrukcia čreva, Reyov syndróm a nádor mozgu.
Podávanie
Dajte pozor, aby nedošlo k neželanému podaniu Paliperidónu Janssen-Cilag International do krvnej
cievy.
Peroperačný syndróm vlajúcej dúhovky
Peroperačný syndróm vlajúcej dúhovky (IFIS, z angl. intraoperative floppy iris syndrome) sa
pozoroval počas operácie katarakty u pacientov liečených liekmi s alfa 1a-adrenergným antagonistickým účinkom, ako napr. Paliperidón Janssen-Cilag International (pozri časť 4.8).
IFIS môže zvyšovať riziko očných komplikácií počas operácie a po nej. Pred operáciou treba očného chirurga informovať o užívaní liekov s alfa 1a-adrenergným antagonistickým účinkom v súčasnosti alebo v minulosti. Potenciálny prínos ukončenia liečby blokujúcej alfa 1 pred operáciou katarakty sa nestanovil a musí sa porovnať s rizikom ukončenia antipsychotickej liečby.
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t.j. v podstate zanedbateľné
množstvo sodíka.
4.5 Liekové a iné interakcie
Odporúča sa zvýšená opatrnosť pri predpisovaní Paliperidónu Janssen-Cilag International
v kombinácii s liekmi, ktoré predlžujú QT interval, napr. antiarytmiká triedy IA (napr. chinidín, disopyramid) a triedy III (napr. amiodarón, sotalol), niektoré antihistaminiká, niektoré iné
antipsychotiká a niektoré antimalariká (napr. meflochín). Tento zoznam je informatívny a nie je úplný.
Možný účinok Paliperidónu Janssen-Cilag International na iné lieky
Nepredpokladá sa, že by mal paliperidón klinicky významné farmakokinetické interakcie s liekmi
metabolizovanými izoenzýmami cytochrómu P-450.
Vzhľadom na primárne účinky paliperidónu (pozri časť 4.8) na centrálny nervový systém (CNS) sa
Paliperidón Janssen-Cilag International má používať opatrne v kombinácii s inými liekmi
s centrálnym účinkom, napr. anxiolytikami, s väčšinou antipsychotík, hypnotikami, opiátmi atď. alebo s alkoholom.
Paliperidón môže antagonizovať účinok levodopy a iných dopamínových agonistov. Ak je táto kombinácia potrebná, najmä u pacientov s Parkinsonovou chorobou v terminálnom štádiu, je nutné predpísať najnižšiu účinnú dávku oboch liekov.
Vzhľadom na možnosť vyvolania ortostatickej hypotenzie (pozri časť 4.4), pri podávaní Paliperidónu Janssen-Cilag International s inými látkami s takýmto potenciálom, napr. iné antipsychotiká, tricykliká, môže vzniknúť aditívny účinok.
Odporúča sa zvýšená opatrnosť, ak sa paliperidón užíva v kombinácii s inými liekmi, ktoré môžu znižovať prah pre vznik kŕčov (t.j. fenotiazíny alebo butyrofenóny, tricykliká alebo SSRI, tramadol, meflochín atď.).
Súbežné podávanie perorálnych tabliet paliperidónu s predĺženým uvoľňovaním pri rovnovážnom stave (12 mg jedenkrát denne) a tabliet divalproexu sodného s predĺženým uvoľňovaním (500 mg až
2 000 mg jedenkrát denne) neovplyvnilo farmakokinetiku valproátu v rovnovážnom stave.
Neuskutočnili sa žiadne štúdie zamerané na interakciu medzi Paliperidónom Janssen-Cilag
International a lítiom, farmakokinetická interakcia je však nepravdepodobná.
Možný účinok iných liekov na Paliperidón Janssen-Cilag International
V štúdiách in vitro sa zistilo, že izoenzýmy CYP2D6 a CYP3A4 majú minimálny význam
v metabolizme paliperidónu, avšak v štúdiách in vitro a in vivo sa nezistilo, že by tieto izoenzýmy mali významnú úlohu v metabolizme paliperidónu. Pri súbežnom podávaní perorálneho paliperidónu
s paroxetínom, silným inhibítorom izoenzýmu CYP2D6, sa nepozorovali žiadne klinicky významné
účinky na farmakokinetiku paliperidónu.
Súbežné podávanie perorálneho paliperidónu s predĺženým uvoľňovaním jedenkrát denne
s karbamazepínom 200 mg dvakrát denne spôsobilo pokles Cmax a AUC paliperidónu v priemernom rovnovážnom stave približne o 37 %. Tento pokles je v značnej miere spôsobený 35 % zvýšením
renálneho klírensu paliperidónu pravdepodobne v dôsledku indukcie renálneho P-gp karbamazepínom. Menší pokles v množstve nezmeneného liečiva vylúčeného močom naznačuje, že počas súbežného podávania spolu s karbamazepínom bol menší vplyv na metabolizmus CYP alebo na biologickú dostupnosť paliperidónu. Väčší pokles plazmatickej koncentrácie paliperidónu sa môže vyskytnúť po vyšších dávkach karbamazepínu. Pri začatí liečby karbamazepínom treba prehodnotiť dávku Paliperidónu Janssen-Cilag International a v prípade potreby ju zvýšiť. Naopak, pri ukončení liečby karbamazepínom treba prehodnotiť dávku Paliperidónu Janssen-Cilag International a v prípade
potreby ju znížiť.
Súbežné podávanie perorálnej tablety paliperidónu s predĺženým uvoľňovaním 12 mg v jednej dávke a tabliet divalproexu sodného s predĺženým uvoľňovaním (dve tablety 500 mg jedenkrát denne) malo za následok približne 50% zvýšenie Cmax a AUC paliperidónu, pravdepodobne následkom zvýšenej perorálnej absorpcie. Keďže sa nepozoroval žiadny účinok na systémový klírens, nemala by sa očakávať žiadna klinicky signifikantná interakcia medzi tabletami divalproexu sodného s predĺženým uvoľňovaním a intramuskulárnou injekciou Paliperidónu Janssen-Cilag International. Táto interakcia nebola študovaná pri Paliperidóne Janssen-Cilag International.
Súbežné užívanie Paliperidónu Janssen-Cilag International s risperidónom alebo perorálnym
paliperidónom
Vzhľadom na to, že paliperidón je hlavným aktívnym metabolitom risperidónu, vyžaduje sa opatrnosť,
keď sa Paliperidón Janssen-Cilag International podáva súbežne s risperidónom alebo s perorálnym paliperidónom počas dlhšieho obdobia. Údaje o bezpečnosti týkajúce sa súbežného podávania
Paliperidónu Janssen-Cilag International s inými antipsychotikami sú obmedzené.
Súbežné použitie Paliperidónu Janssen-Cilag International so psychostimulanciami
Kombinované užívanie psychostimulancií (napr. metylfenidát) s paliperidónom môže viesť
k extrapyramídovým príznakom po zmene jednej alebo oboch liečob (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné údaje o použití paliperidónu počas gravidity. V štúdiách na zvieratách
nemal intramuskulárne podaný paliperidón palmitát ani perorálne podaný paliperidón žiadne teratogénne účinky, avšak pozorovali sa iné formy reprodukčnej toxicity (pozri časť 5.3).
U novorodencov, ktorí boli vystavení počas tretieho trimestra gravidity paliperidónu, existuje riziko vzniku nežiaducich reakcií zahŕňajúcich extrapyramídové príznaky a/alebo príznaky z vysadenia lieku, ktoré sa môžu líšiť v závažnosti a trvaní po pôrode. Boli hlásené agitácia, hypertónia, hypotónia,
tremor, somnolencia, respiračná tieseň alebo ťažkosti pri kŕmení. Preto majú byť novorodenci starostlivo sledovaní. Paliperidón Janssen-Cilag International sa nesmie užívať počas gravidity, pokiaľ
to nie je nevyhnutné.
Dojčenie
Paliperidón sa vylučuje do materského mlieka v množstve, ktoré by pravdepodobne ovplyvnilo
dojčené dieťa, ak by jeho matka dostávala terapeutické dávky tohto lieku. Paliperidón Janssen-Cilag
International sa nesmie používať počas laktácie.
Fertilita
V predklinických štúdiách sa nepozorovali žiadne relevantné účinky.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Paliperidón môže mať malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje kvôli potenciálnemu vplyvu na nervový systém a zrak, ako napr. sedácia, somnolencia, synkopa, rozmazané videnie (pozri časť 4.8). Z tohto dôvodu je potrebné pacientov poučiť, aby neviedli vozidlá ani neobsluhovali stroje, kým nebude známe, ako reagujú na Paliperidón Janssen-Cilag International.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Nežiaduce reakcie na liek najčastejšie uvádzané v klinických štúdiách boli insomnia, bolesť hlavy,
úzkosť, infekcia horných dýchacích ciest, reakcia v mieste podania injekcie, parkinsonizmus, zvýšenie hmotnosti, akatízia, agitovanosť, útlm/somnolencia, nauzea, zápcha, točenie hlavy, muskuloskeletálna
bolesť, tachykardia, tremor, bolesť brucha, vracanie, diarea, únava a dystónia. Z uvedených sa zdajú
byť akatízia a útlm/somnolencia závislá od dávkovania.
Z
o
znam nežiaducich reakcií v tabuľkách
V nasledujúcej časti sú uvedené všetky nežiaduce reakcie na liek hlásené u paliperidónu podľa
kategórie frekvencie odhadnutej z klinických štúdií s paliperidón palmitátom. Výskyt nežiaducich reakcií sa uvádza nasledovne:
veľmi časté (≥ 1/10);
časté (≥ 1/100 až < 1/10);
menej časté(≥ 1/1 000 až < 1/100);
zriedkavé (≥ 1/10 000 až < 1/1 000);
veľmi zriedkavé (< 1/10 000) a
neznáme(z dostupných údajov).
Trieda orgánových systémov
| Nežiaduca reakcia na liek
|
Frekvencia
|
Veľmi časté
| Časté
| Menej časté
| Zriedkavé
| Neznáme
|
Infekcie a nákazy
|
| infekcia horných
dýchacích ciest, infekcia močových ciest, chrípka
| pneumónia,
bronchitída, infekcia dýchacej sústavy, sínusitída, cystitída, infekcia ucha, tonzilitída, onychomykóza,
celulitída
| infekcia oka,
akarodermatitída, podkožný absces
|
|
Poruchy krvi
a lymfatického systému
|
|
| znížený počet
leukocytov, trombocytopénia, anémia
| neutropénia,
zvýšený počet eozinofilov
| agranulo-
cytóza
|
Poruchy imunitného systému
|
|
| hypersenzitivita
|
| anafylak-
tická reakcia
|
Poruchy endokrinného systému
|
| hyperprolaktinémiab
|
| neprimerané
vylučovanie antidiuretického hormónu, prítomnosť glukózy v moči
|
|
Poruchy metabolizmu a výživy
|
| hyperglykémia,
zvýšená telesná hmotnosť, znížená telesná hmotnosť, znížená chuť do jedla
| diabetes mellitusd,
hyperinzulinémia, zvýšená chuť do jedla, anorexia, zvýšená hladina triglyceridov v krvi, zvýšená hladina
cholesterolu v krvi
| diabetická
ketoacidóza, hypoglykémia, polydipsia
| intoxikácia
vodou
|
Psychické poruchy
| nespavosťe
| agitácia, depresia,
úzkosť
| porucha spánku,
mánia, pokles libida, nervozita, nočné mory
| katatónia, stav
zmätenosti, somnambuliz- mus, citová otupenosť, anorgazmia
| porucha
príjmu potravy súvisiaca so spánkom
|
Poruchy nervového systému
|
| parkinsonizmusc,
akatíziac, útlm/somnolencia, dystóniac, točenie hlavy, dyskinézac, tremor, bolesti hlavy
| tardívna dyskinéza,
synkopa, psychomotorická hyperaktivita, posturálne závraty, porucha pozornosti, dyzartria,
dysgeúzia, hypestézia, parestézia
| neuroleptický
malígny syndróm, cerebrálna ischémia, nereagovanie na stimuly, strata vedomia, znížená hladina vedomia, kŕče, porucha rovnováhy, abnormálna koordinácia
| diabetická
kóma, titubácia hlavy
|
Poruchy oka
|
|
|
rozmazané videnie,
konjunktivitída, suché oko
|
glaukóm,
porucha hybnosti oka, prevracanie očí, fotofóbia, zvýšené slzenie, okulárna hyperémia
|
syndróm
vlajúcej dúhovky (perope- račný)
|
Poruchy ucha a labyrintu
|
|
|
závrat, tinnitus,
bolesť ucha
|
|
|
Poruchy srdca a srdcovej činnosti
|
|
tachykardia
|
artrioventrikulárna
blokáda, porucha vedenia, predĺžený QT interval na elektrokardiograme, syndróm posturálnej ortostatickej tachykardie, bradykardia, abnormálny elektrokardiogram, palpitácie
|
atriálna
fibrilácia, sínusová arytmia
|
|
Poruchy ciev
|
|
hypertenzia
|
hypotenzia,
ortostatická hypotenzia
|
venózna
trombóza, začervenanie
|
pľúcna
embólia, ischémia
|
P
oruchy dýchacej sústavy,
hrudníka a
m
e
diastína
|
|
kašeľ, upchanie nosa
|
dyspnoe, kongescia
dýchacieho traktu, sipot, faryngolaryngeálna bolesť, epistaxa
|
syndróm
spánkového apnoe, pľúcna kongescia, šelest
|
hyperventi
-lácia, aspiračná pneumónia dysfónia
|
Po
ruchy gastro- intestinálneho traktu
|
|
abdominálna bolesť,
vracanie, nauzea, zápcha, diarea, dyspepsia, bolesť zubov
|
abdominálny
diskomfort, gastroenteritída, dysfágia, sucho
v ústach, flatulencia
|
pankreatitída,
opuchnutý jazyk, inkontinencia stolice, fekalóm, cheilitída
|
črevná
obštrukcia, ileus
|
Poruchy pečene
a žlčových ciest
|
|
zvýšená hladina
transamináz
|
zvýšená hladina
gama- glutamyltransferázy, zvýšená hladina hepatálnych enzýmov
|
|
žltačka
|
Poruchy kože a podkožného tkaniva
|
|
|
žihľavka, pruritus,
vyrážka, alopécia, ekzém, suchá koža, erytém, akné
|
lieková vyrážka,
hyperkeratóza, lupiny
|
angioedém
sfarbenie kože, seboroická dermatitída
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
|
|
muskuloskeletálna
bolesť, bolesť chrbta, artralgia
|
zvýšená hladina
kreatínfosfokinázy
v krvi, svalové kŕče, stuhnutosť kĺbov, svalová slabosť, bolesť krku
|
rabdomyolýza,
opuch kĺbov
|
abnormál-
ny postoj
|
Poruchy obličiek
a močových
ciest
|
|
|
inkontinencia moču,
polakizúria, dyzúria
|
zadržiavanie
moču
|
|
Stavy
v gravidite,
v šestonedelí
a perinatálnom období
|
|
|
|
|
novorode-
necký syndróm
z vysade- nia (pozri časť 4.6)
|
Poruchy reprodukčného systému a
prsníkov
|
|
amenorea,
galaktorea
|
erektilná
dysfunkcia, porucha ejakulácie, porucha menštruáciee, gynekomastia, sexuálna
dysfunkcia, bolesť prsníkov
|
ťažkosti
s prsníkmi, naliatie prsníkov, zväčšenie prsníkov, vaginálny výtok
|
priapizmus
|
Celkové poruchy a reakcie v
m
i
este podania
|
|
pyrexia, asténia,
únava, reakcia
v mieste vpichu
|
edém tváre, edéme,
zvýšená telesná teplota, neprirodzená chôdza, bolesť na
hrudi, nepohodlie na hrudi, nevoľnosť, indurácia
|
hypotermia,
triaška, smäd, syndróm
z vysadenia, absces v mieste podania injekcie, celulitída
v mieste podania injekcie, cysta
v mieste podania injekcie, hematóm
v mieste podania injekcie
|
znížená
telesná teplota, nekróza v mieste podania injekcie, vred
v mieste podania injekcie
|
Úrazy
, otravy a komplikácie liečebného postupu
|
|
|
pád
|
|
|
a Frekvencia týchto nežiaducich reakcií je klasifikovaná ako „neznáma“, pretože neboli pozorované v klinických štúdiách s paliperidón palmitátom. Boli odvodené buď zo spontánnych postmarketingových hlásení a frekvencia nemôže byť
stanovená, alebo boli odvodené z údajov z klinických štúdií s risperidónom (ktorákoľvek lieková forma) alebo
perorálnym paliperidónom a/alebo postmarketingových hlásení.
b Pozri nižšie časť „Hyperprolaktinémia“.
c Pozri nižšie časť „Extrapyramídové príznaky“.
d V placebom kontrolovaných klinických štúdiách bol u 0,32 % pacientov liečených Paliperidónom Janssen-Cilag International hlásený diabetes mellitus v porovnaní s 0,39 % v skupine s placebom. Celková incidencia zo všetkých klinických štúdií bola 0,65 % zo všetkých pacientov liečených paliperidón palmitátom.
e
Insomnia zahŕňa: počiatočnú insomniu, insomniu strednej fázy;
Kŕče zahŕňajú: záchvaty typu grand mal;
Edém zahŕňa: generalizovaný edém, periférny edém, jamkovitý edém.
Porucha menštruácie zahŕňa: omeškaniemenštruácie, nepravidelnú menštruáciu, oligomenoreu
Nežiaduce účinky zaznamenané s liekovými formami risperidónuPaliperidón je aktívnym metabolitom risperidónu, preto sú profily nežiaducich reakcií týchto liečiv
(vrátane perorálnych a injekčných liekových foriem) navzájom relevantné.
Opis vybraných nežiaducich reakciíAnafylaktická reakciaPočas postmarketingového používania boli u pacientov, ktorí predtým tolerovali perorálny risperidón alebo perorálny paliperidón, zriedkavo hlásené prípady anafylaktickej reakcie po podaní injekcie
Paliperidónu Janssen-Cilag International (pozri časť 4.4).
Reakcie v mieste podania injekcieNajčastejšie hlásenou nežiaducou reakciou spojenou s miestom podania injekciebola bolesť. Väčšina týchto reakcií bola uvedená ako mierne až stredne závažná. Hodnotenia pacientov ohľadom bolesti
v mieste podania injekcie na základe vizuálnej analógovej škály mali tendenciu časom klesať, čo sa
týka frekvencie aj intenzity v štúdiách s Paliperidónom Janssen-Cilag International fázy 2 a 3. Injekcie do deltového svalu boli pociťované ako mierne bolestivejšie v porovnaní s odpovedajúcimi injekciami do sedacieho svalu. Ostatné reakcie v mieste podania injekcie boli väčšinou mierne a zahŕňali zatvrdnutie (časté), pruritus (menej časté) a uzlíky (zriedkavé).
Extrapyramídové príznaky (EPS)EPS predstavuje zlúčenú analýzu nasledujúcich výrazov: parkinsonizmus (zahŕňa hypersekréciu slín, muskuloskeletálnu stuhnutosť, parkinsonizmus, slintanie, rigiditu (fenomén ozubeného kolesa),
bradykinézu, hypokinézu, maskovitú tvár, svalovú stuhnutosť, akinézu, rigiditu šije, svalovú rigiditu, parkinsonickú chôdzu, abnormálny glabelárny reflex a parkinsonický kľudový tremor), akatízia
(vrátane akatízie, nepokoja, hyperkinézy a syndrómu nepokojných nôh), dyskinéza (dyskinéza, svalové zášklby, choreoatetóza, atetóza a myoklonus), dystónia (vrátane dystónie, hypertónie, tortikolis, mimovoľných svalových kontrakcií, skrátenia svalov, blefarospazmu, okulogyrácie,
paralýzy jazyka, kŕča tváre, laryngospazmu, myotónie, opistotonu, orofaryngeálneho kŕča, pleurototonu, kŕča jazyka a trizmu) a tremor. Treba poznamenať, že je zahrnuté širšie spektrum
príznakov, ktoré nemusia mať nevyhnutne extrapyramídový pôvod.
Zvýšenie telesnej hmotnostiV 13-týždňovej štúdii zahŕňajúcej začiatočné dávkovanie 150 mg, vykazovala časť pacientov
s abnormálnym zvýšením telesnej hmotnosti o ≥ 7 % spojitosť s výškou dávky, s 5 % výskytom
v skupine užívajúcej placebo v porovnaní so 6 %, 8 % a 13 % výskytom v príslušných skupinách užívajúcich 25 mg, 100 mg a 150 mg Paliperidónu Janssen-Cilag International.
Počas 33-týždňovej otvorenej prechodnej/udržiavacej periódy dlhodobej klinickej štúdie zameranej na prevenciu recidívy spĺňalo toto kritérium 12 % pacientov liečených Paliperidónom Janssen-Cilag International (zvýšenie telesnej hmotnosti o ³ 7 % od dvojito zaslepenej fázy až po ukončenie); priemerná zmena telesnej hmotnosti (SD) oproti základnej hodnote v otvorenej fáze bola + 0,7
(4,79) kg.
HyperprolaktinémiaV klinických skúškach sa pozoroval stredný nárast sérovej hladiny prolaktínu u pacientov oboch pohlaví liečených Paliperidónom Janssen-Cilag International. Nežiaduce reakcie, ktoré by mohli poukazovať na nárast sérových hladín prolaktínu (napr. amenorea, galaktorea, menštruačné poruchy, gynekomastia), boli zaznamenané celkovo u < 1 % pacientov.
Účinky tejto triedy liekovPri užívaní antipsychotík sa môže vyskytnúť predĺženie QT intervalu, ventrikulárne arytmie
(ventrikulárna fibrilácia, ventrikulárna tachykardia), náhla nevysvetlená smrť, zastavenie srdcovej činnosti a Torsade de pointes.
Pri užívaní antipsychotík boli s neznámou frekvenciou hlásené prípady venózneho tromboembolizmu vrátane prípadov pľúcnej embólie a prípadov hlbokej žilovej trombózy.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePríznakyVo všeobecnosti sa predávkovanie pravdepodobne prejaví prejavmi a príznakmi, ktoré sú
vystupňovaním známych farmakologických účinkov paliperidónu, t.j. ospanlivosť a sedácia, tachykardia a hypotenzia, predĺženie QT intervalu a extrapyramídové príznaky. Torsade de pointes a
ventrikulárna fibrilácia boli hlásené v súvislosti s predávkovaním pacienta perorálnym paliperidónom. Pri akútnom predávkovaní je potrebné zvážiť možnosť predávkovania viacerými liekmi súčasne.
Liečba
Pri hodnotení potreby liečby a rekonvalescencie je potrebné zvážiť charakter liekovej formy
s predĺženým uvoľňovaním a dlhý polčas eliminácie paliperidónu. K dispozícii nie je žiadne špecifické antidotum pre paliperidón. Je potrebné použiť všeobecné podporné opatrenia. Zabezpečiť a udržať
voľné dýchacie cesty a zaistiť dostatočnú oxygenáciu a ventiláciu.
Okamžite je potrebné začať monitorovanie kardiovaskulárnych parametrov, vrátane kontinuálneho monitorovania EKG, vzhľadom na možné poruchy srdcového rytmu. Hypotenziu a zlyhanie obehu je potrebné liečiť vhodnými postupmi, vrátane intravenózneho podania tekutín a/alebo aplikácie sympatomimetík. V prípade závažných extrapyramídových príznakov sa majú podať anticholínergické látky. Pacienta je potrebné pozorne sledovať a monitorovať až do jeho zotavenia.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Psycholeptiká, iné antipsychotiká, ATC kód: N05AX13
Paliperidón Janssen-Cilag International obsahuje racemickú zmes (+)- a (-)-paliperidónu. Mechanizmus účinku
Paliperidón je selektívny blokátor monoamínových účinkov, ktorého farmakologické vlastnosti sa líšia
od tradičných neuroleptík. Paliperidón sa pevne viaže na serotonínové 5-HT2 receptory a na dopamínergické D2 receptory. Paliperidón tiež blokuje alfa 1-adrenergické receptory a v menšom
rozsahu aj histamínové H1 receptory a alfa 2-adrenergické receptory. Farmakologická aktivita enantiomérov (+)- a (-)-paliperidónu je kvalitatívne a kvantitatívne podobná.
Paliperidón sa neviaže na cholínergické receptory. Aj napriek tomu, že paliperidón je silným antagonistom D2-receptorov, ktorý dokázateľne zmierňuje pozitívne príznaky schizofrénie, vyvoláva menej výraznú katalepsiu a znižuje motorické funkcie v menšom rozsahu ako tradičné neuroleptiká. Dominujúci centrálny sérotonínergický antagonizmus môže znižovať tendenciu paliperidónu vyvolávať extrapyramídové vedľajšie účinky.
Klinická účinnosť
Akútna liečba schizofrénie
Účinnosť Paliperidónu Janssen-Cilag International pri akútnej liečbe schizofrénie bola stanovená pomocou štyroch krátkodobých (jedna 9-týždňová a tri 13-týždňové) dvojito zaslepených, randomizovaných, placebom kontrolovaných štúdií s fixným dávkovaním na dospelých hospitalizovaných pacientoch s akútnym relapsom, ktorí spĺňali kritériá DSM-IV pre schizofréniu. Fixné dávky Paliperidónu Janssen-Cilag International v týchto štúdiách sa podávali 1., 8. a 36. deň pri
9-týždňovej štúdii a dodatočne ešte 64. deň pri 13-týždňových štúdiách. Počas akútnej liečby schizofrénie Paliperidónom Janssen-Cilag International neboli potrebné žiadne ďalšie prídavné perorálne antipsychotiká. Primárny cieľ účinnosti bol definovaný ako pokles celkového skóre na PANSS škále (z angl. Positive and Negative Syndrome Scale), ako je to zobrazené v nasledujúcej tabuľke. PANSS je validovaná viacpoložková škála skladajúca sa z piatich faktorov na hodnotenie pozitívnych príznakov, negatívnych príznakov, dezorganizovaného myslenia, nekontrolovanej hostility/podráždenosti a úzkosti/depresie. Fungovanie sa hodnotilo pomocou stupnice Osobnej a sociálnej výkonnosti (PSP, z angl. Personal and Social Performance scale). PSP je validovaná, lekárom hodnotená škála, ktorá meria osobné a sociálne fungovanie v štyroch hlavných oblastiach:
sociálne prospešné aktivity (práca a štúdium), osobné a sociálne vzťahy, starostlivosť o seba a rušivé a agresívne správanie.
V 13-týždňovej štúdii (n = 636) porovnávajúcej tri fixné dávky Paliperidónu Janssen-Cilag International (začiatočná injekcia 150 mg do deltového svalu, následne 3 dávky do sedacieho alebo deltového svalu buď 25 mg/4 týždne, 100 mg/4 týždne alebo 150 mg/4 týždne) s placebom sa pri všetkých troch dávkach Paliperidónu Janssen-Cilag International preukázalo významné zlepšenie celkového skóre PANSS v porovnaní s placebom. V tejto štúdii vykazovali v skóre PSP obe terapeutické skupiny s dávkou 100 mg/4 týždne a 150 mg/4 týždne, okrem dávky 25 mg/4 týždne, štatistickú prevahu oproti placebu. Tieto výsledky podporujú pretrvávanie účinnosti počas celého trvania liečby a zlepšenie v PANSS a bolo pozorované už 4. deň, s významným oddelením Paliperidónu Janssen-Cilag International od placeba v skupinách s Paliperidónom Janssen-Cilag International podávaným v dávkach 25 mg a 150 mg do 8. dňa.
Výsledky ďalších štúdií priniesli štatisticky významné výsledky v prospech Paliperidónu Janssen- Cilag International, okrem dávky 50 mg v jednej zo štúdií (pozri nasledujúcu tabuľku).
Celkové skóre PANSS – Zmena od východiskovej po koncovú hodnotu – LOCF pre štúdie R092670-
SCH-201, R092670-PSY-3003, R092670-PSY-3004 a R092670-PSY-3007: Súbor analýzy primárnej účinnosti
|
| Placebo
| 25 mg
| 50 mg
| 100 mg
| 150 mg
|
R092670-PSY-3007*
Priemerná východisková hodnota (SD)
Priemerná zmena (SD) P-hodnota (vs. placebo)
| n = 160
86,8 (10,31)
-2,9 (19,26)
--
| n = 155
86,9 (11,99)
-8,0 (19,90)
0,034
|
--
| n = 161
86,2 (10,77)
-11,6 (17,63)
< 0,001
| n = 160
88,4 (11,70)
-13,2 (18,48)
< 0,001
|
R092670-PSY-3003
Priemerná východisková hodnota (SD)
Priemerná zmena (SD)
P-hodnota (vs. placebo)
| n = 132
92,4 (12,55)
-4,1 (21,01)
--
|
--
| n = 93
89,9 (10,78)
-7,9 (18,71)
0,193
| n = 94
90,1 (11,66)
-11,0 (19,06)
0,019
| n = 30
92,2 (11,72)
-5,5 (19,78)
--
|
R092670-PSY-3004
Priemerná východisková
hodnota (SD)
Priemerná zmena (SD) P-hodnota (vs. placebo)
| n = 125
90,7 (12,22)
-7,0 (20,07)
--
| n = 129
90,7 (12,25)
-13,6 (21,45)
0,015
| n = 128
91,2 (12,02)
-13,2 (20,14)
0,017
| n = 131
90,8 (11,70)
-16,1 (20,36)
< 0,001
|
--
|
R092670-SCH-201
Priemerná východisková hodnota (SD)
Priemerná zmena (SD) P-hodnota (vs. placebo)
| n = 66
87,8 (13,90)
6,2 (18,25)
--
|
--
| n = 63
88,0 (12,39)
-5,2 (21,52)
0,001
| n = 68
85,2 (11,09)
-7,8 (19,40)
< 0,0001
|
--
|
* Pri štúdii R092670-PSY-3007 bola začiatočná dávka 150 mg podaná všetkým pacientom v terapeutických skupinách s Paliperidónom Janssen-Cilag International 1. deň a následne im bola podávaná pridelená dávka.
Poznámka: Negatívna zmena v skóre označuje zlepšenie.
Udržiavanie kontroly príznakov a oddialenie recidívy schizofrénieÚčinnosť Paliperidónu Janssen-Cilag International pri udržaní symptomatickej kontroly a oddialení relapsu schizofrénie bola stanovená v dlhodobej, dvojito zaslepenej, placebom kontrolovanej štúdii
s flexibilným dávkovaním, ktorej sa zúčastnilo 849 mladších dospelých pacientov spĺňajúcich kritériá DSM-IV pre schizofréniu. Táto štúdia zahŕňala 33-týždňovú otvorenú fázu akútnej liečby a stabilizácie, randomizovanú, dvojito zaslepenú, placebom kontrolovanú fázu na sledovanie relapsu a
52-týždňovú otvorenú pokračovaciu periódu. V tejto štúdii boli dávky Paliperidónu Janssen-Cilag
International 25 mg, 50 mg, 75 mg a 100 mg podávané v mesačných intervaloch; dávka 75 mg bola
povolená len počas 52-týždňovej otvorenej pokračovacej periódy. Pacienti spočiatku dostávali flexibilné dávky Paliperidónu Janssen-Cilag International (25 mg-100 mg) počas 9-týždňového prechodného obdobia, potom nasledovalo 24-týždňové udržiavacie obdobie, kedy museli pacienti dosahovať požadované skóre PANSS ≤ 75. Úpravy dávkovania boli povolené len počas prvých
12 týždňov udržiavacieho obdobia. Celkovo 410 stabilizovaných pacientov bolo randomizovaných do skupiny s Paliperidónom Janssen-Cilag International (medián trvania 171 dní [rozsah 1 až 407 dní])
alebo do skupiny s placebom (medián trvania 105 dní [rozsah 8 až 441 dní]), až kým sa u nich
nevyskytol relaps príznakov schizofrénie v dvojito zaslepenej fáze rôzneho trvania. Klinická štúdia bola zastavená v skorom období z dôvodov spojených s účinnosťou, keďže sa u pacientov liečených
Paliperidónom Janssen-Cilag International pozorovala oveľa dlhšia doba do relapsu (p < 0,0001, obr.
1) v porovnaní s pacientmi užívajúcimi placebo (pomer rizík = 4,32; 95 % CI: 2,4-7,7).
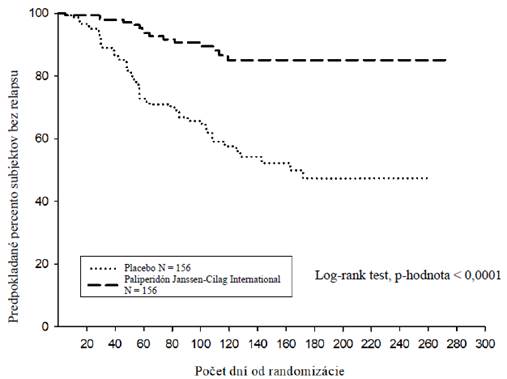 Obrázok 1:
Obrázok 1: Kaplan-Meierova krivka doby do relapsu – predbežná analýza (súbor predbežných analýz
„Intent-to-Treat“ (so zámerom liečby))
Pediatrická populáciaEurópska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom
Paliperidón Janssen-Cilag International vo všetkých podskupinách pediatrickej populácie pre liečbu schizofrénie (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAbsorpcia a distribúciaPaliperidón palmitát je proliečivo paliperidónu vo forme esteru kyseliny palmitovej. Z dôvodu
extrémne nízkej rozpustnosti vo vode sa paliperidón palmitát po intramuskulárnom podaní pomaly rozpúšťa a následne hydrolyzuje na paliperidón a absorbuje do systémového obehu. Po jednej
intramuskulárnej dávke sa plazmatické koncentrácie paliperidónu postupne zvýšia až dosiahnu
maximálne plazmatické koncentrácie pri mediáne Tmax 13 dní. Liečivo sa začína uvoľňovať hneď 1. deň a trvá to minimálne 4 mesiace.
Po intramuskulárnom podaní jednej dávky (25 mg-150 mg) do deltového svalu sa pozorovala v priemere o 28 % vyššia hodnota Cmax ako pri podaní do sedacieho svalu. Dve začiatočné
intramuskulárne injekcie do deltového svalu, jedna v dávke 150 mg 1. deň a druhá v dávke 100 mg
8. deň, napomáhajú rýchlemu dosiahnutiu terapeutických koncentrácií. Profil uvoľňovania a režim dávkovania Paliperidónu Janssen-Cilag International vedú k udržaniu terapeutických koncentrácií. Celková expozícia paliperidónu po podaní Paliperidónu Janssen-Cilag International bola úmerná dávkam v celom dávkovacom rozsahu 25 mg-150 mg a menej ako úmerná dávkam pre hodnotu Cmax pri dávkach vyšších ako 50 mg. Priemerný pomer maximálnych a minimálnych koncentrácií (peak:trough ratio) v rovnovážnom stave pri dávke 100 mg Paliperidónu Janssen-Cilag International bol po podaní do sedacieho svalu 1,8 a po podaní do deltového stavu 2,2. Priemerný zdanlivý biologický polčas paliperidónu po podaní Paliperidónu Janssen-Cilag International v rozsahu dávok od
25 mg-150 mg bol v rozpätí 25-49 dní.
Absolútna biologická dostupnosť paliperidón palmitátu po podaní Paliperidónu Janssen-Cilag
International je 100 %.
Po podaní paliperidón palmitátu sa (+) a (-) enantioméry paliperidónu vzájomne vymenia a dosiahnu pomer AUC (+) k (-) približne 1,6-1,8.
Väzba racemického paliperidónu na plazmatické bielkoviny je 74 %. Biotransformácia a eliminácia
Jeden týždeň po podaní jednorazovej perorálnej dávky 1 mg 14C-paliperidónu (forma s okamžitým
uvoľňovaním účinnej látky) sa 59 % z dávky vylúčilo v nezmenenej forme do moču, čo odráža menej významný metabolizmus paliperidónu pečeňou. Približne 80 % z podanej rádioaktivity sa zachytilo
v moči a 11 % v stolici. In vivo boli identifikované štyri metabolické dráhy, pričom žiadna z nich
nepredstavovala viac ako 6,5 % z podanej dávky: dealkylácia, hydroxylácia, dehydrogenácia a benzisoxazolové štiepenie. Aj napriek tomu, že sa v štúdiách in vitro predpokladal význam izoenzýmov CYP2D6 a CYP3A4 pri metabolizme paliperidónu, v štúdiách in vivo sa nepotvrdilo, že by tieto izoenzýmy mali významnú úlohu. V analýzach populačnej farmakokinetiky sa nezistili výraznejšie rozdiely eliminácie paliperidónu po podaní perorálneho paliperidónu osobám s rýchlym metabolizmom, resp. s pomalým metabolizmom substrátov izoenzýmu CYP2D6. V štúdiách in vitro zameraných na mikrozómy ľudskej pečene sa ukázalo, že paliperidón významnejšie neinhibuje metabolizmus liekov, ktoré sú metabolizované izoenzýmami cytochrómu P450, vrátane CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 a CYP3A5.
V štúdiách in vitro sa ukázalo, že paliperidón je pri vysokých koncentráciách P-gp substrátom a slabým inhibítorom P-gp. Nie sú dostupné žiadne in vivo údaje a klinický význam nie je známy.
Injekcia paliperidón palmitátu s dlhotrvajúcim účinkom verzus perorálny paliperidón s predĺženýmuvoľňovaním
Paliperidón Janssen-Cilag International je určený na podávanie paliperidónu v mesačných intervaloch,
zatiaľ čo perorálny paliperidón s predĺženým uvoľňovaním sa podáva každý deň. Začiatočný režim pre Paliperidón Janssen-Cilag International (150 mg/100 mg do deltového svalu 1. deň/8. deň) bol navrhnutý za účelom rýchleho dosiahnutia rovnovážneho stavu koncentrácií paliperidónu pri začatí terapie bez použitia perorálnej suplementácie.
Vo všeobecnosti boli celkové začiatočné plazmatické hladiny pri Paliperidóne Janssen-Cilag International v rámci expozičného rozsahu, ktorý bol pozorovaný pri dávkach 6-12 mg perorálneho paliperidónu s predĺženým uvoľňovaním. Používanie tohto režimu pri začatí užívania Paliperidónu Janssen-Cilag International umožnilo pacientom zostať v expozičnom okne 6-12 mg perorálneho paliperidónu s predĺženým uvoľňovaním, dokonca aj počas dní pred dávkou s minimami plazmatických hladín (8. a 36. deň). Z dôvodu rozdielnych stredných farmakokinetických profilov medzi týmito dvoma liekmi by sa malo postupovať opatrne pri priamom porovnávaní ich farmakokinetických vlastností.
Porucha funkcie pečene
Paliperidón nie je rozsiahlejšie metabolizovaný v pečeni. Aj napriek tomu, že sa účinky Paliperidónu
Janssen-Cilag International neskúmali u ľudí s poruchou funkcie pečene, nevyžaduje sa žiadna úprava dávkovania u pacientov s miernou alebo stredne závažnou poruchou funkcie pečene. V štúdii
s perorálnym paliperidónom zahŕňajúcej pacientov so stredne závažnou poruchou funkcie pečene
(Childova-Pughova trieda B) boli plazmatické koncentrácie voľného paliperidónu podobné ako
u zdravých jedincov. K dispozícii nie sú žiadne údaje o pacientoch so závažnou poruchou funkcie pečene.
Porucha funkcie obličiek
Vylučovanie jednej dávky 3 mg tablety perorálneho paliperidónu s predĺženým uvoľňovaním sa
sledovalo u pacientov s rôznymi stupňami poruchy funkcie obličiek. Eliminácia paliperidónu sa znižuje so znižujúcim sa predpokladaným klírensom kreatinínu. Celkový klírens paliperidónu
u pacientov s miernou poruchou funkcie obličiek (CrCl = 50 až < 80 ml/min.) bol priemerne nižší
o 32 %, u pacientov so stredne závažnou poruchou funkcie obličiek (CrCl = 30 až < 50 ml/min.) bol nižší o 64 % a u osôb so závažnou poruchou funkcie obličiek (CrCl = 10 až < 30 ml/min.) bol nižší
o 71 %, čo zodpovedá priemernému 1,5-; 2,6- a 4,8-násobnému nárastu expozície (AUCinf) v danom poradí v porovnaní so zdravými jedincami. Na základe obmedzeného počtu pozorovaní s
Paliperidónom Janssen-Cilag International u pacientov s miernou poruchou funkcie obličiek a farmakokinetických simulácií sa odporúča nižšia dávka (pozri časť 4.2).
Staršie osoby
Analýza populačnej farmakokinetiky neodhalila žiadny dôkaz rozdielov vo farmakokinetike spojených
s vekom.
Index telesnej hmotnosti (BMI)/telesná hmotnosť
Farmakokinetické štúdie s paliperidón palmitátom preukázali o niečo nižšie (10-20 %) plazmatické
koncentrácie paliperidónu u pacientov s nadváhou alebo obezitou v porovnaní s pacientmi s normálnou hmotnosťou (pozri časť 4.2).
Rasa
Analýza populačnej farmakokinetiky údajov zo štúdií s perorálnym paliperidónom neodhalila žiaden
dôkaz rozdielov spojených s rasou vo farmakokinetike paliperidónu po podaní Paliperidónu Janssen- Cilag International.
Pohlavie
Nepozorovali sa žiadne klinicky významné rozdiely medzi mužmi a ženami.
Fajčenie
V štúdiách in vitro zameraných na enzýmy ľudskej pečene sa zistilo, že paliperidón nie je substrátom
izoenzýmu CYP1A2. Z tohto dôvodu by fajčenie nemalo ovplyvňovať farmakokinetiku paliperidónu. Vplyv fajčenia na farmakokinetiku paliperidónu sa pri Paliperidóne Janssen-Cilag International neskúmal. V analýze populačnej farmakokinetiky na základe údajov zo štúdií s perorálnymi tabletami paliperidónu s predĺženým uvoľňovaním sa preukázala mierne znížená expozícia paliperidónu
u fajčiarov v porovnaní s nefajčiarmi. Je nepravdepodobné, že tento rozdiel je klinicky relevantný.
5.3 Predklinické údaje o bezpečnosti
V štúdiách skúmajúcich toxicitu po opakovanom intramuskulárnom podaní paliperidón palmitátu (1- mesačná lieková forma) a perorálnom podaní paliperidónu potkanom a psom sa pozorovali najmä
farmakologické účinky, ako je sedácia a prolaktínové účinky na prsné žľazy a pohlavné orgány. U zvierat liečených paliperidón palmitátom bolo možné pozorovať zápalovú reakciu v mieste intramuskulárneho podania. Príležitostne sa vytvoril absces.
V štúdiách s perorálnym risperidónom, ktorý sa z väčšej časti u potkanov a ľudí mení na paliperidón, skúmajúcich reprodukčnú toxicitu u potkanov, sa pozorovali nežiaduce účinky na pôrodnú hmotnosť a prežívanie mláďat. Nepozorovala sa žiadna embryonálna toxicita ani malformácie po intramuskulárnom podaní paliperidón palmitátu gravidným samiciam potkanov do maximálnej dávky (160 mg/kg/deň), čo zodpovedá 4,1-násobku expozičnej hladiny u ľudí pri maximálnej odporúčanej dávke 150 mg. Po podaní iných antagonistov dopamínu gravidným samiciam zvierat sa zistili nežiaduce účinky na učenie a motorický vývin mláďat.
Paliperidón palmitát ani paliperidón neboli genotoxické. V štúdiách skúmajúcich karcinogénne účinky po perorálnom podaní risperidónu potkanom a myšiam sa pozoroval zvýšený výskyt adenómov hypofýzy (u myší), adenómov endokrinného pankreasu (u potkanov) a adenómov prsnej žľazy
(u oboch druhov laboratórnych zvierat). Možnosť karcinogénnych účinkov intramuskulárne podaného paliperidón palmitátu sa vyhodnocovala u potkanov. U samíc potkanov sa vyskytol štatisticky významný nárast adenokarcinómov prsnej žľazy pri dávkach 10, 30 a 60 mg/kg/mesiac. U samcov potkanov sa vyskytol štatisticky významný nárast adenómov a karcinómov prsnej žľazy pri dávkach
30 a 60 mg/kg/mesiac, čo je 1,2- a 2,2-násobok expozičnej hladiny pri maximálnej dávke 150 mg odporúčanej u ľudí. Tieto nádory môžu súvisieť s dlhotrvajúcim antagonizmom dopamínových D2-
receptorov a hypeprolaktinémiou. Význam týchto poznatkov o nádoroch u hlodavcov z hľadiska rizika
pre ľudí nie je známy.
6 FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Polysorbát 20
Polyetylénglykol 4000
Monohydrát kyseliny citrónovej
Bezvodý hydrogénfosforečnan disodný Monohydrát dihydrogénfosforečnanu sodného Hydroxid sodný (na úpravu pH)
Voda na injekcie
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 30 °C.
6.5 Druh obalu a obsah balenia
Naplnená injekčná striekačka (cyklický olefínový kopolymér) s piestovou zátkou, zarážkou a ochranným uzáverom (bromobutylová guma) s 1½-palcovou bezpečnostnou ihlou veľkosti 22 G (0,72 mm x 38,1 mm) a 1-palcovou bezpečnostnou ihlou veľkosti 23 G (0,64 mm x 25,4 mm).
Veľkosti balenia:
Balenie obsahuje 1 naplnenú injekčnú striekačku a 2 ihly.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má byť zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIJanssen-Cilag International NV Turnhoutseweg 30
B-2340 Beerse
Belgicko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/20/1453/001EU/1/20/1453/002 EU/1/20/1453/003 EU/1/20/1453/004 EU/1/20/1453/005
9. DÁTUM PRVEJ REGISTRÁCIE / PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUMM/RRRR
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Paliperidón Janssen-Cilag International 150 mg a Paliperidón Janssen-Cilag International 100 mg injekčná suspenzia s predĺženým uvoľňovaním
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Jedna naplnená injekčná striekačka obsahuje 156 mg paliperidón palmitátu zodpovedajúceho 100 mg paliperidónu.
Jedna naplnená injekčná striekačka obsahuje 234 mg paliperidón palmitátu zodpovedajúceho 150 mg paliperidónu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčná suspenzia s predĺženým uvoľňovaním.
Suspenzia je bielej až sivobielej farby. Suspenzia má neutrálne pH (približne 7,0).
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Paliperidón Janssen-Cilag International je indikovaný na udržiavaciu liečbu schizofrénie dospelým pacientom stabilizovaným pomocou paliperidónu alebo risperidónu.
U vybranch dospelých pacientov so schizofréniou a s predchádzajúcou odpoveďou na liečbu perorálnym paliperidónom alebo risperidónom sa môže Paliperidón Janssen-Cilag International podávať bez predchádzajúcej stabilizácie prostredníctvom perorálnej liečby v prípade, že sa u nich vyskytujú mierne až stredne závažné psychotické príznaky a je potrebná injekčná liečba
s dlhotrvajúcim účinkom.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Odporúčaná dávka pri začatí podávania Paliperidónu Janssen-Cilag International je 150 mg 1. deň
liečby a 100 mg o týždeň neskôr (8. deň). Obe dávky sa majú podať do deltového svalu za účelom rýchleho dosiahnutia terapeutických koncentrácií (pozri časť 5.2). Tretia dávka sa má podať jeden mesiac po druhej úvodnej dávke. Odporúčaná mesačná udržiavacia dávka je 75 mg; niektorým pacientom môžu viac prospievať nižšie alebo vyššie dávky v rámci odporúčaného rozsahu 25 mg –
150 mg na základe tolerancie a/alebo účinnosti u jednotlivých pacientov. Pacienti s nadváhou alebo obézni pacienti môžu vyžadovať dávky na hornej hranici rozsahu (pozri časť 5.2). Po druhej úvodnej
dávke bude možné podávať mesačné udržiavacie dávky buď do deltového alebo sedacieho svalu.
Úpravu udržiavacej dávky je možné vykonávať v mesačných intervaloch. Pri úprave dávkovania sa majú zvážiť vlastnosti týkajúce sa predĺženého uvoľňovania Paliperidónu Janssen-Cilag International (pozri časť 5.2), keďže plný účinok udržiavacích dávok nemusí byť zreteľný niekoľko mesiacov.
Prechod z perorálneho paliperidónu s predĺženým uvoľňovaním alebo perorálneho risperidónu na
Paliperidón Janssen-Cilag International
Paliperidón Janssen-Cilag International sa má začať užívať podľa popisu na začiatku predchádzajúcej časti 4.2. Počas mesačnej udržiavacej liečby Paliperidónom Janssen-Cilag International môžu pacienti, ktorí boli predtým stabilizovaní na rôznych dávkach paliperidónu tabliet s predĺženým uvoľňovaním,
dosiahnuť podobnú expozíciu paliperidónu v rovnovážnom stave pomocou injekcie. Udržiavacie dávky Paliperidónu Janssen-Cilag International potrebné na dosiahnutie podobnej expozície
v rovnovážnom stave, sú uvedené nasledovne:
Dávky paliperidónu tabliet s predĺženým uvoľňovaním a Paliperidónu Janssen-Cilag
International potrebného na dosiahnutie podobnej expozície paliperidónu v rovnovážnom stave počas udržiavacej liečby.
|
Predchádzajúca dávka paliperidónu tabliet s predĺženým uvoľňovaním
| Injekčne podávaný Paliperidón Janssen- Cilag International
|
3 mg denne
| 25-50 mg mesačne
|
6 mg denne
| 75 mg mesačne
|
9 mg denne
| 100 mg mesačne
|
12 mg denne
| 150 mg mesačne
|
Predchádzajúci perorálny paliperidón alebo perorálny risperidón je možné vysadiť v čase začatia
liečby Paliperidónom Janssen-Cilag International. U niektorých pacientov môže byť prínosom postupné vysadenie lieku. Niektorí pacienti prechádzajúci z vyšších perorálnych dávok paliperidónu (napr. 9-12 mg denne) na injekcie Paliperidónu Janssen-Cilag International podávané do gluteálneho svalu môžu mať počas prvých 6 mesiacov po prechode nižšiu plazmatickú expozíciu. Z toho dôvodu sa môže prípadne zvážiť podávanie injekcií do deltového svalu počas prvých 6 mesiacov.
Prechod z injekčne podávaného risperidónu s dlhotrvajúcim účinkom na Paliperidón Janssen-CilagInternationalPri zmene liečby z injekčne podávaného risperidónu s dlhotrvajúcim účinkom začnite terapiu
Paliperidónom Janssen-Cilag International namiesto ďalšej naplánovanej injekcie. Podávanie
Paliperidónu Janssen-Cilag International má následne pokračovať v mesačných intervaloch. Jednotýždňový režim začiatočného dávkovania vrátane intramuskulárnych injekcií (1. deň a 8. deň, v danom poradí) podľa popisu v časti 4.2 sa nevyžaduje.
Pacienti, ktorí boli predtým stabilizovaní pomocou rôznych dávok injekčne podávaného risperidónu s dlhotrvajúcim účinkom môžu dosiahnuť podobnú expozíciu paliperidónu v rovnovážnom stave
počas udržiavacej liečby mesačnými dávkami Paliperidónu Janssen-Cilag International podľa nasledujúcich údajov:
Dávky injekčne podávaného risperidónu s dlhotrvajúcim účinkom a Paliperidónu Janssen-
Cilag International potrebného na dosiahnutie podobnej expozície paliperidónu v rovnovážnom stave
|
Predchádzajúca dávka injekčne podávaného risperidónu s dlhotrvajúcim účinkom
| Injekčne podávaný Paliperidón Janssen- Cilag International
|
25 mg každé 2 týždne
| 50 mg mesačne
|
37,5 mg každé 2 týždne
| 75 mg mesačne
|
50 mg každé 2 týždne
| 100 mg mesačne
|
Antipsychotiká je potrebné vysadiť v súlade s príslušnými pokynmi pre podávanie. V prípade, že
Paliperidón Janssen-Cilag International vysadíte, musíte zvážiť jeho vlastnosti týkajúce sa predĺženého uvoľňovania. Má sa pravidelne prehodnocovať užívanie lieku vzhľadom na prítomnosť
extrapyramídových príznakov (EPS).
Vynechané dávkyPredchádzanie vynechaniu dávokOdporúča sa, aby sa druhá začiatočná dávka Paliperidónu Janssen-Cilag International podávala jeden týždeň po prvej dávke. Aby sa zamedzilo vynechaniu dávky, pacientovi môže byť druhá dávka podaná
4 dni pred alebo po jednotýždňovom limite (8. deň). Podobne sa odporúča podávať tretiu a nasledovné injekcie po začiatočnom režime v mesačných intervaloch. Aby sa zamedzilo vynechaniu dávky, pacientovi môže byť injekcia podaná do 7 dní pred alebo po mesačnom časovom limite.
Ak zmeškáte plánovaný dátum pre druhú injekciu Paliperidónu Janssen-Cilag International (8. deň ±
4 dni), odporúčané opätovné začatie liečby závisí od doby, ktorá uplynula od podania prvej injekcie pacientovi.
Vynechaná druhá začiatočná dávka (< 4 týždne od prvej injekcie)
Ak od prvej injekcie uplynuli menej ako 4 týždne, pacientovi má byť čo najskôr podaná druhá injekcia
100 mg do deltového svalu. Tretia injekcia Paliperidónu Janssen-Cilag International 75 mg má byť podaná do deltového alebo sedacieho svalu 5 týždňov po prvej injekcii (bez ohľadu na čas podania
druhej injekcie). Následne je potrebné dodržiavať normálny mesačný cyklus podávania injekcií buď
do deltového alebo sedacieho svalu v rozsahu dávky 25 mg až 150 mg v závislosti od tolerancie pacienta a/alebo účinnosti.
Vynechaná druhá začiatočná dávka (4-7 týždňov od prvej injekcie)
Ak od prvej injekcie Paliperidónu Janssen-Cilag International ubehlo 4 až 7 týždňov, pokračujte v dávkovaní dvoma injekciami 100 mg nasledujúcim spôsobom:
1. injekcia do deltového svalu čo najskôr
2. ďalšia injekcia do deltového svalu o týždeň neskôr
3. pokračovanie v normálnom mesačnom cykle podávania injekcií buď do deltového alebo sedacieho svalu v rozsahu dávky 25 mg až 150 mg v závislosti od tolerancie pacienta a/alebo účinnosti.
Vynechaná druhá začiatočná dávka (> 7 týždňov od prvej injekcie)
Ak od prvej injekcie Paliperidónu Janssen-Cilag International ubehlo viac ako 7 týždňov, začnite s dávkovaním podľa popisu uvedeného pre odporúčané začatie liečby Paliperidónom Janssen-Cilag International vyššie.
Vynechaná mesačná udržiavacia dávka (1 mesiac až 6 týždňov)
Po začatí sa odporúča mesačný cyklus podávania injekcií Paliperidónu Janssen-Cilag International. Ak od poslednej injekcie ubehlo menej ako 6 týždňov, podajte čo najskôr predchádzajúcu stabilizačnú
dávku, v podávaní ďalších injekcií pokračujte v mesačných intervaloch.
Vynechaná mesačná udržiavacia dávka (> 6 týždňov až 6 mesiacov)
Ak od poslednej injekcie Paliperidónu Janssen-Cilag International ubehlo viac ako 6 týždňov, odporúčania sú nasledovné:
Pre pacientov stabilizovaných dávkami 25 mg až 100 mg
1. čo najskôr injekcia do deltového svalu, s rovnakou dávkou, s ktorou bol pacient predtým stabilizovaný
2. ďalšia injekcia do deltového svalu (rovnaká dávka) o týždeň neskôr (8. deň)
3. pokračovanie v normálnom mesačnom cykle podávania injekcií buď do deltového alebo sedacieho svalu v rozsahu dávky 25 mg až 150 mg v závislosti od tolerancie pacienta a/alebo účinnosti.
Pre pacientov stabilizovaných dávkou 150 mg
1. čo najskôr injekcia do deltového svalu s dávkou 100 mg
2. ďalšia injekcia do deltového svalu o týždeň neskôr (8. deň) s dávkou 100 mg
3. pokračovanie v normálnom mesačnom cykle podávania injekcií buď do deltového alebo sedacieho svalu v rozsahu dávky 25 mg až 150 mg v závislosti od tolerancie pacienta a/alebo účinnosti.
Vynechaná mesačná udržiavacia dávka (> 6 mesiacov)
Ak od poslednej injekcie Paliperidónu Janssen-Cilag International ubehlo viac ako 6 mesiacov, začnite s dávkovaním podľa popisu uvedeného pre odporúčané začatie liečby Paliperidónom Janssen-Cilag International vyššie.
Osobitné populácie
Starší pacienti
Účinnosť a bezpečnosť u starších pacientov vo veku > 65 rokov neboli stanovené.
Vo všeobecnosti sa odporúča pre starších pacientov s normálnou funkciou obličiek rovnaké dávkovanie Paliperidónu Janssen-Cilag International ako pre mladších dospelých pacientov
s normálnou funkciou obličiek. Z dôvodu možnej zníženej funkcie obličiek u starších pacientov však
možno bude potrebné dávkovanie upraviť (pozri Porucha funkcie obličiek nižšie, kde nájdete odporúčania pre dávkovanie u pacientov s poruchou funkcie obličiek).
Porucha funkcie obličiek
Paliperidón Janssen-Cilag International nebol systematicky študovaný u pacientov s poruchou funkcie obličiek (pozri časť 5.2). Pacientom s miernou poruchou funkcie obličiek (klírens kreatinínu ≥ 50 až
< 80 ml/min.) sa odporúča začať liečbu Paliperidónom Janssen-Cilag International dávkou 100 mg v
1. deň liečby a 75 mg o týždeň neskôr, obe podané do deltového svalu. Odporúčaná mesačná udržiavacia dávka je 50 mg s rozsahom 25 mg až 100 mg v závislosti od tolerancie pacienta a/alebo účinnosti.
Paliperidón Janssen-Cilag International sa neodporúča u pacientov so stredne závažnou alebo závažnou poruchou funkcie obličiek (klírens kreatinínu < 50 ml/min.) (pozri časť 4.4).
Porucha funkcie pečene
Na základe skúseností s perorálnym paliperidónom nie je u pacientov s miernou alebo stredne závažnou poruchou funkcie pečene potrebná úprava dávkovania. Keďže nebol paliperidón skúmaný
u pacientov s vážnou poruchou funkcie pečene, odporúča sa u týchto pacientov postupovať opatrne
(pozri časť 5.2).
Pediatrická populácia
Bezpečnosť a účinnosť Paliperidónu Janssen-Cilag International u detí a dospievajúcich vo veku
< 18 rokov neboli stanovené. K dispozícii nie sú žiadne údaje.
Spôsob podávania
Paliperidón Janssen-Cilag International je určený len na intramuskulárne použitie. Nesmie sa podávať
žiadnou inou cestou. Je potrebné podať ho pomaly, hlboko do deltového alebo gluteálneho svalu. Každú injekciu má podať zdravotnícky pracovník. Má sa podať jednou injekciou. Dávka sa nemá
podávať rozdelenými injekciami.
Úvodné dávky v 1. a 8. deň sa musia podať do deltového svalu, aby sa rýchlo dosiahli terapeutické koncentrácie (pozri časť 5.2). Po druhej úvodnej dávke sa môžu podávať mesačné udržiavacie dávky buď do deltového alebo sedacieho svalu. V prípade bolesti v mieste podania, ak je diskomfort v mieste vpichu zle tolerovaný, sa má zvážiť zmena miesta podania zo sedacieho na deltový sval (a naopak) (pozri časť 4.8). Odporúča sa tiež striedať ľavú a pravú stranu (pozri nižšie).
Pokyny na používanie a zaobchádzanie s Paliperidónom Janssen-Cilag International, pozri písomnú informáciu pre používateľa (informáciu určenú pre lekárov a zdravotníckych pracovníkov).
Podanie do deltového svalu
Odporúčaná veľkosť ihly na začiatočné a udržiavacie podávanie Paliperidónu Janssen-Cilag
International do deltového svalu závisí od pacientovej hmotnosti. Pre pacientov vážiacich ³ 90 kg sa odporúča 1½-palcová ihla veľkosti 22 G (38,1 mm x 0,72 mm). Pre pacientov vážiacich < 90 kg sa odporúča 1-palcová ihla veľkosti 23 G (25,4 mm x 0,64 mm). Podanie injekcie do deltového svalu sa má striedať, raz do jedného a raz do druhého svalu.
Podanie do sedacieho svalu
Odporúčaná veľkosť ihly na udržiavacie podávanie Paliperidónu Janssen-Cilag International do sedacieho svalu je 1½-palcová ihla veľkosti 22 G (38,1 mm x 0,72 mm). Dávku je potrebné podať do
vonkajšieho horného kvadrantu sedacej časti. Podanie injekcie do sedacieho svalu sa má striedať, raz do jedného a raz do druhého svalu.
4.3 Kontraindikácie
Precitlivenosť na liečivo, na risperidón alebo na ktorúkoľvek z pomocných látok uvedených v časti
6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Použitie u pacientov akútne agitovaných alebo vo vážnom psychotickom stave
Paliperidón Janssen-Cilag International sa nemá používať na zvládanie akútnych stavov agitovanosti
ani vážnych psychotických stavov, keď sa vyžaduje okamžitá kontrola príznakov.
QT interval
Opatrnosť je potrebná pri predpisovaní paliperidónu pacientom so známym kardiovaskulárnym
ochorením alebo s rodinnou anamnézou predĺženého QT intervalu a pri súbežnom užívaní s inými liekmi, o ktorých sa predpokladá, že predlžujú QT interval.
Neuroleptický malígny syndróm
Pri liečbe paliperidónom sa vyskytol neuroleptický malígny syndróm (NMS), ktorý je
charakterizovaný hypertermiou, svalovou rigiditou, vegetatívnou nestabilitou, poruchami vedomia a zvýšením sérových hladín kreatínfosfokinázy. Ďalšie klinické prejavy môžu zahŕňať myoglobinúriu
(rabdomyolýzu) a akútne zlyhanie obličiek. Ak sa u pacienta objavia prejavy alebo príznaky
indikujúce NMS, je potrebné vysadiť paliperidón.
Tardívna dyskinéza/Extrapyramídové príznaky
Liečba antagonistami dopamínových receptorov sa spája so vznikom tardívnej dyskinézy, ktorá je
charakterizovaná rytmickými, mimovoľnými pohybmi, najmä jazyka a/alebo tváre. Ak sa objavia prejavy a príznaky tardívnej dyskinézy, je potrebné zvážiť vysadenie všetkých antipsychotík, vrátane paliperidónu.
U pacientov dostávajúcich súbežne psychostimulanciá (napr. metylfenidát) a paliperidón sa vyžaduje opatrnosť, pretože sa pri úprave jedného alebo oboch liekov môžu objaviť extrapyramídové príznaky. Odporúča sa postupné ukončenie liečby stimulantom (pozri časť 4.5).
Leukopénia, neutropénia a agranulocytóza
Pri liečbe Paliperidónom Janssen-Cilag International boli hlásené prípady leukopénie, neutropénie
a agranulocytózy. V priebehu postmarketingového sledovania bola agranulocytóza hlásená veľmi zriedkavo (< 1/10 000 pacientov). Pacientov s klinicky významným nízkym počtom leukocytov
v anamnéze alebo s liekom indukovanou leukopéniou/neutropéniou treba sledovať prvých niekoľko mesiacov liečby a treba zvážiť prerušenie liečby Paliperidónom Janssen-Cilag International pri prvých
prejavoch klinicky významného poklesu počtu leukocytov, ak nie sú prítomné iné kauzálne faktory. U pacientov s klinicky významnou neutropéniou treba starostlivo sledovať horúčku a iné príznaky alebo prejavy infekcie a ihneď ich liečiť, ak sa takéto príznaky alebo prejavy objavia. U pacientov so závažnou neutropéniou (absolútny počet neutrofilov < 1 x 109/l) sa má liečba Paliperidónom Janssen- Cilag International prerušiť a sledovať počet leukocytov až do zotavenia.
Reakcie z precitlivenosti
Počas postmarketingových skúseností boli u pacientov, ktorí predtým tolerovali perorálny risperidón
alebo perorálny paliperidón, zriedkavo hlásené anafylaktické reakcie (pozri časti 4.1 a 4.8).
Ak sa vyskytnú reakcie z precitlivenosti, ukončite používanie Paliperidónu Janssen-Cilag International; začnite so všeobecnými podpornými opatreniami podľa klinickej potreby a sledujte pacienta, kým prejavy a príznaky nezmiznú (pozri časti 4.3 a 4.8).
Hyperglykémia a diabetes mellitus
Počas liečby paliperidónom bola hlásená hyperglykémia, diabetes mellitus a exacerbácia existujúceho
diabetu, vrátane diabetickej kómy a ketoacidózy. Odporúča sa vhodné klinické sledovanie v súlade s používanými smernicami pre antipsychotiká. U pacientov liečených Paliperidónom Janssen-Cilag International, treba sledovať príznaky hyperglykémie (ako polydipsia, polyúria, polyfágia a slabosť) a u pacientov s diabetes mellitus treba pravidelne sledovať zhoršenie kontroly glukózy.
Zvýšenie telesnej hmotnosti
Pri užívaní Paliperidónu Janssen-Cilag International bolo hlásené významné zvýšenie telesnej
hmotnosti. Hmotnosť je potrebné pravidelne kontrolovať.
Použitie u pacientov s prolaktín-dependentnými nádormi
Štúdie s tkanivovými kultúrami naznačujú, že rast buniek v nádoroch prsníka u ľudí môže byť
stimulovaný prolaktínom. Hoci sa v klinických a epidemiologických štúdiách zatiaľ nepreukázalo jasné spojenie s podávaním antipsychotík, u pacientov s relevantnou lekárskou anamnézou sa
odporúča opatrnosť. Paliperidón sa má používať opatrne u pacientov s preexistujúcim nádorom, ktorý môže byť prolaktín-dependentný.
Ortostatická hypotenzia
Vzhľadom na alfa-blokujúci účinok môže paliperidón u niektorých pacientov vyvolať ortostatickú
hypotenziu.
Zo zlúčených údajov získaných z troch placebom kontrolovaných 6-týždňových štúdií s fixnou dávkou perorálnych tabliet paliperidónu s predĺženým uvoľňovaním (3 mg, 6 mg, 9 mg a 12 mg) vyplýva, že ortostatická hypotenzia sa vyskytla u 2,5 % pacientov liečených perorálnym paliperidónom
v porovnaní s 0,8 % pacientov užívajúcich placebo. Paliperidón Janssen-Cilag International sa má používať opatrne u pacientov so známym kardiovaskulárnym ochorením (napr. srdcové zlyhanie,
infarkt myokardu alebo ischémia, poruchy prevodu vzruchu), cerebrovaskulárnym ochorením alebo stavmi, ktoré predisponujú pacienta k hypotenzii (napr. dehydratácia a hypovolémia).
Kŕče
Paliperidón Janssen-Cilag International sa má používať opatrne u pacientov s anamnézou kŕčov alebo
iných stavov, ktoré môžu znižovať prah pre vznik kŕčov.
Porucha funkcie obličiek
U pacientov s poruchou funkcie obličiek sú plazmatické hladiny paliperidónu zvýšené, a preto sa
u pacientov s miernou poruchou funkcie obličiek odporúča úprava dávky. Paliperidón Janssen-Cilag
International sa neodporúča u pacientov so stredne závažnou alebo závažnou poruchou funkcie obličiek (klírens kreatinínu < 50 ml/min.) (pozri časti 4.2 a 5.2).
Porucha funkcie pečene
O pacientoch so závažnou poruchou funkcie pečene (Childova-Pughova trieda C) nie sú k dispozícii
žiadne údaje. Pri používaní paliperidónu u týchto pacientov je potrebná zvýšená opatrnosť.
Starší pacienti s demenciou
Paliperidón Janssen-Cilag International nebol študovaný u starších pacientov s demenciou. Paliperidón
Janssen-Cilag International má byť podávaný s opatrnosťou u starších pacientov s demenciou s rizikovými faktormi pre cievnu mozgovú príhodu.
Skúsenosti s risperidónom uvedené nižšie sú považované za platné tiež pre paliperidón.
Celková úmrtnosť
Pri metaanalýze 17 kontrolovaných klinických štúdií sa u starších pacientov s demenciou, ktorí boli liečení inými atypickými antipsychotikami, vrátane risperidónu, aripiprazolu, olanzapínu a kvetiapínu,
zistilo vyššie riziko úmrtia v porovnaní s placebom. U pacientov liečených risperidónom bola
mortalita 4 % v porovnaní s 3,1 % u pacientov užívajúich placebo.
Cerebrovaskulárne nežiaduce reakcie
V randomizovaných, placebom kontrolovaných klinických štúdiách sledujúcich pacientov
s demenciou, ktorí boli liečení niektorými atypickými antipsychotikami, vrátane risperidónu, aripiprazolu a olanzapínu, sa pozorovalo približne 3-násobne vyššie riziko cerebrovaskulárnych
nežiaducich reakcií. Príčina tohto vyššieho rizika nie je známa.
Parkinsonova choroba a demencia s prítomnosťou Lewyho teliesok
Pri predpisovaní Paliperidónu Janssen-Cilag International pacientom s Parkinsonovou chorobou alebo
demenciou s prítomnosťou Lewyho teliesok (DLB) je potrebné, aby lekári zvážili pomer prínosu a rizika liečby, pretože obe skupiny pacientov môžu byť ohrozené zvýšeným rizikom vzniku neuroleptického malígneho syndrómu, resp. môžu mať vyššiu citlivosť na antipsychotiká. Zvýšená citlivosť na antipsychotiká sa môže prejaviť zmätenosťou, otupenosťou, posturálnou nerovnováhou vrátane častých pádov a extrapyramídovými príznakmi.
Priapizmus
Zaznamenalo sa, že antipsychotiká (vrátane risperidónu) s α-adrenergickými blokujúcimi účinkami
vyvolávajú priapizmus. Po uvedení lieku na trh sa priapizmus zaznamenal tiež pri perorálnom paliperidóne, ktorý je aktívnym metabolitom risperidónu. Pacientov treba poučiť, aby vyhľadali urgentnú lekársku pomoc v prípade, že priapizmus pretrváva viac ako 4 hodiny.
Regulácia telesnej teploty
Antipsychotikám sa pripisuje úloha pri poruche schopnosti organizmu znížiť teplotu telesného jadra.
Pri predpisovaní Paliperidónu Janssen-Cilag International pacientom, ktorí sa dostávajú do situácií vedúcich k zvýšeniu teploty telesného jadra, napr. namáhavé cvičenie, pobyt vo veľkých horúčavách,
súbežné užívanie liekov s anticholínergickým účinkom alebo dehydratácia, sa odporúča náležitá
starostlivosť.
Venózny tromboembolizmus
Pri užívaní antipsychotík sa vyskytli prípady venózneho tromboembolizmu (VTE). Keďže sa
u pacientov liečených antipsychotikami často objavujú získané rizikové faktory pre vznik VTE, pred liečbou Paliperidónom Janssen-Cilag International a počas nej treba zistiť všetky možné rizikové faktory VTE a prijať preventívne opatrenia.
Antiemetický účinok
V predklinických štúdiách s paliperidónom sa pozoroval antiemetický účinok. V prípade, že sa tento
účinok vyskytne u ľudí, môže zakrývať prejavy a príznaky predávkovania niektorými liekmi alebo stavov, ako napr. obštrukcia čreva, Reyov syndróm a nádor mozgu.
Podávanie
Dajte pozor, aby nedošlo k neželanému podaniu Paliperidónu Janssen-Cilag International do krvnej
cievy.
Peroperačný syndróm vlajúcej dúhovky
Peroperačný syndróm vlajúcej dúhovky (IFIS, z angl. intraoperative floppy iris syndrome) sa
pozoroval počas operácie katarakty u pacientov liečených liekmi s alfa 1a-adrenergným antagonistickým účinkom, ako napr. Paliperidón Janssen-Cilag International (pozri časť 4.8).
IFIS môže zvyšovať riziko očných komplikácií počas operácie a po nej. Pred operáciou treba očného chirurga informovať o užívaní liekov s alfa 1a-adrenergným antagonistickým účinkom v súčasnosti alebo v minulosti. Potenciálny prínos ukončenia liečby blokujúcej alfa 1 pred operáciou katarakty sa nestanovil a musí sa porovnať s rizikom ukončenia antipsychotickej liečby.
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t.j. v podstate zanedbateľné
množstvo sodíka.
4.5 Liekové a iné interakcie
Odporúča sa zvýšená opatrnosť pri predpisovaní Paliperidón Janssen-Cilag International v kombinácii s liekmi, ktoré predlžujú QT interval, napr. antiarytmiká triedy IA (napr. chinidín, disopyramid) a triedy III (napr. amiodarón, sotalol), niektoré antihistaminiká, niektoré iné antipsychotiká a niektoré antimalariká (napr. meflochín). Tento zoznam je informatívny a nie je úplný.
Možný účinok Paliperidónu Janssen-Cilag International na iné lieky
Nepredpokladá sa, že by mal paliperidón klinicky významné farmakokinetické interakcie s liekmi
metabolizovanými izoenzýmami cytochrómu P-450.
Vzhľadom na primárne účinky paliperidónu (pozri časť 4.8) na centrálny nervový systém (CNS) sa
Paliperidón Janssen-Cilag International má používať opatrne v kombinácii s inými liekmi
s centrálnym účinkom, napr. anxiolytikami, s väčšinou antipsychotík, hypnotikami, opiátmi atď. alebo s alkoholom.
Paliperidón môže antagonizovať účinok levodopy a iných dopamínových agonistov. Ak je táto kombinácia potrebná, najmä u pacientov s Parkinsonovou chorobou v terminálnom štádiu, je nutné predpísať najnižšiu účinnú dávku oboch liekov.
Vzhľadom na možnosť vyvolania ortostatickej hypotenzie (pozri časť 4.4), pri podávaní Paliperidónu Janssen-Cilag International s inými látkami s takýmto potenciálom, napr. iné antipsychotiká, tricykliká, môže vzniknúť aditívny účinok.
Odporúča sa zvýšená opatrnosť, ak sa paliperidón užíva v kombinácii s inými liekmi, ktoré môžu znižovať prah pre vznik kŕčov (t.j. fenotiazíny alebo butyrofenóny, tricykliká alebo SSRI, tramadol, meflochín atď.).
Súbežné podávanie perorálnych tabliet paliperidónu s predĺženým uvoľňovaním pri rovnovážnom stave (12 mg jedenkrát denne) a tabliet divalproexu sodného s predĺženým uvoľňovaním (500 mg až
2 000 mg jedenkrát denne) neovplyvnilo farmakokinetiku valproátu v rovnovážnom stave.
Neuskutočnili sa žiadne štúdie zamerané na interakciu medzi Paliperidónom Janssen-Cilag
International a lítiom, farmakokinetická interakcia je však nepravdepodobná.
Možný účinok iných liekov na Paliperidón Janssen-Cilag International
V štúdiách in vitro sa zistilo, že izoenzýmy CYP2D6 a CYP3A4 majú minimálny význam
v metabolizme paliperidónu, avšak v štúdiách in vitro a in vivo sa nezistilo, že by tieto izoenzýmy mali významnú úlohu v metabolizme paliperidónu. Pri súbežnom podávaní perorálneho paliperidónu
s paroxetínom, silným inhibítorom izoenzýmu CYP2D6, sa nepozorovali žiadne klinicky významné účinky na farmakokinetiku paliperidónu.
Súbežné podávanie perorálneho paliperidónu s predĺženým uvoľňovaním jedenkrát denne
s karbamazepínom 200 mg dvakrát denne spôsobilo pokles Cmax a AUC paliperidónu v priemernom rovnovážnom stave približne o 37 %. Tento pokles je v značnej miere spôsobený 35 % zvýšením
renálneho klírensu paliperidónu pravdepodobne v dôsledku indukcie renálneho P-gp karbamazepínom. Menší pokles v množstve nezmeneného liečiva vylúčeného močom naznačuje, že počas súbežného
podávania spolu s karbamazepínom bol menší vplyv na metabolizmus CYP alebo na biologickú dostupnosť paliperidónu. Väčší pokles plazmatickej koncentrácie paliperidónu sa môže vyskytnúť po
vyšších dávkach karbamazepínu. Pri začatí liečby karbamazepínom treba prehodnotiť dávku Paliperidónu Janssen-Cilag International a v prípade potreby ju zvýšiť. Naopak, pri ukončení liečby karbamazepínom treba prehodnotiť dávku Paliperidónu Janssen-Cilag International a v prípade
potreby ju znížiť.
Súbežné podávanie perorálnej tablety paliperidónu s predĺženým uvoľňovaním 12 mg v jednej dávke a tabliet divalproexu sodného s predĺženým uvoľňovaním (dve tablety 500 mg jedenkrát denne) malo za následok približne 50% zvýšenie Cmax a AUC paliperidónu, pravdepodobne následkom zvýšenej perorálnej absorpcie. Keďže sa nepozoroval žiadny účinok na systémový klírens, nemala by sa očakávať žiadna klinicky signifikantná interakcia medzi tabletami divalproexu sodného s predĺženým uvoľňovaním a intramuskulárnou injekciou Paliperidónu Janssen-Cilag International. Táto interakcia nebola študovaná pri Paliperidóne Janssen-Cilag International.'
Súbežné užívanie Paliperidónu Janssen-Cilag International s risperidónom alebo perorálnympaliperidónom
Vzhľadom na to, že paliperidón je hlavným aktívnym metabolitom risperidónu, vyžaduje sa opatrnosť,
keď sa Paliperidón Janssen-Cilag International podáva súbežne s risperidónom alebo s perorálnym paliperidónom počas dlhšieho obdobia. Údaje o bezpečnosti týkajúce sa súbežného podávania Paliperidónu Janssen-Cilag International s inými antipsychotikami sú obmedzené.
Súbežné použitie Paliperidónu Janssen-Cilag International so psychostimulanciami
Kombinované užívanie psychostimulancií (napr. metylfenidát) s paliperidónom môže viesť
k extrapyramídovým príznakom po zmene jednej alebo oboch liečob (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné údaje o použití paliperidónu počas gravidity. V štúdiách na zvieratách
nemal intramuskulárne podaný paliperidón palmitát ani perorálne podaný paliperidón žiadne teratogénne účinky, avšak pozorovali sa iné formy reprodukčnej toxicity (pozri časť
5.3).U novorodencov, ktorí boli vystavení počas tretieho trimestra gravidity paliperidónu, existuje
riziko vzniku nežiaducich reakcií zahŕňajúcich extrapyramídové príznaky a/alebo príznaky
z vysadenia lieku, ktoré sa môžu líšiť v závažnosti a trvaní po pôrode. Boli hlásené agitácia, hypertónia, hypotónia, tremor, somnolencia, respiračná tieseň alebo ťažkosti pri kŕmení. Preto majú byť novorodenci starostlivo sledovaní. Paliperidón Janssen-Cilag International sa nesmie užívať počas gravidity, pokiaľ to nie je nevyhnutné.
D
ojčenie
Paliperidón sa vylučuje do materského mlieka v množstve, ktoré by pravdepodobne ovplyvnilo
dojčené dieťa, ak by jeho matka dostávala terapeutické dávky tohto lieku. Paliperidón Janssen-Cilag
International sa nesmie používať počas laktácie.
FertilitaV predklinických štúdiách sa nepozorovali žiadne relevantné účinky.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojePaliperidón môže mať malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje kvôli potenciálnemu vplyvu na nervový systém a zrak, ako napr. sedácia, somnolencia, synkopa, rozmazané videnie (pozri časť 4.8). Z tohto dôvodu je potrebné pacientov poučiť, aby neviedli vozidlá ani neobsluhovali stroje, kým nebude známe, ako reagujú na Paliperidón Janssen-Cilag International.
4.8 Nežiaduce účinkySúhrn bezpečnostného profiluNežiaduce reakcie na liek uvádzané v klinických štúdiách boli insomnia, bolesť hlavy, úzkosť,
infekcia horných dýchacích ciest, reakcia v mieste podania injekcie, parkinsonizmus, zvýšenie hmotnosti, akatízia, agitovanosť, útlm/somnolencia, nauzea, zápcha, točenie hlavy, muskuloskeletálna
bolesť, tachykardia, tremor, bolesť brucha, vracanie, diarea, únava a dystónia. Z uvedených sa zdajú
byť akatízia a útlm/somnolencia závislá od dávkovania.
Zoznam nežiaducich reakcií v tabuľkáchV nasledujúcej časti sú uvedené všetky nežiaduce reakcie na liek hlásené u paliperidónu podľa
kategórie frekvencie odhadnutej z klinických štúdií s paliperidón palmitátom. Výskyt nežiaducich reakcií sa uvádza nasledovne:
veľmi časté (≥ 1/10);
časté (≥ 1/100 až < 1/10);
menej časté(≥ 1/1 000 až < 1/100);
zriedkavé (≥ 1/10 000 až < 1/1 000);
veľmi zriedkavé (< 1/10 000) a
neznáme(z dostupných údajov).
Trieda orgánových systémov
| Nežiaduca reakcia na liek
|
Frekvencia
|
Veľmi časté
| Časté
| Menej časté
| Zriedkavé
| Neznáme
|
Infekcie a nákazy
|
| infekcia horných
dýchacích ciest, infekcia močových ciest, chrípka
| pneumónia,
bronchitída, infekcia dýchacej sústavy, sínusitída, cystitída, infekcia ucha, tonzilitída, onychomykóza,
celulitída
| infekcia oka,
akarodermatitída, podkožný absces
|
|
Poruchy krvi
a lymfatického systému
|
|
| znížený počet
leukocytov, trombocytopénia, anémia
| neutropénia,
zvýšený počet eozinofilov
| agranulo-
cytóza
|
Poruchy imunitného systému
|
|
| hypersenzitivita
|
| anafylak-
tická reakcia
|
Poruchy endokrinného systému
|
|
hyperprolaktinémiab
|
|
neprimerané
vylučovanie antidiuretického hormónu, prítomnosť glukózy v moči
|
|
Poruchy metabolizmu a výživy
|
|
hyperglykémia,
zvýšená telesná hmotnosť, znížená telesná hmotnosť, znížená chuť do jedla
|
diabetes mellitusd,
hyperinzulinémia, zvýšená chuť do jedla, anorexia, zvýšená hladina triglyceridov v krvi, zvýšená hladina
cholesterolu v krvi
|
diabetická
ketoacidóza, hypoglykémia, polydipsia
|
intoxikácia
vodou
|
Psychické poruchy
|
nespavosťe
|
agitácia, depresia,
úzkosť
|
porucha spánku,
mánia, pokles libida, nervozita, nočné mory
|
katatónia, stav
zmätenosti, somnambuliz- mus, citová otupenosť, anorgazmia
|
porucha
príjmu potravy súvisiaca so spánkom
|
Poruchy
nervového systému
|
|
parkinsonizmusc,
akatíziac, útlm/somnolencia, dystóniac, točenie hlavy, dyskinézac, tremor, bolesti hlavy
|
tardívna dyskinéza,
synkopa, psychomotorická hyperaktivita, posturálne závraty, porucha pozornosti, dyzartria,
dysgeúzia, hypoestézia, parestézia
|
neuroleptický
malígny syndróm, cerebrálna ischémia, nereagovanie na stimuly, strata vedomia, znížená hladina vedomia, kŕče, porucha rovnováhy, abnormálna koordinácia
|
diabetická
kóma, titubácia hlavy
|
Poruchy oka
|
|
|
rozmazané videnie,
konjunktivitída, suché oko
|
glaukóm,
porucha hybnosti oka, prevracanie očí, fotofóbia, zvýšené slzenie, okulárna hyperémia
|
syndróm
vlajúcej dúhovky (perope- račný)
|
Poruchy ucha a labyrintu
|
|
|
závrat, tinnitus,
bolesť ucha
|
|
|
Poruchy srdca a srdcovej činnosti
|
|
tachykardia
|
artrioventrikulárna
blokáda, porucha vedenia, predĺžený QT interval na elektrokardiograme, syndróm posturálnej ortostatickej tachykardie, bradykardia, abnormálny elektrokardiogram, palpitácie
|
atriálna
fibrilácia, sínusová arytmia
|
|
Poruchy ciev
|
|
hypertenzia
|
hypotenzia,
ortostatická hypotenzia
|
venózna
trombóza, začervenanie
|
pľúcna
embólia, ischémia
|
Poruchy dýchacej sústavy,
hrudníka a
m
e
diastína
|
|
kašeľ, upchanie nosa
|
dyspnoe, kongescia
dýchacieho traktu, sipot, faryngolaryngeálna bolesť, epistaxa
|
syndróm
spánkového apnoe, pľúcna kongescia, šelest
|
hyperventi
-lácia, aspiračná pneumónia dysfónia
|
Poruchy gastro- intestinálneho traktu
|
|
abdominálna bolesť,
vracanie, nauzea, zápcha, diarea, dyspepsia, bolesť zubov
|
abdominálny
diskomfort, gastroenteritída, dysfágia, sucho
v ústach, flatulencia
|
pankreatitída,
opuchnutý jazyk, inkontinencia stolice, fekalóm, cheilitída
|
črevná
obštrukcia, ileus
|
Poruchy pečene
a žlčových ciest
|
|
zvýšená hladina
transamináz
|
zvýšená hladina
gama- glutamyltransferázy, zvýšená hladina hepatálnych enzýmov
|
|
žltačka
|
Poruchy kože a podkožného tkaniva
|
|
|
žihľavka, pruritus,
vyrážka, alopécia, ekzém, suchá koža, erytém, akné
|
lieková vyrážka,
hyperkeratóza, lupiny
|
angioedém
sfarbenie kože, seboroická dermatitída
|
Poruchy kostrovej a svalovej sústavy a
spojivového
tkaniva
|
|
muskuloskeletálna
bolesť, bolesť chrbta, artralgia
|
zvýšená hladina
kreatín fosfokinázy
v krvi, svalové kŕče, stuhnutosť kĺbov, svalová slabosť, bolesť krku
|
rabdomyolýza,
opuch kĺbov
|
abnormál-
ny postoj
|
Poruchy obličiek
a močových ciest
|
|
|
inkontinencia moču,
polakizúria, dyzúria
|
zadržiavanie
moču
|
|
Stavy
v gravidite,
v šestonedelí
a perinatálnom období
|
|
|
|
|
novorode-
necký syndróm
z vysade- nia (pozri časť 4.6)
|
Poruchy reprodukčného systému a
prsníkov
|
|
amenorea,
galaktorea
|
erektilná
dysfunkcia, porucha ejakulácie, porucha menštruáciee, gynekomastia, sexuálna
dysfunkcia, bolesť prsníkov
|
ťažkosti
s prsníkmi, naliatie prsníkov, zväčšenie prsníkov, vaginálny výtok
|
priapizmus
|
Celkové poruchy a reakcie
v mieste podania
|
|
pyrexia, asténia,
únava, reakcia
v mieste vpichu
|
edém tváre, edéme,
zvýšená telesná teplota, neprirodzená chôdza, bolesť na
hrudi, nepohodlie na hrudi, nevoľnosť, indurácia
|
hypotermia,
triaška, smäd, syndróm
z vysadenia, absces v mieste podania injekcie, celulitída
v mieste podania injekcie, cysta
v mieste podania injekcie, hematóm
v mieste podania injekcie
|
znížená
telesná teplota, nekróza v mieste podania injekcie, vred
v mieste podania injekcie
|
Úrazy
, otravy a komplikácie liečebného postupu
|
|
|
pád
|
|
|

a Frekvencia týchto nežiaducich reakcií je klasifikovaná ako „neznáma“, pretože neboli pozorované v klinických štúdiách s paliperidón palmitátom. Boli odvodené buď zo spontánnych postmarketingových hlásení a frekvencia nemôže byť stanovená, alebo boli odvodené z údajov z klinických štúdií s risperidónom (ktorákoľvek lieková forma) alebo perorálnym paliperidónom a/alebo postmarketingových hlásení.
b Pozri nižšie časť „Hyperprolaktinémia“.
c Pozri nižšie časť „Extrapyramídové príznaky“.
d V placebom kontrolovaných klinických štúdiách bol u 0,32 % pacientov liečených Paliperidónom Janssen-Cilag International hlásený diabetes mellitus v porovnaní s 0,39 % v skupine s placebom. Celková incidencia zo všetkých klinických štúdií bola 0,65 % zo všetkých pacientov liečených paliperidón palmitátom.
e
Insomnia zahŕňa: počiatočnú insomniu, insomniu strednej fázy ;
Kŕče zahŕňajú: záchvaty typu grand mal;
Edém zahŕňa: generalizovaný edém, periférny edém, jamkovitý edém.
Porucha menštruácie zahŕňa: nepravidelnú
menštruáciu, oligomenoreu
Nežiaduce účinky zaznamenané s liekovými formami risperidónuPaliperidón je aktívnym metabolitom risperidónu, preto sú profily nežiaducich reakcií týchto liečiv
(vrátane perorálnych a injekčných liekových foriem) navzájom relevantné.
Opis vybraných nežiaducich reakciíAnafylaktická reakciaPočas postmarketingového používania boli u pacientov, ktorí predtým tolerovali perorálny risperidón alebo perorálny paliperidón, zriedkavo hlásené prípady anafylaktickej reakcie po podaní injekcie lieku
Paliperidón Janssen-Cilag International (pozri časť 4.4).
Reakcie v mieste podania injekcieNajčastejšie hlásenou nežiaducou reakciou spojenou s miestom podania injekcie bola bolesť. Väčšina týchto reakcií bola uvedená ako mierne až stredne závažná. Hodnotenia pacientov ohľadom bolesti
v mieste podania injekcie na základe vizuálnej analógovej škály mali tendenciu časom klesať, čo sa
týka frekvencie aj intenzity v štúdiách s Paliperidónom Janssen-Cilag International fázy 2 a 3. Injekcie do deltového svalu boli pociťované ako mierne bolestivejšie v porovnaní s odpovedajúcimi injekciami
do sedacieho svalu. Ostatné reakcie v mieste podania injekcie boli väčšinou mierne a zahŕňali
zatvrdnutie (časté), pruritus (menej časté) a uzlíky (zriedkavé).
Extrapyramídové príznaky (EPS)EPS predstavuje zlúčenú analýzu nasledujúcich výrazov: parkinsonizmus (zahŕňa hypersekréciu slín, muskuloskeletálnu stuhnutosť, parkinsonizmus, slintanie, rigiditu (fenomén ozubeného kolesa), bradykinézu, hypokinézu, maskovitú tvár, svalovú stuhnutosť, akinézu, rigiditu šije, svalovú rigiditu, parkinsonickú chôdzu, abnormálny glabelárny reflex a parkinsonický kľudový tremor), akatízia (vrátane akatízie, nepokoja, hyperkinézy a syndrómu nepokojných nôh), dyskinéza (dyskinéza, svalové zášklby, choreoatetóza, atetóza a myoklonus), dystónia (vrátane dystónie, hypertónie, tortikolis, mimovoľných svalových kontrakcií, skrátenia svalov, blefarospazmu, okulogyrácie, paralýzy jazyka, kŕča tváre, laryngospazmu, myotónie, opistotonu, orofaryngeálneho kŕča, pleurototonu, kŕča jazyka a trizmu) a tremor. Treba poznamenať, že je zahrnuté širšie spektrum príznakov, ktoré nemusia mať nevyhnutne extrapyramídový pôvod.
Zvýšenie telesnej hmotnostiV 13-týždňovej štúdii zahŕňajúcej začiatočné dávkovanie 150 mg, vykazovala časť pacientov
s abnormálnym zvýšením telesnej hmotnosti o ≥ 7 % spojitosť s výškou dávky, s 5 % výskytom
v skupine užívajúcej placebo v porovnaní so 6 %, 8 % a 13 % výskytom v príslušných skupinách užívajúcich 25 mg, 100 mg a 150 mg Paliperidónu Janssen-Cilag International.
Počas 33-týždňovej otvorenej prechodnej/udržiavacej periódy dlhodobej klinickej štúdie zameranej na prevenciu recidívy spĺňalo toto kritérium 12 % pacientov liečených Paliperidónom Janssen-Cilag International (zvýšenie telesnej hmotnosti o ³ 7 % od dvojito zaslepenej fázy až po ukončenie); priemerná zmena telesnej hmotnosti (SD) oproti základnej hodnote v otvorenej fáze bola + 0,7
(4,79) kg.
Hyperprolaktinémia
V klinických skúškach sa pozoroval stredný nárast sérovej hladiny prolaktínu u pacientov oboch pohlaví liečených Paliperidónom Janssen-Cilag International. Nežiaduce reakcie, ktoré by mohli poukazovať na nárast sérových hladín prolaktínu (napr. amenorea, galaktorea, menštruačné poruchy, gynekomastia), boli zaznamenané celkovo u < 1 % pacientov.
Účinky tejto triedy liekovPri užívaní antipsychotík sa môže vyskytnúť predĺženie QT intervalu, ventrikulárne arytmie
(ventrikulárna fibrilácia, ventrikulárna tachykardia), náhla nevysvetlená smrť, zastavenie srdcovej činnosti a Torsade de pointes.
Pri užívaní antipsychotík boli s neznámou frekvenciou hlásené prípady venózneho tromboembolizmu vrátane prípadov pľúcnej embólie a prípadov hlbokej žilovej trombózy.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePríznakyVo všeobecnosti sa predávkovanie pravdepodobne prejaví prejavmi a príznakmi, ktoré sú
vystupňovaním známych farmakologických účinkov paliperidónu, t.j. ospanlivosť a sedácia, tachykardia a hypotenzia, predĺženie QT intervalu a extrapyramídové príznaky. Torsade de pointes a
ventrikulárna fibrilácia boli hlásené v súvislosti s predávkovaním pacienta perorálnym paliperidónom.
Pri akútnom predávkovaní je potrebné zvážiť možnosť predávkovania viacerými liekmi súčasne.
LiečbaPri hodnotení potreby liečby a rekonvalescencie je potrebné zvážiť charakter liekovej formy
s predĺženým uvoľňovaním a dlhý polčas eliminácie paliperidónu. K dispozícii nie je žiadne špecifické antidotum pre paliperidón. Je potrebné použiť všeobecné podporné opatrenia. Zabezpečiť a udržať
voľné dýchacie cesty a zaistiť dostatočnú oxygenáciu a ventiláciu.
Okamžite je potrebné začať monitorovanie kardiovaskulárnych parametrov, vrátane kontinuálneho monitorovania EKG, vzhľadom na možné poruchy srdcového rytmu. Hypotenziu a zlyhanie obehu je potrebné liečiť vhodnými postupmi, vrátane intravenózneho podania tekutín a/alebo aplikácie sympatomimetík. V prípade závažných extrapyramídových príznakov sa majú podať anticholínergické látky. Pacienta je potrebné pozorne sledovať a monitorovať až do jeho zotavenia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Psycholeptiká, iné antipsychotiká, ATC kód: N05AX13
Paliperidón Janssen-Cilag International obsahuje racemickú zmes (+)- a (-)-paliperidónu.
Mechanizmus účinkuPaliperidón je selektívny blokátor monoamínových účinkov, ktorého farmakologické vlastnosti sa líšia
od tradičných neuroleptík. Paliperidón sa pevne viaže na serotonínové 5-HT2 receptory a na
dopamínergické D2 receptory. Paliperidón tiež blokuje alfa 1-adrenergické receptory a v menšom rozsahu aj histamínové H1 receptory a alfa 2-adrenergické receptory. Farmakologická aktivita enantiomérov (+)- a (-)-paliperidónu je kvalitatívne a kvantitatívne podobná.
Paliperidón sa neviaže na cholínergické receptory. Aj napriek tomu, že paliperidón je silným antagonistom D2-receptorov, ktorý dokázateľne zmierňuje pozitívne príznaky schizofrénie, vyvoláva menej výraznú katalepsiu a znižuje motorické funkcie v menšom rozsahu ako tradičné neuroleptiká. Dominujúci centrálny sérotonínergický antagonizmus môže znižovať tendenciu paliperidónu vyvolávať extrapyramídové vedľajšie účinky.
Klinická účinnosťAkútna liečba schizofrénieÚčinnosť Paliperidónu Janssen-Cilag International pri akútnej liečbe schizofrénie bola stanovená pomocou štyroch krátkodobých (jedna 9-týždňová a tri 13-týždňové) dvojito zaslepených, randomizovaných, placebom kontrolovaných štúdií s fixným dávkovaním na dospelých hospitalizovaných pacientoch s akútnym relapsom, ktorí spĺňali kritériá DSM-IV pre schizofréniu. Fixné dávky Paliperidónu Janssen-Cilag International v týchto štúdiách sa podávali 1., 8. a 36. deň pri
9-týždňovej štúdii a dodatočne ešte 64. deň pri 13-týždňových štúdiách. Počas akútnej liečby schizofrénie Paliperidónom Janssen-Cilag International neboli potrebné žiadne ďalšie prídavné perorálne antipsychotiká. Primárny cieľ účinnosti bol definovaný ako pokles celkového skóre na PANSS škále (z angl. Positive and Negative Syndrome Scale), ako je to zobrazené v nasledujúcej tabuľke. PANSS je validovaná viacpoložková škála skladajúca sa z piatich faktorov na hodnotenie pozitívnych príznakov, negatívnych príznakov, dezorganizovaného myslenia, nekontrolovanej hostility/podráždenosti a úzkosti/depresie. Fungovanie sa hodnotilo pomocou stupnice Osobnej a sociálnej výkonnosti (PSP, z angl. Personal and Social Performance scale). PSP je validovaná, lekárom hodnotená škála, ktorá meria osobné a sociálne fungovanie v štyroch hlavných oblastiach:
sociálne prospešné aktivity (práca a štúdium), osobné a sociálne vzťahy, starostlivosť o seba a rušivé a agresívne správanie.
V 13-týždňovej štúdii (n = 636) porovnávajúcej tri fixné dávky Paliperidónu Janssen-Cilag International (začiatočná injekcia 150 mg do deltového svalu, následne 3 dávky do sedacieho alebo deltového svalu buď 25 mg/4 týždne, 100 mg/4 týždne alebo 150 mg/4 týždne) s placebom sa pri všetkých troch dávkach preukázalo významné zlepšenie celkového skóre PANSS v porovnaní
s placebom. V tejto štúdii vykazovali v skóre PSP obe terapeutické skupiny s dávkou 100 mg/4 týždne a 150 mg/4 týždne, okrem dávky 25 mg/4 týždne, štatistickú prevahu oproti placebu. Tieto výsledky
podporujú pretrvávanie účinnosti počas celého trvania liečby a zlepšenie v PANSS bolo pozorované
už 4. dni, s významným oddelením Paliperidónu Janssen-Cilag International od placeba v skupinách s
Paliperidónom Janssen-Cilag International podávaným v dávkach 25 mg a 150 mg do 8. dňa.
Výsledky ďalších štúdií priniesli štatisticky významné výsledky v prospech Paliperidónu Janssen- Cilag International, okrem dávky 50 mg v jednej zo štúdií (pozri nasledujúcu tabuľku).
Celkové skóre PANSS – Zmena od východiskovej po koncovú hodnotu – LOCF pre štúdie R092670-
SCH-201, R092670-PSY-3003, R092670-PSY-3004 a R092670-PSY-3007: Súbor analýzy primárnej účinnosti
|
| Placebo
| 25 mg
| 50 mg
| 100 mg
| 150 mg
|
R092670-PSY-3007*
Priemerná východisková hodnota (SD)
Priemerná zmena (SD)
P-hodnota (vs. placebo)
| n = 160
86,8 (10,31)
-2,9 (19,26)
--
| n = 155
86,9 (11,99)
-8,0 (19,90)
0,034
|
--
| n = 161
86,2 (10,77)
-11,6 (17,63)
< 0,001
| n = 160
88,4 (11,70)
-13,2 (18,48)
< 0,001
|
R092670-PSY-3003
Priemerná východisková
hodnota (SD)
Priemerná zmena (SD) P-hodnota (vs. placebo)
|
n = 132
92,4 (12,55)
-4,1 (21,01)
--
|
--
|
n = 93
89,9 (10,78)
-7,9 (18,71)
0,193
|
n = 94
90,1 (11,66)
-11,0 (19,06)
0,019
|
n = 30
92,2 (11,72)
-5,5 (19,78)
--
|
R092670-PSY-3004
Priemerná východisková hodnota (SD)
Priemerná zmena (SD) P-hodnota (vs. placebo)
|
n = 125
90,7 (12,22)
-7,0 (20,07)
--
|
n = 129
90,7 (12,25)
-13,6 (21,45)
0,015
|
n = 128
91,2 (12,02)
-13,2 (20,14)
0,017
|
n = 131
90,8 (11,70)
-16,1 (20,36)
< 0,001
|
--
|
R092670-SCH-201
Priemerná východisková
hodnota (SD)
Priemerná zmena (SD) P-hodnota (vs. placebo)
|
n = 66
87,8 (13,90)
6,2 (18,25)
--
|
--
|
n = 63
88,0 (12,39)
-5,2 (21,52)
0,001
|
n = 68
85,2 (11,09)
-7,8 (19,40)
< 0,0001
|
--
|
* Pri štúdii R092670-PSY-3007 bola začiatočná dávka 150 mg podaná všetkým pacientom v terapeutických skupinách s Paliperidónom Janssen-Cilag International 1. deň a následne im bola podávaná pridelená dávka.
Poznámka: Negatívna zmena v skóre označuje zlepšenie.
Udržiavanie kontroly príznakov a oddialenie recidívy schizofrénieÚčinnosť Paliperidónu Janssen-Cilag International pri udržaní symptomatickej kontroly a oddialení relapsu schizofrénie bola stanovená v dlhodobej, dvojito zaslepenej, placebom kontrolovanej štúdii s
flexibilným dávkovaním, ktorej sa zúčastnilo 849 mladších dospelých pacientov spĺňajúcich kritériá
DSM-IV pre schizofréniu. Táto štúdia zahŕňala 33-týždňovú otvorenú fázu akútnej liečby a stabilizácie, randomizovanú, dvojito zaslepenú, placebom kontrolovanú fázu na sledovanie relapsu a
52-týždňovú otvorenú pokračovaciu periódu. V tejto štúdii boli dávky Paliperidónu Janssen-Cilag
International 25 mg, 50 mg, 75 mg a 100 mg podávané v mesačných intervaloch; dávka 75 mg bola povolená len počas 52-týždňovej otvorenej pokračovacej periódy. Pacienti spočiatku dostávali flexibilné dávky Paliperidónu Janssen-Cilag International (25 mg-100 mg) počas 9-týždňového prechodného obdobia, potom nasledovalo 24-týždňové udržiavacie obdobie, kedy museli pacienti dosahovať požadované skóre PANSS ≤ 75. Úpravy dávkovania boli povolené len počas prvých
12 týždňov udržiavacieho obdobia. Celkovo 410 stabilizovaných pacientov bolo randomizovaných do skupiny s Paliperidónom Janssen-Cilag International (medián trvania 171 dní [rozsah 1 až 407 dní]) alebo do skupiny s placebom (medián trvania 105 dní [rozsah 8 až 441 dní]), až kým sa u nich nevyskytol relaps príznakov schizofrénie v dvojito zaslepenej fáze rôzneho trvania. Klinická štúdia bola zastavená v skorom období z dôvodov spojených s účinnosťou, keďže sa u pacientov liečených Paliperidónom Janssen-Cilag International pozorovala oveľa dlhšia doba do relapsu (p < 0,0001, obr.
1) v porovnaní s pacientmi užívajúcimi placebo (pomer rizík = 4,32; 95 % CI: 2,4-7,7).
 Obrázok 1:
Obrázok 1: Kaplan-Meierova krivka doby do relapsu – predbežná analýza (súbor predbežných analýz
„Intent-to-Treat“ (so zámerom liečby))
Pediatrická populáciaEurópska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom
Paliperidón Janssen-Cilag International vo všetkých podskupinách pediatrickej populácie pre liečbu schizofrénie (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAbsorpcia a distribúciaPaliperidón palmitát je proliečivo paliperidónu vo forme esteru kyseliny palmitovej. Z dôvodu
extrémne nízkej rozpustnosti vo vode sa paliperidón palmitát po intramuskulárnom podaní pomaly rozpúšťa a následne hydrolyzuje na paliperidón a absorbuje do systémového obehu. Po jednej intramuskulárnej dávke sa plazmatické koncentrácie paliperidónu postupne zvýšia až dosiahnu maximálne plazmatické koncentrácie pri mediáne Tmax 13 dní. Liečivo sa začína uvoľňovať hneď 1. deň a trvá to minimálne 4 mesiace.
Po intramuskulárnom podaní jednej dávky (25 mg-150 mg) do deltového svalu sa pozorovala v priemere o 28 % vyššia hodnota Cmax ako pri podaní do sedacieho svalu. Dve začiatočné intramuskulárne injekcie do deltového svalu, jedna v dávke 150 mg 1. deň a druhá v dávke 100 mg
8. deň, napomáhajú rýchlemu dosiahnutiu terapeutických koncentrácií. Profil uvoľňovania a režim dávkovania Paliperidónu Janssen-Cilag International vedú k udržaniu terapeutických koncentrácií.
Celková expozícia paliperidónu po podaní Paliperidónu Janssen-Cilag International bola úmerná
dávkam v celom dávkovacom rozsahu 25 mg-150 mg a menej ako úmerná dávkam pre hodnotu Cmax pri dávkach vyšších ako 50 mg. Priemerný pomer maximálnych a minimálnych koncentrácií (peak:trough ratio) v rovnovážnom stave pri dávke 100 mg Paliperidónu Janssen-Cilag International bol po podaní do sedacieho svalu 1,8 a po podaní do deltového stavu 2,2. Priemerný zdanlivý biologický polčas paliperidónu po podaní Paliperidónu Janssen-Cilag International v rozsahu dávok od
25 mg-150 mg bol v rozpätí 25-49 dní.
Absolútna biologická dostupnosť paliperidón palmitátu po podaní Paliperidónu Janssen-Cilag
International je 100 %.
Po podaní paliperidón palmitátu sa (+) a (-) enantioméry paliperidónu vzájomne vymenia a dosiahnu pomer AUC (+) k (-) približne 1,6-1,8.
Väzba racemického paliperidónu na plazmatické bielkoviny je 74 %. Biotransformácia a eliminácia
Jeden týždeň po podaní jednorazovej perorálnej dávky 1 mg 14C-paliperidónu (forma s okamžitým
uvoľňovaním účinnej látky) sa 59 % z dávky vylúčilo v nezmenenej forme do moču, čo odráža menej významný metabolizmus paliperidónu pečeňou. Približne 80 % z podanej rádioaktivity sa zachytilo
v moči a 11 % v stolici. In vivo boli identifikované štyri metabolické dráhy, pričom žiadna z nich nepredstavovala viac ako 6,5 % z podanej dávky: dealkylácia, hydroxylácia, dehydrogenácia a
benzisoxazolové štiepenie. Aj napriek tomu, že sa v štúdiách in vitro predpokladal význam izoenzýmov CYP2D6 a CYP3A4 pri metabolizme paliperidónu, v štúdiách in vivo sa nepotvrdilo, že by tieto izoenzýmy mali významnú úlohu. V analýzach populačnej farmakokinetiky sa nezistili
výraznejšie rozdiely eliminácie paliperidónu po podaní perorálneho paliperidónu osobám s rýchlym metabolizmom, resp. s pomalým metabolizmom substrátov izoenzýmu CYP2D6. V štúdiách in vitro
zameraných na mikrozómy ľudskej pečene sa ukázalo, že paliperidón významnejšie neinhibuje metabolizmus liekov, ktoré sú metabolizované izoenzýmami cytochrómu P450, vrátane CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 a CYP3A5.
V štúdiách in vitro sa ukázalo, že paliperidón je pri vysokých koncentráciách P-gp substrátom a slabým inhibítorom P-gp. Nie sú dostupné žiadne in vivo údaje a klinický význam nie je známy.
Injekcia paliperidón palmitátu s dlhotrvajúcim účinkom verzus perorálny paliperidón s predĺženýmuvoľňovaním
Paliperidón Janssen-Cilag International je určený na podávanie paliperidónu v mesačných intervaloch,
zatiaľ čo perorálny paliperidón s predĺženým uvoľňovaním sa podáva každý deň. Začiatočný režim pre
Paliperidón Janssen-Cilag International (150 mg/100 mg do deltového svalu 1. deň/8. deň) bol navrhnutý za účelom rýchleho dosiahnutia rovnovážneho stavu koncentrácií paliperidónu pri začatí terapie bez použitia perorálnej suplementácie.
Vo všeobecnosti boli celkové začiatočné plazmatické hladiny pri Paliperidóne Janssen-Cilag International v rámci expozičného rozsahu, ktorý bol pozorovaný pri dávkach 6-12 mg perorálneho paliperidónu s predĺženým uvoľňovaním. Používanie tohto režimu pri začatí užívania Paliperidónu Janssen-Cilag International umožnilo pacientom zostať v expozičnom okne 6-12 mg perorálneho paliperidónu s predĺženým uvoľňovaním, dokonca aj počas dní pred dávkou s minimami plazmatických hladín (8. a 36. deň). Z dôvodu rozdielnych stredných farmakokinetických profilov medzi týmito dvoma liekmi by sa malo postupovať opatrni pri priamom porovnávaní ich farmakokinetických vlastností.
Porucha funkcie pečene
Paliperidón nie je rozsiahlejšie metabolizovaný v pečeni. Aj napriek tomu, že sa účinky Paliperidónu
Janssen-Cilag International neskúmali u ľudí s poruchou funkcie pečene, nevyžaduje sa žiadna úprava dávkovania u pacientov s miernou alebo stredne závažnou poruchou funkcie pečene. V štúdii
s perorálnym paliperidónom zahŕňajúcej pacientov so stredne závažnou poruchou funkcie pečene
(Childova-Pughova trieda B) boli plazmatické koncentrácie voľného paliperidónu podobné ako u zdravých jedincov. K dispozícii nie sú žiadne údaje o pacientoch so závažnou poruchou funkcie
pečene.
Porucha funkcie obličiek
Vylučovanie jednej dávky 3 mg tablety perorálneho paliperidónu s predĺženým uvoľňovaním sa
sledovalo u pacientov s rôznymi stupňami poruchy funkcie obličiek. Eliminácia paliperidónu sa znižuje so znižujúcim sa predpokladaným klírensom kreatinínu. Celkový klírens paliperidónu
u pacientov s miernou poruchou funkcie obličiek (CrCl = 50 až < 80 ml/min.) bol priemerne nižší
o 32 %, u pacientov so stredne závažnou poruchou funkcie obličiek (CrCl = 30 až < 50 ml/min.) bol nižší o 64 % a u osôb so závažnou poruchou funkcie obličiek (CrCl = 10 až < 30 ml/min.) bol nižší
o 71 %, čo zodpovedá priemernému 1,5-; 2,6- a 4,8-násobnému nárastu expozície (AUCinf) v danom poradí v porovnaní so zdravými jedincami. Na základe obmedzeného počtu pozorovaní s
Paliperidónom Janssen-Cilag International, u pacientov s miernou poruchou funkcie obličiek a farmakokinetických simulácií sa odporúča nižšia dávka (pozri časť 4.2).
Staršie osoby
Analýza populačnej farmakokinetiky neodhalila žiaden dôkaz rozdielov vo farmakokinetike spojených
s vekom.
Index telesnej hmotnosti (BMI)/telesná hmotnosť
Farmakokinetické štúdie s paliperidón palmitátom preukázali o niečo nižšie (10-20 %) plazmatické
koncentrácie paliperidónu u pacientov s nadváhou alebo obezitou v porovnaní s pacientmi s normálnou hmotnosťou (pozri časť 4.2).
Rasa
Analýza populačnej farmakokinetiky údajov zo štúdií s perorálnym paliperidónom neodhalila žiaden
dôkaz rozdielov spojených s rasou vo farmakokinetike paliperidónu po podaní Paliperidónu Janssen- Cilag International.
Pohlavie
Nepozorovali sa žiadne klinicky významné rozdiely medzi mužmi a ženami.
Fajčenie
V štúdiách in vitro zameraných na enzýmy ľudskej pečene sa zistilo, že paliperidón nie je substrátom
izoenzýmu CYP1A2. Z tohto dôvodu by fajčenie nemalo ovplyvňovať farmakokinetiku paliperidónu. Vplyv fajčenia na farmakokinetiku paliperidónu sa pri Paliperidóne Janssen-Cilag International neskúmal. V analýze populačnej farmakokinetiky na základe údajov zo štúdií s perorálnymi tabletami paliperidónu s predĺženým uvoľňovaním sa preukázala mierne znížená expozícia paliperidónu
u fajčiarov v porovnaní s nefajčiarmi. Je nepravdepodobné, že tento rozdiel je klinicky relevantný.
5.3 Predklinické údaje o bezpečnosti
V štúdiách skúmajúcich toxicitu po opakovanom intramuskulárnom podaní paliperidón palmitátu (1- mesačná lieková forma) a perorálnom podaní paliperidónu potkanom a psom sa pozorovali najmä farmakologické účinky, ako je sedácia a prolaktínové účinky na prsné žľazy a pohlavné orgány.
U zvierat liečených paliperidón palmitátom bolo možné pozorovať zápalovú reakciu v mieste intramuskulárneho podania. Príležitostne sa vytvoril absces.
V štúdiách s perorálnym risperidónom, ktorý sa z väčšej časti u potkanov a ľudí mení na paliperidón, skúmajúcich reprodukčnú toxicitu u potkanov, sa pozorovali nežiaduce účinky na pôrodnú hmotnosť a prežívanie mláďat. Nepozorovala sa žiadna embryonálna toxicita ani malformácie po intramuskulárnom podaní paliperidón palmitátu gravidným samiciam potkanov do maximálnej dávky (160 mg/kg/deň), čo zodpovedá 4,1-násobku expozičnej hladiny u ľudí pri maximálnej odporúčanej
dávke 150 mg. Po podaní iných antagonistov dopamínu gravidným samiciam zvierat sa zistili nežiaduce účinky na učenie a motorický vývin mláďat.
Paliperidón palmitát ani paliperidón neboli genotoxické. V štúdiách skúmajúcich karcinogénne účinky po perorálnom podaní risperidónu potkanom a myšiam sa pozoroval zvýšený výskyt adenómov hypofýzy (u myší), adenómov endokrinného pankreasu (u potkanov) a adenómov prsnej žľazy
(u oboch druhov laboratórnych zvierat). Možnosť karcinogénnych účinkov intramuskulárne podaného paliperidón palmitátu sa vyhodnocovala u potkanov. U samíc potkanov sa vyskytol štatisticky
významný nárast adenokarcinómov prsnej žľazy pri dávkach 10, 30 a 60 mg/kg/mesiac. U samcov potkanov sa vyskytol štatisticky významný nárast adenómov a karcinómov prsnej žľazy pri dávkach
30 a 60 mg/kg/mesiac, čo je 1,2- a 2,2-násobok expozičnej hladiny pri maximálnej dávke 150 mg odporúčanej u ľudí. Tieto nádory môžu súvisieť s dlhotrvajúcim antagonizmom dopamínových D2- receptorov a hypeprolaktinémiou. Význam týchto poznatkov o nádoroch u hlodavcov z hľadiska rizika
pre ľudí nie je známy.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Polysorbát 20
Polyetylénglykol 4000
Monohydrát kyseliny citrónovej
Bezvodý hydrogénfosforečnan disodný Monohydrát dihydrogénfosforečnanu sodného Hydroxid sodný (na úpravu pH)
Voda na injekcie
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 30 °C.
6.5 Druh obalu a obsah balenia
Naplnená injekčná striekačka (cyklický olefínový kopolymér) s piestovou zátkou, zarážkou a ochranným uzáverom (bromobutylová guma) s 1½-palcovou bezpečnostnou ihlou veľkosti 22 G (0,72 mm x 38,1 mm) a 1-palcovou bezpečnostnou ihlou veľkosti 23 G (0,64 mm x 25,4 mm).
Veľkosti balenia:
Balenie obsahuje 1 naplnenú injekčnú striekačku a 2 ihly.
Balenie na začatie liečby obsahuje:
Jedno balenie obsahuje 1 balenie Paliperidónu Janssen-Cilag International 150 mg a 1 jedno balenie
Paliperidónu Janssen-Cilag International 100 mg.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Janssen-Cilag International NV Turnhoutseweg 30
B-2340 Beerse
Belgicko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/20/1453/006
9. DÁTUM PRVEJ REGISTRÁCIE / PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUMM/RRRR
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.