
rebné prijať vhodné opatrenia. Zdravotníci by mali Buvidal podávať priamo pacientovi. Užívanie na domáce použitie alebo samo-podávanie lieku pacientmi nie je povolené. Akékoľvek pokusy o odstránenie depotu by sa mali počas liečby sledovať.
Vlastnosti predĺženého uvoľňovania
Vlastnosti predĺženého uvoľňovania lieku by sa mali brať do úvahy počas liečby, vrátane začatia
a ukončenia liečby. Hlavne pacienti s konkomitantnými liekmi a/alebo súbežnými komorbiditami
majú byť sledovaní, či nevykazujú prejavy a príznaky toxicity, predávkovania alebo abstinencie, ktoré
sú spôsobené zvýšenou alebo zníženou hladinou buprenorfínu.
Farmakokinetické vlastnosti, pozri časť 5.2, a ukončenie liečby, pozri časť 4.2.
Útlm dýchania
Popísaných bolo množstvo prípadov úmrtí v dôsledku útlmu dýchania u pacientov liečených
buprenorfínom, najmä ak sa podával v kombinácii s benzodiazepínmi (pozri časť 4.5) alebo ak sa buprenorfín nepoužíval tak, ako je predpísané. Úmrtia boli hlásené aj v súvislosti so súbežným použitím buprenorfínu s ďalšími látkami s tlmiacim účinkom na CNS, ako je alkohol, gabapentinoidy (ako je pregabalín a gabapentín) (pozri časť 4.5) alebo iné opioidy.
U pacientov s respiračnou nedostatočnosťou (napr. chronickou obštrukčnou chorobou pľúc, cor
pulmonale, zníženou respiračnou rezervou, hypoxiou, hyperkapniou, už existujúcim útlmom dýchania alebo kyfoskoliózou) sa musí buprenorfín používať opatrne.
Buprenorfín môže v prípade neúmyselného alebo úmyselného použitia spôsobiť vážny a potenciálne smrteľný útlm dýchania u detí a osôb bez závislosti na opioidoch.
Útlm CNS
Buprenorfín môže spôsobiť ospalosť, zvlášť pri užívaní spolu s alkoholom alebo s liekmi s tlmiacim
účinkom na centrálny nervový systém (ako sú benzodiazepíny, trankvilizéry, sedatíva, gabapentinoidy alebo hypnotiká) (pozri časti 4.5 a 4.7).
Závislosť
Buprenorfín je čiastočný agonista mí-opiátového receptora a chronické podávanie môže vyvolať
závislosť od opiátov.
Hepatitída a hepatické udalosti
Pred začatím liečby sa odporúča vykonať východiskové pečeňové testy a zdokumentovať stav
vírusovej hepatitídy. Pacientom, ktorí sú pozitívni na vírusovú hepatitídu, súbežne užívajú niektoré iné
lieky (pozri časť 4.5) a/alebo majú existujúce poškodenie funkcie pečene, hrozí vyššie riziko poškodenia pečene. Odporúča sa pravidelné sledovanie pečeňových funkcií.
V klinických skúšaniach aj v správach o nežiaducich účinkoch po uvedení liekov obsahujúcich buprenorfín na trh boli u pacientov závislých od opioidov hlásené prípady akútneho poškodenia pečene. Spektrum abnormalít siaha od prechodných asymptomatických zvýšení pečeňových transamináz až po prípady cytolytickej hepatitídy, zlyhania pečene, pečeňovej nekrózy, hepatorenálneho syndrómu, hepatálnej encefalopatie i úmrtia. V mnohých prípadoch môže zohrať príčinnú alebo pomocnú úlohu prítomnosť už existujúcich abnormalít v pečeňových enzýmoch, genetického ochorenia, infekcie vírusmi hepatitídy typu B alebo hepatitídy typu C, nadmerná konzumácia alkoholu, anorexia, súbežné užívanie iných potenciálne hepatotoxických liekov a pokračujúce injekčné užívanie drog. Tieto faktory sa musia vziať do úvahy pred predpísaním buprenorfínu a počas liečby. V prípade podozrenia na hepatickú udalosť sa vyžaduje ďalšie biologické a etiologické zhodnotenie. V závislosti od nálezov môže byť liečba Buvidalom prerušená. Môže byť potrebné monitorovanie presahujúce týždenné a mesačné obdobie liečby. Pokiaľ sa v liečbe pokračuje, je potrebné pozorne sledovať činnosť pečene.
Precipitácia opioidového abstinenčnéhosyndrómu
Pri začatí liečby buprenorfínom je dôležité uvedomiť si čiastočný agonistický profil buprenorfínu.
Buprenorfínové produkty spôsobili abstinenčné príznaky u pacientov závislých od opioidov, keď boli podávané predtým, ako ustúpia agonistické účinky vyplývajúce z nedávneho užívania alebo nesprávneho užívania opioidov. Aby sa zabránilo rýchlemu nástupu abstinenčných príznakov, musí sa vykonať indukcia, ak sú evidentné mierne až stredne závažné abstinenčné prejavy a príznaky (pozri časť 4.2).
Prerušenie liečby môže mať za následok abstinenčný syndróm, ktorý môže byť oneskorený v nástupe.
Porucha funkcie pečene
Buprenorfín je do značnej miery metabolizovaný v pečeni. Pacienti so stredne závažnou poruchou
funkcie pečene majú byť sledovaní z dôvodu možných prejavov a príznakov z vysadenia opioidov, toxicity alebo predávkovania, ktoré sú spôsobené zvýšenou hladinou buprenorfínu. Buprenorfín sa musí používať s opatrnosťou u pacientov so stredne závažnou poruchou funkcie pečene (pozri časti
4.2 a 5.2). Funkciu pečene je počas liečby potrebné pravidelne monitorovať. Použitie buprenorfínu je
kontraindikované u pacientov so závažnou poruchou funkcie pečene (pozri časť 4.3).
Porucha funkcie obličiek
U pacientov s poruchou funkcie obličiek sa akumulujú metabolity buprenorfínu. Dávkovanie s
opatrnosťou sa odporúča u pacientov so závažnou poruchou funkcie obličiek (klírens kreatinínu
< 30 ml/min), pozri časti 4.2 a 5.2.
Predĺženie intervalu QT
Pri súbežnom podávaní Buvidalu s inými liekmi, ktoré predlžujú interval QT, a u pacientov so
syndrómom dlhého intervalu QT alebo inými rizikovými faktormi predĺženia intervalu QT, je potrebná opatrnosť.
Akútna liečba bolesti
Na liečbu akútnej bolesti pri pokračujúcom užívaní Buvidalu môže byť potrebná kombinácia užívania
opioidov s vysokou afinitou na receptory mí-opioidov (napríklad fentanyl), neopioidných analgetík a regionálnej anestézie. Titrácia perorálneho alebo intravenózneho krátkodobo pôsobiaceho opioidného lieku proti bolesti (morfín s okamžitým uvoľňovaním, oxykodón alebo fentanyl) na požadovaný analgetický účinok u pacientov liečených Buvidalom môže vyžadovať vyššie dávky. Pacienti majú byť počas liečby sledovaní.
Použitie u detí a dospievajúcich
Bezpečnosť a účinnosť buprenorfínu u detí vo veku do 16 rokov neboli stanovené (pozri časť 4.2).
Vzhľadom na obmedzené údaje u dospievajúcich (vo veku 16 alebo 17 rokov) musia byť pacienti v tejto vekovej kategórii počas liečby pozorne sledovaní.
Účinky triedy
Opioidy môžu spôsobiť ortostatickú hypotenziu.
Opioidy môžu zvýšiť tlak mozgovomiechového moku a spôsobiť tak záchvaty. U pacientov s poranením hlavy, vnútrolebečnými léziami alebo inými stavmi, ktoré zvyšujú tlak mozgovomiechového moku, ako aj u pacientov s anamnézou záchvatov v minulosti, je preto nutné používať opioidy s opatrnosťou.
U pacientov s hypotenziou, hypertrofiou prostaty alebo s uretrálnou stenózou sa pri používaní
opioidov vyžaduje opatrnosť.
Opioidmi vyvolaná mióza, zmeny v úrovni vedomia či zmeny vo vnímaní bolesti ako symptómu ochorenia môžu narušiť vyhodnotenie stavu pacienta alebo prekryť diagnózu alebo klinický priebeh sprievodného ochorenia.
Opatrnosť pri používaní opioidov sa vyžaduje u pacientov s myxedémom, hypotyreózou alebo
adrenokortikálnou nedostatočnosťou (napr. Addisonovou chorobou).
Preukázalo sa, že opioidy zvyšujú tlak v žlčovode a je nutné ich používať s opatrnosťou u pacientov s dysfunkciou žlčových ciest.
4.5 Liekové a iné interakcie
S Buvidalom sa neuskutočnili žiadne interakčné štúdie.
Buprenorfín sa má používať opatrne pri súbežnom podávaní týchto liekov:
• benzodiazepíny: Táto kombinácia môže viesť k smrti v dôsledku útlmu dýchania centrálneho pôvodu. Dávkovanie sa preto musí starostlivo sledovať a tejto kombinácii treba zamedziť, ak existuje riziko zneužitia. Pacientov treba upozorniť, že počas užívania tohto lieku je mimoriadne
nebezpečné samoaplikovať benzodiazepíny bez predpisu, a musia byť upozornení, aby benzodiazepíny užívali súbežne s týmto liekom len podľa pokynov svojho lekára (pozri časť
4.4).
• gabapentinoidy: Táto kombinácia môže viesť k smrti v dôsledku útlmu dýchania. Dávkovanie sa preto musí starostlivo sledovať a tejto kombinácii treba zamedziť, ak existuje riziko zneužitia. Pacienti majú byť upozornení na používanie gabapentinoidov (ako je pregabalín a gabapentín) súbežne s týmto liekom len podľa pokynov lekára (pozri časť 4.4).
• alkoholickými nápojmi alebo liekmi obsahujúcimi alkohol, pretože alkohol zvyšuje sedatívny
účinok buprenorfínu (pozri časť 4.7).
• iné lieky tlmiace centrálnu nervovú sústavu: ostatné opioidné deriváty (napr. metadón, analgetiká a antitusiká), niektoré antidepresíva, sedatívne antagonisty H1-receptorov,
barbituráty, anxiolytiká iné ako benzodiazepíny, antipsychotiká, klonidín a príbuzné látky. Tieto
kombinácie zvyšujú útlm centrálnej nervovej sústavy. Zníženie úrovne pozornosti môže byť nebezpečné pre vedenie vozidiel a obsluhovanie strojov (pozri časť 4.7).
• opioidné analgetiká: po podaní úplného opioidného agonistu pacientom užívajúcim buprenorfín môže byť náročné dosiahnuť dostatočnú analgéziu. Existuje tiež možnosť predávkovania úplným agonistom, najmä pri pokusoch o prekonanie účinkov čiastočného agonistu buprenorfínu alebo pri poklese hladiny buprenorfínu v plazme (pozri časť 4.4).
• naltrexón a nalmefén: sú to antagonisty opioidov, ktoré dokážu zablokovať farmakologické účinky buprenorfínu. U pacientov závislých od opioidov, ktorí sú v súčasnosti liečení buprenorfínom, môže naltrexón vyvolať náhly nástup predĺžených a intenzívnych abstinenčných príznakov opioidov. U pacientov, ktorí v súčasnosti dostávajú liečbu naltrexónom, môže byť zamýšľaný terapeutický účinok podávania buprenorfínu blokovaný naltrexónom.
• Buprenorfín sa metabolizuje na norbuprenorfín predovšetkým prostredníctvom CYP3A4.
Účinky na expozíciu buprenorfínu u pacientov liečených Buvidalom sa neskúmali. Interakcia so
súbežne podávanými induktormi alebo inhibítormi bola stanovená v štúdiách s použitím transmukózneho a transdermálneho buprenorfínu. Buprenorfín sa tiež metabolizuje na
buprenorfín-3β-glukuronid prostredníctvom UGT1A1.
• Inhibítory CYP3A4 môžu inhibovať metabolizmus buprenorfínu, a tým zvýšiť hodnotu
Cmax a AUC buprenorfínu a norbuprenorfínu. Buvidal stráca účinky prvého prechodu
a očakáva sa, že inhibítory CYP3A4 (napr. inhibítory proteázy ako ritonavir, nelfinavir
alebo indinavir alebo azolové antifungálne látky, ako je ketokonazol alebo itrakonazol
alebo makrolidové antibiotiká), budú mať menší účinok na metabolizmus buprenorfínu pri súčasnom podávaní s Buvidalom, v porovnaní s tým, keď sa podávajú súbežne so sublingválnym buprenorfínom. Pri prechode zo sublingválneho buprenorfínu na Buvidal môže byť potrebné pacientov sledovať, aby sa zabezpečilo, že plazmatické hladiny buprenorfínu sú primerané.
Pacienti užívajúci liek Buvidal, ktorí začali liečbu inhibítormi CYP3A4, majú byť liečení týždenným Buvidalom a majú byť sledovaní s ohľadom na prejavy a príznaky nadmernej liečby. Naopak, ak pacient, ktorému je súbežne podávaný liek Buvidal a inhibítor CYP3A4, ukončí liečbu inhibítorom CYP3A4, má byť sledovaný s ohľadom na abstinenčné príznaky.
• Induktory CYP3A4 môžu indukovať metabolizmus buprenorfínu, a tým znížiť hladiny buprenorfínu. Buvidal stráca účinok prvého prechodu a očakáva sa, že induktory CYP3A4 (napr. fenobarbital, karbamazepín, fenytoín alebo rifampicín) majú pri súčasnom podávaní s Buvidalom menšie účinky na metabolizmus buprenorfínu v porovnaní s tým, keď sa podávajú súbežne s buprenorfínom. Pri prechode zo sublingválneho buprenorfínu na Buvidal môže byť potrebné pacientov sledovať, aby sa zabezpečilo, že plazmatické hladiny buprenorfínu sú primerané. Pacienti užívajúci liek
Buvidal, ktorí začali liečbu induktormi CYP3A4, majú byť liečení týždenným Buvidalom a majú byť sledovaní s ohľadom na abstinenčné prejavy a príznaky. Naopak, ak pacient, ktorému je súbežne podávaný liek Buvidal a induktor CYP3A4, ukončí liečbu
induktorom CYP3A4, má byť sledovaný s ohľadom na príznaky nadmernej liečby.
• Inhibítory UGT1A1 môžu ovplyvniť systémovú expozíciu buprenorfínu.
• inhibítory monoaminooxidázy (MAOI): Možné zhoršenie účinkov opioidov na základe
skúseností s morfínom.
4.6 Fertilita, gravidita a laktácia
G
ra
v
i
dita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití buprenorfínu u gravidných žien.
Štúdie vykonané na zvieratách nenaznačujú reprodukčnú toxicitu (pozri časť 5.3). Buprenorfín sa má používať počas gravidity len v prípade, že potenciálny prínos prevažuje nad potenciálnym rizikom pre
plod.
Ku koncu tehotenstva môže buprenorfín vyvolať útlm dýchania u novorodenca, a to dokonca aj po krátkej dobe podávania. Dlhodobé podávanie počas posledných troch mesiacov gravidity môže spôsobiť abstinenčný syndróm u novorodenca (napr. hypertónia, novorodenecký tremor, novorodenecká agitácia, myoklonus alebo kŕčové záchvaty). K syndrómu dochádza zvyčajne oneskorene niekoľko hodín až niekoľko dní po pôrode.
Vzhľadom na dlhý polčas buprenorfínu sa má zvážiť niekoľkodňové pozorovanie novorodenca po narodení, aby sa zabránilo riziku respiračného útlmu alebo abstinenčného syndrómu u novorodenca.
Dojčenie
Buprenorfín a jeho metabolity sa vylučujú do ľudského mlieka a Buvidal sa má používať s
opatrnosťou počas dojčenia.
Fertilita
Nie sú k dispozícii žiadne alebo len obmedzené údaje o účinkoch buprenorfínu na fertilitu u ľudí.
Účinok buprenorfínu na fertilitu u zvierat nebol pozorovaný (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Buprenorfín má malý až mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje, ak je podaný pacientom závislým od opioidov. Buprenorfín môže spôsobiť ospalosť, závraty alebo poruchy myslenia, a to najmä počas indukcie liečby a po zmene dávkovania. Ak sa používa spolu s alkoholom alebo liekmi s tlmiacim účinkom na centrálnu nervovú sústavu, je pravdepodobné, že účinok bude ešte výraznejší (pozri časti 4.4 a 4.5).
Pacient musí byť upozornený, že počas používania tohto lieku nesmie viesť vozidlá ani obsluhovať nebezpečné stroje, dokým nebude známe, ako tento liek na neho vplýva. Ošetrujúci lekár má vydať
individuálne odporúčanie.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie hlásené nežiaduce reakcie na buprenorfín sú bolesť hlavy, nauzeaa, hyperhidróza,
nespavosť, abstinenčný syndróm a bolesť.
Súhrn nežiaducichreakciívtabuľke
V tabuľke 3 sú uvedené nežiaduce reakcie hlásené u buprenorfínu vrátane Buvidalu. Používajú sa
nasledujúce výrazy a frekvencie: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1000
až <1/100), neznáme (z dostupných údajov).
T
abuľka č. 3. Nežiaduce reakcie uvedené podľa orgánových systémov
T
r
ieda orgánových systémov
Veľmi časté Časté Menej časté Neznáme
I
nfekcie a nákazy Infekcia
Chrípka
Zápal hltanu
Nádcha
Celulitída v mieste vpichu
Poruchy krvi a lymfatického systému
Poruchy imunitného systému
Poruchy metabolizmu a výživy
Lymfadenopatia
Precitlivenosť
Znížená chuť do jedla
Psychické poruchy Nespavosť Úzkosť Agitácia Depresia Nepriateľstvo Nervozita Abnormálne myslenie Paranoja
Závislosť od liečby
Halucinácie
Euforická nálada
Poruchy nervového systému
Bolesť hlavy Ospalosť Závrat Migréna Parestézia Synkopa Tras Hypertónia Poruchy reči
Poruchy oka Porucha slzenia Rozšírenie zreníc očí Mióza
Poruchy ucha a labyrintu
Vertigo
Poruchy srdca a
s
rdcovej činnosti
Palpitácie
Poruchy ciev Vazodilatácia
Hypotenzia
 Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest
Kašeľ Dýchavičnosť Zívanie
Astma
Bronchitída
Nevoľnosť Zápcha Vracanie Bolesť brucha Nadúvanie Dyspepsia Sucho v ústach Hnačka
Poruchy
gastrointestinálneho traktu
Zvýšená hodnota alanínaminotransf erázy
Zvýšená hodnota aspartátaminotran
T
abuľka č. 3. Nežiaduce reakcie uvedené podľa orgánových systémov
T
r
ieda orgánových systémov
Veľmi časté Časté Menej časté Neznáme
sferázy
Zvýšené hladiny pečeňových enzýmov
Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest Poruchy reprodukčného systému a prsníkov Celkové poruchy a reakcie v mieste podania
L
a
boratórne a funkčné vyšetrenia Úrazy, otravy a komplikácie
liečebného postupu
Hyperhidróza Abstinenčné príznaky Bolesť
Vyrážka Svrbenie Žihľavka Bolesti kĺbov Bolesti chrbta Bolesť svalov Svalové kŕče Bolesť krku Bolesti kostí
Dysmenorea
Bolesť v mieste vpichu injekcie Svrbenie v mieste vpichu injekcie Erytém v mieste vpichu injekcie Opuch v mieste vpichu injekcie Reakcie v mieste vpichu injekcie Stvrdnutie v mieste vpichu injekcie Zdurenie v mieste vpichu injekcie Periférny edém Asténia
Celková nevoľnosť
Horúčka
Zimnica
Abstinenčný syndróm u novorodencov Bolesť v hrudníku Abnormálne
výsledky testov
funkcie pečene
Makulárna vyrážka
Zápal v mieste vpichu injekcie Podliatina v mieste vpichu injekcie
Urtikária v mieste vpichu injekcie
Procedurálny závrat
Erytém
Retencia moču
 Popis vybraných nežiaducich reakcií
Reakcie v mieste vpichu injekcie
Popis vybraných nežiaducich reakcií
Reakcie v mieste vpichu injekcie
V dvojito zaslepenom skúšaní účinnosti fázy 3 boli nežiaduce reakcie súvisiace s miestom vpichu injekcie pozorované u 36 (16,9 %) z 213 pacientov (5 % podaných injekcií) v skupine liečenej Buvidalom. Najčastejšie nežiaduce reakcie boli bolesť v mieste vpichu injekcie (8,9 %), pruritus v mieste vpichu injekcie (6,1 %) a erytém v mieste vpichu injekcie (4,7 %). Všetky reakcie v mieste vpichu boli mierne alebo stredne závažné a väčšina prípadov bola prechodná.
H
l
ásenie podozrení na nežiaduce reakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieSymptómyÚtlm dýchania v dôsledku útlmu centrálnej nervovej sústavy je hlavným symptómom vyžadujúcim si
zásah v prípade predávkovania buprenorfínom, pretože môže viesť k zástave dýchania a smrti. Medzi počiatočné príznaky predávkovania môže patriť tiež nadmerné potenie, ospalosť, tupozrakosť, mióza, hypotenzia, nevoľnosť, vracanie a/alebo poruchy reči.
LiečbaMali by sa zaviesť všeobecné podporné opatrenia, vrátane starostlivého monitorovania respiračnej
funkcie a funkcie srdca u pacienta. Treba nasadiť symptomatickú liečbu útlmu dýchania podľa štandardných opatrení intenzívnej starostlivosti. Musia sa zabezpečiť voľné dýchacie cesty pacienta a
asistované alebo kontrolované dýchanie. Pacient by mal byť presunutý do prostredia, v ktorom je k
dispozícii kompletné vybavenie pre resuscitáciu. Ak pacient vracia, treba prijať opatrenia, aby nedošlo k vdýchnutiu. Odporúča sa použitie antagonistu opioidov (napr. naloxónu) aj napriek malému efektu, ktorý môže mať na zvrátenie respiračných symptómov buprenorfínu v porovnaní s účinkami na opioidy s plne agonistickým účinkom.
Pri stanovení dĺžky liečby treba vziať do úvahy dlhé trvanie účinkov buprenorfínu a Buvidalu
s predĺženým uvoľňovaním
, aby sa predišlo účinkom predávkovania (pozri časť 4.4). Naloxón môže byť odstránený rýchlejšie ako buprenorfín, čo umožňuje návrat k predtým kontrolovaným symptómom
predávkovania buprenorfínom.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Iné liečivá na centrálnu nervovú sústavu, liečivá na terapiu závislostí od
opioidov, ATC kód: N07BC01
Mechanizmus účinkuBuprenorfín je opioidný čiastočný agonista/antagonista, ktorý sa viaže na opioidné receptory v mozgu
μ (mí) a κ (kappa). Jeho aktivita v opioidnej udržiavacej liečbe sa vysvetľuje pomalým reverzibilným uvoľňovaním jeho väzby na μ-opioidné receptory, ktoré počas dlhej doby môžu minimalizovať potrebu nezákonných opioidov u pacientov závislých od opioidov.
Efekt stropu opioidných agonistov bol pozorovaný v priebehu klinických farmakologických štúdií u osôb závislých na opioidoch.
Klinická účinnosťÚčinnosť a bezpečnosť Buvidalu pri liečbe závislosti od opioidov bola stanovená v pivotnej
randomizovanej, dvojito zaslepenej, dvojito maskovanej štúdii fázy 3 s aktívne kontrolovanou flexibilnou dávkou u pacientov so stredne ťažkou až ťažkou závislosťou od opioidov. V tejto štúdii bolo 428 pacientov randomizovaných do jednej z dvoch liečebných skupín. Pacienti v skupine s Buvidalom (n = 213) dostávali počas prvých 12 týždňov týždenné injekcie (16 mg až 32 mg), po ktorých nasledovali mesačné injekcie (64 mg až 160 mg) počas posledných 12 týždňov a denné dávky
sublingválnych tabliet placeba počas celého obdobia liečby. Pacienti v skupine so sublingválne podávaným buprenorfínom/naloxónom (n = 215) dostávali počas prvých 12 týždňov týždenné a počas posledných 12 týždňov mesačné injekcie placeba plus denné sublingválne tablety buprenorfínu/naloxónu počas celého obdobia liečby (8 mg až 24 mg počas prvých 12 týždňov a 8 mg až 32 mg počas posledných 12 týždňov). Počas 12 týždňov s mesačnými injekciami pacienti v oboch skupinách mohli v prípade potreby dostať jednu ďalšiu týždennú dávku Buvidalu 8 mg na mesiac. Pacienti sa zúčastnili 12 týždňových návštev počas prvých 12 týždňov a 6 návštev počas posledných
12 týždňov (3 plánované mesačné návštevy a 3 náhodné návštevy na analýzu toxikológie moču). Pri každej návšteve sa hodnotili meradlá výslednej účinnosti a bezpečnosti.
Z 428 randomizovaných pacientov ukončilo 24-týždňové obdobie liečby 69,0 % (147/213) pacientov
v skupine liečenej Buvidalom a 72,6 % (156/215) pacientov v sublingválnej skupine liečenej
buprenorfínom/naloxónom.
Štúdia splnila primárny koncový ukazovateľ non-inferiority v priemernom percentuálnom zastúpení vzoriek moču negatívnych na nedovolené opioidy počas 1. až 24. týždňa liečby pre skupinu
s Buvidalom v porovnaní s sublingválnymi skupinami buprenorfínu/naloxónu (tabuľka č. 4).
V porovnaní so sublingválnym buprenorfínom/naloxónom (vopred špecifikované poradie testov) bola v priebehu 4. až 24. týždňa liečby (tabuľka č. 4) splnená superiorita Buvidalu pre sekundárny ukazovateľ kumulatívnej distribučnej funkcie (cumulative distribution function, CDF) pre percentuálny podiel opioidne negatívnych vzoriek moču.
Tabuľka č. 4. Premenné účinnosti v pivotnej, randomizovanej, dvojito zaslepenej, dvojito maskovanej, aktívne kontrolovanej štúdie fázy 3 s flexibilnou dávkou u pacientov so stredne ťažkou až ťažkou závislosťou od opioidov
P
r
emenná účinnosti Štatistika Buvidal SL BPN/NX Liečebný rozdiel (%)
a
(
95 % IS)
p- hodnot a
P
e
rcento vzoriek moču
negatívnych na
N 213 215
nedovolené opioidy
LS
priemer
(%) (SE)
35,1 (2,48) 28,4 (2,47) 6,7 <0,001
CD
F percentuálneho podielu vzoriek moču negatívnych na nedovolené opioidy v 4. –
24. týždni
95 % IS 30,3 – 40,0 23,5 – 33,3 -0,1 – 13,6
N 213 215
Medián 26,7 6,7 - 0,008b

CDF = kumulatívna distribučná funkcia, IS = interval spoľahlivosti, LS = najmenšie štvorce; SE =
štandardná chyba, SL BPN/NX = sublingválny buprenorfín/naloxón
a Rozdiel = Buvidal – SL BPN/NX.
b p-hodnota bola pre superioritu
Uskutočnila sa dlhodobá nezaslepená štúdia bezpečnosti fázy 3 s flexibilným dávkovaním týždenného a mesačného Buvidalu počas 48 týždňov. Štúdia zahŕňala celkovo 227 pacientov so stredne ťažkou až ťažkou závislosťou od opioidov, z ktorých 190 pacientov prešlo zo sublingválneho buprenorfínu (s naloxónom alebo bez naloxónu) a 37 pacientov bolo novo liečených buprenorfínom. Počas 48- týždňovej liečby mohli pacienti podľa klinického úsudku lekára meniť medzi týždennými a
mesačnými injekciami Buvidalu a rôzne dávky (8 mg až 32 mg Buvidalu týždenne a 64 mg až 160 mg
Buvidalu mesačne).
U pacientov, ktorí prešli zo sublingválneho buprenorfínu, bolo percento pacientov so vzorkami moču negatívnymi na nelegálne opioidy 78,8 % na začiatku liečby a 84,0 % na konci 48-týždňovej liečby. U
pacientov, pre ktorých bola liečba nová, bolo percento pacientov so vzorkami moču negatívnymi na
nedovolené opioidy 0,0 % na začiatku liečby a 63,0 % na konci 48-týždňovej liečby. Celkovo 156
pacientov (68,7 %) dokončilo 48-týždňovú liečbu.
5.2 Farmakokinetické vlastnosti
T
ýždenný Buvidal
A
bsorpcia
Po injekcii sa plazmatická koncentrácia buprenorfínu zvyšuje s mediánom času na maximálnu
plazmatickú koncentráciu (t max) približne za 24 hodín. Buvidal má úplnú absolútnu biologickú
dostupnosť. Stabilizovaná expozícia sa dosiahne v štvrtej týždennej dávke.
Zvýšenie expozície závisí od dávky v dávkovacom intervale od 8 mg do 32 mg. Distribúcia
Zrejmý objem distribúcie buprenorfínu je približne 1 900 l. Buprenorfín sa približne na 96 % viaže na
bielkoviny, primárne na alfa a beta-globulín.
Biotransformácia a eliminácia
Buprenorfín je oxidačne metabolizovaný prostredníctvom 14-N-dealkylácie na N-desalkyl-buprenorfín
(tiež známy ako norbuprenorfín) prostredníctvom cytochrómu P450 CYP3A4 a glukurokonjugáciou
materskej molekuly a dealkylovaného metabolitu. Norbuprenorfín je μ-opioidný agonista so slabou
vlastnou aktivitou.
Subkutánne podávanie Buvidalu vedie k významne nižším koncentráciám norbuprenorfínu v plazme v porovnaní s podávaním sublingválneho buprenorfínu v dôsledku zabránenia metabolizmu pri prvom prechode.
Eliminácia buprenorfínu z Buvidalu je obmedzená rýchlosťou uvoľňovania s terminálnym polčasom v
rozmedzí od 3 do 5 dní.
Buprenorfín sa eliminuje hlavne stolicou, žlčovým vylučovaním glukurokonjugovaných metabolitov
(70 %), zvyšok sa eliminuje močom. Celkový klírens buprenorfínu je približne 68 l/h.
Špeciálne populácie
Staršie osoby
Farmakokinetické údaje u starších pacientov (> 65 rokov) nie sú k dispozícii.
Porucha funkcie obličiek
Eliminácia obličkami hrá relatívne malú úlohu (≈ 30 %) v celkovom klírense buprenorfínu. Úprava dávkovania na základe funkcie obličiek sa nevyžaduje, ale odporúča sa opatrnosť pri dávkovaní u pacientov so závažnou poruchou funkcie obličiek (pozri časti 4.2 a 4.4).
Porucha funkcie pečene
V tabuľke 5 sú zhrnuté výsledky z klinickej štúdie, v ktorej sa stanovila expozícia buprenorfínu po dávke sublingválnej tablety buprenorfínu/naloxónu 2,0/0,5 mg u zdravých účastníkov a u účastníkov s rôznym stupňom poruchy funkcie pečene.
T
abuľka č. 5. Vplyv poruchy funkcie pečene (zmena vzhľadom na zdravých účastníkov) na farmakokinetické parametre buprenorfínu po podaní sublingválneho buprenorfínu/naloxónu (2,0/0,5 mg) u zdravých účastníkov a u účastníkov s rôznymi stupňami poruchy funkcie pečene
F
armakokinetický parameter
B
uprenorfín
Mi
e
r
na porucha funkcie pečene (Childova-Pughova trieda A)
(
n = 9)
Stredne závažná porucha
f
u
nkcie pečene
(
C
hildova-Pughova trieda
B
)
(
n = 8)
Z
ávažná porucha funkcie pečene (Childova-Pughova trieda C)
(
n = 8)
Cmax 1,2-násobný nárast 1,1-násobný nárast 1,7-násobný nárast
AUCposl. Podobná ako kontrolné hodnoty
1,6-násobný nárast 2,8-násobný nárast
Celkovo sa plazmatická expozícia buprenorfínu zvýšila približne 3-násobne u jedincov so závažne
poškodenou funkciou pečene (pozri časti 4.2, 4.3 a 4.4).
Pediatrická populáciaFarmakokinetické údaje u pediatrických pacientov (mladších ako 18 rokov) nie sú k dispozícii. Údaje zo simulácie expozície buprenorfínu u dospievajúcich vo veku 16 rokov preukazujú nižšie hodnoty Cmax a AUC v porovnaní s pozorovanými hodnotami u dospelých pri týždennom a mesačnom Buvidale.
5.3 Predklinické údaje o bezpečnostiAkútna toxicita buprenorfínu bola stanovená u myší a potkanov po perorálnom a parenterálnom (intravenóznom, intraperitoneálnom) podaní. Nežiaduce účinky boli založené na známej farmakologickej aktivite buprenorfínu.
Buprenorfín vykazoval nízku tkanivovú a biochemickú toxicitu, keď sa podával beaglom subkutánne jeden mesiac, makakom rhesus perorálne počas jedného mesiaca a potkanom a paviánom intramuskulárne počas šiestich mesiacov.
Štúdie teratológie a reprodukčnej toxicity na potkanoch a králikoch intramuskulárnym podaním viedli k záveru, že buprenorfín nie je embryotoxický ani teratogénny a nemá výrazný vplyv na potenciál odstavenia. U potkanov nedošlo k žiadnym nežiaducim účinkom na plodnosť všeobecných reprodukčných funkcií.
Štúdie chronickej toxicity nosiča používaného pre Buvidal u potkanov a psov neodhalili žiadne
osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokBuvidal 8 mg, 16 mg, 24 mg, 32 mg
Sójový fosfatidylcholín Glycerol dioleát Bezvodý etanol
6.2 InkompatibilityTento liek sa nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
18 mesiacov.
6.4 Špeciálne upozornenia na uchovávanie
Neuchovávajte v chladničke alebo mrazničke.
6.5 Druh obalu a obsah balenia
1 ml naplnená injekčná striekačka (sklenená, typ I) s piestovou zátkou (brómbutylová guma pokrytá fluoropolymérom) s ihlou (½ palca, 23 G, 12 mm) a kryt ihly (styrén-butadiénový kaučuk). Naplnená injekčná striekačka je nasadená v bezpečnostnom zariadení na zabránenie pichnutia ihlou po injekčnej aplikácii. Kryt ihly bezpečnostnej striekačky môže obsahovať gumový latex, ktorý môže spôsobiť alergické reakcie u osôb citlivých na latex.
Veľkosti balenia:
Balenie obsahuje 1 naplnenú injekčnú striekačku s uzáverom, ihlou, krytom ihly, bezpečnostným
zariadením a 1 piestom.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Dôležitá informácia
• Podanie sa má vykonať do podkožného tkaniva.
• Musí sa zabrániť intravaskulárnemu, intramuskulárnemu a intradermálnemu podaniu.
• Nesmie sa používať, ak je bezpečnostná striekačka zlomená alebo je poškodený obal.
• Kryt ihly striekačky môže obsahovať gumový latex, ktorý môže spôsobiť alergické reakcie u
osôb citlivých na latex.
• S bezpečnostnou striekačkou manipulujte opatrne, aby ste zabránili pichnutiu ihlou.
Bezpečnostná striekačka obsahuje bezpečnostné zariadenie na ochranu ihly, ktoré sa aktivuje na konci injekcie. Neodkrývajte bezpečnostnú striekačku, kým nie ste pripravení na jej podanie. Keď je odkrytá, nikdy sa nepokúšajte znova nasadiť ihlu.
• Po použití bezpečnú striekačku ihneď zlikvidujte. Bezpečnostnú striekačku nepoužívajte
opakovane.
Pred podaním
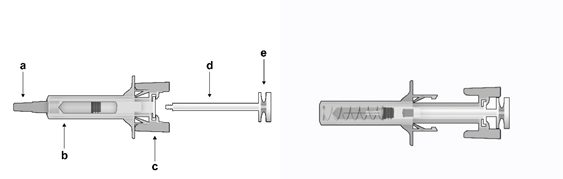
Časti bezpečnostnej striekačky:
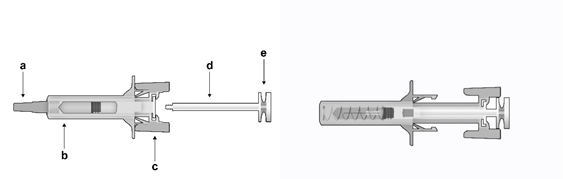
O
brázok
č. 1:
Be
z
pečnostná striekačka: Pred
použitím
a) kryt ihly, b) ochranné telo striekačky, c) krídla striekačky, d) piest,
e) hlava piestu
B
ezpečnostná striekačka: Po použití (s aktivovaným mechanizmom na ochranu ihly)
U
pozorňujeme, že najmenší objem injekcie je sotva viditeľný v zobrazovacom okienku,
pretože pružina bezpečnostného zariadenia „prekrýva“ časť skleneného valca blízko ihly.
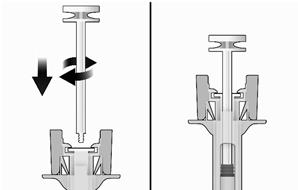
Podávanie (pozri aj časť 4.2)- Vytiahnite injekčnú striekačku zo škatuľky: vytiahnite injekčnú striekačku za ochranné telo
striekačky.
- Kým budete držať injekčnú striekačku za kryt ihly vložte piest do zátky piestu jemným otáčaním piestu v smere hodinových ručičiek, až kým sa nezaistí (pozri obrázok č. 2).
Obrázok č. 2: Pred Po- Bezpečnostnú striekačku dôkladne skontrolujte:
- Nepoužívajte bezpečnostnú striekačku po dátume exspirácie uvedenom na škatuli alebo na štítku striekačky.
- Môžete vidieť malú vzduchovú bublinu, ktorá je normálna.
- Tekutina by mala byť číra. Nepoužívajte bezpečnostnú striekačku, ak kvapalina obsahuje viditeľné čiastočky alebo je zakalená.
- Vyberte miesto podania injekcie. Miesto podania by sa malo meniť a podávať striedavo v oblasti zadku, stehna, brucha alebo hornej časti ramena (pozri obrázok č. 3) minimálne 8 týždňov pred opätovným podaním na to isté miesto injekcie. Mali by ste sa vyhnúť injekcii v oblasti pásu alebo do vzdialenosti 5 cm od pupka.
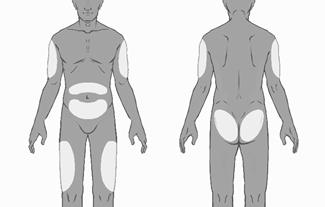 O
brázok č. 3:
O
brázok č. 3:
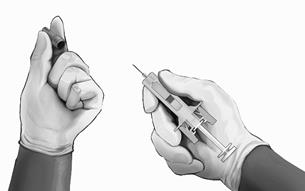
- Oblečte si rukavice a očistite miesto vpichu kruhovým pohybom pomocou tampónu namočeného v etanole (nie je súčasťou balenia). Pred podaním injekcie sa vyčisteného miesta už nedotýkajte.
- Pridržte bezpečnostnú striekačku za telo ochrannej striekačky tak, ako je to znázornené (pozri obrázok č. 4), a opatrne vytiahnite kryt ihly. Kryt ihly okamžite zlikvidujte (nikdy sa nepokúšajte znovu zatvoriť ihlu). Na konci ihly môžete spozorovať kvapku roztoku. To je normálne.
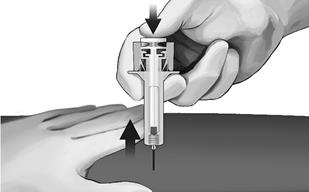
Obrázok č. 4:- Pevne stlačte kožu medzi palcom a ukazovákom, ako je to znázornené (pozri obrázok č. 5).
- Držte bezpečnostnú striekačku podľa obrázka a hladko zasuňte ihlu pod uhlom približne 90° (pozri obrázok č. 5). Zatlačte ihlu úplne dovnútra.
Obrázok č. 5:- Zatlačte injekčnú striekačku tak, ako je znázornené (pozri obrázok č. 6), pomaly stlačte piest, až kým hlava piesta nezapadne medzi ochranné krídla striekačky a všetok roztok sa nevstrekne.
 O
brázok č. 6:
O
brázok č. 6:
- Jemne vytiahnite ihlu z kože. Odporúča sa, aby bol piest úplne stlačený, kým sa ihla opatrne zdvihne priamo z miesta vpichu (pozri obrázok č. 7).
Obrázok č. 7: - Ihneď po úplnom vybratí ihly z kože, pomaly odložte palec z piestu a nechajte kryt striekačky automaticky zakryť exponovanú ihlu (pozri obrázok č. 8). V mieste vpichu sa môže objaviť malé množstvo krvi. Ak je to potrebné, utrite ho vatovou guľôčkou alebo gázou.
Obrázok č. 8:Likvidácia striekačkyVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Camurus AB
Ideon Science Park
SE-223 70 Lund, Švédsko
Telefónne číslo: +800 2577 2577
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)Buvidal injekčný roztok s predĺženým uvoľňovaním (týždenne)
EU/1/18/1336/001 [8 mg buprenorfínu/0,16 ml] EU/1/18/1336/002 [16 mg buprenorfínu/0,32 ml]
EU/1/18/1336/003 [24 mg buprenorfínu 0,48 ml] EU/1/18/1336/004 [32 mg buprenorfínu/0,64 ml]
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Buvidal 64 mg injekčný roztok s predĺženým uvoľňovaním Buvidal 96 mg injekčný roztok s predĺženým uvoľňovaním Buvidal 128 mg injekčný roztok s predĺženým uvoľňovaním
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
64mginjekčnýroztokspredĺženýmuvoľňovaním
Každá naplnená injekčná striekačka obsahuje 64 mg buprenorfínu
96mginjekčnýroztokspredĺženýmuvoľňovaním
Každá naplnená injekčná striekačka obsahuje 96 mg buprenorfínu
128mginjekčnýroztokspredĺženýmuvoľňovaním
Každá naplnená injekčná striekačka obsahuje 128 mg buprenorfínu
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok s predĺženým uvoľňovaním. Žltkastá až žltá číra kvapalina.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba závislosti od opioidov v rámci medicínskej, sociálnej a psychologickej terapie. Liečba je určená pre dospelých a dospievajúcich vo veku od 16 rokov.
4.2 Dávkovanie a spôsob podávania
Podávanie Buvidalu je obmedzené na zdravotníkov. Pri predpisovaní a dávkovaní buprenorfínu je
potrebné prijať vhodné opatrenia, ako je vykonanie návštev v rámci ďalšieho sledovania pacienta s klinickým monitorovaním podľa potrieb pacienta. Užívanie na domáce použitie alebo samo-
podávanie lieku pacientmi nie je povolené.
Bezpečnostné opatrenia, ktoréjepotrebnévykonaťpredzačatímliečby
Aby sa predišlo rýchlemu nástupu abstinenčných príznakov, liečba Buvidalom sa má začať vtedy, keď
sú prítomné objektívne a jasné mierne až stredné abstinenčné príznaky (pozri časť 4.4). Potrebné je venovať pozornosť typu závislosti od užívaných opioidných látok (t. j. dlhodobo alebo krátkodobo pôsobiace opioidy), dobe od posledného užitia opioidu a stupňa závislosti od opioidov.
• U pacientov užívajúcich heroín alebo krátko pôsobiace opioidy sa počiatočná dávka Buvidalu nesmie podať skôr ako po 6 hodinách od posledného užívania opioidov.
• U pacientov užívajúcich metadón je potrebné pred začiatkom liečby Buvidalom znížiť dávku metadónu na maximálne 30 mg/denne a táto dávka sa má podávať najskôr 24 hodín po podaní poslednej dávky metadónu pacientovi. Buvidal môže spôsobiť abstinenčné príznaky u pacientov závislých od metadónu.
D
á
vkovanie
Začatie liečby u pacientov, ktorí ešte neužívajú buprenorfín
Pacienti, ktorí neboli predtým vystavení buprenorfínu, majú dostať sublingválnu dávku 4 mg buprenorfínu a musia sa pozorovať jednu hodinu pred prvým podaním týždenného Buvidalu na potvrdenie znášanlivosti buprenorfínu.
Odporúčaná počiatočná dávka Buvidalu je 16 mg s jednou alebo dvoma ďalšími dávkami 8 mg s odstupom najmenej 1 deň až po cieľovú dávku 24 mg alebo 32 mg počas prvého týždňa liečby. Odporúčaná dávka pre druhý týždeň liečby je celková dávka podaná počas začiatočného týždňa.
Liečba mesačným Buvidalom sa môže začať po začatí liečby týždenným Buvidalom v súlade s konverziou dávky uvedenou v tabuľke č. 2 a po stabilizovaní týždennej liečby u pacientov (po dobu najmenej štyroch týždňov, ak je to možné).
Prechod zo sublingválnych buprenorfínov na Buvidal
Pacienti liečení sublingválnym buprenorfínom môžu prejsť priamo na týždenný alebo mesačný
Buvidal počínajúc dňom po poslednej dennej dávke podávania sublingválneho buprenorfínu v súlade s odporúčaniami pre dávkovanie v tabuľke č. 1. Počas dávkovania po zmene liečby sa odporúča
dôkladnejšie sledovanie pacientov.
Tabuľka č. 1. Konvenčné denné dávky buprenorfínu pre sublingválne podávanie a odporúčané zodpovedajúce dávky týždenného a mesačného Buvidalu
D
ávka denného sublingválneho buprenorfínu
D
ávka týždenného Buvidalu Dávka mesačného Buvidalu

2 – 6 mg 8 mg
8 – 10 mg 16 mg 64 mg
12 – 16 mg 24 mg 96 mg
18 – 24 mg 32 mg 128 mg
Dávka buprenorfínu v mg sa môže líšiť medzi jednotlivými sublingválnymi liekmi, čo sa musí
zohľadniť individuálne pri konkrétnych liekoch. Farmakokinetické vlastnosti Buvidalu sú opísané v časti 5.2.
Udržiavacia liečba a úprava dávkyBuvidal možno podávať týždenne alebo mesačne. Dávky sa môžu zvýšiť alebo znížiť a pacienti môžu meniť režim medzi týždenne a mesačne podávanými liekmi podľa individuálnych potrieb pacienta a podľa klinického úsudku lekára na základe odporúčaní v tabuľke č. 2. Po zmene liečby sa môže vyžadovať dôkladnejšie sledovanie pacientov. Hodnotenie dlhodobej liečby je založené na údajoch za
48 týždňov.
Tabuľka č. 2. Odporúčaná konverzia dávky pri zmene z týždenného na mesačné dávkovanie alebo z mesačného na týždenné dávkovanieTýždenná dávka Buvidalu Mesačná dávka Buvidalu
16 mg 64 mg
24 mg 96 mg
32 mg 128 mg
Doplnkové dávkovanieMaximálna jedna doplnková dávka Buvidalu 8 mg sa môže podať pri neplánovanej návšteve medzi pravidelnými týždennými a mesačnými dávkami na základe individuálnych dočasných potrieb
pacienta.
Maximálna týždenná dávka u pacientov užívajúcich týždennú liečbu Buvidalom je 32 mg s ďalšou 8 mg dávkou. Maximálna mesačná dávka u pacientov užívajúcich mesačnú liečbu Buvidalom je 128 mg s ďalšou 8 mg dávkou.
Vynechané dávky
Aby sa zabránilo vynechaniu dávok, môže byť týždenná dávka podaná až 2 dni pred týždenným časovým bodom alebo po ňom a mesačná dávka môže byť podávaná až do 1 týždňa pred mesačným časovým bodom alebo po ňom.
V prípade vynechania dávky sa má nasledujúca dávka podať čo možno najskôr.
Ukončenie liečby
Ak je liečba Buvidalom prerušená, je potrebné zvážiť jeho charakteristiky predĺženého uvoľňovania a akékoľvek abstinenčné príznaky, ktoré sa vyskytli u pacienta, pozri časť 4.4. Ak pacient prejde na liečbu sublingválnym buprenorfínom, má sa to urobiť týždeň po poslednej týždennej dávke alebo mesiac po poslednej mesačnej dávke Buvidalu podľa odporúčaní v tabuľke č. 1.
Špeciálne populácie
Staršie osoby
Účinnosť a bezpečnosť buprenorfínu u starších pacientov vo veku nad 65 rokov neboli stanovené. Nie je možné uviesť odporúčania na dávkovanie.
Vo všeobecnosti je odporúčané dávkovanie u starších pacientov s normálnou funkciou obličiek rovnaké ako u mladších dospelých pacientov s normálnou funkciou obličiek. Pretože starší pacienti môžu mať zníženú funkciu obličiek/pečene, môže byť potrebné upraviť dávku (pozri časti Porucha funkcie pečene a Porucha funkcie obličiek nižšie).
Porucha funkcie pečene
Buprenorfín sa musí používať s opatrnosťou u pacientov so stredne závažnou poruchou funkcie pečene (pozri časť 5.2). Použitie buprenorfínu je kontraindikované u pacientov so závažnou poruchou
funkcie pečene (pozri časť 4.3).
Porucha funkcie obličiek
U pacientov s poruchou funkcie obličiek nie je nutná úprava dávky buprenorfínu. Dávkovanie s opatrnosťou sa odporúča u pacientov so závažnou poruchou funkcie obličiek (klírens kreatinínu
< 30 ml/min) (pozri časti 4.4 a 5.2).
Pediatrická populácia
Bezpečnosť a účinnosť buprenorfínu u detí a dospievajúcich vo veku do 16 rokov neboli stanovené
(pozri časť 4.4). K dispozícii nie sú žiadne údaje.
Spôsob podávania
Buvidal je určený len na subkutánne podávanie. Mal by sa injikovať pomaly a úplne do podkožného
tkaniva rôznych oblastí (zadok, stehno, brucho alebo horná časť ramena) za predpokladu, že existuje dostatok podkožného tkaniva. Každá oblasť môže mať viac miest vpichu. Miesta podania injekcie by
sa mali striedať pri týždenných aj pri mesačných injekciách. Pri týždennej dávke je potrebný minimálny odstup 8 týždňov pred opätovným injekčným podaním do predtým použitého miesta
podania injekcie. Nie sú žiadne klinické údaje na potvrdenie opätovného injekčného podania mesačnej dávky do rovnakého miesta. Je nepravdepodobné, že by to predstavovalo obavu o bezpečnosť.
Rozhodnutie opätovne podať injekciu do toho istého miesta sa má takisto riadiť klinickým úsudkom
ošetrujúceho lekára. Podaná dávka by sa mala podávať ako jedna injekcia a nemala by sa rozdeľovať. Dávka sa nesmie podávať intravaskulárne (intravenózne), intramuskulárne ani intradermálne (do kože) (pozri časť 4.4). Pokyny na podávanie nájdete v časti 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Závažná respiračná nedostatočnosť
Závažná porucha funkcie pečene
Akútny alkoholizmus alebo delírium tremens
4.4 Osobitné upozornenia a opatrenia pri používaní
Podávanie
Je potrebné dbať na to, aby sa zabránilo neúmyselnej injekcii Buvidalu. Dávka sa nesmie podávať
intravaskulárne (intravenózne), intramuskulárne ani intradermálne.
Intravaskulárne podanie, ako je intravenózna injekcia, by predstavovalo riziko vážneho poškodenia, pretože Buvidal vytvára pri kontakte s telesnými tekutinami pevnú hmotu, ktorá by mohla potenciálne spôsobiť poranenie ciev, oklúziu alebo tromboembolické príhody.
Aby sa minimalizovalo riziko nesprávneho používania, zneužívania alebo nevhodného používania je pri predpisovaní a dávkovaní buprenorfínu potrebné prijať vhodné opatrenia. Zdravotníci by mali Buvidal podávať priamo pacientovi. Užívanie na domáce použitie alebo samo-podávanie lieku pacientmi nie je povolené. Akékoľvek pokusy o odstránenie depotu by sa mali počas liečby sledovať.
Vlastnosti predĺženého uvoľňovania
Vlastnosti predĺženého uvoľňovania lieku by sa mali brať do úvahy počas liečby, vrátanie, vrátane
začatia a ukončenia liečby. Hlavne pacienti s konkomitantnými liekmi a/alebo súbežnými komorbiditami majú byť sledovaní, či nevykazujú prejavy a príznaky toxicity, predávkovania alebo abstinencie, ktoré sú spôsobené zvýšenou alebo zníženou hladinou buprenorfínu.
Farmakokinetické vlastnosti, pozri časť 5.2, a ukončenie liečby, pozri časť 4.2.
Útlm dýchania
Popísaných bolo množstvo prípadov úmrtí v dôsledku útlmu dýchania u pacientov liečených
buprenorfínom, najmä ak sa podával v kombinácii s benzodiazepínami (pozri časť 4.5) alebo ak sa buprenorfín nepoužíval tak, ako je predpísané. Úmrtia boli hlásené aj v súvislosti so súbežným použitím buprenorfínu s ďalšími látkami s tlmiacim účinkom na CNS, ako je alkohol, gabapentinoidy (ako je pregabalín a gabapentín) (pozri časť 4.5) alebo iné opioidy.
U pacientov s respiračnou nedostatočnosťou (napr. chronickou obštrukčnou chorobou pľúc, cor pulmonale, zníženou respiračnou rezervou, hypoxiou, hyperkapniou, už existujúcim útlmom dýchania alebo kyfoskoliózou) sa musí buprenorfín používať opatrne.
Buprenorfín môže v prípade neúmyselného alebo úmyselného použitia spôsobiť vážny a potenciálne smrteľný útlm dýchania u detí a osôb bez závislosti na opioidoch.
Útlm CNS
Buprenorfín môže spôsobiť ospalosť, zvlášť pri užívaní spolu s alkoholom alebo s liekmi s tlmiacim
účinkom na centrálny nervový systém (ako sú benzodiazepíny, trankvilizéry, sedatíva, gabapentinoidy alebo hypnotiká) (pozri časti 4.5 a 4.7).
Závislosť
Buprenorfín je čiastočný agonista mí-opiátového receptora a chronické podávanie môže vyvolať
závislosť od opiátov.
Hepatitída a hepatické udalosti
Pred začatím liečby sa odporúča vykonať východiskové pečeňové testy a zdokumentovať stav
vírusovej hepatitídy. Pacientom, ktorí sú pozitívni na vírusovú hepatitídu, súbežne užívajú niektoré iné
lieky (pozri časť 4.5) a/alebo majú existujúce poškodenie funkcie pečene, hrozí vyššie riziko poškodenia pečene. Odporúča sa pravidelné sledovanie pečeňových funkcií.
V klinických skúšaniach aj v správach o nežiaducich účinkoch po uvedení liekov obsahujúcich buprenorfín na trh boli u pacientov závislých od opioidov hlásené prípady akútneho poškodenia pečene. Spektrum abnormalít siaha od prechodných asymptomatických zvýšení pečeňových transamináz až po prípady cytolytickej hepatitídy, zlyhania pečene, pečeňovej nekrózy, hepatorenálneho syndrómu, hepatálnej encefalopatie i úmrtia. V mnohých prípadoch môže zohrať príčinnú alebo pomocnú úlohu prítomnosť už existujúcich abnormalít v pečeňových enzýmoch, genetického ochorenia, infekcie vírusmi hepatitídy typu B alebo hepatitídy typu C, nadmerná konzumácia alkoholu, anorexia, súbežné užívanie iných potenciálne hepatotoxických liekov a pokračujúce injekčné užívanie drog. Tieto faktory sa musia vziať do úvahy pred predpísaním buprenorfínu a počas liečby. V prípade podozrenia na hepatickú udalosť sa vyžaduje ďalšie biologické a etiologické zhodnotenie. V závislosti od nálezov môže byť liečba Buvidalom prerušená. Môže byť potrebné monitorovanie presahujúce týždenné a mesačné obdobie liečby. Pokiaľ sa v liečbe pokračuje, je potrebné pozorne sledovať činnosť pečene.
Precipitácia opioidového abstinenčnéhosyndrómu
Pri začatí liečby buprenorfínom je dôležité uvedomiť si čiastočný agonistický profil buprenorfínu.
Buprenorfínové produkty spôsobili abstinenčné príznaky u pacientov závislých od opioidov, keď boli podávané predtým, ako ustúpia agonistické účinky vyplývajúce z nedávneho užívania alebo nesprávneho užívania opioidov. Aby sa zabránilo rýchlemu nástupu abstinenčných príznakov, musí sa vykonať indukcia, ak sú evidentné mierne až stredne závažné abstinenčné prejavy a príznaky (pozri časť 4.2).
Prerušenie liečby môže mať za následok abstinenčný syndróm, ktorý môže byť oneskorený v nástupe.
Porucha funkcie pečene
Buprenorfín je do značnej miery metabolizovaný v pečeni. Pacienti so stredne závažnou poruchou
funkcie pečene majú byť sledovaní z dôvodu možných prejavov a príznakov z vysadenia opioidov, toxicity alebo predávkovania, ktoré sú spôsobené zvýšenou hladinou buprenorfínu. Buprenorfín sa musí používať s opatrnosťou u pacientov so stredne závažnou poruchou funkcie pečene (pozri časti
4.2 a 5.2). Funkciu pečene je počas liečby potrebné pravidelne monitorovať. Použitie buprenorfínu je
kontraindikované u pacientov so závažnou poruchou funkcie pečene (pozri časť 4.3).
Porucha funkcie obličiek
U pacientov s poruchou funkcie obličiek sa akumulujú metabolity buprenorfínu. Dávkovanie s
opatrnosťou sa odporúča u pacientov so závažnou poruchou funkcie obličiek (klírens kreatinínu
<30 ml/min) (pozri časti 4.2 a 5.2).
Predĺženie intervalu QT
Pri súbežnom podávaní Buvidalu s inými liekmi, ktoré predlžujú interval QT, a u pacientov so
syndrómom dlhého intervalu QT alebo inými rizikovými faktormi predĺženia intervalu QT, je potrebná opatrnosť.
Akútna liečba bolesti
Na liečbu akútnej bolesti pri pokračujúcom užívaní Buvidalu môže byť potrebná kombinácia užívania
opioidov s vysokou afinitou na receptory mí-opioidov (napríklad fentanyl), neopioidných analgetík a regionálnej anestézie. Titrácia perorálneho alebo intravenózneho krátkodobo pôsobiaceho opioidného lieku proti bolesti (morfín s okamžitým uvoľňovaním, oxykodón alebo fentanyl) na požadovaný analgetický účinok u pacientov liečených Buvidalom môže vyžadovať vyššie dávky. Pacienti majú byť počas liečby sledovaní.
Použitie u detí a dospievajúcich
Bezpečnosť a účinnosť buprenorfínu u detí vo veku do 16 rokov neboli stanovené (pozri časť 4.2).
Vzhľadom na obmedzené údaje u dospievajúcich (vo veku 16 alebo 17 rokov) musia byť pacienti v tejto vekovej kategórii počas liečby pozorne sledovaní.
Účinky triedy
Opioidy môžu spôsobiť ortostatickú hypotenziu.
Opioidy môžu zvýšiť tlak mozgovomiechového moku a spôsobiť tak záchvaty. U pacientov s poranením hlavy, vnútrolebečnými léziami alebo inými stavmi, ktoré zvyšujú tlak mozgovomiechového moku, ako aj u pacientov s anamnézou záchvatov v minulosti, je preto nutné používať opioidy s opatrnosťou.
U pacientov s hypotenziou, hypertrofiou prostaty alebo s uretrálnou stenózou sa pri používaní
opioidov vyžaduje opatrnosť.
Opioidmi vyvolaná mióza, zmeny v úrovni vedomia či zmeny vo vnímaní bolesti ako symptómu ochorenia môžu narušiť vyhodnotenie stavu pacienta alebo prekryť diagnózu alebo klinický priebeh sprievodného ochorenia.
Opatrnosť pri používaní opioidov sa vyžaduje u pacientov s myxedémom, hypotyreózou alebo
adrenokortikálnou nedostatočnosťou (napr. Addisonovou chorobou).
Preukázalo sa, že opioidy zvyšujú tlak v žlčovode a je nutné ich používať s opatrnosťou u pacientov s dysfunkciou žlčových ciest.
4.5 Liekové a iné interakcie
S Buvidalom sa neuskutočnili žiadne interakčné štúdie.
Buprenorfín sa má používať opatrne pri súbežnom podávaní týchto liekov:
• benzodiazepíny: Táto kombinácia môže viesť k smrti v dôsledku útlmu dýchania centrálneho pôvodu. Dávkovanie sa preto musí starostlivo sledovať a tejto kombinácii treba zamedziť, ak existuje riziko zneužitia. Pacientov treba upozorniť, že počas užívania tohto lieku je mimoriadne nebezpečné samoaplikovať benzodiazepíny bez predpisu, a musia byť upozornení, aby benzodiazepíny užívali súbežne s týmto liekom len podľa pokynov svojho lekára (pozri časť
4.4).
• gabapentinoidy: Táto kombinácia môže viesť k smrti v dôsledku útlmu dýchania. Dávkovanie sa preto musí starostlivo sledovať a tejto kombinácii treba zamedziť, ak existuje riziko zneužitia. Pacienti majú byť upozornení na používanie gabapentinoidov (ako je pregabalín a gabapentín) súbežne s týmto liekom len podľa pokynov lekára (pozri časť 4.4).
• alkoholickými nápojmi alebo liekmi obsahujúcimi alkohol, pretože alkohol zvyšuje sedatívny
účinok buprenorfínu (pozri časť 4.7).
• iné lieky tlmiace centrálnu nervovú sústavu: ostatné opioidné deriváty (napr. metadón, analgetiká a antitusiká), niektoré antidepresíva, sedatívne antagonisty H1-receptorov,
barbituráty, anxiolytiká iné ako benzodiazepíny, antipsychotiká, klonidín a príbuzné látky. Tieto
kombinácie zvyšujú útlm centrálnej nervovej sústavy. Zníženie úrovne pozornosti môže byť nebezpečné pre vedenie vozidiel a obsluhovanie strojov (pozri časť 4.7).
• opioidné analgetiká: po podaní úplného opioidného agonistu pacientom užívajúcim buprenorfín môže byť náročné dosiahnuť dostatočnú analgéziu. Existuje tiež možnosť predávkovania úplným agonistom, najmä pri pokusoch o prekonanie účinkov čiastočného agonistu buprenorfínu alebo pri poklese hladiny buprenorfínu v plazme (pozri časť 4.4).
• naltrexón a nalmefén: sú to antagonisty opioidov, ktoré dokážu zablokovať farmakologické účinky buprenorfínu. U pacientov závislých od opioidov, ktorí sú v súčasnosti liečení buprenorfínom, môže naltrexón vyvolať náhly nástup predĺžených a intenzívnych abstinenčných
príznakov opioidov. U pacientov, ktorí v súčasnosti dostávajú liečbu naltrexónom, môže byť zamýšľaný terapeutický účinok podávania buprenorfínu blokovaný naltrexónom.
• Buprenorfín sa metabolizuje na norbuprenorfín predovšetkým prostredníctvom CYP3A4.
Účinky na expozíciu buprenorfínu u pacientov liečených Buvidalom sa neskúmali. Interakcia so
súbežne podávanými induktormi alebo inhibítormi bola stanovená v štúdiách s použitím transmukózneho a transdermálneho buprenorfínu. Buprenorfín sa tiež metabolizuje na buprenorfín-3β-glukuronid prostredníctvom UGT1A1.
• Inhibítory CYP3A4 môžu inhibovať metabolizmus buprenorfínu, a tým zvýšiť hodnotu
Cmax a AUC buprenorfínu a norbuprenorfínu. Buvidal stráca účinky prvého prechodu'
a očakáva sa, že inhibítory CYP3A4 (napr. inhibítory proteázy ako ritonavir, nelfinavir
alebo indinavir alebo azolové antifungálne látky, ako je ketokonazol alebo itrakonazol alebo makrolidové antibiotiká), budú mať menší účinok na metabolizmus buprenorfínu pri súčasnom podávaní s Buvidalom, v porovnaní s tým, keď sa podávajú súbežne s sublingválnym buprenorfínom. Pri prechode zo sublingválneho buprenorfínu na Buvidal môže byť potrebné pacientov sledovať, aby sa zabezpečilo, že plazmatické hladiny buprenorfínu sú primerané.
Pacienti užívajúci liek Buvidal, ktorí začali liečbu inhibítormi CYP3A4, majú byť liečení týždenným Buvidalom a majú byť sledovaní s ohľadom na prejavy a príznaky nadmernej liečby. Naopak, ak pacient, ktorému je súbežne podávaný liek Buvidal a inhibítor CYP3A4, ukončí liečbu inhibítorom CYP3A4, má byť sledovaný s ohľadom na abstinenčné príznaky.
• Induktory CYP3A4 môžu indukovať metabolizmus buprenorfínu, a tým znížiť hladiny buprenorfínu. Buvidal stráca účinok prvého prechodu a očakáva sa, že induktory CYP3A4 (napr. fenobarbital, karbamazepín, fenytoín alebo rifampicín) majú pri súčasnom podávaní s Buvidalom menšie účinky na metabolizmus buprenorfínu v porovnaní s tým, keď sa podávajú súbežne s buprenorfínom. Pri prechode zo sublingválneho buprenorfínu na Buvidal môže byť potrebné pacientov sledovať, aby sa zabezpečilo, že plazmatické hladiny buprenorfínu sú primerané. Pacienti užívajúci liek
Buvidal, ktorí začali liečbu induktormi CYP3A4, majú byť liečení týždenným Buvidalom a majú byť sledovaní s ohľadom na abstinenčné prejavy a príznaky. Naopak, ak pacient,
ktorému je súbežne podávaný liek Buvidal a induktor CYP3A4, ukončí liečbu
induktorom CYP3A4, má byť sledovaný s ohľadom na príznaky nadmernej liečby.
• Inhibítory UGT1A1 môžu ovplyvniť systémovú expozíciu buprenorfínu.
• inhibítory monoaminooxidázy (MAOI): Možné zhoršenie účinkov opioidov na základe
skúseností s morfínom.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití buprenorfínu u gravidných žien.
Štúdie vykonané na zvieratách nenaznačujú reprodukčnú toxicitu (pozri časť 5.3). Buprenorfín sa má používať počas gravidity len v prípade, že potenciálny prínos prevažuje nad potenciálnym rizikom pre plod.
Ku koncu tehotenstva môže buprenorfín vyvolať útlm dýchania u novorodenca, a to dokonca aj po krátkej dobe podávania. Dlhodobé podávanie počas posledných troch mesiacov gravidity môže spôsobiť abstinenčný syndróm u novorodenca (napr. hypertónia, novorodenecký tremor, novorodenecká agitácia, myoklonus alebo kŕčové záchvaty). K syndrómu dochádza zvyčajne oneskorene niekoľko hodín až niekoľko dní po pôrode.
Vzhľadom na dlhý polčas buprenorfínu sa má zvážiť niekoľkodňové pozorovanie novorodenca po narodení, aby sa zabránilo riziku respiračného útlmu alebo abstinenčného syndrómu u novorodenca.
D
ojčenie
Buprenorfín a jeho metabolity sa vylučujú do ľudského mlieka a Buvidal sa má používať s
opatrnosťou počas dojčenia.
Fertilita
Nie sú k dispozícii žiadne alebo len obmedzené údaje o účinkoch buprenorfínu na fertilitu u ľudí.
Účinok buprenorfínu na fertilitu u zvierat nebol pozorovaný (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Buprenorfín má malý až mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje, ak je podaný pacientom závislým od opioidov. Buprenorfín môže spôsobiť ospalosť, závraty alebo poruchy myslenia, a to najmä počas indukcie liečby a po zmene dávkovania. Ak sa používa spolu s alkoholom alebo liekmi s tlmiacim účinkom na centrálnu nervovú sústavu, je pravdepodobné, že účinok bude ešte výraznejší (pozri časti 4.4 a 4.5).
Pacient musí byť upozornený, že počas používania tohto lieku nesmie viesť vozidlá ani obsluhovať nebezpečné stroje, dokým nebude známe, ako tento liek na neho vplýva. Ošetrujúci lekár má vydať
individuálne odporúčanie.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie hlásené nežiaduce reakcie na buprenorfín sú bolesť hlavy, nauzeaa, hyperhidróza,
nespavosť, abstinenčný syndróm a bolesť.
Súhrn nežiaducichreakciívtabuľke
V tabuľke 3 sú uvedené nežiaduce reakcie hlásené u buprenorfínu vrátane Buvidalu. Používajú sa
nasledujúce výrazy a frekvencie: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1000
až <1/100), neznáme (z dostupných údajov).
Tabuľka č. 3. Nežiaduce reakcie uvedené podľa orgánových systémov
T
r
ieda orgánových systémov
Veľmi časté Časté Menej časté Neznáme
I
nfekcie a nákazy Infekcia Chrípka Zápal hltanu
Nádcha
Celulitída v mieste vpichu
Poruchy krvi a lymfatického systému
Poruchy imunitného systému
Poruchy metabolizmu a výživy
Lymfadenopatia
Precitlivenosť
Znížená chuť do jedla
 Psychické poruchy
Psychické poruchy Nespavosť Úzkosť Agitácia Depresia Nepriateľstvo Nervozita Abnormálne myslenie Paranoja
Závislosť od liečby
Halucinácie
Euforická nálada
T
abuľka č. 3. Nežiaduce reakcie uvedené podľa orgánových systémov
T
r
ieda orgánových systémov
Poruchy nervového systému
Veľmi časté Časté Menej časté Neznáme
Bolesť hlavy Ospalosť Závrat Migréna Parestézia Synkopa Tras Hypertónia Poruchy reči
Poruchy oka Porucha slzenia Rozšírenie zreníc očí Mióza
Poruchy ucha a labyrintu
Vertigo
Poruchy srdca a
s
rdcovej činnosti
Palpitácie
Poruchy ciev Vazodilatácia
Hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest
Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest Poruchy reprodukčného systému a prsníkov
Kašeľ Dýchavičnosť Zívanie
Astma
Bronchitída
Nevoľnosť Zápcha Vracanie Bolesť brucha Nadúvanie Dyspepsia Sucho v ústach Hnačka
Poruchy
gastrointestinálneho traktu
Vyrážka Svrbenie Žihľavka Bolesti kĺbov Bolesti chrbta Bolesť svalov Svalové kŕče Bolesť krku Bolesti kostí
Dysmenorea
Zvýšená hodnota alanínaminotransf erázy
Zvýšená hodnota aspartátaminotran sferázy
Zvýšené hladiny pečeňových enzýmov
Makulárna vyrážka
Erytém
Retencia moču
 Celkové poruchy a reakcie v mieste podania
Celkové poruchy a reakcie v mieste podania
Hyperhidróza Abstinenčné príznaky
Bolesť v mieste vpichu injekcie Svrbenie v mieste
Zápal v mieste vpichu injekcie Podliatina v
T
abuľka č. 3. Nežiaduce reakcie uvedené podľa orgánových systémov
T
r
ieda orgánových systémov
Veľmi časté Časté Menej časté Neznáme
L
a
boratórne a funkčné vyšetrenia Úrazy, otravy a komplikácie
liečebného postupu
Bolesť vpichu injekcie
Erytém v mieste vpichu injekcie Opuch v mieste vpichu injekcie Reakcie v mieste vpichu injekcie Stvrdnutie v mieste vpichu injekcie Zdurenie v mieste vpichu injekcie Periférny edém Asténia
Celková nevoľnosť
Horúčka
Zimnica
Abstinenčný syndróm u novorodencov Bolesť v hrudníku Abnormálne
výsledky testov
funkcie pečene
mieste vpichu
injekcie
Urtikária v mieste vpichu injekcie
Procedurálny závrat
 Popis vybraných nežiaducich reakcií
Reakcie v mieste vpichu injekcie
Popis vybraných nežiaducich reakcií
Reakcie v mieste vpichu injekcie
V dvojito zaslepenom skúšaní účinnosti fázy 3 boli nežiaduce reakcie súvisiace s miestom vpichu injekcie pozorované u 36 (16,9 %) z 213 pacientov (5 % podaných injekcií) v skupine liečenej Buvidalom. Najčastejšie nežiaduce reakcie boli bolesť v mieste vpichu injekcie (8,9 %), pruritus v mieste vpichu injekcie (6,1 %) a erytém v mieste vpichu injekcie (4,7 %). Všetky reakcie v mieste vpichu boli mierne alebo stredne závažné a väčšina prípadov bola prechodná.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieSymptómyÚtlm dýchania v dôsledku útlmu centrálnej nervovej sústavy je hlavným symptómom vyžadujúcim si
zásah v prípade predávkovania buprenorfínom, pretože môže viesť k zástave dýchania a smrti. Medzi
počiatočné príznaky predávkovania môže patriť tiež nadmerné potenie, ospalosť, tupozrakosť, mióza, hypotenzia, nevoľnosť, vracanie a/alebo poruchy reči.
LiečbaMali by sa zaviesť všeobecné podporné opatrenia, vrátane starostlivého monitorovania respiračnej
funkcie a funkcie srdca u pacienta. Treba nasadiť symptomatickú liečbu útlmu dýchania podľa štandardných opatrení intenzívnej starostlivosti. Musia sa zabezpečiť voľné dýchacie cesty pacienta a
asistované alebo kontrolované dýchanie. Pacient by mal byť presunutý do prostredia, v ktorom je k dispozícii kompletné vybavenie pre resuscitáciu. Ak pacient vracia, treba prijať opatrenia, aby nedošlo
k vdýchnutiu. Odporúča sa použitie antagonistu opioidov (napr. naloxónu) aj napriek malému efektu, ktorý môže mať na zvrátenie respiračných symptómov buprenorfínu v porovnaní s účinkami na opioidy s plne agonistickým účinkom.
Pri stanovení dĺžky liečby treba vziať do úvahy dlhé trvanie účinkov buprenorfínu a Buvidalu
s predĺženým uvoľňovaním, aby sa predišlo účinkom predávkovania (pozri časť 4.4). Naloxón môže byť odstránený rýchlejšie ako buprenorfín, čo umožňuje návrat k predtým kontrolovaným symptómom predávkovania buprenorfínom.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Iné liečivá na centrálnu nervovú sústavu, liečivá na terapiuzávislostí od
opioidov, ATC kód: N07BC01
Mechanizmus účinku
Buprenorfín je opioidný čiastočný agonista/antagonista, ktorý sa viaže na opioidné receptory v mozgu
μ (mí) a κ (kappa). Jeho aktivita v opioidnej udržiavacej liečbe sa vysvetľuje pomalým reverzibilným uvoľňovaním jeho väzby na μ-opioidné receptory, ktoré počas dlhej doby môžu minimalizovať potrebu nezákonných opioidov u pacientov závislých od opioidov.
Efekt stropu opioidných agonistov bol pozorovaný v priebehu klinických farmakologických štúdií u osôb závislých na opioidoch.
Klinická účinnosť
Účinnosť a bezpečnosť Buvidalu pri liečbe závislosti od opioidov bola stanovená v pivotnej
randomizovanej, dvojito zaslepenej, dvojito maskovanej štúdii fázy 3 s aktívne kontrolovanou flexibilnou dávkou u pacientov so stredne ťažkou až ťažkou závislosťou od opioidov. V tejto štúdii bolo 428 pacientov randomizovaných do jednej z dvoch liečebných skupín. Pacienti v skupine s Buvidalom (n = 213) dostávali počas prvých 12 týždňov týždenné injekcie (16 mg až 32 mg), po ktorých nasledovali mesačné injekcie (64 mg až 160 mg) počas posledných 12 týždňov a denné dávky sublingválnych tabliet placeba počas celého obdobia liečby. Pacienti v skupine so sublingválne podávaným buprenorfínom/naloxónom (n = 215) dostávali počas prvých 12 týždňov týždenné a počas posledných 12 týždňov mesačné injekcie placeba plus denné sublingválne tablety buprenorfínu/naloxónu počas celého obdobia liečby (8 mg až 24 mg počas prvých 12 týždňov a 8 mg až 32 mg počas posledných 12 týždňov). Počas 12 týždňov s mesačnými injekciami pacienti v oboch skupinách mohli v prípade potreby dostať jednu ďalšiu týždennú dávku Buvidalu 8 mg na mesiac. Pacienti sa zúčastnili 12 týždňových návštev počas prvých 12 týždňov a 6 návštev počas posledných
12 týždňov (3 plánované mesačné návštevy a 3 náhodné návštevy na analýzu toxikológie moču). Pri každej návšteve sa hodnotili meradlá výslednej účinnosti a bezpečnosti.
Z 428 randomizovaných pacientov ukončilo 24-týždňové obdobie liečby 69,0 % (147/213) pacientov
v skupine liečenej Buvidalom a 72,6 % (156/215) pacientov v sublingválnej skupine liečenej
buprenorfínom/naloxónom.
Štúdia splnila primárny koncový ukazovateľ non-inferiority v priemernom percentuálnom zastúpení vzoriek moču negatívnych na nedovolené opioidy počas 1. až 24. týždňa liečby pre skupinu
s Buvidalom v porovnaní s sublingválnymi skupinami buprenorfínu/naloxónu (tabuľka č. 4).
V porovnaní so sublingválnym buprenorfínom/naloxónom (vopred špecifikované poradie testov) bola v priebehu 4. až 24. týždňa liečby (tabuľka č. 4) splnená superiorita Buvidalu pre sekundárny ukazovateľ kumulatívnej distribučnej funkcie (cumulative distribution function, CDF) pre percentuálny podiel opioidne negatívnych vzoriek moču.
T
abuľka č. 4. Premenné účinnosti v pivotnej, randomizovanej, dvojito zaslepenej, dvojito maskovanej, aktívne kontrolovanej štúdie fázy 3 s flexibilnou dávkou u pacientov so stredne ťažkou až ťažkou závislosťou od opioidov
L
i
ečebný
P
r
emenná účinnosti Štatistika Buvidal SL BPN/NX
N 213 215
rozdiel (%) a
(95 % IS)
p-
hodnota
P
e
rcento vzoriek moču negatívnych na nedovolené opioidy
LS priemer (%) (SE)
35,1 (2,48) 28,4 (2,47) 6,7 <0,001
CD
F percentuálneho podielu vzoriek moču negatívnych na nedovolené opioidy v 4. – 24. týždni
95 % IS 30,3 – 40,0 23,5 – 33,3 -0,1 – 13,6
N 213 215
Medián 26,7 6,7 - 0,008b

CDF = kumulatívna distribučná funkcia, IS = interval spoľahlivosti, LS = najmenšie štvorce; SE =
štandardná chyba, SL BPN/NX = sublingválny buprenorfín/naloxón
a Rozdiel = Buvidal – SL BPN/NX.
b p-hodnota bola pre superioritu
Uskutočnila sa dlhodobá nezaslepená štúdia bezpečnosti fázy 3 s flexibilným dávkovaním týždenného a mesačného Buvidalu počas 48 týždňov. Štúdia zahŕňala celkovo 227 pacientov so stredne ťažkou až ťažkou závislosťou od opioidov, z ktorých 190 pacientov prešlo zo sublingválneho buprenorfínu (s naloxónom alebo bez naloxónu) a 37 pacientov bolo novo liečených buprenorfínom. Počas 48- týždňovej liečby mohli pacienti podľa klinického úsudku lekára meniť medzi týždennými a
mesačnými injekciami Buvidalu a rôzne dávky (8 mg až 32 mg Buvidalu týždenne a 64 mg až 160 mg
Buvidalu mesačne).
U pacientov, ktorí prešli zo sublingválneho buprenorfínu, bolo percento pacientov so vzorkami moču negatívnymi na nelegálne opioidy 78,8 % na začiatku liečby a 84,0 % na konci 48-týždňovej liečby. U pacientov, pre ktorých bola liečba nová, bolo percento pacientov so vzorkami moču negatívnymi na nedovolené opioidy 0,0 % na začiatku liečby a 63,0 % na konci 48-týždňovej liečby. Celkovo 156 pacientov (68,7 %) dokončilo 48-týždňovú liečbu.
5.2 Farmakokinetické vlastnostiMesačný BuvidalAbsorpciaPo injekcii sa plazmatická koncentrácia buprenorfínu zvyšuje s mediánom t max 6 – 10 hodín. Buvidal
má úplnú absolútnu biologickú dostupnosť. Stabilizovaná expozícia sa dosiahne v štvrtej mesačnej
dávke.
Zvýšenie expozície závisí od dávky v dávkovacom intervale od 64 mg do 128 mg.
DistribúciaZrejmý objem distribúcie buprenorfínu je približne 1 900 l. Buprenorfín sa približne na 96 % viaže na
bielkoviny, primárne na alfa a beta-globulín.
Biotransformácia a elimináciaBuprenorfín je oxidačne metabolizovaný prostredníctvom 14-N-dealkylácie na N-desalkyl-buprenorfín
(tiež známy ako norbuprenorfín) prostredníctvom cytochrómu P450 CYP3A4 a glukurokonjugáciou
materskej molekuly a dealkylovaného metabolitu. Norbuprenorfín je μ-opioidný agonista so slabou
vlastnou aktivitou.
Subkutánne podávanie Buvidalu vedie k významne nižším koncentráciám norbuprenorfínu v plazme v porovnaní s podávaním sublingválneho buprenorfínu v dôsledku zabránenia metabolizmu pri prvom prechode.
Eliminácia buprenorfínu z Buvidalu je obmedzená rýchlosťou uvoľňovania s terminálnym polčasom v
rozmedzí od 19 do 25 dní.
Buprenorfín sa eliminuje hlavne stolicou, žlčovým vylučovaním glukurokonjugovaných metabolitov
(70 %), zvyšok sa eliminuje močom. Celkový klírens buprenorfínu je približne 68 l/h.
Špeciálne populácie
Staršie osoby
Farmakokinetické údaje u starších pacientov (> 65 rokov) nie sú k dispozícii.
Porucha funkcie obličiek
Eliminácia obličkami hrá relatívne malú úlohu (≈ 30 %) v celkovom klírense buprenorfínu. Úprava dávkovania na základe funkcie obličiek sa nevyžaduje, ale odporúča sa opatrnosť pri dávkovaní u pacientov so závažnou poruchou funkcie obličiek (pozri časti 4.2 a 4.4).
Porucha funkcie pečene
V tabuľke 5 sú zhrnuté výsledky z klinickej štúdie, v ktorej sa stanovila expozícia buprenorfínu po dávke sublingválnej tablety buprenorfínu/naloxónu 2,0/0,5 mg u zdravých účastníkov a u účastníkov s rôznym stupňom poruchy funkcie pečene.
Tabuľka č. 5. Vplyv poruchy funkcie pečene (zmena vzhľadom na zdravých účastníkov) na farmakokinetické parametre buprenorfínu po podaní sublingválneho buprenorfínu/naloxónu (2,0/0,5 mg) u zdravých účastníkov a u účastníkov s rôznymi stupňami poruchy funkcie pečene
F
armakokinetický parameter
B
uprenorfín
Mi
e
r
na porucha funkcie pečene (Childova-Pughova trieda A)
(
n = 9)
Stredne ťažká porucha funkcie pečene
(
C
hildova-Pughova trieda
B
)
(
n = 8)
Z
ávažná porucha funkcie pečene (Childova-Pughova trieda C)
(
n = 8)
Cmax 1,2-násobný nárast 1,1-násobný nárast 1,7-násobný nárast
AUCposl. Podobná ako kontrolné hodnoty
1,6-násobný nárast 2,8-násobný nárast

Celkovo sa plazmatická expozícia buprenorfínu zvýšila približne 3-násobne u jedincov so závažne
poškodenou funkciou pečene (pozri časti 4.2, 4.3 a 4.4).
Pediatrická populáciaFarmakokinetické údaje u pediatrických pacientov (mladších ako 18 rokov) nie sú k dispozícii. Údaje zo simulácie expozície buprenorfínu u dospievajúcich vo veku 16 rokov preukazujú nižšie hodnoty Cmax a AUC v porovnaní s pozorovanými hodnotami u dospelých pri týždennom a mesačnom Buvidale.
5.3 Predklinické údaje o bezpečnosti
Akútna toxicita buprenorfínu bola stanovená u myší a potkanov po perorálnom a parenterálnom (intravenóznom, intraperitoneálnom) podaní. Nežiaduce účinky boli založené na známej farmakologickej aktivite buprenorfínu.
Buprenorfín vykazoval nízku tkanivovú a biochemickú toxicitu, keď sa podával beaglom subkutánne jeden mesiac, makakom rhesus perorálne počas jedného mesiaca a potkanom a paviánom intramuskulárne počas šiestich mesiacov.
Štúdie teratológie a reprodukčnej toxicity na potkanoch a králikoch intramuskulárnym podaním viedli k záveru, že buprenorfín nie je embryotoxický ani teratogénny a nemá výrazný vplyv na potenciál odstavenia. U potkanov nedošlo k žiadnym nežiaducim účinkom na plodnosť všeobecných reprodukčných funkcií.
Štúdie chronickej toxicity nosiča používaného pre Buvidal u potkanov a psov neodhalili žiadne
osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Buvidal 64 mg, 96 mg, 128 mg
Sójový fosfatidylcholín
Glycerol dioleát
N-metylpyrolidón
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
18 mesiacov.
6.4 Špeciálne upozornenia na uchovávanie
Neuchovávajte v chladničke alebo mrazničke.
6.5 Druh obalu a obsah balenia
1 ml naplnená injekčná striekačka (sklenená, typ I) s piestovou zátkou (brómbutylová guma pokrytá fluoropolymérom) s ihlou (½ palca, 23 G, 12 mm) a kryt ihly (styrén-butadiénový kaučuk). Naplnená injekčná striekačka je nasadená v bezpečnostnom zariadení na zabránenie pichnutia ihlou po injekčnej aplikácii. Kryt ihly bezpečnostnej striekačky môže obsahovať gumový latex, ktorý môže spôsobiť alergické reakcie u osôb citlivých na latex.
Veľkosti balenia:
Balenie obsahuje 1 naplnenú injekčnú striekačku s uzáverom, ihlou, krytom ihly, bezpečnostným
zariadením a 1 piestom.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
D
ôležitá informácia
• Podanie sa má vykonať do podkožného tkaniva.
• Musí sa zabrániť intravaskulárnemu, intramuskulárnemu a intradermálnemu podaniu.
• Nesmie sa používať, ak je bezpečnostná striekačka zlomená alebo je poškodený obal.
• Kryt ihly striekačky môže obsahovať gumový latex, ktorý môže spôsobiť alergické reakcie u
osôb citlivých na latex.
• S bezpečnostnou striekačkou manipulujte opatrne, aby ste zabránili pichnutiu ihlou.
Bezpečnostná striekačka obsahuje bezpečnostné zariadenie na ochranu ihly, ktoré sa aktivuje na konci injekcie. Neodkrývajte bezpečnostnú striekačku, kým nie ste pripravení na jej podanie. Keď je odkrytá, nikdy sa nepokúšajte znova nasadiť ihlu.
• Po použití bezpečnú striekačku ihneď zlikvidujte. Bezpečnostnú striekačku nepoužívajte
opakovane.
Pred podanímČasti bezpečnostnej striekačky:
O
brázok
č. 1:
Be
z
pečnostná striekačka: Pred
použitím
a) kryt ihly, b) ochranné telo striekačky, c) krídla striekačky, d) piest,
e) hlava piestu
B
ezpečnostná striekačka: Po použití (s aktivovaným mechanizmom na ochranu ihly)
U
pozorňujeme, že najmenší objem injekcie je sotva viditeľný v zobrazovacom okienku,
pretože pružina bezpečnostného zariadenia „prekrýva“ časť skleneného valca blízko ihly.
Podávanie (pozri aj časť 4.2)
- Vytiahnite injekčnú striekačku zo škatuľky: vytiahnite injekčnú striekačku za ochranné telo
striekačky.
- Kým budete držať injekčnú striekačku za kryt ihly vložte piest do zátky piestu jemným otáčaním piestu v smere hodinových ručičiek, až kým sa nezaistí (pozri obrázok č. 2).
 O
brázok č. 2: Pred Po
O
brázok č. 2: Pred Po
- Bezpečnostnú striekačku dôkladne skontrolujte:
- Nepoužívajte bezpečnostnú striekačku po dátume exspirácie uvedenom na škatuli alebo na štítku striekačky.
- Môžete vidieť malú vzduchovú bublinu, ktorá je normálna.
- Tekutina by mala byť číra. Nepoužívajte bezpečnostnú striekačku, ak kvapalina obsahuje viditeľné čiastočky alebo je zakalená.
- Vyberte miesto podania injekcie. Miesto podania by sa malo meniť a podávať striedavo v oblasti zadku, stehna, brucha alebo hornej časti ramena (pozri obrázok č. 3) minimálne 8 týždňov pred opätovným podaním na to isté miesto injekcie. Mali by ste sa vyhnúť injekcii v oblasti pásu alebo do vzdialenosti 5 cm od pupka.
Obrázok č. 3:- Oblečte si rukavice a očistite miesto vpichu kruhovým pohybom pomocou tampónu namočeného v etanole (nie je súčasťou balenia). Pred podaním injekcie sa vyčisteného miesta už nedotýkajte.
- Pridržte bezpečnostnú striekačku za telo ochrannej striekačky tak, ako je to znázornené (pozri obrázok č. 4), a opatrne vytiahnite kryt ihly. Kryt ihly okamžite zlikvidujte (nikdy sa nepokúšajte znovu zatvoriť ihlu). Na konci ihly môžete spozorovať kvapku roztoku. To je normálne.
 O
brázok č. 4:
O
brázok č. 4:
- Pevne stlačte kožu medzi palcom a ukazovákom, ako je to znázornené (pozri obrázok č. 5).
- Držte bezpečnostnú striekačku podľa obrázka a hladko zasuňte ihlu pod uhlom približne 90° (pozri obrázok č. 5). Zatlačte ihlu úplne dovnútra.
Obrázok č. 5:- Zatlačte injekčnú striekačku tak, ako je znázornené (pozri obrázok č. 6), pomaly stlačte piest, až kým hlava piesta nezapadne medzi ochranné krídla striekačky a všetok roztok sa nevstrekne.
Obrázok č. 6:- Jemne vytiahnite ihlu z kože. Odporúča sa, aby bol piest úplne stlačený, kým sa ihla opatrne zdvihne priamo z miesta vpichu (pozri obrázok č. 7).
 O
brázok č. 7:
O
brázok č. 7:
- Ihneď po úplnom vybratí ihly z kože pomaly odložte palec z piestu a nechajte kryt striekačky automaticky zakryť exponovanú ihlu (pozri obrázok č. 8). V mieste vpichu sa môže objaviť malé množstvo krvi. Ak je to potrebné, utrite ho vatovou guľôčkou alebo gázou.
Obrázok č. 8:Likvidácia striekačkyVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIICamurus AB
Ideon Science Park
SE-223 70 Lund, Švédsko
Telefónne číslo: +800 2577 2577
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)Buvidal injekčný roztok s predĺženým uvoľňovaním (mesačne)
EU/1/18/1336/005 [64 mg buprenorfínu/0,18 ml] EU/1/18/1336/006 [96 mg buprenorfínu/0,27 ml]
EU/1/18/1336/007 [128 mg buprenorfínu/0,36 ml]
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.