fo/Spc/13886_files/image001.png" />
1. Ochranný uzáver
2. Náustok
3. Telo
4. Tlačidlo na prepichovanie kapsuly
5. Stredová komora
1. Vytiahnite ochranný uzáver smerom nahor.

2. Držte pevne telo inhalátora a otvorte náustok smerom nahor, v smere šípky ho otvoríte.

3. Vyberte kapsulu Braltus z fľaše bezprostredne pred použitím a tesne zatvorte fľašu. Umiestnite jednu kapsulu do strednej priehradky v spodnej časti inhalátora.
Neskladujte kapsulu v inhalatóre Zonda.

4.
NIKDY nevkladajte kapsulu priamo do náustku, aby sa predišlo riziku udusenia
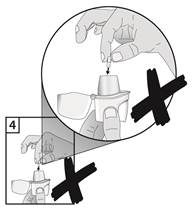
5. Pevne zatvorte náustok pokiaľ nebudete počuť kliknutie, ochranný uzáver nechajte otvorený.

6. Držte inhalátor s náustkom smerom nahor a raz úplne stlačte tlačidlo na prepichovanie kapsuly. Uvoľnite tlačidlo. Týmto sa prepichne kapsula a umožní sa uvoľnenie potrebného liečiva, keď pacient vdychuje.

7. Úplne vydýchnite. Je dôležité, aby ste to vykonali vždy dostatočne ďaleko od náustku. Vždy sa vyvarujte vydýchnutia do náustku.

8. Umiestnite náustok do úst a držte hlavu vo vzpriamenej polohe. Zovrite pery okolo náustku a vdychujte pomaly a zhlboka s takou intenzitou, aby ste počuli alebo cítili kapsulu vibrovať v strednej priehradke.
Zadržte dych tak dlho, pokiaľ vám to nie je nepríjemné, a počas toho vytiahnite inhalátor z úst. Začnite potom normálne dýchať. Opakujte kroky 7 a 8 až kým sa kapsula úplne vyprázdni.

9. Po použití otvorte opäť náustok a vyklopte prázdnu kapsulu. Zatvorte náustok a ochranný uzáver a uložte inhalátor Zonda.
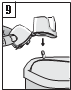
Braltus kapsuly obsahujú len malé množstvo prášku, takže kapsuly sú naplnené iba čiastočne.
Ak je to potrebné, môže pacient po použití utrieť náustok inhalátora Zonda suchou handričkou alebo utierkou.
4.3 KontraindikáciePrecitlivenosť na tiotropiumbromid, atropín alebo jeho deriváty, napr. ipratropium alebo oxitropium alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1, vrátane monohydrátu laktózy, ktorá obsahuje mliečny proteín.
4.4 Osobitné upozornenia a opatrenia pri používaníTiotropiumbromid, ako raz denne dávkované udržiavacie bronchodilatans, sa nemá používať na úvodnú liečbu akútnych záchvatov bronchospazmu, t.j. ako záchranná liečba.
Po podaní inhalačného prášku tiotropiumbromidu sa môžu vyskytnúť okamžité reakcie precitlivenosti.
Pre jeho anticholinergickú aktivitu sa má tiotropiumbromid používať s opatrnosťou u pacientov s glaukómom s úzkym uhlom, hyperpláziou prostaty alebo obštrukciou hrdla močového mechúra (pozri časť 4.8).
Rovnako ako u iných inhalačných prípravkov sa môže vyskytnúť paradoxný bronchospazmus s okamžitým zvýšením sipotu a dýchavičnosti po podaní. Paradoxný bronchospazmus reaguje na rýchlo pôsobiace bronchodilatanciá a mali by byť podané ihneď. Liečba Braltusom 10 mikrogramov by mala byť okamžite prerušená, posúdená a v prípade potreby zavedená alternatívna terapia.
Tiotropium by mal byť používaný s opatrnosťou u pacientov s nedávnym infarktom myokardu < 6 mesiacov; nestabilnou alebo život ohrozujúcou srdcovou arytmiou alebo srdcovou arytmiou vyžadujúcou zásah alebo zmenu farmakoterapie v minulom roku; hospitalizáciou pre srdcové zlyhanie (NYHA trieda III alebo IV) v uplynulom roku.
Títo pacienti boli vylúčení z klinických štúdií a tieto podmienky môžu ovplyvniť anticholinergný účinok.
Keďže pri zníženej renálnej funkcii stúpa plazmatická koncentrácia, u pacientov so stredne ťažkou až ťažkou poruchou funkcie obličiek (klírens kreatinínu ≤ ako 50 ml/min) sa tiotropiumbromid podáva len ak očakávaný prínos prevyšuje potenciálne riziko.
U pacientov s ťažkou poruchou funkcie obličiek nie sú dlhodobé skúsenosti (pozri časť 5.2).
Pacienti si majú dávať pozor, aby im prášok nevnikol do očí. Majú byť poučení, že to môže spôsobiť precipitáciu alebo zhoršenie glaukómu s úzkym uhlom, bolesť alebo nepohodu v očiach, prechodné rozmazané videnie, videnie kruhov alebo farebných obrazcov v spojení s červenými očami z prekrvenia spojiviek a edému rohovky. Ak sa objaví ktorákoľvek kombinácia týchto očných príznakov, pacienti majú prestať užívať tiotropiumbromid a okamžite to konzultovať so špecialistom.
Sucho v ústach, ktoré bolo zaznamenané pri anticholinergickej liečbe, môže pri dlhodobom používaní viesť k zubnému kazu.
Tiotropiumbromid sa nemá užívať častejšie než jedenkrát denne (pozri časť 4.9).
Každá kapsula obsahuje 18 mg monohydrátu laktózy. Pacienti so zriedkavými dedičnými problémami intolerancie galaktózy, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek. Pomocná látka laktóza obsahuje stopové množstvo mliečnej bielkoviny, ktorá môže spôsobiť reakcie u pacientov s ťažkou precitlivenosťou alebo alergiou na mliečnu bielkovinu.
4.5 Liekové a iné interakcie Aj keď sa nevykonali žiadne formálne štúdie interakcií liečiv, inhalačný prášok tiotropiumbromidu sa používa súbežne s inými liekmi bez klinických dôkazov liekových interakcií. Sem patria sympatomimetické bronchodilatátory, metylxantíny, perorálne alebo inhalačné steroidy, ktoré sa vo všeobecnosti používajú na liečbu CHOCHP.
Nebolo zistené, že použitie dlhodobo pôsobiaceho β
2-agonistu (LABA) a inhalačných kortikosteroidov (ICS) má vplyv na zmenu expozície tiotropia.
Súbežné podávanie tiotropiumbromidu s inými liekmi obsahujúcimi anticholinergiká sa neskúmalo, a preto sa neodporúča.
4.6 Fertilita, gravidita a laktáciaFertilitaPre tiotropium nie sú dostupné klinické údaje o fertilite. Predklinická štúdia vykonaná s tiotropiom nepotvrdila žiadne známky nežiaduceho účinku na fertilitu (pozri časť 5.3).
GraviditaJe veľmi málo údajov z použitia tiotropia u tehotných žien. Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky s ohľadom na reprodukčnú toxicitu pri klinicky relevantných dávkach (pozri časť 5.3). Ako preventívne opatrenie je lepšie sa vyhnúť používaniu Braltusu počas tehotenstva.
DojčenieNie je známe, či sa tiotropiumbromid vylučuje do ľudského materského mlieka. Napriek štúdiám na hlodavcoch, ktoré ukázali, že tiotropiumbromid sa vylučuje do materského mlieka len v malých množstvách, sa použitie tiotropiumbromidu počas dojčenia neodporúča. Tiotropiumbromid je dlhodobo pôsobiaca látka. Rozhodnutie o tom, či pokračovať/ukončiť dojčenie alebo pokračovať/ukončiť liečbu Braltusom sa má urobiť po zohľadnení prospechu dojčenia pre dieťa a prospechu liečby Braltusom pre ženu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Výskyt závratov, neostrého videnia alebo bolesti hlavy môže ovplyvňovať schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinkyMnohé z uvedených nežiaducich účinkov môžu byť pripísané anticholinergickým vlastnostiam tiotropiumbromidu.
Frekvencie prideľované nežiaducim účinkom uvedeným nižšie vychádzajú z približnej miery výskytu nežiaducich reakcií lieku (t.j. udalostí pripisovaných tiotropiu), pozorovaných v skupine s tiotropiom (9 647 pacientov), získaných z 28 súhrnných placebom kontrolovaných klinických štúdií s trvaním liečby od štyroch týždňov do štyroch rokov.
Frekvencia je definovaná pomocou nasledovnej konvencie:
Veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až <1/1 000); veľmi zriedkavé (<1/10 000), neznáme ( nemožno odhadnúť z dostupných údajov).
Trieda orgánových systémov/Preferované pomenovanie podľa MedDRA
| Frekvencia
|
Poruchy metabolizmu a výživy
Dehydratácia
|
neznáme
|
Poruchy nervového systému
Závrat
Bolesť hlavy
Poruchy chuti
Insomnia
|
menej časté
menej časté
menej časté
zriedkavé
|
Poruchy oka
Rozmazané videnie
Glaukóm
Zvýšený vnútroočný tlak
|
menej časté
zriedkavé
zriedkavé
|
Poruchy srdca a srdcovej činnosti
Fibrilácia predsiení
Supraventrikulárna tachykardia
Tachykardia
Palpitácie
|
menej časté
zriedkavé
zriedkavé
zriedkavé
|
Poruchy dýchacej sústavy, hrudníka a mediastína
Faryngitída
Dysfónia
Kašeľ
Bronchospazmus
Epistaxa
Laryngitída
Sínusitída
|
menej časté
menej časté
menej časté
zriedkavé
zriedkavé
zriedkavé
zriedkavé
|
Poruchy gastrointestinálneho traktu
Sucho v ústach
Gastroezofageálny reflux
Zápcha
Orofaryngeálna kandidóza
Intestinálne obštrukcie, vrátane paralytického ilea
Gingivitída
Glositída
Dysfágia
Stomatitída
Nauzea
Zubný kaz
|
časté
menej časté
menej časté
menej časté
zriedkavé
zriedkavé
zriedkavé
zriedkavé
zriedkavé
zriedkavé
neznáme
|
Poruchy kože a podkožného tkaniva, poruchy imunitného systému
Vyrážka
Žihľavka
Svrbenie
Precitlivenosť (vrátane okamžitých reakcií)
Angioedém
Anafylaktická reakcia
Infekcia kože, vred na koži
Suchá koža
|
menej časté
zriedkavé
zriedkavé
zriedkavé
zriedkavé
neznáme
neznáme
neznáme
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Opuch kĺbov
|
neznáme
|
Poruchy obličiek a močových ciest
Dyzúria
Retencia moču
Infekcie močových ciest
|
menej časté
menej časté
zriedkavé
|
Alergické reakcie
Pomocná látka laktóza môže obsahovať stopové množstvo mliečnych proteínov, ktoré môžu vyvolať reakcie u pacientov so závažnou precitlivenosťou alebo alergiou na mliečne bielkoviny.
Liečba tiotropiumbromidom by mala byť okamžite prerušená, ak sa vyskytne precitlivenosť alebo alergické reakcie a pacient má byť potom kontrolovaný obvyklým spôsobom.
Paradoxný bronchospazmus
Rovnako ako u iných inhalačných prípravkov sa môže vyskytnúť paradoxný bronchospazmus s okamžitým zvýšením sipotu a dýchavičnosti po podaní. Paradoxný bronchospazmus reaguje na rýchlo pôsobiace bronchodilatanciá a majú byť podané ihneď. Liečba Braltusom 10 mikrogramov má byť okamžite prerušená, posúdená a v prípade potreby zavedená alternatívna terapia.
Popis vybraných nežiaducich reakciíV kontrolovaných klinických štúdiách boli často pozorované anticholinergické nežiaduce účinky, ako je sucho v ústach, ktoré sa vyskytlo približne u 4 % pacientov.
V 28 klinických štúdiách viedlo sucho v ústach k prerušeniu liečby u 18 z 9 647 pacientov liečených tiotropiom (0,2 %).
Závažné nežiaduce účinky súvisiace s anticholinergickými účinkami zahŕňali glaukóm, obstipáciu a intestinálnu obštrukciu vrátane paralytického ilea a retencie moču.
Ďalšia osobitná skupina pacientovSo stúpajúcim vekom sa môže zvýšiť výskyt anticholinergických účinkov.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 PredávkovanieVysoké dávky tiotropiumbromidu môžu viesť k anticholinergickým prejavom a príznakom.
U zdravých dobrovoľníkov sa však nevyskytol žiadny nežiaduci systémový anticholinergický účinok po jednorazovej inhalačnej dávke do 340 mikrogramov tiotropiumbromidu. Navyše sa u zdravých dobrovoľníkov nepozorovali žiadne relevantné nežiaduce účinky, okrem sucha v ústach po 7-dňovej liečbe pri dávkovaní do 170 mikrogramov tiotropiumbromidu. V štúdiách s opakovaným podávaním sa u pacientov s CHOCHP s maximálnou dennou dávkou 43 mikrogramov tiotropiumbromidu dlhšie ako štyri týždne nepozorovali žiadne signifikantné nežiaduce účinky.
Akútna intoxikácia neúmyselným perorálnym užitím kapsúl tiotropiumbromidu je nepravdepodobná z dôvodu nízkej biologickej dostupnosti po perorálnom užití.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Iné inhalačné antiastmatiká, anticholínergiká, ATC kód: R03BB04
Spôsob účinkuTiotropiumbromid je dlhodobo pôsobiaci špecifický antagonista muskarínových receptorov, v klinickej medicíne často nazývaný anticholinergikum. Väzbou na muskarínové receptory hladkého svalstva bronchov tiotropiumbromid inhibuje cholinergické (bronchokonstrikčné) účinky acetylcholínu, uvoľneného z parasympatikových nervových zakončení. Má podobnú afinitu k subtypom muskarínových receptorov M
1 – M
5 . V dýchacích cestách tiotropiumbromid kompetitívne a reverzibilne antagonizuje M
3 receptory, čo má za následok relaxáciu. Účinok je závislý od dávky a trvá dlhšie než 24 hodín. Dlhotrvajúci účinok je spôsobený pravdepodobne veľmi pomalou disociáciou z M
3 receptorov a má preukázateľne významne dlhší polčas disociácie než ipratropium. Tiotropiumbromid, ako N-kvartérne anticholinergikum, je topicky (broncho-) selektívny pri inhalačnom podávaní a vykazuje široký terapeutický rozsah predtým, ako sa prejavia systémové anticholinergické účinky.
Farmakodynamické účinkyBronchodilatácia je prevažne lokálna (v dýchacích cestách), nie systémová. Uvoľňovanie z receptorov M
2 je rýchlejšie ako z receptorov M
3, z čoho sa vo funkčných
in vitro štúdiách vyvodila receptorová selektivita (pri kinetickej kontrole) k subtypu M
3 oproti subtypu M
2. Klinickým korelátorom vysokej účinnosti a pomalého uvoľňovania je významná dlhodobá bronchodilatácia u pacientov s CHOCHP.
Elektrofyziológia srdcaElektrofyziológia: V štúdii zameranej na QT interval zahŕňajúcej 53 zdravých dobrovoľníkov neviedlo podávanie tiotropia v dávke 18 mikrogramov a 54 mikrogramov (t.j. trojnásobok terapeutickej dávky) počas 12 dní k významnému predĺženiu QT intervalu na EKG..
Klinická účinnosť a bezpečnosťKlinický vývojový program pozostával zo štyroch jednoročných a dvoch šesťmesačných randomizovaných, dvojito zaslepených štúdii s 2663 pacientmi (1308 užívalo tiotropiumbromid). Jednoročný program pozostával z dvoch placebom kontrolovaných štúdií a dvoch štúdií s aktívnou kontrolou (ipratropium). Obidve šesťmesačné štúdie boli kontrolované salmeterolom a placebom. Tieto štúdie zahŕňali hodnotenie pľúcnych funkcií a ukazovateľa zdravotného stavu, ako je dyspnoe, exacerbácie a kvalita života v súvislosti so zdravotným stavom.
Pľúcne funkciePodávanie tiotropiumbromidu jedenkrát denne počas 30 minút po podaní prvej dávky prinieslo významné zlepšenie pľúcnych funkcií (expiračný objem počas prvej sekundy pri úsilnom výdychu - FEV
1 a úsilná vitálna kapacita, FVC) trvajúce 24 hodín. Farmakodynamicky rovnovážny stav sa dosiahol počas prvého týždňa s prevažujúcou bronchodilatáciou na tretí deň. Podľa záznamov v pacientskych denníkoch sa ukázalo, že tiotropiumbromid signifikantne zlepšuje rannú a večernú PEFR (peak expiratory flow rate, maximálna výdychová rýchlosť). Bronchodilatačný účinok tiotropiumbromidu sa pozoroval počas jedného roka podávania bez znakov vzniku tolerancie.
Randomizovaná placebom kontrolovaná klinická štúdia so 105 pacientmi s CHOCHP potvrdila
zachovanie bronchodilatácie počas 24 hodinového dávkovacieho intervalu v porovnaní s placebom bez ohľadu na to, či sa liek použil ráno alebo večer.
Klinické štúdie (až 12 mesiacov)
Dýchavičnosť, cvičenie tolerancieTiotropiumbromid signifikantne zlepšil dyspnoe (hodnotené použitím indexu Transition Dyspnoea Index). Toto zlepšenie sa udržalo počas celého obdobia liečby.
Dopad zlepšenia dyspnoe na toleranciu fyzickej záťaže sa skúmal v dvoch randomizovaných, dvojito zaslepených, placebom kontrolovaných štúdiách so 433 pacientmi so stredne ťažkou až ťažkou CHOCHP. V týchto štúdiách, počas bicyklovej ergometrie pri 75 % maximálnej funkčnej záťaže, šesťtýždňová liečba tiotropiumbromidom výrazne predĺžila symptómom limitovaný čas tolerancie fyzickej záťaže o 19,7 % (štúdia A) a 28,3% (štúdia B) v porovnaní s placebom.
Kvalita života súvisiaca s liečbouV 9-mesačnej randomizovanej, dvojito zaslepenej, placebom kontrolovanej klinickej štúdii so 492 pacientmi tiotropiumbromid zlepšil kvalitu života ovplyvnenú zdravotným stavom, meranú celkovým skóre pomocou dotazníka „St. George’s Respiratory Questionnaire“ (SGRQ). Podiel pacientov liečených tiotropiumbromidom, ktorí dosiahli významné zlepšenie v celkovom skóre SGRQ (t. j. > 4 jednotky), bol o 10,9 % vyšší v porovnaní s pacientmi liečenými placebom (59,1 % v skupinách s tiotropiumbromidom v porovnaní so 48,2 % v skupine s placebom (p = 0,029)). Priemerný rozdiel medzi skupinami bol 4,19 jednotiek (p = 0,001; interval spoľahlivosti (CI): 1,69 – 6,68). Zlepšenie podoblastí SGRQ skóre bolo 8,19 jednotiek v podoblasti “symptómy“; 3,91 jednotiek v podoblasti “aktivita” a 3,61 jednotiek v podoblasti “vplyv na každodenný život”. Zlepšenie všetkých jednotlivých podoblastí bolo štatisticky významné.
CHOCHP exacerbáciaV randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii s 1 829 pacientmi so stredne ťažkou až veľmi ťažkou CHOCHP tiotropiumbromid štatisticky významne znížil počet pacientov, u ktorých sa prejavili exacerbácie CHOCHP (z 32,2 % na 27,8 %) a štatisticky významne znížil počet exacerbácií o 19 % (z 1,05 na 0,85 prípadov na jedného pacienta pri jednoročnej liečbe). Navyše 7,0 % pacientov zo skupiny, ktorá dostávala tiotropiumbromid a 9,5 % pacientov zo skupiny, ktorá dostávala placebo, bolo hospitalizovaných z dôvodu exacerbácie CHOCHP (p = 0,056). Počet hospitalizácii z dôvodu CHOCHP sa znížil o 30 % (z 0,25 na 0,18 prípadov na jedného pacienta pri jednoročnej liečbe).
Jednoročná randomizovaná, dvojito zaslepená, dvojito kontrolovaná klinická štúdia s paralelnými skupinami porovnávala účinok liečby 18 mikrogramami tiotropia jedenkrát denne s 50 mikrogramami salmeterolu HFA pMDI dvakrát denne na incidenciu stredne závažnej a závažnej exacerbácie u 7 376 pacientov s CHOCHP a exacerbácie v anamnéze v predchádzajúcom roku.
Tabuľka 1: Súhrn koncového ukazovateľa exacerbácieKoncový ukazovateľ
| Tiotropium 18 mcg inhalačný prášok4
N = 3707
| Salmeterol 50 mcg HFA pMDI
N = 3669
| Pomer
(95% CI)
| p-hodnota
|
Čas [dni] do prvej exacerbácie1
| 187
| 145
| 0,83
(0,77-0,90)
| <0,001
|
Čas do prvej závažnej (s hospitalizáciou) exacerbácie2
| -
| -
| 0,72
(0,61-0,85)
| <0,001
|
Pacienti s ≥ 1 exacerbáciou, n (%)3
| 1277 (34,4)
| 1414 (38,5)
| 0,90
(0,85-0,95)
| <0,001
|
Pacienti s ≥ 1 závažnou (s hospitalizáciou) exacerbáciou, n (%)3
| 262 (7,1)
| 336 (9,2)
| 0,77
(0,66-0,89)
| <0,001
|
1 Čas[dni] sa týka prvého kvartilu pacientov. Čas do analýzy príhody sa vykonal pomocou Coxovho regresného modelu proporcionálnych rizík s centrom a liečbou (spoločne) ako náhodnou veličinou; pomer sa vzťahuje k pomeru rizika.
2 Čas do analýzy príhody sa vykonal pomocou Coxovho regresného modelu proporcionálnych rizík s centrom a liečbou (spoločne) ako náhodnou veličinou; pomer sa vzťahuje k pomeru rizika. Čas[dni] pre prvý kvartil pacientov nemožno vypočítať, pretože podiel pacientov so závažnou exacerbáciou je príliš malý.
3 Počet pacientov s príhodou sa analyzoval pomocou Cochranovho-Mantelovho-Haenszelovho testu stratifikovaného v spoločnom centre; pomer sa vzťahuje k pomeru rizika.
4 Tiotropium 18 mikrogramov inhalačný prášok dodáva 10 mikrogramov tiotropia
V porovnaní so salmeterolom tiotropiumbromid predĺžil čas do prvej exacerbácie (187 dní voči 145 dňom), so 17 % znížením rizika (pomer rizika, 0,83; 95 % interval spoľahlivosti [CI]; 0,77 až 0,90; p <0,001). Tiotropiumbromid predĺžil aj čas do prvej závažnej (s hospitalizáciou) exacerbácie (pomer rizika, 0,72; 95 % CI; 0,61 až 0,85; p <0,001).
Dlhodobé klinické štúdie (viac ako jeden rok, a to až do 4 rokov)V 4-ročnej randomizovanej, dvojito zaslepenej, placebom kontrolovanej klinickej štúdii s 5 993 randomizovanými pacientmi (3 006 pacientov dostávalo placebo a 2 987 dostávalo tiotropiumbromid) tiotropiumbromid v porovnaní s placebom trvalo zlepšoval FEV
1 počas 4 rokov. Vyšší podiel pacientov ukončil ≥ 45 mesačnú liečbu v skupine s tiotropiumbromidom v porovnaní so skupinou s placebom (63,8 % vs 55,4 %, p < 0,001). Medziročný pomer poklesu FEV
1 bol medzi tiotropiumbromidom a placebom podobný. Počas liečby sa o 16 % znížilo riziko úmrtia. Výskyt miery úmrtia v skupine, ktorá dostávala placebo, bolo 4,79 na 100 pacientorokov v porovnaní s 4,10 na 100 pacientorokov v skupine, ktorá dostávala tiotropium (pomer rizika (tiotropium/placebo) = 0,84; 95 % CI = 0,73; 0,97). Liečba tiotropiom znižuje riziko respiračného zlyhania (podľa záznamov hlásených nežiaducich udalostí) o 19 % (2,09 vs 1,68 prípadov na 100 pacientorokov, relatívne riziko (tiotropium/placebo) = 0,81; 95 % CI = 0,65; 0,999).'
Tiotropiom aktívne kontrolované štúdieDlhodobá, rozsiahlo randomizovaná, dvojito zaslepená, liečivom kontrolovaná štúdia so sledovaným obdobím až 3 roky bola vykonaná s cieľom porovnať účinnosť a bezpečnosť tiotropiumbromidu, inhalačný prášok, a tiotropiumbromidu, inhalovaného v podobe jemnej hmly, (5 694 pacientov užívajúcich tiotropiumbromid inhalačný prášok; 5 711 pacientov užívajúcich tiotropiumbromid inhalovaného v podobe jemnej hmly). Primárne koncové ukazovatele boli čas do prvej exacerbácie CHOCHP, doba do celkovej mortality a v sub-štúdii (906 pacientov) „through“ FEV1 (pred dávkou). Čas potrebný k prvej exacerbácii CHOCHP bol numericky podobný v priebehu štúdie s tiotropiumbromidom, inhalačný prášok, a tiotropiumbromidom, inhalovaného v podobe jemnej hmly, (pomer rizika (tiotropiumbromidu inhalačný prášok / tiotropiumbromidu inhalovaného v podobe jemnej hmly) 1,02 s 95% intervalom spoľahlivosti 0,97 až 1,08). Medián počtu dní do prvej exacerbácie CHOCHP bol 719 dní u tiotropiumbromidu, inhalačný prášok, a 756 dní u tiotropiumbromidu, inhalovaného v podobe jemnej hmly.
Bronchodilatačný účinok tiotropiumbromidu, inhalačného prášku, sa udržal počas 120 týždňov, a bol podobný tiotropiumbromidu inhalovaného v podobe jemnej hmly. Priemerný rozdiel v „trough“ (pred podaním dávky) FEV1 pre tiotropiumbromid, inhalačný prášok, v porovnaní s tiotropiumbromidom, inhalovaného v podobe jemnej hmly, bol 0,010 l (95% CI -0,018-0,038 l). V post-marketingovej štúdii, porovnávajúcej tiotropiumbromid, inhalovaný v podobe jemnej hmly, a tiotropiumbromid, inhalačný prášok, na celkovú mortalitu, vrátane vitálneho stavu bol podobný v priebehu štúdie s tiotropiumbromidom, inhalačný prášok, a tiotropiumbromidom, inhalovaného v podobe jemnej hmly, (pomer rizík (tiotropiumbromidu, inhalačný prášok / tiotropiumbromidu, inhalovaného v podobe jemnej hmly) 1,04 s 95% intervalom spoľahlivosti 0,91 až 1,19 s).
Pediatrická populáciaEurópska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií pre tiotropiumbromid vo všetkých vekových podskupinách detí a dospievajúcich pre CHOCHPa cystickú fibrózu (pre informácie o použití u detí a dospievajúcich, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti Tiotropiumbromid je nechirálna kvartérna amónna zlúčenina a je slabo rozpustná vo vode. Tiotropiumbromid sa podáva prostredníctvom inhalácie suchého prášku. Všeobecne sa pri inhalačnej ceste podania väčšina podanej dávky ukladá v gastrointestinálnom trakte a v menšej miere v cieľovom orgáne v pľúcach. Mnohé nižšie popísané farmakokinetické údaje sa získali pri použití vyšších dávok, než ako sú dávky odporúčané na liečbu.
Absorpcia: Po inhalácii suchého prášku mladými zdravými dobrovoľníkmi absolútna biologická dostupnosť 19,5 % poukazuje na to, že podiel dosahujúci pľúca je vysoko biologicky dostupný. Perorálny roztok tiotropia má absolútnu biologickú dostupnosť 2 – 3 %. Maximálne plazmatické koncentrácie tiotropiumbromidu sa dosiahli 5 - 7 minút po inhalácii.
V rovnovážnom stave, maximálne plazmatické koncentrácie tiotropiumbromidu u pacientov s CHOCHP boli 12,9 pg/ml a rýchlo sa znižovali multikompartmentovým spôsobom. Rovnovážny stav minimálnych plazmatických koncentrácií bol 1,71 pg/ml. Systémová expozícia po inhalácii tiotropiumbromidu inhalačného prášku bola podobná ako u tiotropia inhalovaného prostredníctvom jemnej hmly inhalátora.
Distribúcia:Väzba tiotropia na plazmatické bielkoviny je 72 % a dokázaný distribučný objem je 32 l/kg. Lokálne koncentrácie v pľúcach nie sú známe, no spôsob podávania poukazuje na podstatne vyššie koncentrácie v pľúcach. Štúdie na potkanoch ukazujú, že tiotropiumbromid v relevantnom rozmedzí neprechádza hematoencefalickou bariérou.
BiotransformáciaRozsah biotransformácie je malý. Je to zrejmé zo 74 % vylučovania močom nezmenenej látky po intravenóznom podaní u mladých zdravých dobrovoľníkov. Ester tiotropiumbromidu sa neenzymaticky štiepi na alkohol (N-metylskopín) a kyslú zlúčeninu (kyselinu dietylénglykolovú), ktoré sú na muskarínových receptoroch inaktívne.
In-vitro experimenty na mikrozómoch ľudskej pečene a ľudských hepatocytoch poukazujú na to, že určité množstvo liečiva (< 20 % dávky po intravenóznom podaní) sa metabolizuje oxidáciou závislou od cytochrómu P450 (CYP) a následnou konjugáciou s glutatiónom na rôzne metabolity fázy II.
V in vitro štúdiách na pečeňových mikrozómoch sa ukázalo, že enzymatická cesta môže byť inhibovaná inhibítormi CYP 2D6 (a 3A4), chinidínom, ketokonazolom a gestodénom. Teda CYP 2D6 a 3A4 sú zahrnuté do metabolickej cesty zodpovednej za elimináciu malého množstva dávky. Tiotropiumbromid aj pri veľmi vysokých terapeutických koncentráciách neinhibuje CYP 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 alebo 3A v mikrozómoch ľudskej pečene.
ElimináciaEfektívny polčas tiotropia po inhalácii sa pohybuje medzi 27-45 h u CHOCHP pacientov. Celkový klírens bol po intravenóznej dávke u mladých zdravých dobrovoľníkov 880 ml/min. Intravenózne podaný tiotropium je väčšinou nezmenený vylúčený močom (74 %). Po inhalácii suchého prášku CHOCHP pacientom v rovnovážnom stave, je vylučované obličkami 7% (1,3% mikrogramov) nezmeneného lieku po 24 hodinách, zvyšok je prevažne neabsorbované liečivo z čreva, ktoré sa vylučuje stolicou. Renálny klírens tiotropia prevyšuje klírens kreatinínu, čo poukazuje na vylučovanie močom. Po dlhodobej inhalácii jedenkrát denne pacientmi s CHOCHP sa farmakokinetický rovnovážny stav dosiahol od 7. dňa bez kumulácie liečiva.
Linearita/nelinearitaTiotropium vykazuje lineárnu farmakokinetiku v terapeutickom rozsahu nezávislú od formy.
Osobitné skupiny pacientovStarší pacienti: Tak ako sa očakáva pri všetkých prevažne renálne vylučovaných liekoch, v závislosti od veku dochádza k zníženiu renálneho klírensu tiotropia (365 ml/min u pacientov s CHOCHP mladších ako 65 rokov, oproti 271 ml/min u pacientov s CHOCHP vo veku 65 rokov a starších). To nevedie k zodpovedajúcemu zvýšeniu hodnôt AUC
0-6, ss alebo C
max, ss.
Porucha funkcie obličiek: Po inhalačnom podaní tiotropia raz denne do dosiahnutia rovnovážneho stavu u pacientov s CHOCHP viedla mierna porucha funkcie obličiek (CL
CR 50 – 80 ml/min) k mierne vyššej AUC
0-6,ss (o 1,8 – 30 % vyššej) a podobným hodnotám C
max,ss v porovnaní s pacientmi s normálnou funkciou obličiek (CL
CR > 80 ml/min).
.U pacientov s CHOCHP, ktorí majú stredne ťažkú až ťažkú poruchu funkcie obličiek (Cl
CR < 50 ml/min), intravenózne podávanie tiotropia zdvojnásobuje jeho celkovú expozíciu (82 % vyššie AUC
0-4h a o 52% vyššie C
max) v porovnaní s pacientmi s CHOCHP s normálnou funkciou obličiek), čo sa potvrdilo aj pri plazmatických koncentráciách po inhalácii suchého prášku.
Porucha funkcie pečene: Neočakáva sa, že by pečeňová nedostatočnosť mala relevantný vplyv na farmakokinetiku tiotropia. Tiotropium sa eliminuje prevažne renálnou exkréciou (74 % u mladých zdravých dobrovoľníkov) a jednoduchý ester sa neenzymaticky štiepi na farmakokineticky neaktívne látky.
Japonskí CHOCHP pacienti: Vo vzájomnom porovnaní skúšaní, priemerné maximálne plazmatické koncentrácie tiotropia 10 minút po podaní boli v rovnovážnom stave o 20% až 70% vyššie v japonskej populácii v porovnaní s pacientmi bielej rasy s CHOCHP po inhalácii tiotropia, ale nebol žiadny signál pre vyššiu úmrtnosť alebo riziko srdcových príhod u japonských pacientov v porovnaní s belošskými pacientmi. U ostatných etník a rás nie sú k dispozícii dostatočné farmakokinetické údaje.
Deti a dospievajúci: pozri časť 4.2
Vzťah farmakokinetika/farmakodynamikaMedzi farmakokinetikou a farmakodynamikou nie je priamy vzťah.
5.3 Predklinické údaje o bezpečnostiMnohé účinky pozorované v konvenčných štúdiách farmakologickej bezpečnosti, toxicity po opakovanom podávaní a reprodukčnej toxicity možno vysvetliť anticholinergickými vlastnosťami tiotropiumbromidu. Na zvieratách sa spravidla pozorovala znížená spotreba potravy, nižší prírastok telesnej hmotnosti, sucho v ústach a nose, znížená lakrimácia a salivácia, mydriáza a zvýšená srdcová frekvencia. Ďalšie relevantné účinky sledované v štúdiách toxicity po opakovanom podávaní boli: mierne dráždenie dýchacích ciest pri potkanoch a myšiach v zmysle rinitídy a zmien epitelu v nosovej dutine a v hrtane, prostatitída s proteínovými depozitmi a litiáza močového mechúra pri potkanoch.
Škodlivý účinok na graviditu, embryonálny/fetálny vývoj, pôrod alebo postnatálny vývoj sa zistil len po hladinách dávok toxických pre matku. Tiotropiumbromid nebol teratogénny pri potkanoch ani pri králikoch. V štúdii celkovej reprodukcie a fertility na potkanoch sa nezistili známky nežiaducich účinkov na fertilitu alebo párenie pri ktorejkoľvek dávke u liečených rodičov ani u ich potomkov.
Zmeny na respiračnom (iritácia) a urogenitálnom (prostatitída) systéme a reprodukčná toxicita sa zistili po lokálnych aj systémových expozíciách vyšších než päťnásobok terapeutickej expozície. Štúdie zamerané na genotoxicitu a karcinogénny potenciál neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokmonohydrát laktózy (ktorý obsahuje mliečnu bielkovinu)
Kapsuly sa skladajú z hydroxypropylmetylcelulózy (HPMC), bežne známy ako hypromelóza.
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti24 mesiacov
Po prvom otvorení: 30 dní (15 kapsúl vo fľaši) alebo 60 dní (30 kapsúl vo fľaši)
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v dobre uzavretej fľaši. Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
Neuchovávajte v chladničke alebo mrazničke.
6.5 Druh obalu a obsah baleniaFľaše z polyetylénu s vysokou hustotou (HDPE) s polypropylénovým (PP) skrutkovacím uzáverom s poistným krúžkom z polyetylénu (PE) a s vysúšadlom kapsuly z polyetylénu s nízkou hustotou (LDPE) obsahujúcim silica gél.
Každá fľaša obsahuje 15 alebo 30 kapsúl, dodávané v škatuli s inhalátorom Zonda.
Inhalátor Zonda je jednodávkové inhalačné zariadenie so zeleným telom a uzáverom s bielym tlačidlom, vyrobené z plastového materiálu akrylonitrilbutadiénstyrénu (ABS) a nerezovej ocele.
Jedno balenie obsahuje 15 alebo 30 kapsúl a inhalátor Zonda.
Viacnásobné balenie obsahuje buď 60 kapsúl (2 balenia po 30) a 2 inhalátory Zonda alebo 90 kapsúl (3 balenia po 30) a 3 inhalátory Zonda.
Samostatné balenia: 30 kapsúl (fľaša) v škatuli a 1 inhalátor Zonda, zabalený v samostatnej škatuli.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIITEVA Pharmaceuticals Slovakia s.r.o.
Teslova 26
821 02, Bratislava
Slovensko
8. REGISTRAČNÉ ČÍSLO 14/0338/16-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 14. 07. 2016
10. DÁTUM REVÍZIE TEXTUMarec 2020