
/>a pegylovaný interferón alfa-2b) sa hodnotil u pacientov s poruchou funkcie obličiek (pozri časť 5.2). U dospelých pacientov s miernou poruchou funkcie obličiek (GFR 60-89 ml/min) alebo stredne závažnou poruchou funkcie obličiek (GFR 30-59 ml/min) nie je potrebná úprava dávky ropeginterferónu alfa-2b. U pacientov so závažnou poruchou funkcie obličiek (GFR 15-29 ml/min) sa odporúča znížená začiatočná dávka 50 mikrogramov ropeginterferónu alfa-2b. Ropeginterferón alfa-
2b je kontraindikovaný u pacientov s konečným štádiom ochorenia obličiek (GFR <15 ml/min) (pozri
časť 4.3).
Starší pacienti
U starších pacientov nie sú na začiatku liečby nevyhnutné úpravy odporúčanej dávky ropeginterferónu
alfa-2b (pozri časť 5.2).
Obézni pacienti alebo pacienti s podváhou
Farmakokinetický profil ropeginterferónu alfa-2b nebol u obéznych pacientov ani u pacientov
s podváhou stanovený. U týchto pacientov nemožno odporučiť úpravu dávky ropeginterferónu alfa-2b.
Pediatrická populácia
Bezpečnosť a účinnosť Besremi u detí a dospievajúcich neboli stanovené. K dispozícii nie sú žiadne údaje (pozri časť 4.4).
Spôsob podávania
Na subkutánne použitie. Tento liek je určený na dlhodobú liečbu a môže ho podávať lekár, zdravotná sestra, člen rodiny alebo pacient, ak je vyškolený na podávanie subkutánnych injekcií s naplneným perom. Majú sa dodržiavať pokyny na použitie uvedené v písomnej informácii.
Odporúčané miesto vpichu je koža na stehne alebo na bruchu okrem oblasti do 5 cm okolo pupka. Nepodávajte do oblasti, kde je koža podráždená, sčervenená, pomliaždená, infikovaná alebo zjazvená. Pero sa dá upraviť na podávanie dávok v 50 mikrogramových intervaloch v rozmedzí od 50 do
250 mikrogramov alebo 50 až 500 mikrogramov.
4.3 Kontraindikácie
• Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1
• Už existujúce ochorenie štítnej žľazy, pokiaľ nie je kontrolované konvenčnou liečbou
• Závažné psychické ochorenie, či už prebiehajúce alebo v anamnéze, najmä závažná depresia,
samovražedné myšlienky alebo pokus o samovraždu
• Závažné, už existujúce kardiovaskulárne ochorenie (t. j. nekontrolovaná hypertenzia, kongestívne zlyhanie srdca (≥ NYHA trieda 2), závažná srdcová arytmia, signifikantná stenóza koronárnych artérií, nestabilná angina pectoris) alebo nedávna cievna mozgová príhoda alebo infarkt myokardu
• Anamnéza alebo prítomnosť autoimunitného ochorenia
• Príjemcovia transplantátu na imunosupresívnej liečbe
• Kombinácia s telbivudínom (pozri časť 4.5)
• Dekompenzovaná cirhóza pečene (Child-Pugh B alebo C)
• Konečné štádium ochorenia obličiek (GFR <15 ml/min)
4.4 Osobitné upozornenia a opatrenia pri používaní
Fáza s titráciou dávky
Odporúčané dávkovanie ropeginterferónu alfa-2b pre titračkú fázu (pozri časť 4.2) má v porovnaní s hydroxykarbamidom za následok predĺženie dosiahnutia individuálnej optimálnej dávky.
V klinických štúdiách s polycytémiou vera sa koniec priemernej individuálnej titračnej fázy ropeginterferónu alfa-2b dosiahol približne po 3,7 mesiacoch, v prípade hydroxykarbamidu išlo približne o 2,6 mesiaca liečby. Preto sa u pacientov, u ktorých je nutné začiatočné zníženie kvôli zvýšenému krvnému obrazu na prevenciu trombózy a krvácania, môžu preferovať iné produkty (napr. hydroxykarbamid).
Počas titračnej fázy nemusí byť plne vytvorená účinnosť znižovania kardiovaskulárneho
a tromboembolického rizika existujúceho ochorenia. Pacientov je potrebné dôsledne sledovať, najmä počas titračnej fázy. Je potrebné robiť pravidelné úplné krvné obrazy vrátane stanovenia úrovne hematokritu, počtu leukocytov a trombocytov, a to aj po stanovení individuálnej optimálnej dávky. Flebotómia môže byť nevyhnutná ako záchranná liečba na normalizáciu hyperviskozity krvi.
Endokrinný systém
Pred liečbou ropeginterferónom alfa-2b je potrebné liečiť a kontrolovať akékoľvek už existujúce ochorenie štítnej žľazy konvenčnou liečbou (pozri časť 4.3). U pacientov, u ktorých sa počas liečby ropeginterferónom alfa-2b vyvinú príznaky indikujúce dysfunkciu štítnej žľazy, sa majú vyhodnotiť hladiny hormónu stimulujúceho štítnu žľazu (TSH). Ak možno hladiny TSH kontrolovať
v normálnom rozsahu, liečba môže pokračovať.
Diabetes mellitus sapozoroval pri iných liekoch s obsahom interferónu alfa (pozri časť 4.8). Pacienti s touto diagnózou, ktorých nemožno účinne kontrolovať liekmi, nemajú začínať liečbu ropeginterferónom alfa-2b. Pacienti, u ktorých sa počas liečby rozvinie toto ochorenie a nemožno ho liekmi kontrolovať, majú liečbu ropeginterferónom alfa-2b ukončiť.
Centrálny nervový systém (CNS)
Počas klinického vývojového programu sa u niektorých pacientov liečených ropeginterferónom alfa-
2b pozorovali účinky na CNS, najmä depresia (pozri časť 4.8). Ďalšie účinky na CNS vrátane samovražedných myšlienok, pokusu o samovraždu, agresivity, bipolárnej poruchy, mánie a zmätenosti sa pozorovali pri iných liekoch s obsahom interferónu alfa. U pacientov sa majú starostlivo sledovať akékoľvek symptómy psychiatrických porúch a v prípade, že sa takéto príznaky objavia, ošetrujúci lekár má zvážiť liečbu. Ak sa psychiatrické symptómy zhoršia, liečbu ropeginterferónom alfa-2b sa odporúča prerušiť. Ropeginterferón alfa-2b sa nesmie podávať pacientom so závažnými psychiatrickými poruchami, či už prebiehajúce alebo v anamnéze, najmä so závažnou depresiou, samovražednými myšlienkami alebo pokusmi o samovraždu (pozri časť 4.3).
Kardiovaskulárny systém
Liečba interferónom alfa sa spájala so srdcovými príhodami vrátane kardiomyopatie, infarktu myokardu, fibrilácie predsiení a ischemickými poruchami koronárnych artérií (pozri časť 4.8). Pacientov s už existujúcimi kardiovaskulárnymi poruchami alebo s kardiovaskulárnymi poruchami v anamnéze je potrebné počas liečby ropeginterferónom alfa-2b starostlivo sledovať. Tento liek je kontraindikovaný u pacientov so závažným už existujúcim kardiovaskulárnym ochorením alebo
u pacientov, ktorí v nedávnej minulosti prekonali cievnu mozgovú príhodu alebo infarkt myokardu
(pozri časť 4.3).
Dýchacia sústava
Poruchy dýchania, ako je pľúcna infiltrácia, pneumonitída, pneumónia alebo pľúcna arteriálna hypertenzia, sa zriedkavo pozorovali u pacientov liečených interferónom alfa (pozri časť 4.8). Pacientov, u ktorých sa vyvinú respiračné príznaky, je potrebné dôkladne sledovať a ak je to nutné, liečba ropeginterferónom alfa-2b sa má prerušiť.
Zrakový systém
V prípade pacientov liečených interferónom alfa sa zriedkavo pozorovali závažné ochorenia očí, ako je retinopatia, retinálna hemorágia, retinálne exsudáty, odlúčenie sietnice a oklúzia retinálnej artérie alebo žily, ktoré môžu mať za následok oslepnutie (pozri časť 4.8). Pacienti majú pred a počas liečby ropeginterferónom alfa-2b absolvovať očné vyšetrenie, a to najmä tí pacienti, ktorých retinopania je spojená s ochorením, ako je diabetes mellitus alebo hypertenzia. Každý pacient, ktorý zaznamenal zhoršenie alebo stratu zraku alebo mal iné očné príznaky, má ísť okamžite na očné vyšetrenie. Prerušenie liečby ropeginterferónom alfa-2b sa má zvážiť u pacientov, u ktorých sa objavia nové ochorenia očí alebo sa ochorenia očí zhoršia.
Akútna precitlivenosť
Závažné akútne reakcie z precitlivenosti (napr. žihľavka, angioedém, bronchokonstrikcia, anafylaxia) sa zriedkavo pozorovali v súvislosti pri iných liekoch s obsahom interferónu alfa. Ak sa vyskytnú, liečba ropeginterferónom alfa-2b sa musí prerušiť a okamžite sa musí začať vhodná liečba. Prechodné vyrážky si nevyžadujú prerušenie liečby.
Funkcia pečene
Liečba interferónom alfa sa spájala s hepatotoxicitou charakterizovanou potenciálne významným zvýšením pečeňových enzýmov. Zlyhanie pečene u pacientov infikovaných vírusom hepatitídy C sa hlásilo pri iných liekoch s obsahom interferónu alfa (pozri časť 4.8).
U pacientov liečených ropeginterferónom alfa-2b sa pozorovali zvýšenia hladín ALT (≥ 3-násobok horného limitu normálu), AST (≥ 3-násobok horného limitu normálu), GGT (≥ 3-násobok horného limitu normálu) a bilirubínu (> 2-násobok horného limitu normálu). Tieto zvýšenia boli najčastejšie prechodné a vyskytovali sa počas prvého roku liečby.
Ochorenia pečene a abnormálne pečeňové laboratórne parametre sa hlásili u pacientov po dlhodobej
liečbe ropeginterferónom alfa-2b (pozri časť 4.8). Pečeňové enzýmy a funkcia pečene sa majú u pacientov dlhodobo liečených ropeginterferónom alfa-2b pravidelne kontrolovať. Liečbu
ropeginterferónom alfa-2b je potrebné prerušiť, ak je nárast úrovní pečeňových enzýmov napriek zníženiu dávky progresívny a klinicky významný. U pacientov, u ktorých sa počas liečby vyskytli dôkazy hepatálnej dekompenzácie, je potrebné liečbu ropeginterferónom alfa-2b prerušiť. Ropeginterferón alfa-2b je kontraindikovaný u pacientov s dekompenzovanou cirhózou pečene (pozri
časť 4.3).
Funkcia obličiek
Bez ohľadu na začiatočnú dávku alebo stupeň poruchy funkcie obličiek sa majú pacienti sledovať. Ak počas liečby renálna funkcia klesá, liečba ropeginterferónom alfa-2b sa má prerušiť. Ropeginterferón alfa-2b je kontraindikovaný u pacientov s konečným štádiom ochorenia obličiek (pozri časť 4.3).
Zubné a periodontálne choroby
Zubné a periodontálne choroby, ktoré môžu viesť k strate zubov, sa hlásili pri iných liekoch
s obsahom interferónu alfa (pozri časť 4.8). Okrem toho môže mať sucho v ústach počas dlhodobej liečby ropeginterferónom alfa-2b škodlivý účinok na zuby a sliznice ústnej dutiny. Pacienti si majú starostlivo čistiť zuby dvakrát denne a pravidelne absolvovať stomatologické prehliadky.
Ochorenia kože
Použitie ropeginterferónu alfa-2b súvisí s kožnými ochoreniami (pruritus, alopécia, vyrážka, erytém, psoriáza, xeroderma, aknéiformná dermatitída, hyperkeratóza, hyperhidróza). V prípade výskytu alebo zhoršenia týchto kožných ochorení sa musí zvážiť ukončenie liečby.
Pomocné látky
Besremi obsahuje benzylalkohol.
Vysoké množstvá sa majú používať s opatrnosťou a len ak je to nevyhnutné, najmä u osôb s poruchou
funkcie pečene alebo obličiek kvôli riziku akumulácie a toxicity (metabolická acidóza).
Besremi obsahuje menej ako 1 mmol sodíka (23 mg) na ml, t.j. v podstate zanedbateľné množstvo
sodíka.
4.5 Liekové a iné interakcie
Predpokladá sa, že do metabolizmu ropeginterferónu alfa-2b sú zapojené enzýmy proteínového katabolizmu. Účasť transportných proteínov v absorpcii, distribúcii a eliminácii ropeginterferónu alfa-
2b nie je známa. Preukázalo sa, že interferón alfa ovplyvňuje aktivitu izoenzýmov CYP1A2
a CYP2D6 cytochrómu P450 (CYP).
Neuskutočnili sa žiadne interakčné štúdie s ropeginterferónom alfa-2b.
Interakčné štúdie s inými liekmi s obsahom pegylovaného interferónu alfa
Súbežné podávanie pegylovaného interferónu alfa-2a s telbivudínom u pacientov s hepatitídou B zvýšilo riziko vzniku periférnej neuropatie. Kombinovaná liečba s telbivudínom a ropeginterferónom alfa-2b je kontraindikovaná (pozri časť 4.3).
Pri podávaní 180 mikrogramov pegylovaného interferónu alfa-2a raz týždenne počas 4 týždňov
u zdravých mužov sa neprejavili žiadne účinky na farmakokinetické profily mefenytoínu, dapsónu, debrizokvínu a tolbutamidu, čo naznačuje, že pegylovaný interferón alfa-2a nemá vplyv na in vivo metabolickú aktivitu izoenzýmov 3A4, 2C9, 2C19 a 2D6 cytochrómu P450 (CYP). V tej istej štúdii sa pozorovalo 25 % zvýšenie AUC teofylínu (substrát CYP1A2), čo dokazuje, že pegylovaný interferón alfa-2a je inhibítorom aktivity CYP1A2.
Súbežné podávanie pegylovaného interferónu alfa-2b nepreukázalo významnú interakciu
s tolbutamidom (substrátom CYP2C9), midazolamom (substrátom CYP3A4), dapsónom (N- acetyltransferázovým substrátom) a viedlo k miernemu zvýšeniu expozície kofeínu (substrát CYP1A2) a dezipramínu (substrát CYP2D6).
Preto sa musí venovať pozornosť podávaniu ropeginterferónu alfa-2b spolu so substrátmi CYP1A2, a to najmä s tými, ktoré majú úzke terapeutické rozpätie, ako je teofylín alebo metadón. Podobne sa odporúča opatrnosť pri substrátoch CYP2D6 (napr. vortioxetín, risperidón) v kombinácii
s ropeginterferónom alfa-2b. Ropeginterferón alfa-2b môže inhibovať aktivitu CYP1A2 a CYP2D6, a tak zvyšovať koncentrácie týchto liekov v krvi.
Pri súbežnom podávaní s liekmi metabolizovanými prostredníctvom CYP2C9/19, CYP3A4 alebo N- acetyltransferázou nie sú nutné úpravy dávky ropeginterferónu alfa-2b.
Pri podávaní ropeginterferónu alfa-2b v kombinácii s inými potenciálne myelosupresívnymi/chemoterapeutickými látkami je nutná opatrnosť.
Narkotiká, hypnotiká alebo sedatíva sa musia pri súbežnom podávaní s ropeginterferónom alfa-2b
podávať opatrne.
4.6 Fertilita, gravidita a laktácia
Ženy v fertilnom veku/antikoncepcia u žien
Ženy v fertilnom veku musia počas liečby ropeginterferónom alfa-2b používať účinnú antikoncepciu, pokiaľ sa s lekárom nedohodnú inak.
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití interferónu alfa u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). U primátov užívajúcich iné lieky s obsahom interferónu alfa sa hlásil abortívny účinok.
Keďže ropeginterferón alfa-2b môže mať rovnaký účinok, tento liek sa neodporúča používať počas
gravidity.
Dojčenie
Nie je známe, či sa liečivo lieku vylučuje do materského mlieka. Riziko u dojčiat nemôže byť vylúčené. Rozhodnutie, či ukončiť dojčenie alebo či ukončiť/prerušiť liečbu ropeginterferónom alfa-
2b sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Nie sú k dispozícii údaje o účinku liečby ropeginterferónom alfa-2b na fertilitu žien alebo mužov.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Besremi má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti, u ktorých sa počas liečby Besremi vyskytnú závraty, somnolencia alebo halucinácie (pozri časť 4.8), sa majú vyhýbať vedeniu vozidiel alebo obsluhe strojov.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšími nežiaducimi reakciami sú leukopénia (19,1 %), trombocytopénia (18,5 %), artralgia (12,9 %), únava (12.4 %), zvýšená gamaglutamyltransferáza (11,2 %), ochorenie podobné chrípke (10,7 %), myalgia (10,7 %), pyrexia (8,4 %), pruritus (8,4 %), zvýšená alanínaminotransferáza
(8,4 %), anémia (7,9 %), bolesť v končatinách (6,7 %), alopécia (6,7 %), neutropénia (6,7 %), zvýšená aspartátaminotransferáza (6,2 %), bolesť hlavy (6,2 %), hnačka (5,6 %), triaška (5,1 %), závrat (5,1 %) a reakcia v mieste podania injekcie (5,1 %).
Závažné nežiaduce účinky sú depresia (1,1 %), fibrilácia predsiení (1,1 %) a akútna stresová porucha
(0,6 %).
Zoznam nežiaducich reakcií v tabuľkovom formáte
V klinických štúdiách so 178 dospelými pacientmi s polycytémiou vera sa hlásili nasledovné nežiaduce reakcie súvisiace s liečbou ropeginterferónom alfa-2b. Nežiaduce reakcie sú uvedené
v zozname podľa triedy orgánového systému a frekvencie (veľmi časté (≥1/10), časté (≥1/100 až
<1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10
000) alebo neznáme (nie je možné stanoviť z dostupných údajov)).
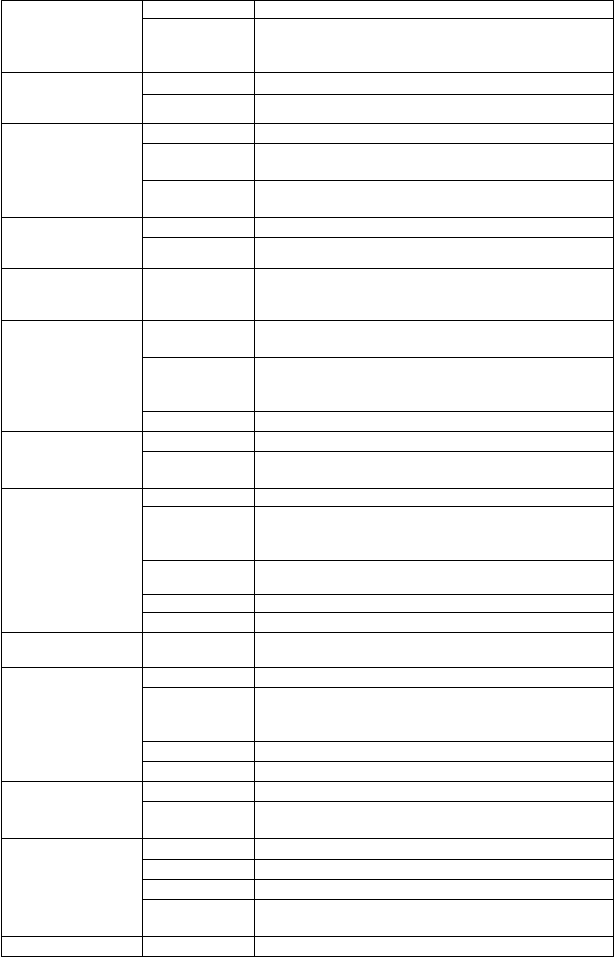
 Trieda orgánového
systému
Frekvencia Nežiaduca reakcia
Trieda orgánového
systému
Frekvencia Nežiaduca reakcia
Infekcie a nákazy časté infekcie dýchacích ciest, rinitída, plesňová kožná infekcia
menej časté orálny herpes, herpes zoster, orálna kandidóza, sinusitída, oesofageálna kandidóza, vulvovaginálna mykotická infekcia, hordeolum, onychomykóza
Poruchy krvi
a lymfatického systému
Poruchy imunitného systému
Poruchy endokrinného systému Poruchy metabolizmu
a výživy
veľmi časté leukopénia, trombocytopénia
časté pancytopénia, neutropénia, anémia
menej časté Basedowova choroba, sarkoidóza
veľmi zriedkavé idiopatická alebo trombotická trombocytopenická purpura#
neznáme Vogtov-Koyanagiho-Haradov syndróm#, akútne reakcie z precitlivenosti#**
časté hypotyreóza, hypertyreóza, tyreoiditída
menej časté diabetes mellitus#
časté hypertriglyceridémia, znížená chuť do jedla
Psychické poruchy časté depresia, agresivita#, insomnia, úzkosť, zmeny nálady, výkyvy nálady, apatia
menej časté pokus o samovraždu#, samovražedné predstavy#, stav zmätenosti#, akútna stresová porucha, halucinácie, emočná úzkosť, nervozita, apatia, nočná mora, podráždenosť
zriedkavé bipolárna porucha#, mánia#
Poruchy nervového systému
časté bolesť hlavy, závrat, hypoestézia, somnolencia, parestézia
menej časté polyneuropatia, periférna motorická neuropatia, radikulopatia, migréna, mentálna porucha, tremor, aura
Poruchy oka časté suché oči
menej časté retinálna hemorágia#, retinálne exsudáty#, porucha videnia, znížená zraková ostrosť, rozmazané videnie, okulárny diskomfort, ekzém očných viečok
zriedkavé retinopatia#, optická neuropatia#, oklúzia retinálnej artérie#, oklúzia retinálnej žily#
veľmi zriedkavé slepota#
neznáme odlúčenie sietnice#
Poruchy ucha a labyrintu Poruchy srdca
a srdcovej činnosti
menej časté hluchota, tinitus, vertigo
časté átriálna fibrilácia
menej časté infarkt myokardu#, átrioventrikulárna blokáda, intrakardiálny trombus, nedovieravosť aortálnej chlopne, kardiovaskulárna porucha
zriedkavé kardiomyopatia#, angina pectoris#
veľmi zriedkavé myokardiálna ischémia#
Poruchy ciev časté mikroangiopatia
menej časté Raynaudov fenomén, hypertenzia, hematóm, návaly
horúčavy
Poruchy dýchacej sústavy, hrudníka a mediastína
časté dyspnoe
menej časté pneumonitída, kašeľ, epistaxis, podráždenie hrdla
veľmi zriedkavé infiltrácia pľúc#
neznáme pulmonárna fibróza#, pneumónia#, pulmonárna arteriálna hypertenzia#*
Poruchy
časté hnačka, nevoľnosť, bolesť brucha, zápcha, abdominálna
gastrointestinálneho traktu
Poruchy pečene
a žlčových ciest
Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
distenzia, sucho v ústach
menej časté gastritída, porucha abdominálnej steny, flatulencia, častá
stolica, odynofágia, krvácanie z ďasien neznáme poruchy zubov#, periodontálne ochorenie# veľmi časté zvýšená hladina gamaglutamyltransferázy
časté porucha pečene, zvýšená hladina alanínaminotrasferázy, zvýšená hladina aspartátaminotransferázy, zvýšená hladina alkalickej fosfatázy v krvi
menej časté hepatotoxicita, toxická hepatitída, hepatomegália
zriedkavé zlyhanie pečene#
časté pruritus, alopécia, vyrážka, erytém, psoriáza, xeroderma, akneiformná dermatitída, hyperkeratóza, hyperhidróza, suchá koža
menej časté fotosenzitívna reakcia, exfoliácia kože, dystrofia nechtov
neznáme strata pigmentu kože#
veľmi časté artralgia, myalgia
časté Sjögrenov syndróm, artritída, bolesť v končatinách, muskuloskeletálna bolesť, bolesť kostí, svalové spazmy
menej časté svalová slabosť, bolesť šije, bolesť slabín
Poruchy obličiek
a močových ciest Poruchy reprodukčného systému a prsníkov Celkové poruchy
a reakcie v mieste
podania
Laboratórne
a funkčné vyšetrenia
menej časté hemoragická cystitída, dysúria, urgentné močenie,
retencia moču
menej časté erektilná dysfunkcia, hematospermia
veľmi časté ochorenie podobné chrípke, únava
časté pyrexia, reakcia v mieste podania injekcie, asténia, triaška, celkové zhoršenie fyzického zdravotného stavu, erytém v mieste podania injekcie
menej časté bolesť v mieste podania injekcie, pruritus v mieste
podania injekcia, precitlivenosť na zmeny počasia
neznáme hyperpigmentácia jazyka#
časté prítomnosť protilátok proti štítnej žľaze, zvýšená hladina tyreostimulačného hormónu, zvýšenie telesnej teploty, pozitívne antinukleárne protilátky, zvýšená hladina laktátdehydrogenázy v krvi
menej časté zvýšený počet trombocytov, zvýšená hladina kyseliny močovej v krvi, pozitívny Coombsov test, zníženie telesnej hmotnosti
#Hlásené ako nežiaduce reakcie počas liečby inými liekmi s obsahom interferónu alfa.
*Informácie pre triedu liekov s obsahom interferónu, pozri nižšie pľúcna arteriálna hypertenzia.
**napr. urtikária, angioedém, bronchokonstrikcia alebo anafylaxia.
Opis vybraných nežiaducich reakcií
Veľmi časté nežiaduce reakcie
Najčastejšie nežiaduce reakcie (vrátane počtu pacientov, miery incidencie, stupňa závažnosti, potreby prispôsobenia dávky a výsledku) hlásené počas klinického vývojového programu ropeginterferónu alfa-2b sú zhrnuté v tabuľke 1.
Tabuľka 1. Najčastejšie nežiaduce reakcie počas liečby ropeginterferónom alfa-2b.
Klinické štúdie s ropeginterferónom alfa-2b


ADR >10 %
PT N (%) IR
Stupeň intenzity CTCAE ≥3
Znížená dávka
Liek prerušený
Liek
ukončený
Zotavený
(N=178)
N (%) N (%) N (%) N (%) N (%)
Leukopénia 34 (19,1) 27,2 3 (8,8)* 23 (67,6) 7 (20,6) nehl. 33 (97,1)
Trombocytopé nia
33 (18,5) 15,0 4 (12,1)* 13 (39,4) 3 (9,1) 1 (3,0) 31 (94,0)
Artralgia 23 (12,9) 8,5 1 (4,3)* 4 (17,4) 4 (17,4) 2 (8,7) 22 (95,7) Únava 22 (12,4) 10,1 nehl. 3 (13,6) 1 (4,5) 1 (4,5) 21 (95,5)
Ochorenie podobné chrípke
19 (10,7) 6,3 nehl. 3 (15,8) 3 (15,8) nehl. 18 (94,7)
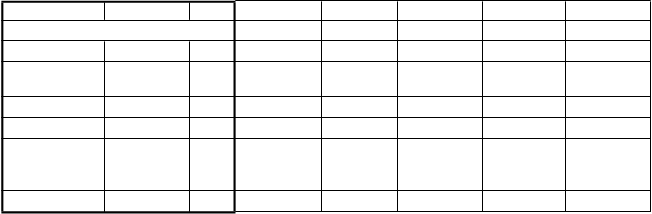
Myalgia 19 (10,7) 6,0 nehl. 6 (31,6) 1 (5,3) nehl. 18 (94,7)
* Nehlásili sa nežiaduce reakcie CTCAE 4. stupňa (život ohrozujúce alebo s trvalými následkami) alebo 5.
stupňa (smrť). Skratky: CTCAE – kritériá spoločnej terminológie pre nežiaduce udalosti (Common Terminology Criteria for Adverse Events), nehl. – nehlásené, ADR – nežiaduce reakcie; PT – preferovaný termín; IR – miera incidencie priemerných nežiaducich udalostí na 100 pacientov za rok; N – počet pacientov.
Gastrointestinálne poruchyGastrointestinálne poruchy sa hlásili pri iných liekoch s obsahom interferónu alfa a hlásili sa u 15,2 %
pacientov liečených ropeginterferónom alfa-2b. Najčastejšie gastrointestinálne poruchy hlásené
v týchto štúdiách boli hnačka (5,1 %; miera incidencie: 2,8 [udalostí/100 pacientov ročne]) a nauzea
(4,5 %, miera incidencie: 1,6 [udalostí/100 pacientov ročne]).
CNSV klinickom vývojovom programe ropeginterferónu alfa-2b sa vyskytli dva prípady závažnej depresie (1,1 %, miera incidencie: 0,4 udalostí/100 pacientov ročne). Po trvalom ukončení liečby týmto liekom sa pacienti úplne zotavili. Jeden pacient, u ktorého sa vyskytla závažná akútna stresová porucha
(0,6 %, miera incidencie: 0,2 udalostí/100 pacientov ročne) so stredne závažnou intenzitou, sa úplne zotavil po znížení dávky ropeginterferónu alfa-2b. Po podaní interferónu alfa sa hlásili účinky na CNS vrátane pokusov o samovraždu, samovražedných myšlienok, agresivity, bipolárnej poruchy, mánie
a zmätenosti (pozri časť 4.4).
Kardiovaskulárny systémPočas liečby ropeginterferónom alfa-2b sa u dvoch pacientov vyskytli tri prípady atriálnej fibrilácie (1,1 %, miera incidencie: 0,5 udalostí/100 pacientov ročne) s intenzitou 1. až 3. stupňa. Liečba ropeginterferónom alfa-2b pokračovala a pacienti dostali vhodné lieky na liečbu týchto udalostí. Pacienti sa z dvoch udalostí zotavili, jedna udalosť v čase hodnotenia stále pretrvávala.
Dýchacia sústavaPo podaní interferónu alfa sa hlásili prípady pľúcnej arteriálnej hypertenzie (PAH), najmä u pacientov s rizikovými faktormi PAH (ako je portálna hypertenzia, infekcia HIV, cirhóza). Udalosti sa hlásili
v rôznych časových bodoch, zvyčajne niekoľko mesiacov po začatí liečby interferónom alfa.
Zrakový systémV súvislosti s interferónom alfa sa hlásili závažné poruchy zraku, ako je retinopatia, krvácanie do
sietnice, retinálne exsudáty, odlúčenie sietnice a oklúzia retinálnej artérie alebo žily (pozri časť 4.4).
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePočas programu klinickej štúdie sa hlásil jeden prípad náhodného predávkovania s ropeginterferónom alfa-2b. Pacient dostal 10-násobne vyššiu odporúčanú začiatočnú dávku a počas troch dní sa u neho
vyvinuli symptómy podobné chrípke, ktoré sa vyhodnotili ako nezávažné. Pacient sa úplne zotavil po podaní paracetamolu a dočasnom prerušení liečby ropeginterferónom alfa-2b.
Pre tento liek neexistuje žiadne antidotum. V prípade predávkovania sa odporúča starostlivé
sledovanie pacienta a v prípade potreby symptomatická liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Imunostimulanciá, interferóny, ATC kód: L03AB15
Ropeginterferón alfa-2b je rekombinantný interferón alfa-2b konjugovaný s dvojramenným metoxypolyetylénglykolom (mPEG) so stupňom substitúcie 1 mol polyméru/mol proteínu. Priemerná molekulová hmotnosť je približne 60 kDa, z ktorej tvorí časť PEG približne 40 kDa.
Mechanizmusúčinku
Interferón alfa patrí do skupiny interferónov typu I, ktoré vykazujú svoje bunkové účinky naviazaním sa na transmembránový receptor nazývaný receptor interferónu alfa (IFNAR). Väzba na IFNAR iniciuje následnú signálnu dráhu prostredníctvom aktivácie kináz, najmä Janusovej kinázy 1 (JAK1)
a tyrozínkinázy 2 (TYK2) a transkripčného aktivátora (STAT) proteínov. Nukleárna translokácia proteínov STAT riadi odlišné programy expresie génov a vykazuje rôzne bunkové účinky. Zistilo sa, že interferón alfa má inhibičný účinok na proliferáciu hematopoetických a fibroblastových progenitorových buniek kostnej drene a antagonizuje pôsobenie rastových faktorov a iných cytokínov, ktoré majú úlohu vo vývoji myelofibrózy. Tieto účinky sa môžu spájať s terapeutickými účinkami interferónu alfa pri polycytémii vera.
Ďalej sa preukázalo, že interferón alfa je u pacientov s polycytémiou vera schopný znížiť zaťaženie mutantnou alelou JAK2V617F (bodová mutácia V617F v JAK2 kináze je charakteristickým znakom polycytémie vera a je prítomná u približne 95 % pacientov).
Klinickáúčinnosťa bezpečnosť
Otvorená randomizovaná štúdia III. fázy (PROUD-PV) hodnotila účinnosť a bezpečnosť
ropeginterferónu alfa-2b u 254 dospelých pacientov s polycytémiou vera v porovnaní
s hydroxykarbamidom (randomizácia 1:1). Pacienti boli stratifikovaní na základe predchádzajúcej expozície hydroxykarbamidu, veku pri skríningu (≤ 60 alebo > 60 rokov) a prítomnosti tromboembolických udalostí v minulosti. Charakteristiky populácie štúdie sú uvedené v tabuľke 2.
Tabuľka 2. Charakteristiky pacientov pri skríningu v štúdii PROUD-PV.
Vek
Skupina liečená ropeginterferónom alfa-2b
(n = 127)
Kontrolná skupina
(n = 127)
Roky* 58,5±10,81 57,9±13,10
Pohlavie
Ženy n (%) Muži n (%) Rasa
68 (53,5)
59 (46,5)
67 (52,8)
60 (47,2)
Biela n (%) 127 (100,0) 127 (100,0)
Trvanie PV (mesiace)* 12,6±24,70 15,7±25,65
Záťaž alelouJAK2V617F (%)* 41,9±23,49 42,8±24,14
Hematologické parametre
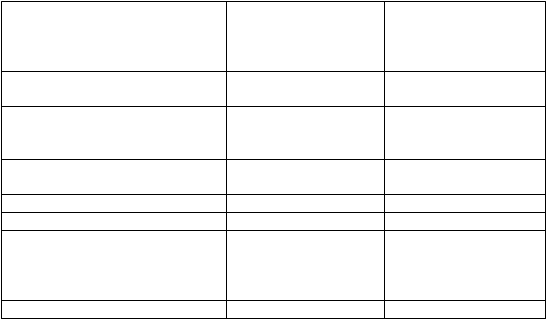
Hematokrit (%)* Trombocyty (109/l)* Leukocyty (109/l)*
Prítomnosť splenomegálie47,8±5,22
537,7±273,08
11,5±4,76
48,6±5,39
516,8±254,43
11,9±4,88
Nie n (%) Áno n (%)
*hodnoty sú priemer ±SD.
115 (90,6)
12 (9,4)
112 (88,2)
15 (11,8)
Pacienti predtým neliečení hydroxykarbamidom (n = 160) alebo liečení hydroxykarbamidom (n = 94)
boli randomizovaní na podávanie ropeginterferónu alfa-2b alebo hydroxykarbamidu. Dávka sa postupne zvyšovala v závislosti od odpovede ochorenia a znášanlivosti ( ropeginterferón alfa-2b, od
50 do 500 mikrogramov podávaných subkutánne každé dva týždne). Priemerná dávka po
12 mesiacoch liečby bola 382 (±141) mikrogramov pri ropeginterferóne alfa-2b.
Odpoveď ochorenia (definovaná ako hematokrit <45 % bez flebotómie [najmenej 3 mesiace od poslednej flebotómie], trombocyty < 400 x 109/l a leukocyty < 10 x 109/l po 12 mesiacoch liečby) bola'
43,1 % [53/123 pacientov] v ramene s ropeginterferónom alfa-2b po 12 mesiacoch liečby.
Do otvorenej štúdie rozšírenej IIIb. fázy (CONTINUATION-PV) bolo zaradených 171 dospelých pacientov s polycytémiou vera, ktorí predtým dokončili štúdiu PROUD-PV, na vyhodnotenie dlhodobej účinnosti a bezpečnosti ropeginterferónu alfa-2b. Deväťdesiat päť pacientov naďalej dostávalo ropeginterferón alfa-2b (od 50 do 500 mikrogramov subkutánne každé dva, tri alebo štyri týždne). Priemerná dávka pri ropeginterferóne alfa-2b po 36 mesiacoch liečby (12-mesačná dĺžka liečby v štúdii PROUD-PV a 24-mesačná dĺžka liečby v rozšírenej štúdii) bola 363
(±149) mikrogramov.
Odpoveď na liečbu ropeginterferónom alfa-2b je uvedená v tabuľke 3 a tabuľke 4. Po 36 mesiacoch liečby bola úplná hematologická odpoveď 70,5 %. Takmer 50 % pacientov preukázalo úplnú hematologickú odpoveď so zlepšením zaťaže ochorenia po 36 mesiacoch liečby. Pacienti vykazovali štatisticky významný rozdiel v záťaži alelou JAK2V617F (19,7 %) a zmeny alely JAK2V617F oproti východiskovej hodnote (-22,9 %).
Tabuľka 3. Odpoveď ochorenia po 24 a 36 mesiacoch liečby s ropeginterferónom alfa-2b alebo kontrolou.
Pacienti liečení ropeginterferónom alfa-2b 24 mesiacov1
Rameno liečené ropeginterferónom
alfa-2b1
% s odpoveďou (n/N)
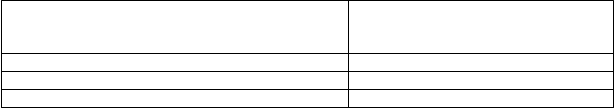
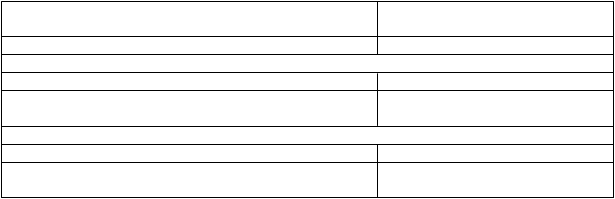
 Kompletná hematologická odpoveď
a
Kompletná hematologická odpoveď
a 70,5 (67/95)
Kompletná hematologická odpoveďa a zlepšenie záťažeochoreniab 49,5 (47/95)
Pacienti liečení ropeginterferónom alfa-2b
36 mesiacov2Kompletná hematologická odpoveďa 70,5 (67/95)
Kompletná hematologická odpoveďa a zlepšenie zaťažeochoreniab 52,6 (50/95)
a definovaná ako hematokrit < 45 % bez flebotómie (najmenej 3 mesiace od poslednej flebotómie), trombocyty
< 00 x 109/l a leukocyty < 10 x 109/l.
b definované ako zlepšenie príznakov súvisiacich s ochorením (klinicky významná splenomegália) a symptómov súvisiacich s ochorením (mikrovaskulárne poruchy, pruritus, bolesť hlavy).
1 12-mesačná liečba v štúdii PROUD-PV a 12-mesačná liečba v predĺženej štúdii
2 12-mesačná liečba v štúdii PROUD-PV a 24-mesačná liečba v predĺženej štúdii
Tabuľka 4. Záťaž alelou JAK2V617F a zmeny v porovnaní s východiskovou hodnotou v predĺženej štúdii CONTINUATION-PV.Skupina liečená ropeginterferónomalfa-2b1(n = 94)Priemer % (±SD)
Alelická záťaž JAK2V617F 19,7 (±21,29)
JAK2V617F zmeny oproti východiskovej hodnote -22.9 (±24,79)
1 Pacienti s 36-mesačnou liečbou ropeginterferónom alfa-2b (12-mesačná liečba v štúdii PROUD-PV a 24-
mesačná liečba v predĺženej štúdii).
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s Besremi
vo všetkých podskupinách pediatrickej populácie pri liečbe polycytémie vera (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Absorpcia ropeginterferónu alfa-2b je u pacientov ustálená, s maximálnymi sérovými koncentráciami dosiahnutými po 3 až 6 dňoch.
Absolútna biologická dostupnosť subkutánne podávaného ropeginterferónu alfa-2b sa u ľudí neskúmala. Preto nebolo možné vykonať žiadny platný odhad absolútnej biologickej dostupnosti. Na základe údajov od opíc je to cca. 80 %, podobne ako pri pegylovanom interferóne alfa-2a.
Distribúcia
Ropeginterferón alfa-2b sa vyskytuje hlavne v krvnom obehu a extracelulárnej tekutine, ako je to zrejmé z distribučného objemu v rovnovážnom stave (Vd) 6,6 až 17 litrov u pacientov po subkutánnom podávaní (rozpätie dávok 50–450 mikrogramov). U pacientov po subkutánnom opakovanom podávaní dávky bola priemerná Cmax 2,4 ng/ml (pri dávke 50–80 mikrogramov) až 49 ng/ml (pri dávke
450 mikrogramov) a AUC0-t sa pohybovala od 28,5 ng.h/ml (pri dávke 50–80 mikrogramov) po
552,6 ng.h/ml (pri dávke 450 mikrogramov). V prípade zdravých dobrovoľníkov bola variabilita
medzi účastníkmi pozorovaná s 25 % a 35 % pre AUC a Cmax.
Zo štúdie hmotnostnej rovnováhy, tkanivovej distribúcie a autorádioluminografie celého tela, ktorá sa vykonala na potkanoch, sa zistilo, že podobný liek s interferónom alfa (pegylovaný interferón alfa-2a) bol distribuovaný do pečene, obličiek a kostnej drene, pričom bol vysoko koncentrovaný v krvi.
Biotransformácia
Metabolizmus ropeginterferónu alfa-2b nie je úplne opísaný. Pripojenie interferónu alfa-2b
k rozvetvenej polyetylénglykolovej časti s vysokou molekulovou hmotnosťou (40 kDa) sa považuje za hlavný dôvod rozdielov v eliminácii v porovnaní s nepegylovanými interferónmi. Štúdie na potkanoch s podobným liekom s interferónom alfa (pegylovaný interferón alfa-2a) preukázali primárnu
elimináciu prostredníctvom metabolizácie v pečeni. Pre ropeginterferón alfa-2b sa uvažuje o rovnakej
eliminačnej ceste.
Farmakokinetické interakčné štúdie s ľuďmi s pegylovaným interferónom alfa-2a poukazujú na stredný inhibičný účinok na substráty metabolizované CYP1A2 a CYP2D6 (pozri časť 4.5).
Eliminácia
Eliminácia ropeginterferónu alfa-2b nie je úplne opísaná. Štúdie s podobným liekom s interferónom alfa (pegylovaný interferón alfa-2a) naznačujú, že oblička je hlavným orgánom vylučovania rádioaktívne značených metabolických produktov (štúdia na potkanoch) a že systémový klírens pegylovaného interferónu alfa-2a u ľudí je približne 100-násobne nižší v porovnaní s natívnym nepegylovaným interferónom alfa-2a.
Po opakovanom subkutánnom podávaní dávky (rozpätie dávok 50–450 mikrogramov) je u pacientov
terminálny polčas ropeginterferónu alfa-2b približne 6 až 10 dní a klírens ropeginterferónu alfa-2b je
0,023 až 0,061 l/h.
Zapojenie transportných proteínov do absorpcie, distribúcie a eliminácie ropeginterferónu alfa-2b nie je známe.
Linearita/nelinearita
Vo farmakokinetickej štúdii so zdravými jedincami sa v rozmedzí dávok 24 až 270 mikrogramov zvýšila Cmax ropeginterferónu alfa-2b proporčne s dávkou. Pozorovalo sa vyššie ako proporčné
zvýšenie expozície. Variabilita medzi jedincami pre ropeginterferón alfa-2b bola 35 % (Cmax) a 25 % (AUC).
Porucha funkciepečene
Porovnateľná expozícia a farmakokinetický profil sa hlásili pri iných liekoch s obsahom interferónu alfa (pegylovaný interferón alfa-2a) u cirhotických pacientov (Child-Pugh A) a u pacientov bez cirhózy. Farmakokinetika sa nehodnotila u pacientov so zvýšenou závažnou poruchou funkcie pečene.
Poruchafunkcieobličiek
Farmakokinetický profil u pacientov so stredne závažnou alebo závažnou poruchou funkcie obličiek a u pacientov s konečným štádiom renálneho ochorenia (ESRD) sa hodnotil len pre iné pegylované lieky s obsahom interferónu alfa.
Pacienti so stredne závažnou alebo závažnou poruchou funkcie obličiek, ktorí dostávali
180 mikrogramov pegylovaného interferónu alfa-2a jedenkrát týždenne, mali porovnateľnú alebo
o 60 % vyššiu expozíciu liečiva v plazme, v uvedenom poradí, v porovnaní s jedincami s normálnou
funkciou obličiek.
U 13 pacientov s ESRD vyžadujúcich si chronickú hemodialýzu, viedlo podávanie 135 mikrogramov pegylovaného interferónu alfa-2a jedenkrát týždenne ku expozícii liečiva nižšej o 34 % oproti pacientom s normálnou funkciou obličiek.
Pacienti s poruchou funkcie obličiek, ktorí dostali jednorazovú dávku 1,0 mikrogramu/kg pegylovaného interferónu alfa-2b, mali zvýšený pomer Cmax, AUC a polčas rozpadu k stupňu poruchy funkcie obličiek. Po opakovanom podávaní dávky pegylovaného interferónu alfa-2b
(1,0 mikrogramu/kg subkutánne podávané každý týždeň počas štyroch týždňov) sa klírens
pegylovaného interferónu alfa-2b znížil v priemere o 17 % u pacientov so stredne závažnou, respektíve o 44 % u pacientov so závažnou poruchou funkcie obličiek v porovnaní s pacientmi s normálnou funkciou obličiek. Na základe údajov s jednorazovou dávkou bol klírens podobný
u pacientov so závažnou poruchou funkcie obličiek bez hemodialýzy a u pacientov, ktorí dostávali hemodialýzu.
Starší pacienti
O používaní ropeginterferónu alfa-2b u starších pacientov sú k dispozícii len obmedzené farmakokinetické údaje. Na základe výsledkov zo štúdií PROUD-PV a CONTINUATION-PV
o expozícii liečiva, farmakodynamickej odpovedi a znášanlivosti sa úprava dávky ropeginterferónu alfa-2b v populácii starších pacientov nepovažuje za nutnú.
Obézni pacienti alebo pacienti s podváhou
Farmakokinetický profil ropeginterferónu alfa-2b nebol stanovený u pacientov s obezitou ani u pacientov s podváhou.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity
po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu, reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
Reprodukčné a vývojové štúdie s ropeginterferónom alfa-2b sa nevykonali. Interferón alfa sa
u primátov preukázal ako látka vyvolávajúca potrat a u ropeginterferónu alfa-2b sa predpokladá, že má
rovnaký účinok. Účinky na fertilitu sa nehodnotili.
Nie je známe, či sa liečivo tohto lieku vylučuje do materského mlieka experimentálnych zvierat alebo do mlieka u ľudí (pozri časť 4.6).
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
chlorid sodný
octan sodný, bezvodý kyselina octová, ľadová benzylalkohol polysorbát 80
voda na injekcie
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
Besremi 250 mikrogramov/0,5 mlinjekčnýroztoknaplnenývinjekčnompere
3 roky
Besremi 500 mikrogramov/0,5 mlinjekčný roztok naplnenývinjekčnompere
1,5 roku
Po prvom otvorení
Naplnené pero sa môže uchovávať v chladničke (2 °C – 8 °C) maximálne 30 dní, ak sa uchováva
s nasadeným krytom pera a je uložené vo vonkajšom obale na ochranu pred svetlom. Toto naplnené pero sa môže použiť v rámci týchto 30 dní dvakrát. Všetok zvyšný liek, ktoré zostane v naplnenom pere po druhom použití a/alebo po 30 dňoch sa musí zlikvidovať.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Naplnené pero uchovávajte vo vonkajšom obale na ochranu pred svetlom. Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Besremi 250 mikrogramov/0,5 ml injekčnýroztoknaplnenývinjekčnompere
Naplnené pero je vyrobené z bieleho polypropylénu, so šedým tlačidlom a silou „250 μg/0,5 ml“, ktorá je na štítku zvýraznená šedou farbou. Je na podávanie dávok 50 μg, 100 μg, 150 μg, 200 μg a 250 μg.
Besremi 500 mikrogramov/0,5 ml injekčný roztok naplnenývinjekčnompere
Naplnené pero je vyrobené z bieleho polypropylénu, s modrým tlačidlom a silou „500 μg/0,5 ml“, ktorá je na štítku zvýraznená modrou farbou. Je na podávanie dávok 50 μg, 100 μg, 150 μg, 200 μg,
250 μg, 300 μg, 350 μg, 400 μg, 450 μg a 500 μg.
Každé naplnené pero obsahuje zásobník (z bezfarebného skla typu I) so šedým piestom (brómbutylová guma) a lemovaného viečka (hliník) so zátkou (brómbutylová guma). Zásobník je zapečatený
v injektore tvaru pera. Každý zásobník obsahuje 0,5 ml roztoku. Každé balenie obsahuje 1 naplnené pero a 2 injekčné ihly.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Naplnené pero sa má pred použitím nechať pri izbovej teplote (15 °C – 25 °C) počas 15 minút.
Keďže Besremi je roztok, pred použitím sa nevyžaduje resuspendovanie. Pred použitím roztok skontrolujte. Smie sa použiť len vtedy, ak je roztok číry, bezfarebný až bledožltý a nie sú v ňom vidieť žiadne častice.
Štítok naplneného pera sa musí skontrolovať pred každým podaním injekcie, aby sa zabránilo
medikačným chybám medzi Besremi 250 mikrogramov/0,5 ml injekčným roztokom a Besremi
500 mikrogramov/0,5 ml injekčným roztokom. Naplnené pero s 250 mikrogramami/0,5 ml má šedé
tlačidlo. Naplnené pero s 500 mikrogramami/0,5 ml má modré tlačidlo.
Nová, sterilná injekčná ihla, ktorá sa dodáva s naplneným perom, sa musí pred každou injekciou
starostlivo pripojiť k naplnenému peru. Injekčné ihly sa musia bezprostredne po použití zlikvidovať.
Ak sa naplnené pero používa po prvý raz, pero sa na injekciu pripraví otočením dávkovacieho tlačidla až kým sa v okne displeja neobjaví symbol „kvapky“. Keď držíte naplnené pero s injekčnou ihlou smerujúcou nahor, jemne poklepte na naplnené pero prstami tak, aby všetky vzduchové bubliny vystúpili smerom k injekčnej ihle. Potom stlačte a podržte tlačidlo, až kým sa v okne displeja neobjaví
„0“. Tento postup sa môže zopakovať až šesťkrát. Keď sa na špičke injekčnej ihly objaví kvapka tekutiny, naplnené pero a injekčná ihla fungujú správne.
Dávku možno nastaviť v krokoch po 50 mikrogramoch otočením dávkovacieho tlačidla. Ak nie je možné nastaviť určitú dávku, v pere môže zostať nedostatočné množstvo lieku, potom sa musí použiť nové pero.
Injekčná ihla sa má zasunúť do kože. Tlačidlo sa má úplne zatlačiť a pred vytiahnutím injekčnej ihly sa musí držať stlačené aspoň 10 sekúnd.
Aby sa zabránilo možnému prenosu ochorenia alebo akéhokoľvek druhu kontaminácie, naplnené pera Besremi má používať výhradne iba jeden pacient, dokonca aj keď došlo k výmene injekčnej ihly. Naplnené pero sa nesmie použiť viac ako dvakrát a musí sa zlikvidovať 30 dní po prvom použití, bez ohľadu na množstvo lieku, ktoré v naplnenom pere zostalo.
Prázdne perá sa nesmú nikdy opakovane použiť a musia sa patrične zlikvidovať.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAOP Orphan Pharmaceuticals AG Wilhelminenstrasse 91/II f
A1160 Viedeň
Rakúsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/18/1352/001
EU/1/18/1352/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.