
romocytómom je Baqsimi kontraindikovaný (pozri časť 4.3).
Inzulinóm
U pacientov s inzulinómom môže podanie glukagónu spôsobiť počiatočné zvýšenie hladiny glukózy v
krvi; avšak podanie glukagónu môže priamo alebo nepriamo (prostredníctvom počiatočného zvýšenia
hladiny glukózy v krvi) stimulovať zvýšené uvoľňovanie inzulínu z inzulinómu a zapríčiniť hypoglykémiu. Pacientovi, u ktorého sa po dávke glukagónu vyvinú príznaky hypoglykémie, má byť glukóza podaná perorálne alebo intravenózne.
Precitlivenosť a alergické reakcie
Môžu sa objaviť alergické reakcie, ktoré boli hlásené po injekčnom podaní glukagónu a ktoré môžu
zahŕňať generalizovanú vyrážku a v niektorých prípadoch anafylaktický šok so sťaženým dýchaním
a hypotenziou. Ak pacient ťažko dýcha, ihneď zavolajte lekársku pomoc.
Zásoby glykogénu a hypoglykémia
Glukagón je účinný pri liečbe hypoglykémie iba vtedy, ak je prítomné dostatočné množstvo
pečeňového glykogénu. Keďže glukagón pomáha veľmi málo alebo vôbec pri stavoch vyhladovania, nadobličkovej insuficiencie, chronického alkoholizmu alebo chronickej hypoglykémie, tieto
ochorenia sa majú liečiť podaním glukózy.
Ak pacient zareagoval na poskytnutú liečbu, je potrebné perorálne mu podávať sacharidy na
obnovenie hladiny pečeňového glykogénu, aby sa predišlo recidíve hypoglykémie.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie. Inzulín
Reaguje antagonisticky na glukagón.
I
ndometacín
Ak sa glukagón užíva spolu s indometacínom, môže strácať svoju schopnosť zvyšovať hladinu
glukózy v krvi alebo môže dokonca spôsobovať hypoglykémiu.
Betablokátory
Dá sa očakávať, že u pacientov užívajúcich betablokátory sa môže objaviť zvýšený nárast hodnôt
srdcovej frekvencie a krvného tlaku, zvýšenie ktorých však bude iba prechodné, pretože glukagón má
krátky polčas.
Liečba glukagónom má za následok uvoľňovanie katecholamínov z nadobličiek a súbežné užívanie betablokátorov môže mať za následok alfa-adrenergickú stimuláciu a následne zvýšený nárast hodnôt krvného tlaku. (pozri časť 4.4)
Warfarín
Glukagón môže zvyšovať antikoagulačný účinok warfarínu.
4.6 Fertilita, gravidita a laktácia
Gravidita
Štúdie s glukagónovým nosovým práškom skúmajúce reprodukciu a fertilitu u zvierat sa
neuskutočnili.
Baqsimi sa môže užívať počas tehotenstva. Glukagón neprechádza ľudskou placentárnou bariérou. Použitie glukagónu vo forme nosového prášku bolo hlásené u tehotných žien s diabetom a nie sú známe žiadne škodlivé účinky glukagónu na priebeh tehotenstva, ani zdravie ešte nenarodených detí či novorodencov.
Dojčenie
Baqsimi sa môže užívať počas dojčenia. Glukagón sa z krvného obehu vylučuje veľmi rýchlo, a preto
sa predpokladá, že jeho množstvo vylúčené do mlieka dojčiacich matiek po liečbe závažných hypoglykemických reakcií bude mimoriadne malé. Keďže glukagón sa rozkladá v tráviacom trakte a
nemôže byť absorbovaný vo svojej intaktnej forme, nebude mať u dieťaťa žiadny metabolický účinok.
Fertilita
S glukagónovým nosovým práškom sa neuskutočnili žiadne štúdie skúmajúce fertilitu.
V štúdiách s potkanmi sa ukázalo, že glukagón nespôsobuje poruchu fertility.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Baqsimi má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
Pacientova schopnosť koncentrácie a reakcie môže byť narušená ako následok hypoglykémie a môže pretrvávať krátky čas po podaní liečby. Môže to predstavovať riziko v situácii, keď sú tieto schopnosti obzvlášť dôležité, ako napríklad pri vedení vozidiel a obsluhe strojov.
4.8 Nežiaduce účinky
Z
hrnutie bezpečnostného profiluNajčastejšie hlásené nežiaduce reakcie sú zvýšená lakrimácia (36 %), podráždenie horných dýchacích
ciest (34 %), nauzea (27 %), bolesť hlavy (21 %) a vracanie (16 %).
Tabuľkový zoznam nežiaducich reakciíNežiaduce reakcie sú uvedené v tabuľke č.1 ako preferované termíny podľa triedy orgánových systémov
a frekvencie výskytu. Príslušná kategória výskytu každej nežiaducej reakcie vznikla na základe nasledujúcej dohody: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1000 až < 1/100);
zriedkavé (≥ 1/10 000 až < 1/1000); veľmi zriedkavé (< 1/10 000).
Tabuľka č. 1. Frekvencia výskytu nežiaducich reakcií glukagónového nosového práškuTrieda orgánových systémov
| Veľmi časté
| Časté
| Menej časté
|
Poruchy nervového systému
| bolesť hlavy
| dysgeúzia
|
|
Poruchy oka
| zvýšená lakrimácia
| okulárna hyperémia
očný pruritus
|
|
Poruchy dýchacej sústavy,
hrudníka a mediastína
| podráždenie
horných dýchacích
ciest a
|
|
|
Poruchy gastrointestinálneho
traktu
| vracanie
nauzea
|
|
|
Poruchy kože a podkožného
tkaniva
|
| pruritus
|
|
Laboratórne a funkčné
vyšetrenia
|
| zvýšený systolický krvný tlakb
zvýšený diastolický krvný tlakb
| zvýšená frekvencia srdcab
|
a
Podráždenie horných dýchacích ciest: rinorea, nosový diskomfort, nosová kongescia, nosový pruritus, kýchanie, podráždené hrdlo, kašeľ, epistaxa a parosmia
b
Zvýšená frekvencia srdca a krvný tlak: Stanovené meraním vitálnych funkcií. Frekvencie výskytu sú založené na zmene hodnôt pred liečbou a po liečbe.
ImunogenicitaCelkovo u 5,6 % pacientov sa počas liečby vyskytli glukagónové protilátky. Tieto protilátky
neneutralizovali pôsobenie glukagónu, neznižovali jeho účinnosť, ani nesúviseli so vznikom
nežiaducich reakcií vyplývajúcich z liečby.
Pediatrická populáciaNa základe údajov z klinických skúšaní sa predpokladá, že frekvencia výskytu, typ a závažnosť
nežiaducich reakcií zaznamenaných u detí budú rovnaké ako u dospelých.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 Predávkovanie
Ak sa objaví predávkovanie, u pacienta sa môže vyskytnúť nauzea, vracanie, inhibícia motility gastrointestinálneho traktu, zvýšenie krvného tlaku a srdcovej frekvencie. V prípade podozrenia na predávkovanie sa môže znížiť hladina draslíka v sére, ktorá má byť monitorovaná a v prípade potreby upravená. Ak sa u pacienta objaví dramatické zvýšenie krvného tlaku, ukázalo sa, že
na zníženie krvného tlaku v krátkom čase, keď je potrebná kontrola, je účinné použiť neselektívnu
α-adrenergickú blokádu (pozri časť 4.4).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: hormóny pankreasu, glykogénolytické hormóny, ATC kód: H04AA01
Mechanizmus účinku
Glukagón zvyšuje koncentráciu glukózy v krvi aktiváciou glukagónových receptorov v pečeni, čím
stimuluje odbúravanie glykogénu a uvoľňovanie glukózy z pečene. Pečeňové zásoby glykogénu sú potrebné na to, aby glukagón vyvolával antihypoglykemický účinok.
Farmakodynamické účinky
Pohlavie ani telesná hmotnosť nemajú žiaden klinicky významný vplyv na farmakodynamiku
glukagónového nosového prášku.
Po podaní 3 mg glukagónového nosového prášku dospelým pacientom s diabetom typu 1 začala hladina glukózy stúpať už po 5 minútach (obrázok č. 1). Do 10 minút bol medián hladiny glukózy vyšší ako 3,9 mmol/l (70 mg/dl). Priemerné zvýšenie maximálnej hladiny glukózy bolo 7,8 mmol/l (140 mg/dl).
U pediatrických pacientov s diabetom typu 1 (4 až < 17 rokov) začala po podaní 3 mg glukagónového nosového prášku hladina glukózy stúpať už po 5 minútach (obrázok č. 2), pričom priemerné zvýšenie maximálnej hladiny glukózy bolo 5,7 mmol/l (102 mg/dl) až 7,7 mmol/l (138 mg/dl).
Bežné prechladnutie s upchatým nosom s použitím alebo bez použitia dekongestantu nemalo žiaden vplyv na farmakodynamiku glukagónového nosového prášku.
O
brázok č. 1. Priemerná koncentrácia glukózy v čase u dospelých pacientov s diabetom typu 1.
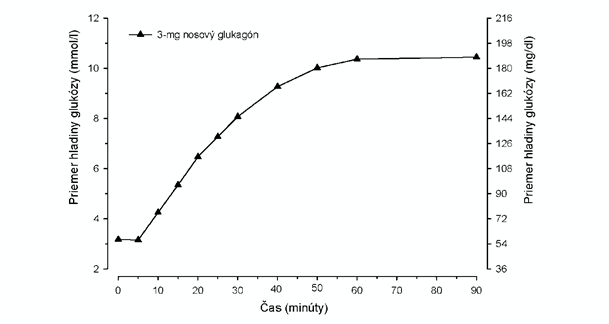 O
brázok č. 2. Priemerná koncentrácia glukózy v čase u pediatrických pacientov s diabetom typu 1.
O
brázok č. 2. Priemerná koncentrácia glukózy v čase u pediatrických pacientov s diabetom typu 1.
 K
l
i
n
i
cká účinnosť
K
l
i
n
i
cká účinnosťPivotná štúdia u dospelých bola randomizovaná, multicentrická, otvorená, skrížená štúdia v 2 etapách
u dospelých pacientov s diabetom typu 1 alebo typu 2. Primárnym cieľom bolo porovnať účinnosť
3 mg glukagónového nosového prášku v jednodávkovom obale s 1 mg intramuskulárnej dávky (i. m. podaného glukagónu) u dospelých pacientov s diabetom typu 1. Na zníženie hladiny glukózy do
pásma hypoglykémie s cieľovou najnižšou hodnotou glukózy v krvi < 2,8 mmol/l (< 50 mg/dl) bol
použitý inzulín.
Do pivotnej štúdie bolo zaradených celkom 83 pacientov vo veku 18 až < 65 rokov. Sedemdesiat sedem pacientov malo diabetes 1. typu, priemerný vek bol 32,9 rokov s priemerným trvaním diabetu v
dĺžke 18,1 roka a 45 (58 %) pacientov boli ženy. Priemerný vek pacientov s diabetom 2. typu (n = 6)
bol 47,8 roka s priemerným trvaním diabetu v dĺžke 18,8 roka a 4 (67 %) pacientky boli ženy.
Meradlom výsledku primárnej účinnosti bolo percento pacientov, ktorí dosiahli úspech v liečbe, definované ako buď zvýšenie hladiny glukózy v krvi na ≥ 3,9 mmol/l (≥ 70 mg/dl) alebo zvýšenie o
≥ 1,1 mmol/l (≥ 20 mg/dl) v porovnaní s najnižšou hodnotou glukózy do 30 minút od podania skúšaného glukagónu, bez ďalších opatrení na zvýšenie hladiny glukózy v krvi. Najnižšia hodnota glukózy bola definovaná ako nadir (najnižšia nameraná hodnota) glukózy v čase podania glukagónu
alebo do 10 minút od jeho podania.
U pacientov s diabetom typu 1 bola priemerná najnižšia nameraná hodnota glukózy 2,5 mmol/l (44,2 mg/dl) pri použití glukagónového nosového prášku a 2,7 mmol/l (48,9 mg/dl) pri použití i. m. glukagónu. Glukagónový nosový prášok preukázal neinferioritu voči i. m. glukagónu v relapse inzulínom vyvolanej hypoglykémie u 98,7 % pacientov liečených Baqsimi a u 100 % pacientov liečených i. m. glukagónom, ktorí dosiahli liečebný účinok do 30 minút (tabuľka č. 2). Všetci pacienti splnili kritériá účinnosti liečby glukózou do 40 minút. Všetci pacienti s diabetom typu 2 (100 %) dosiahli účinnosť liečby do 30 minút.
Stredná hodnota času do dosiahnutia liečebného účinku bola 16,2 minút v skupine liečby
s glukagónovým nosovým práškom a 12,2 minút v skupine liečby s i. m. glukagónom 1 mg. Čas do úspechu v liečbe predstavuje čas od podania glukagónu dovtedy, kým pacient nedosiahne úspech v
liečbe, ale nepatrí tam čas na rekonštitúciu a prípravu intramuskulárnej injekcie v kontrolnej skupine.
Do 30 minút po podaní glukagónu sa u pacientov v skupine liečby s glukagónovým nosovým práškom aj v skupine liečby s i. m. glukagónom vyskytlo podobné zlepšenie príznakov hypoglykémie, ako to vyhodnotil Edinburgský dotazník príznakov hypoglykémie.
Tabuľka č. 2. Pacienti dosahujúci úspech v liečbe a spĺňajúci iné glukózové kritériá v pivotnej štúdii
| Diabetes 1. typu
(n = 75)a
| Diabetes 1. typu a 2. typu (n = 80)a
|
glukagónový nosový
prášok 3 mg
| i. m. glukagón
1 mg
| glukagónový nosový
prášok 3 mg
| i. m. glukagón
1 mg
|
Úspech v liečbe – n (%)
| 74 (98,7 %)
| 75 (100 %)
| 79 (98,8 %)
| 80 (100 %)
|
Rozdiely v liečbe (2-stranný
95 % interval spoľahlivosti) b,c
|
1,3 % (-3,8 %; 7,2 %)
|
1,3 % (-3,6 %; 6,8 %)
|
Splnené glukózové kritériá – n
(%)d
(i) ≥ 3,9 mmol/l (≥ 70 mg/dl)
(ii) zvýšenie o ≥ 1.1 mmol/l
(≥ 20 mg/dl) od nadiru u (i) aj u (ii)
|
72 (97 %)
74 (100 %)
72 (97 %)
|
74 (99 %)
75 (100 %)
74 (99 %)
|
77 (97 %)
79 (100 %)
77 (97 %)
|
79 (99 %)
80 (100 %)
79 (99 %)
|
a Populácia pacientov v analýze účinnosti pozostávala zo všetkých pacientov, ktorým boli podávané
obidve dávky skúšaného lieku s hodnotiteľným primárnym výsledkom.
b Rozdiel vypočítaný ako (percento s úspešnou liečbou i. m. glukagónom) – (percento s úspešnou
liečbou glukagónovým nosovým práškom).
c 2-stranný 95 % interval spoľahlivosti (CI) použitím nepodmieneného profilu pravdepodobnosti založenom na „presných“ koncových plochách; hranica neinferiority = 10 %.
d Percento vyplývajúce z počtu pacientov, ktorí dosiahli úspech v liečbe.
Do podobne navrhnutej potvrdzujúcej klinickej štúdie bolo zaradených 70 pacientov s diabetom
typu 1, priemerným vekom 41,7 roka (20-64 rokov) a priemerným trvaním diabetu v dĺžke 19,8 roka.
Dvadsaťsedem pacientov (39 %) tvorili ženy. Na zníženie hladiny glukózy v krvi na hodnotu
< 3,3 mmol/l (< 60 mg/dl) sa použil inzulín.
Priemerná najnižšia nameraná hodnota glukózy v krvi bola 3,0 mmol/l (54,2 mg/dl) pre glukagónový nosový prášok a 3,1 mmol/l (55,7 mg/dl) pre i. m. glukagón. Glukagónový nosový prášok preukázal neinferioritu voči i. m. glukagónu v relapse inzulínom vyvolanej hypoglykémie u 100 % pacientov liečených glukagónovým nosovým práškom aj u 100 % pacientov liečených i. m. glukagónom, ktorí dosiahli úspech v liečbe (tabuľka č. 3). Priemerný čas do dosiahnutia úspechu v liečbe bol 11,4 minút v skupine liečby s glukagónom nosovým práškom a 9,9 minút v skupine liečby s i. m. glukagónom.
Tabuľka č. 3. Pacienti dosahujúci úspech v liečbe a spĺňajúci iné glukózové kritériáv potvrdzujúcej štúdii
| Diabetes 1. typu
(n = 66)a
|
glukagónový
nosový prášok 3 mg
| i. m.
glukagón
1 mg
|
Úspech v liečbe – n (%)
| 66 (100 %)
| 66 (100 %)
|
Rozdiely v liečbe (2-stranný 95 % interval
spoľahlivosti)b
|
0 % (-5,4 %; 5,4 %)c
|
Splnené glukózové kritériá – n (%)
(i) ≥ 3,9 mmol/l (≥70 mg/dl)
(ii) zvýšenie o ≥ 1,1 mmol/l (≥ 20 mg/dl) od nadiru u (i) aj u (ii)
|
66 (100 %)
66 (100 %)
66 (100 %)
|
66 (100 %)
66 (100 %)
66 (100 %)
|
a Populácia pacientov v analýze účinnosti pozostávala zo všetkých pacientov, ktorým boli
podávané obidve dávky skúšaného lieku s hodnotiteľným primárnym výsledkom.
b Rozdiel vypočítaný ako (percento s úspešnou liečbou i. m. glukagónom) – (percento s úspešnou
liečbou glukagónovým nosovým práškom); hranica neinferiority = 10 %.
c 2-stranný 95 % interval spoľahlivosti (CI) použitím nepodmieneného profilu pravdepodobnosti založenom na „presných“ koncových plochách.
V štúdii s aktuálnym užívaním lieku u dospelých v dĺžke približne 6 mesiacov bol 129 pacientom s diabetom typu 1 (priemerný vek 46,6 rokov, rozpätie 18 až 71 rokov) a ich opatrovateľom poskytnutý glukagónový nosový prášok na liečbu stredne závažných alebo závažných hypoglykemických stavov doma alebo v pracovnom prostredí. Do analýzy účinnosti bolo zahrnutých celkom 157 stredne závažných alebo závažných hypoglykemických príhod pozorovaných u
69 pacientov. Epizóda závažnej hypoglykémie bola definovaná ako epizóda, pri ktorej je osoba s diabetom klinicky nespôsobilá (to znamená v bezvedomí, so záchvatmi, ťažko mentálne'
dezorientovaná) až natoľko, že pri liečbe hypoglykémie vyžaduje pomoc tretej strany. Epizóda stredne závažnej hypoglykémie bola definovaná ako epizóda, pri ktorej osoba s diabetom vykazuje prejavy
neuroglykopénie (to znamená slabosť, ťažkosti s rozprávaním, dvojité videnie, ospalosť, neschopnosť sústrediť sa, zahmlené videnie, úzkosť, hlad, únava alebo zmätenosť) a na glukometri má hodnotu približne 60 mg/dl (3,3 mmol/l) alebo menej. V 151 (96,2 %) z týchto prípadov sa pacienti prebrali
alebo vrátili do normálneho stavu do 30 minút od podania glukagónového nosového prášku. Vo všetkých (100 %) 12 závažných hypoglykemických príhodách sa pacienti prebrali, záchvaty prestali (v
7 prípadoch u 4 pacientov sťažujúcich sa pred podaním glukagónového nosového prášku na kŕče) alebo sa pacienti vrátili do normálneho stavu do 5 až 15 minút od podania glukagónového nosového prášku.
Pediatrická populáciaPediatrická pivotná štúdia bola randomizovaná, multicentrická klinická štúdia, ktorá hodnotila
glukagónový nosový prášok v porovnaní s intramuskulárne podávaným (i. m.) glukagónom u detí a dospievajúcich s diabetom typu 1. Glukagón bol podaný vtedy, keď glukóza dosiahla v deň
dávkovania hodnotu < 4,4 mmol/l (< 80 mg/dl). Účinnosť sa hodnotila na základe percenta pacientov
so zvýšením hladiny glukózy o ≥ 1,1 mmol/l (≥ 20 mg/dl) v porovnaní s najnižšou nameranou hodnotou glukózy do 30 minút od podania glukagónu.
Do štúdie bolo zaradených štyridsaťosem pacientov, ktorým bola podaná najmenej jedna dávka skúšaného lieku. Priemerný vek v kohorte malých detí (4 až < 8 rokov) bol 6,5 roka. V detskej kohorte (8 až < 12 rokov) bol priemerný vek 11,1 rokov a v kohorte dospievajúcich (12 až < 17 rokov) bol priemerný vek 14,6 rokov. Populácia vo všetkých vekových kohortách bola prevažne mužského pohlavia a belošská.
Vo všetkých vekových skupinách, aj v skupine s 3 mg glukagónovým nosovým práškom aj v skupine s i. m. glukagónom 0,5 mg (deti s hmotnosťou nižšou ako 25 kg) alebo 1 mg (deti s hmotnosťou vyššou ako 25 kg), sa prejavili podobné glykemické odpovede. Všetci (100 %) pacienti v oboch ramenách liečby vo všetkých vekových skupinách dosiahli zvýšenie hladiny glukózy o ≥ 1,1 mmol/l (≥ 20 mg/dl) v porovnaní s najnižšou nameranou hodnotou do 20 minút po podaní glukagónu.
Priemerný čas dosiahnutia zvýšenej hladiny glukózy o ≥ 1,1 mmol/l (≥ 20 mg/dl) bol podobný
vo všetkých vekových skupinách v liečbe s glukagónovým nosovým práškom aj s i. m. glukagónom
(tabuľka č. 4).
Tabuľka č. 4. Priemerný čas dosiahnutia zvýšenej hladiny glukózy o ≥ 1,1 mmol/l (≥ 20 mg/dl)v porovnaní s nadirom v pediatrickej pivotnej štúdii
Zvýšenie od nadiru
| Priemerný čas po podaní glukagónu (minúty)
|
Malé deti
(4 až < 8 rokov)
| Deti
(8 až < 12 rokov)
| Dospievajúci
(12 až < 17 rokov)
|
i. m. glukagóna
n = 6
| glukagó
nový nosový prášok
3 mg n = 12
| i. m. glukagóna
n = 6
| glukagó
nový nosový prášok
3 mg n = 12
| i. m. glukagóna
n = 12
| glukagón
ový nosový prášok
3 mg n = 12
|
≥ 1,1 mmol/l
(≥ 20 mg/dl)
|
10,0
|
10,8
|
12,5
|
11,3
|
12,5
|
14,2
|
a 0,5 mg alebo 1 mg i. m. glukagónu (podľa telesnej hmotnosti)
V pediatrickej štúdii s aktuálnym užívaním lieku v dĺžke približne 6 mesiacov bol 26 pacientom
vo veku 4 až < 18 rokov s diabetom typu 1 (priemerný vek 11,7 rokov, rozpätie 5 až 17 rokov) a ich
opatrovateľom poskytnutý 3 mg glukagónový nosový prášok na liečbu stredne závažných vrátane závažných hypoglykemických príhod doma alebo v školskom prostredí. Do analýzy účinnosti bolo zahrnutých celkom 33 stredne závažných hypoglykemických príhod hlásených 14 pacientmi. Epizóda závažnej hypoglykémie bola definovaná ako epizóda s príznakmi neuroglykopénie a s hladinou glukózy nižšou ako 50 mg/dl (2,8 mmol/l). Epizóda stredne závažnej hypoglykémie je definovaná ako epizóda, pri ktorej má dieťa/dospievajúci s diabetom príznaky a/alebo prejavy neuroglykopénie a má hodnotu hladiny glukózy v krvi ≤ 70 mg/dl (3,9 mmol/l). Vo všetkých prípadoch vrátane závažnej hypoglykémie (8 príhod od 5 pacientov) sa pacienti vrátili do normálneho stavu do 5 až 30 minút od podania glukagónového nosového prášku.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií Baqsimi v jednej alebo vo viacerých podskupinách pediatrickej populácie z liečby závažnej hypoglykémie (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAbsorpciaAbsorpcia glukagónu podávaného nazálnou cestou dosiahla priemernú maximálnu plazmatickú
hladinu 6130 pg/ml po 15 minútach.
D
is
t
ri
b
úcia
Zdanlivý distribučný objem glukagónu podávaného nazálnou cestou bol približne 885 l.
Biotransformácia
Je známe, že glukagón sa odbúrava v pečeni, obličkách a plazme.
Eliminácia
Priemerný polčas rozpadu glukagónu podávaného nazálnou cestou bol približne 38 minút.
Poruchy funkcie obličiek a pečene
Neuskutočnili sa žiadne formálne štúdie na vyhodnotenie poruchy funkcie obličiek ani pečene.
Pediatrická populácia
U pediatrických pacientov (4 až < 17 rokov) absorpcia glukagónu podávaného nazálnou cestou
dosiahla priemernú maximálnu plazmatickú hladinu medzi 15 a 20 minútami.
Bežná nádcha a používanie dekongestantov
Bežná nádcha s nazálnou kongesciou so súbežným užívaním dekongestantov alebo bez ich súbežného
užívania nazálnou cestou nemala vplyv na farmakokinetiku.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní a lokálnej tolerancie glukagónového nosového prášku neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
betadex (E459)
dodecylfosfocholín
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky.
6.4 Špeciálne upozornenia na uchovávanie
Neuchovávajte pri teplotách vyšších ako 30 °C.
Jednodávkový obal uchovávajte v tubuse obalenom zmršťovacou fóliou, kým nie ste pripravení na jeho podanie, aby ste ho chránili proti vlhkosti.
Ak už bol tubus otvorený, jednodávkový obal mohol byť vystavený vlhkosti. To môže spôsobiť, že
liek nebude fungovať ako by mal. Pravidelne kontrolujte tubus so zmršťovacou fóliou. Ak bol tubus
už otvorený, vymeňte si liek.
6.5 Druh obalu a obsah baleniaJednodávkový obal pozostáva z polyetylénu a polypropylénu. Zmršťovacou fóliou obalený tubus pozostáva z polyetylénu a polypropylénu a obsahuje vysúšadlo.
K dispozícii sú balenia s 1 alebo 2 jednodávkovými obalmi. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomPokyny na použitieTento produkt je pripravený na použitie a je len na jednorazové použitie.
Jednodávkový obal obsahuje iba jednu dávku lieku, a preto sa pred použitím nesmie prestrekovať ani
skúšať.
Je potrebné dôsledne dodržiavať pokyny na použitie obalu uvedené v písomnej informácii. Po použití, jednodávkový obal a tubus zlikvidujte.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIEli Lilly Nederland B.V. Papendorpseweg 83
3528 BJ Utrecht
Holandsko.
8. REGISTRAČNÉ ČÍSLO(ČÍSLA)EU/1/19/1406/001
EU/1/19/1406/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: DD mesiac RRRR
10. DÁTUM REVÍZIE TEXTU<{DD. mesiac RRRR}>
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu