
unkcie obličiek a pečene
Axumin sa neskúmal u pacientov s poruchou funkcie obličiek alebo pečene.
Je potrebné starostlivo zvážiť aktivitu, ktorá bude podaná, pretože u takýchto pacientov je možná zvýšená radiačná expozícia.
Starší pacienti
Nie je potrebná žiadna úprava dávky.
Pediatrická populácia
Použitie fluciklovínu (18F) sa netýka pediatrickej populácie.
Spôsobpodávania
Axumin je určený na intravenózne použitie.
Aktivita fluciklovínu (18F) sa musí merať meračom rádioaktivity tesne pred podaním injekcie. Axumin sa má podať ako bolusová intravenózna injekcia. Odporúčaný maximálny objem injekcie
nezriedeného Axuminu je 5 ml. Axumin možno 8-násobne (1 diel Axuminu a 7 dielov rozpúšťadla)
zriediť injekčným roztokom chloridu sodného 9 mg/ml (0,9 %). Po podaní injekcie má nasledovať prepláchnutie sterilným injekčným roztokom chloridu sodného 9 mg/ml (0,9 %) podaným i.v.,aby sa
zabezpečilo podanie celej dávky.
Axumin je určený na viacnásobné použitie.
Pokyny na riedenie lieku pred podaním, pozri časť 12. Príprava pacienta, pozri časť 4.4.
Snímkovanie
Pacient má ležať na chrbte, s rukami nad hlavou. Je potrebné urobiť CT sken na korekciu zoslabenia a anatomickú koreláciu. Vyšetrenie PET sa má začať 3-5 minút (cieľ 4 minúty) po podaní injekcie; odporúča sa čas skenovania 3 minúty na jednu polohu lôžka. Predĺženie snímania nad oblasťou panvy môže zvýšiť citlivosť detekcie ochorenia. Odporúča sa, aby sa snímkovanie začalo od strednej časti stehna a pokračovalo po lebečnú bázu. Typický celkový čas snímania trvá 20 až 30 minút.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Odôvodnenie individuálneho pomeru prínosu a rizika
Pre každého pacienta musí byť radiačná expozícia odôvodnená možným prínosom. Podaná aktivita má byť v každom prípade čo najnižšia, aby sa získali požadované diagnostické informácie.
Hodnota PSA môže ovplyvniť diagnostický výkon PET vyšetrenia fluciklovínom (18F) (pozri časť 5.1
Farmakodynamické vlastnosti).
Porucha funkcie obličiek
U týchto pacientov je potrebné starostlivo zvážiť pomer prínosu a rizika, keďže je možné zvýšenie radiačnej expozície.
Pediatrickápopulácia
Informácie o použití v pediatrickej populácii, pozri časť 4.2.
Príprava pacienta
Pacientovi je potrebné odporučiť, aby nevykonával žiadne namáhavé aktivity aspoň jeden deň pred snímaním použitím fluciklovínu (18F).
Pacienti nemajú jesť ani piť aspoň 4 hodiny pred podaním fluciklovínu (18F) (okrem malého objemu vody na zapitie liekov).
Interpretácia snímok s fluciklovínom (18F) a limity použitia
Snímky s fluciklovínom (18F) majú interpretovať riadne zaškolení pracovníci.
Snímky získané PET vyšetrením fluciklovínom (18F) sa majú interpretovať vizuálne. Podozrenie na rakovinu v miestach typických pre recidívu rakoviny prostaty je založené na vychytávaní fluciklovínu (18F) v porovnaní s okolitým tkanivom. V prípade malých lézií (priemer < 1 cm), fokálne vychytávanie vyššie ako signál v krvi treba považovať za podozrenie na rakovinu. V prípade väčších lézií, vychytávanie rovnakej alebo vyššej intenzity ako v kostnej dreni sa považuje za podozrenie na rakovinu.
Vplyv kvantitatívneho/semikvantitatívneho merania vychytávania fluciklovínu (18F) ako pomôcky pri interpretácii snímok nebola hodnotená.
V prípade PET vyšetrenia fluciklovínom (18F) môže dôjsť k chybám interpretácie snímok (pozri časť 5.1).
Vychytávanie fluciklovínu (18F) nie je špecifické pre rakovinu prostaty a môže k nemu dôjsť aj pri iných typoch rakoviny, prostatitíde a benígnej hyperplázii prostaty. Falošne pozitívne prípady boli tiež popísané v súvislosti so zápalovou odpoveďou po kryoterapii a zostatkovom žiarení
pri pacientoch, ktorí už podstúpili rádioterapiu. V prípade potreby sa má zvážiť klinická korelácia zahrnutím histopatologického vyšetrenia suspektného miesta recidívy.
Na interpretáciu snímok PET použitím fluciklovínu (18F) sa nevyžaduje použitie intravenóznej jódovanej kontrastnej látky pre CT, ani perorálne podávaného kontrastného média. Zaznamenaná bola detekcia recidívy rakoviny prostaty v prostate/lôžku prostaty, regionálnych lymfatických uzlinách, kostiach, mäkkom tkanive a extraregionálnych lymfatických uzlinách prostredníctvom PET s fluciklovínom (18F).
Diagnostický výkon použitím fluciklovínu (18F) v detekcii recidív nebol skúmaný u pacientov
s podozrením na recidívu na základe zvýšených koncentrácií PSA v krvi po primárnej radikálnej liečbe a s nedávnou pozitívnou celotelovou scintigrafiou skeletu.
Po vyšetrení
Pacienta je potrebné upozorniť, aby pil dostatočné množstvo tekutín a aby močil počas prvých hodín po skenovaní tak často, ako je to možné, aby sa znížila radiačná záťaž močového mechúra.
Počas prvých 12 hodín po podaní injekcie je potrebné obmedziť blízky kontakt s malými deťmi a tehotnými ženami.
Osobitné upozornenia
Tento liek obsahuje až 39 mg sodíka v dávke. Má sa vziať do úvahy u pacientov na diéte s kontrolovaným obsahom sodíka.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
Vplyv antimitotických látok a faktorov stimulujúcich kolónie na vychytávanie fluciklovínu u pacientov s rakovinou prostaty sa neskúmal.
4.6 Fertilita, gravidita a laktácia
Fluciklovín (18F) nie je indikovaný ženám. Fertilita
Nevykonali sa žiadne štúdie vplyvu na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Axumin nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Vystavenie sa pôsobeniu ionizujúceho žiarenia je spojené so vznikom rakoviny a potenciálom vzniku dedičných chýb. Keďže pri podaní maximálnej odporúčanej aktivity 370 MBq je efektívna dávka
8,2 mSv, očakáva sa, že k týmto nežiaducim reakciám bude dochádzať s nízkou pravdepodobnosťou.
Tabuľkovýprehľadnežiaducichreakcií
Počas klinických skúšaní boli nežiaduce reakcie hlásené často ( ≥ 1/100 až < 1/10 ). Sú uvedené nižšie na základe triedy orgánových systémov podľa databázy MedDRA.
T
rieda orgánových systémov
podľa databázy MedDRA
N
ežiaduce reakcie
Poruchy nervového systému Dysgeúzia
Poruchy dýchacej sústavy,
hrudníka a mediastína Celkové poruchy a reakcie v mieste podania
Parosmia
Reakcie v mieste vpichu
 H
l
ásenie
podozrení
na
nežiaduce
r
eakcie
H
l
ásenie
podozrení
na
nežiaduce
r
eakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 PredávkovanieV prípade predávkovania rádioktívne značeným fluciklovínom (18F)ak je to možné, treba u pacienta znížiť absorbovanú dávku zvýšením eliminácie rádionuklidu z tela forsírovanou diurézou, častým močením a defekáciou. V takýchto prípadoch môže byť užitočné odhadnúť efektívnu dávku, ktorá bola podaná.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Iné diagnostické rádiofarmaká na detekciu nádorov, ATC kód: V09IX12.
Mechanizmusúčinku
Fluciklovín (18F) je syntetická aminokyselina, ktorú cez bunkovú membránu cicavcov prenášajú transportéry aminokyselín ako sú LAT-1 a ASCT2. Je známe, že aktivity LAT-1 a ASCT2 sú zvýšené
pri rakovine prostaty, čím sa vysvetľuje mechanizmus zvýšenej akumulácie fluciklovínu (18F)
pri rakovine prostaty.
Kvantitatívna korelácia medzi vychytávaním fluciklovínu a zvýšeným vstupom (influxom) fluciklovínu do buniek nebola posudzovaná in vivo u zdravých dobrovoľníkov ani u pacientov s rakovinou prostaty.
Farmakodynamickéúčinky
Nepredpokladá sa, že by mal fluciklovín (18F) v koncentráciách používaných na diagnostické vyšetrenia farmakodynamickú aktivitu.
Klinickáúčinnosťabezpečnosť
Hlavné údaje o účinnosti sa získali od 115 pacientov zaradených do štúdie BED-001 v Emory University. Pacienti boli dospelí a starší muži s podozrením na recidívu na základe zvýšených koncentrácií PSA v krvi po primárnej kuratívnej liečbe lokalizovanej rakoviny prostaty a s negatívnou scintigrafiou skeletu. Pacienti, ktorí nepodstúpili chirurgický zákrok, boli liečení najmenej pred dvomi rokmi. PET-CT s fluciklovínom (18F) bolo obmedzené na brušno-panvovú oblasť.
Histopatologický štandard bol k dispozícii pre 99 zo 115 osôb. Histopatologické vyšetrenie extraprostatických oblastí(regionálne lymfatické uzliny alebo vzdialené miesta) bolo vykonané len z oblastí pozitívnych nálezov na snímkach.
Porovnanie diagnostického výkonu PET-CT s fluciklovínom (18F) na detekciu celkovej recidívy
( rôznej lokalizácie) a v troch rôznych lokalitách (prostata a jej lôžko, panvové lymfatické uzliny, vzdialené metastázy) je uvedené v tabuľke 1. Vzdialené metastázy zahŕňali distálne lymfatické uzliny, mäkké tkanivo a kosti.
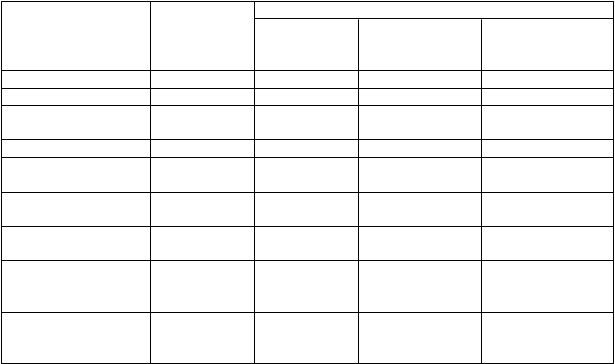
T
abuľka 1: Porovnanie diagnostického výkonu PET s fluciklovínom (
18
F
) vs. histopatologické vyšetrenie jednotlivých pacientov a oblastí
P
acienti Oblasť
P
rostata a lôžko prostaty
P
anvové regionálne uzliny
R
ecidíva mimo prostaty (panvová a distálna)
N 105 97 24 29
Pozitívni n (%) 73 (69,5) 57 (58,8) 23 (95,8) 27 (93,1)
Falošne pozitívni n
(%)
19 (18,1) 27 (27,8) 1 (4,2) 2 (6,9)
Negatívni n (%) 12 (11,4) 12 (12,4) 0 (0,0) 0 (0,0)
Falošne negatívni n
(%)
1 (1,0) 1(1,0) 0 (0,0) 0 (0,0)
Citlivosť
[95 % IS]
Špecificita
[95 % IS]
Pomer pozitívnej pravdepodobnosti
[95 % IS]
Pomer negatívnej pravdepodobnosti
[95 % IS]
98,6% (73/74)
[92,7-100%]
38,7% (12/31)
[21,8-57,8%]
1,61
[1,22 - 2,13]
0,03
[0 - 0,26]
98,3% (57/58)
[90,8-100%]
30,8% (12/39)
[17,0-47,6%]
1,42
[1,15 - 1,75]
0,06
[0,01 - 0,41]
Použitím nálezov iných relevantných zobrazovacích modalít a klinického sledovania ako referenčného
štandardu v populácii zaradených pacientov, citlivosť a špecificita PET-CT s fluciklovínom (18F)
v závislosti od pacienta na detekciu recidív v prostate alebo v lôžku prostaty boli 94,7 % (89/94) (95
% IS: 88,0-98,3 %), a 54,8 % (17/31) (95 % IS:36-72,7 %) v uvedenom poradí. Na detekciu recidív mimo prostaty (regionálne lymfatické uzliny a/alebo distálne metastázy) citlivosť bola 84,2 % (32/38)
(95 % IS: 68,7-94 %) a špecificita bola 89,7 % (78/87) (95 % IS: 81,3-95,2 %) v uvedenom poradí.
Diagnostický výkon PET-CT s fluciklovínom (18F) realizovaný na pacientoch podľa koncentrácie PSA
v krvi je uvedený v tabuľke 2.
Tabuľka 2: Vplyv koncentrácie PSA v krvi na diagnostický výkon PET-CT s fluciklovínom (18F)realizovaný na pacientoch v štúdii BED-001 Emory
PSA (ng/mL)
≤ 1,05 > 1,05 - ≤ 3,98 > 3,98 - ≤8,90 > 8,90
Počet osôb v analýze 16 31 25 27
Pozitívni (%) 3 (18,8) 23 (74,2) 20 (80) 23 (85,2) Falošne pozitívni (%) 4 (25) 5 (16,1) 4 (16) 4 (14,8)
Negatívni (%) 8 (50) 3 (9,7) 1 (4)
Falošne negatívni (%) 1 (6,3) 0 (0) 0 (0)
Citlivosť 75 % (3/4) 100 % (23/23) 100 % (20/20) 100 % (23/23)
[95 % IS] [19,4 - 99,4 %] [85,2 - 100 %] [83,2 – 100 %] [85,2 – 100 %] Špecificita 66,7 % (8/12) 37,5 % (3/8) 20 % (1/5)
[95 % IS] [34,9 - 90,1 %] [8,5 - 75,5 %] [0,5 - 71,6 %]
V ďalšej štúdii BED002 vykonali traja hodnotitelia „zaslepenú“ interpretáciu snímok PET-CT
s fluciklovínom (18F) z podskupiny údajov štúdie BED-001 z Emory.. „Zaslepené“ interpretácie boli porovnané s histologickým štandardom. Citlivosť fluciklovínu (18F) v závislosti od pacienta bola
vyššia ako 88,6 % pri všetkých troch hodnotiteľoch, kým špecificita bola v rozsahu 17,2-53,6 %.
Pediatrickápopulácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Axuminom v jednej alebo vo viacerých podskupinách pediatrickej populácie na diagnostiku aminokyselinového
metabolizmu pri solídnych nádoroch (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Distribúcia
Okamžite po podaní sa fluciklovín (18F) distribuuje do pečene (14 % podanej aktivity), pankreasu (3
%), pľúc (7 %), červenej kostnej drene (12 %) a steny srdca (4 %).
Fluciklovín sa nezačleňuje do bielkovín. Fluciklovín sa nemetabolizuje in vivo.
Vychytávaniedoorgánov
Fluciklovín (18F) sa hromadí v karcinóme prostaty a iných typoch rakoviny, ale tiež v normálnych tkanivách a pri niektorých iných patologických stavoch prostaty (ako sú benígna hyperplázia prostaty, chronická prostatitída, intraepiteliálna hyperplázia prostaty vysokého stupňa). Okrem toho sa vychytávanie fluciklovínu môže zvýšiť v súvislosti so zápalovou reakciou na nedávnu rádioterapiu alebo kryoterapiu.
Fluciklovín (18F) sa prednostne vychytáva bunkami rakoviny prostaty v porovnaní s okolitým normálnym tkanivom. Vychytávanie nádormi je rýchle, pričom najväčší kontrast medzi nádorom
a normálnym tkanivom je medzi 4. a 10. minútou po injekcii a pokračuje ďalších 30 minút; k 61 %-
nému zníženiu priemerného vychytávania nádorom dochádza 90 minút po injekcii.
Vymývanie aktivity z väčšiny orgánov a tkanív (s výnimkou pankreasu) je pomalé. Aktivita v mozgu je nízka. S pribúdajúcim časom po injekcii je viditeľná distribúcia vychytávania, ktorá je hlavne spojená s kostrovým svalstvom. Vymývanie aktivity 18F z krvi prebieha tak, že približne polovica maximálnej koncentrácie 18F v krvi sa dosiahne približne do 1 hodiny po podaní.
Eliminácia
Fluciklovín sa nemetabolizuje in vivo. Hlavnou cestou eliminácie je vylučovanie obličkami. Vylučovanie močom je pomalé a dosahuje približne 3 % podanej rádioaktivity v priebehu 4 hodín a'
5 % v priebehu 24 hodín.
Polčaspremeny
Účinný biologický polčas fluciklovínu (18F) sa rovná polčasu premeny fluóru (18F), čo je približne
110 minút.
Poruchafunkcieobličiek/pečene
Farmakokinetika u pacientov s poruchou funkcie obličiek alebo pečene nebola charakterizovaná.
V štúdiách in vitro nedochádzalo k vychytávaniu fluciklovínu (18F) bežnými transportérmi liečiv, čo poukazuje na zanedbateľný potenciál vzniku liekových interakcií.
5.3 Predklinické údaje o bezpečnosti
Toxikologické štúdie na potkanoch a psoch preukázali, že v prípade jednorazovej intravenóznej injekcie neboli pozorované žiadne úmrtia. Pri opakovanom podávaní až 1 000 mcg/kg/deň potkanom a psom počas 14 dní nebola pozorovaná toxicita. Tento liek nie je určený na pravidelné alebo nepretržité podávanie. Dlhodobé štúdie karcinogenity sa nevykonali.
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní a genotoxicity neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Citronan sodný
Koncentrovaná kyselina chlorovodíková
Hydroxid sodný
Voda na injekcie
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6 a 12.
6.3 Čas použiteľnosti
Axumin1600MBq/mlinjekčnýroztok
8 hodín od času kalibrácie (ToC)
Axumin3200MBq/mlinjekčnýroztok
10 hodín od času kalibrácie (ToC)
Pripoužívaní
Chemická a fyzikálna stabilita počas používania v trvaní 8 hodín bola preukázaná pre Axumin 1
600 MBq/ml a v trvaní 10 hodín pre Axumin 3 200 MBq/ml.
Z mikrobiologického hľadiska, okrem prípadu, keď metóda otvorenia /odobratia dávky/ riedenia bráni riziku mikrobiologickej kontaminácie, liek sa má použiť okamžite.
Ak sa nepoužije okamžite, doba a podmienky uchovávania počas používania sú zodpovednosťou používateľa.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávanie rádiofarmák má byť v súlade s národnými predpismi pre rádioaktívne materiály.
6.5 Druh obalu a obsah balenia
Axumin sa dodáva v sklenených injekčných liekovkách typu 1 v objeme 10 ml alebo 15 ml, uzatvorených fluórované chlorobutylové, chlórbutylovou alebo brómbutylovou gumovou zátkou a hliníkovým tesniacim krytom.
Axumin1600MBq/mlinjekčnýroztok
Jedna injekčná liekovka obsahuje 1 až 10 ml roztoku, čo zodpovedá 1 600 až 16 000 MBq v čase kalibrácie.
Axumin3200MBq/mlinjekčnýroztok
Jedna injekčná liekovka obsahuje 1 až 10 ml roztoku, čo zodpovedá 3 200 až 32 000 MBq v čase kalibrácie.
Na trh nemusia byť uvedené všetky veľkosti balenia.
Výsledkom výrobného postupu sa niektoré injekčné liekovky distribuujú s prepichnutými gumovými zátkami.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Vš
e
obecné
upozornenie
Rádiofarmaká majú prijímať, používať a podávať iba oprávnené osoby v určených klinických zariadeniach. Ich príjem, uchovávanie, používanie, preprava a likvidácia podliehajú predpisom a/alebo príslušným povoleniam kompetentných oficiálnych organizácií.
Rádiofarmaká sa majú pripravovať spôsobom, ktorý spĺňa požiadavky radiačnej bezpečnosti aj farmaceutickej kvality. Je potrebné dodržiavať primerané aseptické opatrenia.
Pokyny na riedenie lieku pred podaním, pozri časť 12.
Ak sa celistvosť injekčnej liekovky poruší kedykoľvek počas prípravy tohto lieku, injekčná liekovka sa nemá používať.
Postupy podávania sa majú vykonávať tak, aby sa minimalizovalo riziko kontaminácie lieku a ožiarenia operátorov. Dostatočné tienenie je povinné.
Podávanie rádiofarmák vytvára riziká pre ďalšie osoby vyplývajúce z externého žiarenia alebo kontaminácie následkom úniku moču, vracania, atď. Z tohto dôvodu treba dodržiavať opatrenia na ochranu pred žiarením v súlade s národnými predpismi.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Blue Earth Diagnostics Ltd
215 Euston Road
London NW1 2BE Veľká Británia
8. REGISTRAČNÉ ČÍSLA
EU/1/17/1186/001
EU/1/17/1186/002
EU/1/17/1186/003
EU/1/17/1186/004
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 22. mája 2017
10. DÁTUM REVÍZIE TEXTU
11. DOZIMETRIA
Odhadované dávky absorbovaného žiarenia pre dospelých pacientov po intravenóznej injekcii fluciklovínu (18F) sú uvedené v Tabuľke 3. Hodnoty boli vypočítané z údajov o biodistribúcii u ľudí pomocou softvéru OLINDA/EXM (Organ Level Internal Dose Assessment/Exponential Modeling).
Tabuľka 3: Odhadované dávky absorbovaného žiarenia pre dospelých, ktorým bol podanýAxuminOrgán/tkanivo Priemerná absorbovaná dávka na jednotku podanej aktivity (µGy/MBq)Nadobličky 16
Mozog 9
Prsia 14
Stena žlčníka 17
Stena dolnej časti hrubého čreva 12
Stena tenkého čreva 13
Stena žalúdka 14
Stena hornej časti hrubého čreva 13
Stena srdca 52
Obličky 14
Pečeň 33

Pľúca 34
Sval 11
Vaječníky 13
Pankreas 102
Červená kostná dreň 25
Osteogénne bunky 23
Koža 8
Slezina 24
Semenníky 17
Týmus 12
Štítna žľaza 10
Stena močového mechúra 25
Maternica 45
Celkovo telo 13
Účinná dávka 22 (µSv/MBq)Efektívna dávka u dospelých vyplývajúca z podania odporúčanej aktivity 370 MBq fluciklovínu (18F)
je 8,2 mSv. Pre podanú aktivitu 370 MBq sú typické dávky žiarenia do kritických orgánov, pankreasu, srdcovej steny a steny maternice 37,8 mGy, 19,1 mGy, a 16,5 mGy v uvedenom poradí.
12. POKYNY NA PRÍPRAVU RÁDIOFARMÁKSpôsobprípravyTento liek možno až 8-násobne (1 diel Axuminu a 7 dielov rozpúšťadla) zriediť injekčným roztokom chloridu sodného 9 mg/ml (0,9 %).
Odbery dávok sa majú konať za aseptických podmienok. Injekčná liekovka sa nesmie otvoriť predtým, ako sa dezinfikuje zátka; roztok sa má odobrať cez zátku pomocou jednorazovej injekčnej striekačky vybavenej vhodným ochranným tienením a jednorazovou sterilnou ihlou, alebo pomocou schváleného automatizovaného aplikačného systému.
Ak je porušená celistvosť injekčnej liekovky, liek sa nemá používať.
Axumin sa má používať iba keď je injekčný objem väčší ako 0,5 ml (približne 2 hodiny po čase kalibrácie pre Axumin 1 600 MBq/ml a 4 hodiny po čase kalibrácie pre Axumin 3 200 MBq/ml).
Ak je injekčný objem medzi 0,5 a 1 ml, treba používať iba injekčné striekačky vhodnej veľkosti
(1 ml).
KontrolakvalityPred použitím sa má roztok vizuálne skontrolovať. Môžu sa použiť iba číre roztoky bez prítomnosti viditeľných častíc.
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
htp://www.ema.europa.eu.