4.4 Osobitné upozornenia a opatrenia pri používaní
Osobitné riziko predstavujú pacienti s klinicky nestabilnou APL a vyžiadajú si častejšie sledovanie hladín elektrolytu a glykémie, ako aj častejšie vyšetrenia hematologických, hepatálnych, renálnych a koagulačných parametrov.
Syndróm leukocytovejaktivácie(diferenciačnýsyndrómAPL)
27 % percent pacientov s APL v relapse/refraktérnom stave liečených oxidom arzenitým pociťovalo
symptómy podobné syndrómu nazývanému retinoicko-kyselinová akútna promyelocytová leukémia (RA-APL) alebo diferenciačný syndróm APL, charakterizovaných horúčkou, dyspnoe, prírastkom telesnej hmotnosti, pulmonárnymi infiltrátmi a pleurálnou alebo perikardiálnou efúziou
s leukocytózou alebo bez nej. Tento syndróm môže byť fatálny. U pacientov s novodiagnostikovanou
APL liečených oxidom arzenitým a ATRA sa pozoroval diferenciačný syndróm APL u 19 %
pacientov vrátane 5 vážnych prípadov. Pri prvých prejavoch, ktoré by mohli poukázať na syndróm (nevysvetliteľná horúčka, dyspnoe a/alebo prírastok telesnej hmotnosti, abnormálne auskultačné nálezy na hrudníku alebo rádiografické abnormality) sa musí dočasne prerušiť liečba oxidom arzenitým a okamžite sa musia podať steroidy vo vysokých dávkach (dexametazón 10 mg intravenózne dvakrát denne), nezávisle od počtu leukocytov, a pokračovať v ich podávaní najmenej
3 dni alebo dlhšie, až kým sa prejavy a symptómy nezmiernia. V klinicky odôvodnených/požadovaných prípadoch sa tiež odporúča súbežná liečba diuretikami. U väčšiny pacientov nie je nutné počas liečby diferenciačného syndrómu APL trvalé ukončenie terapie oxidom arzenitým. Po ustúpení prejavov a príznakov sa môže počas prvých 7 dní liečba oxidom arzenitým obnoviť na úrovni 50 % predchádzajúcej dávky. Následne, ak nedôjde k zhoršeniu predchádzajúcej toxicity, je možné obnoviť podávanie oxidu arzenitého v plnej dávke. V prípade opätovného výskytu symptómov sa má dávkovanie oxidu arzenitého znížiť na predchádzajúcu dávku. Aby sa zabránilo rozvoju diferenciačného syndrómu APL počas indukčnej liečby je možné od 1. dňa aplikácie oxidu arzenitého až po koniec indukčnej terapie u APL pacientov podávať prednizón (0,5 mg/kg telesnej hmotnosti denne počas indukčnej liečby). Neodporúča sa dopĺňať liečbu steroidmi chemoterapiou, pretože nie sú k dispozícii žiadne skúsenosti s podávaním steroidov aj chemoterapiou počas liečby syndrómu leukocytovej aktivácie spôsobeného oxidom arzenitým. Skúsenosti po uvedení lieku na trh naznačujú, že podobný syndróm sa môže vyskytnúť u pacientov s inými typmi zhubného nádoru. Sledovanie a manažment týchto pacientov majú prebiehať tak, ako je to opísané vyššie.
Abnormality elektrokardiogramu (EKG)
Oxid arzenitý môže spôsobovať predĺženie intervalu QT a úplnú atrioventrikulárnu blokádu.
Predĺženie QT môže viesť k ventrikulárnej dysrytmii typu torsade de pointes, ktorá môže byť fatálna. Predchádzajúca liečba antracyklínmi môže zvyšovať riziko predĺženia QT. Riziko torsade de pointes závisí od rozsahu predĺženia QT, súbežného podávania liekov predlžujúcich QT (ako sú antidysrytmiká triedy Ia a III (napr. chinidín, amiodarón, sotalol, dofetilid), antipsychotiká (napr. tioridazín), antidepresíva (napr. amitriptylín), niektoré makrolidové antibiotiká (napr. erytromycín), niektoré antihistaminiká (napr. terfenadín a astemizol), niektoré chinolónové antibiotiká (napr. sparfloxacín), a ďalšie jednotlivé lieky, o ktorých je známe, že predlžujú interval QT (napr. cisaprid)), ako aj od anamnézy torsade de pointes, už existujúceho predĺženia intervalu QT, kongestívneho zlyhania srdca, podávania diuretík spôsobujúcich stratu draslíka, amfotericínu B alebo od iných stavov, ktoré spôsobujú hypokaliémiu alebo hypomagneziémiu. U 40 % pacientov
v relapse/refraktérnom stave liečených oxidom arzenitým bolo v klinických skúšaniach zaznamenané najmenej jedno predĺženie korigovaného intervalu QT (QTc) väčšie ako 500 ms. Predĺženie QTc sa pozorovalo v období medzi 1. a 5. týždňom po začiatku infúzií oxidu arzenitého, potom sa do konca 8. týždňa od začiatku infúzie oxidu arzenitého vrátilo na východiskové hodnoty. U jedného pacienta (súbežne užívajúceho viaceré lieky vrátane amfotericínu B) sa počas indukčnej terapie relapsu APL oxidom arzenitým vyskytla asymptomatická torsade de pointes. U pacientov s novodiagnostikovanou APL sa v 15,6 % prípadoch vyskytlo predĺženie QTc pri podaní oxidu arzenitého v kombinácii
s ATRA (pozri časť 4.8). U jedného novodiagnostikovaného pacienta bola indukčná liečba ukončená
z dôvodu závažného predĺženia QTc intervalu a abnormalít elektrolytov na 3. deň indukčnej liečby.
O
dporúčania
na
sl
e
dovanie
E
K
G
a elektrolytu
Pred začiatkom liečby oxidom arzenitým sa musí vykonať 12-zvodové EKG a musia byť stanovené elektrolyty séra (draslík, vápnik a horčík) a kreatinín; musia byť korigované už existujúce abnormality elektrolytu a, podľa možnosti, musí byť ukončené podávanie liekov, o ktorých je známe, že predlžujú interval QT. Pacienti s rizikovými faktormi predĺženia QTc alebo rizikovými faktormi Torsade de pointes musia mať kontinuálne sledovanú činnosť srdca (EKG). Pri QTc dlhšom ako 500 ms sa musia dokončiť korektívne opatrenia a pred tým, ako sa zvažuje použitie oxidu arzenitého, sa musí QTc znova vyhodnotiť sériou EKG a, ak je k dispozícii, treba vyhľadať radu odborníka. Počas liečby oxidom arzenitým sa musia koncentrácie draslíka udržiavať nad úrovňou 4 mEq/l a koncentrácie horčíka sa musia udržiavať nad 1,8 mg/dl. Pacienti, u ktorých absolútna hodnota intervalu QT presiahne > 500 ms, sa musia znovu vyšetriť a musia sa podniknúť okamžité opatrenia na korekciu sprievodných rizikových faktorov, ak takéto faktory existujú, pričom sa musí zvážiť riziko/prínos pokračovania alebo ukončenia liečby oxidom arzenitým. Ak sa vyskytne synkopa, zrýchlený alebo nepravidelný srdcový tep, pacient musí byť hospitalizovaný a nepretržite sledovaný, musia byť stanovené elektrolyty v sére, a liečba oxidom arzenitým sa musí dočasne prerušiť, až kým interval
QTc neklesne pod 460 ms, kým nebudú korigované abnormality elektrolytov, a kým neskončí synkopa a nepravidelný srdcový tep. Po zotavení sa má liečba obnoviť na úrovni 50 % predchádzajúcej dennej dávky. Ak sa predĺženie QTc nevráti do 7 dní po opätovnom začatí liečby v zníženej dávke, liečba oxidom arzenitým sa môže obnoviť v dávke 0,11 mg/kg telesnej hmotnosti denne počas druhého týždňa. Denná dávka sa môže v prípade, že nedôjde k predĺženiu, zvyšovať späť na 100 % pôvodnej dávky. Nie sú k dispozícii žiadne údaje o vplyve oxidu arzenitého na interval QTc počas infúzie.
Počas indukcie a konsolidácie sa musia dvakrát týždenne získať elektrokardiogramy, a v prípade
klinicky nestabilných pacientov aj častejšie.
Hepatotoxicita (3. stupeňalebovyšší)
U novodiagnostikovaných pacientov s nízkym až stredne vysokým rizikom APL sa počas indukčnej alebo konsolidačnej liečby oxidom arzenitým v kombinácii s ATRA v 63,2 % prípadoch vyvinuli hepatálne toxické účinky 3. alebo 4. stupňa (pozri časť 4.8). Toxické účinky však po dočasnom vysadení oxidu arzenitého, ATRA alebo oboch ustúpili. Vždy, keď sa pozoruje hepatotoxicita
3. stupňa alebo vyššia podľa všeobecných kritérií toxicity Národného onkologického inštitútu
(National Cancer Institute Common Toxicity Criteria), liečba oxidom arzenitým sa musí vysadiť pred plánovaným ukončením terapie. Hneď ako sa hladina bilirubínu a/alebo SGOT a/alebo alkalickej fosfatázy zníži na úroveň nižšiu ako 4-násobok normálnej hornej úrovne, liečba oxidom arzenitým sa má počas prvých 7 dní obnoviť na úrovni 50 % predchádzajúcej dávky. Následne, ak nedôjde
k zhoršeniu predchádzajúcej toxicity, sa má obnoviť podávanie oxidu arzenitého v plnej dávke. V prípade opätovného výskytu hepatotoxicity sa musí oxid arzenitý trvale vysadiť.
Oddialenie a úprava dávky
Liečba oxidom arzenitým sa musí dočasne prerušiť pred plánovaným ukončením terapie vždy, keď bude spozorovaná toxicita tretieho alebo vyššieho stupňa podľa Všeobecných kritérií toxicity
Národného onkologického inštitútu, a ak bude posúdená ako potenciálne súvisiaca s oxidom arzenitým
(pozri časť 4.2).
Laboratórne vyšetrenia
Hladiny elektrolytov a glykémia ako aj vyšetrenia hematologických, hepatálnych, renálnych
a koagulačných parametrov pacienta sa musia počas indukčnej fázy sledovať najmenej dvakrát
týždenne, u klinicky nestabilných pacientov častejšie a počas fázy konsolidácie najmenej raz týždenne.
Pacienti s poruchou funkcieobličiek
Keďže pre všetky skupiny s poruchou funkcie obličiek nie sú k dispozícii žiadne údaje, pri používaní
oxidu arzenitého u pacientov s poruchou funkcie obličiek sa odporúča opatrnosť. Skúsenosť
u pacientov so závažnou poruchou funkcie obličiek je nedostatočná na to, aby sa zistilo, či je potrebná
úprava dávky. Použitie oxidu arzenitého u pacientov na dialýze sa neskúmalo.
Pacienti s poruchou funkciepečene
Keďže pre všetky skupiny s poruchou funkcie pečene nie sú k dispozícii žiadne údaje a počas liečby
oxidom arzenitým sa môžu vyskytnúť hepatotoxické účinky, pri používaní oxidu arzenitého
u pacientov s poruchou funkcie pečene sa odporúča opatrnosť (pozri časť 4.4 o hepatotoxicite
a časť 4.8). Skúsenosť u pacientov so závažnou poruchou funkcie pečene je nedostatočná na to, aby sa zistilo, či je potrebná úprava dávky.
Staršie osobyO použití oxidu arzenitého u staršej populácie sú k dispozícii obmedzené klinické údaje. U týchto pacientov je potrebná opatrnosť.
HyperleukocytózaU niektorých pacientov s relapsujúcou/refraktérnou APL bola liečba oxidom arzenitým spojená so vznikom hyperleukocytózy (≥ 10 x 103/µl). Zdá sa, že súvislosť medzi počiatočnými počtami bielych krviniek a vznikom hyperleukocytózy neexistuje; ani korelácia medzi východiskovým počtom leukocytov a maximálnymi počtami leukocytov. Hyperleukocytóza nebola nikdy liečená ďalšou chemoterapiou a vyriešila sa pri ďalšom podávaní oxidu arzenitého. Počty leukocytov počas konsolidácie neboli také vysoké, ako počas indukčnej liečby a boli < 10 x 103/µl, okrem jedného pacienta, ktorý mal počas konsolidácie počet leukocytov 22 x 103/µl. U dvadsiatich pacientov
s relapsujúcou/refraktérnou APL (50 %) bola pozorovaná leukocytóza; u všetkých týchto pacientov
však počet leukocytov klesal alebo sa do času remisie kostnej drene postupne normalizoval a nebola potrebná cytotoxická chemoterapia ani leukoferéza. U novodiagnostikovaných pacientov s nízkym až
stredne vysokým rizikom APL sa počas indukčnej terapie u 35 zo 74 (47 %) pacientov vyvinula
leukocytóza (pozri časť 4.8). Všetky prípady však boli úspešne liečené hydroxyureou.
U novodiagnostikovaných pacientov a pacientov s relapsujúcou/refraktérnou APL, u ktorých sa po začatí liečby vyvinie trvalá leukocytóza, sa má podať hydroxurea. Hydroxyurea sa má naďalej podávať v danej dávke na udržanie počtu leukocytov na úrovni ≤ 10 x 103/μl a následne sa má znižovať.
Tabuľka 1: Odporúčanie pre nasadenie hydroxyurey
Počet leukocytov
| hydroxyurea
|
10 – 50 x 103/µl
| 500 mg štyrikrát denne
|
> 50 x 103/µl
| 1 000 mg štyrikrát denne
|
Vznik druhých primárnych malignítÚčinná látka lieku Arsenic trioxide Accord, oxid arzenitý, je ľudský karcinogén. U pacientov sledujte vznik druhých primárnych malignít.
Arsenic trioxide Accord obsahuje sodík:
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t.j. v podstate zanedbateľné
množstvo sodíka.
4.5 Liekové a iné interakcieNeuskutočnili sa žiadne oficiálne hodnotenia farmakokinetických interakcií medzi oxidom arzenitým a inými terapeutickými liekmi.
Lieky, o ktorýchjeznáme,žespôsobujúpredĺženieintervaluQT/QTc,hypokaliémiualebohypomagnéziémiuPočas liečby oxidom arzenitým sa očakáva predĺženie QT/QTc a hlásila sa Torsade de pointes a úplná
srdcová blokáda. Riziko torsade de pointes je vyššie u pacientov, ktorí užívajú alebo užívali lieky, o ktorých je známe, že spôsobujú hypokaliémiu alebo hypomagneziémiu, ako sú diuretiká alebo
amfotericín B. Opatrnosť sa odporúča pri podávaní oxidu arzenitého súbežne s inými liekmi, o ktorých
je známe, že spôsobujú predĺženie intervalu QT/QTc, ako sú makrolidové antibiotiká, antipsychotikum
tioridazín, alebo lieky, o ktorých je známe, že spôsobujú hypokaliémiu alebo hypomagneziémiu.
Ďalšie informácie o liečivách predlžujúcich QT sa uvádzajú v časti 4.4.
L
i
eky, o ktorých jeznáme,žespôsobujúhepatotoxickéúčinky
Počas liečby oxidom arzenitým sa môžu vyskytnúť hepatotoxické účinky. Pri súbežnom podávaní
oxidu arzenitého s inými liekmi, o ktorých je známe, že spôsobujú hepatotoxické účinky, sa odporúča opatrnosť (pozri časť 4.4. a 4.8).
Iné antileukemické lieky
Vplyv oxidu arzenitého na účinnosť iných antileukemických liekov nie je známy.
4.6 Fertilita, gravidita a laktácia
Antikoncepcia u mužov a žien
Ženy vo fertilnom veku a muži musia používať účinnú antikoncepciu počas liečby oxidom arzenitým.
Gravidita
Štúdie na zvieratách preukázali embryotoxicitu a teratogenicitu oxidu arzenitého (pozri časť 5.3).
Neuskutočnili sa žiadne štúdie u gravidných žien používajúcich oxid arzenitý. Ak sa tento liek používa
počas gravidity alebo ak pacientka zatiaľ čo používa tento liek otehotnie, musí byť informovaná
o potenciálnej škodlivosti na plod.
Dojčenie
Arzén sa vylučuje do ľudského mlieka. Pred podávaním a počas podávania oxidu arzenitého sa musí
dojčenie kvôli možnosti závažných nežiaducich reakcií u dojčiat a dojčených detí ukončiť.
Fertilita
Neuskutočnili sa žiadne klinické ani neklinické štúdie fertility s oxidom arzenitým.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Oxid arzenitý nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať
stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Nežiaduce reakcie 3. a 4. stupňa súvisiace s chlórtetracyklínom sa v klinických skúšaniach vyskytli
u 37 % pacientov s relapsujúcou/refraktérnou APL. Najčastejšie hlásenými reakciami boli hyperglykémia, hypokaliémia, neutropénia a zvýšená alanínaminotransferáza (ALT). Leukocytóza sa vyskytla u 50 % pacientov s relapsujúcou/refraktérnou APL, bola stanovená skôr na základe hematologických hodnotení.
Závažné nežiaduce reakcie boli časté (1 - 10 %) a v populácii s relapsujúcou/refraktérnou APL neboli neočakávané. Medzi závažné nežiaduce reakcie pripisované oxidu arzenitému patril diferenciačný syndróm APL (3), leukocytóza(3), predĺžený interval QT (4, 1 vrátane torsade de pointes), fibrilácia predsiení/flutter predsiení (1), hyperglykémia(2) a rôznorodé závažné nežiaduce reakcie súvisiace
s hemorágiou, infekciami, bolesťou, hnačkou, nauzeou.
Nežiaduce udalosti vyžadujúce naliehavú liečbu mali všeobecne tendenciu postupom času ustupovať, u pacientov s relapsujúcou/refraktérnou APL možno z dôvodu zlepšenia priebehu základného ochorenia. Pacienti mali tendenciu tolerovať konsolidačnú a udržiavaciu liečbu s nižšou toxicitou ako pri indukčnej liečbe. To je pravdepodobne kvôli nezvládnutiu nežiaducich udalostí pri
nekontrolovanom procese ochorenia na začiatku alebo v priebehu liečby a nespočetnému množstvu liekov potrebných na potlačenie symptómov a morbidity.
V multicentrickom skúšaní neinferiority fázy 3 porovnávajúcom kyselinu all-
trans-retinovú (ATRA)
v kombinácii s chemoterapiou oproti ATRA v kombinácii s oxidom arzenitým u pacientov
s novodiagnostikovanou APL s nízkym až stredne vysokým rizikom (štúdia APL0406, pozri tiež časť 5.1) sa u pacientov liečených oxidom arzenitým pozorovali závažné nežiaduce reakcie vrátane pečeňovej toxicity, trombocytopénie, neutropénie a predĺženia intervalu QTc.
Tabuľkový zoznam nežiaducich reakciíV štúdii APL0406 u novodiagnostikovaných pacientov a počas klinických skúšaní a/alebo po uvedení
lieku na trh u pacientov s relapsujúcou/refraktérnou APL boli hlásené nasledujúce nežiaduce účinky.
V tabuľke 2 nižšie uvádzame zoznam nežiaducich účinkov počas klinických skúšaní oxidu arzenitého s 52 pacientmi s refraktérnou/relapsovanou APL, zoradené podľa klasifikácie triedy orgánových systémov a frekvencie MedDRA. Frekvencie sú definované nasledovne: (veľmi časté ≥ 1/10), (časté
≥ 1/100 až < 1/10), (menej časté ≥ 1/1 000 až < 1/100), neznáme (z dostupných údajov).
Všetky stupne Stupne ≥ 3
| Infekcie a nákazy
Herpes zoster časté neznáme Sepsa neznáme neznáme Pneumónia neznáme neznáme
| Poruchy krvi a lymfatického systému
Anémia časté neznáme Febrilná neutropénia časté časté Leukocytóza časté časté
Neutropénia časté časté
Pancytopénia časté časté
Trombocytopénia časté časté Leukopénia neznáme neznáme Lymfopénia neznáme neznáme
| Poruchy metabolizmu a výživy
Hyperglykémia veľmi časté veľmi časté Hypokaliémia veľmi časté veľmi časté Hypomagneziémia veľmi časté časté
Hypermagneziémia časté neznáme
Hypernatriémia časté časté
Ketoacidóza časté časté Dehydratácia neznáme neznáme Hromadenie tekutín neznáme neznáme
| Psychické poruchy
tav zmätenosti neznáme neznáme
| Poruchy nervového systému
Parestézia veľmi časté časté
Závrat veľmi časté neznáme Bolesť hlavy veľmi časté neznáme Konvulzia časté neznáme
| Poruchy oka
Neostré videnie časté neznáme
| Poruchy srdca a srdcovej činnosti
Tachykardia veľmi časté časté
Perikardiálna efúzia časté časté
Ventrikulárne extrasystoly časté neznáme
|
|
|
V každej skupine sa nežiaduce účinky uvádzajú podľa klesajúcej závažnosti. Tabuľka 2
V
š
etky stupne Stupne ≥ 3
|
Zlyhanie srdca neznáme neznáme
Ventrikulárna tachykardia neznáme neznáme
|
P
oruchy ciev
Vaskulitída časté časté
Hypotenzia časté neznáme
|
P
oruchy dýchacej sústavy, hrudníka a mediastína
Diferenciačný syndróm veľmi časté veľmi časté
Dyspnoe veľmi časté časté
Hypoxia časté časté Pleurálna efúzia časté časté Pleuritická bolesť časté časté Pulmonálna alveolárna hemorágia časté časté Pneumonitída neznáme neznáme
|
P
oruchy gastrointestinálneho traktu
Vracanie veľmi časté neznáme
Hnačka veľmi časté časté Nauzea veľmi časté neznáme Bolesti brucha časté časté
|
P
oruchy kože a podkožného tkaniva
Svrbenie veľmi časté neznáme
Vyrážky veľmi časté neznáme Erytém časté časté Opuch tváre časté neznáme
|
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Myalgia veľmi časté časté
Artralgia časté časté
Bolesti kostí časté časté
|
P
oruchy obličiek a močových ciest
Zlyhanie obličiek časté neznáme
|
C
elkové poruchy a reakcie v mieste podania
Pyrexia veľmi časté časté
Bolesť veľmi časté časté
Únava veľmi časté neznáme Edém veľmi časté neznáme Bolesti na hrudníku časté časté Triaška časté neznáme
|
L
aboratórne a funkčné vyšetrenia
Zvýšená alanínaminotransferáza veľmi časté časté
Zvýšená aspartátaminotransferáza veľmi časté časté
Elektrokardiogram predĺžený QT veľmi časté časté Hyperbilirubinémia časté časté Zvýšený kreatinín v krvi časté neznáme Zvýšená telesná hmotnosť časté neznáme Zvýšená gama-glutamyltransferáza* neznáme* neznáme*
|
*
V štúdií CALGB C9710 boli hlásené 2 prípady stupňa zvýšenej gama-glutamyltransferázy > 3 z 200pacientov, ktorí dostávali cyklus konsolidačnej liečby oxidom arzenitým (cyklus 1 a cyklus 2)v porovnaní s kontrolnou vetvou, v ktorej ju pacienti nedostávali.Popis niektorých nežiaducich reakciíDiferenciačnýsyndrómPočas liečby oxidom arzenitým malo 14 z 52 pacientov s APL v štúdiách v situácii s relapsom jeden alebo viaceré symptómy diferenciačného syndrómu APL, charakterizované horúčkou, dyspnoe, prírastkom telesnej hmotnosti, pulmonárnymi infiltrátmi a pleurálnou alebo perikardiálnou efúziou
s leukocytózou alebo bez nej (pozri časť 4.4). Dvadsaťsedem pacientov malo počas indukcie
leukocytózu (WBC ≥ 10 x 103/µl), z toho 4 s hodnotami nad 100 000/µl. Východiskové počty bielych krviniek (WBC) nekorelujú s vývojom leukocytózy v priebehu štúdie a počty WBC počas konsolidačnej terapie neboli také vysoké ako počas indukčnej terapie. V týchto štúdiách sa leukocytóza neliečila chemoterapeutikami. Lieky používané na zníženie počtu bielych krviniek často
zhoršujú toxicitu spojenú s leukocytózou a žiadny štandardný prístup sa neukázal ako efektívny. Jeden
pacient liečený v rámci programu humanitárneho použitia zomrel na mozgovú mŕtvicu v dôsledku leukocytózy po liečbe chemoterapeutikami na zníženie počtu leukocytov. Odporúčaný prístup je
pozorovanie a zákrok iba vo vybraných prípadoch.
Mortalita na hemorágiu súvisiacu s diseminovanou intravaskulárnou koaguláciou (DIC) bola
v kľúčových štúdiách v situácii s relapsom veľmi častá (> 10 %), čo zodpovedá mortalite v ranej fáze uvádzanej v literatúre.
U novodiagnostikovaných pacientov s nízkym až stredne vysokým rizikom APL sa diferenciačný
syndróm pozoroval u 19 % pacientov vrátane 5 závažných prípadov.
Po uvedení lieku na trh bol pri použití oxidu arzenitého v liečbe malignít iných ako APL hlásený aj diferenciačný syndróm, ako napríklad syndróm kyseliny retinovej.
PredĺženieintervaluQTOxid arzenitý môže spôsobiť predĺženie intervalu QT (pozri časť 4.4). Predĺženie QT môže viesť
k ventrikulárnej dysrytmii typu torsade de pointes, ktorá môže byť fatálna. Riziko torsade de pointes je
závislé od stupňa predĺženia QT, súbežného podávania liekov predlžujúcich QT a anamnézy torsade de pointes, od preexistujúceho predĺženia intervalu QT, kongestívneho zlyhania srdca, podávania
diuretík spôsobujúcich stratu draslíka, alebo od iných stavov, ktorých dôsledkom je hypokaliémia
alebo hypomagneziémia. Jedna pacientka (užívajúca súbežne viaceré lieky vrátane amfotericínu B) mala počas indukčnej terapie relapsu APL oxidom arzenitým asymptomatickú torsade de pointes. Prešla na konsolidáciu bez ďalších príznakov predĺženia QT.
U novodiagnostikovaných pacientov s nízkym až stredne vysokým rizikom APL sa predĺženie intervalu QTc pozorovalo v 15,6 % prípadoch. U jedného pacienta sa indukčná liečba ukončila z dôvodu závažného predĺženia intervalu QTc a abnormalít elektrolytov na 3. deň.
Periférna neuropatiaPeriférna neuropatia charakterizovaná parestéziou/dysestéziou je častý a všeobecne známy účinok
environmentálneho arzénu. Iba 2 pacienti s relapsujúcou/refraktérnou APL predčasne ukončili liečbu kvôli tejto nežiaducej reakcii a jeden naďalej používal ďalší oxid arzenitý podľa následného protokolu. Štyridsaťštyri percent pacientov s relapsujúcou/refkraktérnou APL pociťovalo symptómy, ktoré mohli súvisieť s neuropatiou; väčšinou boli mierne až stredné a boli reverzibilné po skončení liečby oxidom arzenitým.
Hepatotoxicita (3. – 4. stupeň)U novodiagnostikovaných pacientov s nízkym až stredne vysokým rizikom APL sa počas indukčnej alebo konsolidačnej liečby oxidom arzenitým v kombinácii s ATRA v 63,2 % prípadoch vyvinuli hepatálne toxické účinky 3. alebo 4. stupňa. Toxické účinky však po dočasnom vysadení oxidu arzenitého, ATRA alebo oboch ustúpili (pozri časť 4.4).
Hematologická a gastrointestinálna toxicitaU novodiagnostikovaných pacientov s nízkym až stredne vysokým rizikom APL sa vyskytla gastrointestinálna toxicita, neutropénia 3. – 4. stupňa a trombocytopénia 3. – 4. stupňa, ktoré však
boli 2,2-krát menej časté u pacientov liečených oxidom arzenitým v kombinácii s ATRA v porovnaní s pacientmi liečenými ATRA a chemoterapiou.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 Predávkovanie
Ak sa prejavia symptómy poukazujúce na závažnú akútnu toxicitu arzénu (napr. kŕče, svalová slabosť a zmätenosť) podávanie oxidu arzenitého sa musí okamžite ukončiť a môže sa uvážiť nasadenie chelatačnej terapie pomocou penicilamínu pri dennej dávke ≤ 1 gram denne. Dĺžka liečby penicilamínom sa musí zhodnotiť berúc do úvahy laboratórne hodnoty arzénu v moči. U pacientov, ktorí nemôžu užívať liek perorálne, sa môže uvažovať o podaní dimerkaprolu v dávke 3 mg/kg intramuskulárne každé 4 hodiny, až dokiaľ neustúpi akákoľvek toxicita bezprostredne ohrozujúca život. Potom možno podávať penicilamín v dennej dávke ≤ 1 gramu denne. Pri koagulopatii sa odporúča perorálne podávanie chelatačného lieku (kyseliny dimerkaptojantárovej, sukcimér, DCI)
10 mg/kg alebo 350 mg/m2 každých 8 hodín počas 5 dní a potom každých 12 hodín počas 2 týždňov.
U pacientov so závažným akútnym predávkovaním arzénom by sa malo uvažovať o dialýze.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Iné antineoplastiká, ATC kód: L01XX27
Mechanizmus účinku
Mechanizmus účinku oxidu arzenitého nie je úplne pochopený. Oxid arzenitý spôsobuje morfologické
zmeny a fragmentáciu dezoxyribonukleovej kyseliny (DNA) charakteristickú pre apoptózu ľudských
promyelocytových leukemických buniek NB4 in vitro. Oxid arzenitý spôsobuje aj poškodenie alebo rozklad fúzneho proteínu PML/RAR alfa.
Klinická účinnosť abezpečnosť
Novodiagnostikovaní pacienti s APL bez vysokého rizika
Oxid arzenitý bol skúmaný u 77 novodiagnostikovaných pacientov s nízkym až stredne vysokým rizikom APL v kontrolovanej, randomizovanej, neinferiórnej klinickej štúdii fázy 3, v ktorej sa
porovnávala účinnosť a bezpečnosť oxidu arzenitého kombinovaného s kyselinou all-trans-retinovou
(ATRA) s účinnosťou a bezpečnosťou ATRA+chemoterapia (napr. idarubicín a mitoxantrón) (štúdia
APL0406). Zahrnutí boli pacienti s novodiagnostikovanou APL potvrdenou prítomnosťou t(15; 17) alebo PML-RAR alfa prostredníctvom RT-PCR, alebo mikroškvrnitou nukleárnou distribúciou PML v leukemických bunkách. K dispozícii nie sú žiadne údaje o pacientoch s variantnými translokáciami ako t(11;17) (PLZF/RAR alfa). Pacienti so závažnými arytmiami, s abnormalitami EKG (vrodeným syndrómom dlhého QT, výraznou komorovou alebo predsieňovou tachyarytmiou v anamnéze alebo aktuálnou, klinicky významnou pokojovou bradykardiou (< 50 úderov za minútu), QTc > 450 ms pri vyšetrení EKG, blokom pravého ramienka a ľavým predným hemiblokom, bifascikulárnou blokádou) alebo neuropatiou boli zo štúdie vylúčení. Pacienti v liečebnej skupine s ATRA+ oxid arzenitý dostávali perorálne ATRA v dávke 45 mg/m2 denne a i.v. oxid arzenitý v dávke 0,15 mg/kg denne až
do úplnej remisie. Počas konsolidácie bol ATRA podávaný v rovnakej dávke počas obdobia 2 týždňov
s liekom a 2 týždne bez lieku po dobu celkovo 7 cyklov a oxid arzenitý bol podávaný v rovnakej dávke 5 dní v týždni v striedaní 4 týždne s liekom a 4 týždne bez lieku počas celkovo 4 cyklov. Pacienti v liečebnej skupine s ATRA + chemoterapiou dostávali až do úplnej remisie i.v. idarubicín v dávke 12 mg/m2 na 2., 4., 6. a 8. deň a perorálnu ATRA na v dávke 45 mg/m2 denne. Počas
konsolidácie dostávali pacienti idarubicín v dávke 5 mg/m2 v 1. až 4. deň a ATRA v dávke 45 mg/m2
denne po dobu 15 dní, potom i.v. mitoxantrón v dávke 10 mg/m2 v 1. až 5. deň a ATRA znovu
v dávke 45 mg/m2 denne počas 15 dní a napokon jednorazovú dávku idarubicínu v dávke 12 mg/m2 a
ATRA v dávke 45 mg/m2 denne počas 15 dní. Každý cyklus konsolidácie bol iniciovaný pri hematologickom zotavení z predchádzajúceho cyklu definovanom ako absolútny počet neutrofilov
> 1,5×109/l a trombocytov > 100×109/l. Pacienti v liečebnej skupine s ATRA + chemoterapiou takisto
až 2 roky dostávali udržiavaciu liečbu, ktorá pozostávala z perorálneho 6-merkaptopurínu v dávke
50 mg/m2 denne, intramuskulárneho metotrexátu v dávke 15 mg/m2 týždenne a ATRA v dávke
45 mg/m2 denne počas 15 dní každé 3 mesiace.
Kľúčové výsledky účinnosti sú zhrnuté v tabuľke 3 nižšie.
Tabuľka 3
Koncový
ukazovateľ
| ATRA +
oxid arzenitý
(n = 77)
[%]
| ATRA +
chemoterapia
(n = 79)
[%]
| Interval
spoľahlivosti
(IS)
| Hodnota p
|
2-ročné prežívanie
bez udalosti (EFS)
|
97
|
86
|
95 % IS pre rozdiel, 2 - 22 percentuálnych bodov
| p < 0,001
pre podradenosť
p = 0,02
pre nadradenosť
ATRA + oxid arzenitý
|
Kompletná hematologická remisia (HCR)
|
100
|
95
|
|
p = 0,12
|
2-ročné celkové
prežívanie (OS)
|
99
|
91
|
|
p = 0,02
|
2-ročné prežívanie bez ochorenia (DFS)
|
97
|
90
|
|
p = 0,11
|
Kumulatívna incidencia relapsu po 2 rokoch (CIR)
|
1
| '
6
|
|
p = 0,24
|
APL = akútna promyelocytová leukémia; ATRA = kyselina all-
trans-retinová.
Relapsujúca/refraktérna APLOxid arzenitý bol skúmaný na 52 pacientoch s APL, ktorí sa predtým liečili použitím dávkovacej schémy s antracyklínom a retinoidom, v dvoch otvorených, jednoramenných, nekomparatívnych štúdiách. Jednou bola klinická štúdia s jediným skúšajúcim (n = 12) a druhou multicentrická štúdia v 9 inštitúciách (n = 40). Pacienti v prvej štúdii dostávali priemernú dávku 0,16 mg/kg/deň oxidu arzenitého (v rozsahu od 0,06 do 0,20 mg/kg/deň) a pacienti v multicentrickej štúdii dostávali fixnú dávku 0,15 mg/kg/deň. Oxid arzenitý sa podával intravenózne od 1 až 2 hodín dovtedy, kým sa kostná dreň nezbavila leukemických buniek, maximálne do 60 dní. Pacienti s úplnou remisiou absolvovali konsolidačnú liečbu oxidom arzenitým vo forme 25 ďalších dávok počas 5 týždňov. Konsolidačná liečba začala 6 týždňov (v rozsahu 3-8) po indukcii v štúdii s jedinou inštitúciou a 4 týždne (v rozsahu
3-6) v multicentrickej štúdii. Úplná remisia (CR) bola definovaná ako neprítomnosť viditeľných
leukemických buniek v kostnej dreni a periférne obnovenie krvných doštičiek a bielych krviniek.
U pacientov s jedným centrom štúdie došlo k relapsu po 1-6 predchádzajúcich terapeutických režimoch a u 2 pacientov po transplantácii kmeňových buniek. U pacientov v multicentrickej štúdii došlo k relapsu po 1-4 predchádzajúcich terapeutických režimoch a u 5 pacientov po transplantácii kmeňových buniek. Medián veku v štúdii s jedným centrom bol 33 rokov (vekový rozsah od 9 po 75). Medián veku v multicentrickej štúdii bol 40 rokov (vekový rozsah od 5 po 73).
Výsledky sú zhrnuté v tabuľke 4 nižšie.
Tabuľka 4
 Skúšanie s jedným centromMulticentrické skúšanie
Skúšanie s jedným centromMulticentrické skúšanie
|
N = 12
|
N = 40
|
Dávka oxidu arzenitého,
mg/kg/deň
(medián, rozsah)
|
0,16 (0,06 – 0,20)
|
0,15
|
Úplná remisia
|
11 (92 %)
|
34 (85 %)
|
Č
as do remisie kostnej
drene (medián)
|
32 dní
|
35 dní
|
Č
as do úplnej remisie
(m
edián)
|
54 dní
|
59 dní
|
18-mesačné prežitie
|
67 %
|
66 %
|
V štúdii s jednou inštitúciou boli 2 pediatrickí pacienti (< 18 rokov), z ktorých obaja dosiahli úplnú
remisiu. V multicentrickej štúdii bolo 5 pediatrických pacientov (< 18 rokov), z ktorých 3 dosiahli
úplnú remisiu. Neboli liečené žiadne deti mladšie ako 5 rokov.
V rámci následnej liečby po konsolidácii dostávali 7 pacienti v štúdii s jednou inštitúciou a 18 pacientov v multicentrickej štúdii ďalšiu udržiavaciu liečbu oxidom arzenitým. Trom pacientom zo štúdie s jednou inštitúciou a 15 pacientom z multicentrickej štúdie boli po dokončení liečby oxidom arzenitým transplantované kmeňové bunky. Priemerná dĺžka úplnej remisie podľa Kaplana-Meiera
v štúdii s jednou inštitúciou je 14 mesiacov; v multicentrickej štúdii nebola dosiahnutá. Pri poslednej kontrole bolo 6 z 12 pacientov v štúdii s jednou inštitúciou stále nažive, s mediánom času následnej
kontroly 28 mesiacov (v rozsahu od 25 po 29).
V multicentrickej štúdii bolo 27 z 40 pacientov stále nažive, s mediánom času následnej kontroly 16
mesiacov (v rozsahu od 9 po 25). Dolu sa uvádzajú odhady 18-mesačného prežitia podľa Kaplana- Meiera pre každú štúdiu.
100 %80 %60 %
40 %

 20 %
0 %
V jedinom centre Multicentrická štúdia
rizikoví
20 %
0 %
V jedinom centre Multicentrická štúdia
rizikoví
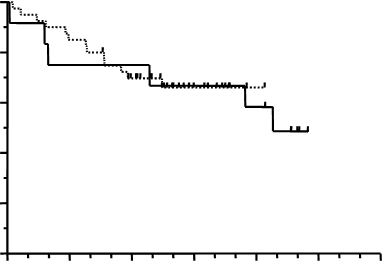 12
40
úmrtia
6
13
18 mesiacov
67 %
66 %
12
40
úmrtia
6
13
18 mesiacov
67 %
66 %
0 6 12 18 24 30 36
mesiac
V tabuľke 5 nižšie sa uvádza cytogenetické potvrdenie konverzie na normálny genotyp a reverzná
transkriptázová polymerázová reťazová reakcia (RT-PCR) na detekciu konverzie PML/RARα na normál.
Cytogenetika po liečbe oxidom arzenitým
Tabuľka 5
 Kľúčové skúšanies jedným centromMulticentrické skúšanieN s CR = 34
Kľúčové skúšanies jedným centromMulticentrické skúšanieN s CR = 34
|
N s CR = 11
|
|
Konvenčná
cytogenetika
[t(15;17)]
Neprítomná Prítomná Nestanoviteľná
|
8 (73 %)
1 (9 %)
2 (18 %)
|
31 (91 %)
0 %
3 (9 %)
|
RT-PCR pre PML/
RARα
Negatívna Pozitívna Nestanoviteľná
|
8 (73 %)
3 (27 %)
0
|
27 (79 %)
4 (12 %)
3 (9 %)
|
Reakcie boli pozorované vo všetkých testovaných vekových skupinách, v rozsahu od 6 do 75 rokov.
Pomer odpovedí bol podobný u oboch pohlaví. Neexistujú žiadne skúsenosti s účinkom oxidu arzenitého na variant APL obsahujúci chromozómové translokácie t(11;17) a t(5;17).
Pediatrická populáciaSkúsenosti s podávaním u detí sú obmedzené. Zo 7 pacientov vo veku menej ako 18 (vekový rozsah 5 až 16 rokov) liečených oxidom arzenitým s odporúčanou dávkou 0,15 mg/kg/deň, 5 pacientov dosiahlo úplnú odpoveď (pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAnorganická lyofilizovaná forma oxidu arzénového vo forme roztoku ihneď formuje hydrolyzovaný
produkt kyselinu arzenitú (AsIII). AsIII je farmakologicky aktívny látka oxidu arzénového.
DistribúciaDistribučný objem (Vd) pre AsIII je veľký (> 400 l), čo naznačuje značnú distribúciu do tkanív so zanedbateľnou väzbou na proteíny. Vd tiež závisí od telesnej hmotnosti a zvyšuje sa s narastajúcou
telesnou hmotnosťou. Celkovo sa arzén akumuluje hlavne v pečeni, obličkách a srdci a v menšej miere
v pľúcach, vlasoch a nechtoch.
BiotransformáciaMetabolizmus oxidu arzénového zahŕňa oxidáciu kyseliny arzenitej (AsIII), aktívnej súčasti oxidu arzénového, na kyselinu arzeničnú (AsV) ako aj oxidatívnu metyláciu na kyselinu monometylarzónu
(MMAV) a kyselinu dimetylarzónu (DMAV) pomocou metyltransferáz hlavne v pečeni. Pentavalentné
metabolity MMAV a DMAV sa v plazme objavujú pomaly (približne 10-24 hodín po prvom podaní
oxidu arzénového), ale sa po mnohonásobnom podaní vďaka dlhému polčasu akumulujú viac ako
AsIII. Rozsah akumulácie týchto metabolitov závisí na dávkovacom režime. Približná akumulácia bola v rozpätí 1,4 – až 8- násobok po podaní viacnásobných dávok v porovnaní s jednou dávkou. AsV sa
v plazme nachádza len v relatívne nízkych hladinách.
In vitro enzymatické štúdie s ľudskými pečeňovými mikrozómami odhalili, že oxid arzénový nemá
inhibičnú aktivitu na substráty hlavných enzýmov cytochrómu P450 ako 1A2, 2A6, 2B6, 2C8, 2C9,
2C19, 2D6, 2E1, 3A4/5, 4A9/11. Neočakáva sa, že látky, ktoré sú pre tieto P450 enzýmy substrátmi,
budú interagovať s oxidom arzenitým.
ElimináciaPribližne 15 % podanej dávky oxidu arzenitého sa v moči vylučuje ako nezmenený AsIII. Metylované metabolity AsIII (MMAV, DMAV) sú primárne vylučované močom. Plazmatická koncentrácia AsIII
klesá z maximálnej plazmatickej koncentrácie dvojfázovo s priemerným terminálnym eliminačným
polčasom 10 až 14 hodín. Celkový klírens AsIII počas rozpätia jednorazovej dávky 7–32 mg (podanej ako 0,15 mg/kg) je 49 l/h a renálny klírens je 9 l/h. Klírens nezávisí od telesnej hmotnosti jedinca alebo od dávky podanej v študovanom dávkovacom režime. Priemerný predpokladaný terminálny
eliminačný polčas metabolitov MMAV je 32 hodín, a DMAV 70 hodín.
Porucha
f
unkcie
obličiek
Plazmatický klírens AsIII sa nezmenil u pacientov s miernou poruchou funkcie obličiek (klírens
kreatinínu 50–80 ml/min) alebo so strednou poruchou funkcie obličiek (klírens kreatinínu 30–
49 ml/min). Plazmatický klírens AsIII u pacientov so závažnou poruchou funkcie obličiek (klírens
kreatinínu menej ako 30 ml/min) bol o 40 % nižší v porovnaní s pacientmi s normálnou funkciou
obličiek (pozri časť 4.4).
Systémová expozícia MMAV a DMAV sa zdala byť vyššia u pacientov s poškodenou poruchou
obličiek; klinické dôsledky tohto javu sú neznáme, ale nepozorovala sa zvýšená toxicita.
Poruchafunkciepečene
Farmakokinetické údaje od pacientov s hepatocelulárnym karcinómom s miernou alebo strednou poruchou funkcie pečene naznačujú, že AsIII alebo AsV po dvojtýždňových infúziách neakumulujú. Nepozoroval sa žiadny jasný trend voči zvýšeniu systémovej expozície AsIII, AsV, MMAV alebo DMAV s klesajúcou hladinou pečeňových funkcií, ako sa zhodnotili pomocou AUC (per mg dávky) normalizovaného na dávku.
Linearita/nelinearita
V celkovom dávkovacom rozpätí jednej dávky 7 až 32 mg (podanej ako 0,15 mg/kg) sa systémová expozícia (AUC) zdá byť lineárna. Pokles z maximálnej koncentrácie AsIII sa objavuje dvojfázovo a je charakterizovaný iniciálnou rýchlou distribučnou fázou, po ktorej nasleduje pomalá terminálna eliminačná fáza. Po podaní 0,15 mg/kg v dennom (n=6) alebo dvojtýždňovom (n=3) režime sa pozorovala približne 2-násobná akumulácia AsIII v porovnaní s jednorazovou infúziou. Táto akumulácia bola mierne vyššia, ako sa očakávalo podľa výsledkov z podania jednej dávky.
5.3 Predklinické údaje o bezpečnosti
Obmedzené štúdie reprodukčnej toxicity oxidu arzenitého na zvieratách svedčia o embryotoxicite a teratogenicite (defekty nervovej rúrky, anoftalmia a mikroftalmia) pri podávaní 1 - 10 násobku odporúčanej klinickej dávky (mg/m2). Štúdie plodnosti s oxidom arzenitým neboli uskutočňované. Zlúčeniny arzénu vyvolávajú chromozómové aberácie a morfologické transformácie buniek cicavcov in vitro a in vivo. Neuskutočnili sa žiadne oficiálne štúdie karcinogenity oxidu arzenitého. Oxid arzenitý a ďalšie anorganické zlúčeniny arzénu sa však považujú za ľudské karcinogény.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
hydroxid sodný
kyselina chlorovodíková, koncentrovaná (na úpravu pH)
voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie inkompatibility, preto sa tento liek nesmie miešať s inými liekmi okrem tých,
ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Neotvorenáinjekčnáliekovka
2 roky
Po prvom otvorení
Po otvorení sa musí liek ihneď použiť.
P
o nariedení
Chemická a fyzikálna stabilita po otvorení sa preukázala počas 168 hodín pri 25 °C a pri 2 °C – 8 °C.
Z mikrobiologického hľadiska sa liek musí použiť okamžite. Ak sa nepoužije okamžite, za čas
a podmienky uchovávania pred použitím zodpovedá používateľ. Spravidla sa nesmie uchovávať dlhšie
ako 24 hodín pri 2 °C – 8 °C, pokiaľ sa však nariedenie neuskutočňuje za kontrolovaných a validovaných aseptických podmienok.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
Podmienky na uchovávanie po riedení alebo prvom otvorení lieku, pozri časť 6.3
6.5 Druh obalu a obsah balenia
Injekčná liekovka z priehľadného bezfarbého skla typu I uzatvorená nesilikónovou elastomérovou šedou gumenou zátkou vyrobenou z bromobutylovej gumy a hliníkovou fóliou s plastovým vyklápacím viečkom obsahujúca 10 ml koncentrátu.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Príprava lieku Arsenic trioxide Accord
Počas celého času manipulácie s liekom Arsenic trioxide Accord musia byť striktne dodržiavané
aseptické podmienky, pretože neobsahuje žiadnu konzervačnú látku.
Arsenic trioxide Accord sa musí nariediť so 100 až 250 ml injekčného roztoku glukózy 50 mg/ml (5 %) alebo s injekčným roztokom chloridu sodného 9 mg/ml (0,9 %), okamžite po vytiahnutí z injekčnej liekovky. Je treba použiť plastové vrecká bez PVC. Je určený iba na jednorazové použitie a akékoľvek nespotrebované zvyšky každej ampulky alebo každej injekčnej liekovky sa musia vhodným spôsobom zlikvidovať. Akékoľvek nespotrebované zvyšky si neodkladajte na neskoršie podanie.
Arsenic trioxide Accord sa nesmie miešať ani súčasne podávať rovnakou infúznou hadičkou s inými liekmi.
Arsenic trioxide Accord sa musí podávať intravenózne v priebehu 1–2 hodín. Ak spozorujete vazomotorické reakcie, dĺžka trvania infúzie sa môže predĺžiť na 4 hodiny. Centrálny žilový katéter nie je potrebný.
Nariedený roztok musí byť číry a bezfarebný. Všetky parenterálne roztoky sa pred podávaním musia vizuálne skontrolovať, či neobsahujú častice alebo či nedošlo k zmene sfarbenia. Liek nepoužívajte, ak obsahuje cudzie častice.
Správny postup likvidácie
Všetok nepoužitý liek, všetky predmety, ktoré sa dostali do kontaktu s liekom, alebo odpad vzniknutý
z lieku sa majú zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Accord Healthcare S.L.U.
World Trade Center, Moll de Barcelona s/n, Edifici Est, 6a planta,
08039 Barcelona,
Španielsko
8. REGISTRAČNÉ ČÍSLOEÚ/1/19/1398/001 (balenie 1 injekčnej liekovky) EÚ/1/19/1398/002 (balenie 5 injekčných liekoviek) EU/1/19/1398/003 (balenie 10 injekčných liekoviek)
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 14. novembra 2019
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.