
Aripiprazole Accord neodporúča používať u pacientov mladších ako 13 rokov (pozri časti 4.8 a 5.1).
Podráždenosť spojená s autistickou poruchou: bezpečnosť a účinnosť Aripiprazole Accord u detí a dospievajúcich mladších ako 18 rokov nebola doteraz stanovená. V súčasnosti dostupné údaje sú opísané v časti 5.1, ale neumožňujú uviesť odporúčania na dávkovanie.
Tiky súvisiace s Tourettovým syndrómom: bezpečnosť a účinnosť Aripiprazole Accord u detí
a dospievajúcich vo veku 6 až 18 rokov neboli doteraz stanovené. V súčasnosti dostupné údaje sú opísané v časti 5.1, ale neumožňujú uviesť odporúčania na dávkovanie.
Poruchafunkciepečene
U pacientov s miernou až stredne ťažkou poruchou funkcie pečene nie je potrebná žiadna úprava dávkovania. Odporúčania u pacientov s ťažkou poruchou funkcie pečene nie je možné stanoviť,
pretože dostupné údaje sú nedostatočné. U týchto pacientov má byť dávkovanie stanovené opatrne. Maximálna denná dávka 30 mg sa však musí podávať s opatrnosťou u pacientov s ťažkou poruchou
funkcie pečene (pozri časť 5.2).
Poruchafunkcieobličiek
U pacientov s poruchou funkcie obličiek nie je potrebná žiadna úprava dávkovania.
Staršípacienti
Účinnosť Aripiprazole Accord v liečbe schizofrénie a bipolárnej poruchy typu I u pacientov vo veku
65 rokov a starších nebola stanovená. Vzhľadom na väčšiu citlivosť v tejto časti populácie sa má zvážiť nižšia počiatočná dávka, pokiaľ si to vyžadujú klinické faktory (pozri časť 4.4).
Pohlavie
Nie je potrebná žiadna úprava dávkovania u ženských pacientov v porovnaní s mužskými pacientmi
(pozri časť 5.2).
Fajčenie
Vzhľadom na metabolickú cestu aripiprazolu nie je u fajčiarov potrebná žiadna úprava dávkovania
(pozri časť 4.5).
Úpravadávkovaniapriinterakciách
V prípade súčasného podávania silných inhibítorov CYP3A4 alebo CYP2D6 s aripiprazolom sa dávka aripiprazolu má znížiť. Keď sa inhibítory CYP3A4 alebo CYP2D6 vysadia z kombinovanej liečby má
sa dávka aripiprazolu zvýšiť (pozri časť 4.5).
V prípade súčasného podávania silných induktorov CYP3A4 s aripiprazolom sa dávka aripiprazolu má zvýšiť. Keď sa induktor CYP3A4 vysadí z kombinovanej liečby má sa dávka aripiprazolu znížiť na odporúčanú dávku (pozri časť 4.5).
Spôsobpodávania
Aripiprazole Accord je určený na perorálne použitie.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Počas liečby antipsychotikami sa môže zlepšenie klinického stavu pacienta prejaviť po niekoľkých dňoch až niekoľkých týždňoch. Počas celého tohto obdobia majú byť pacienti starostlivo
monitorovaní.
Samovražda
Výskyt samovražedného správania je u psychotických ochorení a porúch nálady bežný jav a v
niektorých prípadoch sa pozoroval skoro po začatí liečby alebo zmene antipsychotickej liečby, vrátane liečby aripiprazolom (pozri časť 4.8). Antipsychotická liečba vysokorizikových pacientov si vyžaduje
dôkladné sledovanie.
Výsledky epidemiologickej štúdie naznačili, že nie je zvýšené riziko suicidality po aripiprazole v porovnaní s inými antipsychotikami u dospelých pacientov so schizofréniou alebo bipolárnou poruchou. Na vyhodnotenie tohto rizika u mladších pacientov (do veku 18 rokov) nie sú dostatočné pediatrické údaje, no pri atypických antipsychotikách vrátane aripiprazolu je preukázané, že riziko samovraždy pretrváva dlhšie než prvé 4 týždne liečby.
Kardiovaskulárne poruchy
Aripiprazol sa má opatrne používať u pacientov so známou kardiovaskulárnou chorobou (anamnéza
infarktu myokardu alebo ischemickej choroby srdca, srdcové zlyhania alebo abnormality vedenia), cerebrovaskulárnou chorobou, podmienkami, ktoré môžu mať vplyv na pacientov s predispozíciou na hypertenziu (dehydratácia, hypovolémia a liečba antihypertenzívnymi liekmi) alebo hypertenziou zahŕňajúcou akcelerovanú alebo malígnu. Prípady venózneho tromboembolizmu (VTE) boli hlásené pri antipsychotikách. Pred a počas liečby aripiprazolom sa majú stanoviť rizikové faktory VTE a vykonať preventívne opatrenia, pretože u pacientov liečených antipsychotikami sú často prítomné získané rizikové faktory VTE.
Predĺženie QT intervalu
V klinických štúdiách s aripiprazolom bola incidencia QT predĺženia porovnateľná s placebom. Tak
ako aj iné antipsychotiká, aripiprazol sa má opatrne používať u pacientov s rodinnou anamnézou QT
predĺženia (pozri časť 4.8).
Tardívna dyskinéza
V jednoročných alebo v kratších klinických skúšaniach boli počas liečby aripiprazolom hlásené
zriedkavé prípady dyskinézy vzniknutej počas liečby. Pokiaľ sa u pacienta užívajúceho aripiprazol objavia znaky a príznaky tardívnej dyskinézy má sa zvážiť zníženie dávky alebo prerušenie liečby
(pozri časť 4.8). Tieto príznaky sa môžu postupom času zhoršovať, alebo môžu vzniknúť dokonca aj
po prerušení liečby.
Iné extrapyramídové symptómy
V klinických skúšaniach s deťmi a dospievajúcimi s aripiprazolom sa pozorovala akatízia a
parkinsonizmus. Ak sa objavia znaky a symptómy iných extrapyramídových symptómov u pacienta užívajúceho aripiprazol má sa zvážiť zníženie dávky a starostlivý klinický monitoring.
Neuroleptický malígnysyndróm(NMS)
NMS je potenciálne fatálny komplex symptómov súvisiaci s podávaním antipsychotických liekov. V
klinických skúšaniach boli počas liečby aripiprazolom hlásené zriedkavé prípady NMS. Klinickými prejavmi NMS sú hyperpyrexia, svalová rigidita, zmenený duševný stav a dôkazy o nestabilite
autonómneho nervového systému (nepravidelný pulz alebo krvný tlak, tachykardia, diaforéza a
srdcová arytmia). Medzi ďalšie znaky môže patriť zvýšená hodnota kreatínfosfokinázy, myoglobinúria
(rabdomyolýza) a akútne renálne zlyhanie. Avšak, vyskytla sa tiež zvýšená kreatínfosfokináza a rabdomyolýza nie nevyhnutne spojená s NMS. Ak u pacientov vzniknú znaky a príznaky svedčiace o NMS, alebo ak pacienti budú mať nevysvetliteľnú vysokú horúčku bez ďalších klinických prejavov NMS, užívanie všetkých antipsychotických liečiv vrátane aripiprazolu sa musí prerušiť.
Z
áchvat
V klinických skúšaniach boli počas liečby aripiprazolom hlásené menej časté prípady záchvatov.
Aripiprazol sa preto má podávať s opatrnosťou u pacientov, ktorí majú epilepsiu v anamnéze, alebo ktorí majú stavy súvisiace so záchvatmi (pozri časť 4.8).
Starší pacienti s psychózou spojenou sdemenciou
Zvýšeniemortality
V troch placebom kontrolovaných štúdiách (n = 938; priemerný vek: 82,4 rokov; rozsah: 56-99 rokov) aripiprazolu u starších pacientov s psychózou spojenou s Alzheimerovou chorobou, pacienti liečení aripiprazolom mali zvýšené riziko smrti v porovnaní s placebom. Výskyt smrti u pacientov liečených aripiprazolom bol 3,5 % v porovnaní s 1,7 % v placebovej skupine. Aj keď príčiny smrti sú rôzne, väčšina z nich sa zdá byť pôvodom buď kardiovaskulárna (napr. srdcové zlyhanie, náhla smrť) alebo infekčná (napr. pneumónia) (pozri časť 4.8).
Cerebrovaskulárnenežiaducereakcie
V tých istých štúdiách boli u pacientov hlásené cerebrovaskulárne nežiaduce reakcie (napr., mŕtvica, prechodný ischemický záchvat) zahŕňajúce smrť (priemerný vek: 84 rokov; rozsah: 78-88 rokov). Celkove sa u 1,3 % aripiprazolom liečených pacientov zistili cerebrovaskulárne nežiaduce reakcie v porovnaní s 0,6 % placebom liečených pacientov v týchto štúdiách. Tento rozdiel nebol štatisticky významný. Avšak v jednej z týchto štúdií, v štúdii s fixovanou dávkou, bol významný vzťah reakcie na dávku pre cerebrovaskulárne nežiaduce reakcie u pacientov liečených aripiprazolom (pozri
časť 4.8).
Aripiprazol nie je indikovaný pre liečbu psychózy spojenej s demenciou. Hyperglykémiaadiabetesmellitus
Hyperglykémia v niektorých prípadoch mimoriadna a spojená s ketoacidózou alebo hyperosmolárnou
kómou alebo smrťou bola hlásená u pacientov liečených atypickými antipsychotikami zahŕňajúcimi aripiprazol. Medzi rizikové faktory, ktoré majú vplyv u pacientov s predispozíciou na vážne
komplikácie, patrí obezita a rodinná anamnéza diabetu. V klinických štúdiách aripiprazolu neboli
významné rozdiely v stupni výskytu s hyperglykémiou súvisiacimi nežiaduci reakciami (zahŕňajúcimi diabetes) alebo v abnormálnych laboratórnych hodnotách v porovnaní s placebom. Priame porovnania
presných odhadov rizika s hyperglykémiou súvisiacimi nežiaducimi reakciami u pacientov liečených
aripiprazolom a inými antipsychotikami nie sú dostupné. Pacienti liečení inými antipsychotikami zahŕňajúcimi aripiprazol majú byť sledovaní na znaky a príznaky hyperglykémie (ako je polydipsia, polyúria, polyfágia a slabosť) a pacienti s diabetes mellitus alebo s rizikovými faktormi pre diabetes mellitus majú byť pravidelne monitorovaní na zhoršenie glukózovej kontroly (pozri časť 4.8).
Hypersenzitivita
Podobne ako u iných liekov sa hypersenzitívne reakcie charakterizované alergickými symptómami
môžu vyskytnúť po aripiprazole (pozri časť 4.8).
Prírastok telesnej hmotnosti
Prírastok telesnej hmotnosti je všeobecne pozorovateľný u pacientov so schizofréniou a bipolárnou
mániou kvôli komorbiditám, užívaniu antipsychotík, o ktorých je známe, že spôsobujú prírastok telesnej hmotnosti, nesprávnemu životnému štýlu a môže viesť k závažným komplikáciám. Po uvedení lieku na trh sa hlásil prírastok telesnej hmotnosti u pacientov užívajúcich aripiprazol. Ak sa zistí, je to zvyčajne u pacientov s významnými rizikovými faktormi, ako je diabetes, porucha štítnej žľazy alebo adenóm hypofýzy v anamnéze. V klinických skúšaniach sa nepreukázalo, že aripiprazol spôsobuje klinicky významné zvýšenie telesnej hmotnosti u dospelých (pozri časť 5.1). V klinických skúšaniach
s dospievajúcimi pacientmi s bipolárnou mániou sa preukázalo, že sa aripiprazol po 4 týždňoch liečby
spájal s nárastom telesnej hmotnosti. U dospievajúcich pacientov s bipolárnou mániou sa má sledovať prírastok telesnej hmotnosti. Ak je prírastok telesnej hmotnosti klinicky významný, má sa zvážiť zníženie dávky (pozri časť 4.8).
Dysfágia
Ezofageálna dysmotilita a aspirácia súvisia s používaním antipsychotík vrátane aripiprazolu.
Aripiprazol a iné antipsychoticky aktívne látky sa majú používať opatrne u pacientov s rizikom aspiračnej pneumónie.
Patologické hráčstvo
Po uvedení lieku na trh sú hlásenia patologického hráčstva, ktoré sa hlásili u pacientov, ktorým bol
predpísaný aripiprazol, a to bez ohľadu na to, či mali títo pacienti patologické hráčstvo v predošlej anamnéze. Pacienti s patologickým hráčstvom v predošlej anamnéze môžu mať zvýšené riziko a majú sa starostlivo monitorovať (pozri časť 4.8).
Laktóza
Aripiprazole Accord obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej
intolerancie, Lapp laktátovej deficiencie alebo glukózo-galaktózovej malabsorpcie nesmú tento liek užívať.
Pacienti s komorbiditou ADHD
Napriek vysokej frekvencii komorbidity bipolárnej poruchy typu I a ADHD sú dostupné veľmi
obmedzené údaje o bezpečnosti o súbežnom používaní aripiprazolu a stimulancií, preto ak sa lieky podávajú súbežne je potrebná extrémna opatrnosť.
4.5 Liekové a iné interakcie
V dôsledku antagonizmu α1 -adrenergných receptorov môže aripiprazol zvyšovať účinok niektorých antihypertenzív.
Vzhľadom na primárne účinky aripiprazolu na CNS sa zvýšená pozornosť musí venovať podávaniu aripiprazolu v kombinácii s alkoholom alebo inými liekmi pôsobiacimi na CNS s prekrývajúcimi sa nežiaducimi reakciami ako je sedácia (pozri časť 4.8).
Aripiprazol sa má opatrne používať, ak sa podáva súbežne s liekmi, u ktorých je známe, že zapríčiňujú
QT predĺženie alebo elektrolytovú nerovnováhu.
Potenciál iných liekovpreovplyvneniearipiprazolu
Blokátor tvorby žalúdočnej kyseliny, H2 antagonista famotidín, znižuje rýchlosť absorpcie
aripiprazolu, ale tento účinok sa nepokladá za klinicky relevantný. Aripiprazol je metabolizovaný
mnohopočetnými cestami zahŕňajúcimi enzýmy CYP2D6 a CYP3A4, ale nie enzýmy CYP1A. Preto nie je potrebná žiadna úprava dávkovania u fajčiarov.
ChinidínaďalšieinhibítoryCYP2D6
V klinickom skúšaní so zdravými jedincami zvýšil silný inhibítor CYP2D6 (chinidín) hodnoty AUC aripiprazolu o 107 %, kým hodnoty Cmax boli nezmenené. Hodnoty AUC aktívneho metabolitu dehydro-aripiprazolu sa znížili o 32 % a hodnoty Cmax o 47 %. Dávka aripiprazolu sa má znížiť približne na polovicu predpísanej dávky, ak sa má aripiprazol podávať súčasne s chinidínom. U ďalších silných inhibítorov CYP2D6 ako sú fluoxetín a paroxetín je možné očakávať podobné účinky, a preto sa má použiť podobné zníženie dávkovania.
KetokonazolaďalšieinhibítoryCYP3A4
V klinickom skúšaní so zdravými jedincami zvýšil silný inhibítor CYP3A4 (ketokonazol) hodnoty
AUC aripiprazolu o 63 % a hodnoty Cmax o 37 %. Hodnoty AUC dehydro-aripiprazolu sa zvýšili o
77 % a hodnoty Cmax o 43 %. U pomalých metabolizérov CYP2D6 môže súčasné použitie silných
inhibítorov CYP3A4 viesť k vyšším plazmatickým koncentráciám aripiprazolu oproti tým, ktoré sú u
rýchlych metabolizérov CYP2D6.
Pokiaľ sa uvažuje o súčasnom podávaní ketokonazolu alebo iných silných inhibítorov CYP3A4 s aripiprazolom, možný úžitok pre pacienta musí prevažovať nad potenciálnymi rizikami. V prípade súčasného podávania ketokonazolu s aripiprazolom sa má dávka aripiprazolu znížiť približne na polovicu predpísanej dávky. U ďalších silných inhibítorov CYP3A4 ako sú itrakonazol a inhibítory HIV-proteáz je možné očakávať podobné účinky, a preto sa má použiť podobné zníženie dávkovania.
Po vysadení inhibítora CYP2D6 alebo CYP3A4 sa dávka aripiprazolu má zvýšiť na úroveň pred zahájením sprievodnej terapie.
Pri súbežnom používaní slabých inhibítorov CYP3A4 (napr. diltiazem alebo escitalopram), CYP2D6
s aripiprazolom sa môže očakávať mierne zvýšenie koncentrácie aripiprazolu.
KarbamazepínaďalšieinduktoryCYP3A4
Po súčasnom podávaní karbamazepínu, silného induktora CYP3A4, bol geometrický priemer hodnôt Cmax nižší o 68 % a hodnôt AUC o 73 % pre aripiprazol v porovnaní s aripiprazolom (30 mg) podávaným samostatne. Podobne, geometrický priemer hodnôt Cmax dehydro-aripiprazolu bol pri súčasnom podávaní karbamazepínu nižší o 69 % a hodnôt AUC o 71 % ako bol geometrický priemer po liečbe samostatným aripiprazolom.
Dávka aripiprazolu sa má zdvojnásobiť, ak sa má aripiprazol podávať súčasne s karbamazepínom. U ďalších silných induktorov CYP3A4 (ako sú rifampicín, rifabutín, fenytoín, fenobarbital, primidon, efavirenz, nevirapín a Ľubovník bodkovaný) je možné očakávať podobné účinky, a preto sa má použiť podobné zvýšenie dávkovania. Po vysadení silných induktorov CYP3A4 sa má dávka aripiprazolu znížiť na odporúčanú dávku.
Valproátalítium
Pri súčasnom podávaní aripiprazolu buď s valproátom alebo lítiom, nenastala žiadna klinicky významná zmena v koncentráciách aripiprazolu.
Sérotonínový syndróm
U pacientov užívajúcich aripiprazol sa hlásili prípady sérotonínového syndrómu a možné znaky a symptómy tohto stavu sa môžu objaviť najmä v prípadoch súčasného používania s inými sérotonergickými liečivami, ako sú SSRI/SNRI alebo s liečivami, o ktorých je známe, že zvyšujú koncentrácie aripiprazolu (pozri časť 4.8).
Potenciálaripiprazolupreovplyvnenieinýchliekov
V klinických štúdiách nemali dávky aripiprazolu 10-30 mg/deň nijaký významný vplyv na metabolizmus substrátu CYP2D6 (pomer dextrometorfán/3-metoxymorfinan), CYP2C9 (warfarínu),
CYP2C19 (omeprazolu) a CYP3A4 (dextrometorfánu). Aripiprazol a dehydro-aripiprazol okrem toho
nepreukázali in vitro potenciál pre zmenu metabolizmu sprostredkovaného CYP1A2. Je preto nepravdepodobné, že by aripiprazol spôsobil klinicky významné liekové interakcie sprostredkované
týmito enzýmami.
Pri súbežnom podávaní aripiprazolu s valproátom, lítiom alebo lamotrigínom, sa nezaznamenala žiadna klinicky významná zmena v koncentráciách valproátu, lítia alebo lamotrigínu.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné a dobre kontrolované skúšania aripiprazolu u gravidných žien. Vrodené
anomálie boli hlásené; avšak príčinná súvislosť s aripiprazolom nebola stanovená. Štúdie na zvieratách
nemohli vylúčiť možnosť vývojovej toxicity (pozri časť 5.3). Pacientkam sa má odporučiť, aby svojmu lekárovi oznámili, že sú gravidné alebo ak počas liečby aripiprazolom graviditu plánujú. Vzhľadom na nedostatočné informácie o bezpečnosti u ľudí a obavám vyvolaných reprodukčnými štúdiami na zvieratách sa tento liek nemá podávať počas gravidity, pokiaľ očakávaný prínos liečby zreteľne neprevýši potenciálne riziko pre plod.
U novorodencov po pôrode, ktorí boli vystavení počas tretieho trimestra gravidity antipsychotikám (vrátane aripiprazolu ), existuje riziko vzniku nežiaducich reakcií zahŕňajúcich extrapyramídové príznaky a/alebo príznaky z vysadenia lieku, ktoré sa môžu líšiť v závažnosti a trvaní. Boli hlásené agitácia, hypertónia, hypotónia, tremor, somnolencia, respiračná tieseň alebo ťažkosti pri kŕmení. Preto majú byť novorodenci starostlivo sledovaní.
Dojčenie
Aripiprazol sa vylučuje do materského mlieka u ľudí. Pacientkam sa má odporučiť, aby nedojčili, ak
užívajú aripiprazol.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Tak ako u ostatných antipsychotík, pacienti musia byť opatrní pri obsluhovaní nebezpečných strojov, vrátane vozidiel, pokiaľ si nie sú dostatočne istí tým, že aripiprazol na nich nemá nepriaznivý účinok. Niektorí pediatrickí pacienti s bipolárnou poruchou typu I majú zvýšenú incidenciu somnolencie a únavy (pozri časť 4.8).
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšími nežiaducimi reakciami v placebom kontrolovaných štúdiách boli nepokoj a nauzea,
ktoré sa objavili u viac ako 3 % pacientov liečených perorálne podávaným aripiprazolom.
Tabuľkový zoznamnežiaducichúčinkov
Všetky nežiaduce reakcie lieku sú zoradené podľa triedy orgánových systémov a frekvencie: veľmi
časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až
< 1/1 000), veľmi zriedkavé (< 1/10 000) a neznáme (z dostupných údajov). Pri každej frekvencii výskytu sú nežiaduce reakcie zoradené podľa klesajúcej závažnosti.
Frekvenciu výskytu nežiaducich reakcií hlásených po uvedení na trh nie je možné určiť, pretože pochádzajú zo spontánnych hlásení. Frekvencia výskytu týchto nežiaducich udalostí je následne klasifikovaná ako „neznáma“.
Časté Menej časté Neznáme
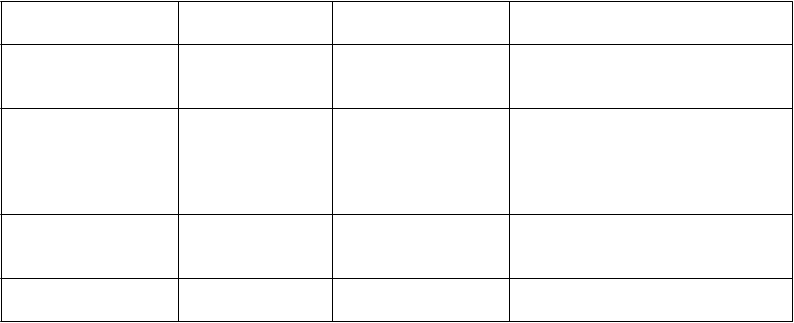 P
oruchy krvi a
l
ymfatického systému
P
oruchy
im
unitného systému
P
oruchy endokrinného systému Poruchy metabolizmu a
P
oruchy krvi a
l
ymfatického systému
P
oruchy
im
unitného systému
P
oruchy endokrinného systému Poruchy metabolizmu a
Leukopénia
Neutropénia
Trombocytopénia Alergická reakcia (napr. anafylaktická reakcia, angioedém vrátane napuchnutého jazyka, edému jazyka, edému tváre, vyrážky alebo urtikárie)
Hyperprolaktinémia Diabetická hyperosmolárna kóma Diabetická ketoacidóza Hyperglykémia
Diabetes mellitus Hyperglykémia Hyponatriémia
Anorexia
Č
asté Menej časté Neznáme
výživy Zníženie telesnej hmotnosti
Prírastok telesnej hmotnosti
P
sychické poruchy Insomnia Úzkosť Nepokoj
Depresia
Hypersexualita
Pokus o samovraždu, samovražedné predstavy, dokončená samovražda (pozri časť 4.4)
Patologické hráčstvo
Agresia Agitovanosť Nervozita
P
oruchy nervového systému
Akatízia Extrapyramídová porucha
Tremor
Bolesť hlavy Sedácia Somnolencia Závrat
Tardívna dyskinéza
Dystónia
Neuroleptický malígny syndróm
(NMS)
Záchvat typu grand mal Serotonínový syndróm Poruchy reči
P
oruchy oka Rozmazané videnie
Poruchy srdca a srdcovej činnosti
Diplopia
Tachykardia Náhla nevysvetliteľná smrť Torsades de pointes Predĺženie QT intervalu Ventrikulárne arytmie Zástava srdca
Bradykardia
P
oruchy ciev Ortostatická hypotenzia
Venózna tromboembólia (vrátane pľúcnej embólie a trombózy hlbokých žíl)
Hypertenzia
Synkopa
P
oruchy dýchacej sústavy, hrudníka a mediastína
Štikútanie Aspiračná pneumónia Laryngospazmus Orofaryngeálny spazmus
 P
oruchy
gastrointestinálneho traktu
P
oruchy pečene a žlčových ciest
P
oruchy kože a podkožného tkaniva
P
oruchy
gastrointestinálneho traktu
P
oruchy pečene a žlčových ciest
P
oruchy kože a podkožného tkaniva
Zápcha
Dyspepsia
Nauzea Hypersekrécia slín
Vracanie
Pankreatitída
Dysfágia
Hnačka
Abdominálne ťažkosti
Žalúdočné ťažkosti
Zlyhanie pečene Hepatitída Žltačka
Zvýšenie alanínaminotransferázy
(ALT)
Zvýšenie aspartátaminotransferázy
(AST)
Zvýšenie gamaglutamyltransferázy
(GGT)
Zvýšenie alkalickej fosfatázy
Vyrážka Fotosenzitívna reakcia Alopécia
Hyperhidróza
Č
asté Menej časté Neznáme
P
oruchy kostrovej a
s
valovej sústavy a spojivového tkaniva
P
oruchy obličiek a močových ciest Stavy v gravidite, v šestonedelí a perinatálnom období
P
oruchy reprodukčného systému a prsníkov Celkové poruchy a reakcie v mieste podania
L
aboratórne a funkčné vyšetrenia
Rabdomyolýza
Myalgia
Stuhnutosť
Močová inkontinencia
Retencia moču
Neonatálny abstinenčný syndróm
(pozri časť 4.6)
Priapizmus
Únava Porucha regulácie teploty (napr. hypotermia, pyrexia)
Bolesť v hrudníku
Periférny edém
Zvýšenie glukózy v krvi Zvýšenie glykozylovaného hemoglobínu
Kolísanie glukózy v krvi
Zvýšenie kreatínfosfokinázy
 O
pis
vy
braných
nežiaducich
reakcií
E
xtrapyramídové
symptómy
(
EP
S)
Schizofrénia:
O
pis
vy
braných
nežiaducich
reakcií
E
xtrapyramídové
symptómy
(
EP
S)
Schizofrénia: v dlhodobom 52 týždňov trvajúcom kontrolovanom skúšaní mali pacienti liečení aripiprazolom celkovo nižšiu incidenciu (25,8 %) EPS zahŕňajúcich parkinsonizmus, akatíziu,
dystóniu a dyskinézu v porovnaní s pacientmi liečenými haloperidolom (57,3 %). V dlhodobom
26 týždňov trvajúcom placebom kontrolovanom skúšaní bola 19 % incidencia EPS u pacientov liečených aripiprazolom a 13,1 % u pacientov liečených placebom. V inom dlhodobom 26 týždňov
trvajúcom kontrolovanom skúšaní bola 14,8 % incidencia EPS u pacientov liečených aripiprazolom a
15,1 % u pacientov liečených olanzapínom.
Manické epizódy u bipolárnej poruchy typu I: v 12 týždňov trvajúcom kontrolovanom skúšaní mali pacienti liečení aripiprazolom incidenciu EPS 23,5 % a pacienti liečení haloperidolom 53,3 %. V inom
12 týždňov trvajúcom skúšaní mali pacienti liečení ariprazolom incidenciu EPS 26,6 % a pacienti liečení lítiom 17,6 %. V dlhodobom 26 týždňov trvajúcom placebom kontrolovanom skúšaní bola u
pacientov liečených aripiprazolom incidencia EPS 18,2 % a u pacientov liečených placebom 15,7 %.
AkatíziaV placebom kontrolovaných skúšaniach bola u bipolárnych pacientov liečených aripiprazolom incidencia akatízie 12,1 % a u pacientov liečených placebom 3,2 %. U pacientov so schizofréniou
liečených aripiprazolom bola incidencia akatízie 6,2 % a u pacientov liečených placebom 3,0 %.
DystóniaClass efekt - symptómy dystónie, predĺžené abnormálne kontrakcie svalových skupín, sa môžu objaviť u citlivých jedincov počas prvých niekoľkých dní liečby. Dystonické symptómy zahŕňajú: spazmus
krčných svalov, niekedy rozvíjajúci sa do uzavretia hrdla, ťažkosti s prehĺtaním, ťažkosti s dýchaním,
a/alebo vystúpením jazyka. Pokiaľ sa tieto príznaky objavia pri nízkych dávkach, môžu sa vyskytovať častejšie a s väčšou závažnosťou a maximálnou mohutnosťou a pri vyšších dávkach prvej generácie
antipsychotických liekov. Zvýšené riziko akútnej dystónie je pozorované u mužov a mladších
vekových skupín.
Prolaktín
Počas klinického skúšania pre schválené indikácie a po uvedení na trh bol pri aripiprazole v porovnaní s východiskovou hodnotou pozorovaný nárast aj pokles prolaktínu v sére (časť 5.1).
Laboratórneparametre
Porovnanie medzi aripiprazolom a placebom v pomere pacientov, u ktorých sa vyskytli potenciálne klinicky významné zmeny v bežných laboratórnych a lipidových parametroch (pozri časť 5.1),
neodhalili žiadne medicínsky dôležité rozdiely. Zvýšenie CPK (kreatínfosfokinázy) zvyčajne prechodné a asymptomatické bolo pozorované u 3,5 % pacientov liečených aripiprazolom v porovnaní
s 2,0 % pacientov liečených placebom.
Pediatrická populácia
Dospievajúcisoschizofréniouvoveku15rokovastarší
V krátkodobej placebom kontrolovanej klinickej štúdii zahŕňajúcej 302 dospievajúcich (od 13 -
17 rokov) so schizofréniou, frekvencia a typ nežiaducich účinkov boli podobné tým ako u dospelých, okrem nasledovných reakcií, ktoré boli hlásené častejšie u dospievajúcich užívajúcich aripiprazol ako
u dospelých užívajúcich aripiprazol (a častejšie ako placebo):
Somnolencia/sedácia a extrapyramidálna porucha boli hlásené ako veľmi časté (≥ 1/10), suchosť v ústach, zvýšená chuť do jedla, a ortostatická hypotenzia boli hlásené ako časté (≥ 1/100 až < 1/10).
Bezpečnostný profil v 26 týždňovej otvorenej rozšírenej štúdii bol podobný tomu, ktorý bol
pozorovaný v krátkodobej, placebom kontrolovanej štúdii.
V súhrne populácie dospievajúcich so schizofréniou (od 13 až 17 rokov) s expozíciou až do 2 rokov bol výskyt nízkych hladín prolatínu v sére u žien (< 3 ng/ml) 29,5 % a u mužov (< 2 ng/ml) 48,3 %. V populácii dospievajúcich pacientov (vo veku 13-17 rokov) trpiacich schizofréniou, ktorí boli vystavení
5 až 30 mg aripiprazolu až po dobu 72 mesiacov, bol výskyt nízkej hladiny prolaktínu v sére u žien
(< 3 ng/ml) 25,6 % a u mužov (< 2 ng/ml) 45,0 %.
ManickéepizódypribipolárnejporuchetypuIudospievajúcichvoveku13rokovastaršíchFrekvencia a typ nežiaducich účinkov u dospievajúcich s bipolárnou poruchou typu I boli podobné tým, ktoré boli u dospelých s výnimkou nasledovných reakcií: veľmi časté (≥ 1/10) somnolencia
(23,0 %), extrapyramidálna porucha (18,4 %), akatízia (16,0 %) a únava (11,8 %); a časté (≥ 1/100 až
< 1/10) abdominálna bolesť v hornej časti, zvýšená tepová frekvencia, zvýšená telesná hmotnosť, zvýšená chuť do jedla, svalové zášklby a dyskinéza.
Nasledovné nežiaduce účinky mali pravdepodobný vzťah s odpoveďou na dávku; extrapyramidálna porucha (incidencia bola pri 10 mg: 9,1 %; pri 30 mg: 28,8 % a pri placebe: 1,7 %); a akatízia incidencia bola pri 10 mg: 12,1 %; pri 30 mg: 20,3 % a pri placebe: 1,7 %).
Priemerné zmeny telesnej hmotnosti u dospievajúcich s bipolárnou poruchou typu I v 12. a 30. týždni po aripiprazole boli 2,4 kg a 5,8 kg (v uvedenom poradí) a po placebe 0,2 kg a 2,3 kg (v uvedenom poradí).
V pediatrickej populácii sa somnolencia a únava pozorovali častejšie u pacientov s bipolárnou poruchou v porovnaní s pacientmi so schizofréniou.
V pediatrickej populácii s bipolárnou poruchou (10-17 rokov) s expozíciou do 30. týždňov bola incidencia nízkych hladín prolaktínu v sére u dievčat (< 3 ng/ml) 28,0 % a u chlapcov (< 2 ng/ml)
53,3 %.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
Prejavy
a
príznaky
V klinickom skúšaní a v post-marketingovom období bola identifikovaná náhodná alebo zámerná akútna toxicita samotného aripiprazolu u dospelých pacientov s odhadovanou dávkou do 1 260 mg bez smrteľných prejavov. Potenciálne medicínsky dôležité sledované znaky a príznaky zahŕňali letargiu, zvýšenie krvného tlaku, somnolenciu, tachykardiu, nauzeu, vracanie a hnačku. Ďalej sa získali aj správy náhodného predávkovania samotným aripiprazolom (do 195 mg) u detí bez smrteľných prejavov. Medzi potenciálne medicínsky závažné znaky a príznaky patrila prechodná strata vedomia a extrapyramidové symptómy.
Liečba predávkovania
Liečba predávkovania by sa mala zamerať na podpornú liečbu, zabezpečenie voľných dýchacích ciest,
oxygenáciu a ventiláciu a na liečbu príznakov. Musí sa zvážiť možnosť pôsobenia ďalších liekov. Preto sa má okamžite začať monitorovanie kardiovaskulárneho systému vrátane priebežného
elektrokardiografického monitorovania na odhalenie možných arytmií. Po akomkoľvek potvrdenom
alebo podozrivom predávkovaní aripiprazolom má pokračovať starostlivý lekársky dohľad a monitorovanie dovtedy, kým sa pacient nezotaví.
Živočíšne uhlie (50 g) podané po jednej hodine po podaní aripiprazolu znížilo hodnoty Cmax aripiprazolu asi o 41 % a hodnoty AUC asi o 51 %, čo poukazuje na to, že živočíšne uhlie môže byť účinné v liečbe predávkovania.
Hemodialýza
Aj napriek tomu, že neexistujú žiadne informácie o účinku hemodialýzy v liečbe predávkovania, nie je
pravdepodobné, že by hemodialýza bola užitočná v liečbe predávkovania, pretože sa aripiprazol vo veľkej miere viaže na plazmatické proteíny.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: ostatné antipsychotiká, ATC kód N05AX12
Mechanizmus účinku
Predpokladá sa, že účinnosť aripiprazolu u schizofrénie a bipolárnej poruchy typu I je sprostredkovaná
cez kombináciu čiastočného agonizmu dopamínových D2 a sérotonínových 5HT 1 a receptorov a antagonizmu sérotonínových 5HT 2 a receptorov. Aripiprazol preukázal antagonistické vlastnosti na zvieracích modeloch dopamínergnej hyperaktivity a agonistické vlastnosti na zvieracích modeloch dopamínergnej hypoaktivity. Aripiprazol preukázal in vitro vysokú väzbovú afinitu k dopamínovým D2 a D3 , sérotonínovým 5HT 1 a a 5HT2a receptorom a miernu afinitu k
dopamínovým D4 , sérotonínovým 5HT 2c a 5HT7 , alfa-1 adrenergným a histamínovým H1 receptorom. Aripiprazol preukázal miernu afinitu aj k miestu spätného vychytávania sérotonínu a nepreukázal
žiadnu afinitu k muskarínovým receptorom. Interakcia s receptormi, ktoré sú iné ako dopamínové a sérotonínové podtypy, môže vysvetľovať niektoré z ďalších klinických účinkov aripiprazolu.
Dávky aripiprazolu v rozsahu od 0,5 do 30 mg podané jedenkrát denne zdravým jedincom po dobu
2 týždňov vyvolali dávkovo závislú redukciu väzby 11C-raklopridu, ligandu D2 /D3 receptora na caudatus a putamen zistenú pozitrónovou emisnou tomografiou.
Klinická účinnosť abezpečnosť
Schizofrénia
V troch krátkodobých (4 až 6 týždňových) placebom kontrolovaných štúdiách zahŕňajúcich
1 228 dospelých schizofrenických pacientov s pozitívnymi alebo negatívnymi symptómami sa aripiprazol spájal so štatisticky významnými väčšími zlepšeniami v psychotických symptómoch v
porovnaní s placebom.
Aripiprazol je účinný v udržiavaní klinického zlepšenia počas pokračovacej terapie u dospelých pacientov, u ktorých sa prejavila odpoveď na úvodnú liečbu. V haloperidolom kontrolovanej štúdii pomer reagujúcich pacientov zachovávajúcich si citlivosť na liek počas 52 týždňov bol podobný v obidvoch skupinách (aripiprazol 77 % a haloperidol 73 %). Celkový konečný pomer bol signifikantne vyšší u pacientov liečených aripiprazolom (43 %) než u pacientov liečených haloperidolom (30 %). Ako sekundárny koncový ukazovateľ bolo použité aktuálne skóre na hodnotiacej škále zahŕňajúcej PANSS a Montgomeryho-Asbergovu hodnotiacu škálu depresie, ktorá ukazovala signifikantné zlepšenie oproti haloperidolu. V 26-týždňovej, placebom kontrolovanej štúdii s dospelými stabilizovanými pacientmi s chronickou schizofréniou sa u aripiprazolu zistilo významne väčšie zníženie miery relapsu, 34 % v aripiprazolovej skupine a 57 % u placeba.
Prírastok telesnej hmotnosti
V klinických štúdiách sa nedokázalo, že by aripiprazol vyvolával klinicky relevantný prírastok hmotnosti. V 26-týždňovej, olanzapínom kontrolovanej, dvojito zaslepenej, medzinárodnej štúdii schizofrénie, ktorá zahŕňala 314 dospelých pacientov, v ktorej bol primárne sledovaným parametrom prírastok telesnej hmotnosti, malo najmenej 7 % prírastok telesnej hmotnosti od počiatočnej hodnoty signifikantne menej pacientov (t.j. prírastok najmenej 5,6 kg pri počiatočnej hodnote hmotnosti
~80,5 kg) na aripiprazole (n = 18, alebo 13 % hodnotených pacientov) v porovnaní s olanzapínom
(n = 45, alebo 33 % hodnotených pacientov).
Lipidové parametre
V dostupných analýzach lipidových parametrov s placebom kontrolovaných klinických štúdií u dospelých, aripiprazol nepreukázal klinicky významné zmeny v hladinách celkového cholesterolu, triglyceridov, HDL a LDL.
-Celkový cholesterol: incidencia zmien hladín z normálnej (< 5,18 mmol/l) na vysokú (≥ 6,22 mmol/l)
bola 2,5 % pre aripiprazol a 2,8 % pre placebo a priemerná zmena oproti bazálnej hladine bola
−0,15 mmol/l (95 % CI: −0,182, −0,115) pre aripiprazol a −0,11 mmol/l (95 % CI: −0,148, −0,066)
pre placebo.
- hladina triglyceridov: incidencia zmien hladín z normálnej (< 1,69 mmol/l) na vysokú
(≥ 2,26 mmol/l) bola 7,4 % pre aripiprazol a 7,0 % pre placebo a priemerná zmena oproti bazálnej hladine bola −0,11 mmol/l (95 %CI: −0,182, −0,046) pre aripiprazol a −0,07 mmol/l (95 %CI: −0,148,
0,007) pre placebo.
-HDL: incidencia zmien hladín z normálnej (≥ 1,04 mmol/l) na nízku (< 1,04 mmol/l) bola 11,4 % pre aripiprazol a 12,5 % pre placebo a priemerná zmena oproti bazálnej hladine bola −0,03 mmol/l (95 % CI: −0,046, −0,017) pre aripiprazol a −0,04 mmol/l (95 % CI: −0,056, −0,022) pre placebo.
-hladina LDL: incidencia zmien hladín z normálnej (< 2,59 mmol/l) na vysokú (≥ 4,14 mmol/l) bola
0,6 % pre aripiprazol a 0,7 % pre placebo a priemerná zmena oproti bazálnej hladine bola
−0,09 mmol/l (95 % CI: −0,139, −0,047) pre aripiprazol a −0,06 mmol/l (95 % CI: −0,116, −0,012)
pre placebo.
Prolaktín
Hladiny prolaktínu boli hodnotené vo všetkých skúšania všetkých dávok aripiprazolu (n = 28 242). Výskyt hyperprolaktinémie alebo nárast prolaktínu v sére u pacientov liečených aripiprazolom (0,3 %)
bol podobný ako výskyt pri liečbe placebom (0,2 %). U pacientov liečených aripiprazolom výskyt
nastal v priemere po 42 dňoch a trval v priemere 34 dní.
Výskyt hyperprolaktinémie alebo pokles prolaktínu v sére u pacientov liečených aripiprazolom bol
0,4 % v porovnaní s 0,02 % u pacientov liečených placebom. U pacientov liečených aripiprazolom výskyt nastal v priemere po 30 dňoch a trval v priemere 194 dní.
M
anické epizódy pri bipolárnej poruche typu I
V dvoch 3-týždňových placebom kontrolovaných monoterapeutických štúdiách s flexibilným dávkovaním zahŕňajúcich pacientov s manickou alebo zmiešanou epizódou bipolárnej poruchy typu I, aripiprazol dosiahol lepšiu účinnosť v porovnaní s placebom v redukcii manických symptómov počas
3 týždňov. Tieto skúšania zahŕňali pacientov s psychotickými príznakmi alebo bez nich a s priebehom rýchleho cyklovania alebo bez neho.
V jednej 3-týždňovej placebom kontrolovanej monoterapeutickej štúdii s fixným dávkovaním zahŕňajúcej pacientov s manickou alebo zmiešanou epizódou bipolárnej poruchy typu I, aripiprazol
nepreukázal lepšiu účinnosť v porovnaní s placebom.
V dvoch 12-týždňových placebom a aktívne kontrolovaných monoterapeutických štúdiách u pacientov s manickou alebo zmiešanou epizódou bipolárnej poruchy typu I s psychotickými príznakmi alebo bez nich, aripiprazol dosiahol lepšiu účinnosť v porovnaní s placebom v 3. týždni a udržiavací účinok porovnateľný s lítiom alebo haloperidolom v 12. týždni. Aripiprazol taktiež dosiahol porovnateľný pomer pacientov so symptomatickou remisiou mánie ako lítium alebo haloperidol v 12. týždni.'
V 6-týždňovej placebom kontrolovanej štúdii zahŕňajúcej pacientov s manickou alebo zmiešanou epizódou bipolárnej poruchy typu I s psychotickými príznakmi alebo bez nich, ktorí čiastočne neodpovedali na monoterapiu lítiom alebo valproátom počas 2. týždňov v terapeutických sérových hladinách pridanie aripiprazolu ako adjuvantnej terapie malo za následok lepšiu účinnosť v znížení manických symptómov ako monoterapia lítiom alebo valproátom.
V 26-týždňovej placebom kontrolovanej štúdii nasledovanej 74-týždňovým rozšírením štúdie u manických pacientov, ktorí dosiahli remisiu na aripiprazole počas stabilizačnej fázy pred randomizáciou, aripiprazol dosiahol lepšiu účinnosť ako placebo v prevencii bipolárnej rekurencie, najmä v prevencii rekurencie mánie, ale nedosiahol lepšiu účinnosť ako placebo v prevencii rekurencie depresie.
V 52-týždňovej placebom kontrolovanej štúdii u pacientov so súčasnou manickou alebo zmiešanou epizódou bipolárnej poruchy typu I, ktorý dosiahli pretrvávajúcu remisiu (Y-MRS a MADRS celkové skóre ≤ 12) na aripiprazol (10 mg/deň až 30 mg/deň) pridávaný k lítiu alebo valproátu počas 12. po sebe nasledujúcich týždňoch, pridaný aripiprazol preukázal lepšiu účinnosť ako placebo so 46 % znížením rizika (hazard ratio: 0,54) v prevencii bipolárnej rekurencie a so 65 % znížením rizika (hazard ratio: 0,35) v prevencii rekurencie mánie nad pridaným placebom, ale nedosiahol lepšiu účinnosť ako placebo v prevencii rekurencie depresie. Pridaný aripiprazol preukázal lepšiu účinnosť ako placebo podľa sekundárne sledovaného parametra CGI-BP skóre závažnosti ochorenia (mánia).
V tomto skúšaní boli pacienti zaradení skúšajúcimi do dvoch skupín buď do open-label s lítiom alebo monoterapie s valproátom na zistenie čiastočnej odpovede. Pacienti boli stabilizovaní počas najmenej
12. po sebe nasledujúcich týždňov kombináciou aripiprazolu a rovnakého stabilizátora nálady. Stabilizovaní pacienti boli následne randomizovaní na pokračujúcu liečbu rovnakým stabilizátorom
nálady s dvojito zaslepeným podávaním aripiprazolu alebo placeba. Štyri podskupiny
so stabilizátorom nálady boli určené v randomizačnej fáze: aripiprazol + lítium, aripiprazol + valproát;
placebo + lítium; placebo + valproát. Miera rekurencie akejkoľvek epizódy nálady v ramene s adjuvantnou liečbou, podľa Kaplana-Meiera, bola 16 % pre aripiprazol + lítium a 18 % pre
aripiprazol + valproát oproti 45 % pre placebo + lítium a 19 % pre placebo + valproát.
Pediatrická populácia
Schizofréniaudospievajúcich
V 6-týždňovom placebom kontrolovanom skúšaní zahŕňajúcom 302 dospievajúcich pacientov
(13-17 rokov) so schizofréniou s pozitívnymi alebo negatívnymi symptómami sa aripiprazol spájal so štatisticky významnejším zlepšením psychotických symptómov v porovnaní s placebom. Pri subanalýze dospievajúcich pacientov vo veku medzi 15. až 17. rokmi, ktorí predstavujú 74 % celkovej zaradenej populácie, sa zachovanie účinku pozorovalo dlhšie ako počas 26-týždňovej otvorenej predĺženej štúdii.
M
anické
epizódy
pri
bipolárnej
poruche
t
ypu
I
u
detí
a
dospievajúcich
Aripiprazol sa skúmal v 30-týždňovom placebom kontrolovanom klinickom skúšaní, do ktorého bolo zaradených 296 detí a dospievajúcich (10-17 rokov), ktorí spĺňali kritériá DSM-IV pre bipolárnu
poruchu typu I s manickými alebo zmiešanými epizódami s psychotickými znakmi alebo bez nich
a mali na začiatku štúdie skóre Y-MRS ≥ 20. Medzi pacientmi zaradenými do analýzy primárne účinnosti malo 139 pacientov súčasne diagnostikovanú komorbiditu ADHD.
Aripiprazol bol superiórny v celkovom skóre Y-MRS voči placebu v zmene medzi východiskovým stavom a 4. týždňom a 12. týždňom. V následnej (post-hoc) analýze bolo zlepšenie voči placebu očividnejšie u pacientov so spojenou komorbiditou ADHD v porovnaní so skupinou bez ADHD, kde sa nezistil žiaden rozdiel voči placebu. Rekurencia prevencie nie je dokázaná.
Tabuľka 1: Priemerné zlepšenie voči východiskovému stavu v skóre YMRS v psychiatrickej komorbidite
P
sychiatrická
komorbidita
Aripiprazole Accord
4.
týždeň
12.
týždeň
ADHD 4.
týždeň
Aripiprazole Accord
12.
týždeň
10 mg (n = 48) 14,9 15,1
Aripiprazole Accord
30 mg (n = 51) 16,7 16,9
Placebo
(n = 52)a 7,0 8,2
10 mg (n = 44) 15,2 15,6
Aripiprazole Accord
30 mg (n = 48) 15,9 16,7
Placebo
(n = 47)b 6,3 7,0
B
ez psychiatrickej komorbidity
Aripiprazole Accord
4. týždeň
12. týždeň
Bez ADHD 4. týždeň
Aripiprazole Accord
12. týždeň
10 mg (n = 27) 12,8 15,9
Aripiprazole Accord
30 mg (n = 25) 15,3 14,7
Placebo
(n = 18) 9,4 9,7
a n = 51 v 4. týždni
b n = 46 v 4. týždni
10 mg (n = 37) 12,7 15,7
Aripiprazole Accord
30 mg (n = 30) 14,6 13,4
Placebo
(n = 25) 9,9 10,0

Najčastejšími naliehavými nežiaducimi reakciami pri liečbe pacientov, ktorí užívali 30 mg boli
extrapyramídové poruchy (28,3 %), somnolencia (27,3 %), bolesť hlavy (23,2 %) a nauzea (14,1 %). Priemerný nárast telesnej hmotnosti v 30-týždňovom intervale liečby bol 2,9 kg v porovnaní s 0,98 kg
u pacientov liečených placebom.
Podráždenosťspojenásautistickouporuchouupediatrickýchpacientov(pozričasť4.2)Aripiprazol sa skúmal u pacientov vo veku 6 až 17 rokov v dvoch 8-týždňových placebom kontrolovaných klinických skúšaniach [jedna variabilná dávka (2-15 mg/deň) a jedna fixná dávka (5,
10 alebo 15 mg/deň)] a v jednom 52-týždňovom otvorenom klinickom skúšaní. Dávkovanie v týchto klinických skúšaniach sa začalo 2 mg/deň, zvýšilo sa na 5 mg/deň po jednom týždni a v týždenných
prírastkoch sa zvyšovalo o 5 mg/deň až na cieľovú dávku. Viac ako 75 % pacientov malo vek menej než 13 rokov. Aripiprazol preukázal štatisticky významnú superioritu účinnosti v porovnaní
s placebom v podškále Podráždenosti v Zozname odchýlok správania (Aberrant Behaviour Checklist Irritability subscale). Klinický význam tohto zistenia však nie je stanovený. Bezpečnostný profil zahŕňal zvýšenie telesnej hmotnosti a zmeny hladín prolaktínu. Trvanie dlhodobej štúdie bezpečnosti
bolo obmedzené na 52 týždňov. V súhrne klinických skúšaní bol výskyt nízkych hladín sérového prolaktínu u dievčat (< 3 ng /ml) 27/46 (58,7 %) a u chlapcov (< 2 ng /ml) 258/298 (86, 6 % ) u
pacientov liečených aripiprazolom. V placebom kontrolovaných klinických skúšaniach bol priemerný prírastok telesnej hmotnosti 0,4 kg pri liečbe placebom a 1,6 kg pri liečbe aripiprazolom.
Aripiprazol sa skúmal aj v placebom-kontrolovanom, dlhodobo udržiavanom klinickom skúšaní. Po
13.-26. týždňoch stabilizácie aripiprazolom (2-15 mg/deň) pacienti so stabilizovanou odpoveďou
pokračovali v liečbe aripiprazolom alebo ho mali nahradený placebom na ďalších 16 týždňov. Podľa
Kaplana-Meiera bol pomer relapsov v 16. týždni 35 % po aripiprazole a 52 % po placebe; pomer
rizika replasov v priebehu 16. týždňov (aripiprazol/placebo) bol 0,57 (štatisticky nevýznamný rozdiel). Priemerný prírastok telesnej hmotnosti počas stabilizačnej fázy (až do 26. týždňa) bol po aripiprazole
3,2 kg a v druhej fáze (16. týždňov) klinického skúšania sa pozoroval ďalší priemerný prírastok o
2,2 kg po aripiprazole v porovnaní s 0,6 kg po placebe. Extrapyramídové symptómy sa hlásili najmä počas stabilizačnej fázy u 17 % pacientov, s trasom predstavujúcim 6,5 %.
Tiky súvisiace s Tourettovým syndrómom u pediatrických pacientov (pozri časť 4.2)
Účinnosť aripiprazolu bola skúmaná u pediatrických subjektov trpiacich Tourettovým syndrómom
(aripiprazol: n = 99, placebo: n = 44) v randomizovanej, dvojito zaslepenej, placebom kontrolovanej
8-týždňovej štúdii s použitím dizajnu s pevnou dávkou na základe telesnej hmotnosti v liečenej skupine v rozsahu dávky 5 mg/deň až 20 mg/deň a so začiatočnou dávkou 2 mg. Pacienti boli vo veku
7-17 rokov a dosahovali základnú hodnotu priemerného skóre 30 z celkového skóre tikov podľa
Yaleovej celkovej škály závažnosti tikov (TTS-YGTSS). Aripiprazol preukázal zlepšenie vo forme zmeny TTS-YGTSS zo základnej hodnoty do 8. týždňa na hodnotu 13,35 v skupine s nízkou dávkou
(5 mg alebo 10 mg) a hodnotu 16,94 v skupine s vysokou dávkou (10 mg alebo 20 mg) v porovnaní so
zlepšením na hodnotu 7,09 v skupine užívajúcej placebo.
Účinnosť aripiprazolu u pediatrických subjektov s Tourettovým syndrómom (aripiprazol: n = 32, placebo: n = 29) bola hodnotená aj pri flexibilnom rozsahu dávky od 2 mg/deň do 20 mg/deň a pri začiatočnej dávke 2 mg v 10-týždňovej, randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii vykonanej v Južnej Kórei. Pacienti boli vo veku 6-18 rokov a dosahovali základnú hodnotu priemerného skóre 29 podľa TTS-YGTSS. Skupina, ktorá užívala aripiprazol, preukázala zlepšenie hodnoty TTS-YGTSS na hodnotu 14,97 zo základnej hodnoty do 10. týždňa v porovnaní so zlepšením na hodnotu 9,62 v skupine užívajúcej placebo.
V obidvoch krátkodobých skúšaniach nebol stanovený klinický význam zistení účinnosti pri posúdení miery účinku liečby v porovnaní s vysokým účinkom placeba a nejasnými účinkami týkajúcimi sa psychosociálneho fungovania. Nie sú dostupné žiadne dlhodobé údaje týkajúce sa účinnosti
a bezpečnosti aripiprazolu pri tejto fluktuačnej poruche.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s aripiprazolom
v jednej alebo vo viacerých podskupinách pediatrickej populácie pri liečbe schizofrénie a pri liečbe bipolárnej afektívnej poruchy (informácie o použití v pediatrickej populácii, pozri časť 4.2 ).
5.2 Farmakokinetické vlastnosti
Absorpcia
Aripiprazol sa dobre vstrebáva a vrcholové plazmatické koncentrácie sa dosiahnu do 3-5 hodín po
podaní dávky. Aripiprazol podlieha minimálnemu pre-systémovému metabolizmu. Absolútna biologická dostupnosť tabletovej liekovej formy je 87 %. Jedlo s vysokým obsahom tuku nemá žiadny
vplyv na farmakokinetiku aripiprazolu.
Distribúcia
Aripiprazol je v značnej miere distribuovaný do celého tela so zdanlivým distribučným objemom
4,9 l/kg, čo poukazuje na rozsiahlu extravaskulárnu distribúciu. Pri terapeutických koncentráciách je väzba aripiprazolu a dehydro-aripiprazolu na proteíny v sére viac než 99 % s väzbou hlavne na
albumín.
Biotransformácia
Aripiprazol sa v rozsiahlej miere metabolizuje v pečeni hlavne tromi biotransformačnými cestami:
dehydrogenáciou, hydroxyláciou a N-dealkyláciou. Na základe in vitro štúdií sú enzýmy CYP3A4 a
CYP2D6 zodpovedné za dehydrogenáciu a hydroxylácia aripiprazolu a N-dealkylácia je katalyzovaná
enzýmom CYP3A4. Aripiprazol tvorí hlavný podiel lieku v systémovom obehu. V rovnovážnom stave predstavuje aktívny metabolit, dehydro-aripiprazol, asi 40 % hodnoty AUC aripiprazolu v plazme.
Eliminácia
Priemerný polčas eliminácie aripiprazolu je približne 75 hodín u rýchlych metabolizérov CYP2D6 a
približne 146 hodín u pomalých metabolizérov CYP2D6.
Celkový telesný klírens aripiprazolu je 0,7 ml/min/kg a je predovšetkým hepatálny.
Po jednotlivej perorálnej dávke aripiprazolu značeného [14C] bolo približne 27 % podanej rádioaktívnej látky zistenej v moči a približne 60 % v stolici. Menej ako 1 % nezmeneného aripiprazolu sa vylúčilo močom a približne 18 % sa vylúčilo v nezmenenej forme stolicou.
Farmakokinetika u špeciálnychskupínpacientov
Pediatrická populácia
Farmakokinetika aripiprazolu a dehydroaripiprazolu u pacientov od 10 do 17 rokov bola podobná tej ako u dospelých po vykorigovaní rozdielov v telesnej hmotnosti.
Starší
Neexistujú žiadne rozdiely vo farmakokinetike aripiprazolu medzi zdravými staršími a mladšími dospelými jedincami a vo farmakokinetickej populačnej analýze u schizofrenických pacientov sa
nezistil ani žiadny vplyv veku.
Pohlavie
Neexistujú žiadne rozdiely vo farmakokinetike aripiprazolu medzi zdravými mužskými a ženskými jedincami a vo farmakokinetickej populačnej analýze u schizofrenických pacientov sa nezistil ani
žiadny vplyv pohlavia.
Fajčenie
Hodnotenie farmakokinetických vlastností populácie neodhalilo žiadne klinicky podstatné účinky súvisiace s fajčením na farmakokinetiku aripiprazolu.
Rasa
Hodnotenie farmakokinetických vlastností populácie nepreukázalo výskyt žiadnych rozdielov spojených s rasou vo farmakokinetike aripiprazolu.
Porucha funkcie obličiek
Zistilo sa, že farmakokinetické vlastnosti aripiprazolu a dehydro-aripiprazolu sú u pacientov s ťažkým ochorením obličiek podobné ako u mladých zdravých jedincov.
Porucha funkcie pečene
Štúdia jednorazovej dávky u jedincov s rôznymi stupňami cirhózy pečene (Childov-Pughov stupeň A, B a C) neodhalila významný vplyv poruchy funkcie pečene na farmakokinetiku aripiprazolu a
dehydro-aripiprazolu, ale do štúdie boli zaradení iba 3 pacienti s pečeňovou cirhózou triedy C, čo je nedostatočné na vyvodenie dôsledkov na základe ich metabolickej kapacity.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje o bezpečnosti na základe obvyklých štúdií farmakologickej bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu a vývojovej a reprodukčnej toxicity neodhalili žiadne osobitné riziko pre ľudí.
Toxikologicky významné účinky sa pozorovali iba po dávkach alebo expozíciách považovaných za dostatočne vyššie než je maximálna dávka alebo expozícia u ľudí, čo poukazuje na to, že tieto účinky boli obmedzené alebo nemali význam pre klinické použitie. Tieto účinky zahŕňali: dávkovo závislú
adrenokortikálnu toxicitu (kumulácia lipofuscínu a/alebo strata parenchymálnych buniek) u potkanov po 104 týždňoch pri dávke od 20 do 60 mg/kg/deň (3 až 10-násobok priemernej hodnoty AUC v rovnovážnom stave pri maximálnej odporúčanej dávke u ľudí) a zvýšené adrenokortikálne karcinómy a kombinované adrenokortikálne adenómy/karcinómy u samíc potkanov pri dávke 60 mg/kg/deň
(10-násobok priemernej hodnoty AUC v ustálenom stave pri maximálnej odporúčanej dávke u ľudí). Najvyššia nekarcinogénna expozícia u samíc potkanov bola pri odporúčanej dávke 7-násobne vyššia
ako expozícia u ľudí.
Dodatočným zistením bola cholelitiáza ako dôsledok precipitácie sulfátových konjugátov hydroxymetabolitov aripiprazolu v žlči opíc po opakovanom perorálnom podaní dávky od 25 do
125 mg/kg/deň (1 až 3-násobok priemernej hodnoty AUC v rovnovážnom stave pri maximálnej odporúčanej klinickej dávke alebo pri 16 až 81-násobku maximálnej odporúčanej dávky u ľudí založenej na mg/m2). Koncentrácie sulfátových konjugátov hydroxy-aripiprazolu v ľudskej žlči pri najvyššej navrhovanej dávke 30 mg denne však neboli vyššie ako 6 % koncentrácií v žlči zistených u opíc v 39 týždňovej štúdii a boli značne pod (6 %) limitmi ich rozpustnosti in vitro.
Profil toxicity aripiprazolu v štúdiách s opakovanou dávkou u potkanov a psov bol porovnateľný s tým, ktorý bol pozorovaný u dospelých zvierat a nevyskytol sa žiadny prejav neurotoxicity ani nežiaducich účinkov na vývoj.
Na základe kompletného rozsahu štandardných testov genotoxicity sa aripiprazol nepokladá za genotoxický. Aripiprazol v reprodukčných štúdiách toxicity nepoškodil fertilitu. Vývojová toxicita, zahŕňajúca na dávke závislú oneskorenú osifikáciu plodu a možné teratogénne účinky, bola pozorovaná u potkanov pri dávkach vedúcich k subterapeutickej expozícii (odvodené od AUC) a u králikov pri dávkach vedúcich k expozícii 3 a 11-násobku priemernej hodnoty AUC v rovnovážnom stave pri maximálnej odporúčanej klinickej dávke u ľudí. Zistilo sa, že dávky podobné tým, ktoré vyvolali vývojovú toxicitu, boli toxické aj pre matku.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Aripiprazole Accord 5 mgtablety
Monohydrát laktózy
Celulóza, mikrokryštalická
Kukuričný škrob Hydroxypropylcelulóza Magnéziumstearát
Hlinitý lak indigokarmínu (E132)
Aripiprazole Accord 10mg/30mgtablety
Monohydrát laktózy
Celulóza, monokryštalická Kukuričný škrob Hydroxypropylcelulóza Magnéziumstearát
Červený oxid železitý (E172)
Aripiprazole Accord 15mgtablety
Monohydrát laktózy
Celulóza, monokryštalická Kukuričný škrob Hydroxypropylcelulóza
Magnéziumstearát
Žltý oxid železitý (E172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
Čas použiteľnosti po 1. otvorení:
- 30 dní (pre HDPE s obsahom 30 tabliet)
- 100 dní (pred HDPE s obsahom 100 tabliet)
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Aripiprazole Accord 5/10/15/30 mg tablety v hliníkových/hliníkových perforovaných blistroch s jednotlivými dávkami s 14 x 1, 28 x 1, 49 x 1, 56 x 1, 98 x 1 tabletami.
Aripiprazole Accord 5/10/15 mg tablety vo fľašiach HDPE s uzáverom PPCRC obsahujúce
30 alebo 100 tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa musí zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Accord Healthcare Limited
Sage House, 319 Pinner Road
North Harrow, Middlesex, HA1 4HF Veľká Británia
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
5 mg: EU/1/15/1045/001- 006, EU/1/15/1045/023
10 mg: EU/1/15/1045/007- 012, EU/1/15/1045/024
15 mg: EU/1/15/1045/013- 018, EU/1/15/1045/025
30 mg: EU/1/15/1045/019- 022, EU/1/15/1045/026
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.