>
Opatrenia pred zaobchádzaním alebo podaním lieku, pozri časť 6.6.
4.3 KontraindikácieAQUA PRO INJECTIONE IMUNA nesmie byť použitá ako samostatný infúzny, alebo injekčný roztok.
Do úvahy treba vziať kontraindikácie pridaného lieku.
4.4 Osobitné upozornenia a opatrenia pri používaníAQUA PRO INJECTIONE IMUNA je silne hypotonická. Nepoužíva sa na intravenóznu injekciu, pokiaľ nie je upravená na približne izotonický roztok vhodne rozpusteným liekom.
Ak sa AQUA PRO INJECTIONE IMUNA používa na riedenie hypertonických roztokov, príslušné riedenie treba zvoliť tak, aby vznikol približne izotonický roztok.
Po infúzii veľkých objemov hypotonických roztokov, použitím vody na injekciu ako rozpúšťadla, môže dôjsť k hemolýze.
Pri podávaní veľkých objemov treba pravidelne monitorovať iónovú rovnováhu.
4.5 Liekové a iné interakcieNie sú známe.
Treba vziať do úvahy možné klinické interakcie medzi jednotlivými pridanými liekmi.
4.6 Fertilita, gravidita, laktáciaPoužitie u tehotných a dojčiacich žien závisí od charakteru pridávaných liekov.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNie je známe.
4.8 Nežiaduce účinkyPriame nežiaduce účinky nie sú uvádzané, avšak nezodpovedajúca infúzna terapia môže viesť k všeobecným nežiaducim účinkom.
Ak sa podáva AQUA PRO INJECTIONE IMUNA samostatne, môže intravenózna injekcia spôsobiť hemolýzu. Povaha aditív predurčuje pravdepodobnosť výskytu ďalších nežiaducich účinkov. Ďalej sa môžu vyskytnúť reakcie v mieste vpichu.
Pri výskyte nežiaducej reakcie treba prerušiť podávanie infúzie a za kontinuálneho monitorovania korigovať vnútorné prostredie. Pokiaľ sa objaví nežiaduci účinok spôsobený liekom pridaným do infúzie, je potrebné infúziu prerušiť a liečbu prehodnotiť.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 PredávkovaniePri príjme väčších množstiev hypotonickej tekutiny sa môže vyskytnúť hyperhydratácia a hypotonické elektrolytové poruchy, hlavne pri poruchách funkcie obličiek.
Prejavy a príznaky predávkovania určuje tiež charakter pridávaných liekov. V prípade predávkovania infúznym roztokom je treba liečbu prerušiť a pacienta sledovať, vzhľadom na možný výskyt prejavov a príznakov spojených s podaním lieku.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Všetky ostatné neterapeutické prípravky. Rozpúšťadlá a riedidlá vrátane irigačných roztokov
ATC kód: V07AB.
AQUA PRO INJECTIONE IMUNA sa používa iba ako vehikulum pre podanie pridávaných liekov. Farmakodynamika závisí od charakteru použitého lieku.
5.2 Farmakokinetické vlastnostiAQUA PRO INJECTIONE IMUNA sa voľne distribuuje vo všetkých kompartmentoch, dobre preniká membránami.
Farmakokinetika závisí od charakteru pridaného lieku.
5.3 Predklinické údaje o bezpečnostiJedná sa o bezpečný liek bez toxických, mutagénnych, karcinogénnych a teratogénnych účinkov.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokŽiadne.
6.2 InkompatibilityPred pridaním liekov si overte, či sú rozpustné a stabilné vo vode pri pH vody na injekciu a či sú vzájomne kompatibilné
Aditíva, ktorých inkompatibilita nie je známa, sa nemajú používať.
6.3 Čas použiteľnostiInjekčná liekovka v neporušenom obale: 2 roky
Sklenená infúzna fľaša v neporušenom obale: 3 roky
Plastový PVC vak v neporušenom obale: 2 roky
Plastový PP vak (ENVIBAG) v neporušenom obale: 1 rok
Použiť ihneď po otvorení.
Liek sa nesmie používať po uplynutí času použiteľnosti vyznačenom na obale.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 25°C.
Neuchovávajte v mrazničke.
6.5 Druh obalu a obsah baleniaa) injekčná liekovka s gumovou zátkou, hliníkový lemovací uzáver s odtrhávajúcim štítkom, kartónová škatuľa.
Veľkosti balenia: 1 x 5 ml, 1 x 10 ml, 1 x 20 ml, 1 x 100 ml,
b) sklenená infúzna fľaša s gumovou zátkou a kovovým uzáverom, kartónová škatuľa.
Veľkosti balenia: 1 x 100 ml, 1 x 200 ml, 1 x 250 ml, 1 x 400 ml, 1 x 500 ml
c) PVC plastový vak, plastový uzáver z PVC alebo z polykarbonátu uzavretý v PE+PA fólii, kartónová škatuľa
Veľkosti balenia: 1 x 100 ml, 1 x 200 ml, 1 x 250 ml, 1 x 400 ml, 1 x 500 ml, 1 x 1000 ml, 1 x 2000 ml, 1 x 3000 ml, 1 x 5000 ml
d) PP plastový vak ENVIBAG s injekčným a infúznym portom uzavretý v plastovej fólii.
Vaky sa dodávajú nasledovne:
1 x 100 ml, 1 x 250 ml, 1 x 500 ml, 1 x 1000 ml (jednotlivo)
40 x 100 ml, 18 x 250 ml, 10 x 500 ml, 10 x 1000 ml (v kartónovej škatuli).
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom Len na lekársky predpis. Dávkovanie podľa pokynov lekára.
Použite len v prípade, že je roztok číry, bez viditeľných častíc, a ak je obal nepoškodený. Podajte okamžite po napojení na infúzny set.
Nepoužívajte plastové vaky v sériových napojeniach. Takéto použitie môže viesť k vzduchovej embólii spôsobenej natiahnutím zvyšného vzduchu z hlavného vaku pred ukončením podávania tekutiny z vedľajšieho vaku. Stlačenie intravenózneho roztoku v pružnom plastovom obale za účelom zvýšenia rýchlosti prietoku môže zapríčiniť vzduchovú embóliu, ak pred podaním nie je reziduálny objem vzduchu z vaku úplne vyprázdnený.
Roztok sa musí podávať aseptickou metódou pomocou sterilného zariadenia. Aby sa predišlo vniknutiu vzduchu do systému, zariadenie sa musí naplniť roztokom.
Ďalšie lieky sa môžu pridať pred alebo počas podávania infúzie cez venóznu linku.
Keď sa pridáva do roztoku ďalší liek, pred parenterálnym podaním skontrolujte izotonicitu. Musí sa zaistiť dôkladné a starostlivé aseptické premiešanie všetkých ďalších pridaných liekov. Roztoky obsahujúce aj ďalšie pridané lieky sa musia použiť okamžite a nesmú sa uchovávať.
Len na jednorazové použitie.Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.Čiastočne použité vaky už viackrát nepripájajte.Vnútorný vak je zabalený v sekundárnom obale. Vyberte z ochranného obalu tesne pred použitím. Vnútorný vak udržiava sterilitu lieku.'
NÁVOD NA MANIPULÁCIU S VAKOMObrázok 1: Vak 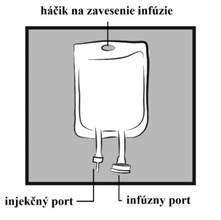
1. KONTROLA PRED PODANÍM
a) Skontrolujte vak, či nedochádza k unikaniu tekutiny. Pokiaľ zistíte narušenie celistvosti vaku, vak s roztokom zlikvidujte, keďže môže byť narušená jeho sterilita.
b) Skontrolujte, či roztok opticky spĺňa charakteristiky uvedené v súhrne charakteristických vlastností lieku. Pokiaľ nie, roztok zlikvidujte. Na prípravu a podávanie používajte sterilný materiál.
2. PRÍPRAVA NA PODANIE
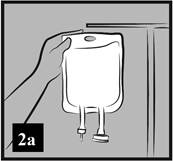
a) Zaveste vak na stojan alebo ho položte na vodorovnú plochu (Obrázok 2a).
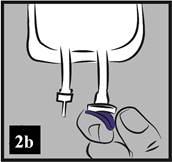
b) Modrý plastový kryt z výstupného portu (infúzneho portu) odstráňte vylomením (Obrázok 2b).
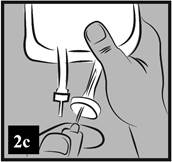
c) Gumená zátka portu je sterilná, preto nie je potrebná jej dezinfekcia. Pripojte hrubú perforačnú ihlu infúzneho setu do infúzneho portu (Obrázok 2c).
d) Ďalej postupujte podľa návodu priloženého k infúznemu setu (naplnenie setu a podávanie roztoku).
3. PRIDANIE LIEKU DO ROZTOKU
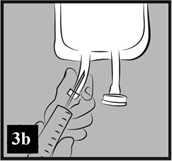
a) Odlomte priesvitný kryt na injekčnom porte. Gumená zátka je sterilná, preto nie je potrebná jej dezinfekcia (Obrázok 3a).
b) Prepichnite injekčný port a pridajte liek. Odporúčaná veľkosť ihly: 19 G (1,10 mm) až 22 G (0,70 mm) (Obrázok 3b).
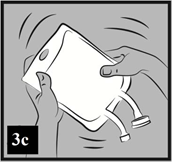
c) Dôkladne premiešajte obsah vaku (Obrázok 3c).

Upozornenie: Riaďte sa pokynmi na likvidáciu vakov v zdravotníctve (obsah pridaného lieku).
Do vaku je možné doplniť maximálne množstvo ďalšieho lieku :
100 ml vak
| max. 70 ml
|
250 ml vak
| max. 75 ml
|
500 ml vak
| max. 115 ml
|
1 000 ml vak
| max. 130 ml
|
7. Držiteľ rozhodnutia o registrácii IMUNA PHARM, a.s.
Jarková 269/17
082 22 Šarišské Michaľany
Slovenská republika
8. Registračné číslo87/0023/72-S
9. DátumPRVEJ registrácie/DÁTUM PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 03. mája 1972
Dátum posledného predĺženia registrácie: 30. januára 2004
10. DÁTUM REVÍZIE TEXTU01/2018