
/>U osôb so zhoršenou imunitnou odpoveďou, či už v dôsledku používania imunosupresívnej liečby alebo genetickej chyby, infekcie HIV alebo z iných dôvodov, môže byť znížená odpoveď protilátok na aktívnu imunizáciu. Klinický význam týchto údajov nie je známy.
Údaje o bezpečnosti a imunogenite pre Prevenar 13 (pneumokoková konjugovaná očkovacia látka zložená z 13 polysacharidových konjugátov, ktoré sú obsiahnuté aj v Apexxnare) sú dostupné u obmedzeného počtu osôb s infekciou HIV alebo s HSCT (pozri časti 4.8 a 5.1).
U dospelých boli vo všetkých študovaných vekových skupinách splnené kritériá formálnej non- inferiority, hoci u Apexxnaru sa pozoroval numericky nižší geometrický priemer titrov pre väčšinu sérotypov v porovnaní s Prevenarom 13 (pozri časť 5.1). Klinický význam tohto pozorovania
u imunokompromitovaných osôb však nie je známy.
Pomocná látka
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v dávke, t. j. v podstate zanedbateľné množstvo
sodíka.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
Rôzne injekčne podávané očkovacie látky sa majú podávať vždy do rôznych miest očkovania. Nemiešajte Apexxnar s inými očkovacia látkami/liekmi v tej istej injekčnej striekačke.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii údaje o použití Apexxnaru u gravidných žien.
Štúdie na zvieratách nepreukázali priame alebo nepriame účinky z hľadiska reprodukčnej toxicity. O podaní Apexxnaru počas gravidity sa má uvažovať len vtedy, keď potenciálne prínosy prevažujú
nad akýmikoľvek potenciálnymi rizikami pre matku a plod.
Dojčenie
Nie je známe, či sa očkovacia látka Apexxnar vylučuje do materského mlieka.
Fertilita
Nie sú k dispozícii žiadne údaje o účinku Apexxnaru na fertilitu ľudí. Štúdie na zvieratách
nepreukázali priame alebo nepriame účinky z hľadiska samičej plodnosti (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Apexxnar nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Niektoré účinky uvedené v časti 4.8 však môžu dočasne ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Účastníci vo veku 18 rokov a starší
Bezpečnosť Apexxnaru sa hodnotila u 4 552 účastníkov vo veku 18 rokov a starších v šiestich klinických skúšaniach (dve fázy 1, jedno fázy 2 a tri fázy 3) a u 2 496 účastníkov v kontrolných skupinách.
V klinických skúšaniach fázy 3 dostalo 4 263 účastníkov Apexxnar. Z týchto účastníkov bolo
1 798 účastníkov vo veku 18 až 49 rokov, 334 účastníkov bolo vo veku 50 až 59 rokov
a 2 131 účastníkov bolo vo veku 60 rokov a starších (1 138 bolo vo veku 65 rokov a starších). Z tých účastníkov, ktorí dostali Apexxnar v skúšaniach fázy 3, nebolo 3 639 predtým očkovaných žiadnou očkovacou látkou proti pneumokokom, 253 predtým dostalo Pneumovax 23 (pneumokoková polysacharidová očkovacia látka [23-valentná]; PPSV23) (≥ 1 až ≤ 5 rokov pred zaradením),
246 predtým dostalo len Prevenar 13 (≥ 6 mesiacov pred zaradením) a 125 predtým dostalo
Prevenar 13 a následne PPSV23 (dávka PPSV23 ≥ 1-rok pred zaradením).
Účastníci v skúšaní B7471007 fázy 3 (pivotné skúšanie 1007) boli hodnotení z hľadiska nežiaducich udalostí 1 mesiac po očkovaní a z hľadiska závažných nežiaducich udalostí počas 6 mesiacov
po očkovaní. Toto skúšanie zahŕňalo 447 účastníkov vo veku 18 až 49 rokov, 445 účastníkov vo veku
50 až 59 rokov, 1 985 účastníkov vo veku 60 až 64 rokov, 624 účastníkov vo veku 65 až 69 rokov,
319 účastníkov vo veku 70 až 79 rokov a 69 účastníkov vo veku ≥ 80 rokov.
U účastníkov vo veku 18 až 49 rokov boli v skúšaní 1007 a v skúšaní B7471008 fázy 3 (skúšanie 1008
hodnotiace konzistentnosť šarží) najčastejšie hlásenými nežiaducimi reakciami bolesť v mieste podania injekcie (79,2 %), bolesť svalov (62,9 %), únava (46,7 %), bolesť hlavy (36,7 %) a bolesť kĺbov (16,2 %). U účastníkov vo veku 50 až 59 rokov boli v skúšaní 1007 najčastejšie hlásenými nežiaducimi reakciami bolesť v mieste podania injekcie (72,5 %), bolesť svalov (49,8 %), únava (39,3 %), bolesť hlavy (32,3 %) a bolesť kĺbov (15,4 %). U účastníkov vo veku ≥ 60 rokov boli
v skúšaní 1007 najčastejšie hlásenými nežiaducimi reakciami bolesť v mieste podania injekcie
(55,4 %), bolesť svalov (39,1 %), únava (30,2 %), bolesť hlavy (21,5 %) a bolesť kĺbov (12,6 %). Ich intenzita bola zvyčajne mierna alebo stredne závažná a odzneli do niekoľkých dní po očkovaní.
Skúšanie B7471006 fázy 3 (skúšanie 1006) hodnotilo Apexxnar u účastníkov vo veku ≥ 65 rokov
s rôznym stavom predchádzajúceho očkovania proti pneumokokom (predtým podaná očkovacia látka PPSV23, Prevenar 13 alebo Prevenar 13 nasledovaný PPSV23). V tomto skúšaní boli u účastníkov najčastejšie hlásené nežiaduce reakcie frekvenciou podobné tým, ktoré boli popísané u účastníkov
vo veku ≥ 60 v skúšaní 1007, s mierne vyššou bolesťou v mieste vpichu (61,2 %) u účastníkov
predtým očkovaných Prevenarom 13, a bolesťou kĺbov (16,8 %) u účastníkov predtým očkovaných
Prevenarom 13 nasledovaným očkovacou látkou PPSV23.
Tabuľkový zoznamnežiaducichreakcií
Tabuľkové zoznamy nežiaducich reakcií z klinických skúšaní fázy 3 a zo skúseností po uvedení
očkovacej látky na trh sú uvedené nižšie.
Nežiaduce reakcie z klinických skúšaní
Keďže Apexxnar obsahuje tých istých 13 sérotypovo-špecifických konjugátov kapsulárnych polysacharidov a rovnaké pomocné látky ako očkovacia látka Prevenar 13, nežiaduce reakcie, ktoré sa už identifikovali pre Prevenar 13 sa prevzali pre Apexxnar. V tabuľke 1 sú uvedené nežiaduce reakcie hlásené zo skúšaní s Apexxnarom fázy 3 podľa najvyššej frekvencie v rámci nežiaducich reakcií, lokálnych reakcií alebo systémových udalostí po očkovaní v ktorejkoľvek skupine s Apexxnarom.
V klinických skúšaniach bol bezpečnostný profil Apexxnaru podobný bezpečnostnému profilu
Prevenaru 13. V porovnaní s Prevenarom 13 sa neidentifikovali žiadne nové nežiaduce reakcie.
Nežiaduce reakcie sú uvedené podľa triedy orgánových systémov v poradí s klesajúcou frekvenciou
a závažnosťou. Frekvencia je definovaná nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé
(< 1/10 000), neznáme (z dostupných údajov).
Tabuľka 1. Nežiaduce reakcie na liek z klinických skúšaní ApexxnaruTrieda orgánových systémov
| Veľmi časté
| Časté
| Menej časté
| Neznáme
|
Poruchy imunitného systému
|
|
| Hypersenzitívna reakcia vrátane opuchu tváre, dyspnoe, bronchospazmu
|
|
Poruchy
metabolizmu a výživy
|
|
|
| Znížená chuť do jedlaa
|
Poruchy nervového
systému
| Bolesť hlavy
|
|
|
|
Poruchy
gastrointestinálneho traktu
|
|
| Hnačkaa
Nevoľnosť
Vracaniea
|
|
Poruchy kože
a podkožného tkaniva
|
|
| Vyrážkaa
Angioedém
|
|
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
| Bolesť kĺbov
Bolesť svalov
|
|
|
|
Celkové poruchy
a reakcie v mieste podania
| Bolesť/citlivosť
v mieste očkovania
Únava
| Stvrdnutie/opuch v mieste očkovaniaa
Erytém v mieste očkovaniaa Pyrexia
| Pruritus v mieste očkovania Lymfadenopatia
Urtikária v mieste očkovania
Triaškaa
| Obmedzená pohyblivosť ramenaa
|
a. Udalosť hlásená v klinických skúšaniach s Prevenarom 13 s frekvenciou veľmi časté (≥ 1/10). Znížená chuť do jedla
a obmedzená pohyblivosť ramena sa nehlásili u dospelých v skúšaniach fázy 3 s Apexxnarom, preto je frekvencia neznáma.
Nežiaduce reakcie zo skúseností po uvedení očkovacej látky na trhTabuľka 2 zahŕňa nežiaduce skúsenosti, ktoré boli spontánne hlásené počas používania Prevenaru 13
po jeho uvedení na trh, a ktoré sa môžu pozorovať aj pri Apexxnare. Skúsenosti s Prevenarom 13
po jeho uvedení na trh sú relevantné pre Apexxnar, pretože Apexxnar obsahuje všetky zložky
(polysacharidové konjugáty a pomocné látky) Prevenaru 13. Pretože tieto účinky boli dobrovoľne hlásené z populácie neurčitej veľkosti, nie je možné spoľahlivo odhadnúť ich frekvenciu alebo
pre všetky stanoviť kauzálny vzťah k expozícii očkovacej látke.
Tabuľka 2. Nežiaduce reakcie zo skúseností po uvedení Prevenaru 13 na trh
Trieda orgánových systémov
|
Frekvencia neznáme
|
Poruchy imunitného systému
|
Anafylaktická/anafylaktoidná reakcia vrátane šoku
|
Poruchy kože a podkožného tkaniva
|
Multiformný erytém
|
Celkové poruchy a reakcie v mieste podania
|
Dermatitída v mieste očkovania
|
Udalosti sa hlásili spontánne v rámci skúsenosti po uvedení Prevenaru 13 na trh. Preto sa ich frekvencia nedala odhadnúť z dostupných údajov a je považovaná za neznámu.
Ďalšie informácieoosobitnýchpopuláciáchvskúšaniachsPrevenarom13Účastníci vo veku ≥ 18 rokov s infekciou HIV mali podobné frekvencie nežiaducich reakcií ako
v tabuľke 1, okrem pyrexie (5 % až 18 %) a vracania (8 % až 12 %), ktoré boli veľmi časté, a nevoľnosti (< 1 % až 3 %), ktorá bola častá.
Účastníci vo veku ≥ 18 rokov s HSCT mali podobné frekvencie nežiaducich reakcií ako v tabuľke 1, okrem pyrexie (4 % až 15 %), vracania (6 % až 21 %) a hnačky (25 % až 36 %), ktoré boli veľmi časté.
Hlásenie podozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePredávkovanie Apexxnarom nie je pravdepodobné, vzhľadom k tomu, že je v naplnenej injekčnej striekačke.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: očkovacie látky, očkovacie látky proti pneumokokom; ATC kód: J07AL02
Mechanizmus účinkuApexxnar obsahuje 20 pneumokokových kapsulárnych polysacharidov, ktoré sú všetky konjugované
na proteínový nosič CRM197, ktorý modifikuje imunitnú odpoveď na polysacharid z odpovede nezávislej od T-buniek na odpoveď závislú od T-buniek. Odpoveď závislá od T-buniek vedie aj
k posilneniu protilátkovej odpovede, aj k tvorbe pamäťových B-buniek, čo umožňuje anamnestickú
(posilnenú) odpoveď pri opakovanej expozícii baktériám.
Očkovanie Apexxnarom navodzuje tvorbu sérových protilátok a imunologickú pamäť proti sérotypom, ktoré sú obsiahnuté v očkovacej látke. U dospelých neboli jasne stanovené hladiny cirkulujúcich protilátok, ktoré zodpovedajú ochrane pred pneumokokovým ochorením.
Klinická účinnosťNeuskutočnili sa žiadne štúdie účinnosti s Apexxnarom.
Údajeoimunogenite
K
linické skúšania s Appexnarom u dospelých
V Spojených štátoch amerických a vo Švédsku sa uskutočňovali tri klinické skúšania fázy 3, B7471006, B7471007 a B7471008 (skúšanie 1006, skúšanie 1007 a skúšanie 1008), v ktorých sa hodnotila imunogenita Apexxnaru v rôznych vekových skupinách dospelých a u účastníkov, ktorí buď predtým neboli očkovaní žiadnou pneumokokovou očkovacou látkou, alebo boli predtým očkovaní Prevenarom 13, PPSV23 alebo oboma týmito očkovacia látkami.
Každé skúšanie zahŕňalo účastníkov, ktorí boli zdraví alebo imunokompetentní so stabilnými primárnymi ochoreniami, vrátane chronického kardiovaskulárneho ochorenia, chronického pľúcneho ochorenia, porúch obličiek, diabetes mellitus, chronického ochorenia pečene a zdravotne rizikových stavov a správania (napr. fajčenie), o ktorých je známe, že zvyšujú riziko závažnej pneumokokovej pneumónie a invazívneho pneumokokového ochorenia (Invasive Pneumococcal Disease; IPD).
V pivotnom skúšaní (skúšanie 1007) sa tieto rizikové faktory identifikovali u 34 % účastníkov vo veku
60 rokov a starších, u 32 % účastníkov vo veku 50 až 59 rokov a u 26 % účastníkov vo veku 18 až
49 rokov. Stabilný zdravotný stav bol definovaný ako zdravotný stav, ktorý nevyžadoval významnú zmenu v liečbe počas predchádzajúcich 6 týždňov (tzn. prechod na novú kategóriu liečby v dôsledku zhoršenia ochorenia) alebo hospitalizáciu kvôli zhoršeniu ochorenia počas 12 týždňov pred podaním skúšanej očkovacie látky.
V každom klinickom skúšaní sa imunitné odpovede vyvolané Apexxnarom a kontrolnými pneumokokovými očkovacími látkami merali testom opsonofagocytóznej aktivity (OPA). OPA testy merajú funkčné protilátky proti S. pneumoniae.
Porovnanie imunitných odpovedí na Apexxnar, s odpoveďami na Prevenar 13 a PPSV23
V randomizovanom, aktívne kontrolovanom, dvojito zaslepenom, klinickom skúšaní non-inferiority
(pivotné skúšanie 1007) Apexxnaru v Spojených štátoch amerických a vo Švédsku sa účastníci
vo veku 18 rokov a starší, ktorí predtým neboli očkovaní pneumokokovou očkovacou látkou, zaradili do 1 z 3 kohort na základe ich veku pri zaradení (vek 18 až 49, 50 až 59 a ≥ 60 rokov) a randomizovali
sa do skupiny s Apexxnarom alebo do kontrolnej skupiny. Účastníci vo veku 60 rokov a starší sa randomizovali v pomere 1 : 1 a dostali Apexxnar (n = 1 507) s následným podaním fyziologického
roztoku ako placeba o 1 mesiac neskôr alebo Prevenar 13 (n = 1 490) a o 1 mesiac neskôr sa im podala očkovacia látka PPSV23. Účastníci vo veku 18 až 49 rokov a vo veku 50 až 59 rokov sa náhodne
(v pomere 3 : 1) zaradili do skupiny, ktorá dostala dávku Apexxnaru (vo veku 18 až 49 rokov:
n = 335; vo veku 50 až 59 rokov: n = 334), alebo do skupiny, ktorá dostala Prevenar 13 (vo veku 18 až
49 rokov: n = 112; vo veku 50 až 59 rokov: n = 111).
Pred prvým očkovaním a 1 mesiac po každom očkovaní sa merali sérotypovo-špecifické OPA geometrické priemery titrov (geometric mean titre; GMT). Non-inferiorita imunitných odpovedí, OPA GMT 1 mesiac po očkovaní, u Apexxnaru v porovnaní s kontrolnou očkovacou látkou bola pre sérotyp potvrdená, ak dolná hranica 2-stranného 95 % intervalu spoľahlivosti (IS) pre pomer GMT (Apexxnar/Prevenar 13; Apexxnar/PPSV23) bola pre daný sérotyp vyššia ako 0,5.
U účastníkov vo veku 60 rokov a starších boli 1 mesiac po očkovaní imunitné odpovede vyvolané Apexxnarom voči všetkým 13 spoločným sérotypom non-inferiórne k imunitným odpovediam vyvolaným Prevenarom 13 voči rovnakým sérotypom. Vo všeobecnosti sa pozorovali numericky nižšie geometrické priemery titrov pri Apexxnare u zodpovedajúcich sérotypoch v porovnaní
s Prevenarom 13 (tabuľka 3), avšak klinický význam týchto zistení nie je známy.
Imunitné odpovede vyvolané Apexxnarom na 6/7 ďalších sérotypov boli 1 mesiac po očkovaní non- inferiórne k imunitným odpovediam na rovnaké sérotypy vyvolaným prostredníctvom PPSV23. Odpoveď na sérotyp 8 nespĺňala vopred špecifikované štatistické kritériá non-inferiority (dolná
hranica 2-stranného 95 % IS pre pomer GMT je 0,49, a nie > 0,50) (tabuľka 3). Klinický význam tohto pozorovania nie je známy. Podporné analýzy pre iné koncové ukazovatele pre sérotyp 8 v skupine
s Apexxnarom vykazovali priaznivé výsledky. Tieto zahŕňali 22,1-násobné zvýšenie geometrického
priemeru (Geometric mean fold rise; GMFR) 1 mesiac po očkovaní oproti stavu pred očkovaním.
77,8 % účastníkov dosiahlo ≥ 4-násobné zvýšenie OPA titrov 1 mesiac po očkovaní oproti titrom pred očkovaním a 92,9 % účastníkov dosiahlo OPA titre ≥ LLOQ 1 mesiac po očkovaní.
Tabuľka 3. OPA GMT pre 13 zhodných sérotypov 1 mesiac po očkovaní u účastníkov vo veku
|
Apexxnar
(N = 1 157 – 1 430)
| Prevenar 13 (N = 1 390 –
1 419)
| PPSV23 (N = 1 201 –
1 319)
| Porovnanie očkovacích látok
|
|
GMTe
|
GMTe
|
GMTe
| Pomer GMTe
| 95 % ISe
| Sérotyp
|
| 1
| 123
| 154
|
| 0,80
| 0,71; 0,90
| 3
| 41
| 48
|
| 0,85
| 0,78; 0,93
| 4
| 509
| 627
|
| 0,81
| 0,71; 0,93
| 5
| 92
| 110
|
| 0,83
| 0,74; 0,94
| 6A
| 889
| 1 165
|
| 0,76
| 0,66; 0,88
| 6B
| 1 115
| 1 341
|
| 0,83
| 0,73; 0,95
| 7F
| 969
| 1 129
|
| 0,86
| 0,77; 0,96
| 9V
| 1 456
| 1 568
|
| 0,93
| 0,82; 1,05
| 14
| 747
| 747
|
| 1,00
| 0,89; 1,13
| 18C
| 1 253
| 1 482
|
| 0,85
| 0,74; 0,97
| 19A
| 518
| 645
|
| 0,80
| 0,71; 0,90
| 19F
| 266
| 333
|
| 0,80
| 0,70; 0,91
| 23F
| 277
| 335
|
| 0,83
| 0,70; 0,97
| Ďalšie sérotypy
|
| 8
| 466
|
| 848
| 0,55
| 0,49; 0,62
| 10A
| 2 008
|
| 1 080
| 1,86
| 1,63; 2,12
| 11A
| 4 427
|
| 2 535
| 1,75
| 1,52; 2,01
| 12F
| 2 539
|
| 1 717
| 1,48
| 1,27; 1,72
| 15B
| 2 398
|
| 769
| 3,12
| 2,62; 3,71
| 22F
| 3 666
|
| 1 846
| 1,99
| 1,70; 2,32
| 33F
| 5 126
|
| 3 721
| 1,38
| 1,21; 1,57
|
|
|
60 rokov a starších, ktorým sa podal Apexxnar, v porovnaní s tými, ktorým sa podal Prevenar 13, a pre 7 ďalších sérotypov u tých, ktorým sa podala PPSV23, (skúšanie 1007)a,b,c,dSkratky: IS = interval spoľahlivosti; GMT = geometrický priemer titrov; LLOQ = dolná hranica
kvantifikácie; N = počet účastníkov; OPA = opsonofagocytózna aktivita; PPSV23 = pneumokoková polysacharidová očkovacia látka (23-valentná).
a. Skúšanie 1007 sa uskutočňovalo v Spojených štátoch amerických a vo Švédsku.
b. Non-inferiorita pre určitý sérotyp bola splnená, ak dolná hranica 2-stranného 95 % IS pre pomer GMT (pomer Apexxnar/porovnávajúca očkovacia látka) bola vyššia ako 0,5 (kritérium 2-násobku pre non-
inferioritu).
c. Výsledky testu nižšie ako LLOQ boli v analýze nastavené na 0,5 × LLOQ. d. Populácia s hodnotiteľnou imunogenitou.
e. GMT a pomery GMT, ako aj súvisiace 2-stranné IS boli založené na analýze log-transformovaných titrov OPA použitím regresného modelu zohľadňujúceho skupinu s očkovacou látkou, pohlavie, fajčenie, vek pri očkovaní v rokoch a východiskové log-transformované titre OPA.
Imunogenita u účastníkov vo veku 18 až 59 rokovV skúšaní 1007 boli účastníci vo veku 50 až 59 rokov a účastníci vo veku 18 až 49 rokov náhodne zaradení (v pomere 3 : 1) do skupiny na jedno očkovanie Apexxnarom alebo do skupiny na jedno očkovanie Prevenarom 13. Sérotypovo-špecifické OPA GMT sa merali pred očkovaním a 1 mesiac po očkovaní. S oboma očkovacími látkami sa u mladších účastníkov v porovnaní so staršími účastníkmi pozorovali silnejšie imunitné odpovede. Pre každý sérotyp sa uskutočňovala analýza non- inferiority Apexxnaru v mladšej vekovej skupine v porovnaní s Apexxnarom u účastníkov vo veku
60 až 64 rokov, aby sa podporila indikácia u dospelých vo veku 18 až 49 rokov a 50 až 59 rokov. Non- inferiorita sa deklarovala, ak bola dolná hranica 2-stranného 95 % IS pre pomer GMT (Apexxnar
u účastníkov vo veku 18 až 49 rokov/vo veku 60 až 64 rokov a vo veku 50 až 59 rokov/vo veku 60 až
64 rokov) pre každý z 20 sérotypov > 0,5. Apexxnar vyvolával 1 mesiac po očkovaní v dvoch mladších vekových skupinách imunitné odpovede proti všetkým 20 sérotypom v očkovacej látke, ktoré boli non-inferiórne s odpoveďami u účastníkov vo veku 60 až 64 rokov (tabuľka 4).
Hoci sa neplánovala ako aktívna kontrola pre hodnotenie imunogenity v skúšaní, post hoc deskriptívna analýza preukázala vo všeobecnosti numericky nižší geometrický priemer titrov OPA 1 mesiac
po Apexxnare pre zodpovedajúce sérotypy v porovnaní s Prevenarom 13 u účastníkov vo veku
18 až 59 rokov. Avšak klinický význam týchto zistení nie je známy.
Ako bolo uvedené vyššie, do tohto skúšania boli zaradené osoby s rizikovými faktormi. Vo všetkých študovaných vekových skupinách sa vo všeobecnosti pozorovala numericky nižšia imunitná odpoveď u účastníkov s rizikovými faktormi v porovnaní s účastníkmi bez rizikových faktorov. Klinický význam tohto pozorovania nie je známy.
Tabuľka 4. Porovnanie OPA GMT 1 mesiac po Apexxnare u účastníkov vo veku 18 až49 rokov alebo vo veku 50 až 59 rokov s účastníkmi vo veku 60 až 64 rokov
|
18 – 49 rokov
(N = 251 – 317)
| 60 – 64 rokov
(N = 765 –
941)
| 18 – 49 rokov
V porovnaní s
60 – 64 rokov
|
50 – 59 rokov
(N = 266 – 320)
|
60 – 64 rokov
(N = 765 – 941)
| 50 – 59 rokov
V porovnaní s
60 – 64 rokov
|
GMTe
|
GMTe
| Pomer GMTe
(95 % IS)e
|
GMTe
|
GMTe
| Pomer GMTe
(95 % IS)e
| Sérotyp
|
1
|
163
|
132
| 1,23 (1,01; 1,50)
|
136
|
132
| 1,03 (0,84; 1,26)
|
3
|
42
|
42
| 1,00 (0,87; 1,16)
|
43
|
41
| 1,06 (0,92; 1,22)
|
4
|
1 967
|
594
| 3,31 (2,65; 4,13)
|
633
|
578
| 1,10 (0,87; 1,38)
|
5
|
108
|
97
| 1,11
(0,91; 1,36)
|
85
|
97
| 0,88
(0,72; 1,07)
|
6A
|
3 931
|
1 023
| 3,84
(3,06; 4,83)
|
1 204
|
997
| 1,21
(0,95; 1,53)
|
6B
|
4 260
|
1 250
| 3,41
(2,73; 4,26)
|
1 503
|
1 199
| 1,25
(1,00; 1,56)
|
7F
|
1 873
|
1 187
| 1,58
(1,30; 1,91)
|
1 047
|
1 173
| 0,89
(0,74; 1,07)
|
9V
|
6 041
|
1 727
| 3,50
(2,83; 4,33)
|
1 726
|
1 688
| 1,02
(0,83; 1,26)
|
14
|
1 848
|
773
| 2,39
(1,93; 2,96)
|
926
|
742
| 1,25
(1,01; 1,54)
|
18C
|
4 460
|
1 395
| 3,20
(2,53; 4,04)
|
1 805
|
1 355
| 1,33
(1,06; 1,68)
|
19A
|
1 415
|
611
| 2,31
(1,91; 2,81)
|
618
|
600
| 1,03
(0,85; 1,25)
|
19F
|
655
|
301
| 2,17
(1,76; 2,68)
|
287
|
290
| 0,99
(0,80; 1,22)
|
23F
|
1 559
|
325
| 4,80
(3,65; 6,32)
|
549
|
328
| 1,68
(1,27; 2,22)
| Ďalšie sérotypy
|
8
|
867
|
508
| 1,71 (1,38; 2,12)
|
487
|
502
| 0,97 (0,78; 1,20)
|
10A
|
4 157
|
2 570
| 1,62 (1,31; 2,00)
|
2 520
|
2 437
| 1,03 (0,84; 1,28)
|
11A
|
7 169
|
5 420
| 1,32 (1,04; 1,68)
|
6 417
|
5 249
| 1,22 (0,96; 1,56)
|
|
|
(štúdia 1007)a,b,c,d
Tabuľka 4. Porovnanie OPA GMT 1 mesiac po Apexxnare u účastníkov vo veku 18 až
49 rokov alebo vo veku 50 až 59 rokov s účastníkmi vo veku 60 až 64 rokov
(štúdia 1007)
a,b,c,d
|
18 – 49 rokov
(
N = 251 – 317)
|
60 – 64 rokov
(
N = 765 –
941)
|
18 – 49 rokov
V porovnaní s
60 – 64 rokov
|
50 – 59 rokov
(
N = 266 – 320)
|
60 – 64 rokov
(
N = 765 – 941)
|
50 – 59 rokov
V porovnaní s
60 – 64 rokov
|
GMT
e
|
GMT
e
|
Pomer GMT
e
(95 % IS)
e
|
GMT
e
|
GMT
e
|
Pomer GMT
e
(95 % IS)
e
|
12F
|
5 875
|
3 075
|
1,91
(1,51; 2,41)
|
3 445
|
3 105
|
1,11
(0,88; 1,39)
|
15B
|
4 601
|
3 019
|
1,52
(1,13; 2,05)
|
3 356
|
2 874
|
1,17
(0,88; 1,56)
|
22F
|
7 568
|
4 482
|
1,69
(1,30; 2,20)
|
3 808
|
4 228
|
0,90
(0,69; 1,17)
|
33F
|
7 977
|
5 693
|
1,40
(1,10; 1,79)
|
5 571
|
5 445
|
1,02
(0,81; 1,30)
|
Skratky: IS = interval spoľahlivosti; GMT = geometrický priemer titrov; LLOQ = dolná hranica kvantifikácie; N = počet účastníkov; OPA = opsonofagocytózna aktivita; PPSV23 = pneumokoková polysacharidová očkovacia látka (23-valentná). a. Skúšanie 1007 sa uskutočnilo v Spojených štátoch amerických a vo Švédsku.
b. Non-inferiorita pre určitý sérotyp bola splnená, ak dolná hranica 2-stranného 95 % IS pre pomer GMT (pomer mladšia veková skupina/veková skupina vo veku 60 až 64 rokov) bola vyššia ako 0,5 (2-násobok kritéria pre neinferioritu).
c. Výsledky testu nižšie ako LLOQ boli v analýze nastavené na 0,5 × LLOQ.
d. Populácia s hodnotiteľnou imunogenitou.
e. GMT, pomery GMT a súvisiace 2-stranné IS boli založené na analýze log-transformovaných titrov OPA použitím regresného modelu zohľadňujúceho vekovú skupinu, pohlavie, fajčenie a východiskové log-transformované titre OPA. Porovnania medzi účastníkmi vo veku 18 až 49 rokov a účastníkmi vo veku 60 až 64 rokov a medzi účastníkmi vo veku
50 až 59 rokov a účastníkmi vo veku 60 až 64 rokov boli založené na separátnych regresných modeloch.
Imunogenita Apexxnaru u dospelých, ktorí boli predtým očkovaní pneumokokovou očkovacou látkouV randomizovanom, otvorenom klinickom skúšaní fázy 3 (skúšanie 1006) boli popísané imunitné odpovede na Apexxnar u účastníkov vo veku 65 rokov a starších, ktorí boli predtým očkovaní PPSV23, Prevenarom 13 alebo Prevenarom 13 a následne PPSV23. Účastníci v tomto klinickom skúšaní, ktorí boli predtým očkovaní Prevenarom 13 (len Prevenarom 13 alebo Prevenarom 13
a následne PPSV23), boli zaradení na pracoviskách v Spojených štátoch amerických, zatiaľ
čo účastníci, ktorí boli predtým očkovaní len PPSV23, boli zaradení aj na švédskych pracoviskách
(35,5 % v tejto kategórii).
Apexxnar vyvolával imunitné odpovede proti všetkým 20 sérotypom v očkovacej látke u účastníkov vo veku 65 rokov a starších, ktorí boli predtým očkovaní pneumokokovou očkovacou látkou (tabuľka 5). V oboch skupinách boli imunitné odpovede nižšie u účastníkov, ktorí boli predtým očkovaní PPSV23.
Tabuľka 5. Pneumokokové OPA GMT pred očkovaním a 1 mesiac po Apexxnare u účastníkov vo veku 65 rokov a starších, ktorí boli predtým očkovaní pneumokokovou očkovacou látkou (skúšanie 1006)a,b,c,d
| Predchádzajúce očkovanie len
PPSV23
| Predchádzajúce očkovanie len Prevenarom 13
| Predchádzajúce očkovanie
Prevenarom 13 a PPSV23
|
Pred
očkovaním
(N = 208 –
247)
|
Po očkovaní
(N = 216 – 246)
| Pred
očkovaním
(N = 210 –
243)
|
Po očkovaní
(N = 201 – 243)
|
Pred očkovaním
(N = 106 – 121)
|
Po očkovaní
(N = 102 –
121)
|
GMT (95 % IS)e'
| GMT (95 % IS)e
| GMT (95 % IS)e
| GMT (95 % IS)e
| GMT (95 % IS)e
| GMT (95 % IS)e
|
Sérotyp
|
1
| 24 (20; 28)
| 51 (42; 62)
| 34 (28; 41)
| 115 (96; 138)
| 42 (32; 56)
| 82 (61; 110)
|
3
| 13 (11; 15)
| 31 (27; 36)
| 15 (13; 18)
| 54 (47; 63)
| 20 (17; 25)
| 39 (32; 48)
|
Tabuľka 5. Pneumokokové OPA GMT pred očkovaním a 1 mesiac po Apexxnare u účastníkov vo veku 65 rokov a starších, ktorí boli predtým očkovaní pneumokokovou očkovacou látkou (skúšanie 1006)
a,b,c,d
|
Predchádzajúce očkovanie len
PPSV23
|
Predchádzajúce očkovanie len Prevenarom 13
|
Predchádzajúce očkovanie
Prevenarom 13 a PPSV23
|
Pred
očkovaním
(
N = 208 –
247)
|
Po očkovaní
(
N = 216 – 246)
|
Pred
očkovaním
(
N = 210 –
243)
|
Po očkovaní
(
N = 201 – 243)
|
Pred očkovaním
(
N = 106 – 121)
|
Po očkovaní
(
N = 102 –
121)
|
GMT (95 % IS)
e
|
GMT (95 % IS)
e
|
GMT (95 % IS)
e
|
GMT (95 % IS)
e
|
GMT (95 % IS)
e
|
GMT (95 % IS)
e
|
4
|
29
(23; 35)
|
150
(118; 190)
|
67
(53; 84)
|
335
(274; 410)
|
73
(53; 101)
|
194
(143; 262)
|
5
|
27
(24; 31)
|
63
(53; 75)
|
38
(32; 44)
|
87
(73; 104)
|
47
(37; 59)
|
83
(65; 108)
|
6A
|
57
(46; 70)
|
749
(577; 972)
|
125
(99; 158)
|
1 081
(880; 1 327)
|
161
(116; 224)
|
1 085
(797; 1 478)
|
6B
|
107
(86; 133)
|
727
(574; 922)
|
174
(138; 219)
|
1 159
(951; 1 414)
|
259
(191; 352)
|
1 033
(755; 1 415)
|
7F
|
156
(132; 184)
|
378
(316; 452)
|
210
(175; 251)
|
555
(467; 661)
|
206
(164; 258)
|
346
(277; 432)
|
9V
|
203
(171; 241)
|
550
(454; 667)
|
339
(282; 408)
|
1 085
(893; 1 318)
|
352
(270; 459)
|
723
(558; 938)
|
14
|
212
(166; 270)
|
391
(315; 486)
|
282
(224; 356)
|
665
(554; 798)
|
336
(238; 473)
|
581
(434; 777)
|
18C
|
173
(137; 218)
|
552
(445; 684)
|
219
(177; 272)
|
846
(693; 1 033)
|
278
(209; 369)
|
621
(470; 821)
|
19A
|
82
(66; 100)
|
239
(197; 288)
|
124
(100; 153)
|
365
(303; 440)
|
182
(141; 235)
|
341
(264; 439)
|
19F
|
61
(52; 71)
|
159
(131; 192)
|
89
(74; 107)
|
242
(199; 294)
|
120
(94; 154)
|
218
(168; 282)
|
23F
|
23
(18; 28)
|
152
(115; 199)
|
48
(37; 62)
|
450
(358; 566)
|
66
(46; 94)
|
293
(204; 420)
|
Ďalšie sérotypy
|
8
|
55 (45; 67)
|
212 (172; 261)
|
28 (24; 33)
|
603 (483; 753)
|
139 (99; 195)
|
294 (220; 392)
|
10A
|
212 (166; 269)
|
1 012 (807; 1 270)
|
141 (113; 177)
|
2 005
(1 586; 2 536)
|
400 (281; 568)
|
1 580
(1 176; 2 124)
|
11A
|
510 (396; 656)
|
1 473
(1 192; 1 820)
|
269 (211; 343)
|
1 908
(1 541; 2 362)
|
550 (386; 785)
|
1 567
(1 141; 2 151)
|
12F
|
147 (112; 193)
|
1 054 (822; 1 353)
|
53 (43; 65)
|
1 763
(1 372; 2 267)
|
368 (236; 573)
|
1 401
(1 002; 1 960)
|
15B
|
140 (104; 189)
|
647 (491; 853)
|
74 (56; 98)
|
1 480
(1 093; 2 003)
|
190 (124; 291)
|
1 067 (721; 1 578)
|
22F
|
167 (122; 230)
|
1 773
(1 355; 2 320)
|
60 (45; 82)
|
4 157
(3 244; 5 326)
|
286 (180; 456)
|
2 718
(1 978; 3 733)
|
33F
|
1 129 (936; 1 362)
|
2 026
(1 684; 2 437)
|
606 (507; 723)
|
3 175
(2 579; 3 908)
|
1 353
(1 037; 1 765)
|
2 183
(1 639; 2 908)
|
Skratky: IS = interval spoľahlivosti; GMT = geometrický priemer titrov; LLOQ = dolná hranica kvantifikácie; N = počet účastníkov; OPA = opsonofagocytózna aktivita; PPSV23 = pneumokoková polysacharidová očkovacia látka (23-valentná). a. Skúšanie 1006 sa uskutočnilo v Spojených štátoch amerických a vo Švédsku.
b. Výsledky testu nižšie ako LLOQ boli v analýze nastavené na 0,5 × LLOQ.
c. Populácia s hodnotiteľnou imunogenitou. d. Nezaslepené podávanie Apexxnaru.
e. 2-stranné IS na základe Studentovej t-distribúcie.
Imunitnéodpovede vosobitnýchpopuláciách
Osoby s nižšie popísanými zdravotnými stavmi majú zvýšené riziko pneumokokového ochorenia. Neuskutočňovali sa žiadne štúdie s Apexxnarom u účastníkov s HIV a transplantáciou kostnej drene.
U dospelých s HIV infekciou a u dospelých po transplantácii kostnej drene sú obmedzené skúsenosti z klinických skúšaní s Prevenarom 13 (pneumokokovou konjugovanou očkovacou látkou zloženou
z 13 polysacharidových konjugátov, ktoré sú obsiahnuté aj v Apexxnare).
Účastníci, ktorí boli zdraví alebo mali stabilné neimunokompromitujúce chronické ochorenia, mali vo všetkých analyzovaných vekových skupinách nižšiu imunitnú odpoveď u Apexxnaru v porovnaní s Prevenarom 13 napriek tomu, že splnili vopred definovaný rozsah pre non-inferioritu. Klinický význam tohto pozorovania nie je známy.
Infekcia HIV
Dospelí, ktorí predtým neboli očkovaní pneumokokovou očkovacou látkou
V skúšaní 6115A1-3002 (B1851021), 152 účastníkov infikovaných HIV vo veku 18 rokov a starší
(CD4 ≥ 200 buniek/µl, vírusová záťaž < 50 000 kópií/ml a bez ochorení súvisiacich s aktívnym syndrómom získanej imunodeficiencie [AIDS]), ktorí predtým neboli očkovaní pneumokokovou
očkovacou látkou, bolo zaradených, aby dostali 3 dávky Prevenaru 13. V súlade so všeobecnými
odporúčaniami sa následne podala jedna dávka PPSV23. Očkovacie látky sa podávali v 1-mesačných intervaloch. Imunitné odpovede sa hodnotili u 131 až 137 hodnotiteľných účastníkov približne
1 mesiac po každej dávke očkovacie látky. Po prvej dávke Prevenar 13 vyvolával hladiny protilátok
merané prostredníctvom geometrického priemeru koncentrácií (geometric mean concentrations, GMC) imunoglobulínu G (IgG), a prostredníctvom OPA GMT, ktoré boli štatisticky signifikantne vyššie ako hladiny pred očkovaním. Po druhej a tretej dávke Prevenaru 13 boli imunitné odpovede podobné alebo vyššie ako imunitné odpovede po prvej dávke.
Dospelí, ktorí predtým boli očkovaní PPSV23
V klinickom skúšaní 6115A1-3017 (B1851028) sa hodnotili imunitné odpovede u 329 účastníkov infikovaných HIV vo veku 18 rokov a starších (počet CD4+ T-buniek ≥ 200 buniek/µl a vírusová
záťaž < 50 000 kópií/ml), ktorí boli predtým očkovaní PPSV23 najmenej 6 mesiacov pred zaradením.
Účastníci dostali 3 dávky Prevenaru 13: pri zaradení, 6 mesiacov a 12 mesiacov po prvej dávke Prevenaru 13. Po prvom očkovaní Prevenar 13 vyvolával hladiny protilátok merané prostredníctvom IgG GMC a prostredníctvom OPA GMT, ktoré boli štatisticky signifikantne vyššie ako hladiny
pred očkovaním. Po druhej a tretej dávke Prevenaru 13 boli imunitné odpovede porovnateľné alebo vyššie ako imunitné odpovede po prvej dávke. Účastníci, ktorí predtým dostali 2 alebo viac dávok
PPSV23, vykazovali podobné imunitné odpovede ako účastníci, ktorí predtým dostali jednu dávku.
Transplantácia hemopoetických kmeňových buniek (Hematopoietic stem cell transplant, HSCT)
Do klinického skúšania 6115A1-3003 (B1851022) bolo zaradených 190 účastníkov vo veku 18 rokov a starších s alogénnou HSCT, ktorí dostali 3 dávky Prevenaru 13 s odstupom medzi jednotlivými dávkami najmenej 1 mesiac. Prvá dávka sa podala 3 až 6 mesiacov po HSCT. Štvrtá (posilňovacia) dávka Prevenaru 13 sa podala 6 mesiacov po tretej dávke. V súlade so všeobecnými odporúčaniami sa jedna dávka PPSV23 podala 1 mesiac po štvrtej dávke Prevenaru 13. Imunitné odpovede, merané prostredníctvom IgG GMC, sa hodnotili u 130 až 159 hodnotiteľných účastníkov približne 1 mesiac
po očkovaní. Prevenar 13 vyvolával zvýšené hladiny protilátok po každej dávke. Imunitné odpovede po štvrtej dávke Prevenaru 13 boli signifikantne vyššie pre všetky sérotypy v porovnaní s imunitnými odpoveďami po tretej dávke.
Toto skúšanie preukázalo, že 4 dávky Prevenaru 13 vyvolávajú podobné sérové koncentrácie IgG ako jedna dávka u zdravých účastníkov v rovnakej vekovej skupine.
Pediatrickápopulácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Apexxnarom
v jednej alebo viacerých podskupinách pediatrickej populácie pre prevenciu ochorenia spôsobeného baktériou Streptococcus pneumoniae (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Neaplikovateľné.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých štúdií toxicity po opakovanom podávaní a reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Chlorid sodný Kyselina jantárová Polysorbát 80
Voda pre injekcie
Pre adjuvans, pozri časť 2.
6.2 Inkompatibility
Nevykonali sa žiadne štúdie kompatibility, preto sa táto očkovacia látka nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
24 mesiacov
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Naplnené injekčné striekačky sa majú uchovávať v chladničke vo vodorovnej polohe, aby sa minimalizoval čas resuspendovania.
Neuchovávajte v mrazničke. Ak bola očkovacia látka zmrazená, zlikvidujte ju.
Z mikrobiologického hľadiska sa má očkovacia látka použiť okamžite potom, ako sa vyberie z chladničky.
Z údajov o stabilite vyplýva, že očkovacia látka je stabilná 96 hodín, keď sa uchováva pri teplotách od 8 °C do 25 °C, alebo 72 hodín, keď sa uchováva pri teplotách od 0 °C do 2 °C. Po uplynutí týchto časových období sa Apexxnar musí použiť alebo zlikvidovať. Tieto údaje sú určené ako návod
pre zdravotníckych pracovníkov len pre prípad dočasnej teplotnej odchýlky.
6.5 Druh obalu a obsah balenia
0,5 ml suspenzie v naplnenej injekčnej striekačke (sklo typu I) s uzáverom na hrote (syntetická izoprén/brómbutylová zmesová guma) a piestovou zátkou (chlórbutylová guma).
Veľkosti balení po 1, 10 a multibalenie po 50 (5 x 10) naplnených injekčných striekačiek s ihlou alebo bez ihly.
Na trh nemusia byť uvedené všetky veľkosti balenia.
 6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Počas uchovávania sa v naplnenej injekčnej striekačke obsahujúcej suspenziu môže objaviť biely sediment a číry supernatant. Naplnené injekčné striekačky sa majú uchovávať vo vodorovnej polohe, aby sa minimalizoval čas resuspendovania.
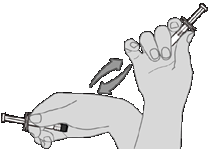
Príprava napodanie1. krok Resuspendovanie očkovacej látkyNaplnenú injekčnú striekačku držte vodorovne medzi palcom a ukazovákom a silne ju pretrepávajte, kým nie je obsah injekčnej striekačky vo forme homogénnej bielej suspenzie. Ak sa očkovacia látka nedá resuspendovať, nepoužívajte ju.
2. krok Vizuálna kontrolaPred podaním očkovaciu látku vizuálne skontrolujte, či neobsahuje veľké častice, a či sa nezmenila jej farba.

Ak spozorujete veľké častice alebo zmenu farby, očkovaciu
látku nepoužívajte. Ak očkovacia látka nie je vo forme homogénnej bielej suspenzie, opakujte 1. a 2. krok.
 3. krok Odstráňte uzáver injekčnej striekačky
3. krok Odstráňte uzáver injekčnej striekačkyOdstráňte uzáver injekčnej striekačky z adaptéra typu Luer lock tak, že budete držať adaptér typu Luer lock a zároveň pomaly otáčať uzáverom proti smeru hodinových ručičiek.
Poznámka: Pri odstraňovaní uzáveru injekčnej striekačky sa musí starostlivo dbať na to, aby nedošlo k stlačeniu vysunutého piestu.
4. krok Pripojte sterilnú ihluNa naplnenú injekčnú striekačku pripojte ihlu vhodnú na intramuskulárne podávanie tak, že budete držať adaptér typu Luer lock a zároveň budete ihlou otáčať v smere hodinových ručičiek.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIPfizer Europe MA EEIG Boulevard de la Plaine 17
1050 Bruxelles
Belgicko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
EU/1/21/1612/001
EU/1/21/1612/002
EU/1/21/1612/003
EU/1/21/1612/004
EU/1/21/1612/005
EU/1/21/1612/006
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: {DD. mesiac RRRR}
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.