
N alebo AST > 10 × ULN nie sú k dispozícii dostatočné údaje, ktoré by umožnili uviesť odporúčania na dávkovanie (pozri časti 4.4 a 5.2).
Porucha funkcie obličiek
Pacientov s miernou alebo stredne závažnou poruchou funkcie obličiek (rýchlosť glomerulárnej filtrácie (GFR) 89 − 60 ml/min alebo GFR 59 − 30 ml/min) možno liečiť liekom Apealea bez úpravy dávky. Paklitaxelom sa nemajú liečiť pacienti so závažnou poruchou funkcie obličiek (GFR < 30 ml/min) (pozri časť 5.2).
Starší pacienti
U pacientov vo veku 65 rokov a starších sa neodporúčajú žiadne ďalšie zníženia dávok, ktoré by boli odlišné od znížení uvedených pre všetkých pacientov.
Z 391 pacientok s rakovinou vaječníkov, ktoré v randomizovanej štúdii dostávali liek Apealea
v kombinácii s karboplatinou, bolo 13 % vo veku 65 až 74 rokov. Pri tomto obmedzenom počte pacientok sa pozorovala anorexia, únava, myalgia, artralgia, periférna senzorická neuropatia a hnačka
častejšie ako u pacientok mladších ako 65 rokov. Údaje, ktoré sú k dispozícii o použití u pacientok vo veku ≥ 75 rokov (2 % pacientok v štúdii), sú obmedzené.
-Pacienti inej ako bielej rasy
Údaje, ktoré sú k dispozícii o použití lieku Apealea u pacientov inej ako bielej rasy, sú obmedzené a súčasné údaje nie sú dostatočné na to, aby bolo možné odporučiť ďalšie úpravy dávky (pozri časť 4.4).
V prípade, že spozorujete neuropatiu, riaďte sa odporúčaniami na zníženie dávky uvedenými
v tabuľke 1.
Pediatrická populácia
Použitie paklitaxelu v indikáciách epiteliálneho karcinómu vaječníkov, primárneho peritoneálneho karcinómu a karcinómu Fallopiových kanálov nie je v pediatrickej populácii relevantné. Bezpečnosť a účinnosť lieku Apealea u detí a dospievajúcich vo veku 0 – 17 rokov neboli stanovené.
Spôsob podávania
Liek Apealea je určený na intravenózne použitie.
Po rekonštitúcii prášku vznikne číry zelenožltý infúzny roztok. Roztok sa má približne jednu hodinu podávať intravenóznou infúziou (120 – 140 kvapiek/min). Majú sa použiť infúzne súpravy obsahujúce
15 μm polyamidový filter tekutín. Pred podaním a po podaní je dôležité vypláchnuť infúznu súpravu a katéter/kanylu pomocou roztoku na rekonštitúciu, aby nedošlo k neúmyselnému podaniu do okolitého
tkaniva a zabezpečilo sa podanie celej dávky.
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1 (pozri časť 4.4).
Dojčenie (pozri časť 4.6).
Počiatočný počet neutrofilov< 1,5 × 109/l.
4.4 Osobitné upozornenia a opatrenia pri používaní
Hematológia
Paklitaxel spôsobuje myelosupresiu (predovšetkým neutropéniu). Neutropénia je toxicita závislá od
dávky a obmedzujúca dávku. Preto sa počas liečby liekom Apealea má často vykonávať kompletné vyšetrenie krvného obrazu. V hlavnej štúdii približne tretina pacientov dostávala faktor stimulujúci
kolónie granulocytov (GCSF) na liečbu neutropénie a klinickí lekári majú zvážiť, či by GCSF mohli byť v jednotlivých prípadoch prínosom. Pacienti sa nemajú liečiť nasledujúcimi cyklami, kým počet neutrofilov nedosiahne znovu hladinu ≥ 1,5 × 109/l a počet trombocytov ≥ 100 × 109/l. Pacienti s nízkym počtom neutrofilov majú byť informovaní o zvýšenom riziku výskytu infekcií. Riziko
myelosupresie sa zvýši v dôsledku kombinovanej liečby s karboplatinou. V prípade myelosupresie sa majú dodržiavať odporúčania ohľadne dávkovania lieku Apealea aj karboplatiny (pozri časť 4.2).
N
europatia
Periférna senzorická neuropatia a periférna neuropatia sú veľmi časté nežiaduce reakcie. Pri
senzorickej alebo motorickej neuropatii ≥ 2. stupňa podľa CTCAE prerušte liečbu do zotavenia na < 2. stupeň a potom znížte dávku pre všetky nasledujúce cykly liečby (pozri časť 4.2).
Porucha funkcie pečene
Podávanie lieku Apealea sa u pacientov s poruchou funkcie pečene neskúmalo, môžu však byť
vystavení zvýšenému riziku toxicity, najmä v dôsledku myelosupresie. Liek sa má u pacientov
s poruchou funkcie pečene definovanou ako celkový bilirubín> 1 až ≤ 5 × ULN a AST ≤ 10 × ULN (pozri časť 4.2) preto podávať opatrne a títo pacienti sa musia pozorne sledovať vzhľadom na zvýšenú poruchu funkcie pečene a myelosupresiu. Pacienti s celkovým bilirubínom> 5 × ULN alebo
AST >10 × ULN sa nemajú liečiť paklitaxelom.
Gastrointestinálne príznaky
Gastrointestinálne nežiaduce reakcie sú veľmi časté. Ak sa u pacientov po podaní lieku Apealea
vyskytne nevoľnosť, vracanie a hnačka, možno ich liečiť antiemetikami a/alebo antidiaroikami. Premedikáciu možno zvážiť u pacientov, ktorí mali pri predchádzajúcej liečbe cytotoxickými liekmi gastrointestinálne príznaky.
Reakcie súvisiace sinfúziou
Lokálne reakcie v mieste podania infúzie sú pri infúzii lieku Apealea veľmi časté. Pozorované reakcie
v mieste podania infúzie môžu zahŕňať bolesť, flebitídu, zmenu sfarbenia, sčervenanie, edém a vyrážku. Tieto reakcie sú častejšie pri prvej infúzii a možno ich zmierniť spomalením rýchlosti infúzie. U pacientov, u ktorých sa objaví silná bolesť alebo iné reakcie na infúziu lieku Apealea, sa odporúča zvážiť použitie centrálneho intravenózneho katétra. Počas intravenózneho podávania je potrebné zabrániť náhodnému podaniu do okolitého tkaniva. Ak sa objavia akékoľvek prejavy extravazálneho vpichu, okamžite vykonajte tieto opatrenia: ukončite infúziu, pred vytiahnutím ihly odsajte kvapalinu z katétra/kanyly, podajte do zasiahnutej oblasti sterilný fyziologický roztok alebo Ringerov laktátový alebo acetátový roztok a oblasť pozorne sledujte. Pred podaním a po podaní vypláchnite infúznu súpravu a katéter/kanylu, aby ste predišli náhodnému podaniu do okolitého tkaniva a aby ste zaistili intravenózne podanie celej dávky.
Precitlivenosť
Väčšina reakcií z precitlivenosti súvisiacich s liekom Apealea je mierna až stredne závažná a
vyskytuje sa hlavne vo forme poškodenia pokožky a podkožného tkaniva, celkových porúch a reakcií
v mieste podania, ale boli hlásené i závažné reakcie v dôsledku precitlivenosti vrátane anafylaktického šoku. Menej závažné príznaky, ako sčervenanie alebo kožné reakcie si nevyžadujú prerušenie liečby. Mierne závažné prípady si môžu vyžadovať premedikáciu kortikosteroidmi, antihistaminikami a/alebo antagonistami H2 v nasledujúcich liečebných cykloch. V prípade závažných reakcií, ako sú hypotenzia vyžadujúca liečbu, dyspnoe vyžadujúca bronchodilatanciá, angioedém alebo generalizovaná urtikária, je potrebné podávanie paklitaxelu okamžite prerušiť a začať symptomatickú liečbu. Pacientom, u ktorých sa vyskytnú závažné reakcie, sa paklitaxel nesmie znovu podávať. Pacienti majú byť počas liečby pozorne sledovaní, najmä tí pacienti, u ktorých sa predtým vyskytli reakcie z precitlivenosti na ktorúkoľvek formu taxánu.
Skutočný výskyt, závažnosť a čas do nástupu reakcií z precitlivenosti v dôsledku podávania lieku Apealea nebolo možné počas klinického vývoja stanoviť kvôli kombinovanej liečbe s karboplatinou. Počas infúzie karboplatiny alebo po nej nie je možné vylúčiť oneskorené reakcie súvisiace
s paklitaxelom.
A
l
opécia
Veľmi častou nežiaducou reakciou je alopécia a dochádza k nej v skorom štádiu liečby. Môže mať
výrazný vplyv na sebaposudzovanie a kvalitu života pacientov, pričom pacientov treba informovať o pravdepodobnosti výskytu tohto nežiaduceho účinku a o tom, aké opatrenia ho môžu zmierniť, napríklad používanie chladiacich čiapok (cold caps). V štúdiách s liekom Apealea hlásilo počas liečby alopéciu 45 % pacientov.
Kardiotoxicita
U niektorých pacientov, ktorí dostávali liek Apealea, sa pozorovalo zlyhanie srdca. V niektorých
prípadoch boli pacienti predtým vystavení kardiotoxickým liekom, ako je doxorubicín, alebo mali základné ochorenie srdca v anamnéze. Lekári majú týchto pacientov dôsledne sledovať
v súvislosti s výskytom srdcových príhod.
Pacienti vo veku65rokovastarší
V celkovej tolerancii medzi vekovou skupinou 65 – 74 a mladšími pacientmi nebol zaznamenaný
výrazný rozdiel. Údaje, ktoré sú k dispozícii o použití u pacientov vo veku ≥ 75 rokov, sú obmedzené. Vzhľadom na túto skutočnosť a potenciálnu krehkosť a komorbidity sa starší pacienti majú pozorne sledovať.
Rasa
Údaje, ktoré sú k dispozícii o použití lieku Apealea u pacientov inej ako bielej rasy, sú obmedzené.
Štúdie u pacientok s rakovinou prsníka liečených pomocou režimov obsahujúcich paklitaxel však naznačujú možné zvýšené riziko neuropatie u pacientok inej ako bielej rasy (pozri časť 4.2).
Pomocné látky
Po rekonštitúcii tento liek obsahuje približne 1,4 g sodíka na dávku (0,77 g/m2 BSA, 3,06 mg na ml),
čo zodpovedá 70 % maximálnej dennej dávky 2 g sodíka pre dospelú osobu, ktorú odporúča WHO.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne štúdie na vyhodnotenie liekových interakcií medzi liekom Apealea a inými liekmi.
Metabolizmus paklitaxelu je čiastočne katalyzovaný izoenzýmami cytochrómu P450 – CYP2C8 a CYP3A4 (pozri časť 5.2). Preto je pri súbežnom podávaní paklitaxelu s liekmi, o ktorých je známe, že inhibujú buď CYP2C8 alebo CYP3A4 (napr. ketokonazol a iné imidazolové antimykotiká,
erytromycín, fluoxetín, gemfibrozil, klopidogrel, cimetidín, ritonavir, sachinavir, indinavir a
nelfinavir) potrebné postupovať opatrne, lebo v dôsledku vyššej expozície paklitaxelu môže dôjsť
k zvýšeniu toxicity. Podávanie paklitaxelu súbežne s liekmi, o ktorých je známe, že indukujú buď CYP2C8 alebo CYP3A4 (napríklad rifampicín, karbamazepín, fenytoín, efavirenz, nevirapín), sa neodporúča, pretože účinok môže byť narušený v dôsledku nižšej expozície paklitaxelu.
Liek Apealea obsahuje ako pomocné látky zmes dvoch derivátov kyseliny retinovej. V štúdiách in vitro používajúcich ľudské mikrozómy sa preukázalo, že tieto deriváty pôsobia inhibične na CYP2B6, CYP2C8, CYP2C9 a v menšom rozsahu na CYP2D6. Keďže neexistujú štúdie in vivo zamerané na inhibíciu CYP2B6 a CYP2C9, súbežné používanie lieku Apealea a látok metabolizovaných primárne týmito enzýmami CYP sa má vykonávať opatrne.
Liek Apealea je indikovaný na použitie v kombinácii s karboplatinou (pozri časť 4.1). Liek Apealea sa má podávať ako prvý a potom sa podá karboplatina. Na základe údajov z literatúry sa žiadna klinicky významná farmakokinetická interakcia medzi paklitaxelom a karboplatinou neočakáva.
Klinicky významná farmakokinetická interakcia sa pozorovala medzi paklitaxelom a cisplatinou. Keď sa paklitaxel podáva pred cisplatinou, bezpečnostný profil paklitaxelu na báze rozpúšťadla je v súlade s bezpečnostným profilom, ktorý sa uvádza pri použití monoterapie. Keď sa paklitaxel na báze rozpúšťadla podal po cisplatine, pacientky vykazovali hlbšiu myelosupresiu a približne 20 % zníženie klírensu paklitaxelu. Podobný účinok možno očakávať u lieku Apealea (micelárnypaklitaxel). Pacientky s gynekologickými karcinómami môžu byť pri liečbe paklitaxelom a cisplatinou vystavené vyššiemu riziku zlyhania obličiek ako pri liečbe cisplatinou v monoterapii.
4.6 Fertilita, gravidita a laktácia
Ženy vofertilnomveku/antikoncepcia
Ženy vo fertilnom veku musia počas liečby a šesť mesiacov po jej skončení užívať účinnú
antikoncepciu.
Gravidita
Údaje o použití paklitaxelu u gravidných žien sú obmedzené. Existuje podozrenie, že paklitaxel
spôsobuje závažné vrodené chyby, ak sa podáva počas gravidity. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Paklitaxel sa nemá používať počas gravidity, pokiaľ si túto liečbu nevyžaduje klinický stav.
Dojčenie
Paklitaxel sa vylučuje do ľudského mlieka. Vzhľadom na potenciálne závažné nežiaduce reakcie u
dojčených detí je podávanie lieku Apealea počas laktácie kontraindikované. Dojčenie sa musí počas liečby prerušiť.
Fertilita
Štúdie na zvieratách liečených paklitaxelom preukázali zníženú fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek Apealea má mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Liek Apealea môže spôsobovať nežiaduce reakcie, ako sú únava (veľmi časté) a závrat (časté), ktoré môžu ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje. Pacientky treba poučiť, aby neriadili vozidlá ani neobsluhovali stroje, ak sa cítia unavené alebo pociťujú závrat.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie klinicky významné nežiaduce reakcie spojené s použitím lieku Apealea sú neutropénia,
gastrointestinálne poruchy, periférna neuropatia, artralgia/myalgia a reakcie v mieste podania infúzie. Nežiaduce reakcie sa vyskytli u približne 86 % pacientov.
Tabuľkový zoznamnežiaducichreakcií
Frekvencia nežiaducich účinkov uvedených v tabuľke 2 je definovaná podľa nasledujúcej konvencie:
veľmi časté (≥1/10), časté (≥1/100 až < 1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000
až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme (nemožno odhadnúť z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí podľa klesajúcej závažnosti.
V tabuľke 2 sú uvedené nežiaduce reakcie spojené s podávaním lieku Apealea v kombinácii s karboplatinou pozorované v klinickej štúdii (N = 391).
Tabuľka 2. Zoznam nežiaducich reakcií
T
rieda orgánových
systémov
F
r
ekvencia Preferovaný výraz
Infekcie a nákazy
M
enej časté: sepsa, absces, pneumónia, chrípka, vírusová infekcia dýchacích ciest, herpes simplex, celulitída v mieste infúzie, tonzilitída, infekcia močových ciest, infekcia kože, cystitída
B
enígne a malígne nádory vrátane nešpecifikovaných novotvarov (cysty
a polypy)
P
oruchy krvi a
l
ymfatického systému
P
oruchy imunitného systému
P
oruchy metabolizmu
a výživy
M
enej časté: metastatická bolesť
Veľmi časté: neutropéniaa
Časté: Febrilná neutropéniaa, leukopéniaa, trombocytopéniaa, granulocytopénia, anémiaa
Menej časté: Diseminovaná intravaskulárna koaguláciaa, pancytopénia, hematotoxicita, koagulopatia
Časté: precitlivenosť
Menej časté: anafylaktický šok, precitlivenosť na liek
Veľmi časté: anorexia
Menej časté: hyponatrémia, hypokalémia, hypomagnezémia, dehydratácia, znížená chuť do jedla
P
sychické poruchy
M
enej časté: depresia, nespavosť, úzkosť
P
oruchy nervového systému
V
eľmi časté: periférna senzorická neuropatiaa, periférna neuropatiaa
Časté: hypoestézia, závraty, parestézia, periférna motorická neuropatia, dysgeúzia, bolesť hlavy
Menej časté: epileptický stav, kóma, cerebrovaskulárna príhoda, periférna senzorimotorická neuropatia, letargia, hypotónia, neurotoxicita, polyneuropatia, polyneuropatia pri malígnych ochoreniach, pocit pálenia, somnolencia, kognitívna porucha, paréza tváre, encefalopatia, hydrocefália
P
oruchy oka
M
enej časté: rozmazané videnie, podráždenie oka, očný diskomfort, zvýšené slzenie
Poruchy ucha a labyrintu Menej časté: vertigo, hluchota, porucha vnútorného ucha, pískanie v ušiach
P
oruchy srdca a srdcovej činnosti
Č
asté: srdcová angína, tachykardia
Menej časté: zástava srdca, chronické zlyhanie srdca, cyanóza, atriálna fibrilácia, sínusová tachykardia, palpitácie, sínusová bradykardia
 P
oruchy ciev
Č
asté:
P
oruchy ciev
Č
asté: hypotenzia, sčervenanie, flebitída, bolesť žíl, hyperémia
 T
rieda orgánových systémov
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy pečene a žlčových
ciest
P
oruchy kože
a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
P
oruchy obličiek
a močových ciest
P
oruchy reprodukčného systému a prsníkov
F
r
ekvencia Preferovaný výraz
M
enej časté:
T
rieda orgánových systémov
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy pečene a žlčových
ciest
P
oruchy kože
a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
P
oruchy obličiek
a močových ciest
P
oruchy reprodukčného systému a prsníkov
F
r
ekvencia Preferovaný výraz
M
enej časté: obehový kolaps, venózna trombóza, vaskulitída, trombóza, hypertenzia, hlboká žilová trombóza, lymfedém, povrchová flebitída, tromboflebitída, kolísanie krvného tlaku, krvácanie, angiopatia, návaly tepla, bledosť
Časté: dyspnoe, nosová kongescia
Menej časté: zlyhanie dýchania, krvácanie z nosa, kašeľ, výtok z nosa, orofaryngálna bolesť, faryngálna porucha, asfyxia, bronchospazmus, dysfónia, alergická rinitída, alergický kašeľ, orofaryngálny diskomfort
Veľmi časté: hnačkaa, nevoľnosťa, vracaniea
Časté: bolesť brucha, zápcha, bolesť v hornej časti brucha, plynatosť, sucho v ústach, stomatitída
Menej časté: brušná distenzia, gastritída, abdominálny diskomfort, bolesť v spodnej časti brucha, dyspepsia, fekalóm, porucha funkcie čriev, krvácanie ďasien, hematochézia, orálna parestézia
Menej časté: hepatitída, porucha pečene
Veľmi časté: alopéciaa
Časté: erytém, vyrážka, pruritus, urtikária
Menej časté: angioedém, generalizovaná vyrážka, zmena sfarbenia kože, hyperhidróza, papulózna vyrážka, bulózna dermatitída, opuch tváre, porucha pigmentácie, suchá koža, studený pot, livedo reticularis (tzv. mramorová koža), porucha nechtov, alergický pruritus, porucha kože
Veľmi časté: artralgiaa, myalgiaa
Časté: bolesť chrbta, bolesť kostí, muskuloskeletálna bolesť, svalová slabosť, bolesť v končatine
Menej časté: hemartróza, muskuloskeletálne ťažkosti, pocit ťažoby
Menej časté: azotémia
Menej časté: vaginálne krvácanie, panvová bolesť, bolesť prsníkov
T
rieda orgánových systémov
C
elkové poruchy a reakcie v mieste podania
L
aboratórne a funkčné vyšetrenia
F
r
ekvencia Preferovaný výraz
V
eľmi časté: asténiaa, únavaa, reakcie v mieste podania infúziea,b
Časté: periférny edém, bolesť, pyrexia, hrudný diskomfort, hypertermia, edém tváre
Menej časté: smrť, zlyhanie viacerých orgánov, edém, bolesť v mieste podania, krvácanie v mieste zavedenia katétra, edém v mieste zavedenia katétra, lokálny opuch, generalizovaný edém, hernia, bolesť na hrudníku, ochorenie podobné chrípke, lokalizovaný edém, hypotermia, triaška, pocit horúčavy
Menej časté: zvýšená hladina aminotransferázy

a Pozri opis vybraných nežiaducich reakcií.
b Zhŕňa nasledujúce preferované výrazy: bolesť v mieste podania infúzie, flebitída v mieste podania infúzie, reakcia v mieste podania infúzie, zmena sfarbenia miesta podania infúzie, erytém v mieste podania infúzie, extravazácia v mieste podania infúzie, zápal v mieste podania infúzie, edém v mieste
podania infúzie, parestézia v mieste podania infúzie, podráždenie v mieste podania infúzie a vyrážka v mieste podania infúzie.
Opis vybraných nežiaducichreakciíV pivotnej klinickej štúdii boli pacienti liečení buď liekom Apealea (micelárny paklitaxel) v dávke
250 mg/m2 v kombinácii s karboplatinou alebo paklitaxelom na báze rozpúšťadla v dávke 175 mg/22
v kombinácii s karboplatinou (N = 391 v každej skupine). Celkovo bola miera závažných nežiaducich udalostí pri použití micelárneho paklitaxelu vyššia (41 %) ako pri použití paklitaxelu na báze rozpúšťadla (27 %). V oboch skupinách väčšinu závažných nežiaducich udalostí predstavovala hematologická toxicita. Medzi dvomi študijnými skupinami sa v žiadnom momente počas liečby ani po liečbe nezistili rozdiely v skóre výkonnosti ECOG (Eastern Cooperative Oncology Group) (hlavne skóre 0 alebo 1).
PoruchykrvialymfatickéhosystémuTakmer u všetkých pacientov liečených liekom Apealea sa vyskytol nejaký stupeň neutropénie, u
79 % pacientov sa zaznamenal 3. alebo 4. stupeň. Neutropénia sa ako závažná nežiaduca reakcia vyskytla u 29 % pacientov a febrilná neutropénia u 3 % pacientov. Pred ďalším liečebným cyklom neutropénia sa znížila na hodnotu ≥ 1,5 × 109/l. U takmer všetkých pacientov sa počas liečby zaznamenala anémia, znížený počet trombocytov a bielych krviniek akéhokoľvek stupňa (98 %, 93 % a 98 %). Anémia ako závažná nežiaduca udalosť sa vyskytla u 5 % pacientov, trombocytopénia a leukopénia u 3 %, resp. 6 % pacientov.
V skupine, v ktorej sa podával micelárny paklitaxel, viac pacientov zaznamenalo hematologické toxicity 3. a 4. stupňa ako v skupine pacientov, ktorí dostávali paklitaxel na báze rozpúšťadla. Neutropénia sa vyskytla u 79 % a 66 %, leukopénia u 53 % a 34 %, trombocytopénia u 18 % a 10 % a anémia u 24 % a 14 % pacientov v liečebných skupinách, v ktorých dostávali micelárny paklitaxel, resp. paklitaxel na báze rozpúšťadla.
Bola hlásená diseminovaná intravaskulárna koagulácia (DIC), často spojená so sepsou alebo zlyhaním viacerých orgánov.
PoruchygastrointestinálnehotraktuNajčastejšie hlásené nežiaduce reakcie v štúdii boli nevoľnosť (38 %), vracanie (22 %) a hnačka
(15 %).
P
oruchy
nervového
systému
Periférne neuropatie (vrátane preferovaných výrazov periférna neuropatia, periférna motorická neuropatia, periférna senzomotorická neuropatia, periférna senzorická neuropatia, polyneuropatia a polyneuropatia pri malígnych ochoreniach) boli hlásené u 29 % pacientov a boli väčšinou
(98 %) mierne až stredne závažné (stupeň ≤ 2 podľa CTCAE ). Priemerný čas do nástupu bol 53 dní od prvej dávky. Periférna senzorická neuropatia bola najčastejšou reakciou a bola hlásená u 16 %
pacientov. Ďalšie súvisiace reakcie boli hlásené u 10 % pacientov a boli väčšinou (98 %) mierne až
stredne závažné (stupeň ≤ 2 podľa CTCAE). Najčastejšie boli parestézia a hypoestézia. V priebehu hlavnej štúdie odznelo 46 % periférnych neuropatií, ako aj väčšina (78 %) súvisiacich reakcií.
Závislosť frekvencie od dávky a závažnosť neurotoxicity sa u lieku Apealea neskúmala, ale v iných
indikáciách sa pozorovala pri iných formách paklitaxelu.
Reakciezprecitlivenosti
Väčšina reakcií z precitlivenosti súvisiacich s liekom Apealea bola mierna až stredne závažná (pozri časť 4.4). Frekvencia reakcií z precitlivenosti súvisiacich s paklitaxelom bola v obidvoch skupinách podobná (5 % pacientov dostávajúcich micelárny paklitaxel a 7 % pacientov dostávajúcich paklitaxel na báze rozpúšťadla), zatiaľ čo v skupine, ktorá dostávala micelárny paklitaxel, bola pozorovaná
vyššia frekvencia hypersenzitívnych reakcií súvisiacich s karboplatinou (12 % oproti 7 %). V dôsledku kombinovanej liečby nie je možné určiť, či toto pozorovanie je spôsobené liekom Apealea alebo inými
faktormi, pričom nie je možné vylúčiť oneskorené reakcie súvisiace s paklitaxelom.
Poruchykožeapodkožnéhotkaniva
Alopécia sa pozorovala u 45 % pacientov a jej nástup bol náhly. U väčšiny pacientov, u ktorých sa objaví alopécia, sa očakáva výrazné vypadávanie vlasov ≥ 50 %.
Poruchykostrovejasvalovejsústavyaspojivovéhotkaniva
U 19 % pacientov sa vyskytla artralgia a u 10 % pacientov myalgia.
Celkovéporuchyareakcievmiestepodania
Asténia a únava boli veľmi časté a vyskytli sa u 23 %, resp. 11 % pacientov. U 12 % pacientov sa
v mieste podania infúzie pozorovali veľmi časté reakcie, ako sú bolesť, flebitída a erytém (pozri časť
4.4).
V skupine, ktorá dostávala micelárny paklitaxel, boli hlásené bolesti v mieste podania infúzie vo väčšom počte prípadov ako v skupine liečenej paklitaxelom na báze rozpúšťadla (8 %, resp. 1 %).
Ďalšie skúsenosti z klinických štúdií
Liek Apealea bol v rôznych indikáciách podávaný ako monoterapia u celkovo 132 pacientov v
dávkach v rozmedzí od 90 mg/m2 v 3-týždňovom režime až po týždenné dávky 250 mg/m2. Na základe kombinovaných údajov zo štúdií s monoterapiou medzi veľmi časté nežiaduce reakcie
a nežiaduce reakcie s osobitným významom boli: neutropénia (45 %), únava (37 %), leukopénia
(33 %), alopécia (30 %), nevoľnosť (27 % ), reakcia v mieste podania infúziea (23 %), periférna senzorická neuropatia (20 %), hnačka (17 %), asténia (15 %), pyrexia (12 %), zápcha (12 %), artralgia (12 %), parestézia (11 %), bolesť (11 %), vracanie (9 %), myalgia, (9 %), periférna motorická
neuropatia (5 %), neuropatia (5 %) periférna neuropatia (5 %), trombocytopénia (4 %), febrilná neutropénia (2 %), sepsa (2 %), tachykardia (2 %), flebitída (2 %), trombóza (2 %).
a Zahŕňa nasledujúce preferované výrazy: flebitída v mieste podania infúzie, bolesť v mieste podania infúzie, reakcia v mieste podania injekcie, zápal v mieste podania injekcie, erytém v mieste podania infúzie, extravazácia v mieste podania injekcie, reakcia v mieste podania infúzie, edém v mieste podania injekcie.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieNa predávkovanie paklitaxelom nie je známe žiadne antidotum. V prípade predávkovania treba pacienta pozorne sledovať. Liečba sa má zamerať na hlavné očakávané toxicity, ktoré sú nevoľnosť, vracanie, hnačka, myelosupresia, periférna senzorická neuropatia a periférna neuropatia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Cytostatiká, taxány, ATC kód: L01CD01
Mechanizmus účinkuPaklitaxel je antimikrotubulárna látka, ktorá podporuje tvorbu mikrotubúl z tubulínových dimérov a
stabilizuje mikrotubuly tým, že zabraňuje depolymerizácii. Stabilizácia vedie k inhibícii štandardnej dynamickej reorganizácie siete mikrotubúl, ktorá je nevyhnutná pre životne dôležité interfázové
a mitotické bunkové funkcie. Okrem toho paklitaxel v priebehu bunkového cyklu vyvoláva tvorbu
mikrotubulových zväzkov a počas mitózy indukuje tvorbu mikrotubulových hviezdic.
Klinická účinnosť abezpečnosťBezpečnosť a účinnosť lieku Apealea bola v kombinácii s karboplatinou hodnotená v otvorenej,
randomizovanej, multicentrickej štúdii u 782 žien s rekurentným epiteliálnym karcinómom vaječníkov, primárnym peritoneálnym karcinómom a karcinómom Fallopiových kanálov. Pacientky boli liečené každé tri týždne počas šiestich cyklov buď liekom Apealea (micelárnym paklitaxelom)
250 mg/m2 podávaným počas jednej hodiny intravenóznou infúziou (N = 391) alebo paklitaxelom na báze rozpúšťadla 175 mg/m2 podávaným vo forme 3-hodinovej infúzie (N = 391). V obidvoch
liečebných skupinách bola 30 minút po infúzii paklitaxelu podaná karboplatina.
Percento pacientok liečených pri prvom alebo druhom relapse bolo v obidvoch liečebných skupinách rovnaké (76 % bolo liečených pri prvom relapse a 24 % pri druhom relapse). Pacientky, u ktorých sa predtým vyskytla neuropatia ≥ 2. stupňa alebo vážne zdravotné rizikové faktory zahŕňajúce niektorý
z hlavných orgánových systémov, sa štúdie nemohli zúčastniť. V obidvoch liečebných skupinách bol priemerný vek 56 rokov (rozsah 26 – 81). Väčšina pacientok zaradených do štúdie mala stav výkonnosti podľa ECOG rovný 0 alebo 1 (≥ 96 %), pričom v obidvoch liečebných skupinách išlo
o podobný pomer. Len niekoľko pacientok malo stav výkonnosti podľa ECOG rovný 2.
Podiel pacientok, ktoré v klinickej štúdii absolvovali šesť liečebných cyklov, bol v skupine liečenej micelárnym paklitaxelom 81 % a v skupine liečenej paklitaxelom na báze rozpúšťadla 87 %. Zodpovedajúci medián počtu cyklov (min., max.) pre obe skupiny bol 6 (1, 12), resp. 6 (1, 9).
Pacienti pred infúziou paklitaxelu na báze rozpúšťadla, micelárneho paklitaxelu a karboplatiny dostali premedikáciu, ako je to zhrnuté ďalej v tabuľke 3. Pred infúziou micelárneho paklitaxelu nebola nariadená premedikácia.
T
abuľka 3. Podiel pacientok, ktoré dostali premedikáciu pred infúziou paklitaxelu alebo karboplatiny alebo vo všeobecnosti (bezpečnostná populácia)
T
yp premedikácie
Vo všeobecn osti
Apealea
(N = 391)
Paklitaxel Karboplatina
Paklitaxel (na báze rozpúšťadla)
(N = 391)
Vo
všeobecnosti Paklitaxel Karboplatina
Kortikosteroidy 43% 6% 39% 99% 97% 15% Antihistaminiká 19% 4% 16% 85% 85% 9% Antagonisty H2 5% 2% 2% 90% 90% 1%
Antiemetiká a
lieky proti
nevoľnosti
87% 8% 81% 92% 38% 63%

V rámci štúdie 35 % pacientok liečených micelárnym paklitaxelom, resp. 30 % pacientok liečených
paklitaxelom na báze rozpúšťadla dostalo GCSF na liečbu neutropénie. Medián počtu cyklov liečby s paklitaxelom/karboplatinou u pacientov dostávajúcich GCSF bol 6 v obidvoch skupinách. Medián počtu cyklov liečby pri podaní GCSF bol 3 (1;6) a priemerná hodnota dosahovala 3,1 v obidvoch skupinách.
Hlavnými parametrami účinnosti boli prežívanie bez progresie (PFS) a celkové prežívanie (OS). PFS bolo hodnotené zaslepeným posúdením snímok počítačovej tomografie pomocou RECIST 1.0 (Kritériá hodnotenia odpovede solídnych tumorov). Medzi dvomi liečebnými skupinami sa nezistil žiadny štatisticky významný rozdiel v PFS ani v celkovom prežívaní. V populácii podľa protokolu bola vykonaná analýza neinferiority pre PFS s vopred stanovenou hranicou neinferiority. Kritérium neinferiority bolo splnené pre PFS s hornou hranicou jednostranného 97,5 % intervalu spoľahlivosti (IS) pre súvisiace pomery rizík menšie ako 1,2. Kritérium neinferiority bolo splnené pre celkové
prežívanie, pričom horná hranica jednostranného 97,5 % IS pre súvisiace miery rizika bola menšia ako
1,185 v populácii podľa protokolu (tabuľka 4, obrázky 1 a 2). V populácii so zámerom liečby
(intention-to-treat, ITT) bol pomer rizík pre PFS a OS hodnotu 0,85 (95 % IS: 0,72; 1,00) , resp. 1,02 (95 % IS: 0,85; 1,22). Tým sa aj v populácii so zámerom liečby stanovila neinferiorita pre PFS, nie
však pre celkové prežívanie. V čase analýzy údajov o celkovom prežívaní sa smrť vyskytla u 56 %
pacientov v skupine liečenej micelárnym paklitaxelom v porovnaní so 60 % v skupine liečenej
paklitaxelom na báze rozpúšťadla (populácia ITT).
T
abuľka 4. Účinnosť pri rekurentnom epiteliálnom karcinóme vaječníkov, primárnom peritoneálnom karcinóme a karcinóme Fallopiových kanálov v kombinácii s karboplatinou (populácia podľa protokolu)
'
P
režitie bez progresie
Medián času do smrti alebo progresie
Apealea
(N = 311)
Paklitaxel (na báze
rozpúšťadla)
(N = 333)
ochorenia [mesiace] (95 % IS) 10,3 (10,1; 10,7) 10,1 (9,9; 10,2)
Log-rank hodnota p 0,0919
Pomer rizika (95 % IS) 0,86 (0,72; 1,03)
p-hodnota 0,0938
Celkové prežívanieMedián času do smrti [mesiace]
(95 % IS) 25,7 (22,9; 28,1) 24,8 (21,7; 27,1)
Log-rank hodnota p 0,6196
Pomer rizika (95 % IS) 0,95 (0,78; 1,16)
p-hodnota 0,6202
 Obrázok 1. Kaplan-Meierova krivka prežitia bez progresie (populácia podľa protokolu)
Obrázok 1. Kaplan-Meierova krivka prežitia bez progresie (populácia podľa protokolu)Pacienti Udalosti
Apealea: 311 239
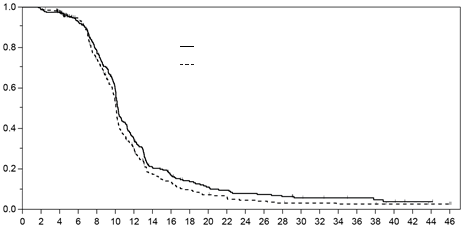
paklitaxel na báze
rozpúšťadla: 333 270
Mesiace

Apealea:
paklitaxel na báze rozpúšťadla:


Počet v ohrození
 O
brázok 2. Kaplan-Meierova krivka celkového prežívania (populácia podľa protokolu)
O
brázok 2. Kaplan-Meierova krivka celkového prežívania (populácia podľa protokolu)
Pacienti Udalosti
Apealea: 311 179
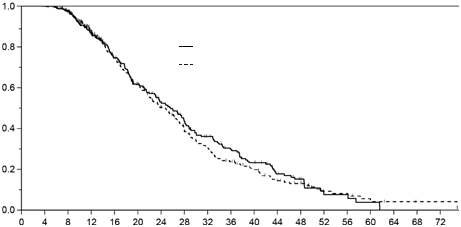
paklitaxel na báze
rozpúšťadla: 333 206
Mesiace
Apealea:
paklitaxel na báze rozpúšťadla:

Počet v ohrození
Údaje o bezpečnosti, ktoré porovnávajú výsledky kombinovanej liečby liekom Apealea
(micelárnypaklitaxel)/karboplatinou a paklitaxelom/karboplatinou na báze rozpúšťadla, pozri časť 4.8.
Pediatrická populácia
Európska agentúra pre lieky upustila od povinnosti predkladať výsledky štúdií s liekom Apealea vo
všetkých podskupinách pediatrickej populácie pri liečbe rakoviny vaječníkov (okrem rabdomyosarkómu a nádorov zárodočných buniek), peritoneálneho karcinómu (okrem blastómov a sarkómov) a karcinómu Fallopiových kanálov (okrem rabdomyosarkómu a nádorov zárodočných buniek) (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Keď sa liek Apealea (micelárny paklitaxel) podáva intravenózne, jeho farmakokinetický profil naznačuje, že táto forma okamžite uvoľňuje paklitaxel do krvi. Farmakokinetika paklitaxelu sa skúmala u 22 pacientok so solídnymi nádormi po jednu hodinu trvajúcej infúzii lieku Apealea (úrovne dávky 90 až 275 mg/m2). Okrem toho sa v skríženej štúdii porovnávali celkové a neviazané koncentrácie paklitaxelu v plazme po 1-hodinovej infúzii lieku Apealea 260 mg/m2 s hodnotami po 1- hodinovej infúzii paklitaxelu viazaného na albumín pri rovnakej dávke. Celkové plazmatické hladiny paklitaxelu boli po infúzii oboch foriem podobné. Preukázalo sa, že plazmatické hladiny neviazaného paklitaxelu, t. j. koncentrácie, ktoré predstavujú farmakologicky aktívny paklitaxel v tele, boli po podaní paklitaxelu viazaného na albumín a lieku Apealea bioekvivalentné (Cmax a AUC). Na základe obmedzených údajov sa Cmax a AUC zvýšili po 1-hodinových infúziách lieku Apealea v dávkach
v rozmedzí od 90 do 275 mg/m2. Keďže sa pozorovala veľká individuálna variabilita, linearitu dávky
nebolo možné stanoviť.
Distribúcia
Paklitaxel sa distribuuje rovnomerne medzi plazmou a krvou, ako je opísané v publikovaných údajoch
in vitro. Priemerná neviazaná frakcia paklitaxelu (fu) v čase po infúzii lieku Apealea kolísala
v rozmedzí 5,2 % až 4,3 %. To bolo v súlade s priemernou fu po infúzii paklitaxelu viazaného na albumín, ktorá v priebehu času kolísala v rozmedzí 5,5 % až 4,5 %.
Bola hlásená väzba paklitaxelu na albumín aj α1-kyselinový glykoproteín, ale môžu byť dôležité iné viažuce sa proteíny, napríklad lipoproteíny. Nie sú k dispozícii žiadne hlásenia o liečivách, ktoré by boli schopné vytlačiť paklitaxel viazaný na proteíny, ani nie je pravdepodobné, že paklitaxel bol
schopný vytlačiť iné liečivá vzhľadom na jeho nízke molárne koncentrácie v plazme. Na základe publikovanej literatúry štúdie in vitro naznačujú, že prítomnosť cimetidínu, ranitidínu, dexametazónu alebo difenhydramínu neovplyvňujú väzbu paklitaxelu na proteíny. V podmienkachin vitro sa preukázalo, že paklitaxel je substrátom influxných transportných proteínov OATP1B3 a OATP1A2.
Počas infúzie a po infúzii lieku Apealea paklitaxel rýchlo opúšťa plazmatický kompartment
s distribučným polčasom eliminácie približne 0,6 hodiny. Distribučná fáza sa teda v podstate končí
2 hodiny po ukončení infúzie. Distribúcia v tkanive je rozsiahla, s distribučným objemom vo fáze konečnej eliminácie približne 155 l/m2, čo zodpovedá približne 280 l pre priemerného pacienta
s plochou povrchu tela 1,8 m2. Počas fázy eliminácie sa teda len 1 % paklitaxelu prítomného v tele
nachádza v plazme.
Biotransformácia a eliminácia
Konečný polčas paklitaxelu po infúzii lieku Apealea sa medzi subjektmi líšil približne 5-násobne, a to
v rozsahu 5 – 23 hodín. Podobne celkový plazmový klírens kolísal 5-násobne, od 8 do 41 l/hod. Predpokladá sa, že vysoká interindividuálna variabilita klírensu je dôsledkom variability aktivity pečeňových enzýmov.
Biotransformácia a eliminácia paklitaxelu boli uvedené v publikovaných štúdiách. Paklitaxel sa prevažne eliminuje pečeňovým metabolizmom a vylučovaním žlčou. Hlavným metabolitom paklitaxelu je 6-hydroxypaklitaxel. Ďalšími metabolitmi sú 3’-p-hydroxypaklitaxel
a 6α,3’-p-dihydroxypaklitaxel. Tvorba týchto metabolitov je katalyzovaná pomocou CYP2C8 a CYP3A4. Nezistil sa žiadny farmakologicky aktívny metabolit. V štúdiách in vitro a in vivo sa preukázalo, že paklitaxel je substrátom efluxného proteínu P-glykoproteínu. Hlavnou cestou vylučovania látok pochádzajúcich z paklitaxelu u ľudí je stolica, kde hlavnú látku tvorí 6-- hydroxypaklitaxel. Vylučovanie obličkami tvorí menšiu časť, menej ako 15 % dávky.
Špeciálne populácie
Poruchafunkciepečene
Nevykonali sa žiadne klinické štúdie u pacientok s poruchou funkcie pečene, ktoré dostávali liek
Apealea (pozri časti 4.2 a 4.4). Štúdia populačnej farmakokinetiky s paklitaxelom viazaným na albumín preukázala, že pacientky s miernou poruchou funkcie pečene (celkový bilirubín> 1 až ≤ 1,5 ×
ULN) majú rýchlosť eliminácie v štandardnom rozsahu. Naproti tomu pacientky so stredne závažnou
poruchou funkcie pečene (celkový bilirubín> 1,5 až ≤ 3 × ULN) a závažnou poruchou funkcie pečene (celkový bilirubín> 3 až ≤ 5 × ULN) mali 22 %, resp. 26 % zníženie rýchlosti eliminácie paklitaxelu. V porovnaní s pacientkami s normálnou funkciou pečene mali pacientky s poruchou funkcie pečene
s celkovým bilirubínom> 1,5 × ULN zvýšené stredné AUC paklitaxelu približne o 20 %. Porucha
funkcie pečene nemá žiadny vplyv na priemernú hodnotu Cmaxpaklitaxelu. Farmakokinetické údaje pre pacientky s celkovým bilirubínom> 5 × ULN nie sú k dispozícii.
Poruchafunkcieobličiek
Nevykonali sa žiadne klinické štúdie u pacientok s poruchou funkcie obličiek, ktoré dostávali liek
Apealea (pozri časť 4.2). Keďže renálna eliminácia je pre paklitaxel menej významnou cestou, u tejto
skupiny pacientok sa neočakávajú zvýšené plazmatické hladiny. V štúdii populačnej farmakokinetiky s paklitaxelom viazaným na albumín sa preukázalo, že pacientky s mierne závažnou a stredne závažnou poruchou funkcie obličiek (klírenskreatinínu ≥ 30 až < 90 ml/min) majú rýchlosť eliminácie podobnú ako pacientky s normálnou funkciou obličiek. U pacientok so závažnou poruchou funkcie obličiek (GFR < 30 ml/min) nie sú informácie k dispozícii.
Vplyvveku,pohlavia,rasyaveľkostitela
Nevykonala sa žiadna analýza vplyvu veku, pohlavia alebo veľkosti tela na elimináciu lieku Apealea. Bola však nahlásená štúdia populačnej farmakokinetiky u 168 pacientov (86 mužov a 82 žien) liečených paklitaxelom na báze rozpúšťadla. Priemerná rýchlosť eliminácie paklitaxelu bola u mužov o 20 % vyššia ako u žien. Pokiaľ ide o vek, model populácie naznačil približne 5 % pokles rýchlosti eliminácie paklitaxelu pri každom 10-ročnom zvýšení veku v porovnaní s mediánom veku 56 rokov
v štúdii. To zodpovedá poklesu o 14 % u 86-ročného pacienta v porovnaní s pacientom vo veku
56 rokov. Ďalej sa ukázalo, že rýchlosť eliminácie paklitaxelu sa zvyšuje s rastúcou veľkosťou tela. Model naznačil, že zväčšenie BSA o 0,2 m2 by viedlo k 9 % zvýšeniu rýchlosti eliminácie. Existuje len veľmi málo informácií o tom, či sa eliminácia paklitaxelu medzi rasami odlišuje.
5.3 Predklinické údaje o bezpečnosti
Mutagenéza, karcinogenéza,poruchafertility
V štúdiách in vitro používajúcich rôzne bunkové systémy sa preukázalo, že paklitaxel klastogénne
vyvoláva chromozomálne aberácie, poškodenie mikrojadier a DNA. Chromozomálne aberácie boli zistené aj v štúdiách in vivo u myší a opíc. Paklitaxel nevykazoval mutagénnu aktivitu v Amesovom teste ani v teste génovej mutácie vaječníkov čínskeho škrečka/hypoxantín-guanín- fosforibozyltransferázy (CHO/HGPRT). Karcinogénna aktivita paklitaxelu sa neskúmala. Paklitaxel je však potenciálne karcinogénny vzhľadom na svoj mechanizmus účinku a preukázal genotoxickú aktivitu. Paklitaxel v dávkach nižších ako terapeutická dávka u ľudí bol u potkanov spojený s nízkou fertilitou a s fetálnou toxicitou. V štúdiách toxicity s opakovanými dávkami sa preukázali nevratné toxické účinky na samčie reprodukčné orgány.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
sodná soľ metylesteru kyseliny N-(all-trans-retinoyl)-L-cysteínovej sodná soľ metylesteru kyseliny (13-cis-retinoyl)-L-cysteínovej hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Neotvorená injekčná liekovka
2 roky.
Po rekonštitúcii
Chemická a fyzikálna stabilita lieku pripraveného na použitie sa preukázala počas 24 hodín pri teplote
2 ˚C až 8 ˚C, pokiaľ je liek chránený pred svetlom. Z mikrobiologického hľadiska sa má liek použiť okamžite, pokiaľ metóda otvorenia a rekonštitúcie nevylučuje riziko mikrobiálnej kontaminácie. Ak sa
nepoužije okamžite, za čas a podmienky uchovávania lieku pri používaní zodpovedá používateľ.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C).
Injekčnú liekovku uchovávajte vo vonkajšej škatuli na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Číra sklenená injekčná liekovka typu I so zátkou z butylovej gumy potiahnutou silikónom, hliníkovou obrubou a plastovým vyklápacím viečkom s práškom, ktorý zodpovedá 60 mg paklitaxelu.
Veľkosť balenia: 1 injekčná liekovka.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomOpatrenia pri podávaníPaklitaxel je antineoplastický liek, a rovnako, ako aj pri iných potenciálne toxických zlúčeninách, pri
manipulácii s liekom Apealea treba postupovať opatrne. Odporúča sa používať rukavice, ochranné okuliare a ochranný odev. Ak sa roztok dostane do kontaktu s pokožkou, pokožka sa má okamžite a
dôkladne umyť mydlom a vodou. Ak sa dostane do kontaktu so sliznicami, sliznice je potrebné
dôkladne prepláchnuť vodou. Liek Apealea má pripravovať a podávať len personál, ktorý bol vhodne vyškolený na manipuláciu s cytotoxickými látkami. Tehotné a dojčiace ženy nemajú manipulovať
s liekom Apealea. Rekonštituovaný liek sa nemá riediť.
Rekonštitúcia liekuLiek Apealea sa dodáva vo forme sterilného prášku určeného na rekonštitúciu pred použitím. Po
rekonštitúcii roztok obsahuje 1 mg/ml paklitaxelu vo forme micelárnych nanočastíc. Rekonštituovaný infúzny roztok je číry, zelenožltý roztok.
Počas celého procesu prípravy liek chráňte pred priamym a/alebo jasným svetlom. (Rekonštituovaný)
produkt vydrží bez ochrany pred svetlom len krátkodobú manipuláciu.
Rekonštituujte len pomocou komerčne dostupných Ringerových laktátových alebo acetátových roztokov vhodných na infúziu. Hodnota pH roztoku na rekonštitúciu musí byť v rozmedzí 5,0 až 7,5 a prípustné koncentrácie iónov vápnika a horčíka sú uvedené ďalej (tabuľka 5).
Tabuľka 5. Prípustné koncentrácie iónov vápnika a horčíka v Ringerových laktátových a acetátových roztokoch vhodných na rekonštitúciu Ión Rozsah (mmol/l)
Ión Rozsah (mmol/l) Ca2+ 1,0 – 3,5* Mg2+ 0,0 – 2,5*
* Roztoky obsahujúce Mg2+ aj Ca2+ majú mať celkovú (kombinovanú) koncentráciu Mg2+ a Ca2+
v rozsahu 1,0 až 3,5 mmol/l.
a. Vyberte z chladničky požadovaný počet injekčných liekoviek. Prášok má byť zelenožltý až žltý. V prípade zmeny sfarbenia (oranžovo-červenkasté) injekčnú liekovku zlikvidujte. Ak chcete dosiahnuť izbovú teplotu, nechajte injekčné liekovky stáť chránené pred svetlom približne 20 až 30 minút a pri teplote do 25 °C.
b. Vzhľadom na podtlak v injekčnej liekovke je nevyhnutné pred vstreknutím roztoku na rekonštitúciu vyrovnať tlak ihlou alebo bodcom. Pomocou sterilnej injekčnej striekačky
vstreknite 60 ml roztoku na rekonštitúciu do každej liekovky. Roztok sa má vstrekovať pomaly,
namierený na vnútornú stenu liekovky a nie priamo na prášok, pretože to spôsobí penenie.
c. Krúživým pohybom liekovky roztok 20 až 30 sekúnd manuálne jemne premiešavajte, chráňte ho pred svetlom a nechajte liekovku stáť tri až päť minút.
d. Liekovkou sa má potom jemne a pomaly krúžiť a/alebo sa má prevracať, kým sa prášok úplne nerozpustí. Nepretrepávajte ju, aby nedochádzalo k tvorbe peny. V prípade, že roztok obsahuje častice, liekovka sa má umiestniť na vytriasač a má sa nechať rotovať až 15 minút, pričom má
byť chránená pred svetlom (režim orbitálneho vytriasania, 200 – 250 ot/min). Kroky c a d
nemajú trvať dlhšie ako 30 minút.
e. Roztok má byť číry a zelenožltý bez viditeľných častíc alebo zrazenín. Ak spozorujete častice, zrazeniny alebo zmenu sfarbenia (oranžovo-červenkasté), roztok sa musí zlikvidovať.
f. Vstreknite primerané množstvo rekonštituovaného lieku Apealea do prázdneho sterilného etylén-vinylacetátového vaku (EVA). Na infúzny vak EVA nasaďte ochranný vak na ochranu pred svetlom.
Bola preukázaná kompatibilita s infúznymi súpravami z PVC bez obsahu DEHP (t. j. polyvinylchlorid bez plastifikátora di-(2-etylhexyl) ftalátu). Kompatibilita s infúznymi súpravami obsahujúcimi DEHP však nebola preukázaná. Majú sa použiť infúzne súpravy obsahujúce 15 μm polyamidový filter
tekutín.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIOasmia Pharmaceutical AB Vallongatan 1
752 28 Uppsala
Švédsko
Tel. +46 18 50 54 40
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/18/1292/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.