
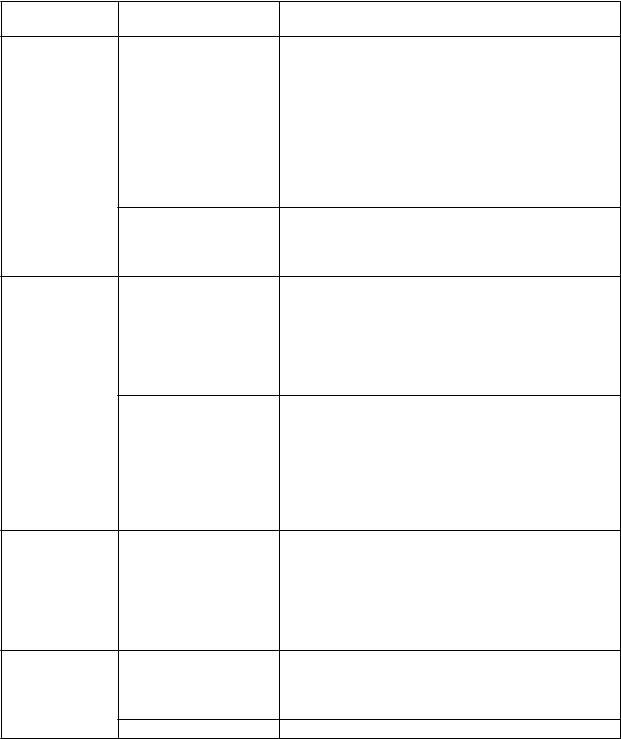
width="621" height="859" src="PublicData/Liekinfo/Spc/13306_files/image003.png" />Hypertenzia Hypertenzia 3. stupňa (STK ≥ 160 mmHg alebo
DTK ≥ 100 mmHg, indikovaný lekársky zásah, indikované viac ako jedno antihypertenzívum alebo indikovaná
intenzívnejšia liečba,
ako bola predchádzajúca liečba)
Hypertenzia 4. stupňa (život ohrozujúce následky, indikovaný súrny lekársky zásah)
· Liečba Alunbrigom sa má prerušiť, až kým sa hypertenzia nevráti na stupeň ≤ 1
(STK < 140 mmHg a DTK < 90 mmHg), potom sa má v liečbe pokračovať v rovnakej dávke.
· Ak dôjde k opätovnému výskytu hypertenzie
3. stupňa, liečba Alunbrigom sa má prerušiť, až kým sa hypertenzia nevráti na stupeň ≤ 1, potom sa má v liečbe pokračovať na najbližšej nižšej úrovni dávky podľa tabuľky 1 alebo sa má liečba natrvalo ukončiť.
· Liečba Alunbrigom sa má prerušiť, až kým sa hypertenzia nevráti na stupeň ≤ 1
(STK < 140 mmHg a DTK < 90 mmHg), potom sa má v liečbe pokračovať na najbližšej nižšej úrovni dávky podľa tabuľky 1 alebo sa má liečba natrvalo ukončiť.
· Ak dôjde k opätovnému výskytu hypertenzie
4. stupňa, liečba Alunbrigom sa má natrvalo ukončiť.
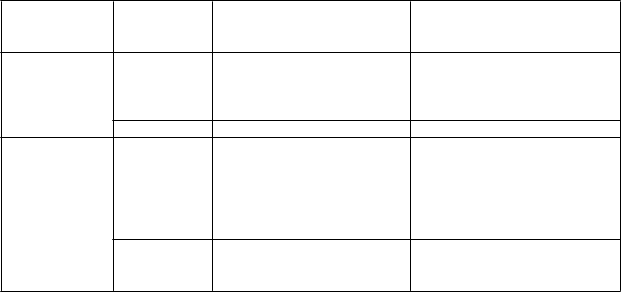
Nežiaduca
reakcia
Závažnosť
* Úprava dávky

Bradykardia (frekvencia srdcového rytmu menej ako
60 úderov/min.)
Zvýšenie koncentrácie CK
Syptomatická bradykardia
Bradykardia so život ohrozujúcimi následkami, indikovaný súrny lekársky zásah
Zvýšenie koncentrácie
CK 3. stupňa
(> 5,0 × ULN)
Zvýšenie koncentrácie
CK 4. stupňa
(> 10,0 × ULN)
· Liečba Alunbrigom sa má prerušiť až do úpravy na asymptomatickú bradykardiu alebo na frekvenciu srdcového rytmu v pokojnom stave
60 úderov/min. alebo vyššiu.
· Ak sa identifikuje súbežne podávaný liek,
o ktorom je známe, že spôsobuje bradykardiu,
a preruší sa jeho podávanie alebo sa upraví jeho dávka, v liečbe Alunbrigom sa má po úprave na asymptomatickú bradykardiu alebo na frekvenciu srdcového rytmu v pokojnom stave
60 úderov/min. alebo vyššiu pokračovať
v rovnakej dávke.
· Ak sa neidentifikuje žiadny súbežne podávaný liek, o ktorom je známe, že spôsobuje bradykardiu, alebo ak sa nepreruší podávanie ani neupraví dávka súbežne podávaných liekov prispievajúcich k bradykardii, v liečbe Alunbrigom sa má po úprave na asymptomatickú bradykardiu alebo na frekvenciu srdcového rytmu v pokojnom stave 60 úderov/min. alebo vyššiu pokračovať na najbližšej nižšej úrovni dávky podľa tabuľky 1.
· Ak sa identifikuje subežne podávaný liek prispievajúci k bradykardii a jeho podávanie sa preruší alebo sa upraví jeho dávka, v liečbe Alunbrigom sa má po úprave na asymptomatickú bradykardiu alebo na frekvenciu srdcového rytmu v pokojnom stave 60 úderov/min. alebo vyššiu pokračovať na najbližšej nižšej úrovni dávky podľa tabuľky 1 s častým sledovaním, ako je klinicky indikované.
· Ak sa neidentifikuje žiadny súbežne podávaný liek prispievajúci k bradykardii, liečba Alunbrigom sa má natrvalo ukončiť.
· Ak dôjde k opätovnému výskytu, liečba
Alunbrigom sa má natrvalo ukončiť.
· Liečba Alunbrigom sa má prerušiť až do úpravy na stupeň ≤ 1 (≤ 2,5 × ULN) alebo na pôvodný stav, potom sa má v liečbe pokračovať v rovnakej dávke.
· Ak dôjde k opätovnému zvýšeniu koncentrácie CK 3. stupňa, liečba Alunbrigom sa má prerušiť až do úpravy na stupeň ≤ 1 (≤ 2,5 × ULN) alebo na pôvodný stav, potom sa má v liečbe pokračovať na najbližšej nižšej úrovni dávky podľa tabuľky 1.
· Liečba Alunbrigom sa má prerušiť až do úpravy na stupeň ≤ 1 (≤ 2,5 × ULN) alebo na pôvodný stav, potom sa má v liečbe pokračovať na najbližšej nižšej úrovni dávky podľa tabuľky 1.
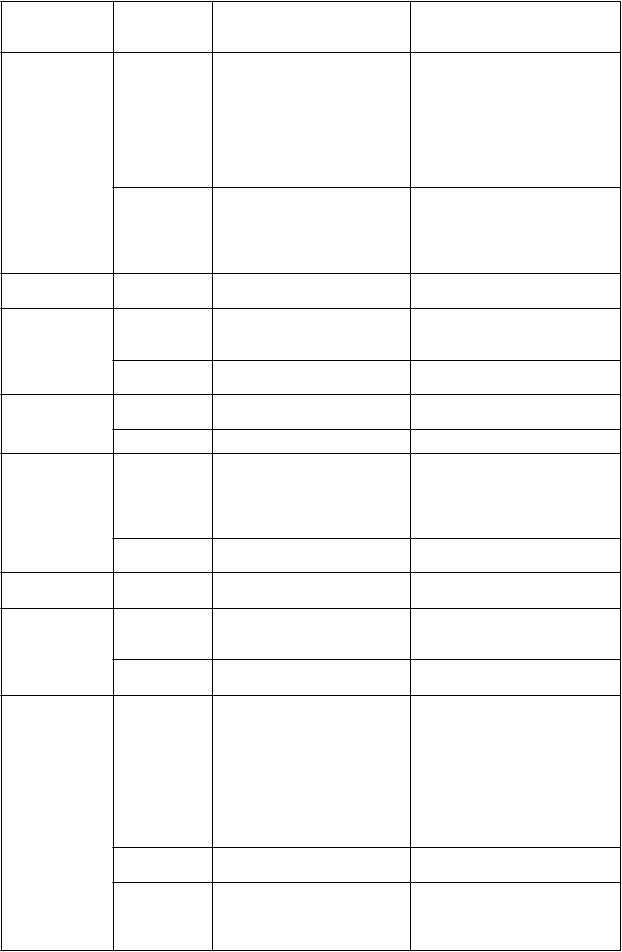
Nežiaduca
reakcia
Závažnosť
* Úprava dávky
Zvýšenie koncentrácie lipázy alebo amylázy
Zvýšenie koncentrácie lipázy alebo amylázy
3. stupňa (> 2,0 × ULN)
Zvýšenie koncentrácie lipázy aleb amylázy
4. stupňa (> 5,0 × ULN)
· Liečba Alunbrigom sa má prerušiť až do úpravy na stupeň ≤ 1 (≤ 1,5 × ULN) alebo na pôvodný stav, potom sa má v liečbe pokračovať v rovnakej dávke.
· Ak dôjde k opätovnému zvýšeniu koncentrácie lipázy alebo amylázy 3. stupňa, liečba Alunbrigom sa má prerušiť až do úpravy na stupeň ≤ 1 (≤ 1,5 × ULN) alebo na pôvodný stav, potom sa má v liečbe pokračovať na najbližšej nižšej úrovni dávky podľa tabuľky 1.
· Liečba Alunbrigom sa má prerušiť až do úpravy na stupeň ≤ 1 (≤ 1,5 × ULN), potom sa má
v liečbe pokračovať na najbližšej nižšej úrovni
dávky podľa tabuľky 1.
Hepatotoxicita Zvýšenie na stupeň ≥ 3 (> 5,0 × ULN) buď alanínaminotransferázy (ALT) alebo aspartátaminotransferázy (AST) s bilirubínom
≤ 2 × ULN
Zvýšenie na stupeň ≥ 2 (> 3 × ULN) ALT alebo AST so súbežným zvýšením celkového bilirubínu > 2 × ULN bez prítomnosti cholestázy alebo hemolýzy
Hyperglykémia Pre 3. stupeň (viac ako
250 mg/dl alebo
13,9 mmol/l) alebo vyšší
· Liečba Alunbrigom sa má prerušiť až do úpravy na pôvodný stav alebo na stav nižší alebo rovný
3 × ULN, potom sa má v liečbe pokračovať na
najbližšej nižšej úrovni dávky podľa tabuľky 1.
· Liečba Alunbrigom sa má natrvalo ukončiť.
· Ak nie je možné optimálnou liečbou dosiahnuť dostatočnú kontrolu hyperglykémie, liečba Alunbrigom sa má až do dosiahnutia dostatočnej kontroly hyperglykémie prerušiť. Po úprave sa môže v liečbe Alunbrigom buď pokračovať na najbližšej nižšej dávke podľa tabuľky 1 alebo sa má liečba natrvalo ukončiť.
Poruchy videnia 2. alebo 3. stupeň · Liečba Alunbrigom sa má prerušiť až do úpravy na stupeň 1 alebo na pôvodný stav, potom sa má v liečbe pokračovať na najbližšej nižšej úrovni dávky podľa tabuľky 1.
4. stupeň · Liečba Alunbrigom sa má natrvalo ukončiť.
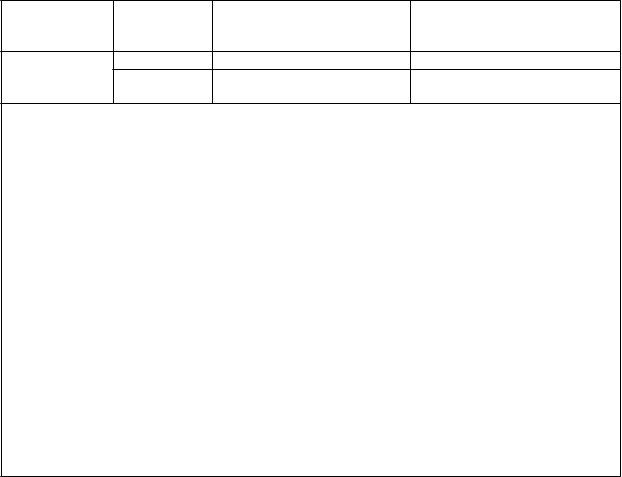
Nežiaduca
reakcia
Iné nežiaduce reakcie
Závažnosť* Úprava dávky
3. stupeň · Liečba Alunbrigom sa má prerušiť až do úpravy na pôvodný stav, potom sa má v liečbe pokračovať na rovnakej úrovni dávky.
· Ak dôjde k opätovnému výskytu príhody
3. stupňa, liečba Alunbrigom sa má prerušiť až do úpravy na pôvodný stav, potom sa má v liečbe pokračovať na ďalšej nižšej úrovni dávky podľa tabuľky 1 alebo sa má liečba natrvalo ukončiť.
4. stupeň · Liečba Alunbrigom sa má prerušiť až do úpravy na pôvodný stav, potom sa má v liečbe pokračovať na najbližšej nižšej úrovni dávky podľa tabuľky 1.
· Ak dôjde k opätovnému výskytu príhody
4. stupňa, liečba Alunbrigom sa má prerušiť až do úpravy na pôvodný stav, potom sa má v liečbe pokračovať na najbližšej nižšej úrovni dávky podľa tabuľky 1 alebo sa má liečba natrvalo ukončiť.

CK = kreatínfosfokináza, DTK = diastolický krvný tlak, STK = systolický krvný tlak, ULN = horná hranica normálnej hodnoty (
Upper Limit of Normal)
*Stupňované podľa bežných kritérií terminológie pre nežiaduce reakcie národného inštitútu pre nádorové ochorenia (
National Cancer Institute Common Terminology Criteria for Adverse Events). Verzia 4.0 (NCI CTCAE v4).
Osobitné skupinypacientovStarší pacientiObmedzené údaje o bezpečnosti a účinnosti Alunbrigu u pacientov vo veku 65 rokov a starších
naznačujú, že u starších pacientov nie je potrebná žiadna úprava dávky (pozri časť 4.8). Pre pacientov starších ako 85 rokov nie sú k dispozícii žiadne údaje.
Porucha funkcie pečeneU pacientov s miernou poruchou funkcie pečene (trieda A podľa Childa-Pugha) alebo stredne závažnou poruchou funkcie pečene (trieda B podľa Childa-Pugha) nie je potrebná žiadna úprava
dávky Alunbrigu. U pacientov so závažnou poruchou funkcie pečene (trieda C podľa Childa-Pugha) sa odporúča znížená začiatočná dávka 60 mg jedenkrát denne počas prvých 7 dní a potom 120 mg jedenkrát denne (pozri časť 5.2).
Porucha funkcie obličiekU pacientov s miernou alebo stredne závažnou poruchou funkcie obličiek (odhadovaná rýchlosť glomerulárnej filtrácie (eGFR) ≥ 30 ml/min.) nie je potrebná žiadna úprava dávky Alunbrigu.
U pacientov so závažnou poruchou funkcie obličiek (eGFR < 30 ml/min.) sa odporúča znížená začiatočná dávka 60 mg jedenkrát denne počas prvých 7 dní a potom 90 mg jedenkrát denne (pozri časť 5.2). Pacientov so závažnou poruchou funkcie obličiek je potrebné pozorne sledovať ohľadne
zhoršenia respiračných príznakov čo môže indikovať ILD/pneumonitídu (napr. dyspnoe, kašeľ, atď.), a to hlave počas prvého týždňa (pozri časť 4.4).
Pediatrická populáciaBezpečnosť a účinnosť Alunbrigu u detí vo veku menej ako 18 rokov neboli stanovené. K dispozícii nie sú žiadne údaje.
Spôsob podávaniaAlunbrig je určený na perorálne použitie. Tablety sa majú prehltnúť celé a s vodou. Alunbrig sa môže
užívať s jedlom alebo bez jedla.
Grapefruit alebo grapefruitová šťava môžu zvýšiť plazmatické koncentrácie brigatinibu a treba sa im vyhnúť (pozri časť 4.5).
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pľúcnenežiaducereakcie
U pacientov liečených Alunbrigom sa môžu vyskytnúť ťažké, život ohrozujúce a smrteľné pľúcne nežiaduce reakcie, vrátane reakcií s charakteristikami zhodujúcimi sa s ILD/pneumonitídou (pozri časť 4.8).
Väčšina pľúcnych nežiaducich reakcií sa pozorovala počas prvých 7 dní liečby. Pľúcne nežiaduce reakcie 1. – 2. stupňa vymizli po prerušení liečby alebo úprave dávky. Vyšší vek a kratší interval (menej ako 7 dní) medzi poslednou dávkou krizotinibu a prvou dávkou Alunbrigu boli nezávisle od seba spájané so zvýšenou mierou výskytu týchto pľúcnych nežiaducich reakcií. Tieto faktory sa majú zohľadniť pri začatí liečby Alunbrigom. Pacienti s ILD alebo pneumonitídou spôsobenou liekmi
v anamnéze boli vylúčení z pivotného skúšania.
U niektorých pacientov sa pneumonitída vyskytla neskôr počas liečby Alunbrigom.
Pacientov je potrebné sledovať ohľadne nových alebo zhoršujúcich sa respiračných príznakov (napr. dyspnoe, kašeľ, atď.), a to hlavne počas prvého týždňa liečby. U každého pacienta so zhoršujúcimi sa respiračnými príznakmi sa majú neodkladne preskúmať dôkazy pneumonitídy. Ak existuje podozrenie na pneumonitídu, dávka Alunbrigu sa nemá podať a u pacienta sa majú vyhodnotiť iné príčiny príznakov (napr. pľúcna embólia, progresia nádorového ochorenia a infekčný zápal pľúc). Dávka sa
má príslušne upraviť (pozri časť 4.2).
Hypertenzia
U pacientov liečených Alunbrigom sa vyskytla hypertenzia (pozri časť 4.8).
Počas liečby Alunbrigom sa má pravidelne sledovať krvný tlak. Hypertenzia sa má liečiť podľa štandardných postupov na kontrolu krvného tlaku. Ak sa nedá vyhnúť súbežnému používaniu liekov, o ktorých je známe, že spôsobujú bradykardiu, má sa u pacientov častejšie sledovať frekvencia srdcového rytmu. Pri ťažkej hypertenzii (≥ 3. stupeň) sa má liečba Alunbrigom prerušiť až do úpravy hypertenzie na 1. stupeň alebo na pôvodný stav. Dávka sa má príslušne upraviť (pozri časť 4.2).
Bradykardia
U pacientov liečených Alunbrigom sa vyskytla bradykardia (pozri časť 4.8). Pri podávaní Alunbrigu v kombinácii s inými látkami, o ktorých je známe, že spôsobujú bradykardiu, treba postupovať opatrne. Pravidelne sa má sledovať frekvencia srdcového rytmu a krvný tlak.
Ak sa vyskytne symptomatická bradykardia, liečba Alunbrigom sa má prerušiť a má sa vyhondotiť podávanie súbežného lieku, o ktorom je známe, že spôsobuje bradykardiu. Po úprave stavu sa má dávka príslušne upraviť (pozri časť 4.2).Ak sa v prípade život ohrozujúcej bradykardie neidentifikoval
súbežne podávaný liek alebo ak dôjde k opätovnému výskytu, má sa liečba Alunbrigom prerušiť (pozri časť 4.2).
Poruchyvidenia
U pacientov liečených Alunbrigom sa vyskytli nežiaduce reakcie porúch videnia (pozri časť 4.8). Pacientov treba poučiť, aby hlásili akékoľvek príznaky týkajúce sa videnia. Pri nových alebo ťažkých príznakoch týkajúcich sa videnia sa má zvážiť oftalmologické vyšetrenie a zníženie dávky (pozri
časť 4.2).
Zvýšenie
hladiny
kreatínfosfokinázy
(CK)
U pacientov liečených Alunbrigom sa vyskytli zvýšené koncentrácie CK (pozri časť 4.8). Pacientov treba poučiť, aby hlásili akúkoľvek nevysvetlenú bolesť, citlivosť alebo slabosť svalov. Počas liečby Alunbrigom sa majú pravidelne sledovať koncentrácie CK. Podľa závažnosti zvýšenia koncentrácie CK sa má prerušiť liečba Alunbrigom a dávka príslušne upraviť (pozri časť 4.2).
Zvýšeniehladínpankreatickýchenzýmov
U pacientov liečených Alunbrigom sa vyskytli zvýšené koncentrácie amylázy a lipázy (pozri časť 4.8). Počas liečby Alunbrigom sa majú pravidelne sledovať koncentrácie lipázy a amylázy. Podľa
závažnosti abnormalít laboratórnych hodnôt sa má liečba Alunbrigom prerušiť a dávka príslušne upraviť (pozri časť 4.2).
Hepatotoxicita
U pacientov liečených Alunbrigom sa vyskytli zvýšené koncentrácie pečeňových enzýmov
(aspartátaminotransferáza, alanínaminotransferáza) a bilirubín (pozri časť 4.8). Pred začatím liečby Alunbrigom a následne každé 2 týždne počas prvých 3 mesiacov liečby sa má vyhodnotiť funkcia pečene vrátane AST, ALT a celkového bilirubínu. Potom sa má sledovanie vykonávať pravidelne. Podľa závažnosti abnormalít laboratórnych hodnôt sa má liečba Alunbrigom prerušiť a dávka príslušne upraviť (pozri časť 4.2).
Hyperglykémia
U pacientov liečených Alunbrigom sa vyskytli zvýšené koncentrácie glukózy v sére. Pre začatím liečby Alunbrigom sa majú vyhodnotiť koncentrácie glukózy v sére nalačno a následne sa majú pravidelne sledovať. Podľa potreby sa má začať alebo optimalizovať liečba liekmi na hyperglykémiu. Ak nie je možné optimálnou liečbou dosiahnuť dostatočnú kontrolu hyperglykémie, liečba Alunbrigom sa má až do dosiahnutia dostatočnej kontroly hyperglykémie prerušiť. Po úprave sa môže zvážiť zníženie dávky podľa tabuľky 1 alebo sa môže liečba Alunbrigom natrvalo ukončiť.
Liekovéinterakcie
Treba sa vyhnúť súbežnému užívaniu Alunbrigu so silnými inhibítormi CYP3A. Ak sa súbežnému používaniu silných inhibítorov CYP3A nedá vyhnúť, dávka Alunbrigu sa má znížiť zo 180 mg na
90 mg alebo z 90 mg na 60 mg. Po ukončení používania silného inhibítora CYP3A sa má v liečbe Alunbrigom pokračovať v dávke, ktorá bola dobre znášaná pred začatím liečby silným inhibítorom CYP3A.
Treba sa vyhnúť súbežnému užívaniu Alunbrigu so silnými a stredne silnými induktormi CYP3A (pozri časť 4.5).
Plodnosť
Ženy vo fertilnom veku treba poučiť, aby používali účinnú nehormonálnu antikoncepciu počas liečby Alunbrigom a aspoň 4 mesiace po poslednej dávke. Mužov s partnerkami vo fertilnom veku treba poučiť, aby používali účinnú antikoncepciu počas liečby a aspoň 3 mesiace po poslednej dávke Alunbrigu (pozri časť 4.6).
Laktóza
Alunbrig obsahuje monohydrát laktózy. Pacienti so zriedkavými dedičnými problémami, galaktózovej intolerancie, celkovým deficitom laktázy alebo glukózo-galaktózovou malabsorpciou nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Látky, ktorémôžuzvýšiťplazmatickékoncentráciebrigatinibu
InhibítoryCYP3A
In vitro štúdie preukázali, že brigatinib je substrátom CYP3A4/5. U zdravých jedincov zvýšilo
súbežné podávanie viacerých 200 mg dávok itrakonazolu, silného inhibítora CYP3A, dvakrát denne s jednorazovou 90 mg dávkou brigatinibu hodnoty brigatinibu Cmax o 21 %, AUC0-INF o 101 %
(2-násobne) a AUC0-120 o 82 % (< 2-násobne) v porovnaní s 90 mg dávkou brigatinibu podanou samostatne. Treba sa vyhnúť súbežnému používaniu silných inhibítorov CYP3A s Alunbrigom, okrem iného niektorých antivirotík (napr. indinavir, nelfinavir, ritonavir, sakvinavir), makrolidových antibiotík (napr. klaritromycín, telitromycín, troleandomycín), antimykotík (napr. ketokonazol, vorikonazol), mibefradilu a nefazodónu. Ak sa súbežnému používaniu silných inhibítorov CYP3A nedá vyhnúť, dávka Alunbrigu sa má znížiť o približne 50 % (t.j. zo 180 mg na 90 mg alebo z 90 mg na 60 mg). Po ukončení používania silného inhibítora CYP3A sa má v liečbe Alunbrigom pokračovať v dávke, ktorá bola dobre znášaná pred začatím liečby silným inhibítorom CYP3A.
Podľa simulácií z farmakokinetického modelu na fyziologickom základe môžu stredne silné inhibítory CYP3A (napr. diltiazem a verapamil) zvýšiť hodnotu AUC brigatinibu o približne 40 %. Pri užívaní Alunbrigu v kombinácii so stredne silnými inhibítormi CYP3A sa nevyžaduje žiadna úprava dávky.
Pri súbežnom podávaní Alunbrigu so stredne silnými inhibítormi CYP3A je potrebné pacientov pozorne sledovať.
Grapefruit alebo grapefruitová šťava tiež môžu zvýšiť plazmatické koncentrácie brigatinibu a treba sa im vyhnúť (pozri časť 4.2).
InhibítoryCYP2C8
In vitro štúdie preukázali, že brigatinib je substrátom CYP2C8. U zdravých jedincov znížilo súbežné podávanie viacerých 600 mg dávok gemfibrozilu, silného inhibítora CYP2C8, dvakrát denne
s jednorazovou 90 mg dávkou brigatinibu hodnoty brigatinibu Cmax o 41 %, AUC0-INF o 12 %
a AUC0-120 o 15 % v porovnaní s 90 mg dávkou brigatinibu podanou samostatne. Účinok gemfibrozilu na farmakokinetické vlastnosti brigatinibu nie je klinicky významný a základný mechanizmus zníženia
expozície brigatinibu nie je známy. Pri súbežnom užívaní so silnými inhibítormi CYP2C8 sa nevyžaduje žiadna úprava dávky.
InhibítoryP-gpaBCRP
In vitro je brigatinib substrátom P-glykoproteínu (P-gp) a proteínu rezistencie rakoviny prsníka
(Breast Cancer Resistance Protein, BCRP). Keďže brigatinib preukazuje vysokú rozpustnosť
a vysokú permeabilitu, neočakáva sa, že inhibícia P-gp ani BCRP bude mať za následok klinicky
významnú zmenu systémovej expozície brigatinibu. Pri súbežnom užívaní s inhibítormi P-gp a BCRP
sa nevyžaduje žiadna úprava dávky Alunbrigu.
Látky, ktorémôžuznížiťplazmatickékoncentráciebrigatinibu
InduktoryCYP3A
U zdravých jedincov znížilo súbežné podávanie viacerých 600 mg denných dávok rifampicínu, silného
induktora CYP3A, s jednorazovou 180 mg dávkou brigatinibu hodnoty brigatinibu Cmax o 60 %, AUC0-INF o 80 % (5-násobne) a AUC0-120 o 80 % (5-násobne) v porovnaní so 180 mg dávkou brigatinibu podanou samostatne. Treba sa vyhnúť súbežnému používaniu silných induktorov CYP3A s Alunbrigom, okrem iného rifampicínu, karbamazepínu, fenytoínu, rifabutínu, fenobarbitalu
a ľubovníka bodkovaného.
Podľa simulácií z farmakokinetického modelu na fyziologickom základe môžu stredne silné induktory CYP3A znížiť hodnotu AUC brigatinibu o približne 50 %. Treba sa vyhnúť súbežnému používaniu stredne silných induktorov CYP3A s Alunbrigom, okrem iného efavirenzu, modafinilu, bosentanu, etravirinu a nafcilínu.
Látky, ktorýchplazmatickékoncentráciemôžebrigatinib zmeniť
SubstrátyCYP3A
In vitro štúdie ukázali, že brigatinib je induktorom CYP3A4. Nevykonali sa klinické štúdie liekových interakcií so substrátmi citlivými na CYP3A. Brigatinib môže znížiť plazmatické koncentrácie súbežne podávaných liekov, ktoré sú prevažne metabolizované CYP3A. Preto sa treba vyhnúť súbežnému podávaniu Alunbrigu so substrátmi CYP3A s úzkym terapeutickým indexom (napr. alfentanil, fentanyl, kvinidín, cyklosporín, sirolimus, takrolimus), keďže to môže znížiť ich účinnosť.
Alunbrig tiež môže indukovať iné enzýmy a transportéry (napr. CYP2C, P-gp) prostredníctvom rovnakého mechanizmu zodpovedného sa indukciu CYP3A (napr. aktivácia pregnánového X receptora).
Substrátytransportérov
Súbežné podávanie brigatinibu so substrátmi P-gp (napr. digoxín, dabigatran, kolchicín, pravastatín),
BCRP (napr. metotrexát, rosuvastatín, sulfasalazín), transportérov organických katiónov 1 (Organic Cation Transporter 1, OCT1), multiliekových a toxíny vylučujúcich proteínov 1 (Multidrug and Toxin Extrusion Protein 1, MATE1) a 2K (MATE2K) môže zvýšiť ich plazmatické koncentrácie. Pri súbežnom podávaní Alunbrigu so substrátmi týchto transportérov s úzkym terapeutickým indexom (digoxín, dabigatran, metotrexát) je potrebné pacientov pozorne sledovať.
4.6 Fertilita, gravidita a laktácia
Ženy vofertilnomveku/Antikoncepciau mužova žien
Ženy vo fertilnom veku liečené Alunbrigom treba poučiť o tom, aby neotehotneli, a mužov liečených
Alunbrigom treba poučiť o tom, aby počas liečby nesplodili dieťa. Ženy vo fertilnom veku treba poučiť, aby používali účinnú nehormonálnu antikoncepciu počas liečby Alunbrigom a aspoň
4 mesiace po poslednej dávke. Mužov s partnerkami vo fertilnom veku treba poučiť, aby používali
účinnú antikoncepciu počas liečby a aspoň 3 mesiace po poslednej dávke Alunbrigu.
Gravidita
Alunbrig môže pri podávaní gravidným ženám spôsobiť poškodenie plodu. Štúdie na zvieratách
preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie sú k dispozícii údaje o použití Alunbrigu
u gravidných žien. Alunbrig sa nemá užívať počas gravidity, pokiaľ klinický stav ženy nevyžaduje
liečbu. Ak sa Alunbrig užíva počas gravidity alebo ak pacientka otehotnie počas užívania tohto lieku, treba ju oboznámiť s možným rizikom pre plod.
Dojčenie
Nie je známe, či sa Alunbrig vylučuje do ľudského mlieka. Dostupné údaje nemôžu vylúčiť potenciál
vylučovania do ľudského mlieka. Dojčenie má byť počas liečby Alunbrigom ukončené.
Fertilita
Nie sú dostupné žiadne údaje o účinkoch Alunbrigu na fertilitu u ľudí. Na základe štúdií toxicity po
opakovanom podávaní u samcov zvierat môže Alunbrig spôsobiť zníženú fertilitu u mužov (pozri časť 5.3). Klinický význam týchto nálezov pre ľudskú fertilitu nie je známy.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Alunbrig má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pri vedení vozidla a obsluhe strojov však majú byť pacienti opatrní, pretože sa u nich počas užívania Alunbrigu môžu objaviť poruchy videnia, závraty alebo únava.
4.8 Nežiaduce účinky
Zhrnutie bezpečnostnéhoprofilu
Nežiaduce reakcie opísané v tejto časti boli identifikované v dvoch klinických štúdiách:
Štúdia 201 (ALTA): Randomizovaná, otvorená, multicentrická štúdia u pacientov liečených Alunbrigom (N = 219) s ALK + NSCLC, u ktorých predtým došlo k progresii ochorenia počas liečby krizotinibom. Pacienti boli randomizovaní v pomere 1:1 na kontinuálne užívanie Alunbrigu 90 mg
jedenkrát denne (režim 90 mg) alebo na užívanie 180 mg jedenkrát denne so 7-dňovým zahájením v dávke 90 mg jedenkrát denne (režim 180 mg).
Štúdia 101: Otvorená, multicentrická štúdia fázy 1/2 s eskaláciou/expanziou dávky u pacientov s malignitami v pokročilom štádiu.
Najčastejšími nežiaducimi reakciami (≥ 25 %) hlásenými u pacientov liečených Alunbrigom v odporúčanom dávkovacom režime boli zvýšená koncentrácia AST, hyperglykémia, hyperinzulinémia, anémia, zvýšená koncentrácia CK, nevoľnosť, zvýšená koncentrácia lipázy, znížený počet lymfocytov, zvýšená koncentrácia ALT, hnačka, zvýšená koncentrácia amylázy, únava, kašeľ, bolesť hlavy, zvýšená koncentrácia alkalickej fosfatázy, hypofosfatémia, zvýšený APTT, vyrážka, zvracanie, dyspnoe, hypertenzia, znížený počet bielych krviniek, myalgia a periférna neuropatia.
Najčastejšími závažnými nežiaducimi reakciami (≥°2 %) inými ako príhody súvisiace s progresiou nádoru hlásenými u pacientov liečených Alunbrigom v odporúčanom dávkovacom režime boli pneumonitída, zápal pľúc a dyspnoe.
Tabuľkový zoznamnežiaducichreakcií
Nežiaduce reakcie hlásené v štúdii ALTA a v Štúdii 101 pri odporúčanom dávkovacom režime sú
uvedené v tabuľke 3 a zoradené podľa triedy orgánových systémov, preferovaného termínu
a frekvencie výskytu. Kategórie frekvencie výskytu sú veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10)
a menej časté (≥ 1/1 000 až < 1/100). V rámci každej skupiny frekvencií sú nežiaduce účinky zoradené v poradí frekvencie výskytu.
Tabuľka 3: Nežiaduce reakcie hlásené u pacientov liečených Alunbrigom v štúdii ALTA a v Štúdii 101 (podľa bežných terminologických kritérií pre nežiaduce príhody (Common Terminology Criteria for Adverse Events, CTCAE) verzia 4.0)
Trieda
orgánových
systémov
Kategória frekvencie
Nežiaduc
e reakcie†
všetkýc
h stupňov
Nežiaduc
e reakcie
3. – 4. stupňa
Infekcie
a nákazy
veľmi časté zápal pľúca
infekcia horných dýchacích
ciest
časté zápal pľúca
Poruchy krvi
a lymfatického systému
veľmi časté anémia
znížený počet lymfocytov zvýšený APTT
znížený počet bielych krvniek
znížený počet neutrofilov znížený počet trombocytov
znížený počet lymfocytov
časté zvýšený APTT
anémia
znížený počet neutrofilov
Trieda
orgánových
systémov
Kategória frekvencie
Nežiaduc
e reakcie†
všetkýc
h stupňov
Nežiaduc
e reakcie
3. – 4. stupňa
Poruchy metabolizmu a výživy
veľmi časté hyperglykémia hyperinzulinémiab hypofosfatémia znížená chuť do jedla hypokalémia hypomagnezémia hyponatrémia hyperkalcémia
časté hypofosfatémia hyperglykémia hyponatrémia hypokalémia
znížená chuť do jedla
Psychické poruchy Poruchy nervového systému
veľmi časté nespavosť
veľmi časté bolesť hlavyc periférna neuropatiad závrat
časté poruchy pamäte dysgeúzia
periférna neuropatiad
bolesť hlavyc
Poruchy oka veľmi časté poruchy videniae
Poruchy srdca a srdcovej činnosti
časté poruchy videniae
časté tachykardiaf
predĺžený interval QT na
elektrokardiograme bradykardiag palpitácie
menej časté predĺžený interval QT na elektrokardiograme
Poruchy ciev veľmi časté hypertenzia hypertenzia
Poruchy
dýchacej sústavy, hrudníka
a mediastína
veľmi časté kašeľ
dyspnoeh
časté pneumonitídai pneumonitídai
dyspnoeh
Poruchy gastrointestináln eho traktu
veľmi časté zvýšená koncentrácia lipázy nevoľnosť
hnačkaj
zvýšená koncentrácia amylázy
zvracanie zápcha
bolesť bruchak
sucho v ústach stomatitídal
časté dyspepsia flatulencia
zvýšená koncentrácia lipázy
zvýšená koncentrácia amylázy bolesť bruchak
menej časté pankreatitída nevoľnosť dyspepsia pankreatitída
Trieda
orgánových
systémov
Kategória frekvencie
Nežiaduc
e reakcie†
všetkýc
h stupňov
Nežiaduc
e reakcie
3. – 4. stupňa
Poruchy pečene a žlčových ciest
Poruchy kože a podkožného tkaniva
veľmi časté zvýšená koncentrácia AST zvýšená koncentrácia ALT zvýšená koncentrácia alkalickej fosfatázy
časté zvýšená koncentrácia laktátdehydrogenázy v krvi hyperbilirubinémia
veľmi časté vyrážkam
pruritus
časté suchá koža fotosenzitívne reakcie
zvýšená koncentrácia ALT zvýšená koncentrácia AST zvýšená koncentrácia alkalickej fosfatázy
hyperbilirubinémia
vyrážkam
fotosenzitívne reakcie
menej časté suchá koža
Poruchy kostrovej
a svalovej sústavy
a spojivového
tkaniva
veľmi časté zvýšená koncentrácia CK
v krvi myalgian artralgia
muskuloskeletálna bolesť hrudníka
časté bolesť končatín
stuhnutosť svalov a kĺbov
zvýšená koncentrácia CK v krvi
bolesť končatín
menej časté myalgian
Poruchy
obličiek
a močových ciest Celkové poruchy
a reakcie v mieste
podania
veľmi časté zvýšený kreatinín v krvi
veľmi časté únavao edémp pyrexia
časté bolesť
nekardiatická bolesť hrudníka
diskomfort v hrudníku
únavao

menej časté nekardiatická bolesť hrudníka pyrexia
Trieda
orgánových
systémov
Kategória frekvencie
Nežiaduc
e reakcie†
všetkýc
h stupňov
Nežiaduc
e reakcie
3. – 4. stupňa
Laboratórne a funkčné vyšetrenia
časté pokles telesnej hmotnosti
menej časté pokles telesnej hmotnosti
a Zahŕňa atypický zápal pľúc, zápal pľúc, aspiračný zápal pľúc, pseudomonálny zápal pľúc, infekcie dolných dýchacích ciest, vírusové infekcie dolných dýchacích ciest, infekcie pľúc
b Stupeň sa nedá aplikovať
c Zahŕňa bolesť hlavy, bolesť hlavy pochádzajúcu z prínosových dutín, pocit diskomfortu hlavy, migrénu, bolesť hlavy s napätím
d Zahŕňa paraestéziu, periférnu senzorickú neuropatiu, dyzestéziu, hyperestéziu, hypoestéziu, neuralgiu, periférnu neuropatiu, neurotoxicitu, periférnu motorickú neuropatiu, polyneuropatiu
e Zahŕňa zmenu vizuálneho vnímania hĺbky, astenopiu, katarakt, získanú farbosleposť, diplopiu, glaukóm, zvýšený intraokulárny tlak, makulárny edém, fotofóbiu, fotopsiu, retinálny edém, rozmazané videnie, zníženú ostrosť zraku, poruchy zrakového poľa, poruchy videnia, oddelenie sklovca, plávajúce častice v sklovci,
amaurosis fugaxf Zahŕňa sínusovú tachykardiu, tachykardiu
g Zahŕňa bradykardiu, sínusovú bradykardiu
h Zahŕňa dyspnoe, námahové dyspnoe
i Zahŕňa intersticiálnu chorobu pľúc, pneumonitídu
j Zahŕňa hnačku, infekčnú hnačku
k Zahŕňa diskomfort v bruchu, abdominálnu distenziu, bolesť brucha, bolesť podbruška, bolesť hornej časti brucha, epigastrický diskomfort
l Zahŕňa aftóznu stomatitídu, stomatitídu, aftózny vred, vredy v ústach, pľuzgiere ústnej sliznice
m Zahŕňa akneiformnú dermatitídu, erytém, exfoliatívnu vyrážku, vyrážku, erytematóznu vyrážku, makulárnu vyrážku, makulopapulárnu vyrážku, papulárnu vyrážku, svrbivú vyrážku, pustulárnu vyrážku, dermatitídu, alergickú dermatitídu, generalizovaný erytém, folikulárnu vyrážku, urtikáriu
n Zahŕňa muskuloskeletálnu bolesť, myalgiu, svalové kŕče, stuhnutie svalov, svalové zášklby, muskuloskeletálny diskomfort
o Zahŕňa asténiu, únavu
p Zahŕňa edém očného viečka, edém tváre, lokalizovaný edém, periférny edém, periorbitálny edém, opuch tváre, generalizovaný edém, periférny opuch
† Frekvencie termínov nežiaducich liekových reakcií spojené so zmenami chemických a hematologických laboratórnych hodnôt sa určili na základe frekvencie abnormálnych posunov laboratórnych hodnôt od pôvodnej hodnoty.
OpisvybranýchnežiaducichreakciíPľúcnenežiaducereakcieV štúdii ALTA sa u 6,4 % pacientov vyskytli pľúcne nežiaduce reakcie akéhokoľvek stupňa, vrátane
ILD/pneumonitídy, zápalu pľúc a dyspnoe v skorej fáze liečby (do 9 dní, medián začiatku výskytu:
2 dni). 2,7 % pacientov malo pľúcne nežiaduce reakcie 3. – 4. stupňa a u 1 pacienta (0,5 %) bol zápal pľúc smrteľný. Po výskyte pľúcnych nežiaducich reakcií 1. – 2. stupňa sa liečba Alunbrigom buď prerušila a následne sa v nej pokračovalo, alebo sa znížila dávka. Skoré pľúcne nežiaduce reakcie sa
u pacientov vyskytli tiež v štúdii s eskaláciou dávky (N = 137) (Štúdia 101) vrátane troch smrteľných prípadov (hypoxia, syndróm akútnej respiračnej tiesne a zápal pľúc).
Okrem toho sa u 2,3 % pacientov v štúdii ALTA vyskytla pneumonitída v neskoršej fáze liečby, pričom 2 pacienti mali pneumonitídu 3. stupňa (pozri časti 4.2 a 4.4).
StaršípacientiV štúdii ALTA sa u 13,5 % pacientov vo veku ≥ 65 rokov vyskytli skoré pľúcne nežiaduce reakcie v porovnaní so 4,2 % pacientov vo veku < 65 rokov.
HypertenziaV štúdii ALTA sa hlásila hypertenzia u 28 % pacientov liečených Alunbrigom v režime 180 mg, pričom 10 % pacientov malo hypertenziu 3. stupňa. K zníženiu dávky z dôvodu hypertenzie došlo
u 0,9 % v režime 180 mg. Priemerný systolický a diastolický krvný tlak sa postupne zvýšil u všetkých pacientov (pozri časti 4.2 a 4.4).
BradykardiaV štúdii ALTA sa hlásila bradykardia u 4,5 % pacientov liečených Alunbrigom v režime 180 mg.
U 8,2 % pacientov v režime 180 mg sa hlásili frekvencie srdcového rytmu menej ako 50 úderov za minútu (pozri časti 4.2 a 4.4).
Poruchyvidenia
V štúdii ALTA sa hlásili nežiaduce reakcie porúch videnia u 18 % pacientov liečených Alunbrigom v režime 180 mg. U týchto pacientov sa hlásili nežiaduce reakcie 3. stupňa (2,7 %) vrátane makulárneho edému a kataraktu.
K zníženiu dávky z dôvodu porúch videnia došlo u dvoch pacientov (1,8 %) v režime 180 mg (pozri časti 4.2 a 4.4).
Periférnaneuropatia
V štúdii ALTA bola hlásená periférna neuropatia ako nežiaduce reakcie u 27,3 % pacientov liečených režimom 180 mg. U 30 % pacientov všetky nežiaduce reakcie periférnej neuropatie vymizli. Medián trvania nežiaducich reakcií periférnej neuropatie bol 4,5 mesiaca s maximálnym trvaním 28,7 mesiaca.
Zvýšeniehladinykreatínfosfokinázy(CK)
V štúdii ALTA sa hlásili zvýšené koncentrácie CK u 50 % pacientov liečených Alunbrigom v režime
180 mg. Výskyt zvýšenia koncentrácií CK 3. – 4. stupňa bol 13,6 %. Medián času do začiatku zvýšenia koncentrácií CK bol 27 dní.
K zníženiu dávky z dôvodu zvýšenej koncentrácie CK došlo u 6,4 % pacientov v režime 180 mg
(pozri časti 4.2 a 4.4).
Zvýšeniekoncentráciípankreatickýchenzýmov
V štúdii ALTA sa hlásili zvýšené koncentrácie amylázy a lipázy u 43 % a 50 % pacientov liečených
Alunbrigom v režime 180 mg, v uvedenom poradí. Výskyt zvýšení 3. a 4. stupňa bol pre amylázu
8,2 % a pre lipázu 10 %. Medián času do začiatku zvýšenia koncentrácie amylázy bol 17 dní
a koncentrácií pre lipázu to bolo 29 dní.
K zníženiu dávky z dôvodu zvýšenej koncentrácie lipázy došlo u 1,8 % a zvýšenej koncentrácie amylázy u 0,9 % pacientov v režime 180 mg (pozri časti 4.2 a 4.4).
Zvýšeniehladínpečeňovýchenzýmov
V štúdii ALTA sa hlásili zvýšené koncentrácie ALT a AST u 46 % a 65 % pacientov liečených Alunbrigom v režime 180 mg, v uvedenom poradí. Výskyt zvýšení 3. a 4. stupňa bol pre ALT 5,5 % a pre AST 3,6 %.
U žiadneho pacienta nedošlo k zníženiu dávky z dôvodu zvýšenej koncentrácie ALT alebo AST.
Hyperglykémia
V štúdii ALTA sa u 69 % pacientov vyskytla hyperglykémia. Hyperglykémia 3. stupňa sa vyskytla u 7,3 % pacientov.
U žiadneho pacienta nedošlo k zníženiu dávky z dôvodu hyperglykémie. Hlásenie podozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 Predávkovanie
Nie je k dispozícii žiadne špecifické antidotum na predávkovanie Alunbrigom. V prípade predávkovania je potrebné pacienta sledovať ohľadne nežiaducich reakcií (pozri časť 4.8) a má sa poskytnúť vhodná podporná liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.
1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: cytostatiká, inhibítory proteínkinázy, ATC kód: L01XE43
Mechanizmusúčinku
Brigatinib je inhibítor tyrozínkinázy cielený voči ALK, c-ros onkogénu 1 (ROS1) a receptoru inzulínu podobnému rastovému faktoru 1 (IGF-1R). Brigatinib inhiboval autofosforyláciu ALK a fosforyláciu
„downstream“ (t. j. regulovaného) signálneho proteínu STAT3 sprostredkovanú ALK v in vitro a in vivo analýzach.
Brigatinib inhiboval in vitro proliferáciu bunkových línií exprimujúcich fúzne proteíny EML4-ALK a NPM-ALK a preukazoval inhibíciu rastu EML4-ALK-pozitívneho NSCLC xenograftu u myší závislú od dávky. Brigatinib inhiboval in vitro a in vivo životaschopnosť buniek exprimujúcich mutované formy EML4-ALK spojené s rezistenciou voči inhibítorom ALK, vrátane G1202R
a L1196M.
Elektrofyziológiasrdca
V štúdii 101 sa u 123 pacientov s malignitami v pokročilom štádiu hodnotil potenciál Alunbrigu predlžovať interval QT po dávke brigatinibu 30 mg až 240 mg podávanej jedenkrát denne. Maximálna priemerná zmena QTcF (QT upraveného podľa metódy Fridericia, corrected QT by the Fridericia method) oproti pôvodnému stavu bola menej ako 10 ms. Analýza expozície QT nenaznačovala žiadne predĺženie intervalu QTc v závislosti od koncentrácie.
Klinická účinnosťa bezpečnosť
ALTA
Bezpečnosť a účinnosť Alunbrigu sa hodnotila v randomizovanej (1:1), otvorenej, multicentrickej'
štúdii (ALTA) u 222 dospelých pacientov s lokálne pokročilým alebo metastatickým ALK-pozitívnym NSCLC, u ktorých došlo k progresii ochorenia pri liečbe krizotinibom. Kritériá vhodnosti povoľovali zahrnutie pacientov s dokumentovaným preskupením ALK na základe validovaného testu, výkonnostného stavu ECOG 0 – 2 a prechádzajúcej chemoterpie. Okrem toho boli zahrnutí pacienti
s metastázami v centrálnom nervovom systéme (CNS) za predpokladu, že boli neurologicky stabilní a nevyžadovali zvýšené dávky kortikosteroidov. Pacienti s intersticiálnou chorobou pľúc alebo pneumonitídou súvisiacou s liekmi v anamnéze boli vylúčení.
Pacienti boli randomizovaní v pomere 1:1 na užívanie Alunbrigu v dávke buď 90 mg jedenkrát denne (režim 90 mg, N = 112) alebo 180 mg jedenkrát denne so 7-dňov ou úvodnou dávkou 90 mg jedenkrát denne (režim 180 mg, N = 110). Medián dĺžky sledovania bol 22,9 mesiacov. Randomizácia bola stratifikovaná s ohľadom na metastázy v mozgu (prítomné, neprítomné) a najlepšiu dosiahnutú odpoveď na predchádzajúcu liečbu krizotinibom (kompletná alebo parciálna odpoveď, akákoľvek iná odpoveď/neznáma odpoveď).
Hlavným ukazovateľom výsledku bola potvrdená miera objektívnej odpovede (Objective Response Rate, ORR) podľa Kritérií hodnotiacich odpoveď v solídnych nádoroch (Response Evaluation Criteria in Solid Tumors, RECIST v1.1) vyhodnotená skúšajúcim. Dodatočné ukazovatele výsledku zahŕňali potvrdenú ORR vyhodnotenú nezávislou hodnotiacou komisiou (Independent Review Committee,
IRC), čas do odpovede, prežívanie bez progresie ochorenia (Progression Free Survival, PFS), dĺžka
trvania odpovede (Duration Of Response, DOR), celkové prežívanie a intrakraniálnu ORR
a intrakraniálnu DOR vyhodnotené komisiou IRC.
Základnými demografickými charakteristikami a charakteristikami ochorenia v štúdii ALTA boli medián veku 54 rokov (rozsah 18 až 82, 23 % vo veku 65 rokov a starší), 67 % belochov
a 31 % ázijskej rasy, 57 % žien, 36 % výkonnostný stav ECOG 0 a 57 % výkonnostný stav ECOG 1,
7 % výkonnostný stav ECOG 2, 60 % nikdy nefajčilo, 35 % bývalí fajčiari, 5 % súčasní fajčiari,
98 % štádium IV, 97 % adenokarcinóm a 74 % s predchádzajúcou chemoterapiou. Najčastejšie miesta mimotorakálnych metastáz zahŕňali 69 % mozog (z čoho 62 % predtým dostalo radiačnú terapiu mozgu), 39 % kosti a 26 % pečeň.
Výsledky účinnosti z analýz štúdie ALTA sú zhrnuté v tabuľke 4 a KaplanovejMeierovej (KM) krivke
PFS vyhodnoteného skúšajúcim na obrázku 1.
Tabuľka 4: Výsledky účinnosť v štúdii ALTA (ITT populácia)
Parameter účinnosti Vyhodnotenie skúšajúceho Vyhodnotenie komisiou IRC
R
eži
m 90 mg* N = 112
R
eži
m 180 mg* N = 110
R
eži
m 90 mg* N = 112
R
eži
m 180 mg* N = 110
Miera objektívnej odpovede
(%) 46 % 56 % 51 % 56 % IS‡ (35, 57) (45, 67) (41, 61) (47, 66) Čas do odpovede
Medián (mesiace) 1,8 1,9 1,8 1,9
Dĺžka trvania odpovede
Medián (mesiace) 12,0 13,8 16,4 15,7
95 % IS (9,2; 17,7) (10,2; 19,3) (7,4; 24,9) (12,8; 21,8)
Prežívanie bez progresie ochorenia
Medián (mesiace) 9,2 15,6 9,2 16,7
95 % IS (7,4; 11,1) (11,1; 21) (7,4; 12,8) (11,6; 21,4)
Celkové prežívanie
Medián (mesiace) 29,5 34,1 NA NA
95 % IS (18,2; NE) (27,7; NE) NA NA
12-mesačná pravdepodobnosť prežívania (%)
70,3 % 80,1 % NA NA

IS = interval spoľahlivosti; NE = nestanoviteľné; NA = neaplikovateľné
*režim 90 mg jedenkrát denne
†180 mg jedenkrát denne so 7-dňovou úvodnou dávkou 90 mg jedenkrát denne
‡Interval spoľahlivosti pre ORR vyhodnotenou skúšajúcim je 97,5 % a pre ORR vyhodnotenou
komisiou IRC je 95 %
Obrázok 1: Systémové prežívanie bez progresie ochorenia hodnotené skúšajúcim: ITT populácia podľa liečebných skupín (ALTA)Skratky: ITT =
Intent-to-treat (populácia všetkých randomizovaných pacientov)
Poznámka: Prežívanie bez progresie ochorenia sa definovalo ako čas od začatia liečby do dátumu, kedy sa prvý krát zaznamenala progresia ochorenia alebo do dátumu úmrtia pacienta, podľa toho, čo nastalo ako prvé.
*režim 90 mg jedenkrát denne
†180 mg jedenkrát denne so 7-dňovou úvodnou dávkou 90 mg jedenkrát denne
Vyhodnotenia intrakraniálnej ORR a trvania intrakraniálnej odpovede u pacientov zo štúdie ALTA s merateľnými metastázami v mozgu (s najdlhším priemerom ≥ 10 mm) komisiou IRC na začiatku štúdie sú zhrnuté v tabuľke 5.
Tabuľka 5: Intrakraniálna účinnosť u pacientov s merateľnými metastázami v mozgu na začiatku štúdie v štúdii ALTA
Parameter účinnosti vyhodnotený komisiou
Pacienti s merateľnými metastázami v mozgu na začiatku štúdie
IRC
Miera objektívnej intrakraniálnej odpovede
Režim 90 mg* (N = 26)
Režim 180 mg† (N = 18)

(%) 50 % 67 %
95 % IS (30, 70) (41, 87)
Miera kontroly intrakraniálneho ochorenia(%) 85 % 83 %
95 % IS (65, 96) (59, 96)
Trvanie intrakraniálnej odpovede‡,Medián (mesiace) 9,4 16,6
95 % IS (3,7; 24,9) (3,7; NE)
% IS = interval spoľahlivosti, NE = nestanoviteľné
*režim 90 mg jedenkrát denne
†180 mg jedenkrát denne so 7-dňovou úvodnou dávkou 90 mg jedenkrát denne
‡Príhody zahŕňajú progresiu intrakraniálneho ochorenia (nové lézie, rast priemeru intrakraniálnych
cieľových lézií ≥ 20 % od nadiru alebo jednoznačná progresia intrakraniálnych necieľových lézií)
alebo úmrtie pacienta.
U pacientov s akýmikoľvek metastázami v mozgu na začiatku štúdie bola kontrola intrakraniálneho ochorenia 77,8 % (95 % IS 67,2 – 86,3) v skupine s 90 mg (N = 81) a 85,1 % (95 % IS 75 – 92,3)
v skupine so 180 mg (N = 74).
Štúdia101V oddelenej štúdii určovania dávky sa 25 pacientom s ALK pozitívnym NSCLC, u ktorých došlo
k progresii ochorenia počas liečby krizotinibom, podával Alunbrig v dávke 180 mg jedenkrát denne so
7-dňovou úvodnou dávkou 90 mg v režime jedenkrát denne. Z nich malo 19 pacientov potvrdenú objektívnu odpoveď vyhodnotenú skúšajúcim (76 %; 95 % IS: 55, 91) a KM odhadovaný medián trvania odpovede u 19 pacientov odpovedajúcich na liečbu bol 26,1 mesiacov (95 % IS: 7,9; 26,1). KM medián PFS bol 16,3 mesiacov (95 % IS: 9,2; NE) a 12-mesačná pravdepodobnosť celkového prežívania bola 84,0 % (95 % IS: 62,8; 93,7).
Pediatrická populáciaEurópska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s Alunbrigom vo
všetkých podskupinách pediatrickej populácie pre pľúcny karcinóm (malobunkový a nemalobunkový
karcinóm) (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAbsorpciaV Štúdii 101 bol po podaní jednorazovej perorálnej dávky brigatinibu (30 – 240 mg) pacientom
medián času do dosiahnutia maximálnej koncentrácie (Tmax) 1 – 4 hodiny po podaní dávky. Po jednorazovej dávke v ustálenom stave bola systémová expozícia priamo úmerná dávke v rozsahu dávok 60 – 240 mg jedenkrát denne. Po opakovanom dávkovaní sa pozorovala mierna akumulácia
(geometrický priemer akumulačného pomeru: 1,9 ku 2,4). Geometrický priemer hodnoty Cmax brigatinibu v ustálenom stave pri dávkach 90 mg a 180 mg jedenkrát denne bol 552 a 1 452 ng/ml, v uvedenom poradí, a príslušná hodnota AUC0-t bola 8 165 a 20 276 h∙ng/ml, v uvedenom poradí. Brigatinib je substrátom transportných proteínov P-gp a BCRP.
U zdravých jedincov znížilo jedlo s vysokým obsahom tukov, v porovnaní so stavom nalačno cez noc, hodnotu Cmax brigatinibu o 13 % so žiadnym účinkom na hodnotu AUC. Brigatinib sa môže podávať
s jedlom alebo bez jedla.
Distribúcia
Brigatinib sa stredne (91 %) viazal na ľudské plazmatické proteíny a väzba nezávisela od
koncentrácie. Pomer koncentrácie krvi ku plazme je 0,69. U pacientov, ktorým sa podal brigatinib
180 mg jedenkrát denne, bol geometrický priemer zjavného distribučného objemu (Vz/F) brigatinibu
v ustálenom stave 153 l, čo naznačuje strednú distribúciu do tkanív.
Biotransformácia
In vitro štúdie preukázali, že brigatinib sa primárne metabolizuje CYP2C8 a CYP3A4 a v oveľa nižšej
miere CYP3A5.
Po perorálnom podaní jednorazovej dávky 180 mg [14C]brigatinibu zdravým jedincom boli
N-demetylácia a cysteínová konjugácia dvomi hlavnými metabolickými cestami vylučovania. V moči a stolici spoločne sa vylúčilo 48 %, 27 %, a 9,1 % rádioaktívnej dávky ako nezmenený brigatinib,
N-desmetyl-brigatinib (AP26123) a cysteínový konjugát brigatinibu, v uvedenom poradí. Nezmenený brigatinib bol hlavnou rádioaktívnou zložkou v obehu (92 %) spolu s primárnym metabolitom
AP26123 (3,5 %), tiež pozorovaným in vitro. U pacientov v ustálenom stave bola plazmatická hodnota
AUV AP26123 < 10 % expozície brigatinibu. V in vitro bunkových a kinázových analýzach metabolit
AP26123 inhiboval ALK s približne 3-násobne nižšou silou v porovnaní s brigatinibom.
Eliminácia
U pacientov, ktorým sa podával brigatinib 180 mg jedenkrát denne, bol geometrický priemer zjavného
perorálneho klírensu (CL/F) brigatinibu v ustálenom stave 13 l/h a medián polčas eliminácie z plazmy
bol 24 h.
Primárnou cestou vylučovania brigatinibu je vylučovanie stolicou. U 6 zdravých mužov sa po podaní jednorazovej 180 mg perorálnej dávky [14C]brigatinibu 65 % podanej dávky vylúčilo stolicou a 25 % podanej dávky sa vylúčilo močom. Nezmenený brigatinib predstavoval 41 % celkovej rádioaktivity
v stolici a 86 % v moči, pričom zvyšok predstavovali metabolity.
Osobitné skupinypacientov
Poruchafunkciepečene
Farmakokinetické vlastnosti brigatinibu sa charakterizovali u zdravých jedincov s normálnou funkciou
pečene (N = 9) a u pacientov s miernou poruchou funkcie pečene (trieda A podľa Childa-Pugha, N = 6), stredne závažnou poruchou funkcie pečene (trieda B podľa Childa-Pugha, N = 6) alebo závažnou poruchou funkcie pečene (trieda C podľa Childa-Pugha, N = 6). Farmakokinetické vlastnosti brigatinibu boli podobné u zdravých jedincov s normálnou funkciou pečene a u pacientov s miernou (trieda A podľa Childa-Pugha) alebo stredne závažnou poruchou (trieda B podľa Childa-Pugha)
funkcie pečene. Neviazaná hodnota AUC0-INF bola o 37 % vyššia u pacientov so závažnou poruchou funkcie pečene (trieda C podľa Childa-Pugha) v porovnaní so zdravými jedincami s normálnou funkciou pečene (pozri časť 4.2).
Poruchafunkcieobličiek
Na základe výsledkov populačných farmakokinetických analýz sú farmakokinetické vlastnosti brigatinibu podobné u pacientov s normálnou funkciou obličiek a u pacientov s miernou alebo stredne
závažnou poruchou funkcie obličiek (eGFR ≥ 30 ml/min.). Vo farmakokinetickej štúdii bola neviazaná hodnota AUC0-INF o 94 % vyššia u pacientov so závažnou poruchou funkcie obličiek
(eGFR < 30 ml/min., N = 6) v porovnaní s jedincami s normálnou funkciou obličiek
(eGFR ≥ 90 ml/min., N = 8) (pozri časť 4.2).
Rasovápríslušnosťapohlavie
Populačné farmakokinetické analýzy ukázali, že rasová príslušnosť a pohlavie nemajú žiadny vplyv na
farmakokinetické vlastnosti brigatinibu.
Vek,telesnáhmotnosťakoncentráciealbumínu
Populačné farmakokinetické analýzy ukázali, že telesná hmotnosť, vek a koncentrácia albumínu
nemali žiadny klinicky významný vplyv na farmakokinetické vlastnosti brigatinibu.
5.3 Predklinické údaje o bezpečnosti
Vo farmakologických štúdiách bezpečnosti s brigatinibom sa identifikoval potenciál pľúcnych účinkov
(zmeny frekvencie dýchania, 1 – 2-násobok ľudskej hodnoty Cmax), kardiovaskulárnych účinkov (zmena frekvencie srdcového rytmu a krvného tlaku, 0,5-násobok ľudskej hodnoty Cmax) a účinkov na obličky (znížená funkcia obličiek, 1 – 2,5-násobok ľudskej hodnoty Cmax), avšak tieto štúdie nenaznačovali žiadny potenciál predĺženia intervalu QT ani účinkov na nervovú funkciu.
Nežiaduce reakcie, ktoré boli pozorované u zvierat pri expozíciách podobných klinickým expozíciám
a s možným významom pre klinické použitie, boli nasledujúce: gastrointestinálny systém, kostná dreň, oči, semenníky, pečeň, obličky, kosti a srdce. Tieto účinky boli vo všeobecnosti reverzibilné počas obdobia zotavovania bez podávania lieku, s dôležitou výnimkou účinkov na oči a semenníky, pri ktorých nedošlo k ich vymiznutiu.
V štúdiách toxicity po opakovanom podávaní sa u opíc pri hodnotách ≥ 0,2 krát ľudských hodnôt
AUC zaznamenali pľúcne zmeny (penové alveolárne makrofágy), avšak tie boli minimálne a podobné
zmenám hláseným ako základné nálezy u neliečených opíc a u týchto opíc sa nepozoroval žiadny klinický dôkaz respiračnej tiesne.
S brigatinibom sa nevykonali žiadne štúdie karcinogenity.
Brigatinib nebol mutagénny v in vitro bakteriálnom teste reverznej mutácie (Ames) ani v teste chromozómových aberácií v bunkách cicavcov, avšak mierne zvýšil počet mikrojadier v teste mikrojadier kostnej drene potkanov. Mechanizmom indukcie mikrojadier bola abnormálna segregácia chromozómov (aneugenicita) a nie klastogénny účinok na chromozómy. Tento účinok sa pozoroval pri približne päťnásobku expozície u ľudí pri dávke 180 mg jedenkrát denne.
Brigatinib môže mať negatívne účinky na mužskú fertilitu. V zvieracích štúdiách po opakovanom podávaní sa pozorovala toxicita voči semenníkom. U potkanov nálezy zahŕňali nižšiu hmotnosť semenníkov, semenných vezikúl a prostaty a testikulárnu tubulárnu degeneráciu. Tieto účinky neboli počas obdobia zotavovania reverzibilné. U opíc nálezy zahŕňali zníženú veľkosť semenníkov spolu
s mikroskopickým dôkazom hypospermatogenézy. Tieto účinky boli počas obdobia zotavovavnia reverzibilné.Vo všeobecnosti sa tieto účinky na samčie reprodukčné orgány u potkanov a opíc vyskytovali pri expozíciách ≥ 0,2-násobku hodnoty AUC pozorovanej u pacientov pri dávke 180 mg jedenkrát denne. Vo všeobecných toxikologických štúdiách u potkanov a opíc sa nepozorovali žiadne zjavné nežiaduce účinky na samičie reprodukčné orgány.
V embryofetálnej vývojovej štúdii, v ktorej sa gravidným potkanom počas organogenézy podávali denné dávky brigatinibu, sa pozorovali kostrové abnormality závisiace od dávky už pri takých nízkych dávkach, ako je 0,7-násobok ľudskej expozície AUC pri dávke 180 mg jedenkrát denne. Nálezy zahŕňali úmrtnosť embryí, znížený rast plodu a kostrové zmeny.
6. FARMACEUTICKÉ INFORMÁCIE
6.
1 Zoznam pomocných látok
Ja
d
r
o
tablety
laktóza, monohydrát mikrokryštalická celulóza karboxymetylškrob A, sodná soľ
oxid kremičitý, koloidný hydrofóbny stearan horečnatý
Obaltablety mastenec makrogol polyvinylalkohol oxid titaničitý
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
Alunbrig30mgfilmomobalenétablety
3 roky
Alunbrig90mgfilmomobalenétablety
2 roky
Alunbrig180 mgfilmomobalenétablety
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Alunbrig30mgfilmomobalenétablety
Fľaše s okrúhlym širokým otvorom z polyetylénu s vysokou hustotou (HDPE) s dvojdielnym polypropylénovým detským bezpečnostným skrutkovacím uzáverom s fóliovou indukčnou tesniacou vložkou obsahujúce buď 60 alebo 120 filmom obalených tabliet spolu s jednou HDPE nádobkou obsahujúcou molekulárne sitkové vysúšadlo.
Priesvitný, termoformovateľný, polychlorotrifluoroetylénový (PCTFE) blister s tepelne uzatvárateľnou, papierom laminovanou fóliou v škatuli obsahujúcej buď 56 alebo 112 filmom obalených tabliet.
Alunbrig90mgfilmomobalenétablety
Fľaše s okrúhlym širokým otvorom z polyetylénu s vysokou hustotou (HDPE) s dvojdielnym polypropylénovým detským bezpečnostným skrutkovacím uzáverom s fóliovou indukčnou tesniacou vložkou obsahujúce buď 7 alebo 30 filmom obalených tabliet spolu s jednou HDPE nádobkou obsahujúcou molekulárne sitkové vysúšadlo.
Priesvitný, termoformovateľný, polychlorotrifluoroetylénový (PCTFE) blister s tepelne uzatvárateľnou, papierom laminovanou fóliou v škatuli obsahujúcej buď 7 alebo 28 filmom obalených tabliet.
Alunbri
g
180 mg
filmom
obalené
tablety
Fľaše s okrúhlym širokým otvorom z polyetylénu s vysokou hustotou (HDPE) s dvojdielnym polypropylénovým detským bezpečnostným skrutkovacím uzáverom s fóliovou indukčnou tesniacou vložkou obsahujúce 30 filmom obalených tabliet spolu s jednou HDPE nádobkou obsahujúcou molekulárne sitkové vysúšadlo.
Priesvitný, termoformovateľný, polychlorotrifluoroetylénový (PCTFE) blister s tepelne uzatvárateľnou, papierom laminovanou fóliou v škatuli obsahujúcej 28 filmom obalených tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomPacientov treba poučiť, aby nádobku s vysúšadlom nechali vo fľaši a aby vysúšadlo neprehĺtali. Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIITakeda Pharma A/S Dybendal Alle 10
2630 Taastrup
Dánsko
8. REGISTRAČNÉ ČÍSLAAlunbrig 30 mg filmomobalenétabletyEU/1/18/1264/001 60 tabliet vo fľaši
EU/1/18/1264/002 120 tabliet vo fľaši
EU/1/18/1264/003 56 tabliet v škatuli
EU/1/18/1264/004 112 tabliet v škatuli
Alunbrig 90 mg filmom obalené tabletyEU/1/18/1264/005 7 tabliet vo fľaši
EU/1/18/1264/006 30 tabliet vo fľaši
EU/1/18/1264/007 7 tabliet v škatuli
EU/1/18/1264/008 28 tabliet v škatuli
Alunbrig 180 mgfilmomobalenétabletyEU/1/18/1264/009 30 tabliet vo fľaši
EU/1/18/1264/010 28 tabliet v škatuli
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.