
>
Liek AJOVY je určený len na subkutánnu injekciu. Nesmie sa podávať intravenóznou ani intramuskulárnou cestou. Liek AJOVY sa môže podávať injekčne do oblastí brucha, stehna alebo ramena, ktoré nie sú citlivé, s podliatinami, sčervenané alebo podráždené. Pre viaceré injekcie sa majú miesta podania injekcie striedať.
Pacienti si môžu podávať injekciu sami, ak boli poučení o technike subkutánneho samoinjikovania zdravotníckym pracovníkom. Ďalšie pokyny na podávanie, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Sledovateľnosť
Na zlepšenie sledovateľnosti biologických liekov sa má jasne zaznamenať názov a číslo šarže
podávaného lieku.
Precitlivenosť
Pre fremanezumab sa v klinických skúšaniach hlásili reakcie z precitlivenosti u menej ako 1 %
pacientov. Ak sa vyskytne reakcia z precitlivenosti, má sa zvážiť ukončenie podávania fremanezumabu a začať príslušná liečba.
Závažné kardiovaskulárne ochorenia
Pacienti s určitými závažnými kardiovaskulárnymi ochoreniami boli vylúčení z klinických štúdií
(pozri časť 5.1). Pre týchto pacientov nie sú k dispozícii žiadne údaje o bezpečnosti.
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t. j. v podstate zanedbateľné
množstvo sodíka.
4.5 Liekové a iné interakcie
S liekom AJOVY sa neuskutočnili žiadne formálne klinické interakčné štúdie. Podľa charakteristík fremanezumabu sa neočakávajú žiadne farmakokinetické liekové interakcie. Okrem toho, súbežné používanie iných typov liečby akútnej migrény (špecificky analgetík, ergotov a triptánov)
a preventívnych liekov na migrénu nemalo počas klinických štúdií žiadny vplyv na farmakokinetiku
fremanezumabu.
4.6 Fertilita, gravidita a laktácia
Gravidita
K dispozícii je iba obmedzené množstvo údajov o použití lieku AJOVY u gravidných žien. Štúdie na
zvieratách nepreukázali priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej toxicity (pozri časť 5.3). Ako preventívne opatrenie je vhodnejšie vyhnúť sa používaniu lieku AJOVY počas gravidity.
Dojčenie
Nie je známe, či sa fremanezumab vylučuje do ľudského mlieka. Je známe, že sa ľudský IgG vylučuje
do materského mlieka počas prvých dní po pôrode a skoro potom klesá na nízke koncentrácie. Preto riziko u dojčených detí v tomto krátkom období nemôže byť vylúčené. Potom sa má o použití fremanezumabu počas dojčenia uvažovať len vtedy, keď je to klinicky potrebné.
Fertilita
Nie sú dostupné žiadne údaje týkajúce sa fertility u ľudí. Dostupné predklinické údaje nenaznačujú
žiadny účinok na fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek AJOVY nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať
stroje.
4.8 Nežiaduce účinky
Zhrnutie bezpečnostného profilu
Celkom viac ako 2 500 pacientov (viac ako 1 900 pacientorokov) sa v registračných štúdiách liečilo
liekom AJOVY. Viac ako 1 400 pacientov sa liečilo najmenej 12 mesiacov.
Často hlásené nežiaduce liekové reakcie boli lokálne reakcie v mieste podania injekcie (bolesť [24 %], stvrdnutie [17 %], erytém [16 %] a pruritus [2 %]).
Tabuľkový zoznamnežiaducichreakcií
Nežiaduce liekové reakcie z klinických štúdií sú uvedené podľa klasifikácie orgánových systémov
MedDRA. Nežiaduce liekové reakcie sú v rámci každej triedy orgánových systémov zoradené podľa frekvencie, s najčastejšie sa vyskytujúcimi reakciami uvedenými na prvom mieste. V každej skupine frekvencií sú nežiaduce liekové reakcie zoradené podľa klesajúcej závažnosti. Kategórie frekvencie výskytu sa zakladajú na nasledujúcej konvencii: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000).
V klinickom vývojovom programe lieku AJOVY sa identifikovali nasledujúce nežiaduce liekové
reakcie (tabuľka 1).
Tabuľka 1: Nežiaduce reakcie v klinických štúdiách
T
rieda orgánových systémov podľa klasifikácie MedDRA
C
elkové poruchy a reakcie
v mieste podania
F
r
ekvencia Nežiaduca reakcia
Veľmi časté Bolesť v mieste podania injekcie Stvrdnutie v mieste podania injekcie
Erytém v mieste podania injekcie Časté Pruritus v mieste podania injekcie Menej časté Vyrážka v mieste podania injekcie
 Popis vybraných nežiaducich reakcií
R
eakcie v mieste podania injekcie
Popis vybraných nežiaducich reakcií
R
eakcie v mieste podania injekcie
Najčastejšie pozorované lokálne reakcie v mieste podania injekcie boli bolesť, stvrdnutie a erytém. Všetky lokálne reakcie v mieste podania injekcie boli prechodné a prevažne mierne až stredne závažné. Bolesť, stvrdnutie a erytém sa zvyčajne pozorovali hneď po podaní injekcie, zatiaľ čo pruritus a vyrážka sa objavili do mediánu 24 a 48 hodín, v uvedenom poradí. Všetky reakcie v mieste podania injekcie vymizli, a to väčšinou do niekoľkých hodín alebo dní. Reakcie v mieste podania injekcie vo všeobecnosti nevyžadovali prerušenie podávania lieku.
ImunogenitaV placebom kontrolovaných štúdiách sa u 0,4 % pacientov (6 z 1 701) liečených fremanezumabom vyvinuli protilátky proti lieku. Protilátkové odpovede mali nízky titer. U jedného z týchto 6 pacientov sa vyvinuli neutralizačné protilátky. Do dnešného dňa ukončilo 1 494 pacientov 12 mesiacov liečby fremanezumabom v prebiehajúcej dlhodobej štúdii 3. Protilátky proti lieku sa zaznamenali
u 2 % pacientov (38 z 1 888). Bezpečnosť a účinnosť fremanezumabu neboli ovplyvnené rozvojom
protilátok proti lieku.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieV klinických skúšaniach sa podávali intravenózne dávky až 2 000 mg bez toxicity limitujúcej dávku. V prípade predávkovania sa odporúča pacienta sledovať ohľadne akýchkoľvek prejavov alebo príznakov nežiaducich účinkov a ak je to potrebné, podať vhodnú symptomatickú liečbu.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Zatiaľ nepridelená. ATC kód: Zatiaľ nepridelený.
Mechanizmus účinkuFremanezumab je humanizovaná IgG2Δa/kappa monoklonálna protilátka odvodená z myšieho
prekurzora. Fremanezumab sa selektívne viaže na ligand peptidu súvisiaceho s génom kalcitonínu
(
Calcitonin Gene-Related Peptide, CGRP) a blokuje väzbu oboch izoforiem CGRP (α-a β-CGRP) na receptor CGRP. Zatiaľ čo presný mechanizmus účinku, ktorým fremanezumab zabraňuje záchvatom
migrény nie je známy, predpokladá sa, že prevencia migrény sa dosahuje jeho modulačným účinkom
na trigeminálny systém. Preukázalo sa, že hladiny CGRP sa počas migrény významne zvyšujú a vracajú sa na normálnu hodnotu po utíšení bolesti hlavy.
Fremanezumab je vysoko špecifický pre CGRP a neviaže sa na blízke členy tejto skupiny (napr.
amylín, kalcitonín, intermedín a adrenomedulín).
Klinická účinnosť abezpečnosť
Účinnosť fremanezumabu sa hodnotila v dvoch randomizovaných, 12-týždňových, dvojito
zaslepených, placebom kontrolovaných štúdiách fázy III u dospelých pacientov s epizodickou
(štúdia 1) a chronickou migrénou (štúdia 2). Zaradení pacienti mali migrénu (s aurou alebo bez aury)
v anamnéze aspoň 12 mesiacov podľa diagnostických kritérií medzinárodnej klasifikácie ochorení
bolesti hlavy (International Classification of Headache Disorders, ICHD-III). Starší pacienti
(> 70 rokov), pacienti používajúci opioidy alebo barbituráty viac ako 4 dni za mesiac a pacienti
s infarktom myokardu, cerebrovaskulárnou príhodou a tromboembolickou príhodou v anamnéze boli
vylúčení.
Štúdia epizodickej migrény (štúdia 1)
Účinnosť fremanezumabu pri epizodickej migréne sa hodnotila v randomizovanej, multicentrickej,
12-týždňovej, placebom kontrolovanej, dvojito zaslepenej štúdii (štúdia 1). Do tejto štúdie boli zaradení dospelí s epizodickou migrénou (menej ako 15 udalostí bolesti hlavy za mesiac) v anamnéze. Celkom 875 pacientov (742 žien, 133 mužov) bolo randomizovaných do jednej z troch skupín: 675 mg fremanezumabu každé tri mesiace (štvrťročne, n = 291), 225 mg fremanezumabu jedenkrát za mesiac (mesačne, n = 290) alebo mesačné podávanie placeba (n = 294) podávaných subkutánnou injekciou. Demografické charakteristiky a základné charakteristiky ochorenia boli medzi študijnými skupinami vyrovnané a porovnateľné. Medián veku pacientov bol 42 rokov (rozsah: 18 až 70 rokov), 85 % bolo žien a 80 % bolo belochov. Priemerná počiatočná frekvencia migrény bola približne 9 dní s migrénou za mesiac. Pacientom bolo počas štúdie povolené používanie liečby akútnej bolesti hlavy. Podskupine pacientov (21 %) bolo tiež povolené používať jeden bežne používaný, súbežný, preventívny liek (beta- blokátory, blokátor vápnikového kanála/benzocykloheptán, antidepresíva, antikonvulzíva). Celkovo
19 % pacientov predtým používalo topiramát. Celkom 791 pacientov ukončilo 12-týždňové, dvojito
zaslepené liečebné obdobie.
Primárnym koncovým ukazovateľom účinnosti bola priemerná zmena priemerného počtu dní
s migrénou za mesiac počas 12-týždňového liečebného obdobia oproti priemernému počtu dní
s migrénou za mesiac pri počiatočnom stave. Kľúčovými sekundárnymi koncovými ukazovateľmi boli
dosiahnutie najmenej 50 % zníženia počtu dní s migrénou za mesiac (50 % podiel pacientov reagujúcich na liečbu) oproti počiatočnému stavu, priemerná zmena skóre MIDAS hláseného pacientom oproti počiatočnému stavu a zmena priemerného počtu dní s používaním lieku na akútnu bolesť hlavy za mesiac oproti počiatočnému stavu. Pre oba, mesačný aj štvrťročný dávkovací režim fremanezumabu, sa preukázalo štatisticky a klinicky významné zlepšenie oproti počiatočnému stavu
v porovnaní s kľúčovými koncovými ukazovateľmi placeba (pozri tabuľku 2). Účinok sa tiež dostavil
už prvý mesiac a udržal sa počas celého obdobia liečby (pozri obrázok 1).
O
brázok 1: Priemerná zmena priemerného počtu dní s migrénou za mesiac oproti počiatočnej
hodnote v štúdii 1
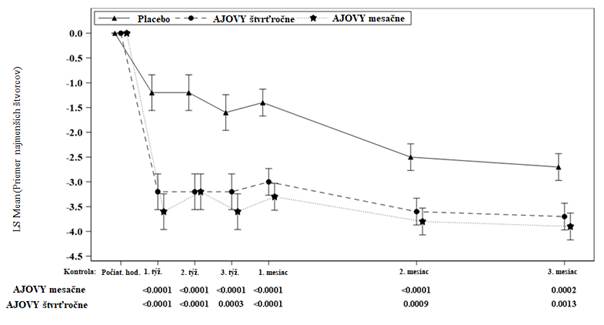
Priemerná hodnota v počiatočnom stave (priemerný počet dní s migrénou za mesiac): Placebo: 9,1, AJOVY
štvrťročne 9,2, AJOVY mesačne 8,9.
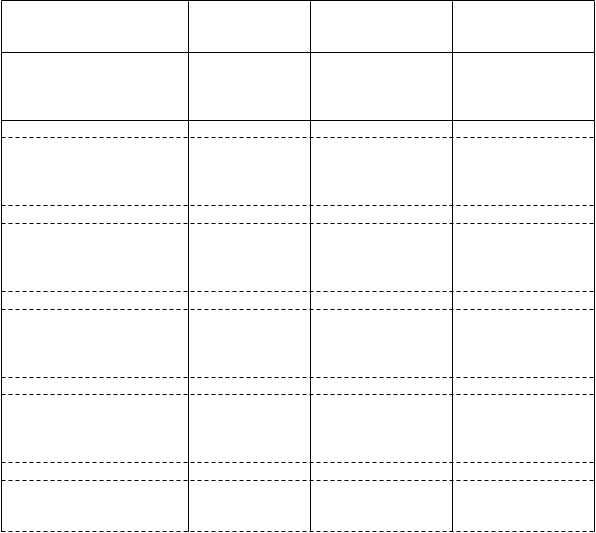
Tabuľka 2: Kľúčové výsledky účinnosti v štúdii 1 epizodickej migrény
K
oncový ukazovateľ účinnosti
MMD
Priemerná zmenaa (95 % IS) TD (95 % IS)b
Počiatočný stav (SD)
Placebo
(n = 290)
-2,2 (-2,68; -1,71)
-
9,1 (2,65)
Fremanezumab
675 mg štvrťročne
(n = 288)
-3,4 (-3,94; -2,96)
-1,2 (-1,74; -0,69)
9,2 (2,62)
Fremanezumab
225 mg mesačne
(n = 287)
-3,7 (-4,15; -3,18)
-1,4 (-1,96; -0,90)
8,9 (2,63)
H
odnota p (oproti placebu)
a
- p < 0,0001 p < 0,0001
MHD
Priemerná zmenaa (95 % IS) TD (95 % IS)b
Počiatočný stav (SD)
-1,5 (-1,88; -1,06)
-
6,9 (3,13)
-3,0 (-3,39; -2,55)
-1,5 (-1,95; -1,02)
7,2 (3,14)
-2,9 (-3,34; -2,51)
-1,5 (-1,92; -0,99)
6,8 (2,90)
H
odnota p (oproti placebu)
a
- p < 0,0001 p < 0,0001
50 % podiel pacientov
reagujúcich na liečbu
MMD
Percentá [%]
27,9 % 44,4 % 47,7 %
H
odnota p (oproti placebu) - p < 0,0001 p < 0,0001
75 % podiel pacientov
reagujúcich na liečbu
MMD
Percentá [%]
9,7 % 18,4 % 18,5 %
H
odnota p (oproti placebu) - p = 0,0025 p = 0,0023
C
elkové skóre MIDAS
Priemerná zmenaa (95 % IS)
Počiatočný stav (SD)
-17,5 (-20,62;
-14,47)
37,3 (27,75)
-23,0 (-26,10;
-19,82)
41,7 (33,09)
-24,6 (-27,68;
-21,45)
38 (33,30)
H
odnota p (oproti placebu)
a
- p = 0,0023 p < 0,0001
MAHMD
Priemerná zmenaa (95 % IS) TD (95 % IS)b
-1,6 (-2,04; -1,20)
-
-2,9 (-3,34; -2,48)
-1,3 (-1,73; -0,78)
-3,0 (-3,41; -2,56)
-1,3 (-1,81; -0,86)

Počiatočná hodnota (SD) 7,7 (3,60) 7,7 (3,70) 7,7 (3,37)
Hodnota p (oproti placebu)a - p < 0,0001 p < 0,0001IS = interval spoľahlivosti, MAHMD = počet dní s používaním liečby akútnej bolesti hlavy (
Monthly Acute Headache Medication Days), MHD = počet dní s bolesťou hlavy aspoň strednej závažnosti za mesiac (
Monthly Headache Days), MIDAS = hodnotenie postihnutia spôsobeného migrénou (
Migraine Disability Assessment), MMD = počet dní s migrénou za mesiac (
Monthly Migraine Days), SD = smerodajná odchýlka (
Standard Deviation), TD = rozdiel medzi liečbami (
Treatment Difference)
a Pre všetky koncové ukazovatele sa priemerná zmena a hodnoty IS zakladajú na modeli ANCOVA, ktorý
zahŕňal liečbu, pohlavie, región a používanie základnej preventívnej liečby (áno/nie) ako fixné efekty a zodpovedajúce počiatočné hodnoty a počet rokov od začatia migrény ako kovariáty.
b Rozdiel medzi liečbami sa zakladá na analýze MMRM s liečbou, pohlavím, regiónom a používaním základnej
preventívnej liečby (áno/nie), mesiacom a mesiacom liečby ako fixné efekty a zodpovedajúcimi počiatočnými
hodnotami a počtom rokov od začatia migrény ako kovariátmi.
U pacientov používajúcich jeden ďalší súbežne podávaný preventívny liek na migrénu bol pozorovaný rozdiel v znížení dní s migrénou za mesiac (MMD) medzi liečbou fremanezumabom 675 mg štvrťročne a placebom -1,8 dňa (95 % IS:-2,95; -0,55) a medzi liečbou fremanezumabom 225 mg mesačne a placebom -2,0 dňa (95 % IS: -3,21; -0,86).
U pacientov, ktorí predtým používali topiramát, bol pozorovaný rozdiel v znížení dní s migrénou za
mesiac (MMD) medzi liečbou fremanezumabom 675 mg štvrťročne a placebom -2,3 dňa
(95 % IS: -3,64; -1,00) a medzi liečbou fremanezumabom 225 mg mesačne a placebom -2,4 dňa
(95 % IS: -3,61; -1,13).
Štúdia chronickej migrény (štúdia 2)Fremanezumab sa hodnotil pri chronickej migréne v randomizovanej, multicentrickej, 12-týždňovej,
placebom kontrolovanej, dvojito zaslepenej štúdii (štúdia 2). Populácia štúdie zahŕňala dospelých
s chronickou migrénou v anamnéze (15 alebo viac dní s bolesťou hlavy za mesiac). Celkom
1 130 pacientov (991 žien, 139 mužov) bolo randomizovaných do jednej z troch skupín: začiatočná dávka 675 mg fremanezumabu, po ktorej nasledovalo 225 mg fremanezumabu jedenkrát za mesiac (mesačne, n = 379), 675 mg fremanezumabu každé tri mesiace (štvrťročne, n = 376) alebo mesačné podávanie placeba (n = 375) podávaných subkutánnou injekciou. Demografické charakteristiky
a základné charakteristiky ochorenia boli medzi študijnými skupinami vyrovnané a porovnateľné.
Medián veku pacientov bol 41 rokov (rozsah: 18 až 70 rokov), 88 % bolo žien a 79 % bolo belochov.
Priemerná počiatočná frekvencia bolesti hlavy bola približne 21 dní s bolesťou hlavy za mesiac
(z čoho 13 dní s bolesťou hlavy bolo aspoň strednej závažnosti). Pacientom bolo počas štúdie povolené používanie liečby akútnej bolesti hlavy. Podskupine pacientov (21 %) bolo tiež povolené
používať jeden bežne používaný, súbežný, preventívny liek (beta-blokátory, blokátory vápnikového
kanála/benzocykloheptány, antidepresíva, antikonvulzíva). Celkovo 30 % pacientov predtým používalo topiramát a 15 % onabotulinumtoxín A. Celkom 1 034 pacientov ukončilo 12-týždňové, dvojito zaslepené liečebné obdobie.
Primárnym koncovým ukazovateľom účinnosti bola priemerná zmena priemerného počtu dní
s bolesťou hlavy aspoň strednej závažnosti za mesiac počas 12-týždňového liečebného obdobia oproti
počiatočnému stavu. Kľúčovými sekundárnymi koncovými ukazovateľmi boli dosiahnutie najmenej
50 % zníženia počtu dní s bolesťou hlavy aspoň strednej závažnosti za mesiac (50 % podiel pacientov reagujúcich na liečbu) oproti počiatočnému stavu, priemerná zmena skóre HIT-6 hláseného pacientom oproti počiatočnému stavu a zmena priemerného počtu dní s používaním lieku na akútnu bolesť hlavy za mesiac oproti počiatočnému stavu. Pre oba, mesačný aj štvrťročný dávkovací režim fremanezumabu, sa preukázalo štatisticky a klinicky významné zlepšenie oproti počiatočnému stavu
v porovnaní s kľúčovými koncovými ukazovateľmi placeba (pozri tabuľku 3). Účinok sa tiež dostavil
už prvý mesiac a udržal sa počas obdobia liečby (pozri obrázok 2).
O
brázok 2: Priemerná zmena priemerného počtu dní s bolesťou hlavy aspoň strednej závažnosti
z
a mesiac oproti počiatočnej hodnote v štúdii 2
Priemerná počiatočná hodnota (priemerný počet dní s bolesťou hlavy aspoň strednej závažnosti za mesiac):
Placebo: 13,3, AJOVY štvrťročne: 13,2, AJOVY mesačne: 12,8.
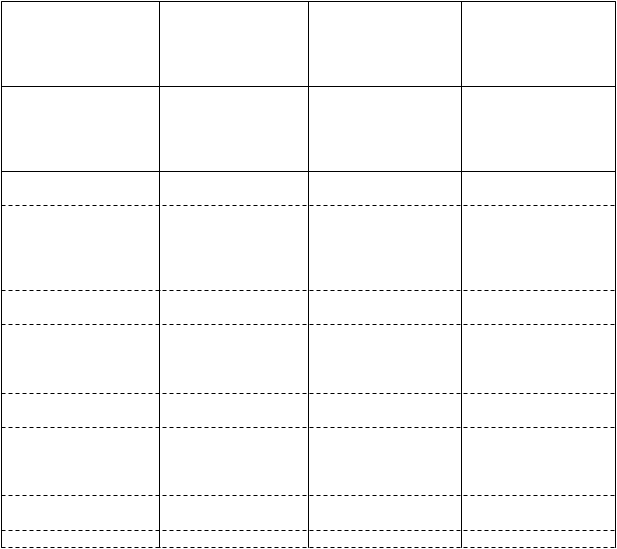
Tabuľka 3: Kľúčové výsledky účinnosti v štúdii 2 chronickej migrény
K
oncový ukazovateľ účinnosti
MHD
Priemerná zmenaa
(95 % IS)
TD (95 % IS)b
Počiatočný stav (SD)
Hodnota p (oproti
Placebo
(n = 371)
-2,5 (-3,06; -1,85)
-
13,3 (5,80)
Fremanezumab
675 mg štvrťročne
(n = 375)
-4,3 (-4,87; -3,66)
-1,8 (-2,45; -1,13)
13,2 (5,45)
Fremanezumab
225 mg mesačne so začiatočnou dávkou
675 mg
(n = 375)
-4,6 (-5,16; -3,97)
-2,1 (-2,77; -1,46)
12,8 (5,79)
placebu)
a
- p < 0,0001 p < 0,0001
MMD
Priemerná zmenaa
(95 % IS)
TD (95 % IS)b
Počiatočný stav (SD)
Hodnota p (oproti
-3,2 (-3,86; -2,47)
-
16,3 (5,13)
-4,9 (-5,59; -4,20)
-1,7 (-2,44; -0,92)
16,2 (4,87)
-5,0 (-5,70; -4,33)
-1,9 (-2,61; -1,09)
16,0 (5,20)
 placebu)
a
- p < 0,0001 p < 0,0001
50 % podiel pacientov reagujúcich na liečbu MHD
placebu)
a
- p < 0,0001 p < 0,0001
50 % podiel pacientov reagujúcich na liečbu MHD
Percentá [%] 18,1 % 37,6 % 40,8 %
Hodnota p (oprotiplacebu) - p < 0,0001 p < 0,000175 % podiel pacientov reagujúcich na liečbu MHDPercentá [%] 7,0 % 14,7 % 15,2 %
Hodnota p (oprotiplacebu) p = 0,0008 p = 0,0003Celkové skóre HIT-6
Priemerná zmenaa
(95 % IS)
Počiatočný stav (SD)
Hodnota p (oproti'
-4,5 (-5,38; -3,60)
64,1 (4,79)
-6,4 (-7,31; -5,52)
64,3 (4,75)
-6,7 (-7,71; -5,97)
64,6 (4,43)
placebu)
a
- p = 0,0001 p < 0,0001
MAHMD
Priemerná zmenaa
(95 % IS)
TD (95 % IS)b
Počiatočný stav (SD)
Hodnota p (oproti
-1,9 (-2,48; -1,28)
-
13,0 (6,89)
-3,7 (-4,25; -3,06)
-1,7 (-2,40; -1,09)
13,1 (6,79)
-4,2 (-4,79; -3,61)
-2,3 (-2,95; -1,64)
13,1 (7,22)
 placebu)
a
- p < 0,0001 p < 0,0001
placebu)
a
- p < 0,0001 p < 0,0001
IS = interval spoľahlivosti, HIT-6 = Test postihnutia spôsobeného bolesťou hlavy (
Headache Impact Test), MAHMD = počet dní s používaním liečby akútnej bolesti hlavy, MHD = počet dní s bolesťou hlavy aspoň strednej závažnosti za mesiac, MMD = počet dní s migrénou za mesiac, SD = smerodajná odchýlka, TD = rozdiel medzi liečbami
a Pre všetky koncové ukazovatele sa priemerná zmena a hodnoty IS zakladajú na modeli ANCOVA, ktorý
zahŕňal liečbu, pohlavie, región a používanie základnej preventívnej liečby (áno/nie) ako fixné efekty a zodpovedajúce počiatočné hodnoty a počet rokov od začatia migrény ako kovariáty.
b Rozdiel medzi liečbami sa zakladá na analýze MMRM s liečbou, pohlavím, regiónom a používaním základnej preventívnej liečby (áno/nie), mesiacom a mesiacom liečby ako fixné efekty a zodpovedajúcimi počiatočnými hodnotami a počtom rokov od začatia migrény ako kovariátmi.
U pacientov používajúcich jeden ďalší súbežne podávaný preventívny liek na migrénu bol pozorovaný rozdiel v znížení dní s bolesťou hlavy (MHD) aspoň strednej závažnosti za mesiac medzi liečbou fremanezumabom 675 mg štvrťročne a placebom -1,3 dňa (95 % IS:-2,66; -0,03) a medzi liečbou fremanezumabom 225 mg mesačne so začiatočnou dávkou 675 mg a placebom -2,0 dňa
(95 % IS: -3,27; -0,67).
U pacientov, ktorí predtým používali topiramát, bol pozorovaný rozdiel v znížení dní s bolesťou hlavy
(MHD) aspoň strednej závažnosti za mesiac medzi liečbou fremanezumabom 675 mg štvrťročne
a placebom -2,7 dňa (95 % IS: -3,88; -1,51) a medzi liečbou fremanezumabom 225 mg mesačne so začiatočnou dávkou 675 mg a placebom -2,9 dňa (95 % IS: -4,10; -1,78). U pacientov, ktorí predtým
používali onabotulinumtoxín A, bol pozorovaný rozdiel v znížení dní s bolesťou hlavy (MHD) aspoň
strednej závažnosti za mesiac medzi liečbou fremanezumabom 675 mg štvrťročne a placebom -1,3 dňa
(95 % IS: -3,01; -0,37) a medzi liečbou fremanezumabom 225 mg mesačne so začiatočnou dávkou
675 mg a placebom -2,0 dňa (95 % IS: -3,84; -0,22).
Približne 52 % pacientov v štúdii nadmerne užívalo lieky na akútnu bolesť hlavy. Bol pozorovaný rozdiel v znížení dní s bolesťou hlavy (MHD) aspoň strednej závažnosti za mesiac medzi liečbou fremanezumabom 675 mg štvrťročne a placebom u týchto pacientov -2,2 dňa (95 % IS: -3,14; -1,22) a medzi liečbou fremanezumabom 225 mg mesačne so začiatočnou dávkou 675 mg
a placebom -2,7 dňa (95 % IS: -3,71; -1,78).
Dlhodobá štúdia (štúdia 3)U všetkých pacientov s epizodickou a chronickou migrénou sa účinnosť udržala aj počas ďalších
12 mesiacov v dlhodobej štúdii (štúdia 3), v ktorej pacienti dostávali 225 mg fremanezumabu mesačne
alebo 675 mg štvrťročne. 79 % pacientov ukončilo 12-mesačné liečebné obdobie štúdie 3. Súhrnne v rámci oboch dávkovacích režimov sa pozorovalo zníženie o 6,6 dňa s migrénou za mesiac po
15 mesiacoch pri porovnaní s počiatočnou hodnotou štúdie 1 a štúdie 2. 61 % pacientov, ktorí ukončili
štúdiu 3, dosiahlo 50 % odpoveď v poslednom mesiaci štúdie. Počas 15-mesačného kombinovaného liečebného obdobia sa nepozoroval žiadny bezpečnostný signál.
Vnútorné a vonkajšie faktoryÚčinnosť a bezpečnosť fremanezumabu sa preukázali nezávisle od veku, pohlavia, rasy, používania súbežných preventívnych liekov (beta-blokátory, blokátor vápnikového kanála/benzocykloheptán,
antidepresíva, antikonvulzíva), používania topiramátu alebo onabotulinumtoxínu A na migrénu v minulosti a nadmerného používania liekov na akútnu bolesť hlavy v minulosti.
O používaní fremanezumabu u pacientov ≥ 65 rokov (2 % pacientov) je iba obmedzené množstvo údajov.
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s liekom AJOVY
v jednej alebo vo viacerých podskupinách pediatrickej populácie pre prevenciu bolesti hlavy spôsobenej migrénou (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Po jednorazovom subkutánnom podaní 225 mg a 675 mg fremanezumabu bol medián času do
dosiahnutia maximálnych koncentrácií (tmax) u zdravých jedincov 5 až 7 dní. Absolútna biologická
dostupnosť fremanezumabu po subkutánnom podaní 225 mg a 900 mg bola u zdravých jedincov 55 %
(±SD 23 %) až 66 % (±SD 26 %). Úmernosť dávky sa na základe populačných farmakokinetických
vlastností pozorovala medzi 225 mg až 675 mg. Ustálený stav sa dosiahol približne za 168 dní (asi
6 mesiacov) pri dávkovacích režimoch 225 mg mesačne a 675 mg štvrťročne. Medián pomeru
akumulácie na základe dávkovacích režimov jedenkrát mesačne a jedenkrát štvrťročne je približne 2,4
a 1,2, v uvedenom poradí.
Distribúcia
Predpokladajúc, že pre populáciu pacientov platí z modelu odvodená biologická dostupnosť 66 %
(±SD 26 %), distribučný objem pre typického pacienta bol po subkutánnom podaní 225 mg, 675 mg a 900 mg fremanezumabu 3,6 l (35,1 % VK).
Biotransformácia
Podobne ako pri iných monoklonálnych protilátkach sa pre fremanezumab očakáva, že sa bude
odbúravať enzymatickou proteolýzou na malé peptidy a aminokyseliny.
Eliminácia
Predpokladajúc, že pre populáciu pacientov platí z modelu odvodená biologická dostupnosť 66 %
(±SD 26 %), centrálny klírens pre typického pacienta bol po subkutánnom podaní 225 mg, 675 mg
a 900 mg fremanezumabu 0,09 l/deň (23,4 % VK). Vytvorené malé peptidy a aminokyseliny sa môžu
znova použiť v tele na de novo proteínovú syntézu alebo vylúčiť obličkami. Fremanezumab má odhadovaný biologický polčas 30 dní.
Osobitné skupiny pacientov
Populačná farmakokinetická analýza týkajúca sa veku, rasy, pohlavia a hmotnosti bola vykonaná na
údajoch od 2 546 jedincov. U štvrtiny populácie s najnižšou telesnou hmotnosťou (43,5 až 60,5 kg) sa
očakáva približne dvojnásobná expozícia v porovnaní so štvrtinou s najvyššou telesnou hmotnoťou
(84,4 až 131,8 kg). Telesná hmotnosť však nemala žiadny pozorovaný vplyv na klinickú účinnosť na základe analýz expozície-odpovede u pacientov s epizodickou a chronickou migrénou. Nevyžadujú sa žiadne úpravy dávky fremanezumabu. O vzťahu medzi expozíciou a účinnosťou u jedincov s telesnou hmotnosťou > 132 kg nie sú dostupné žiadne údaje.
Porucha funkcie obličiek alebo pečene
Keďže pre monoklonálne protilátky nie je známe, že by sa vylučovali renálnou cestou alebo
metabolizovali v pečeni, pri poruchách funkcie obličiek a pečene sa neočakáva vplyv na
farmakokinetické vlastnosti fremanezumabu. Pacienti so závažnou poruchou funkcie obličiek (eGFR
< 30 ml/min/1,73 m2) neboli v štúdiách zaradení. Populačná farmakokinetická analýza integrovaných
údajov z klinických štúdií lieku AJOVY neodhalili rozdiel medzi farmakokinetickými vlastnosťami
fremanezumabu u pacientov s miernymi až stredne závažnými poruchami funkcie obličiek alebo pečene a pacientov s normálnou funkciou obličiek alebo pečene (pozri časť 4.2).
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po
opakovanom podávaní, reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
Keďže fremanezumab je monoklonálna protilátka, neboli vykonané žiadne štúdie genotoxicity ani karcinogenocity.
6. FARMACEUTICKÉ ÚDAJE
6.1 Zoznam pomocných látok
L-histidín,
monohydrát L-histidíniumhydrochloridu, sacharóza,
dihydrát disodnej soli kyseliny etyléndiamíntetraoctovej (EDTA),
polysorbát 80, voda na injekcie.
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Naplnenú(-é) injekčnú(-é) striekačku(-y) uchovávajte vo vonkajšej škatuli na ochranu pred svetlom.
Liek AJOVY sa môže uchovávať nechladený až 24 hodín pri teplote do 25 °C. Liek AJOVY sa musí
zlikvidovať, ak bol mimo chladničky dlhšie ako 24 hodín.
6.5 Druh obalu a obsah balenia
1,5 ml roztoku v 2,25 ml striekačke zo skla typu I s piestovou zátkou (brómbutylová guma) a ihlou.
Veľkosť balenia je 1 alebo 3 naplnené injekčné striekačky. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pokyny na použitie
Podrobné pokyny na použitie uvedené na konci písomnej informácie pre používateľa sa musia krok za
krokom prísne dodržiavať.
Naplnená injekčná striekačka je určená len na jednorazové použitie.
Liek AJOVY sa nesmie použiť, ak je roztok zakalený alebo sfarbený alebo obsahuje častice.
Liek AJOVY sa nesmie použiť, ak bol roztok zmrazený. Naplnenou injekčnou striekačkou sa nesmie triasť.
LikvidáciaVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIITEVA GmbH Graf-Arco-Str. 3
89079 Ulm
Nemecko
8. REGISTRAČNÉ ČÍSLAEU/1/19/1358/001
EU/1/19/1358/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: {DD. mesiac RRRR}
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.