nosť na ktorúkoľvek z pomocných látok (úplný zoznam pomocných látok, pozri časť 6.1).
Pacienti s predpokladanou hodnotou FEV
1 < 70 % (po adekvátnej farmakologickej liečbe) na začiatku liečby.
Pacienti, u ktorých sa počas posledných 3 mesiacov objavilo závažné zhoršenie astmy.
U pacientov s astmou a s prítomnosťou akútnej infekcie dýchacích ciest, sa má liečba liekom ACARIZAX oddialiť dovtedy, kým sa infekcia nevylieči.
Pacienti s aktívnym alebo nedostatočne kontrolovanými autoimunitnými ochoreniami, poruchami imunitného systému, imunodeficienciami, imunosupresiou alebo malígnymi neoplastickými ochoreniami so závažným stavom ochorenia v súčasnosti.
Pacienti s akútnym závažným zápalom v ústach alebo rankami v ústach (pozri časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaníAstmaAstma je známym rizikovým faktorom pre závažné systémové alergické reakcie.
Pacientov je potrebné poučiť, že ACARIZAX nie je určený na liečbu akútnych zhoršení liečby. V prípade akútneho zhoršenia astmy sa má použiť krátkodobo účinkujúce bronchodilatans. Ak pacient považuje liečbu krátkodobo účinkujúcim bronchodilatanciom za neúčinnú alebo ak potrebuje viac vdychov ako zvyčajne, musí sa vyhľadať lekárska pomoc.
Pacient musí byť informovaný o potrebe vyhľadať okamžitú lekársku pomoc, ak sa jeho astma náhle zhorší.
ACARIZAX sa má na začiatku užívať ako doplnok k liečbe a nemá sa používať ako náhrada predtým užívaného lieku na astmu. Náhle vysadenie lieku na kontrolu astmy po začatí liečby liekom ACARIZAX sa neodporúča. Zníženia dávky lieku na kontrolu astmy sa majú vykonať postupne pod dohľadom lekára na základe usmernení pre liečbu astmy.
Závažné systémové alergické reakcie V prípade výskytu závažných systémových alergických reakcií, závažného zhoršenia astmy, ťažkostí s prehĺtaním, ťažkostí s dýchaním, zmien hlasu, hypotenzie alebo pocitu plnosti v hrdle sa má liečba vysadiť a okamžite kontaktovať lekár. Výskyt systémových príznakov môže zahŕňať sčervenanie, svrbenie, pocit tepla, celkovo nepríjemný pocit a rozrušenie/úzkosť.
Jednou z možností liečby závažných systémových alergických reakcií je podanie adrenalínu. Účinky adrenalínu môžu byť zosilnené u pacientov liečených tricyklickými antidepresívami, inhibítormi monoamínoxidázy (IMAO) a/alebo inhibítormi COMT s možnými smrteľnými následkami. Účinky adrenalínu môžu byť oslabené u pacientov liečených betablokátormi.
V prípade výskytu systémových alergických reakcií sa zvýšené riziko môže vyskytovať u pacientov s ochorením srdca. Klinické skúsenosti s liečbou liekom ACARIZAX u pacientov s ochorením srdca sú obmedzené. Pred začiatkom imunologickej liečby alergie sa má toto zvážiť.
Začiatok liečby liekom ACARIZAX sa má starostlivo zvážiť u pacientov, u ktorých sa v minulosti objavila systémová alergická reakcia na subkutánne podávanú imunologickú liečbu roztočmi domáceho prachu a k dispozícii majú byť opatrenia na liečbu možných reakcií. Je to na základe postmarketingových skúseností príslušnej sublinguálnej tablety na imunologickú liečbu alergií vyvolaných peľom tráv, ktoré naznačujú, že sa riziko výskytu závažnej alergickej reakcie môže zvýšiť u pacientov, u ktorých sa v minulosti objavila systémová alergická reakcia na imunologickú liečbu alergie vyvolanej peľom tráv.
Zápal v ústachU pacientov so závažným zápalom v ústach (napr. orálny lichen planus, vriedky alebo afty v ústach), rankami v ústach alebo po chirurgickom zákroku v ústach vrátane extrakcie zuba alebo po vypadnutí zuba, sa má liečba liekom ACARIZAX oddialiť a prebiehajúca liečba sa má dočasne vysadiť, aby došlo k zahojeniu ústnej dutiny.
Lokálne alergické reakcie Pri liečbe liekom ACARIZAX je pacient vystavený alergénu, ktorý vyvoláva príznaky alergie. Počas obdobia liečby sa preto očakáva výskyt lokálnych alergických reakcií. Tieto reakcie sú zvyčajne mierne až stredne závažné, môžu sa objaviť závažnejšie orofaryngeálne reakcie. Ak sa u pacienta objavia významné lokálne nežiaduce reakcie spôsobené liečbou, má sa zváži podanie lieku proti alergii (napr. antihistaminikum).
Eozinofilná ezofagitídaV súvislosti s liečbou liekom ACARIZAX sa hlásili ojedinelé prípady eozinofilnej ezofagitídy. U pacientov so závažnými alebo vopred prítomnými gastroezofageálnymi príznakmi, ako je napr. dysfágia alebo dyspepsia, sa musí vyhľadať lekárska pomoc.
Autoimunitné ochorenie v remisiiK dispozícii sú obmedzené údaje týkajúce sa liečby alergie imunologickou liečbou u pacientov s autoimunitnými ochoreniamia v remisii. ACARIZAX sa má preto u týchto pacientov predpisovať s opatrnosťou.
Alergia na potravinyACARIZAX môže obsahovať stopové množstvá bielkovín pochádzajúcich z rýb. Dostupné údaje nepoukazujú na zvýšené riziko alergických reakcií u pacientov s alergiou na ryby.
4.5 Liekové a iné interakcieNeuskutočnili sa žiadne interakčné štúdie u ľudí a v literatúre sa neidentifikovali žiadne možné liekové interakcie. Súbežná liečba symptomatickými liekmi proti alergii môže zvýšiť mieru znášanlivosti imunologickej liečby pacientom. Pri vysadzovaní takých liekov sa to má vziať do úvahy.
4.6 Fertilita, gravidita a laktáciaGraviditaNeexistujú žiadne údaje týkajúce sa klinických skúsenosti s používaním lieku ACARIZAX u gravidných žien. Štúdie na zvieratách nenaznačujú žiadne zvýšené riziko pre plod. Liečba liekom ACARIZAX sa počas gravidity nemá začínať. Ak počas liečby dôjde ku gravidite, v liečbe je možné pokračovať po vyhodnotení celkového stavu (vrátane funkcie pľúc) pacientky a reakcií na predchádzajúce podávanie lieku ACARIZAX. U pacientok s vopred prítomnou astmou sa počas gravidity odporúča pozorné sledovanie.
DojčenieNeexistujú žiadne dostupné údaje týkajúce sa používania lieku ACARIZAX počas laktácie. Neočakávajú sa však žiadne účinky na dojčenie dojčatá.
FertilitaNeexistujú žiadne klinické údaje s ohľadom na fertilitu pri používaní lieku ACARIZAX. V štúdiách toxicity opakovaných dávok u myší sa nepozorovali žiadne účinky na reprodukčné orgány oboch pohlaví.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeLiečba liekom ACARIZAX nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinkySúhrn profilu bezpečnostiU pacientov užívajúcich ACARIZAX sa má očakávať najmä výskyt miernych až stredne závažných alergických reakcií v rámci prvých niekoľkých dní a ich opätovné odoznenie pri pokračovaní v liečbe (1 - 3 mesiace) (pozri časť 4.4). Vo väčšine prípadov sa má nástup reakcie očakávať počas 5 minút po užití lieku ACARIZAX počas každého dňa výskytu a jej zoslabnutie po niekoľkých minútach až hodinách. Môžu sa objaviť závažnejšie orofaryngeálne alergické reakcie (pozri časť 4.4).
Boli zaznamenané ojedinelé prípady závažného akútneho zhoršenia príznakov astmy. Liečba liekom ACARIZAX sa nemá začínať u pacientov so známymi rizikovými faktormi (pozri časť 4.3).
Tabuľkový zoznam nežiaducich reakciíNasledujúca tabuľka nežiaducich reakcií vychádza z údajov z placebom kontrolovaných klinických skúšaní skúmajúcich liek ACARIZAX u dospelých pacientov s alergickou rinitídou a/alebo alergickou astmou vyvolanou roztočmi domáceho prachu.
Nežiaduce reakcie sú rozdelené do skupín podľa pravidla na určenie frekvencií ich výskytu podľa MedDRA: Veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000).
Trieda orgánových systémov
| Frekvencia
| Nežiaduca lieková reakcia
|
Infekcie a nákazy
| Veľmi časté
| nazofaringitída
|
Časté
| bronchitída, laryngitída, faryngitída, rinitída, sinusitída
|
Poruchy nervového systému
| Menej časté
| závrat, dysgeuzia
|
Poruchy oka
| Časté
| svrbenie oka
|
Poruchy ucha a labyrintu
| Časté
| svrbenie ucha
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| Veľmi časté
| podráždenie hrdla
|
Časté
| dysfónia, dyspnoe, orofaryngeálna bolesť, faryngeálny opuch
|
Menej časté
| laryngeálny opuch, nazálna kongescia, nepríjemný pocit v nose, upchatie nosa, rinorea, kýchanie, zovretie v hrdle
|
Poruchy gastrointestinálneho traktu
| Veľmi časté
| opuch úst, svrbenie úst
|
Časté
| bolesť brucha, hnačka, sucho v ústach, dysfágia, porucha trávenia, glosodýnia, opuch pier, svrbenie pier, svrbenie jazyka, nevoľnosť, nepríjemný pocit v ústach, parestézia úst, stomatitída, opuch jazyka
|
Menej časté
| glositída, tvorba vriedkov v ústach, podráždenie ezofágu, tvorba pľuzgierov na sliznici úst, erytém sliznice úst, vracanie
|
Celkové poruchy a reakcie v mieste podania
| Časté
| nepríjemný pocit v hrudníku
|
Menej časté
| únava, malátnosť, pocit cudzieho predmetu v tele
|
Poruchy kože a podkožného tkaniva
| Menej časté
| svrbenie
|
Popis vybraných nežiaducich reakciíAk sa u pacienta objavia významné nežiaduce reakcie spôsobené liečbou, má sa zváži podanie lieku proti alergii.
Pri príslušnej sublinguálnej tablete na liečbu alergie vyvolanej peľom tráv sa hlásili prípady systémových alergických reakcií a považujú sa za skupinový účinok. Dohľad lekára pri prvom užití perorálneho lyofilizátu preto predstavuje dôležité bezpečnostné opatrenie (pozri časť 4.2).
V prípade akútneho zhoršenia príznakov astmy alebo závažných systémových alergických reakcií, angioedému, ťažkostí s prehĺtaním, ťažkostí s dýchaním, zmien hlasu, hypotenzie alebo pocitu plnosti v hrdle sa má okamžite kontaktovať lekár. V takýchto prípadoch sa má liečba natrvalo vysadiť alebo sa má vysadiť dovtedy, kým určí lekár.
Hlásili sa ojedinelé prípady eozinofilnej ezofagitídy (pozri časť).
Pediatrická populáciaACARIZAX nie je indikovaný pacientom vo veku < 18 rokov (pozri časť 4.2). K dispozícii sú len obmedzené údaje týkajúce sa pacientov vo veku 5 - 17 rokov a neexistujú žiadne údaje týkajúce sa liečby liekom ACARIZAX u detí vo veku < 5 rokov.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.
4.9 PredávkovanieV štúdiách fázy I boli pacienti s alergiou vyvolanou roztočmi domáceho prachu vystavení dávkam až do 32 SQ-HDM.
Ak sa užívajú dávky, ktoré sú vyššie ako odporúčané dávky, riziko nežiaducich účinkov vrátane rizika systémových alergických reakcií alebo závažných lokálnych alergických reakcií sa zvyšuje. V prípade závažných reakcií ako je napr. angioedém, ťažkosti s prehĺtaním, ťažkosti s dýchaním, zmeny hlasu alebo pocit plnosti v hrdle, je potrebné okamžité posúdenie lekárom. Tieto reakcie sa majú liečiť príslušnými symptomatickými liekmi.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Extrakty alergénov, domáci prach, roztoče.
ATC kód: V01AA03
Mechanizmus účinkuACARIZAX je liek na imunologickú liečbu alergie. Imunologická liečba alergie liekmi obsahujúcimi alergény predstavuje opakované podávanie alergénov u jedincov s alergiou s cieľom zmeniť imunologickú odpoveď na alergén.
Cieľom farmakodynamického účinku imunologickej liečby alergie je imunitný systém, ale úplný a presný mechanizmu účinku týkajúci sa klinického účinku nie je úplne známy. Preukázalo sa, že liečba liekom ACARIZAX indukuje zvýšenie hladiny IgG
4 špecifického pre roztoče domáceho prachu a indukuje odpoveď systémových protilátok, ktoré môžu súperiť s IgE o väzbu na alergény roztočov domáceho prachu. Tento účinok sa pozoroval už po 4 týždňoch liečby.
ACARIZAX účinkuje tak, že sa zameriava na príčinu alergického ochorenia dýchacej sústavy vyvolaného roztočmi domáceho prachu a klinický účinok počas liečby sa preukázal pri horných a aj dolných dýchacích cestách. Základná ochrana, ktorú poskytuje ACARIZAX, vedie k zlepšeniu kontroly ochorenia a k zlepšeniu kvality života, ktoré sa prejaví zmiernením príznakov, zníženou potrebou iných liekov a znížením rizika zhoršenia stavu.
Klinická účinnosť a bezpečnosťÚčinnosť liečby liekom ACARIZAX 12 SQ-HDM pri alergickom ochorení vyvolanom roztočmi domáceho prachu bola skúmaná v dvoch dvojito zaslepených, randomizovaných, placebom kontrolovaných skúšaniach s rozdielnymi cieľovými ukazovateľmi a s rozdielnymi populáciami pacientov. Dve tretiny jedincov v skúšaní boli senzibilizované na viac alergénov ako len na roztoče domáceho prachu. Senzibilizácia len na roztoče domáceho prachu alebo na roztoče domáceho prachu a jeden alebo viacero iných alergénov nemala vplyv na výsledky skúšania. Uvedené sú tiež podporné dôkazy zo skúšania využívajúceho expozičné komôrky alergénu ako aj dôkazy zo skúšania vykonaného s nižšími dávkami.
Alergická rinitídaSkúšanie MERIT (MT-06)· Skúšanie MERIT zahŕňalo 992 dospelých so stredne závažnou až závažnou alergickou rinitídou vyvolanou roztočmi domáceho prachu napriek užívaniu farmakologickej liečby na rinitídu. Jedinci boli randomizovaní do skupiny s dennou liečbou 12 SQ-HDM, 6 SQ-HDM alebo placebom s trvaním približne 1 rok a bol im udelený voľný prístup k štandardizovanej farmakologickej liečbe rinitídy. Jedinci boli kontrolovaní špecialistom približne každé dva mesiace počas celého skúšania.
· Primárnym cieľovým ukazovateľom bolo priemerné denné celkové kombinované skóre rinitídy (
total combined rhinitis score, TCRS) vyhodnocované počas posledných 8 týždňov liečby.
o TCRS bolo súčtom skóre príznakov rinitídy a skóre liečby rinitídy. Pomocou skóre príznakov rinitídy sa denne na stupnici od 0 do 3 (neprítomné, mierne, stredne závažné, závažné príznaky) vyhodnocovali 4 nazálne príznaky (nádcha, upchatý nos, svrbenie nosa, kýchanie) t. j. rozsah stupnice je od 0 do 12. Skóre liečby rinitídy bol súčet skóre pre používanie nazálnych steroidov (2 body na jeden vstrek, maximálne 4 vstreky/deň) a užívanie perorálnych antihistaminík (4 body/tableta, maximálne 1 tableta/deň), t. j. rozsah: od 0 po 12. Rozsah TCRS je preto: od 0 do 24.
· Ďalšími vopred zadefinovanými kľúčovými sekundárnymi cieľovými ukazovateľmi boli celkové kombinované skóre rinokonjunktivitídy a kvalita života pri rinokonjunktivitíde (
rhinoconjunctivitis quality of life, RQLQ).
· Na ďalší opis klinickej významnosti výsledkov sa vykonali post-hoc analýzy dní so zhoršením rinitídy.
o Zhoršenie rinitídy bolo definované ako deň, kedy u jedinca došlo k návratu k vysokej miere príznakov vyžadovaných na zaradenie do skúšania: skóre príznakov rinitídy minimálne 6 alebo minimálne 5 s jedným príznakom ohodnoteným ako závažným.

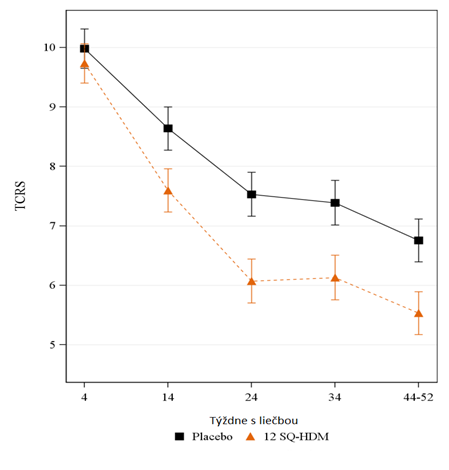
Výsledky skúšania MERIT
| 12 SQ-HDM
| Placebo
| Účinok liečby
|
|
Primárny cieľový ukazovateľ
| N
| Skóre
| N
| Skóre
| Absolútny rozdielc
| Relatívny rozdield
| p-hodnota
|
Celkové kombinované skóre rinitídy
|
FAS-MIa (upravená priemerná hodnota)
| 318
| 5,71
| 338
| 6,81
| 1,09 [0,35; 1,84]
| -
| 0,004
|
FAS b(upravená priemerná hodnota)
| 284
| 5,53
| 298
| 6,76
| 1,22 [0,49; 1,96]
| 18 %
| 0,001
|
FAS b (medián)
| 284
| 5,88
| 298
| 7,54
| 1,66
| 22 %
| -
|
Vopred definované kľúčové sekundárne cieľové ukazovatele
| N
| Skóre
| N
| Skóre
| Absolútny rozdiel c
| Relatívny rozdield
| p-hodnota
|
Skóre príznakov rinitídy
|
FAS b(upravená priemerná hodnota)
| 284
| 2,76
| 298
| 3,30
| 0,54 [0,18; 0,89]
| 16 %
| 0,003
|
FAS b (medián)
| 284
| 2,98
| 298
| 3,98
| 1,00
| 25 %
| -
|
Skóre liečby rinitídy
|
FAS b(upravená priemerná hodnota)
| 284
| 2,22
| 298
| 2,83
| 0,60 [0,08; 1,13]
| 21 %
| 0,024
|
FAS b (medián)
| 284
| 2,83
| 298
| 4,00
| 1,17
| 29%
| -
|
Celkové kombinované skóre rinokonjunktivitídy
|
FAS b(upravená priemerná hodnota)
| 241
| 7,91
| 257
| 9,12
| 1,21 [0,13; 2,28]
| 13 %
| 0,029
|
FAS b (medián)
| 241
| 8,38
| 257
| 10,05
| 1,67
| 20%
| -
|
Skóre kvality života pri rinokonjunktivitíde (RQLQ(S))
|
FAS b(upravená priemerná hodnota)
| 229
| 1,38
| 240
| 1,58
| 0,19 e [0,02; 0,37]
| 12 %
| 0,031
|
FAS b (medián)
| 229
| 1,25
| 240
| 1,46
| 0,21
| 14%
| -
|
Cieľové ukazovatele post-hoc
| N
| Podiel
| N
| Podiel
| Pomer šancíf [95 % IS]
| p-hodnota
|
Pravdepodobnosť výskytu dňa so zhoršením rinitídy
|
FAS (odhad) b
| 284
| 5,33 %
| 298
| 11,14 %
| 0,45 [0,28; 0,72]
| 0,001
|
Pravdepodobnosť výskytu dňa so zhoršením rinitídy napriek užívaniu farmakologickej liečby na rinitídu
|
FAS (odhad) b
| 284
| 3,43 %
| 298
| 6,50 %
| 0,51 [0,32; 0,81]
| 0,005
|
N: počet jedincov v liečebnej skupine s údajmi dostupnými pre analýzu. IS: interval spoľahlivosti.
a. FAS-MI: celý analyzovaný súbor s viacnásobnými imputáciami. V analýze sú jedinci, ktorí opustili skúšanie pred obdobím hodnotenia účinnosti, uvedení ako jedinci užívajúci placebo. Absolútny rozdiel bol vopred zadefinovaný len pre primárnu analýzu (FAS-MI).
b. FAS: celý analyzovaný súbor. Všetky dostupné údaje použité v celom svojom rozsahu, t. j. jedinci, ktorí poskytli údaje počas obdobia hodnotenia účinnosti.
c Absolútny rozdiel: placebo mínus 12 SQ-HDM, 95 % intervaly spoľahlivosti.
d Relatívny rozdiel voči placebu: placebo mínus 12 SQ-HDM rozdelené podľa placeba.
e Rozdiel medzi 12 SQ-HDM a placebom bol primárne vedený tromi rozdielmi v troch oblastiach: problémy so spánkom, praktické problémy a nazálne príznaky.
f Pomer pravdepodobnosti zhoršenia rinitídy: 12 SQ-HDM oproti placebu.
|
Podporné dôkazy – alergická rinitídaV expozičných komôrkach alergénu u 124 dospelých s alergickou rinitídou vyvolanou roztočmi domáceho prachu sa vykonalo randomizované, dvojito zaslepené, placebom kontrolované skúšanie fázy II. Pred každou expozíciou alergénu došlo u jedincov k odstráneniu farmakologickej liečby z tela. Na konci skúšanej expozície alergénu po 24 týždňoch liečby 12 SQ-HDM, 6 SQ-HDM alebo placebom bolo priemerné skóre príznakov rinitídy 7,45 [6,57; 8,33] v skupine s placebom a 3,83 [2,94; 4,72] v skupine s 12 SQ-HDM, čo zodpovedá hodnote absolútneho rozdielu 3,62 a relatívnemu rozdielu 49 % (95 % interval spoľahlivosti [35 %; 60 %], p < 0,001). Rozdiel medzi 12 SQ-HDM a placebom bol štatisticky významný v 16. týždni (priemerné skóre 5, 95 a 8,58, rozdiel 2,62 zodpovedajúci 30 %, 95 % IS [17 %; 42 %], p < 0,001) a v 8. týždni (priemerné skóre 6,51 a 8,48, rozdiel 1,97 zodpovedajúci 20 %, 95 % IS [7 %; 33 %], p = 0,007).'
Alergická astmaSkúšanie MITRA (MT-04)· Skúšanie MITRA zahŕňalo 834 dospelých s alergickou astmou vyvolanou roztočmi domáceho prachu, ktorá nebola dobre kontrolovaná denným používaním inhalačného kortikosteroidu (ICS) zodpovedajúcemu 400 - 1 200 µg budenozidu. Všetci jedinci podstúpili 7- až 12-mesačnú liečbu liekom ACARIZAX ako doplnok k ICS a krátkodobo účinkujúcim betablokátorom pred znížením dávky ICS. Pred randomizáciou sa nevykonala žiadna fáza titrácie dávky na stanovenie najnižšej udržiavacej dávky ICS. Účinnosť bola hodnotená na základe času do prvého výskytu stredne závažného až závažného zhoršenia astmy pri znížení dávky ICS počas minimálne 6 mesiacov 13‑ až 18-mesačnej liečby.
o Definícia stredne závažného zhoršenia astmy bola splnená v prípade, ak sa u jedinca objavilo jedno alebo viacero zo 4 kritérií uvedených nižšie a viedlo k zmene liečby:
§
Nočné prebudenie sa alebo zvýšený výskyt príznakov: nočné prebudenie (prebudenia) sa z dôvodu astmy vyžadujúcej použitie krátkodobo účinkujúceho β
2-agonistu (SABA) počas dvoch po sebe nasledujúcich nocí alebo zvýšenie skóre výskytu príznakov počas dňa o ≥ 0,75 od východiskového stavu počas dvoch po sebe nasledujúcich dní.
§
Zvýšené používanie SABA: zvýšenie epizód použitia SABA počas dvoch po sebe nasledujúcich dní (minimálne zvýšenie: 4 vstreky/deň).
§
Zhoršenie funkcie pľúc: ≥ 20 % pokles PEF od východiskového stavu počas minimálne dvoch po sebe nasledujúcich rán/večerov alebo ≥ 20 % pokles FEV
1 od východiskového stavu.
§
Návšteva zdravotníckeho zariadenia: návšteva pohotovosti / skúšajúceho pracoviska pre liečbu astmy, ktorá nevyžaduje podanie systémových kortikosteroidov.
o Závažné zhoršenie astmy bolo definované ako výskyt minimálne jedného z dvoch nasledujúcich:
§ potreba podania systémových kortikosteroidov počas ≥ 3 dní,
§ návšteva pohotovosti, počas ktorej sa vyžaduje podanie systémových kortikosteroidov alebo hospitalizácia počas ≥ 12 hodín.

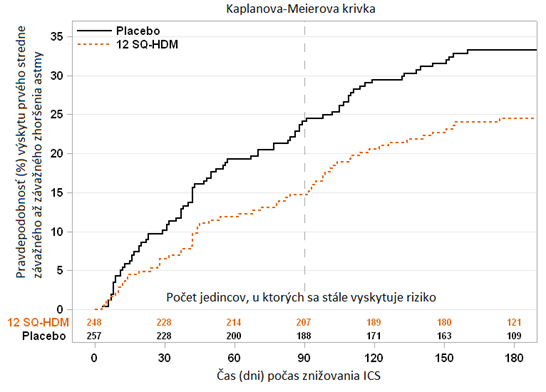
Výsledky skúšania MITRA
| 12 SQ-HDM
| Placebo
| Účinnosť
12 SQ-HDM oproti placebu
| p- hodnota
|
N
| n (%)
| N
| n (%)
| Pomer rizika
[95 % IS]
| Zníženie rizikaa
|
Primárny cieľový ukazovateľ
|
Akékoľvek zhoršenie, stredne závažné alebo závažné (FAS-MI) b
| 282
| 59 (21 %)
| 277
| 83 (30 %)
| 0,69 [0,50; 0,96]
| 31 %
| 0,027
|
Akékoľvek zhoršenie, stredne závažné alebo závažné (FAS) c
| 248
| 59 (24 %)
| 257
| 83 (32 %)
| 0,66 [0,47; 0,93]
| 34 %
| 0,017
|
Vopred zadefinované analýzy zložiek primárneho cieľového ukazovateľa
|
Nočné prebudenie sa alebo zvýšenie výskytu príznakov c
| 248
| 39 (16 %)
| 257
| 57 (22 %)
| 0,64 [0,42; 0,96]
| 36 %
| 0,031
|
Zvýšenie používania SABA c
| 248
| 18 (7 %)
| 257
| 32 (12 %)
| 0,52 [0,29; 0,94]
| 48 %
| 0,029
|
Zhoršenie funkcie pečene c
| 248
| 30 (12 %)
| 257
| 45 (18 %)
| 0,58 [0,36; 0,93]
| 42 %
| 0,022
|
Závažné zhoršenie c
| 248
| 10 (4 %)
| 257
| 18 (7 %)
| 0,49 [0,23; 1,08]
| 51 %
| 0,076
|
N: počet jedincov v liečebnej skupine s údajmi dostupnými pre analýzu.
n (%): počet a percentuálne vyjadrenie jedincov spĺňajúcich kritérium v liečebnej skupine.
IS: intervaly spoľahlivosti.
a Odhadnuté na základe pomeru rizika
b FAS-MI: celý analyzovaný súbor s viacnásobnými imputáciami. V analýze sú jedinci, ktorí opustili skúšanie pred obdobím hodnotenia účinnosti, uvedení ako jedinci užívajúci placebo.
c FAS: celý analyzovaný súbor. Všetky dostupné údaje použité v celom svojom rozsahu, t. j. vrátane všetkých jedincov, ktorí poskytli údaje počas obdobia hodnotenia účinnosti.
|
Na zistenie účinku lieku ACARIZAX ako doplnku k inhalačnému kortikosteroidu sa tiež vykonali post-hoc analýzy príznakov astmy a použitia symptomatických liekov v posledných 4 týždňoch obdobia liečby pred znížením dávky inhalačných kortikosteroidov. Analýzy boli zamerané na skóre denných a nočných príznakov astmy, nočné prebúdzanie sa a používanie SABA. Post-hoc analýzy preukázali číselné rozdiely neustále v prospech 12 SQ-HDM oproti placebu pri všetkých parametroch skúmaných počas posledných 4 týždňov pred znížením dávky inhalačného kortikosteroidu. Rozdiely boli štatisticky významné len pri skóre denných príznakov astmy (p = 0,0450) a pravdepodobnosti výskytu nočného prebudenia sa (p = 0,0409).
Podporné dôkazy – alergická astmaV dvojito zaslepenom, randomizovanom, placebom kontrolovanom skúšaní fázy II bolo na liečbu 1, 3 alebo 6 SQ-DHM alebo placebom a trvaním približne 1 rok randomizovaných 604 jedincov vo veku ≥ 14 rokov s alergickou astmou vyvolanou roztočmi domáceho prachu kontrolovanou inhalačnými kortikosteroidmi (100 - 800 µg budezonidu) a s klinickou anamnézou alergickej rinitídy vyvolanej roztočmi domáceho prachu. Počas 4-týždňového obdobia na vyhodnotenie účinnosti na konci skúšania bola priemerná zmena od východiskového stavu v dennej dávke ICS 207,6 µg budezonidu v skupine so 6 SQ-HDM a 126,3 µg v skupine s placebom, čo zodpovedá absolútnemu rozdielu 81 µg budezonidu na deň (95 % interval spoľahlivosti [27; 136], p = 0,004. Relatívny priemer a medián znížení dávky ICS od východiskového stavu boli 42 % a 50 % pre 6 SQ-HDM a 15 % a 25 % pre placebo. V post-hoc analýze podskupiny (N = 108) jedincov so slabšou kontrolou astmy a ICS ≥ 400 µg budezonidu bola priemerná zmena od východiskového stavu v dennej dávke ICS 384,4 µg budezonidu v skupine so 6 SQ-HDM a 57,8 µg v skupine s placebom, čo zodpovedá absolútnemu rozdielu medzi 6 SQ-HDM a placebom 327 µg budezonidu na deň (95 % IS [182; 471], p < 0,0001, post-hoc analýza).
Pediatrická populáciaACARIZAX nie je indikovaný pacientom vo veku < 18 rokov (pozri časť 4.2).
U pediatrických pacientov vo veku 5 - 17 rokov existujú obmedzené údaje týkajúce sa bezpečnosti a znášanlivosti.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom ACARIZAX u detí mladších ako 5 rokov pri respiračnej alergii vyvolanej roztočmi domáceho prachu (liečba alergickej rinitídy, predchádzanie astme, liečba astmy).
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s liekom ACARIZAX u detí vo veku 5 rokov a starších pri respiračnej alergii vyvolanej roztočmi domáceho prachu (liečba alergickej rinitídy, predchádzanie astme, liečba astmy.
Populácia starších osôbACARIZAX nie je indikovaný pacientom vo veku > 65 rokov (pozri časť 4.2). U starších pacientov vo veku > 65 rokov existujú obmedzené údaje týkajúce sa bezpečnosti a znášanlivosti.
Dlhodobá liečba Pri imunologickej liečbe alergie sa na dosiahnutie úpravy ochorenia v medzinárodných liečebných usmerneniach uvádza 3-ročné obdobie liečby. Údaje týkajúce sa účinnosti sú dostupné pre 18‑mesačnú liečbu liekom ACARIZAX zo skúšania MITRA. Dlhodobá účinnosť sa nestanovila.
5.2 Farmakokinetické vlastnostiNevykonali sa žiadne klinické štúdie skúmajúce farmakokinetický profil a metabolizmus lieku ACARIZAX. Účinok imunologickej liečby alergie je sprostredkovaný prostredníctvom imunologických mechanizmov a dostupné sú obmedzené informácie týkajúce sa farmakokinetických vlastností.
Aktívne molekuly alergénového extraktu pozostávajú najmä z bielkovín. Pri sublinguálne podávanej imunologickej liečbe alergie sa v štúdiách preukázalo, že nedochádza k žiadnemu pasívnemu vstrebávaniu alergénu cez sliznicu úst. Dôkazy naznačujú, že alergén zachytávajú dendritické bunky sliznice úst, najmä Langerhansonove bunky. Pri alergéne, ktorý sa nevstrebe týmto spôsobom, sa predpokladá, že sa hydrolyzuje na aminokyseliny a malé polypeptidy v lúmene gastrointestinálneho traktu. Neexistujú žiadne dôkazy, ktoré by naznačovali, že sa alergény nachádzajúce sa v lieku ACARIZAX vo významnom rozsahu vstrebávajú do vaskulárneho systému po sublinguálnom podaní.
5.3 Predklinické údaje o bezpečnostiObvyklé štúdie celkovej toxikológie a toxicity pre reprodukciu u myší neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokŽelatína (rybieho pôvodu)
Manitol
Hydroxid sodný (na úpravu pH)
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti3 roky
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia Al/Al blister v škatuľke.
Veľkosti balenia: 10, 30 a 90 perorálnych lyofilizátov.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIALK-Abelló A/S
Bøge Allé 6-8
2970 Hørsholm
Dánsko
8. REGISTRAČNÉ ČÍSLOReg. číslo: 59/0472/15-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
Dátum posledného predĺženia registrácie:
10. DÁTUM REVÍZIE TEXTUNovember 2015