
deň
≥ 1000
|
A
|
≥ 75 000
|
Vráťte sa k dávkam rovnakým ako v 1. deň a sledujte rastové faktory bielych krviniek
ALEBO
Znížte dávku odporúčanú na 1. deň o 1 úroveň
|
|
≥ 500 ale < 1000
|
ALEBO
|
≥ 50 000 ale < 75 000
|
Znížte dávky o 1 úroveň a sledujte
rastové faktory bielych krviniek
ALEBO
Znížte dávku odporúčanú na 1. deň o 2 úrovne
|
|
< 500
|
ALEBO
|
< 50 000
|
Nepodávajte dávky
|
Skratky: ANC=absolútny počet neutrofilov
(Absolute Neutrophil Count); WBC=biele krvinky
(white bloodcells)Tabuľka 3: Úpravy dávkovania z dôvodu iných nežiaducich účinkov u pacientovs adenokarcinómom pankreasu
Nežiaduci účinok
|
Dávka Abraxanu
|
Dávka Gemcitabínu
| Febrilná neuropénia:
3. alebo 4. stupeň
| Pozastavte podávanie dávok dovtedy, kým horúčka neustúpi a ANC
nebude ≥ 1500; pokračujte s dávkou nižšou o 1 úroveňa
|
Periférna neuropatia:
3. alebo 4. stupeň
| Nepodávajte dávku dovtedy, kým nedôjde k zlepšeniu na ≤ 1. stupeň; pokračujte s dávkou nižšou o 1 úroveňa
|
Podajte rovnakú dávku
| Kožná toxicita:
2. alebo 3. stupeň
| Redukujte dávku o 1 úroveň nižšiea;
ak nežiaduci účinok pretrváva, ukončite liečbu
| Gastrointestinálna toxicita:
mukozitída 3. stupňa alebo hnačka
|
Nepodávajte dávky dovtedy, kým nedôjde k zlepšeniu na ≤ 1. stupeň;
pokračujte s dávkou nižšou o 1 úroveňa
|
|
|
aPozri Tabuľku 1 pre úrovne znížovania dávky
Osobitné populáciePacienti s poškodenou funkciou pečeneV súčasnosti nie sú dostupné dostatočné údaje na zmeny odporúčaného dávkovania u pacientov
s miernym až stredne závažným poškodením funkcie pečene, ktoré zabezpečí prijateľnú toxicitu
a zároveň dostatočnú účinnosť Abraxanu. Pacienti so závažným poškodením funkcie pečene sa nemajú liečiť paklitaxelom (pozri časti 4.4 a 5.2).
Pacienti s poškodenou funkciou obličiekNevykonali sa žiadne štúdie u pacientov s poškodenou funkciou obličiek a u pacientov s poškodenou funkciou obličiek nie sú dostupné dostatočné údaje o odporúčaniach na zmeny dávkovania Abraxanu
(pozri časť 5.2).
Starší ľudia
Pre pacientov vo veku 65 rokov a viac sa neodporúča žiadne ďalšie znižovanie dávkovania, okrem zmien odporúčaných pre všetkých pacientov.
Z 229 pacientov v randomizovanej štúdii, ktorí dostávali Abraxane v monoterapii pri liečbe karcinómu prsníka, malo 13 % minimálne 65 rokov a < 2 % pacientov malo 75 rokov a viac. Neobjavili sa žiadne toxicity, ktoré by sa vyskytovali oveľa častejšie u pacientov vo veku minimálne 65 rokov, ktorí dostávali Abraxane.
V randomizovanej štúdii bolo zo 421 pacientov s adenokarcinómom pankreasu, ktorí dostávali Abraxane v kombinácii s gemcitabínom, 41 % vo veku 65 rokov a viac a 10 % bolo vo veku 75 rokov a viac. U pacientov vo veku 75 rokov a viac, ktorí dostávali Abraxane a gemcitabín, bol vyšší výskyt závažných nežiaducich účinkov a nežiaducich účinkov, ktoré viedli k ukončeniu liečby (pozri časť
4.4). Pacienti s adenokarcinómom pankreasu vo veku 75 rokov a viac sa majú starostlivo vyšetriť predtým, než sa zvažuje ich liečba (pozri časť 4.4).
Pediatrická populácia
Bezpečnosť a účinnosť Abraxanu u detí a dospievajúcich vo veku 0-17 rokov neboli doteraz
stanovené. Použitie Abraxanu sa netýka pediatrickej populácie v indikácii metastatického karcinómu prsníka alebo adenokarcinómu pankreasu.
Spôsob podávania
Abraxane sa podáva intravenózne.
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Laktácia (pozri časť 4.6).
Pacienti s východiskovým počtom neutrofilov < 1500 buniek/mm3.
4.4 Osobitné upozornenia a opatrenia pri používaní
Abraxane obsahuje paklitaxel vo forme nanočastíc viazaných na albumín, ktorý môže mať podstatne odlišné farmakologické vlastnosti v porovnaní s inými formami paklitaxelu (pozri časti 5.1 a 5.2). Liek nemá byť náhradou iných liekov obsahujúcich paklitaxel, ani sa nemá nimi nahrádzať.
Precitlivenosť
Hlásený bol zriedkavý výskyt závažných reakcií precitlivenosti, vrátane veľmi zriedkavých prípadov anafylaktických reakcií so smrteľným koncom. Ak sa vyskytne reakcia z precitlivenosti, liek sa má
okamžite vysadiť, má sa začať symptomatická liečba a pacientovi sa nemá znovu podať paklitaxel.
Hematológia
Pri liečbe Abraxanom často dochádza k potlačeniu krvotvorby v kostnej dreni (najmä k neutropénii). Neutropénia je toxicita závislá od dávky a obmedzujúca dávku. Počas liečby Abraxanom sa má
vykonávať časté monitorovanie krvného obrazu. Pacienti nemajú pokračovať v liečbe následnými cyklami Abraxanu, kým sa hladina neutrofilov nevráti na > 1500 buniek/mm3 a kým sa krvné doštičky nevrátia na > 100 000 buniek/mm3 (pozri časť 4.2).
Neuropatia
Pri liečbe Abraxanom sa často vyskytuje senzorická neuropatia, hoci vývoj závažných príznakov je menej častý. Výskyt senzorickej neuropatie 1. a 2. stupňa si zvyčajne nevyžaduje zníženie dávky. Ak
sa pri podávaní Abraxanu v monoterapii vyvinie senzorická neuropatia 3. stupňa, liečba sa má
pozastaviť dovtedy, kým sa nezlepší na 1. alebo 2. stupeň a pre všetky následné liečby sa odporúča
zníženie dávky Abraxanu (pozri časť 4.2). Ak sa vyvinie periférna neuropatia 3. alebo vyššieho stupňa pri podávaní Abraxanu v kombinácii s gemcitabínom, pozastavte podávanie Abraxanu a pokračujte v liečbe gemcitabínom v rovnakej dávke. Keď sa periférna neuropatia zlepší na stupeň 0 alebo 1, pokračujte v podávaní Abraxanu v zníženej dávke (pozri časť 4.2).
Sepsa
Sepsa bola hlásená u 5 % pacientov s neutropéniou alebo bez neutropénie, ktorým bol podávaný
Abraxane v kombinácii s gemcitabínom. Ako významne prispievajúce faktory sa identifikovali komplikácie súvisiace so základným ochorením rakoviny pankreasu, najmä obštrukcia žlčových ciest
alebo prítomnosť biliárneho stentu. Ak sa u pacienta vyvinie febrilita (bez ohľadu na počet
neutrofilov), má sa začať liečba so širokospektrálnymi antibiotikami. Pri febrilnej neutropénii sa má pozastaviť podávanie Abraxanu a gemcitabínu do času, kým sa horúčka nevylieči a absolútny počet neutrofilov dosiahne ≥ 1500 buniek/mm3, potom sa má pokračovať v liečbe so zníženými dávkami (pozri časť 4.2).
Pneumonitída
Pneumonitída sa objavila u 1 % pacientov, keď sa Abraxane podával v monoterapii a u 4 % pacientov,
keď sa Abraxane podával v kombinácii s gemcitabínom. Všetci pacienti majú byť pozorne sledovaní kvôli príznakom a symptómom pneumonitídy. Po vylúčení infekčnej etiológie a po určení diagnózy
pneumonitídy sa má liečba Abraxanom a gemcitabínom trvalo vysadiť a okamžite začať s primeranou
liečbou a podpornými opatreniami (pozri časť 4.2).
Poškodeniefunkciepečene
Keďže toxicita paklitaxelu môže byť zvýšená pri poškodení funkcie pečene, má sa Abraxane pacientom s poškodením funkcie pečene podávať s opatrnosťou. Pacienti s poškodením funkcie pečene môžu mať zvýšené riziko toxicity, najmä kvôli myelosupresii a títo pacienti sa majú pozorne monitorovať, či sa u nich nevyvíja ťažká myelosupresia.
Pacienti so závažným poškodením funkcie pečene (bilirubín > 5 x ULN alebo AST/ALT > 10 x ULN) sa neskúmali a nemajú sa liečiť Abraxanom. Vhodný dávkovací režim pre pacientov s menej závažným poškodením funkcie pečene nie je známy. U pacientov s bilirubínom > 2 ULN sa musí zvážiť zníženie dávky, pretože klírens paklitaxelu je u pacientov s vysokými hladinami bilirubínu znížený (pozri časť 5.2).
Kardiotoxicita
U jedincov liečených Abraxanom sa pozorovali zriedkavé prípady kongestívneho srdcového zlyhania a dysfunkcie ľavej komory. Väčšina jedincov bola predtým vystavená kardiotoxickým liekom, ako sú antracyklíny alebo mali srdcové ochorenia v anamnéze. Preto majú lekári u pacientov dostávajúcich Abraxane dôsledne monitorovať výskyt srdcových príhod.
Metastázy v CNS
Účinnosť a bezpečnosť Abraxanu u pacientov s metastázami v centrálnom nervovom systéme (CNS)
nebola stanovená. Metastázy v CNS zvyčajne nie sú dobre kontrolované systémovou chemoterapiou.
Gastrointestinálne symptómy
Ak pacienti po podaní Abraxanu cítia nevoľnosť, vracajú alebo majú hnačku, možno ich liečiť bežne používanými antiemetikami a konstipačnými látkami.
Pacienti vo veku 75 rokovastarší
Nepreukázal sa prínos liečby Abraxanom v kombinácii s gemcitabínom v porovnaní s monoterapiou gemcitabínom pre pacientov vo veku 75 rokov a starších. U pacientov vo vyššom veku (≥ 75 rokov),
ktorí dostávali Abraxane a gemcitabín, bol vyšší výskyt závažných nežiaducich účinkov a nežiaducich
účinkov, ktoré viedli k ukončeniu liečby, vrátane hematologických toxicít, periférnej neuropatie, zníženej chuti do jedla a dehydratácie. U pacientov s adenokarcinómom pankreasu vo veku 75 rokov a starších sa má starostlivo zhodnotiť ich schopnosť tolerovať Abraxane v kombinácii s gemcitabínom, so zameraním pozornosti na stav výkonnosti, komorbidity a zvýšené riziko infekcií (pozri časti 4.2 a
4.8).
I
né
Hoci sú k dispozícii len obmedzené údaje, nepreukázal sa žiadny jasný prospech s ohľadom na predĺženie celkového prežívania u pacientov s adenokarcinómom pankreasu s normálnymi hodnotami
CA 19-9 pred začiatkom liečby Abraxanom a gemcitabínom (pozri časť 5.1).
Erlotinib sa nemá podávať súbežne s Abraxanom a gemcitabínom (pozri časť 4.5).
Pomocné látky
Po rekonštitúcii každý ml koncentrátu Abraxanu obsahuje 0,183 mmol sodíka, čo zodpovedá 4,2 mg sodíka. Toto sa má zohľadniť pri podávaní pacientom s diétou s obmedzením soli.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
Metabolizmus paklitaxelu je čiastočne katalyzovaný izoenzýmami cytochrómu P450 CYP2C8 a CYP3A4 (pozri časť 5.2). Preto je pri podávaní paklitaxelu súbežne s liekmi, ktoré sú známe ako inhibítory (napr. ketokonazol a iné imidazolové antimykotiká, erytromycín, fluoxetín, gemfibrozil, cimetidín, ritonavir, saquinavir, indinavir a nelfinavir) alebo induktory (napr. rifampicín, karbamazepín, fenytoín, efavirenz, nevirapín) CYP2C8 alebo CYP3A4, potrebné postupovať opatrne.
Paklitaxel a gemcitabín nezdieľajú rovnakú metabolickú cestu. Klírens paklitaxelu primárne určuje metabolizmus sprostredkovaný CYP2C8 a CYP3A4, potom nasleduje exkrécia žlčou, zatiaľ čo gemcitabín je deaktivovaný cytidín-deaminázou a potom nasleduje exkrécia močom. Farmakokinetické interakcie medzi Abraxanom a gemcitabínom neboli u ľudí hodnotené.
Abraxane je indikovaný v monoterapii na liečbu karcinómu prsníka, alebo v kombinácii
s gemcitabínom na liečbu adenokarcinómu pankreasu (pozri časť 4.1). Abraxane sa nemá používať v
kombinácii s inými protirakovinovými liekmi.
4.6 Fertilita, gravidita a laktácia
Antikoncepciaumužovažien
Ženy vo fertilnom veku majú používať účinnú antikoncepciu počas liečby a 1 mesiac po ukončení liečby Abraxanom. Mužským pacientom liečeným Abraxanom sa odporúča nesplodiť dieťa počas
liečby a do šiestich mesiacov po liečbe.
Gravidita
Existujú len veľmi obmedzené údaje o používaní paklitaxelu počas gravidity u ľudí. Predpokladá sa,
že paklitaxel spôsobuje závažné vrodené defekty, keď sa podáva počas gravidity. Štúdie na zvieratách
preukázali reprodukčnú toxicitu (pozri časť 5.3). Abraxane sa nemá používať počas gravidity a ani u žien vo fertilnom veku, ktoré nepoužívajú účinnú antikoncepciu, pokiaľ si klinický stav ženy nevyžaduje liečbu paklitaxelom.
Laktácia
Nie je známe, či sa paklitaxel vylučuje do ľudského materského mlieka. Vzhľadom k možnému výskytu závažných nežiaducich účinkov u dojčených detí, je Abraxane počas dojčenia kontraindikovaný. Počas liečby sa musí dojčenie prerušiť.
Fertilita
Abraxane spôsobil neplodnosť u samcov potkanov (pozri časť 5.3). Mužskí pacienti sa majú pred liečbou poradiť o konzervácii spermií, pretože existuje možnosť nevratnej neplodnosti spôsobenej liečbou Abraxanom.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Abraxane má malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Abraxane môže spôsobovať nežiaduce reakcie, ako napríklad únavu (veľmi často) a závrat (často), ktoré môžu ovplyvniť schopnosť viesť vozidlá a obsluhovať stroje. Pacienti majú byť upozornení, aby neviedli vozidlá a neobsluhovali stroje, keď pociťujú únavu alebo závrat.
4.8 Nežiaduce účinkySúhrnbezpečnostnéhoprofiluNajčastejšie klinicky signifikantné nežiaduce účinky spojené s podávaním Abraxanu boli neutropénia, periférna neuropatia, artralgia/myalgia a gastrointestinálne poruchy.
Frekvencie výskytu nežiaducich účinkov spojené s podávaním Abraxanu sú uvedené v Tabuľke 4
(Abraxane v monoterapii) a v Tabuľke 5 (Abraxane v kombinácii s gemcitabínom).
Frekvencie výskytu sú definované ako: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1000 až <1/100), zriedkavé (≥1/10 000 až <1/1000), veľmi zriedkavé (<1/10 000). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Rakovina prsníka (Abraxane podávaný v monoterapii) Zoznam neži aducich úči nkov uv edený ch v t abuľke V tabuľke 4 sú uvedené nežiaduce účinky spojené s podávaním Abraxanu u pacientov zo štúdií, v
ktorých sa Abraxane podával v monoterapii v akejkoľvek dávke pre akúkoľvek indikáciu (n = 789).
Tabuľka 4: Nežiaduce účinky hlásené pri podávaní Abraxanu v monoterapii pri akejkoľvek
Infekcie a nákazy
| Časté: Infekcia, infekcia močových ciest, folikulitída, infekcia horných
dýchacích ciest, kandidóza, sínusitída
Menej časté: Orálna kandidóza, nazofaryngitída, celulitída, herpes simplex, vírusová infekcia, pneumónia, infekcia spojená so zavedením katétra, plesňová infekcia, herpes zoster, infekcia v mieste vpichu, sepsa2, neutropenická sepsa2
| Benígne a malígne
nádory, vrátane nešpecifikovaných novotvarov (cysty a polypy)
|
Menej časté: Bolesť súvisiaca s metastázami, nekróza tumoru
|
Poruchy krvi a lymfatického systému
| Veľmi časté: Neutropénia, anémia, leukopénia, trombocytopénia,
lymfopénia, supresia kostnej drene
Časté: Febrilná neutropénia
Zriedkavé: Pancytopénia
|
Poruchy imunitného systému
| Menej časté 1: Hypersenzitivita
Zriedkavé: Závažná hypersenzitivita
|
Poruchy metabolizmu a
výživy
| Veľmi časté: Anorexia
Časté: Dehydratácia, znížená chuť do jedla, hypokalémia
Menej časté: Hypofosfatémia, zadržiavanie tekutín, hypoalbuminémia,
polydipsia, hyperglykémia, hypokalciémia, hypoglykémia, hyponatriémia
|
|
|
dávke v klinických štúdiách
Psychické poruchy
|
Č
asté: Nespavosť, depresia, úzkosť
Menej časté: Nepokoj
|
Poruchy nervového systému
|
Veľmi časté: Periférna neuropatia, neuropatia, hypoestézia, parestézia
Časté: Periférna senzorická neuropatia, bolesť hlavy, dysgeúzia, závrat,
periférna motorická neuropatia, ataxia, zmyslové poruchy, somnolencia
Menej časté: Polyneuropatia, areflexia, dyskinéza, hyporeflexia, neuralgia, strata zmyslov, synkopa, závrat v stoji, neuropatická bolesť, tremor
|
Poruchy oka
|
Č
asté: Zvýšené slzenie, rozmazané videnie, suché oči, suchá
keratokonjunktivitída, madaróza
Menej časté: Podráždenie očí, bolesť očí, abnormálne videnie, znížená ostrosť videnia, konjunktivitída, poruchy videnia, svrbenie očí, keratitída
Zriedkavé: cystoidný edém makuly2
|
Poruchy ucha a labyrintu
|
Časté: Vertigo (závrat)
Menej časté: Bolesť ucha, tinitus (hučanie v ušiach)
|
Poruchy srdca a srdcovej
činnosti
|
Č
asté: Tachykardia, arytmia, supraventrikulárna tachykardia
Zriedkavé: bradykardia, zástava srdca, dysfunkcia ľavej komory,
kongestívne srdcové zlyhanie, atrioventrikulárna blokáda2
|
Poruchy ciev
|
Č
asté: Sčervenanie pokožky, návaly horúčavy, hypertenzia, lymfedém
Menej časté: Hypotenzia, periférny chlad, ortostatická hypotenzia
Zriedkavé: Trombóza
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Č
asté: Intersticiálna pneumonitída3, dýchavičnosť, epistaxa, bolesť hltana
a hrtana, kašeľ, nádcha, výtok z nosa
Menej časté: Produktívny kašeľ, námahová dýchavičnosť, upchanie dutín, znížené dychové ozvy, pleurálny výpotok, alergická nádcha, chrapot, upchanie nosa, suchý nos, sipot, pľúcna embólia, pľúcna tromboembólia
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté: Nevoľnosť, hnačka, vracanie, zápcha, stomatitída
Časté: Bolesť brucha, nadúvanie, bolesť hornej časti brucha, dyspepsia,
gastroezofageálna refluxná choroba, orálna hypoestézia
Menej časté: Dysfágia, plynatosť, glosodýnia, sucho v ústach, bolesť ďasien, riedka stolica, ezofagitída, bolesť v podbrušku, vredy v ústach, bolesť úst, krvácanie z rekta
|
Poruchy pečene a
žlčových ciest
|
M
enej časté: Hepatomegália
|
Poruchy kože a podkožného tkaniva
|
Veľmi časté: Alopécia, vyrážka
Časté: Porucha nechtov, svrbenie, suchá koža, erytém, pigmentácia/zmena sfarbenia nechtov, hyperpigmentácia kože, onycholýza, zmeny nechtov
Menej časté: Citlivosť v nechtovom lôžku, urtikária, bolesť kože, precitlivenosť na svetlo, porucha pigmentácie, svrbivá vyrážka, porucha kože, hyperhidróza, onychomadéza, erytematózna vyrážka, generalizovaná vyrážka, dermatitída, nočné potenie, makulo-papulárna vyrážka, vitiligo, hypotrichóza, nepríjemné pocity v nechtoch, generalizovaný pruritus, makulárna vyrážka, papulárna vyrážka, kožné lézie, opuch tváre
Veľmi zriedkavé: Stevensov-Johnsonov syndróm2, toxická epidermálna nekrolýza2
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
Veľmi časté: Artralgia, myalgia
Časté: Bolesť v končatinách, bolesť v kostiach, bolesť chrbta, svalové kŕče, bolesti končatín
Menej časté: Bolesť hrudnej steny, svalová slabosť, bolesť krku, bolesť v slabinách, svalové kŕče, muskuloskeletárna bolesť, bolesť v boku, nepríjemné pocity v končatinách, svalová slabosť
|
Poruchy obličiek
a močových ciest
|
M
enej časté: Dyzúria, polakizúria, hematúria, noktúria, polyúria, močová
inkontinencia
|
Poruchy reprodukčného
systému a prsníkov
|
M
enej časté: Bolesť prsníkov
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté: Únava, asténia, pyrexia
Časté: Periférny edém, zápal slizníc, bolesť, zimnica, edém, slabosť, znížená výkonnosť, bolesť hrudníka, ochorenie podobné chrípke, nevoľnosť, letargia, hyperpyrexia
Menej časté: Nepríjemné pocity v hrudníku, abnormálna chôdza, opuch, reakcia v mieste vpichu
Zriedkavé: Extravazácia
|
Laboratórne a funkčné vyšetrenia
|
Č
asté: Pokles telesnej hmotnosti, zvýšená alanínaminotransferáza, zvýšená
aspartátaminotransferáza, znížený hematokrit, znížený počet červených krviniek, zvýšená telesná teplota, zvýšená gamaglutamyltransferáza,
zvýšená alkalická fosfatáza v krvi
Menej časté: Zvýšený krvný tlak, zvýšenie telesnej hmotnosti, zvýšená laktátdehydrogenáza v krvi, zvýšený kreatinín v krvi, zvýšená glukóza v krvi, zvýšený fosfor v krvi, znížený draslík v krvi, zvýšený bilirubín
|
Úrazy, otravy a komplikácie liečebného postupu
|
M
enej časté: Kontúzia
Zriedkavé: Jav radiačnej pamäti (radiation recall phenomenon), radiačná
pneumonitída
|
MedDRA (z angl. Medical Dictionary for Regulatory Activities) = Slovník medicínskej terminológie
pre regulačné činnosti.
SMQ (z angl. Standardized MedDRA Query) = štandardizované dotazy MedDRA; SMQ je zoskupenie niekoľkých termínov preferovaných MedDRA pre vystihnutie medicínskeho pojmu.
1 Frekvencia hypersenzitívnych reakcií sa vypočítala na základe jedného určite súvisiaceho prípadu v
skupine 789 pacientov.
2 Ako sa zaznamenalo podľa hlásení vychádzajúcich zo sledovaní lieku Abraxane po uvedení na trh.
3 Frekvencia výskytu pneumonitídy sa vypočítala na základe združených údajov od 1310 pacientov z klinických štúdií, ktorí dostávali Abraxane v monoterapii na liečbu rakoviny prsníka a v ďalších indikáciách zahrnutých MedDRA SMQ pod pojmom intersticiálne ochorenie pľúc. Pozri časť 4.4.
Popis vy branýc h neži aducich úči nkovĎalej nasledujú najčastejšie a klinicky relevantné nežiaduce účinky od 229 pacientov s metastatickým
karcinómom prsníka, ktorí boli liečení Abraxanom v dávke 260 mg/m2 jedenkrát za tri týždne
v pivotnej klinickej štúdii fázy III.
Poruchy krvi a lymfatického systémuNajvýznamnejšia pozorovateľná hematologická toxicita bola neutropénia (hlásená u 79 % pacientov), bola rýchlo reverzibilná a závisela od dávky; leukopénia bola hlásená u 71 % pacientov. Neutropénia
4. stupňa (< 500 buniek/mm3) sa vyskytla u 9 % pacientov liečených Abraxanom. Febrilná
neutropénia sa vyskytla u štyroch pacientov liečených Abraxanom. Anémia (Hb < 10 g/dl) sa pozorovala u 46 % pacientov liečených Abraxanom a bola závažná (Hb < 8 g/dl) v troch prípadoch. Lymfopénia sa pozorovala u 45 % pacientov.
Poruchy nervového systémuFrekvencia a závažnosť neurotoxicity u pacientov dostávajúcich Abraxane bola vo všeobecnosti závislá od dávky. Periférna neuropatia (najmä senzorická neuropatia 1. alebo 2. stupňa) sa pozorovala u 68 % pacientov liečených Abraxanom, pričom 10 % malo 3. stupeň a 4. stupeň nemal žiadny pacient.
Poruchy gastrointestinálneho traktuU 29 % pacientov sa vyskytla nauzea a u 25 % pacientov hnačka.
Poruchy kože a podkožného tkanivaAlopécia sa pozorovala u 90 % pacientov liečených Abraxanom.
Poruchy kostrovej a svalovej sústavy a spojivového tkanivaArtralgia sa vyskytla u 32 % pacientov liečených Abraxanom a v 6 % prípadov bola závažná. Myalgia sa vyskytla u 24 % pacientov na Abraxane a v 7 % prípadov bola závažná. Príznaky boli zvyčajne prechodné, obvykle sa vyskytli tri dni po podaní Abraxanu a vymizli do jedného týždňa.
Celkové poruchy a reakcie v mieste podaniaAsténia/únava sa hlásili u 40 % pacientov.
Adenokarcinóm pankreasu (Abraxane podávaný v kombinácii s gemcitabínom) Zoznam neži aducich úči nkov uv edený ch v tabuľke Nežiaduce účinky sa hodnotili v randomizovanej, kontrolovanej, otvorenej štúdii fázy III
u 421 pacientov liečených Abraxanom v kombinácii s gemcitabínom a u 402 pacientov liečených
gemcitabínom v monoterapii ako systémová liečba metastatického adenokarcinómu pankreasu v prvej línii. V tabuľke 5 sú uvedené nežiaduce účinky hodnotené u pacientov s adenokarcinómom pankreasu liečených Abraxanom v kombinácii s gemcitabínom.
Tabuľka 5: Nežiaduce účinky hlásené pri liečbe Abraxanom v kombinácii s gemcitabínom
Infekcie a nákazy
| Časté: Sepsa, pneumónia, orálna kandidóza
|
Pruchy krvi a lymfatického systému
| Veľmi časté: Neutropénia, anémia, trombocytopénia
Časté: Pancytopénia
Menej časté: Trombotická trombocytopenická purpura
| Poruchy metabolizmu a
výživy
| Veľmi časté: Dehydratácia, znížená chuť do jedla, hypokalémia
|
|
|
(n = 421)
T
abuľka 5: Nežiaduce účinky hlásené pri liečbe Abraxanom v kombinácii s gemcitabínom
(
n = 421)
Psychické poruchy
|
Veľmi časté: Nespavosť, depresia
Časté: Úzkosť
|
Poruchy nervového systému
|
Veľmi časté: Periférna neuropatiaa, dysgeúzia, bolesť hlavy, závrat
Menej časté: Paralýza VII. hlavového nervu
|
Poruchy oka
|
Č
asté: Zvýšené slzenie
Menej časté: Cystoidný edém makuly
|
Poruchy srdca a srdcovej
činnosti
|
Č
asté: Kongestívne srdcové zlyhanie, tachykardia
|
Poruchy ciev
|
Č
asté: Hypotenzia, hypertenzia
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Veľmi časté: Dýchavičnosť, epistaxa, kašeľ
Časté: Pneumonitída, upchanie nosa
Menej časté: Sucho v hrdle, suchý nos
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté: Nauzea, hnačka, vracanie, zápcha, bolesť brucha, bolesť hornej časti brucha
Časté: Stomatitída, intestinálna obštrukcia, kolitída, sucho v ústach
|
Poruchy pečene a žlčových ciest
|
Č
asté: Cholangitída
|
Poruchy kože a podkožného tkaniva
|
Veĺmi časté: Alopécia, vyrážka
Časté: Pruritus, suchá koža, porucha nechtov, návaly horúčavy
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
Veľmi časté: Bolesť v končatinách, artralgia, myalgia
Časté: Svalová slabosť, bolesť kostí
|
Poruchy obličiek a močových ciest
|
Č
asté: Akútne renálne zlyhanie
Menej časté: Hemolyticko-uremický syndróm
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté: Únava, periférny edém, pyrexia, asténia, zimnica
Časté: Reakcia v mieste podania infúzie
|
Laboratórne a funkčné
vyšetrenia
|
Veľmi časté: Úbytok telesnej hmotnosti, zvýšená hodnota
alanínaminotransferázy
Časté: Zvýšená hodnota aspartátaminotransferázy, zvýšená hladina bilirubínu v krvi, zvýšená hladina kreatinínu v krvi
|
MedDRA (z angl. Medical Dictionary for Regulatory Activities) = Slovník medicínskej terminológie pre regulačné činnosti; SMQ (z angl. Standardized MedDRA Query) = štandardizované dotazy
MedDRA (zoskupenie niekoľkých termínov preferovaných MedDRA pre vystihnutie medicínskeho pojmu).
a Periférna neuropatia hodnotená s použitím štandardizovaných dotazov MedDRA – SMQ (broad
scope– široký rozsah).
V tejto randomizovanej, kontrolovanej, otvorenej štúdii fázy III boli nežiaduce účinky vedúce k smrti do 30 dní od poslednej dávky študijného lieku hlásené u 4 % pacientov dostávajúcich Abraxane v kombinácii s gemcitabínom a u 4 % pacientov, ktorí dostávali gemcitabín v monoterapii.
Popis vybranýc h neži aducich úči nkovĎalej nasledujú najčastejšie a najdôležitejšie nežiaduce účinky u 421 pacientov s metastatickým karcinómom pankreasu, ktorí boli liečení Abraxanom v dávke 125 mg/m2 v kombinácii s gemcitabínom v dávke 1000 mg/m2 podávaných v 1., 8. a 15. deň každého 28-dňového cyklu v klinickej štúdii fázy III.
Poruchy krvi a lymfatického systémuTabuľka 6 uvádza frekvencie výskytu a závažnosť laboratórne detekovaných hematologických abnormalít u pacientov liečených Abraxanom v kombinácii s gemcitabínom alebo monoterapie
gemcitabínom.
Tabuľka 6: Laboratórne detekované hematologické abnormality v štúdii s adenokarcinómompankreasu
| Abraxane(125 mg/m2)/
gemcitabín
|
gemcitabín
| 1.-4. stupeň
(%)
| 3.-4. stupeň
(%)
| 1.-4. stupeň
(%)
| 3.-4. stupeň
(%)
| Anémiaa,b
| 97
| 13
| 96
| 12
| Neutropénia a,b
| 73
| 38
| 58
| 27
| Trombocytopéniab,c
| 74
| 13
| 70
| 9
|
|
|
a V skupine liečených Abraxanom/gemcitabínom sa hodnotilo 405 pacientov
b V skupine liečených gemcitabínom sa hodnotilo 388 pacientov
c V skupine liečených Abraxanom/gemcitabínom sa hodnotilo 404 pacientov
Periférna neuropatiaU pacientov liečených Abraxanom v kombinácii s gemcitabínom bol medián času do prvého výskytu 3. stupňa periférnej neuropatie 140 dní. Medián času do zlepšenia najmenej o 1 stupeň bol 21 dní
a medián času do zlepšenia z periférnej neuropatie 3. stupňa na stupeň 0 alebo 1 bol 29 dní. Z
pacientov, u ktorých bola liečba prerušená z dôvodu periférnej neuropatie, bolo 44 % (31 zo
70 pacientov) schopných pokračovať v liečbe Abraxanom v zníženej dávke. U žiadneho pacienta liečeného Abraxanom v kombinácii s gemcitabínom sa nevyskytla periférna neuropatia 4. stupňa.
SepsaSepsa bola hlásená u 5 % pacientov s neutropéniou alebo bez neutropénie, ktorým bol v priebehu hodnotenia adenokarcinómu pankreasu podávaný Abraxane v kombinácii s gemcitabínom. Ako
významne prispievajúce faktory sa identifikovali komplikácie súvisiace so základným ochorením
rakoviny pankreasu, najmä obštrukcia žlčových ciest alebo prítomnosť biliárneho stentu. Ak sa u pacienta vyvinie febrilita (bez ohľadu na počet neutrofilov), má sa začať liečba so širokospektrálnymi
antibiotikami. Pri febrilnej neutropénii sa má pozastaviť podávanie Abraxanu a gemcitabínu do času, kým sa horúčka nevylieči a absolútny počet neutrofilov dosiahne ≥ 1500 buniek/mm3 , potom sa má pokračovať v liečbe so zníženými dávkami (pozri časť 4.2).
PneumonitídaPneumonitída bola hlásená u 4 % pri použití Abraxanu v kombinácii s gemcitabínom. Zo 17 prípadov
pneumonitídy hlásenej u pacientov liečených Abraxanom v kombinácii s gemcitabínom, boli 2 fatálne. Pacienti majú byť pozorne sledovaní kvôli príznakom a symptómom pneumonitídy. Po vylúčení infekčnej etiológie a po určení diagnózy pneumonitídy sa má liečba Abraxanom a gemcitabínom
trvalo vysadiť a okamžite začať s primeranou liečbou a podpornými opatreniami (pozri časť 4.2).
Skúsenosti po uvedení lieku na trh
Ochrnutie hlavových nervov, paréza hlasiviek a zriedkavo sa hlásili prípady závažných hypersenzitívnych reakcií počas sledovania Abraxanu po uvedení na trh.
Počas liečby Abraxanom boli zriedkavo hlásené prípady zníženej zrakovej ostrosti zapríčinenej cystoidným edémom makuly. Po diagnostike cystoidného edému makuly by mala byť liečba Abraxanom ukončená.
U niektorých pacientov už predtým vystavených kapecitabinu sa hlásili prípady palmárno-plantárnej erytrodyzestézie v rámci pokračujúceho sledovania Abraxanu. Pretože tieto príhody sa hlásili dobrovoľne počas klinickej praxe, nemožno urobiť skutočné odhady frekvencie výskytu a kauzálny vzťah k týmto príhodám sa nezistil.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieNa predávkovanie paklitaxelom nie je známe žiadne antidotum. V prípade predávkovania sa má pacient pozorne monitorovať. Liečba sa má zamerať na hlavné očakávané toxicity, čo je potlačenie krvotvorby v kostnej dreni, mukozitída a periférna neuropatia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antineoplastické látky, rastlinné alkaloidy a iné prírodné liečivá,
taxány, ATC kód: L01CD01
Mechanizmus účinkuPaklitaxel je antimikrotubulárna látka, ktorá podporuje zoskupenie mikrotubulov z tubulínových
dimérov a mikrotubuly stabilizuje tým, že bráni ich depolymerizácii. Dôsledkom tejto stabilizácie je inhibícia normálnej dynamickej reorganizácie mikrotubulárnej siete, ktorá je nevyhnutná pre vitálne interfázové a mitotické bunkové funkcie. Okrem toho paklitaxel indukuje abnormálne usporiadanie alebo „zväzky“ mikrotubulov v celom bunkovom cykle a viacpočetné mikrotubulárne astery počas mitózy.
Abraxane obsahuje nanočastice o veľkosti približne 130 nm zložené z ľudského sérového albumínu a paklitaxelu, v ktorých sa paklitaxel nachádza v nekryštalickom, amorfnom stave. Po intravenóznom podaní sa nanočastice rýchlo disociujú na rozpustné, albumín viažúce komplexy paklitaxelu o veľkosti približne 10 nm. Albumín je známy ako sprostredkovateľ endotelovej dutinovej transcytózy zložiek plazmy a štúdie
in vitro preukázali, že prítomnosť albumínu v Abraxane zlepšuje transport paklitaxelu cez endotelové bunky. Existuje hypotéza, že tento zlepšený transendoteliálny dutinový transport je sprostredkovaný albumínovým receptorom gp-60, a že v oblasti tumoru dochádza k zvýšenému nahromadeniu paklitaxelu následkom proteínu viazaného na albumín, tzv. vylučovaný kyslý proteín bohatý na cysteín (Secreted Protein Acidic Rich in Cysteine - SPARC).
Klinická účinnosťabezpečnosťKarcinóm prsníkaNa podporu používania Abraxanu pri metastatickom karcinóme prsníka sú k dispozícii údaje od
106 pacientov zhromaždené v dvoch otvorených jednoramenných štúdiách a od 454 pacientov
liečených v randomizovanej komparatívnej štúdii fázy III. Tieto informácie sú uvedené nižšie.
O
t
vorené jednoramenné štúdie
V jednej štúdii sa Abraxane podával ako 30 minútová infúzia v dávke 175 mg/m2 43 pacientom s metastatickým karcinómom prsníka. V druhom klinickom skúšaní sa používala dávka 300 mg/m2 ako
30 minútová infúzia u 63 pacientov s metastatickým karcinómom prsníka. Pacienti sa liečili bez
premedikácie steroidmi alebo plánovanej podpory G-CSF. Cykly sa podávali v 3-týždňových
intervaloch. Miera odpovede u všetkých pacientov bola 39,5 % v jednej štúdii (95 % CI: 24,9 % –
54,2 %) a 47,6 % v druhej štúdii (95 % CI: 35,3 % – 60,0 %). Medián času do progresie ochorenia bol
5,3 mesiaca (175 mg/m2; 95 % CI: 4,6 – 6,2 mesiaca) a 6,1 mesiaca (300 mg/m2; 95 % CI: 4,2 – 9,8
mesiaca).
Randomizovaná komparatívna štúdiaToto multicentrické klinické skúšanie sa uskutočnilo u pacientov s metastatickým karcinómom prsníka, ktorí sa liečili každé 3 týždne paklitaxelom ako jedinou látkou, buď ako paklitaxel na báze rozpúšťadla 175 mg/m2, podávaný ako 3-hodinová infúzia s premedikáciou na zabránenie vzniku precitlivenosti (n = 225), alebo ako Abraxane 260 mg/m2, podávaný ako 30 minútová infúzia bez premedikácie (n = 229).
Šesťdesiatštyri percent pacientov malo oslabený stav výkonnosti (ECOG 1 alebo 2) pri nástupe do štúdie, 79 % malo viscerálne metastázy a 76 % malo > 3 miesta metastáz. Štrnásť percent pacientov nedostávalo predtým chemoterapiu; 27 % dostávalo len podpornú chemoterapiu, 40 % len na liečbu metastáz a 19 % aj na liečbu metastáz a aj ako podpornú liečbu. Päťdesiatdeväť percent dostávalo skúšaný liek ako druhú alebo vyššiu ako druhú líniu liečby. Sedemdesiatsedem percent pacientov už bolo skôr vystavených účinku antracyklínov.
Výsledky celkovej miery odpovede a čas do progresie ochorenia, čas prežívania bez progresie ochorenia a čas prežívania u pacientov, ktorí dostávali > ako liečbu 1. línie, sú uvedené nižšie.
Premenná účinnosti
| Abraxane
(260 mg/m2)
| Paklitaxel na báze
rozpúšťadla
(175 mg/m2)
| p-hodnota
| Miera odpovede [95 % CI] (%)
| > liečba 1. línie
| 26,5 [18,98; 34,05] (n = 132)
| 13,2 [7,54; 18,93] (n = 136)
| 0,006a
| * Medián času do progresie ochorenia [95 % CI] (týždne)
| > liečba 1. línie
| 20,9 [15,7; 25,9] (n = 131)
| 16,1 [15,0; 19,3] (n = 135)
| 0,011b
| * Medián prežívania bez progresie ochorenia [95 % CI] (týždne)
| > liečba 1. línie
| 20,6 [15,6; 25,9] (n = 131)
| 16,1 [15,0; 18,3] (n = 135)
| 0,010b
|
|
|
Tabuľka 7: Výsledky celkovej miery odpovede, medián času do progresie ochorenia a čas prežívania bez progresie ochorenia, podľa vyhodnotenia skúšajúceho
Premenná účinnosti
|
Abraxane
(260 mg/m2)
|
Paklitaxel na báze
rozpúšťadla
(175 mg/m2)
|
p-hodnota
|
*Prežívanie [95 % CI] (týždne)
|
> liečba 1. línie
|
56,4 [45,1; 76,9] (n = 131)
|
46,7 [39,0; 55,3] (n = 136)
|
0,020b
|
|
|
T
abuľka 7: Výsledky celkovej miery odpovede, medián času do progresie ochorenia a čas prežívania bez progresie ochorenia, podľa vyhodnotenia skúšajúceho
*Tieto údaje sa zakladajú na správe z klinickej štúdie: CA012-0 dodatok datovaný ako finálny (23. marca 2005)
a Chi-kvadrát test
b Log-rank test
U dvestodvadsaťdeväť pacientov liečených Abraxanom v randomizovanom, kontrolovanom klinickom
skúšaní sa hodnotila bezpečnosť. Neurotoxicita paklitaxelu sa vyhodnotila prostredníctvom zlepšenia o jeden stupeň u pacientov, ktorí mali periférnu neuropatiu 3. stupňa, kedykoľvek v priebehu liečby.
Prirodzený priebeh periférnej neuropatie v rozlíšení základnej línie vzhľadom na kumulatívnu toxicitu
Abraxanu po > 6 cykloch liečby sa nehodnotil a ostáva neznámy.
Adenokarcinóm pankreasuVykonala sa multicentrická, medzinárodná, randomizovaná, otvorená klinická štúdia u 861 pacientov,
ktorá porovnávala liečbu Abraxanom a gemcitabínom voči monoterapii gemcitabínom ako liečba
prvej línie u pacientov s metastatickým adenokarcinómom pankreasu. Abraxane sa podával pacientom (n = 431) ako intravenózna infúzia po dobu 30-40 minút v dávke 125 mg/m2, po ktorej nasledovala intravenózna infúzia gemcitabínu po dobu 30-40 minút v dávke 1000 mg/m2, obe podávané v 1., 8. a
15. deň každého 28-dňového cyklu. V porovnávacom ramene sa podával pacientom (n = 430) gemcitabín v monoterapii v súlade s odporúčanými dávkami a režimom. Liečba sa podávala do času progresie ochorenia alebo do rozvoja neprijateľnej toxicity. Zo 431 pacientov s adenokarcinómom pankreasu, ktorí boli randomizovaní do skupiny, ktorá dostávala Abraxane v kombinácii s gemcitabínom, bola väčšina (93 %) bielej rasy, 4 % boli čiernej rasy a 2 % boli Aziati. 16 % malo stav výkonnosti podľa Karnofského (
Karnofsky performance status, KPS) 100; 42 % malo KPS 90; 35 % malo KPS 80; 7 % malo KPS 70; a <1 % pacientov malo KPS pod 70. Pacienti s vysokým kardiovaskulárnym rizikom, periférnou arteriálnou chorobou a/alebo ochorením spojivového tkaniva a/alebo intersticiálnym ochorením pľúc v anamnéze boli vylúčení zo štúdie.'
Medián trvania liečby pacientov v ramene s Abraxanom a gemcitabínom bol 3,9 mesiaca a v ramene s gemcitabínom to bolo 2,8 mesiaca. 32 % pacientov v ramene s Abraxanom a gemcitabínom podstúpilo
6 alebo viac mesiacov liečby v porovnaní s 15 % pacientov v ramene s gemcitabínom. Pre liečenú
populáciu bol medián relatívnej intenzity dávky pre gemcitabín 75 % v ramene Abraxane/gemcitabín a
85 % v ramene s gemcitabínom. Medián relatívnej intenzity dávky Abraxanu bol 81 %. Vyšší medián kumulatívnej dávky gemcitabínu bol podaný v ramene Abraxane/gemcitabín (11 400 mg/m2) v porovnaní s ramenom s gemcitabínom (9000 mg/m2).
Primárnym cieľovým ukazovateľom účinnosti bola miera celkového prežívania (CP;
overall survival, OS). Kľúčovými sekundárnymi cieľovými ukazovateľmi bolo prežitie bez progresie (PBP;
progression-free survival, PFS) a celková miera odpovede (CMO;
overall response rate, ORR), obidva sekundárne cieľové ukazovatele boli hodnotené nezávislým, centrálnym, zaslepeným rádiológickým vyšetrením s použitím kritérií RECIST (verzia 1.0).
|
A
braxane(125 mg/m
2
)
/
gemcitabín
(
n = 431)
|
gemcitabín
(
n = 430)
|
C
elkové prežívanie
|
Počet úmrtí (%)
|
333 (77)
|
359 (83)
|
Medián celkového prežitia, v
mesiacoch (95 % CI)
|
8,5 (7,89; 9,53)
|
6,7 (6,01; 7,23)
|
a
HRA+G/G (95 % CI)
|
0,72 (0,617; 0,835)
|
p-hodnotab
|
<0,0001
|
Miera prežitia % (95 % CI)
|
|
v 1.roku
|
35 % (29,7; 39,5)
|
22 % (18,1; 26,7)
|
v 2.roku
|
9 % (6,2; 13,1)
|
4 % (2,3; 7,2)
|
75. percentil celkového prežitia
(mesiace)
|
14,8
|
11,4
|
P
r
ežitie bez progresie
|
Smrť alebo progresia, n (%)
|
277 (64)
|
265 (62)
|
Medián prežitia bez progresie,
v mesiacoch (95 % CI)
|
5,5 (4,47; 5,95)
|
3,7 (3,61; 4,04)
|
a
HRA+G/G (95 % CI)
|
0,69 (0,581; 0,821)
|
p-hodnotab
|
<0,0001
|
C
elková miera odpovede
|
Potvrdená úplná alebo
čiastočná celková odpoveď,
n (%)
|
99 (23)
|
31 (7)
|
95 % CI
|
19,1; 27,2
|
5,0; 10,1
|
pA+G/pG (95 % CI)
|
3,19 (2,178; 4,662)
|
p-hodnota (chi-kvadrát test)
|
<0,0001
|
|
|
T
abuľka 8: Výsledky účinnosti z randomizovanej štúdie u pacientov s adenokarcinómom pankreasu (populácia “intent-to-treat” - so zámerom liečiť)
CI = interval spoľahlivosti (z angl. confidence interval), HRA+G/G = pomer rizika
Abraxane+gemcitabín/gemcitabín, pA+G/pG= pomer miery odpovedí Abraxane+gemcitabín/gemcitabín
a stratifikovaný Coxov model proporčného rizika
b stratifikovaný log-rank test, stratifikovaný podľa geografických regiónov (Severná Amerika verzus ostatné), KPS (70 až 80 verzus 90 až 100) a prítomnosťou metastáz v pečeni (áno verzus nie).
Zaznamenalo sa štatisticky významné zlepšenie v celkovom prežívaní u pacientov liečených Abraxanom a gemcitabínom v porovnaní s gemcitabínom samotným, so zvýšením mediánu celkového prežitia o 1,8 mesiaca, 28 % celkového zníženia rizika úmrtia, 59 % miery zlepšenia v 1-ročnom prežívaní a 125 % miery zlepšenia v 2-ročnom prežívaní.
O
brázok 1: Kaplan-Meierova krivka celkového prežitia (populácia “intent-to-treat”)
1,0
0,9
0,8
0,7
0,6
0,5
0,4

0,3
0,2
0,1
0,0
ABRAXANE+Gemcitabín
Gemcitabín
(rizikoví pacienti)
ABX/GEM: GEM:
Čas (mesiace)
Účinky liečby na celkové prežívanie uprednostňujú rameno Abraxanu a gemcitabínu spomedzi
väčšiny preddefinovaných podskupín (vrátane pohlavia, KPS, geografického regiónu, primárneho miesta rakoviny pankreasu, rozsahu nádoru v čase diagnózy (stage), prítomnosti metastáz v pečeni, prítomnosti peritoneálnej karcinomatózy, uskutočnenia Whipplerovej operácie, prítomnosti biliárneho stentu na začiatku liečby, prítomnosti metastáz v pľúcach a počtu miest metastáz). U pacientov vo veku ≥ 75 rokov v ramene Abraxane a gemcitabín a v ramene s gemcitabínom bol pomer rizika prežívania 1,08 (95 % CI 0,653; 1,797). U pacientov s normálnymi hodnotami CA 19-9 na začiatku liečby bol pomer rizika prežívania 1,07 (95 % CI 0,692; 1,661).
K štatisticky významnému zlepšeniu v prežívaní bez progresie ochorenia došlo u pacientov liečených Abraxanom a gemcitabínom v porovnaní s gemcitabínom samotným, a to zvýšením v mediáne prežívania bez progresie o 1,8 mesiaca.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s Abraxanom vo
všetkých podskupinách pediatrickej populácie v liečbe metastatického karcinómu prsníka
a adenokarcinómu pankreasu (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
V klinických štúdiách sa zistila farmakokinetika celkového podaného paklitaxelu po 30 a 180 minútových infúziách Abraxanu pri hladinách dávok 80 až 375 mg/m2. Expozícia paklitaxelu (AUC) sa zvyšovala lineárne od 2653 do 16736 ng.hod/ml po podaní dávok od 80 do 300 mg/m2.
Po intravenóznom podaní Abraxanu pacientom s metastázujúcim karcinómom prsníka v odporúčanej klinickej dávke 260 mg/m2 sa koncentrácie paklitaxelu v plazme znižovali multifázovým spôsobom. Priemerná Cmax koncentrácia paklitaxelu, ktorá sa dosiahla na konci infúzie, bola 18,7 µg/ml. Priemerný celkový klírens bol 15 l/hod/m2. Terminálny polčas bol asi 27 hodín. Priemerný distribučný objem bol 632 l/m2, veľký distribučný objem indikuje rozsiahlu extravaskulárnu distribúciu a/alebo väzbu paklitaxelu na tkanivo.
V štúdii s pacientmi s pokročilými solídnymi tumormi sa farmakokinetické parametre paklitaxelu po
Abraxane podávanom intravenózne v dávke 260 mg/m2 počas 30 minút porovnávali s dávkami
175 mg/m2 infúzie paklitaxelu na báze rozpúšťadla podávaného v priebehu 3 hodín. Klírens paklitaxelu s Abraxanom bol väčší (43 %) ako po infúzii paklitaxelu na báze rozpúšťadla a aj jeho
distribučný objem bol vyšší (53 %). Rozdiely v Cmax a Cmax upravenej k dávke odrážali rozdiely v
celkovej dávke a rýchlosti infúzie. V terminálnom polčase neboli žiadne rozdiely.
V štúdii s opakovaným podávaním uskutočnenej na 12 pacientoch, ktorí dostávali Abraxane intravenózne v schválenej dávke, bola intraindividuálna variabilita systémovej expozície paklitaxelu (AUCinf) 19 % (rozsah = 3,21 % – 27,70 %). Pri viacnásobných liečebných cykloch sa nepozoroval žiadny dôkaz kumulácie paklitaxelu.
Analýza expozície pacienta (AUCinf) vzhľadom na telesnú hmotnosť naznačila tendenciu k zníženiu AUC pri 260 mg/m2 Abraxane v súvislosti so znižovaním telesnej hmotnosti. Pacienti s telesnou hmotnosťou 50 kg mali AUC paklitaxelu približne o 25 % nižšiu ako pacienti s telesnou hmotnosťou
75 kg. Klinický význam tohto zistenia nie je jasný.
Množstvo proteínu viažúceho paklitaxel po podaní Abraxanu bolo vyhodnotené ultrafiltráciou. Frakcia
voľného paklitaxelu bola významne vyššia pri Abraxane (6,2 %) ako u paklitaxelu na báze
rozpúšťadla (2,3 %). To malo za následok významne vyššiu expozíciu neviazaného paklitaxelu pri Abraxane v porovnaní s paklitaxelom na báze rozpúšťadla, hoci celková expozícia bola porovnateľná. Je to pravdepodobne z dôvodu nezachytenia paklitaxelu v micelách Cremophor EL, ako je to v prípade paklitaxelu na báze rozpúšťadla. Na základe publikácií v literatúre vyplýva, že in vitro štúdie väzbovosti na ľudské proteíny v sére (použitím paklitaxelu 6 µM) ukázali, že prítomnosť ranitidínu, dexametazónu ani difenhydramínu neovplyvnila väzbu proteínov na paklitaxel.
Na základe publikácií v literatúre vyplýva, že in vitro štúdie s mikrozómami z ľudskej pečene a rezmi tkaniva ukazujú, že paklitaxel sa metabolizuje primárne na 6a-hydroxypaklitaxel a na dva menšie metabolity, 3’-p-hydroxypaklitaxel a 6a-3’-p-dihydroxypaklitaxel. Vznik týchto hydroxylovaných metabolitov je katalyzovaný prostredníctvom CYP2C8 v prípade 6a-hydroxypaklitaxelu, CYP3A4
v prípade 3’-p-hydroxypaklitaxelu, a obidva typy CYP2C8 aj CYP3A4 v prípade 6a-3’-p- dihydroxypaklitaxelu.
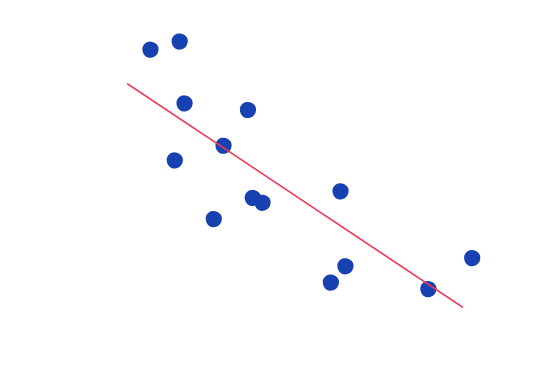
Farmakokinetický profil Abraxanu, podávaného ako 30 minútová infúzia, sa vyhodnotil u 15 z 30 pacientov s troma stupňami poškodenia pečene, hodnotenými na základe hladín sérového bilirubínu a pečeňových enzýmov. Obrázok 2 ukazuje koreláciu medzi klírensom paklitaxelu a celkovým bilirubínom v krvi, meraným pred podaním dávky.
O
brázok 2: Korelácia medzi klírensom paklitaxelu a celkovým bilirubínom v krvi
Klírens paklitaxel (ml/h/m2)
35000
30000
25000
u
Celkový bilirubín (µmol/l)
|
|

20000
15000
10 20 30 40 50 60 70 80 90
Cycle 1 bilirubin
Vplyv dysfunkcie obličiek na distribúciu paklitaxelu sa formálne neskúmal.
U pacientov s metastatickým karcinómom prsníka po 30 minútovej infúzii Abraxanu v dávke
260 mg/m2 predstavovala priemerná hodnota kumulovaného vylučovania močom nezmeneného liečiva
4 % celkovej podanej dávky s menej než 1 % metabolitov 6a-hydroxypaklitaxelu a
3’-
p-hydroxypaklitaxelu, čo indikuje rozsiahly klírens mimo obličiek. Paklitaxel sa primárne eliminuje metabolizáciou v pečeni a vylučuje sa žlčou.
Farmakokinetika paklitaxelu u pacientov vo veku nad 65 rokov sa zdá byť porovnateľná
s farmakokinetikou u pacientov vo veku do 65 rokov. Pre pacientov vo veku nad 75 rokov však existuje len málo informácií, pretože do farmakokinetickej analýzy boli zaradení len 3 pacienti nad
75 rokov.
5.3 Predklinické údaje o bezpečnostiKarcinogénny potenciál paklitaxelu sa neskúmal. Na základe publikácií v literatúre je však paklitaxel potenciálne karcinogénnou a genotoxickou látkou pri klinických dávkach na základe jeho farmakodynamického mechanizmu účinku. Ukázalo sa, že paklitaxel je klastogenický
in vitro (chromozómové aberácie v ľudských lymfocytoch) a
in vivo (mikronukleárny test u myší). Ukázalo sa, že paklitaxel je genotoxický
in vivo (mikronukleárny test u myší), no nevyvolával mutagenitu v Amesovom teste ani na ováriách čínskeho škrečka/hypoxantín-guanín fosforibozyltransferáza (CHO/HGPRT).
Paklitaxel pri nižších dávkach ako je terapeutická dávka pre ľudí sa spájal s nízkou plodnosťou a fetálnou toxicitou u potkanov. Štúdie na zvieratách s Abraxanom preukázali ireverzibilné toxické účinky na mužské reprodukčné orgány v dávkach zodpovedajúcich klinickému podaniu.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokRoztok ľudského albumínu (obsahujúci sodík, kaprylát sodný a N-acetyl-DL-tryptofanát).
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Neotvorenéinjekčnéliekovky
3 roky
Stabilita rekonštituovanej suspenzie v injekčnejliekovke
Po prvej rekonštitúcii sa má suspenzia okamžite naplniť do infúzneho vaku. Chemická a fyzikálna stabilita použiteľnosti však bola preukázaná 8 hodín pri 2 °C – 8 °C v pôvodnom obale a chránená pred priamym svetlom. V sterilnej miestnosti sa môže použiť alternatívna ochrana pred svetlom.
Stabilita rekonštituovanej suspenzie v infúznom vaku
Po rekonštitúcii sa má rekonštituovaná suspenzia v infúznom vaku použiť okamžite. Chemická a
fyzikálna stabilita použiteľnosti však bola preukázaná 8 hodín pri teplote neprevyšujúcej 25 °C.
6.4 Špeciálne upozornenia na uchovávanie
Neotvorené injekčnéliekovky
Injekčné liekovky uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Rekonštituovaná suspenzia
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
50 ml injekčná liekovka (sklo typu I) so zátkou (butylkaučuk), s vrchným uzáverom (hliník), obsahujúca 100 mg paklitaxelu vo forme nanočastíc viazaných na albumín.
100 ml injekčná liekovka (sklo typu I) so zátkou (butylkaučuk), s vrchným uzáverom (hliník),
obsahujúca 250 mg paklitaxelu vo forme nanočastíc viazaných na albumín.
Veľkosť balenia je jedna injekčná liekovka.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Bezpečnostnéopatreniapriprípravea podávaní
Paklitaxel je cytotoxický liek proti rakovine, a tak ako pri iných potenciálne toxických zlúčeninách je pri manipulácii s Abraxanom potrebné postupovať opatrne. Odporúča sa použitie rukavíc, ochranných
okuliarov a ochranného oblečenia. Ak sa suspenzia dostane do kontaktu s pokožkou, okamžite ju
dôkladne umyte mydlom a vodou. Ak sa dostane do kontaktu so sliznicami, okamžite ich dôkladne opláchnite vodou. Abraxane majú pripravovať a podávať len pracovníci primerane vyškolení na manipuláciu s cytotoxickými látkami. Tehotné pracovníčky nemajú manipulovať s Abraxanom.
Vzhľadom na možnosť extravazácie sa odporúča starostlivo sledovať miesto infúzie z dôvodu možnej infiltrácie počas podávania lieku. Obmedzenie infúzie Abraxane podľa odporúčania na 30 minút znižuje pravdepodobnosť reakcií súvisiacich s infúziou.
Príprava a podávanie lieku
Abraxane sa dodáva ako sterilný lyofilizovaný prášok na rekonštitúciu pred použitím. Po rekonštitúcii každý mililiter suspenzie obsahuje 5 mg paklitaxelu vo forme nanočastíc viazaných na albumín.
100 mginjekčnáliekovka: Pomocou sterilnej striekačky pomaly vstrekujte 20 ml roztoku chloridu sodného 9 mg/ml (0,9 %) na infúzny roztok do injekčnej liekovky s Abraxanom minimálne počas
1 minúty.
250 mg
i
n
j
ekčná
li
ekovka: Pomocou sterilnej striekačky pomaly vstrekujte 50 ml roztoku chloridu sodného 9 mg/ml (0,9 %) na infúzny roztok do injekčnej liekovky s Abraxanom minimálne počas
1 minúty.
Roztok sa má nasmerovať
navnútornústenuinjekčnejliekovky. Roztok sa nemá vstrekovať priamo
do prášku, pretože to spôsobí spenenie.
Po ukončení dolievania nechajte injekčnú liekovku stáť minimálne 5 minút, aby sa tuhé častice riadne
navlhčili. Potom je potrebné injekčnú liekovku jemne a pomaly miešať a/alebo preklápať najmenej
2 minúty, kým sa prášok úplne neresuspenduje. Musíte sa vyhnúť vytvoreniu peny. Ak dôjde k vytvoreniu peny alebo zhlukov, nechajte roztok stáť najmenej 15 minút, kým pena neopadne.
Pripravená suspenzia má byť mliečna a homogénna bez viditeľných zrazenín. Ak sú viditeľné zrazeniny alebo usadeniny, injekčnú liekovku treba znova jemne preklopiť, aby sa pred použitím zabezpečila úplná resuspenzia. Môže dôjsť k určitému usadeniu pripravenej suspenzie. Úplnú resuspenziu možno zaistiť jemným pretrepaním pred použitím.
Ak spozorujete zrazeniny, rekonštituovanú suspenziu zlikvidujte.
Je potrebné vypočítať presný objem celkovej dávky na 5 mg/ml suspenzie, potrebný pre pacienta
a vstreknúť príslušné množstvo rekonštituovaného Abraxanu do prázdneho, sterilného intravenózneho vaku z PVC alebo bez PVC. Na prípravu ani podávanie infúzií Abraxanu nie je nutné použitie
špecializovaných nádob s roztokmi bez obsahu di(2-etylhexyl)ftalátu (DEHP) alebo podávacích
súprav. Nepoužívajte zabudované (in-line) filtre.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIICelgene Europe Limited
1 Longwalk Road Stockley Park Uxbridge
UB11 1DB
Veľká Británia
8. REGISTRAČNÉ ČÍSLO(A)EU/1/07/428/001
EU/1/07/428/002
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 11. januára 2008
Dátum posledného predĺženia registrácie: 11. januára 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.