
/>Monitorovanie pacientov s určitými už existujúcimi srdcovými ochoreniami pri prvej dávke
Vzhľadom na riziko prechodného poklesu HR pri začatí liečby ozanimodom sa u pacientov
s pokojovou HR < 55 tepov/min, AV blokom druhého stupňa [Mobitz typ I] alebo infarktom myokardu, či srdcovým zlyhávaním v anamnéze odporúča pri prvej dávke počas 6 hodín sledovanie
s ohľadom na prejavy a príznaky symptomatickej bradykardie (pozri časť 4.3).
U pacientov sa má počas tohto 6-hodinového obdobia sledovať pulz a krvný tlak, s meraním každú hodinu. Pred začatím a na záver tohto 6-hodinového obdobia sa odporúča urobiť EKG.
Po 6 hodinách sa odporúča dodatočné sledovanie pacientov:
· so srdcovou frekvenciou menej než 45 tepov/min;
· s najnižšou hodnotou srdcovej frekvencie po podaní dávky, čo naznačuje, že k najväčšiemu
poklesu HR ešte pravdepodobne nedošlo;
· s dôkazom novovzniknutého AV bloku druhého alebo vyššieho stupňa podľa EKG urobeného
po 6 hodinách po podaní dávky;
· s QTc intervalom ≥ 500 ms.
V týchto prípadoch sa musí začať s vhodnými opatreniami a pokračovať v sledovaní, kým prejavy/nálezy nevymiznú. Ak sa vyžaduje lekárske ošetrenie, sledovanie musí pokračovať aj cez noc,
a 6-hodinové sledovacie obdobie sa musí zopakovať po druhej dávke ozanimodu.
Pred začatím liečby ozanimodom je potrebné získať pre nasledujúcich pacientov vyjadrenie kardiológa, aby sa rozhodlo, či je možné bezpečne začať liečbu ozanimodom a aby sa mohol určiť najvhodnejší postup sledovania:
· zástava srdca v anamnéze, mozgovocievne ochorenie, nekontrolovaná hypertenzia alebo závažné neliečené spánkové apnoe, opakované synkopy alebo symptomatická bradykardia v anamnéze;
· už existujúce významné predĺženie QT intervalu (QTc viac ako 500 ms) alebo iné riziká predĺženia QT intervalu, a pacienti, ktorí sú liečení inými liekmi ako beta-blokátormi
a blokátormi kalciového kanála, ktoré môžu potencovať bradykardiu;
· pacienti liečení antiarytmikami triedy Ia (napr. chinidín, dizopyramid) alebo triedy III (napr. amiodaron, sotalol), ktoré boli u pacientov s bradykardiou spojené s prípadmi torsades de pointes, sa v súvislosti s ozanimodom neskúmali.
Pečeňové funkcie
U pacientov liečených ozanimodom sa môže vyskytnúť zvýšenie hladín aminotransferáz (pozri
časť 4.8). Pred začatím liečby ozanimodom majú byť k dispozícii hodnoty aminotransferáz
a bilirubínu z nedávneho obdobia (t.j. posledných 6 mesiacov). Ak nie sú prítomné klinické príznaky,
majú sa sledovať hodnoty aminotransferáz a bilirubínu v liečebných mesiacoch 1, 3, 6, 9 a 12,
a následne pravidelne. Ak hladina pečeňových aminotransferáz stúpne nad 5-násobok ULN, má sa zaviesť častejšie sledovanie. Ak sa potvrdí zvýšenie hladín pečeňových aminotransferáz nad 5- násobok ULN, liečba ozanimodom sa má prerušiť a môže sa obnoviť, až keď sa hodnoty pečeňových aminotransferáz znormalizujú.
Ak sa u pacientov rozvinú príznaky naznačujúce dysfunkciu pečene, ako sú nevysvetliteľná nauzea, vracanie, bolesť brucha, únava, anorexia alebo zožltnutie a/alebo tmavý moč, je potrebné skontrolovať
hodnoty pečeňových enzýmov a ak sa potvrdí významná porucha funkcie pečene, liečba ozanimodom
sa musí prerušiť. Obnovenie liečby bude závisieť od toho, či sa stanoví iná príčina poruchy funkcie pečene a od prínosov obnovenia liečby pre pacienta v porovnaní s rizikami návratu pečeňovej
dysfunkcie. U pacientov s už existujúcim pečeňovým ochorením je pri užívaní ozanimodu zvýšené
riziko elevácie pečeňových enzýmov (pozri časť 4.2).
Použitie ozanimodu sa u pacientov s ťažkou poruchou funkcie pečene (Childova-Pughova trieda C)
neskúmalo a ozanimod sa u týchto pacientov nesmie používať (pozri časť 4.3).
Imunosupresívne účinky
Ozanimod má imunosupresívny účinok, ktorý pacientov predisponuje na riziko infekcie, vrátane
oportúnnych infekcií, a môže zvýšiť riziko rozvoja malignít, vrátane kožných malignít. Lekári majú pacientov dôkladne sledovať, najmä tých so súbežnými ochoreniami alebo známymi faktormi, ako je
predchádzajúca imunosupresívna liečba. V prípade podozrenia na toto riziko má lekár na individuálnej
báze zvážiť ukončenie liečby (pozri časť 4.3)
Infekcie
Ozanimod spôsobuje priemerne zníženie počtu lymfocytov v periférnej krvi na 45 % východiskových
hodnôt, z dôvodu reverzibilnej retencie lymfocytov v lymfoidných tkanivách. Preto môže ozanimod
zvýšiť náchylnosť na infekcie (pozri časť 4.8).
Pred začatím liečby ozanimodom má byť k dispozícii kompletný krvný obraz (complete blood cell count, CBC), vrátane počtu lymfocytov z nedávneho obdobia (t.j. z predchádzajúcich 6-tich mesiacov alebo po ukončení predchádzajúcej liečby MS).
Počas liečby sa tiež odporúča pravidelné sledovanie CBC. Ak sa potvrdí absolútny počet lymfocytov
< 0,2 x 109/l, má to viesť k prerušeniu liečby ozanimodom, až kým hodnoty nedosiahnu > 0,5 x 109/l,
kedy je možné zvážiť obnovenie liečby.
Začiatok podávania ozanimodu sa má u pacientov s aktívnou infekciou odložiť až do vyliečenia
infekcie.
Pacienti majú byť poučení, aby okamžite hlásili svojmu lekárovi príznaky infekcie. U pacientov s príznakmi infekcie počas liečby sa majú prijať účinné diagnostické a liečebné postupy. Ak sa
u pacienta vyvinie vážna infekcia, má sa zvážiť prerušenie liečby ozanimodom.
Keďže eliminácia ozanimodu po ukončení liečby môže trvať až 3 mesiace, sledovanie s ohľadom na prejavy infekcie má počas tohto obdobia pokračovať.
Predchádzajúcaasúbežnáliečbaprotinádorovými,imunosupresívnymialeboimunomodulačnými
terapiami
V klinických štúdiách MS neboli pacientom liečeným ozanimodom súbežne podávané protinádorové,
nesteroidné imunosupresívne alebo imunomodulačné terapie používané pre liečbu MS. Predpokladá sa, že súbežné použitie ozanimodu a ktorejkoľvek z týchto terapií zvyšuje riziko imunosupresie. Pri
prechodu z imunosupresívnych liekov na ozanimod sa musí vziať do úvahy polčas a spôsob účinku,
aby sa predišlo prídavnému imunitnému účinku a zároveň sa v rovnakom čase minimalizovalo riziko
reaktivácie ochorenia.
Po ukončení liečby interefónom (INF) sa vo všeobecnosti môže liečba ozanimodom začať okamžite.
Progresívna multifokálna leukoencefalopatia (progressive multifocal leukoencephalopathy, PML)
PML je oportúnna vírusová infekcia mozgu spôsobená vírusom John Cunningham (John Cunningham
virus, JCV), ktorá typicky postihuje imunokompromitovaných pacientov a môže viesť k smrti alebo ťažkému postihnutiu. Infekcia JCV s následkom PML sa pozorovala u pacientov liečených terapiami
MS a bola asociovaná s niektorými rizikovými faktormi (napr. polyterapia imunosupresívami, vážne
imunokompromitovaní pacienti). Typické príznaky spojené s PML sú rozličné, napredujú počas dní až týždňov a zahŕňajú progresívnu slabosť jednej strany tela alebo nemotornosť končatín, poruchy videnia, a zmeny v myslení, pamäti a orientácii, ktoré vedú k zmätenosti a zmenám osobnosti.
Lekári majú venovať zvýšenú pozornosť klinickým príznakom alebo nálezom na MRI poukazujúcim
na PML. Nálezy na MRI môžu byť zjavné ešte pred objavením sa klinických prejavov a príznakov. Ak existuje podozrenie na PML, liečba ozanimodom sa má odložiť, pokiaľ sa PML nevylúči. Ak sa PML
potvrdí, má sa liečba ozanimodom ukončiť.
Očkovanie
K dispozícii nie sú žiadne údaje o účinnosti a bezpečnosti vakcinácie u pacientov užívajúcich
ozanimod. Počas liečby a 3 mesiace po liečbe ozanimodom je potrebné vyhnúť sa použitiu živých
atenuovaných vakcín.
Ak je očkovanie živými atenuovanými vakcínami nutné, majú sa podať najmenej 1 mesiac pred začatím liečby ozanimodom. Pred začatím liečby ozanimodom sa u pacientov bez zdokumentovanej
imunity voči vírusu varicella zoster (varicella zoster virus, VZV) odporúča očkovanie proti VZV.
Kožné novotvary
Polovica novotvarov hlásených pri liečbe ozanimodom vo fáze 3 kontrolovaných klinických štúdií
pozostávala z nemelánomových kožných malignít, pričom najčastejšie sa vyskytujúcim kožným
novotvarom bol bazocelulárny karcinóm, ktorý bol hlásený s podobnou mierou výskytu
v kombinovaných skupinách s ozanimodom (0,2 %, 3 pacienti) a IFN ß-1a (0,1 %, 1 pacient).
Keďže existuje potenciálne riziko vzniku kožných malignít, pacienti liečení ozanimodom musia byť opatrní pri expozícii slnečnému žiareniu bez ochrany. Títo pacienti nesmú dostávať súbežnú fototerapiu s UV-B-žiarením alebo PUVA-fotochemoterapiu.
Edém makuly
Pri liečbe ozanimodom sa u pacientov s už existujúcimi rizikovými faktormi alebo s komorbiditami
pozoroval edém makuly s príznakmi poruchy zraku alebo bez nich (pozri časť 4.8).
U pacientov s uveitídou alebo diabetes mellitus v anamnéze alebo základným/súbežným ochorením
sietnice existuje zvýšené riziko vzniku edému makuly (pozri časť 4.8). Odporúča sa, aby pacienti
s diabetes mellitus, uveitídou alebo ochorením sietnice v anamnéze podstúpili pred začatím liečby ozanimodom oftalmologické vyšetrenie a počas liečby absolvovali následné kontroly.
Pacientov s príznakmi poruchy zraku poukazujúcimi na edém makuly je potrebné vyšetriť a v prípade
potvrdenia edému sa má liečba ozanimodom ukončiť. Pri rozhodovaní o tom, či sa má po úprave stavu liečba ozanimodom obnoviť, je potrebné vziať do úvahy potenciálne prínosy a riziká pre jednotlivého pacienta.
Syndróm posteriórnej reverzibilnej encefalopatie (posterior reversible encephalopathy syndrome,
PRES)
PRES je syndróm charakterizovaný náhlym vznikom silnej bolesti hlavy, zmätenosti, záchvatov
a straty zraku. Príznaky PRES sú zvyčajne reverzibilné, ale môžu vyústiť do ischemickej mozgovej porážky alebo mozgového krvácania. V kontrolovaných klinických skúšaniach s ozanimodom bol hlásený jeden prípad u pacienta so syndrómom Guillain-Barré. Ak vznikne podozrenie na PRES, liečba ozanimodom sa má ukončiť.
Účinky nakrvnýtlak
V klinických štúdiách s MS bola hypertenzia hlásená častejšie u pacientov liečených ozanimodom ako
u pacientov liečených IFN β-1a IM, a u pacientov, ktorí súbežne dostávali ozanimod a SSRI alebo
SNRI (pozri časť 4.8). Počas liečby ozanimodom musí byť krvný tlak pravidelne monitorovaný.
Respiračné účinky
U pacientov s ťažkým respiračným ochorením, pľúcnou fibrózou a obštrukčnou chorobou pľúc sa má
ozanimod podávať s opatrnosťou.
Súbežne podávané lieky
Súbežné podanie ozanimodu s inhibítormi proteínu rezistencie rakoviny prsníka (breast cancer
resistance protein, BCRP), inhibítormi monoaminooxidázy (monoamine oxidase, MAO) alebo
induktorom CYP2C8 (rifampicínom) sa neodporúča (pozri časť 4.5).
Ženy vo fertilnom veku
Z dôvodu rizika pre plod je ozanimod kontraindikovaný počas tehotenstva a u žien vo fertilnom veku,
ktoré nepoužívajú účinnú antikoncepciu. Pred začatím liečby musia byť ženy vo fertilnom veku informované o tomto riziku pre plod, musia mať negatívny tehotenský test a musia používať účinnú
antikoncepciu počas liečby a až do 3 mesiacov po ukončení liečby (pozri časti 4.3 a 4.6 a informácie
obsiahnuté v zozname pre zdravotníckeho pracovníka).
Návrat (rebound) aktivity ochoreniapoukončeníliečbyozanimodom
Po ukončení liečby iným modulátorom S1P receptora (sphingosine 1-phosphate receptor) boli vzácne
hlásené prípady závažnej exacerbácie ochorenia, vrátane návratu (rebound) choroby. Po prerušení
liečby ozanimodom sa má zvážiť možnosť závažnej exacerbácie ochorenia. Pacientov je po ukončení liečby ozanimodom potrebné sledovať s ohľadom na relevantné prejavy možnej závažnej exacerbácie alebo návratu vysokej aktivity ochorenia a v prípade potreby je potrebné zaviesť primeranú liečbu.
4.5 Liekové a iné interakcie
Účinok inhibítorov proteínurezistencierakovinyprsníka(BCRP)naozanimod
Inhibítor BCRP (cyklosporín) zdvojnásobil expozíciu (AUC) vedľajších aktívnych metabolitov, čo
môže následne viesť k podobnému vzostupu hlavných aktívnych metabolitov a zvýšeniu rizika
nežiaducich reakcií. Súbežné podanie inhibítorov BCRP (napr. cyklosporínu a eltrombopagu)
s ozanimodom sa neodporúča (pozri časť 4.4).
Účinok inhibítorov CYP2C8naozanimod
Súbežné podanie gemfibrozilu (silného inhibítora CYP2C8) v dávke 600 mg dvakrát denne
v ustálenom stave a jednorazovej dávky 0,46 mg ozanimodu zvýšilo expozíciu (AUC) hlavných aktívnych metabolitov približne o 47 % až 69 %. Pri súbežnom podaní ozanimodu so silnými
inhibítormi CYP2C8 (napr. gemfibrozilom, klopidogrelom) je potrebná opatrnosť.
Účinok induktorov CYP2C8naozanimod
Súbežné podanie rifampicínu (silného induktora CYP3A a P-gp, a stredne silného induktora CYP2C8)
v dávke 600 mg jedenkrát denne v ustálenom stave a jednorazovej dávky 0,92 mg ozanimodu znížilo expozíciu (AUC) hlavných aktívnych metabolitov približne o 60 % cestou indukcie CYP2C8, čo môže viesť k zníženej klinickej odpovedi. Súbežné podanie induktorov CYP2C8 (napr. rifampicínu)
s ozanimodom sa neodporúča (pozri časť 4.4).
Účinok inhibítorov monoaminooxidázy (MAO) na ozanimod
Potenciál klinickej interakcie s inhibítormi MAO sa neskúmal. Avšak súbežné použitie s inhibítormi
MAO-B môže znížiť expozíciu hlavných aktívnych metabolitov a viesť k zníženej klinickej odpovedi. Súbežné podanie inhibítorov MAO (napr. selegilínu, fenelzínu) s ozanimodom sa neodporúča (pozri
časť 4.4).
Účinokozanimodunaliekyspomaľujúcesrdcovúfrekvenciualeboatrioventrikulárnevedenie(napr.
beta-blokátory alebo blokátory kalciového kanála)
Ozanimod v jednorazovej dávke 0,23 mg spolu s dlhodobo pôsobiacim propranololom 80 mg
jedenkrát denne alebo diltiazemom 240 mg jedenkrát denne v ustálenom stave neviedol u zdravých
osôb k žiadnym dodatočným klinicky významným zmenám srdcovej frekvencie ani PR intervalu v porovnaní s podaním propranololu alebo diltiazemu samostatne. U pacientov liečených beta- blokátormi alebo blokátormi kalciového kanála je pri začatí liečby ozanimodom potrebná opatrnosť (pozri časť 4.4). Pacienti liečení inými bradykardizujúcimi liekmi a antiarytmikami (ktoré boli
u pacientov s bradykardiou spojené s prípadmi torsades de pointes) sa v súvislosti s ozanimodom neskúmali.
Očkovanie
Počas liečby a až do 3 mesiacov po liečbe ozanimodom môže byť očkovanie menej účinné. Použitie
živých atenuovaných vakcín môže byť rizikom pre vznik infekcií a preto je potrebné vyhnúť sa mu počas liečby a až do 3 mesiacov po liečbe ozanimodom (pozri časť 4.4).
Protinádorové, imunomodulačnéalebonesteroidnéimunosupresívneterapie
Z dôvodu rizika prídavných účinkov na imunitný systém sa protinádorové, imunomodulačné alebo
nesteroidné imunosupresívne terapie nemajú podávať súbežne (pozri časti 4.3 a 4.4).
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Ženy vo fertilnom veku/antikoncepcia u žien
Zeposia je kontraindikovaná u žien vo fertilnom veku, ktoré nepoužívajú účinnú antikoncepciu (pozri
časť 4.3). Preto pred začatím liečby u žien vo fertilnom veku musí byť k dispozícii negatívny výsledok tehotenského testu a týmto ženám musí byť poskytnuté poradenstvo ohľadom závažného rizika pre plod. Ženy vo fertilnom veku musia používať účinnú antikoncepciu počas liečby ozanimodom a až do
3 mesiacov po ukončení liečby (pozri časť 4.4).
V zozname pre zdravotníckeho pracovníka sú uvedené zvláštne opatrenia. Tieto opatrenia sa musia
vykonať predtým, ako sa ozanimod predpíše pacientkam a musia sa dodržiavať počas liečby.
Pri ukončení liečby ozanimodom kvôli plánovaniu tehotenstva je potrebné brať do úvahy možný návrat aktivity ochorenia (pozri časť 4.4).
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití ozanimodu u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu vrátane straty plodu a anomálií, najmä
malformácií krvných ciev, generalizovaného edému (anasarka) a chybného postavenia semenníkov a stavcov (pozri časť 5.3). Je známe, že receptor ovplyvnený ozanimodom (sfingozín-1-fosfátový receptor) je zapojený do tvorby ciev počas embryogenézy (pozri časť 5.3).
Z toho dôvodu je Zeposia počas tehotenstva kontraindikovaná (pozri časť 4.3). Podávanie Zeposie sa má ukončiť 3 mesiace pred plánovaním tehotenstva (pozri časť 4.4). Ak žena otehotnie počas liečby,
liečba Zeposiou sa musí ukončiť. Žene je potrebné poskytnúť poradenstvo ohľadom rizika škodlivých účinkov na plod spojených s liečbou a má byť sonograficky vyšetrená.
Dojčenie
Ozanimod/metabolity sa u liečených zvierat počas laktácie vylučujú do mlieka (pozri časť 5.3).
Vzhľadom na možné riziko závažných nežiaducich reakcií na ozanimod/metabolity u dojčiat, nemajú ženy liečené ozanimodom dojčiť.
Fertilita
Nie sú dostupné žiadne údaje o fertilite u ľudí. V štúdiách na zvieratách sa žiadne vedľajšie
účinky na fertilitu nepozorovali (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Zeposia nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie hlásenými nežiaducimi reakciami sú nazofaryngitída (11 %), zvýšenie hladiny
alanínaminotransferázy (5 %) a zvýšenie hladiny gamaglutamyltransferázy (5 %).
Najčastejšie nežiaduce reakcie vedúce k ukončeniu liečby boli spojené s eleváciou hladín pečeňových
enzýmov (1,1 %).
Zoznam nežiaducich reakcií v tabuľke
Nežiaduce reakcie pozorované u pacientov liečených ozanimodom sú zoradené podľa tried
orgánových systémov (system organ class, SOC) a frekvencie všetkých nežiaducich reakcií. Pri každom SOC a skupine frekvencie sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
Frekvencie sú definované ako: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000
až < 1/100), zriedkavé (³ 1/10 000 až < 1/1 000).
Tabuľka 2: Súhrn nežiaducich reakcií hlásených pri MS
Trieda orgánových systémov
|
Frekvencia
|
Nežiaduca reakcia
|
Infekcie a nákazy
| Veľmi časté
| Nazofaryngitída
|
Časté
| Faryngitída, vírusové infekcie dýchacej sústavy,
infekcie močovej sústavy*
|
Menej časté
| Herpes zoster
|
Poruchy krvi
a lymfatického systému
|
Veľmi časté
|
Lymfopénia
|
Poruchy imunitného systému
| Menej časté
|
Precitlivenost (vrátane vyrážky a urtikárie*)
|
Poruchy oka
| Menej časté
| Edém makuly**
|
Poruchy srdca a srdcovej
činnosti
| Časté
|
Bradykardia*
|
Poruchy ciev
| Časté
|
Hypertenzia*†, ortostatická hypotenzia
|
Laboratórne a funkčné
vyšetrenia
| Časté
| Zvýšená hladiny alanínaminotransferázy,
zvýšená hladiny gamaglutamyltransferázy, zvýšená hladina bilirubínu, abnormálne výsledky testov pľúcnych funkcií***
|
*Najmenej jedna z týchto nežiaducich reakcií bola hlásená ako závažná.
† Zahŕňa hypertenziu, esenciálnu hypertenziu a zvýšený krvný tlak (pozri časť 4.4).
** u pacientov s už existujúcimi faktormi (pozri časť 4.4)
***vrátane zníženého výsledku testov pľúcnych funkcií, abnormálnych výsledkov spirometrie, zníženej úsilnej vitálnej kapacity, zníženej difúznej kapacity oxidu uhoľnatého, zníženého úsilného exspiračného objemu
Popis vybraných nežiaducich reakciíZvýšené hladiny pečeňových enzýmovV klinických štúdiách MS sa vyskytlo zvýšenie ALT až 5-násobne nad hornú hranicu normy (
upper limit of normal, ULN) alebo vyššie u 1,6 % pacientov liečených ozanimodom 0,92 mg a u 1,3 %
pacientov na liečbe IFN β -1a i.m. Zvýšenie na 3-násobok ULN alebo vyššie sa vyskytlo u 5,5 %
pacientov na ozanimode a u 3,1 % pacientov na IFN β -1a i.m. Medián času do 3-násobného zvýšenia
ULN bol 6 mesiacov. Väčšina (79%) pokračovala v liečbe ozanimodom s návratom hodnôt na < 3- násobok ULN v priebehu približne 2 – 4 týždňov. V klinických štúdiách MS bola liečba ozanimodom ukončená kvôli potvrdenému zvýšeniu väčšiemu ako 5-násobok ULN. Celkovo bola miera ukončenia liečby kvôli zvýšeniu pečeňových enzýmov 1,1 % pacientov na ozanimode 0,92 mg a 0,8 % pacientov na IFN β -1a i.m.
BradyarytmiaV klinických štúdiách MS sa po úvodnej dávke ozanimodu 0,23 mg vyskytlo najväčšie priemerné zníženie HR v sede/v ľahu oproti východiskovej hodnote o 1,2 tepov za minútu v 5. hodine
počas 1. dňa, s návratom k približne východiskovej hodnote v 6. hodine. Pri pokračujúcom zvyšovaní
dávky nedošlo k žiadnemu klinicky podstatnému poklesu HR.
V klinických štúdiách MS bola bradykardia hlásená u 0,5 % pacientov liečených ozanimodom oproti
0 % pacientov liečených IFN β -1a i.m. v deň začatia liečby (1. deň). Po 1. dni bol výskyt
bradykardie 0,8 % pacientov na ozanimode oproti 0,7 % pacientov na IFN β -1a i.m. (pozri časť 5.1).
Pacienti, u ktorých sa vyskytla bradykardia, boli vo všeobecnosti asymptomatickí. Srdcová frekvencia pod 40 úderov za minútu nebola pozorovaná.
V klinických štúdiách MS bol atrioventrikulárny blok 1. stupňa hlásený u 0,6 % (5/882) pacientov
liečených ozanimodom oproti 0,2 % (2/885) pacientov liečených IFN β-1a i.m. Z prípadov hlásených s ozanimodom bolo 0,2 % hlásených 1. deň a 0,3 % po prvom dni.
Zvýšený krvný tlak
V klinických štúdiách MS bol priemerný vzostup systolického tlaku u pacientov liečených ozanimodom približne o 1-2 mmHg oproti pacientom liečených IFN β-1a i.m. a vzostup diastolického tlaku približne o 1 mmHg oproti IFN β-1a i.m. Vzostup systolického tlaku sa prvýkrát zistil približne po 3 mesiacoch od začatia liečby a počas liečby zostal stabilný.
Udalosti spojené s hypertenziou (hypertenzia, esenciálna hypertenzia a zvýšenie krvného tlaku) boli hlásené ako nežiaduca reakcia u 4,5 % pacientov liečených ozanimodom 0,92 mg a u 2,3 % pacientov liečených IFN β-1a i.m.
Zníženie počtu lymfocytov v krviV klinických štúdiách MS malo 3,3 % pacientov počet lymfocytov nižší ako 0,2 x 109/l, vo všeobecnosti s úpravou na hodnoty vyššie ako 0,2 x 109/l počas zotrvania na liečbe ozanimodom.
InfekcieV klinických štúdiách MS bola celková miera infekcií (35 %) pri ozanimode 0,92 mg podobná ako pri
IFN β -1a i.m. Ozanimod zvýšil riziko infekcií horných dýchacích ciest a infekcií močových ciest. Celková miera závažných infekcií v klinických štúdiách MS bola podobná pri ozanimode (1 %) a IFN β -1a i.m. (0,8 %).
Herpes zosterV klinických štúdiách MS bol herpes zoster hlásený ako nežiaduca reakcia u 0,6 % pacientov
liečených Zeposiou 0,92 mg a u 0,2 % pacientov na IFN β -1a i.m.
Respiračný systémPri liečbe ozanimodom boli pozorované menšie, na dávke závislé zníženia úsilného expiračného
objemu v prvej sekunde (
forced expiratory volume on first second, FEV1) a úsilnej vitálnej kapacity (
forced vital capacity, FVC). V klinických štúdiách MS bol medián zmeny oproti východiskovej hodnote FEV1 (FVC) v 3. a 12. mesiaci liečby v skupine s ozanimodom 1 mg - 0,07 l a - 0,1 l (- 0,05 l a - 0,065 l), v uvedenom poradí, s malými zmenami oproti východiskovej hodnote v skupine s IFN ß-
1a (FEV1: - 0,01 l a – 0,04 l, FVC: 0,00 l a - 0,02 l).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePacientov predávkovaných ozanimodom sledujte s ohľadom na prejavy a príznaky bradykardie, vhodné je sledovanie aj počas noci, do druhého dňa. Vyžaduje sa pravidelné meranie HR a krvného tlaku, odporúča sa tiež urobiť EKG (pozri časti 4.4 a 5.1). Zníženie HR vyvolané ozanimodom je možné zvrátiť parenterálnym podaním atropínu alebo izoprenalínu.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Imunosupresíva, selektívne imunosupresíva, ATC kód: L04AA38
Mechanizmus účinkuOzanimod je modulátor receptora sfingozín-1-fosfátu (S1P), ktorý sa selektívne viaže na podtypy 1 a 5
receptora sfingozín-1-fosfátu. Ozanimod spôsobuje zadržiavanie lymfocytov v lymfoidných tkanivách. Mechanizmus akým ozanimod uplatňuje terapeutický účinok pri MS nie je známy, ale môže zahŕňať zníženie migrácie lymfocytov do centrálneho nervového systému (CNS).
Ozanimod je 10-násobne selektívnejší voči S1P1 než voči S1P5 a má malú aktivitu voči ďalším S1P receptorom (S1P2, S1P3 a S1P4). Ozanimod sa u ľudí extenzívne metabolizuje a tvorí množstvo cirkulujúcich aktívnych metabolitov (pozri časť 5.2). In vitro ozanimod a jeho aktívne metabolity vykazujú podobnú aktivitu a selektivitu voči S1P1 a S1P5. Približne 94 % expozície cirkulujúceho celkového liečiva je u ľudí tvorené ozanimodom (6 %) a dvoma hlavnými metabolitmi CC112273 (73 %) a CC1084037 (15 %) (pozri časť 5.2).
Farmakodynamické účinky
Zníženie počtu lymfocytov v periférnej krvi
V priebehu 6 hodín od prvej dávky indukuje ozanimod od dávky závislé zníženie počtu lymfocytov
v periférnej krvi spôsobené reverzibilnou sekvestráciou lymfocytov v lymfoidných tkanivách.
V aktívne kontrolovaných klinických štúdiách MS klesol v 3. mesiaci priemerný počet lymfocytov približne na 45 % východiskovej hodnoty (približný priemerný počet lymfocytov v krvi 0,8 x 109/l)
a zostal stabilný počas liečby ozanimodom. Po ukončení liečby ozanimodom 0,92 mg bol medián času
do úpravy počtu lymfocytov v periférnej krvi do normálneho rozmedzia 30 dní, pričom u 90 %
pacientov došlo k úprave v priebehu 3 mesiacov (pozri časti 4.4 a 4.8).
Srdcová frekvencia a rytmus
Ozanimod môže pri úvodnom podaní spôsobiť prechodné zníženie HR (pozri časti 4.4 a 4.8). Tento negatívny chronotropný účinok mechanicky súvisí s aktiváciou draslíkových kanálov nasmerovaných
do vnútri, spojených s G-proteínom (G-protein-coupled inwardly rectifying potassium, GIRK)
stimuláciou S1P1 receptorov ozanimodom a jeho aktívnymi metabolitmi, čo vedie k bunkovej hyperpolarizácii a zníženej dráždivosti, pričom najvyšší účinok na HR sa pozoruje v priebehu 5 hodín
po dávke. V dôsledku jeho funkčného antagonizmu na S1P1 receptoroch, režim eskalácie dávky
ozanimodu 0,23 mg, nasledované dávkami 0,46 mg a 0,92 mg postupne znižuje citlivosť GIRK
kanálov až do času, keď sa dosiahne udržiavacia dávka. Po období eskalácie dávky, pri pokračujúcom
podávaní ozanimodu sa HR vracia k východiskovej hodnote.
Potenciál predĺženia QR intervalu
V randomizovanej, pozitívne a placebom kontrolovanej, podrobnej štúdii QT s použitím 14-dňového režimu eskalácie dávky 0,23 mg denne počas 4 dní, 0,46 mg denne počas 3 dní, 0,92 mg denne počas
3 dní a 1,84 mg denne počas 4 dní, neboli u zdravých osôb žiadne dôkazy predĺženia QTc , ktorý bol pod 10 ms, čo bolo preukázané hornou hranicou 95 % jednostranného intervalu spoľahlivosti (confidence interval, CI). Analýza vzťahu koncentrácie ozanimodu a jeho aktívnych metabolitov
CC112273 a CC1084037 a QTc, s použitím údajov z inej štúdie fázy 1 ukázala, že horná hranica 95 % CI pre modelovo odvodené QTc pod 10 ms pri maximálnych koncentráciách (korigované pre placebo
a východiskovú hodnotu) sa dosiahla pri dávkach ozanimodu ≥ 0,92 mg jedenkrát denne.
Klinická účinnosť a bezpečnosť
Ozanimod bol hodnotený v dvoch randomizovaných, dvojito zaslepených, dvojito simulovaných,
aktívne kontrolovaných klinických skúšaniach v paralelných skupinách, s podobným dizajnom a koncovými ukazovateľmi, u pacientov s relabujúcou-remitujúcou MS (RRMS). Štúdia 1 – SUNBEAM bola 1-ročná štúdia s pacientmi, ktorí pokračovali na pridelenej liečbe najmenej
12 mesiacov, až kým posledný zaradený pacient nedokončil štúdiu. Štúdia 2 – RADIANCE bola 2- ročná štúdia.
Dávky ozanimodu boli 0,92 mg a 0,46 mg podávané perorálne jedenkrát denne, s úvodnou dávkou
0,23 mg počas 1. - 4. dňa, nasledovanou eskaláciou dávky na 0,46 mg počas 5. -7. dňa a po 8. dni sa pokračovalo pridelenou dávkou. Dávka aktívneho komparátora IFN β -1a bola 30 µg a podávala sa
intramuskulárne jedenkrát týždenne.
Obe štúdie zahŕňali pacientov s aktívnym ochorením definovaným prítomnosťou najmenej jedného relapsu v predchádzajúcom roku alebo jedného relapsu v predchádzajúcich dvoch rokoch a aspoň
dôkazom lézie vychytávajúcej gadolínium (gadolinium-enhancing, GdE) v predchádzajúcom roku
a ich skóre rozšírenej škály stavu postihnutia (Expanded Disability Status Scale, EDSS) bolo od 0 do
5,0.
Neurologické hodnotenia sa uskutočňovali na začiatku štúdie, každé 3 mesiace a v čase podozrenia na relaps. MRI sa uskutočňovalo na začiatku štúdie (štúdie 1 a 2), v 6. mesiaci (SUNBEAM), v 1. roku (štúdie 1 a 2) a v 2. roku (RADIANCE).
Primárny cieľ aj v SUNBEAM aj v RADIANCE bola anualizovaná miera výskytu relapsov
(
annualised relapse rate, ARR) počas obdobia liečby (najmenej 12 mesiacov) v SUNBEAM
a 24 mesiacov v RADIANCE. Kľúčové sekundárne cieľové parametre zahŕňali: 1) počet nových alebo zväčšených T2 hyperintenzívnych lézií na MRI počas 12 a 24 mesiacov; 2) počet T1 GdE lézií na
MRI v 12. mesiaci a 24. mesiaci a 3) čas do potvrdenia progresie postihnutia, ktorá je definovaná ako
vzostup od východiskovej hodnoty EDSS najmenej o 1 bod, pretrvávajúci 12 týždňov. Potvrdená
progresia postihnutia sa prospektívne hodnotila v súhrnnej analýze štúdie 1 a štúdie 2.
V SUNBEAM bolo randomizovaných 1 346 pacientov na užívanie ozanimodu 0,92 mg (n = 447), ozanimodu 0,46 mg (n= 451) alebo IFN â-1a i.m. (n = 448); štúdiu dokončilo 94 % pacientov liečených ozanimodom 0,92 mg, 94 % pacientov liečených ozanimodom 0,46 mg a 92% pacientov liečených IFN â-1a i.m. V RADIANCE bolo randomizovaných 1 313 pacientov na užívanie ozanimodu 0,92 mg (n = 433), ozanimodu 0,46 mg (n= 439) alebo IFN β -1a i.m. (n = 441); štúdiu dokončilo 90 % pacientov liečených ozanimodom 0,92 mg, 85 % pacientov liečených ozanimodom
0,46 mg a 85% pacientov liečených IFN β -1a i.m. Priemerný vek pacientov zaradených do 2 štúdií bol 35,5 roka (rozsah 18-55), 67% boli ženy, priemerný čas od vznikov príznakov MS bol 6,7 roka.
Medián skóre EDSS na začiatku štúdie bol 2,5; približne jedna tretina pacientov bola liečená liečbou
modifikujúcou ochorenie (
disease-modifying therapy, DMT), prevažne interferónom alebo
glatirameracetátom. Na začiatku štúdie bol priemerný počet relapsov v predchádzajúcom roku 1,3 a
45 % pacientov malo jednu alebo viac T1 Gd-vychytávajúcich lézií (priemer 1,7).
Výsledky SUNBEAM a RADIANCE sú uvedené v tabuľke 3. Účinnosť sa preukázala u ozanimodu
0,92 mg, pričom účinok dávky pozorovaný pre študijné koncové ukazovatele je uvedený v tabuľke 3. Preukázanie účinnosti 0,46 mg bolo menej výrazné, keďže pri tejto dávke sa v RADIANCE
nepreukázal významný účinok na primárny cieľový ukazovateľ, ak sa do úvahy zobrala
uprednostňovaná stratégia negatívneho binominálneho modelu.
Tabuľka 3: Kľúčové klinické a MRI koncové ukazovatele u RMS pacientov zo štúdie 1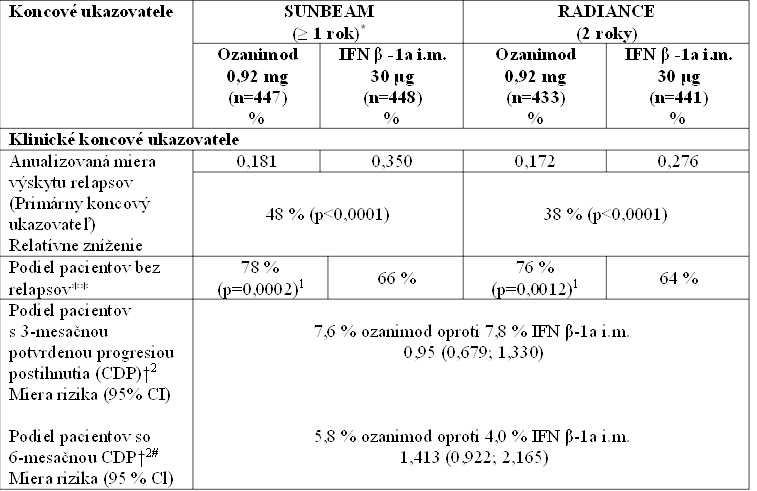 – SUNBEAM a štúdie 2 - RADIANCE
– SUNBEAM a štúdie 2 - RADIANCE
K
oncové ukazovatele MRI
|
Priemerný počet
nových alebo zväčšených T2 hyperintenzívnych lézií na MRI3
Relatívne zníženie
|
1,465
|
2,836
|
1,835
|
3,183
|
48 % (p<0,0001)
|
42 % (p<0,0001)
|
Priemerný počet T1
Gd- vychytávajúcich lézií4
Relatívne zníženie
|
0,160
|
0,433
|
0,176
|
0,373
|
63 % (p<0,0001)
|
53 % (p=0,0006)
|
* Priemerná doba trvania bola 13,6 mesiacov
** Nominálna p-hodnota cieľových ukazovateľov nezahrnutých do hierarchického testovania a neupravená pre opakovanie
†Progresia postihnutia definovaná ako vzostup o 1 bod v EDSS, s potvrdením o 3 mesiace alebo 6 mesiacov
# V post-hoc analýze 6-mesačného CDP, ktorá zahŕňala údaje z otvoreného pokračovania (štúdia 3), bola miera rizika (95 % CI) 1,040
(0,730; 1,482).
1 Log rank test
2 Prospektívne plánovaná súhrnná analýza štúdií 1 a 2
3 Počas 12 mesiacov v štúdii 1 a počas 24 mesiacov v štúdii 2
4 V 12. mesiaci v štúdii 1 a 24. mesiaci v štúdii 2
V SUNBEAM a RADIANCE viedla liečba ozanimodom 0,92 mg k zníženiu priemernej percentuálnej
zmeny normalizovaného objemu mozgu od východiskovej hodnoty v porovnaní s IFN beta-1a i.m.
(-0,41% oproti -0,61%, a -0,71% oproti -0,94%, v uvedenom poradí, nominálna p-hodnota <0,0001
v oboch štúdiách).
Do štúdií boli zaradení pacienti bez predchádzajúcej liečby s DMT a pacienti predtým liečení,
s aktívnym ochorením, ktoré bolo stanovené na základe klinických parametrov a zobrazovacích vyšetrení. V post-hoc analýzach populácií pacientov s odlišnými hladinami aktivity ochorenia, vrátane
aktívneho a vysoko aktívneho ochorenia sa ukázalo, že účinnosť ozanimodu na koncové ukazovatele
klinických parametrov a zobrazovacích vyšetrení bola konzistentná vo všetkých populáciách.
Dlhodobé údaje:
Pacienti, ktorí ukončili fázu 3 štúdií SUNBEAM a RADIANCE mohli vstúpiť do otvorenej
pokračovacej štúdie (štúdia 3 – DAYBREAK). Zo 751 pacientov pôvodne randomizovaných na ozanimod 0,92 mg a liečených po dobu až 3 rokov bola (upravená) hodnota ARR 0,124 po druhom roku liečby.
Pediatrická populáciaEurópska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s ozanimodom
v jednej alebo vo viacerých podskupinách pediatrickej populácie s MS (pozri časť 4.2).
5.2 Farmakokinetické vlastnostiOzanimod sa u ľudí extenzívne metabolizuje a tvorí množstvo cirkulujúcich aktívnych metabolitov, vrátane dvoch hlavných metabolitov CC112273 a CC1084037 s podobnou aktivitou a selektivitou voči S1P1 a S1P5 ako pôvodný liek. Maximálna plazmatická koncentrácia (Cmax) a plocha pod krivkou
(
area under the curve, AUC) ozanimodu, CC112273 a CC1084037 stúpali proporcionálne v rozmedzí
dávok ozanimodu 0,46 mg až 0,92 mg (0,5-násobok až 1-násobok odporúčanej dávky). Po opakovaných dávkach je približne 94 % expozície celkového cirkulujúceho liečiva reprezentované ozanimodom (6 %), CC112273 (73 %) a CC1084037 (15 %). Pri dávke ozanimodu 0,92 mg perorálne jedenkrát denne pri RRMS bol v ustálenom stave geometrický priemer [koeficient variácie (CV%)] Cmax 231,6 pg/ml (37, 2 %) a AUC0-24 a 4 223 pg*h/ml (37,7 ). Pre CC112273 sú tieto hodnoty 6 378 pg/ml (48,4 %) a 132 861 pg*h/ml (45,6 %), v uvedenom poradí. Pre CC1084037 zodpovedajú hodnoty Cmax a AUC0-24h približne 20 % hodnôt CC112273. Faktory ovplyvňujúce CC112273 sa vzťahujú aj na CC1084037, keďže sa jedná o vzájomne sa konvertujúce metabolity.
A
bsorpcia
Tmax ozanimodu je približne 6–8 hodín. Tmax CC112273 je približne 10 hodín. Podávanie ozanimodu
s veľmi tučným, vysoko kalorickým jedlom nemalo vplyv na expozíciu ozanimodu (Cmax a AUC).
Preto sa môže ozanimod užívať s jedlom alebo bez jedla.
Distribúcia
Priemerný (CV%) zdanlivý objem distribúcie ozanimodu (Vz/F) bol 5590 l (27 %), čo poukazuje na
extenzívnu distribúciu v tkanivách. Väzba ozanimodu na plazmatické bielkoviny je približne 98,2 %. Väzba CC112273 a CC1084037 na plazmatické bielkoviny je približne 99,8 % a 99,3 %, v tomto
poradí.
Biotransformácia
Ozanimod sa značne metabolizuje mnohými cestami biotransformácie vrátane aldehyddehydrogenázy
a alkoholdehydrogenázy (ALDH/ADH), izoformami 3A4 a 1A1cytochrómu P450 (CYP) a črevnou
mikroflórou a v celkovom metabolizme neprevažuje žiaden jednotlivý enzým. Po opakovanej dávke presiahli AUC dvoch hlavných metabolitov CC112273 a CC1084037 AUC ozanimodu 13-násobne
a 2,5-násobne, v uvedenom poradí. In vitro štúdie naznačili, že monoaminooxidáza B (MAO-B) je
zodpovedná za tvorbu CC112273 (cez intermediárny vedľajší aktívny metabolit RP101075), zatiaľ čo
CYP2C8 a oxidoreduktáza sú zapojené do metabolizmu CC112273. CC1084037 sa formuje priamo z CC112273 a podlieha reverzibilnému metabolizmu na CC112273. Vzájomná konverzia týchto
2 aktívnych metabolitov je mediovaná karbonylreduktázami (carbonyl reductases, CBR), aldoketoreduktázou (aldo-keto reductase, AKR) 1C1/1C2 a/alebo 3β- a 11β-
hydroxysteroiddehydrogenázou (hydroxysteroid dehydrogenase, HSD).
Eliminácia
Priemerný (CV%) zjavný perorálny klírens ozanimodu bol približne 192 l/h (37 %). Priemerný
(CV %) plazmatický polčas (t1/2) ozanimodu bol približne 21 hodín (15 %). Ustálený stav ozanimodu sa dosiahol v priebehu 7 dňov, s odhadovaným pomerom akumulácie po opakovanom perorálnom podaní 0,92 mg jedenkrát denne približne 2.
Priemer (CV %) efektívneho polčasu (t1/2) CC112273 na základe modelu bol u pacientov s RMS
približne 11 dní (104 %) s priemerným časom do ustálenia stavu približne 45 dní (45 %) a pomerom
akumulácie približne 16 (101 %), čo poukazuje na prevahu CC112273 nad ozanimodom. Plazmatické
hladiny CC112273 a jeho priameho, vzájomne sa konvertujúceho metabolitu CC1084037 klesali
v terminálnej fáze paralelne, čo malo za následok podobný t1/2 u oboch metabolitov. Očakáva sa, že
dosiahnutie ustáleného stavu a pomer akumulácie CC1084037 budú podobné ako u CC112273. Po podaní jednorazovej perorálnej dávky [14C]-ozanimodu 0,92 mg sa 26 % a 37 % rádioaktivity
získalo z moču a stolice, v uvedenom poradí, a bola primárne tvorená neaktívnymi metabolitmi. Koncentrácie ozanimodu, CC112273 a CC1084037 v moči boli zanedbateľné, čo naznačuje, že
renálny klírens nie je dôležitou cestou eliminácie ozanimodu, CC112273 a CC1084037.
Farmakokinetika u osobitných skupín pacientov
Porucha funkcie obličiek
V skúšaní zameranom na poruchu funkcie obličiek boli expozície (AUClast) ozanimodu a CC112273 po jednorazovej perorálnej dávke ozanimodu 0,23 mg u pacientov v terminálnom štádiu zlyhania obličiek (n = 8), v porovnaní s pacientmi s normálnou funkciou obličiek (n = 8), približne
o 27 % vyššie a 23 % nižšie, v uvedenom poradí. Na základe tohto skúšania nemá porucha funkcie
obličiek žiaden klinicky významný účinok na farmakokinetiku ozanimodu alebo CC112273. U pacientov s poruchou funkcie obličiek nie je potrebná úprava dávky.
Porucha funkcie pečene
V skúšaní zameranom na poruchu funkcie pečene boli expozície (AUClast) ozanimodu a CC112273 po
jednorazovej perorálnej dávke ozanimodu 0,23 mg u pacientov s miernou poruchou funkcie pečene
(Childova-Pughova trieda A; n = 8) v porovnaní s pacientmi s normálnou funkciou pečene (n = 7),
približne o 11 % nižšie a 31 % nižšie, v uvedenom poradí. Expozície (AUClast) ozanimodu
a CC112273 u pacientov so stredne ťažkou poruchou funkcie pečene (Childova-Pughova trieda B;
n = 8), v porovnaní s pacientmi s normálnou funkciou pečene (n = 8), boli približne o 27 % vyššie a 33 % nižšie, v uvedenom poradí. Tieto rozdiely sa nepokladali za klinicky významné. Farmakokinetika ozanimodu sa u pacientov s ťažkou poruchou funkcie pečene nehodnotila.
U pacientov s miernou alebo stredne ťažkou poruchou funkcie pečene (Childova-Pughova trieda A
a B) nie je potrebná úprava dávky. Použitie u pacientov s ťažkou poruchou funkcie pečene (Childova- Pughova trieda C) je kontrainidikované (pozri časť 4.3)
Staršie osoby
K dispozícii nie sú žiadne farmakokinetické údaje o podávaní ozanimodu pacientom vo veku 55 rokov a viac.
Pediatrická populácia
K dispozícii nie sú žiadne farmakokinetické údaje o podávaní ozanimodu pediatrickým alebo
dospievajúcim pacientom (vo veku < 18 rokov).
5.3 Predklinické údaje o bezpečnosti
V toxikologických štúdiách s opakovanými dávkami u myší (do 4 týždňov), potkanov (do 26 týždňov) a opíc (do 39 týždňov), ozanimod viditeľne ovplyvnil lymfatický systém (lymfopénia, lymfoidná atrofia a znížená protilátková odpoveď) a zvýšil hmotnosť pľúc a výskyt mononukleárnych alveolárnych infiltrátov, čo zodpovedá jeho primárnej aktivite na S1P1 receptoroch (pozri časť
5.1).V štúdiách chronickej toxicity s hladinami bez pozorovaných nežiaducich účinkov boli systémové expozície neúmerných hlavných aktívnych a pretrvávajúcich ľudských metabolitov CC112273
a CC1084037 (pozri časť 5.2), a dokonca aj celkovej účinnej látky u ľudí (ozanimod kombinovaný so spomenutými metabolitmi) nižšie než tie, ktoré sa očakávali u pacientov pri maximálnej ľudskej dávke
0,92 mg ozanimodu.
Genotoxicita a karcinogenita
Ozanimod a jeho hlavné aktívne metabolity u ľudín neprejavili genotoxický potenciál in vitro ani in vivo.
Karcinogenicita ozanimodu sa hodnotila v 6-mesačnej biologickej skúške Tg.rasH2 na myšiach
a dvojročnej biologickej skúške na potkanoch. V dvojročnej biologickej skúške na potkanoch neboli prítomné žiadne nádory súvisiace s liečbou pri akejkoľvek dávke ozanimodu. Avšak expozícia metabolitu pri najvyššej testovanej dávke bola 62 % expozície u ľudí u CC112273 a 18 % expozície u ľudí u CC1084037 pri maximálnej klinickej dávke 0,92 mg ozanimodu.
V 6-mesačnej štúdií Tg.rasH2 na myšiach bol vzostup výskytu hemangiosarkómov štatisticky významný a závislý na dávke. Pri nízkej dávke (8 mg/kg/deň) bol výskyt hemangiosarkómov
štatisticky významne zvýšený u samcov a pri stredných a vysokých dávkach (25 mg/kg/deň
a 80 mg/kg/deň) u samcov aj samíc, v porovnaní so súbežnými kontrolami. Na rozdiel od potkanov
a ľudí, agonizmus S1P1 receptoru u myší spôsobuje trvalú tvorbu placentárneho rastového faktora 2 (placental growth factor 2, PLGF2) a následne pretrvávajúce mitózy cievnych endotelových buniek,'
čo potenciálne vedie k druhovo špecifickým hemangiosarkómom u S1P1 agonistov. Preto hemangiosarkómy súvisiace s agonistami S1P1 receptora u myší môžu byť druhovo špecifické a nemusia predvídať riziko u ľudí.
V štúdií Tg.rasH2 na myšiach neboli prítomné žiadne nádory súvisiace s liečbou v akejkoľvek dávke.
Pri najnižšej testovanej dávke u myší v Tg.rashH2 bola expozícia dvom hlavným neúmerným
aktívnym metabolitom u ľudí pre CC112273 2,95-násobok a pre CC1084037 1,4-násobok expozície u ľudí pri maximálnej klinickej dávke 0,92 mg ozanimodu.
Reprodukčnátoxicita
Ozanimod nemal žiadny vplyv na fertilitu u mužov a žien pri systémovej expozícii do približne 150- násobku celkovej účinnej látky (kombinácia ozanimodu a metabolitov CC112273 a CC1084037) pri maximálnej ľudskej dávke 0,92 mg.
Embryofetálny vývin bol nepriaznivo ovplyvnený liečbou ozanimodom u matky, s úzkym (potkany) alebo žiadnym (králici) bezpečnostným rozmedzím založeným na porovnaní systémovej expozície celkovej účinnej látky, čo malo za následok stratu plodu alebo teratogenitu (generalizovaný edém/anasarka a chybné postavenie semenníkov u potkanov, chybené postavenie chvostových stavcov a malformácie veľkých ciev u králikov). Cievne nálezy u potkanov a králikov sú v súlade s predpokladanou farmakológiou S1P1.
Prenatálny a postnatálny vývin nebol ovplyvnený podaním ozanimodu až do 5,6-násobku systémovej
expozície celkovej účinnej látke pri maximálnej dávke 0,92 mg ozanimodu u ľudí. Ozanimod
a metabolity boli prítomné v mlieku potkanov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly
Mikrokryštalická celulóza
Koloidný bezvodý oxid kremičitý
Sodná soľ kroskarmelózy
Stearát horečnatý
Obal kapsuly
Zeposia 0,23 mg a 0,46 mg
Želatína
Oxid titaničitý (E171)
Žltý oxid železitý (E172) Čierny oxid železitý (E172) Červený oxid železitý (E172)
Zeposia 0,92 mg kapsula
Želatína
Oxid titaničitý (E171)
Žltý oxid železitý (E172)
Červený oxid železitý (E172)
Atramentová potlač
Šelak (E904)
Čierny oxid železitý (E172)
Propylénglykol (E1520)
Roztok amoniaku, koncentrát (E527) Hydroxid draselný (E525)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 25 °C.
6.5 Druh obalu a obsah balenia
Polyvinylchlorid (PVC)/polychlórotrifluoroetylén (PCTFE)/blistre z hliníkovej fólie.
Balenie na začatie liečby: Zeposia 0,23 mg a 0,46 mgVeľkosť balenia 7 tvrdých kapsúl (4 x 0,23 mg, 3 x 0,46 mg).
Udržiavacie balenie: Zeposia 0,92 mgVeľkosť balenia 28 alebo 98 tvrdých kapsúl.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIICelgene Europe B.V. Winthontlaan 6 N
3526 KV Utrecht
Holandsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)Balenie na začatie liečby -Zeposia0,23mg/0,46mgtvrdékapsulyEU/1/20/1442/001 (veľkosť balenia 7 tvrdých kapsúl)
Udržiavacie balenie - Zeposia 0,92 mg tvrdé kapsulyEU/1/20/1442/002 (veľkosť balenia 28 tvrdých kapsúl)
EU/1/20/1442/003 (veľkosť balenia 98 tvrdých kapsúl)
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: xxxxxxxx
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Písomná informácia pre používateľa
Z
eposia 0,23 mg tvrdé kapsuly
Z
eposia 0,46 mg tvrdé kapsuly
Z
eposia 0,92 mg tvrdé kapsuly
ozanimod

Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Môžete prispieť tým, že nahlásite akékoľvek vedľajšie účinky, ak sa u vás vyskytnú. Informácie o tom, ako hlásiť vedľajšie účinky, nájdete na konci časti 4.
Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek, pretožeobsahuje pre vás dôležité informácie.- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.
- Tento liek bol predpísaný iba vám. Nedávajte ho nikomu inému. Môže mu uškodiť, dokonca aj
vtedy, ak má rovnaké prejavy ochorenia ako vy.
- Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii.
Pozri časť 4.
V tejto písomnej informácii sa dozviete1. Čo je Zeposia a na čo sa používa
2. Čo potrebujete vedieť predtým, ako užijete Zeposiu
3. Ako užívať Zeposiu
4. Možné vedľajšie účinky
5. Ako uchovávať Zeposiu
6. Obsah balenia a ďalšie informácie
1. Čo je Zeposia a na čo sa používaČo je ZeposiaZeposia obsahuje liečivo ozanimod, ktorý patrí do skupiny liekov, ktoré môžu znížiť počet bielych krviniek (lymfocytov) voľne cirkulujúcich v tele.
Na čo sa Zeposia používaZeposia je indikovaná na liečbu dospelých pacientov s relaps-remitujúciou sklerózou multiplex
(
relapsing remitting multiple sclerosis, RRMS), s aktívnym ochorením.
Čo je roztrúsená skleróza· Roztrúsená skleróza (RS) je ochorenie, pri ktorom imunitný systém (obrana tela, vrátane bielych krviniek) chybne útočí na ochranný obal nervov v mozgu a mieche. To zabraňuje správnemu fungovaniu nervov a môže to viesť k príznakom ako sú: necitlivosť, ťažkosti s chôdzou
a problémy so zrakom a rovnováhou.
· Pri relaps-remitujúcej roztrúsenej skleróze nasledujú po útokoch na nervové bunky obdobia zotavení. Počas obdobia zotavenia môžu príznaky vymiznúť, ale niektoré problémy môžu pretrvávať.
Ako Zeposia účinkujeZeposia pomáha ochrániť nervy pred útokmi tým, že bráni lymfocytom dostať sa k mozgu a mieche, kde by mohli spôsobovať zápal a poškodenie ochranného obalu nervov.
2. Čo potrebujete vedieť predtým, ako užijete Zeposiu
N
e
užívajte Zeposiu:
· ak ste alergický na ozanimod alebo na ktorúkoľvek z ďalších zložiek tohto lieku (uvedených v časti 6);
· ak vám zdravotnícky pracovník povedal, že máte vážne oslabený imunitný systém;
· ak ste v uplynulých 6 mesiacoch mali srdcový infarkt, angínu pectoris, mozgovú porážku alebo mini-porážku (tranzitórny ischemický atak, transient ischemic attack, TIA) alebo určitý typ
závažného srdcového zlyhania;
· ak máte určitý typ nepravidelného alebo abnormálneho srdcového rytmu (arytmiu) – váš lekár pred začiatkom liečby skontroluje vaše srdce;
· ak máte závažnú infekciu ako je hepatitída alebo tuberkulóza;
· ak máte nádorové ochorenie;
· ak máte závažné problémy s pečeňou;
· ak ste tehotná alebo žena vo fertilnom veku a nepoužívate účinnú antikoncepciu.
Upozornenia a opatrenia
Predtým, ako začnete užívať Zeposiu, obráťte sa na svojho lekára alebo lekárnika ak:
· máte pomalú srdcovú frekvenciu alebo užívate alebo ste nedávno užívali lieky spomaľujúce
srdcovú frekvenciu (ako sú beta-blokátory alebo blokátory kalciového kanála);
· máte neliečené závažné problémy s dýchaním počas spánku (závažné spánkové apnoe);
· máte problémy s pečeňou;
· máte infekciu;
· máte nízke hladiny určitých bielych krviniek nazývaných lymfocyty;
· ste nikdy nemali alebo si nie ste istí, či ste mali ovčie kiahne;
· ste boli nedávno očkovaní alebo máte plánované očkovanie;
· ste si vy alebo ostatní všimli zhoršenie vašich príznakov MS, ako aj akékoľvek nové alebo neznáme príznaky. To môže byť spôsobené zriedkavou infekciou mozgu nazývanou
„progresívna multifokálna leukoencefalopatia“ (PML);
· v minulosti ste mali problémy so zrakom alebo iné príznaky nahromadenia tekutiny v centrálnej zóne sietnice nazývanej makula (toto ochorenie sa nazýva makulárny edém);
· máte zápal oka (uveitídu);
· máte cukrovku (ktorá môže spôsobiť problémy s očami);
· máte závažné ochorenie pľúc (pľúcnu fibrózu alebo chronické obštrukčné ochorenie pľúc).
Predtým, ako začnete užívať Zeposiu, vám lekár skontroluje srdce pomocou elektrokardiogramu (EKG). Ak máte určité ochorenie srdca, lekár vás bude sledovať najmenej prvých 6 hodín po prvej dávke.
Keďže Zeposia môže spôsobiť zvýšenie krvného tlaku, lekár vám pravdepodobne bude pravidelne kontrolovať tlak krvi.
Počas užívania Zeposie (a až do 3 mesiacov po ukončení užívania) môžete byť viac náchylní na infekcie. Akékoľvek infekcie, ktoré už máte, sa môžu zhoršiť. V prípade, že sa u vás rozvinie infekcia, obráťte sa na svojho lekára.
Keďže Zeposia môže zvýšiť riziko rakoviny kože, musíte obmedziť svoje vystavenie slnečnému a UV (ultrafialovému) svetlu nosením ochranného odevu a pravidelným používaním opaľovacieho krému (s vysokým ochranným faktorom).
Ak sa u vás počas liečby Zeposiou rozvinie silná bolesť hlavy, pocit zmätenosti alebo budete mať záchvaty (kŕče) a stratu zraku, okamžite sa obráťte na svojho lekára. Tieto príznaky sa môžu objaviť v dôsledku syndrómu nazývaného „syndróm reverzibilnej posteriornej encefalopatie“ (PRES).
Ženy vo fertilnom veku
Pri užívaní Zeposie počas tehotenstva môže dôjsť k poškodeniu nenarodeného dieťaťa. Predtým, ako začnete liečbu Zeposiou, vás lekár informuje o rizikách a požiada vás, aby ste si urobili tehotenský test na vylúčenie tehotenstva. Váš lekár vám dá kartu, v ktorej bude vysvetlené, prečo nemáte otehotnieť počas užívania Zeposie. Rovnako tam bude vysvetlené, ako zabrániť otehotneniu počas užívania Zeposie. Musíte používať účinnú antikoncepciu počas liečby a 3 mesiace po ukončení liečby (pozri časť „Tehotenstvo a dojčenie“).
Ak sa vás niečo z tohto týka, pred užívaním Zeposie sa poraďte so svojim lekárom alebo lekárnikom.
Zhoršenie RS po prerušení liečby Zeposiou
Ak si myslíte, že sa vám po prerušení liečby Zeposiou RS zhoršila, okamžite to povedzte svojmu lekárovi (pozri „Ak prestanete užívať Zeposiu“ v časti 3).
Deti a dospievajúci
Tento liek nepodávajte deťom a dospievajúcim vo veku menej ako 18 rokov. Je to z dôvodu, že
použitie Zeposie sa u detí a dospievajúcich neskúmalo.
Iné lieky a Zeposia
Ak teraz užívate alebo ste v poslednom čase užívali, či práve budete užívať ďalšie lieky, povedzte to svojmu lekárovi alebo lekárnikovi. Je to z dôvodu, že Zeposia môže ovplyvniť účinok iných liekov.
Rovnako aj iné lieky môžu ovplyvniť účinok Zeposie.
Predtým ako začnete užívať Zeposiu, povedzte svojmu lekárovi alebo lekárnikovi, ak práve užívate
alebo ste nedávno užívali najmä niektorý z nasledujúcich liekov:
· lieky potláčajúce alebo modulujúce imunitný systém (napr. cyklosporín a eltrombopag), vrátane iných liekov používaných na liečbu RS, ako sú alemtuzumab, beta interferón, dimetylfumarát, glatirameracetát, mitoxantrón, natalizumab alebo teriflunomid;
· gemfibrozil na úpravu hladín tukov alebo cholesterolu v krvi;
· klopidogrel, liek používaný na prevenciu tvorby krvných zrazenín;
· rifampicín, antibiotikum na liečbu tuberkulózy a iných závažných infekcií;
· lieky nazývané inhibítory monoaminooxidázy na liečbu depresie (napr. fenelzín) alebo
Parkinsonovej choroby (napr. selegilín);
· lieky spomaľujúce srdcovú frekvenciu (ako sú beta-blokátory alebo blokátory kalciového
kanála).
· určitý typ vakcín. Počas liečby a 3 mesiace po liečbe je potrebné vyhnúť sa živým atenuovaným
vakcínam.
Tehotenstvo a dojčenie
Ak ste tehotná alebo dojčíte, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím lekárom predtým, ako začnete užívať tento liek.
Tehotenstvo
Nepoužívajte Zeposiu počas tehotenstva, ak sa snažíte otehotnieť, alebo ak ste žena, ktorá môže otehotnieť a nepoužívate účinnú antikoncepciu. Pri užívaní Zeposie počas tehotenstva môže dôjsť
k poškodeniu nenarodeného dieťaťa. Ak ste žena, ktorá môže otehotnieť, predtým, ako začnete liečbu
Zeposiou, vás lekár bude informovať o rizikách a požiada vás, aby ste si urobili tehotenský test na vylúčenie tehotenstva. Musíte používať účinnú antikoncepciu počas liečby Zeposiou a aspoň 3
mesiace po ukončení liečby. Opýtajte sa vášho lekára na účinné formy antikoncepcie.
Lekár vám dá kartu, kde sa vysvetľuje, prečo nemáte počas liečby Zeposiou otehotnieť.
Okamžite oznámte svojmu lekárovi, ak otehotniete počas užívania Zeposie. Váš lekár sa rozhodne ukončiť liečbu. (pozri “Ak prestanete užívať Zeposiu” v časti 3). Vykoná sa špecializované prenatálne vyšetrenie.
D
ojčenie
· Počas užívania Zeposie nesmiete dojčiť. Zeposia môže prechádzať do materského mlieka a existuje riziko vážnych vedľajších účinkov pre dieťa.
Vedenie vozidiel a obsluha strojov
Zeposia nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
3. Ako užívať Zeposiu
Vždy užívajte tento liek presne tak, ako vám povedal váš lekár. Ak si nie ste niečím istý, overte si to
u svojho lekára alebo lekárnika.
Koľko lieku užívať
Keď prvýkrát začnete užívať Zeposiu, musíte začať nižšou dávkou a postupne dávku zvyšovať. Tým
sa minimalizuje riziko zníženia vašej srdcovej frekvencie.
· Dostanete „balenie na začatie liečby“, ktoré vám pomôže začať liečbu týmto spôsobom. Balenie
obsahuje:
o 4 svetlo-sivé kapsuly obsahujúce 0,23 mg ozanimodu. Užívajte jednu z nich na 1. až
4. deň liečby.
o 3 svetlo-sivé a oranžové kapsuly obsahujúce 0,46 mg ozanimodu. Užívajte jednu z
nich na 5., 6. a 7. deň.
· Na 8. deň a nasledujúce dni, po dokončení užívania „balenia na začatie liečby“, budete pokračovať v „udržiavacom balení“ s oranžovými kapsulami, kde každá obsahuje odporúčanú dávku 0,92 ozanimodu. Budete pokračovať v užívaní pravidelnej liečby jednou 0,92 mg kapsulou denne.
Ako užívať Zeposiu
· Zeposia je na perorálne použitie.
· Kapsulu prehltnite vcelku.
· Kapsulu môžete užiť s jedlom alebo bez jedla.
Ak užijete viac Zeposie, ako máte
Ak užijete viac Zeposie, ako máte, obráťte sa okamžite na svojho lekára alebo choďte priamo do nemocnice. Vezmite si so sebou balenie s liekom a túto písomnú informáciu pre používateľa.
Ak zabudnete užiť Zeposiu
· Ak zabudnete užiť dávku Zeposie, užite ju hneď, ako si spomeniete. Ak však zabudnete dávku užiť celý deň, vynechanú dávku preskočte a nasledujúcu dávku užite vo zvyčajnom čase.
· Neužívajte dvojnásobnú dávku, aby ste nahradili vynechanú dávku. Ak vynecháte jednu alebo
viac dávok počas prvých 14 dní na začiatku liečby Zeposiou, opýtajte sa svojho lekára, ako znova začať liečbu.
Ak prestanete užívať Zeposiu
· Neprestávajte užívať Zeposiu bez toho, aby ste sa najprv poradili so svojím lekárom.
· Opýtajte sa svojho lekára, ako znova začať liečbu, ak ste prestali užívať Zeposiu:
- 1 deň alebo viac dní počas prvých 14 dní liečby,
- počas viac ako 7 po sebe nasledujúcich dní medzi 15. a 28.dňom liečby,
- počas viac ako 14 po sebe nasledujúcich dní po 28 dňoch liečby. Bude potrebné, aby ste opäť začali užívať „balenie na začatie liečby“.
Zeposia vo vašom tele pretrváva až do 3 mesiacoch po ukončení užívania. Počet vašich bielych krviniek (počet lymfocytov) môže rovnako počas tohto času zostať nízky a stále sa môžu vyskytnúť nežiaduce reakcie uvedené v tejto písomnej informácii pre používateľa (pozri „Možné vedľajšie účinky“ v časti 4).
Ak si myslíte, že sa vám po ukončení liečby Zeposiou RS zhoršila, okamžite to povedzte svojmu
lekárovi.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára alebo
lekárnika.
4. Možné vedľajšie účinkyTak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
Závažné vedľajšie účinkyOkamžite sa obráťte sa na svojho lekára alebo lekárnika, ak si všimnete akýkoľvek z vážnych vedľajších účinkov uvedených nižšie:
·
Časté: môžu postihovať až 1 z 10 osôb
- znížená srdcová frekvencia,
- infekcia močových ciest,
- zvýšený krvný tlak.
·
Menej časté: môžu postihovať až 1 zo 100 osôb
- alergická reakcia – prejavy môžu zahŕňať vyrážku.
Ďalšie vedľajšie účinkyObráťte sa na svojho lekára alebo lekárnika, ak si všimnete akýkoľvek z nasledujúcich vedľajších účinkov:
·
Veľmi časté: môžu postihovať viac ako 1 z 10 osôb
- infekcie nosa alebo nosových dierok, nosovej dutiny, úst, hrdla (hltanu) alebo hlasiviek (hrtanu) spôsobené vírusmi,
- nízke hladiny určitých bielych krviniek nazývaných lymfocyty.
·
Časté: môžu postihovať až 1 z 10 osôb
- zápal hrdla (faryngitída),
- dýchacie infekcie (prejav pľúcnej infekcie),
- pokles krvného tlaku,
- zvýšené hladiny pečeňových enzýmov v krvných testoch (prejav problémov s pečeňou) alebo žlté zafarbenie kože, slizníc alebo očí (žltačka),
- pľúcne abnormality, ktoré môžu spôsobiť dýchavičnosť
·
Menej časté: môžu postihovať až 1 zo 100 osôb
- herpes zoster (pásový opar),
- rozmazané videnie (makulárny edém).
Hlásenie vedľajších účinkov
Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené v
Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať Zeposiu· Tento liek uchovávajte mimo dohľadu a dosahu detí.
· Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na blistri a škatuli po EXP.
Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
· Uchovávajte pri teplote neprevyšujúcej 25 °C.
· Nepoužívajte tento liek, ak spozorujete poškodenie alebo znaky manipulácie s obalom.
· Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácie
Čo Zeposia obsahuje
· Liečivo je ozanimod.
- Zeposia 0,23 mg tvrdé kapsuly
Každá tvrdá kapsula obsahuje 0,23 mg ozanimodu (ako hydrochlorid).
- Zeposia 0,46 mg tvrdé kapsuly
Každá tvrdá kapsula obsahuje 0,46 mg ozanimodu (ako hydrochlorid).
- Zeposia 0,92 mg tvrdé kapsuly
Každá tvrdá kapsula obsahuje 0,92 mg ozanimodu (ako hydrochlorid).
· Ďalšie zložky sú
- Obsah kapsuly:
mikrokryštalická celulóza, koloidný bezvodý oxid kremičitý, sodná soľ kroskarmelózy, stearan horečnatý.
- Obal kapsuly :
§ Každá 0,23 mg kapsula obsahuje želatínu, oxid titaničitý (E171), žltý oxid železitý (E172), čierny oxid železitý (E172) a červený oxid železitý (E172).
§ Každá 0,46 mg kapsula obsahuje želatínu, oxid titaničitý (E171), žltý oxid
železitý (E172), čierny oxid železitý (E172) a červený oxid železitý (E172).
§ Každá 0,92 mg kapsula obsahuje želatínu, oxid titaničitý (E171), žltý oxid železitý (E172) a červený oxid železitý (E172).
- Atramentová potlač: čierny oxid železitý (E172), šelak (E904), propylénglykol
(E1520), roztok amoniaku, koncentrát (E527), hydroxid draselný (E525).
Ako vyzerá Zeposia a obsah balenia
· Zeposia 0,23 mg, tvrdá kapsula veľkosti 14,3 mm, má svetlosivé nepriehľadné viečko a telo, s čiernou potlačou “OZA” na viečku a “0.23 mg” na tele kapsuly.
· Zeposia 0,46 mg, tvrdá kapsula veľkosti 14,3 mm, má nepriehľadné oranžové viečko a svetlosivé telo, s čiernou potlačou “OZA” na viečku a “0.46 mg” na tele kapsuly.
· Zeposia 0,92 mg, tvrdá kapsula veľkosti 14,3 mm, má nepriehľadné oranžové viečko a telo, s čiernou potlačou “OZA” na viečku a “0.92 mg” na tele kapsuly.
Veľkostibalenia
· „Balenie na začatie liečby“ je skladacie vrecko obsahujúce 7 tvrdých kapsúl: 4 x 0,23 mg
tvrdých kapsúl, 3 x 0,46 mg tvrdých kapsúl.
· Udržiavacie balenie obsahujúce 28 x 0,92 mg tvrdých kapsúl ALEBO
· Udržiavacie balenie obsahujúce 98 x 0,92 mg tvrdých kapsúl.
Na trh nemusia byť uvedené všetky veľkosti balenia.
Držiteľ rozhodnutia o registrácii
Celgene Europe B.V. Winthontlaan 6 N
3526 KV Utrecht
Holandsko
Výrobca
Celgene Distribution B.V. Winthontlaan 6 N
3526 KV Utrecht
Holandsko
T
áto písomná informácia bola naposledy aktualizovaná v
Ď
alšie zdroje informácií
Podrobné a aktualizované informácie o tomto lieku sú dostupné po naskenovaní QR kódu na vonkajšom balení smartfónom. Rovnaké informácie sú tiež dostupné na internetovej stránke
www.zeposia-eu-pil.com.Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
 http://www.ema.europa.eu.
http://www.ema.europa.eu.