
ledku vyššie uvedených ochorení, dávka sa u staršej populácii nepovažuje za odlišnú od dávky u pacientov vo veku 18 až 65 rokov.
V klinických štúdiách bol Xembify hodnotený u 5 osôb s PID vo veku > 65 rokov a na dosiahnutie
požadovaných sérových hladín IgG neboli potrebné žiadne špecifické úpravy dávky.
Pediatrická populácia
Dávkovanie u detí a dospievajúcich (0-18 rokov) sa nelíši od dávkovania u dospelých, keďže sa dávkovanie pre každú indikáciu stanovuje na základe telesnej hmotnosti a upravuje podľa klinického výsledku pri indikáciách substitučnej liečby.
Xembify bol hodnotený u 43 pediatrických osôb s PID vo veku 2 až 16 rokov (vrátane), ktorí zahŕňali
28 osôb vo veku 12 rokov alebo mladších. Pre pediatrickú populáciu neboli na dosiahnutie požadovaných sérových hladín IgG potrebné žiadne špecifické úpravy dávky.
Spôsob podávania
Len na subkutánne použitie.
Subkutánnu infúziu pri domácej liečbe musí začať podávať a monitorovať zdravotnícky pracovník, ktorý má skúsenosti s vedením pacientov pri domácej liečbe. Je možné použiť infúzne pumpy vhodné na subkutánne podávanie imunoglobulínov. Pacient alebo ošetrovateľ musí byť poučený o používaní infúznej pumpy, infúznych technikách, vedení denníka o liečbe, rozpoznaní závažných nežiaducich reakcií a opatreniach, ktoré je potrebné vykonať v prípade ich výskytu.
Xembify sa môže injekčne podávať do miest ako je brucho, stehno, horná časť ramena a laterálna časť
bedra.
Odporúčaná úvodná rýchlosť infúzie závisí od individuálnych potrieb pacienta. Úprava rýchlosti infúzie a objemu infúzie v každom mieste podania závisí od znášanlivosti pacienta.
Odporúča sa použiť úvodnú rýchlosť podávania 10 ml/h/miesto podania infúzie. Ak je dobre znášaná (pozri časť 4.4), môže sa pri prvých dvoch infúziách rýchlosť podávania zvyšovať v intervaloch najmenej 10 minút maximálne na 20 ml/h/miesto pre pediatrických pacientov a maximálne na
25 ml/h/miesto pre dospelých pacientov.
Ak je táto rýchlosť dobre znášaná počas dvoch infúzií (pozri časť 4.4), rýchlosť infúzie sa môže postupne zvýšiť na 35 ml/h/miesto.
Súbežne je možné použiť viac ako jednu pumpu. Množstvo lieku infúzne podaného do konkrétneho miesta sa môže líšiť. U dojčiat a detí sa miesto na podanie infúzie môže meniť každých 5 – 15 ml.
U dospelých sa dávky nad 30 ml môžu rozdeliť podľa preferencie pacienta. Počet miest na podanie
infúzie nie je obmedzený. Miesta na podanie infúzie majú byť od seba vzdialené najmenej 5 cm.
Miesta na podanie infúzie sa majú striedať a je potrebné vyhnúť sa výbežkom kostí.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1 (pozri
časť 4.4). Xembify sa nemá podávať intravaskulárne alebo intramuskulárne.
Pacienti, ktorí mali anafylaktickú alebo závažnú systémovú reakciu na podanie ľudského imunoglobulínu.
Pacienti s nedostatkom IgA s protilátkami proti IgA a precitlivenosťou na liečbu ľudským imunoglobulínom v anamnéze.
4.4 Osobitné upozornenia a opatrenia pri používaní
Sledovateľnosť
Aby sa zlepšila (do)sledovateľnosť biologického lieku, má sa zrozumiteľne zaznamenať názov a číslo šarže podaného lieku.
Ak sa Xembify náhodne podá do krvnej cievy, u pacienta sa môže vyvinúť šok.
Odporúčaná rýchlosť podávania infúzie uvedená v časti 4.2 sa musí dôsledne dodržať. Pacienti sa musia počas podávania infúzie pozorne monitorovať a starostlivo pozorovať s ohľadom na výskyt akýchkoľvek nežiaducich príznakov.
Niektoré nežiaduce reakcie sa môžu objavovať častejšie u pacientov, ktorým sa podáva normálny ľudský imunoglobulín po prvýkrát alebo, v zriedkavých prípadoch, ak dôjde k zmene lieku obsahujúceho normálny ľudský imunoglobulín alebo ak od predchádzajúcej infúzie uplynulo dlhé obdobie.
Prípadným komplikáciám je možné často predísť:
· pomalým injekčným podaním lieku na začiatku (neprekračujte 25 ml/hod/miesto),
· uistite sa, že pacienti sú starostlivo sledovaní na prípadný výskyt akýchkoľvek nežiaducich príznakov počas celého obdobia podávania infúzie. Najmä pacienti, ktorým ešte nebol podaný normálny ľudský imunoglobulín, pacienti po zmene z alternatívneho lieku obsahujúceho
imunoglobulín alebo ak od predchádzajúcej infúzie uplynul dlhý časový interval, musia byť sledovaní počas prvého podania infúzie a počas prvej hodiny po prvej infúzii, s cieľom zistiť možné nežiaduce prejavy.
Všetci ostatní pacienti sa musia sledovať najmenej počas 20 minút po podaní.
V prípade výskytu nežiaducej reakcie sa má buď znížiť rýchlosť podávania infúzie alebo sa má zastaviť infúzia. Potrebná liečba závisí od povahy a závažnosti nežiaducej reakcie. Pri reakciách alergického alebo anafylaktického typu sa vyžaduje okamžité ukončenie podávania.
V prípade šoku sa má použiť štandardná liečba šoku.
Precitlivenosť
Pravé alergické reakcie sú zriedkavé. Môžu sa objaviť najmä u pacientov s anti-IgA protilátkami, títo
pacienti sa majú liečiť s osobitnou opatrnosťou. Pacienti s anti-IgA protilátkami, u ktorých je liečba
subkutánnymi liekmi obsahujúcimi IgG jedinou možnosťou, majú byť liečení liekom Xembify len pod
dôkladným dohľadom lekára.
Zriedkavo môže normálny ľudský imunoglobulín vyvolať pokles krvného tlaku s anafylaktickou reakciou, dokonca aj u pacientov, ktorí predchádzajúcu liečbu normálnym ľudským imunoglobulínom dobre tolerovali.
Tromboembólia
S používaním imunoglobulínov sa spájajú arteriálne a venózne trombembolické príhody zahŕňajúce
infarkt myokardu, cievnu mozgovú príhodu, hlbokú žilovú trombózu a pľúcnu embóliu. Pred použitím imunoglobulínov majú byť pacienti dostatočne hydratovaní. Opatrnosť je potrebná u pacientov s už
existujúcim rizikom výskytu trombotických príhod (ako napr. užívanie estrogénov, pokročilý vek,
hypertenzia, diabetes mellitus a výskyt vaskulárneho ochorenia alebo trombotických epizód v anamnéze, pacienti so získanými alebo vrodenými trombofilnými poruchami, dlhodobo imobilizovaní pacienti, ťažko hypovolemickí pacienti, pacienti s ochoreniami, ktoré zvyšujú viskozitu krvi).
Pacientov je potrebné informovať o prvých príznakoch trombembolických príhod, medzi ktoré patrí dýchavičnosť, bolesť a opuch končatiny, fokálne neurologické deficity a bolesť na hrudníku a je potrebné ich poučiť, aby okamžite pri výskyte týchto príznakov kontaktovali svojho lekára.
Syndróm aseptickej meningitídy (aseptic meningitis syndrome, AMS)
V súvislosti so subkutánnou liečbou imunoglobulínmi bol hlásený výskyt syndrómu aseptickej
meningitídy. Príznaky sa zvyčajne objavia v priebehu niekoľkých hodín až 2 dní po liečbe. Zvýšený výskyt AMS sa častejšie pozoroval u žien ako u mužov. Pre AMS sú charakteristické nasledujúce
prejavy a príznaky: silná bolesť hlavy, stuhnutosť šije, ospalosť, horúčka, svetloplachosť, nauzea a
vracanie. Pacienti s prejavmi a príznakmi AMS sa majú dôkladne neurologicky vyšetriť vrátane vyšetrenia mozgovomiechového moku, aby sa vylúčili iné príčiny meningitídy. Prerušenie liečby
imunoglobulínom môže v priebehu niekoľkých dní viesť k remisii AMS bez následkov.
Pacienti sa musia informovať o prvých príznakoch AMS. AMS sa môže častejšie vyskytovať v
súvislosti s vysokými dávkami a/alebo vysokou rýchlosťou infúzie.
Renálna dysfunkcia/ zlyhanie
U pacientov liečených imunoglobulínom, najmä pri liekoch obsahujúcich sacharózu (Xembify
neobsahuje sacharózu), boli hlásené závažné renálne nežiaduce reakcie. Tieto zahŕňajú akútne renálne zlyhanie, akútnu tubulárnu nekrózu, proximálnu tubulárnu nefropatiu a osmotickú nefrózu. Medzi
faktory, ktoré zvyšujú riziko renálnych komplikácií, patria okrem iného už existujúca renálna insuficiencia, diabetes mellitus, hypovolémia, súbežné užívanie nefrotoxických liekov, vek nad 65 rokov, sepsa, hyperviskozita a paraproteinémia.
Je tiež potrebné sledovať pacientov s poruchou funkcie obličiek, najmä pacientov s už existujúcou renálnou insuficienciou alebo rizikom akútneho renálneho zlyhania.
Interferencia sosérologickými testami
Po podaní injekcie imunoglobulínu môže dôjsť k prechodnému nárastu rôznych pasívne prenesených
protilátok v krvi pacienta, a tým k zavádzajúcim pozitívnym výsledkom v sérologických testoch.
Pasívny prenos protilátok proti antigénom erytrocytov, napr. A, B, D môže interferovať s niektorými sérologickými testami na protilátky proti červeným krvinkám, napríklad priamy antiglobulínový test (DAT, priamy Coombsov test). V prípade vysokých dávok alebo krvnej skupiny inej ako 0 sa môže objaviť hemolýza, preto sa odporúča monitorovanie.
Prenosné látky
Štandardné opatrenia na prevenciu infekcií spôsobených používaním liekov vyrobených z ľudskej krvi
alebo plazmy zahŕňajú výber darcov, skríning jednotlivých odberov a plazmatických poolov na špecifické markery infekcií a zaradenie účinných výrobných krokov na inaktiváciu/odstránenie vírusov. Napriek tomu pri príprave liekov vyrábaných z ľudskej krvi alebo plazmy nie je možné úplne vylúčiť možnosť prenosu infekčných agensov. To platí aj pre neznáme alebo novovznikajúce vírusy a iné patogény.
Vykonané opatrenia sa považujú za účinné proti obaleným vírusom ako napr. vírus ľudskej imunodeficiencie (HIV), vírus hepatitídy B (HBV) a vírus hepatitídy C (HCV) a proti neobalenému vírusu hepatitídy A (HAV). Vykonané opatrenia môžu mať obmedzený účinok proti neobaleným vírusom ako parvovírus B19.
Klinické štúdie znovu potvrdili absenciu prenosu hepatitídy A alebo parvovírusu B19 imunoglobulínmi a predpokladá sa, že obsah protilátok vo veľkej miere prispieva k vírusovej bezpečnosti.
Dôrazne sa odporúča, aby sa pri každom podávaní Xembify pacientovi zaznamenal názov a číslo šarže lieku s cieľom zachovať prepojenie medzi pacientom a číslom šarže lieku.
Pediatrická populácia
Uvedené upozornenia a opatrenia sa vzťahujú na dospelých a aj deti.
4.5 Liekové a iné interakcie
Živé oslabenévírusovévakcíny
Po podaní imunoglobulínu môže počas obdobia najmenej 6 týždňov až 3 mesiacov dôjsť k zníženiu
účinnosti živých oslabených vírusových vakcín, ako sú vakcíny proti osýpkam, rubeole, mumpsu a ovčím kiahňam. Medzi podaním tohto lieku a očkovaním živou oslabenou vírusovou vakcínou musí uplynúť obdobie 3 mesiacov. V prípade vakcíny proti osýpkam môže toto zníženie účinnosti trvať až
1 rok.
Z tohto dôvodu sa má u pacientov očkovaných vakcínou proti osýpkam skontrolovať hladina
protilátok.
Pediatrická populácia
Uvedené interakcie sa vzťahujú na dospelých a aj pediatrickú populáciu.
Starší ľudia
Uvedené interakcie sa vzťahujú na starších pacientov.
4.6 Fertilita, gravidita a laktácia
Gravidita
Bezpečnosť aplikácie tohto lieku gravidným ženám nebola overená v kontrolovaných klinických
skúšaniach, preto sa má podávať gravidným ženám a dojčiacim matkám len s veľkou opatrnosťou.
Pri imunoglobulínových liekoch sa preukázalo, že prestupujú placentou, vo zvýšenej miere počas tretieho trimestra. Klinické skúsenosti s imunoglobulínmi naznačujú, že sa neočakávajú žiadne škodlivé účinky na priebeh gravidity alebo na plod a na novorodenca.
Dojčenie
Imunoglobulíny sa vylučujú do ľudského materského mlieka a môžu prispievať k ochrane
novorodenca pred patogénmi, ktoré do organizmu vstupujú cez sliznice.
Fertilita
Klinické skúsenosti s imunoglobulínmi naznačujú, že sa neočakávajú žiadne škodlivé účinky na
ferlititu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Xembify má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje, napr. závrat (pozri časť 4.8). Pacienti, u ktorých sa počas liečby objavia nežiaduce reakcie, majú pred vedením vozidla alebo obsluhou strojov počkať do odznenia týchto účinkov.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Príležitostne sa môžu vyskytnúť nežiaduce reakcie ako zimnica, bolesť hlavy, závrat, horúčka,
vracanie, alergické reakcie, nauzea, bolesť kĺbov, nízky krvný tlak a stredne silná bolesť v spodnej časti chrbta.
Normálne ľudské imunoglobulíny môžu zriedkavo spôsobiť náhly pokles krvného tlaku a v ojedinelých prípadoch anafylaktický šok, dokonca aj v prípade, ak sa u pacienta pri predchádzajúcom podaní nevyskytli žiadne známky precitlivenosti.
Často sa môžu objaviť lokálne reakcie v miestach podania infúzie: opuch, bolestivosť, začervenanie,
stvrdnutie, pocit tepla v mieste podania, svrbenie, podliatina a vyrážka.
Informácie týkajúce sa bezpečnosti s ohľadom na prenosné agensy, pozri časť 4.4.
Tabuľkový zoznamnežiaducichreakcií
Bezpečnosť subkutánne podávaného lieku Xembify bola hodnotená v dvoch prospektívnych,
otvorených, nekontrolovaných, multicentrických štúdiách fázy 3 u 110 osôb mužského alebo ženského
pohlavia vo veku 2 – 72 rokov so syndrómom primárnej imunodeficiencie (PID) s predchádzajúcou liečbou IVIg/SCIg. Štyridsaťdeväť (49) osôb bolo v severoamerickej štúdii a 61 osôb v európskej štúdii.
V obidvoch štúdiách došlo u ôsmich osôb k prerušeniu podávania Xembify z dôvodu nežiaducich reakcií, všetky boli miernej až strednej závažnosti okrem inkompetencie aortálnej chlopne v dôsledku vrodenej anomálie.
Nasledujúca tabuľka používa klasifikáciu orgánových systémov MedDRA (trieda orgánových systémov a preferovaná úroveň terminológie).
Frekvencie boli hodnotené podľa nasledujúcej konvencie: Veľmi časté (≥1/10); časté (≥1/100 až
<1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až <1/1 000); veľmi zriedkavé (<1/10 000). V rámci každej skupiny frekvencie sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti (všetky nezávažné).
Frekvencia nežiaducich reakcií spojených s Xembify u 1 % alebo viac osôb a na jednu infúziu vklinických štúdiáchTrieda orgánových systémov podľa MedDRA
|
Nežiaduca reakcia
| Frekvencia na osobua
(N = 110 osôb)
| Frekvencia na
infúziub
(N = 4 098 infúzií)
|
Infekcie a nákazy
| rinitída
| 3 (2,7 %) časté
| 4 (0,0010) menej časté
|
Poruchy nervového systému
| bolesť hlavy
| 4 (3,6 %) časté
| 4 (0,0010) menej časté
|
Poruchy gastrointestinálneho
traktu
| hnačka
| 3 (2,7 %) časté
| 3 (0,0007) zriedkavé
|
nauzea
| 2 (1,8 %) časté
| 2 (0,0005) zriedkavé
|
Poruchy kože a podkožného
tkaniva
| papula
| 2 (1,8 %) časté
| 2 (0,0005) zriedkavé
|
pruritus
| 2 (1,8 %) časté
| 2 (0,0005) zriedkavé
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
| artralgia
| 3 (2,7 %) časté
| 3 (0,0007) zriedkavé
|
bolesť chrbta
| 3 (2,7 %) časté
| 3 (0,0007) zriedkavé
|
Celkové poruchy a reakcie v mieste podania
| lokálna reakcia v mieste
podania infúzie
| 35 (31,8 %) veľmi časté
| 125 (0,0305) časté
|
pyrexia
| 2 (1,8 %) časté
| 4 (0,0010) menej časté
|
Laboratórne a funkčné vyšetrenia
| znížená krvná hladina
imunoglobulínu G
| 2 (1,8 %) časté
| 2 (0,0005) zriedkavé
|
a Frekvencia na osobu je vypočítaná pomocou počtu osôb s nežiaducimi účinkami okrem infekcií, pri ktorých
existovala aspoň možnosť príčinného vzťahu s Xembify, vydeleného celkovým počtom osôb.
b Frekvencia na jednu infúziu je vypočítaná pomocou počtu infúzií spojených s výskytom nežiaducich účinkov okrem infekcií, pri ktorých existovala aspoň možnosť príčinného vzťahu s Xembify, vydeleného celkovým počtom infúzií.
Skúsenosti po uvedeníliekunatrhuNasledujúce nežiaduce reakcie boli identifikované a hlásené počas používania Xembify po jeho
uvedení na trh: lokálna reakcia v mieste podania infúzie ako napr. erytém a opuch, dyspnoe, únava, bolesť, nauzea a bolesť hlavy. Frekvenciu týchto reakcií nie je možné vždy spoľahlivo odhadnúť.
Pediatrická populáciaPredpokladá sa, že frekvencia, typ a závažnosť nežiaducich reakcií v pediatrickej populácii bude
rovnaká ako u dospelých.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNásledky predávkovania nie sú známe.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: imunoséra a imunoglobulíny: normálne ľudské imunoglobulíny na extravenózne podanie, ATC kód: J06BA01
Mechanizmus účinku
Xembify poskytuje široké spektrum opsonizujúcich a neutralizačných protilátok imunoglobulínu G
(IgG) proti bakteriálnym, vírusovým, parazitickým a mykoplazmatickým agensom a ich toxínom. Úloha týchto protilátok a mechanizmus účinku Xembify nie sú úplne objasnené.
Farmakodynamické účinky
Normálny ľudský imunoglobulín obsahuje najmä imunoglobulín G (IgG) so širokým spektrom
protilátok proti rôznym infekčným agensom.
Normálny ľudský imunoglobulín obsahuje protilátky IgG prítomné v bežnej populácii. Zvyčajne sa
pripravuje zo zmiešanej plazmy od minimálne 1 000 darcov. Distribúcia podtried imunoglobulínu G zodpovedá ich distribúcií v prirodzenej ľudskej plazme. Odpovedajúce dávky tohto lieku môžu upraviť abnormálne nízke hladiny imunoglobulínu G na normálne rozmedzie.
Klinická účinnosť pri PID
V európskej štúdii bolo liekom Xembify liečených celkovo 61 osôb so syndrómami primárnej
imunodeficiencie vo veku od 2 rokov do 69 rokov počas obdobia až do 52 týždňov. Priemerná dávka podávaná každý týždeň bola 125,5 mg/kg telesnej hmotnosti. Počas liečby sa tým trvalo dosiahli minimálne hladiny IgG s priemernou koncentráciou 947,64 mg/dl. Osobám bolo podaných celkovo
3 045 infúzií lieku Xembify raz týždenne. Ročná miera výskytu závažných bakteriálnych infekcií
(serious bacterial infections, SBI) bola 0,017 na jeden osoborok (horná hranica jednostranného 99 %
intervalu spoľahlivosti 0,036), čo predstavuje jednu osobu s pneumóniou liečenú perorálnymi
antibiotikami v ambulantnej starostlivosti s vyriešením do 4 dní.
V severoamerickej štúdii bolo liekom Xembify liečených celkovo 49 osôb so syndrómom primárnej imunodeficiencie vo veku od 2 rokov do 72 rokov počas obdobia až do 24 týždňov. Priemerná dávka podávaná každý týždeň bola 178,9 mg/kg telesnej hmotnosti. Počas liečby sa tým trvalo dosiahli minimálne hladiny IgG s priemernou koncentráciou 1 244,84 mg/dl. Osobám bolo podaných celkovo
1 053 infúzií lieku Xembify raz týždenne. Ročná miera výskytu SBI počas liečby Xembify bola 0,049
na jeden osoborok (horná hranica jednostranného 99 % intervalu spoľahlivosti 0,110), čo predstavuje
jednu osobu so sepsou spôsobenou uhryznutím mačkou.
Pediatrická populácia
Bezpečnosť a účinnosť Xembify boli u detí stanovené. Xembify bol hodnotený u 28 detí s PID vo
veku 2 až 12 rokov (vrátane) a u 15 detí vo veku viac ako 12 rokov až menej ako 17 rokov. Nezistili sa
žiadne rozdiely vo farmakokinetike, bezpečnostnom profile a účinnosti v porovnaní s dospelými. Pre pediatrickú populáciu neboli na dosiahnutie požadovaných sérových hladín IgG potrebné žiadne špecifické úpravy dávky. Medzi dospelými a pediatrickými pacientmi s PID sa v štúdii nezistili žiadne rozdiely vo farmakodynamických vlastnostiach.
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s Xembify vo všetkých podskupinách pediatrickej populácie s primárnou imunodeficienciou u predčasne a/alebo v riadnom termíne narodených novorodencov (0 – 27 dní), dojčiat a batoliat (28 dní až 23 mesiacov). Informácie o použití v pediatrickej populácii, pozri časť 4.2.
Starší pacientiNeboli pozorované žiadne celkové rozdiely v bezpečnosti alebo účinnosti medzi osobami s PID vo
veku > 65 rokov a osobami s PID vo veku 18 až 65 rokov. V klinických štúdiách bol Xembify hodnotený u 5 pacientov s PID vo veku > 65 rokov.
5.2 Farmakokinetické vlastnostiAbsorpciaPo subkutánnom podaní Xembify sa maximálne sérové hladiny dosiahnu približne po troch dňoch.
DistribúciaTýždenné dávkovanieV klinickom skúšaní s Xembify (n = 61) v Európe sa u osôb dosiahli trvalé minimálne hladiny IgG
(medián 909,10 mg/dl) počas obdobia 52 týždňov pri podávaní dávok raz týždenne s mediánom
113,0 mg/kg telesnej hmotnosti. Údaje z klinického skúšania Xembify ukazujú, že minimálne sérové hladiny IgG je možné udržiavať režimami dávkovania 400 až 848 mg/kg telesnej hmotnosti/4 týždne.
Súhrn minimálnych koncentrácií celkového IgG v ustálenom stave počas predchádzajúceho režimu a s.c. fáz (populácia IgG)
| Minimálna koncentrácia počas fázy predchádzajúceho režimu (mg/dl)
|
Minimálna koncentrácia počas s.c. fázy (mg/dl)
|
Štatististické údaje
| Priemer minimálnych koncentrácií a
| Priemer minimálnych koncentrácií b
| Pomer minimálnych priemerov
s.c./predchádzajúci režim
|
n
| 59
| 59
| 59
|
Priemer±SD
| 891,37±165,943
| 947,64±150,262
| 1,078±0,1425
|
CV%
| 18,6
| 15,9
| 13,22
|
Medián
| 874,00
| 909,10
| 1,050
|
Min, Max
| 516,5; 1 255,0
| 629,2; 1 340,8
| 0,83; 1,54
|
Geometrický
priemer
| 875,96
| 936,48
| 1,069
|
a Priemer minimálnych koncentrácií vo fáze predchádzajúceho režimu je vypočítaný ako priemer minimálnych koncentrácií v čase, kedy osoby boli liečené v predchádzajúcom režime komerčnej náhrady IgG.
b Priemer minimálnych koncentrácií v subkutánnej (s.c.) fáze (počas používania Xembify) je vypočítaný ako priemer minimálnych koncentrácií počas návštev SC#17, SC#18, SC#20, SC#24, SC#28, SC#32, SC#36, SC#40, SC#44, SC#48, SC#52 a SC#53.'
Farmakokinetika Xembify bola hodnotená v štúdii účinnosti a bezpečnosti fázy 3 u 27 dospelých
pacientov s PID. Farmakokinetické výsledky sú uvedené v tabuľke nižšie.
Farmakokinetické parametre celkového IgG v sére pri používaní Xembify (farmakokinetická populácia)
Štatistické údaje
| Farmakokinetické parametre
|
AUC0-7 dní
(hod*mg/dl)
| Cmax
(mg/dl)
| Tmax
(hod)
|
n
| 27
| 27
| 27
|
Priemer (SD)
| 177 445,7 (31 081,89)
| 1 126,6 (190,11)
| 50,78 (44,596)
|
CV%
| 18
| 17
| 87,8
|
Medián
| 172 369,0
| 1 080,0
| 68,80
|
Štatistické údaje
|
Farmakokinetické parametre
|
AUC
0-7 dní
(
hod*mg/dl)
|
C
m
a
x
(
m
g
/dl)
|
T
m
a
x
(
hod)
|
Min, Max
|
132 728, 250 410
|
828, 1 610
|
0,0; 166,8
|
Geometrický priemer
|
175 002,1
|
1 112,2
|
|
90 % CI pre geometrický
priemer
|
165 652,5; 184 879,5
|
1 055,1; 1 172,4
|
|
CI = interval spoľahlivosti
(confidence interval); CV = variačný koeficient (
coefficient of variation);
SD = štandardná odchýlka (
standard deviation)Dávkovanie raz za týždeň, raz za dva týždne alebo častejšie (2 – 7-krát za týždeň)Farmakokinetická (
pharmacokinetic, PK) charakterizácia dávkovania Xembify raz za dva týždne alebo častejšie sa uskutočnila pomocou populačného modelovania a simulácie založených na PK. Údaje týkajúce sa sérovej koncentrácie IgG zahŕňali 1 841 vzoriek od 95 jedinečných pediatrických a dospelých osôb s PID. V porovnaní s podávaním raz týždenne, sa pomocou PK modelovania a simulácie predpovedalo, že podávanie Xembify raz za dva týždne pri dvojnásobnej týždennej dávke vedie k prekrývajúcej expozícii IgG v celom 2-týždňovom intervale. PK modelovania a simulácie zároveň predpovedali, že pri rovnakej celkovej týždennej dávke spôsobia infúzie Xembify podávané
2- až 7-krát za týždeň (časté dávkovanie) tiež prekrývajúcu sa expozíciu IgG v celom liečebnom
intervale.
ElimináciaIgG a komplexy IgG sa odbúravajú v bunkách retikuloendoteliálneho systému.
Pediatrická populáciaNeexistujú žiadne teoretické ani pozorované rozdiely v účinku imunoglobulínov u detí v porovnaní
s dospelými.
5.3 Predklinické údaje o bezpečnostiImunoglobulíny sú normálnou zložkou ľudského tela. Neklinické údaje získané na základe toxikologických štúdií neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokGlycín (E 640) Polysorbát 80 (E 433) Voda na injekcie
6.2 InkompatibilityNevykonali sa žiadne štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti3 roky
Po otvorení injekčnej liekovky sa odporúča liek ihneď použiť.
6.4 Špeciálne upozornenia na uchovávanie
· Uchovávajte v chladničke (2 ºC – 8 °C).
o Xembify sa môže uchovávať pri teplote neprevyšujúcej 25 ºC až do 6 mesiacov
kedykoľvek pred uplynutím času použiteľnosti.
o V deň vybratia lieku z chladničky zaznamenajte na miesto na škatuľke určené pre „Dátum likvidácie“ buď dátum zodpovedajúci 6 mesiacom od toho istého dňa alebo dátum exspirácie uvedený na škatuľke, podľa toho, čo nastane skôr.
o Ak sa liek uchováva pri teplote miestnosti, nedávajte ho späť do chladničky. Liek použite do „Dátum likvidácie“ alebo ho zlikvidujte.
· Neuchovávajte v mrazničke.
· Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
· Podajte ihneď po prenesení lieku Xembify z injekčnej liekovky do injekčnej striekačky.
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
5, 10, 20 alebo 50 ml roztoku v čírej sklenenej injekčnej liekovke s chlórbutylovou zátkou, hliníkovým viečkom, plastovým uzáverom a obopínacou fóliou, ktorá zaručuje neporušenosť obalu.
Veľkosť balenia 1 injekčnej liekovky:
1 g/5 ml
2 g/10 ml
4 g/20 ml
10 g/50 ml
Na trh nemusia byť uvedené všetky veľkosti balenia.
Každá škatuľka obsahuje 1 injekčnú liekovku Xembify a 1 písomnú informáciu pre používateľa.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pred použitím sa má liek ohriať na teplotu miestnosti alebo telesnú teplotu (20 °C až 37 °C). Nepretrepávajte.
Pred podaním sa má liek vizuálne skontrolovať. Roztoky, pri ktorých došlo k zmene farby, sú zakalené alebo obsahujú usadeniny, sa nemajú použiť.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Pokyny na použitie
Len na subkutánne použitie.
Pred použitím nechajte roztok zahriať na teplotu miestnosti alebo telesnú teplotu (20 °C až 37 °C).
Nepretrepávajte.
Postupujte podľa pokynov nižšie a na podanie Xembify použite aseptickú techniku.
1. Injekčné liekovky skontrolujte: skontrolujte čírosť, farbu a dátum použiteľnosti.
2. Príprava infúzie:
Pripravte si pomôcky: Injekčnú liekovku (injekčné liekovky) Xembify, pomocný materiál, nádobu na ostré predmety, denník/záznamník liečby pacienta a infúznu pumpu.
Pripravte si čisté pracovné miesto.
Umyte si ruky.
3. Z injekčnej liekovky odstráňte ochranné viečko, aby ste odkryli strednú časť zátky.
4. Zátku utrite alkoholom a nechajte vysušiť.
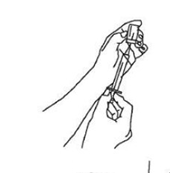
5. Pomocou sterilnej injekčnej striekačky a injekčnej ihly pripravte natiahnutie Xembify tak, že najprv vstreknete do injekčnej liekovky množstvo vzduchu, ktoré zodpovedá objemu Xembify, ktorý sa má natiahnuť. Potom natiahnite požadovaný objem Xembify. Ak sú potrebné viaceré injekčné liekovky na
dosiahnutie požadovanej dávky, tento krok zopakujte. (Obrázok 1)
Obrázok 1
6. Použite Xembify čo najskôr, aby ste predišli možnej tvorbe čiastočiek spôsobenej použitím silikonizovaných injekčných striekačiek.
7. Pri príprave pumpy a hadičky na podávanie postupujte podľa pokynov výrobcu. Naplňte hadičku/injekčnú ihlu liekom Xembify, aby ste zaistili, že v hadičke alebo injekčnej ihle nezostane pred podaním žiaden vzduch.
8. Zvoľte počet a miesta vpichov. Pri každom podaní miesta
vpichov striedajte. (Obrázok 2)
Xembify infúzne podajte do brucha, stehna, hornej časti
ramena, bokov, zadnej a/alebo laterálnej časti bedra.
Vyhnite sa oblastiam s výbežkami kostí, jazvám, zapáleným miestam, miestam s povrchovou infekciou alebo krvným cievam.
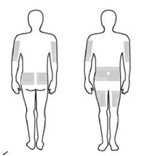
Obrázok 2
9. Miesto (miesta) vpichu očistite pomocou antiseptického
roztoku krúživým pohybom od stredu miesta smerom von. Miesta majú byť čisté, suché a vzdialené najmenej 5 cm od seba. (Obrázok 3)
10.Uchopte kožu medzi 2 prsty (zovrite najmenej 2,5 cm kože) a zaveďte injekčnú ihlu pod 90-stupňovým uhlom do podkožného tkaniva. (Obrázok 4)
Obrázok 3

Obrázok 4
11.Po každom zavedení injekčnej ihly sa uistite, že nedošlo
k náhodnému vpichu do krvnej cievy. Na koniec pripravenej hadičky na podávanie nasaďte sterilnú injekčnú striekačku, potiahnite piest smerom k sebe a ak spozorujete krv, injekčnú ihlu a hadičku na podávanie odstráňte a zlikvidujte.
(Obrázok 5)
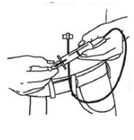
Obrázok 5
12.Zopakujte kroky plnenia a zavedenia injekčnej ihly s použitím novej injekčnej ihly, hadičky na podávanie a nového miesta na podanie infúzie. Injekčnú ihlu v danom mieste zaistite pomocou sterilnej gázy alebo priehľadnej náplasti.
13.Pre prvé dve infúzie bude rýchlosť infúzie 10 ml za hodinu na jedno miesto podania infúzie. Ak je táto rýchlosť infúzie dobre znášaná a nepozorujete žiadne nežiaduce účinky (pozri časť 4.4), rýchlosť sa môže zvýšiť každých 10 minút maximálne na 20 ml za hodinu na jedno miesto podania infúzie pre pediatrických pacientov a dospievajúcich a 25 ml za hodinu na jedno miesto podania infúzie pre dospelých pacientov. Ak sú tieto dve infúzie dobre znášané, rýchlosť infúzie sa môže postupne zvýšiť na 35 ml za hodinu na jedno miesto podania infúzie.
Uistite sa, že u pacientov všetkých vekových skupín sú miesta na podanie infúzie vzdialené najmenej 5 cm od seba. O počte miest na podanie infúzie rozhodne zdravotnícky pracovník. U dospelých sa dávky nad 30 ml môžu rozdeliť podľa preferencie pacienta. Počet miest na podanie infúzie nie je obmedzený.
Pri špecifických dávkach Xembify u detí (mg/kg telesnej hmotnosti) sa bude vyžadovať menší celkový objem ako u dospelých. U detí môže zdravotnícky pracovník zvoliť menší objem/miesto a/alebo menej miest na podanie infúzie na dosiahnutie celkovej dávky, v závislosti od potrieb dieťaťa.
Na vypočítanie počtu miest na podanie infúzie, ktoré sa majú použiť, sa celkový objem dávky
Xembify vydelí požadovaným objemom (ml/miesto).
14.Zaznamenajte si informácie o infúzii (napr. číslo šarže, čas použiteľnosti, dávku, dátum, čas, miesto (miesta) podania infúzie, nežiaduce účinky) do záznamníka liečby pacienta alebo záznamníka podávania infúzie.
15.Injekčnú ihlu (injekčné ihly) a infúznu hadičku (infúzne hadičky) zlikvidujte vo vhodnej nádobe.
Pri údržbe infúznej pumpy dodržiavajte pokyny výrobcu.
16.Čiastočne použitú(é) injekčnú(é) liekovku(y) zlikvidujte.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIInstituto Grifols, S.A.
Can Guasch, 2 - Parets del Vallès
08150 Barcelona - Španielsko
8. REGISTRAČNÉ ČÍSLO/ČÍSLA59/0018/22-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU 04/2022
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Štátneho ústavu pre kontrolu liečiv (
www.sukl.sk)