
tejto liečbe sa má pridať adrenalín alebo bronchodilatanciá. Nepokračujte s infúziou a neobnovujte liečbu. Liečba Vyxeosom sa má trvalo
ukončiť. Pacientov je potrebné monitorovať až kým neodoznejú príznaky (pozri časti 4.4 a 4.8).
Vynechaná dávka
Ak sa vynechá plánovaná dávka Vyxeosu, dávku je potrebné podať čo najskôr a v súlade s tým upraviť rozvrh dávkovania, aby sa zachoval liečebný interval.
K
ardiotoxicita
Odporúča sa vyšetriť funkciu srdca pred začiatkom liečby, najmä u pacientov, u ktorých je vysoké riziko srdcovej toxicity. Liečba Vyxeosom sa má prerušiť u pacientov, u ktorých sa vyvinú prejavy alebo príznaky kardiomyopatie, pokiaľ prínosy neprevažujú nad rizikami (pozri časť 4.4).
Osobitné populácie
Porucha funkcie obličiek
U pacientov s miernou (klírens kreatinínu [CrCL] 60 ml/min až 89 ml/min podľa Cockcroftovej- Gaultovej rovnice [C-G]) alebo stredne závažnou (CrCL 30 ml/min až 59 ml/min) poruchou funkcie obličiek nie je potrebná úprava dávky. U pacientov so závažnou poruchou funkcie obličiek (CrCL
15 ml/min až 29 ml/min) alebo v konečnom štádiu ochorenia obličiek nie sú skúsenosti s použitím
Vyxeosu. Vyxeos sa má použiť u pacientov so závažnou poruchou funkcie obličiek len ak prínosy prevážia nad rizikami (pozri časti 4.4 a 5.2).
Porucha funkcie pečene
U pacientov s hladinou bilirubínu nižšou alebo rovnou 50 µmol/l nie je potrebná úprava dávky. U
pacientov s poruchou funkcie pečene spôsobujúcim hladinu bilirubínu vyššiu ako 50 µmol/l nie sú skúsenosti s použitím Vyxeosu. Vyxeos sa má použiť u pacientov so závažnou poruchou funkcie
pečene len ak prínosy prevážia nad rizikami (pozri časť 4.4).
Staršia populácia
U starších pacientov (≥65 rokov) nie je potrebná žiadna úprava dávky (pozri časť 5.2).
Pediatrická populácia
Bezpečnosť a účinnosť Vyxeosu u detí vo veku 0 až 18 rokov neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Spôsobpodávania
Vyxeos je určený len na intravenózne použitie. Nesmie sa podávať intramuskulárne, intratekálne, ani subkutánne.
Vyxeos sa podáva intravenóznou infúziou trvajúcou 90 minút. Treba dbať na to, aby nedošlo k extravazácii, aby sa predišlo riziku nekrózy tkaniva.
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
Závažná precitlivenosť v anamnéze na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Iné liekysobsahomdaunorubicínua/alebocytarabínu
Vyxeos nesmie byť substituovaný alebo zamenený s inými liekmi obsahujúcimi daunorubicín a /alebo
cytarabín.Vzhľadom na podstatné rozdiely vo farmakokinetických parametroch, odporúčania dávky a rozvrhu dávkovania pre Vyxeos sa líšia od odporúčaní pre injekciu hydrochloridu daunorubicínu, injekciu cytarabínu, injekciu lipozómov citrátu daunorubicínu a injekciu lipozómov cytarabínu. Pred podaním sa má skontrolovať názov a dávka lieku, aby sa vyhlo chybám v dávkovaní.
Závažnýútlmkostnejdrene
U pacientov bol hlásený závažný útlm kostnej drene (vrátane smrteľných infekcií a hemoragických príhod) po podaní terapeutickej dávky Vyxeosu. U pacientov liečených Vyxeosom došlo k závažným
alebo smrteľným hemoragickým príhodám, vrátane krvácaní v centrálnej nervovej sústave (CNS),
spojených s ťažkou trombocytopéniou. Počas liečby Vyxeosom je potrebné vyhodnotiť východiskový
krvný obraz a pozorne monitorovať pacientov, aby sa zistili možné klinické komplikácie spôsobené útlmom kostnej drene. Vzhľadom na dlhý biologický polčas Vyxeosu v plazme, čas zotavenia ANC a trombocytov môže byť predĺžený a môže byť potrebné dodatočné monitorovanie.
Počas obdobia výraznej neutropénie možno profylakticky podať antiinfekčné látky (vrátane antibakteriálnych, antivirálnych a antifungálnych látok, kým sa ANC nevráti na úroveň 500/μl alebo vyššie. Ak dôjde ku komplikáciám spôsobeným útlmom kostnej drene, majú sa vykonať príslušné podporné opatrenia, napr. antiinfekčné látky, faktory stimulujúce kolónie, transfúzie. Krvný obraz sa má monitorovať pravidelne až kým sa pacient nezotaví (pozri časť 4.8).
Kardiotoxicita
Kardiotoxicita je známe riziko liečby antracyklínmi. Predchádzajúca liečba antracyklínmi (vrátane pacientov, ktorí už dostali odporúčané maximálne kumulatívne dávky doxorubicínu a hydrochloridu
daunorubicínu), existujúce ochorenie srdca (vrátane poruchy funkcie srdca), rádioterapia mediastína v minulosti, alebo súbežné používanie kardiotoxických liekov môžu zvýšiť riziko srdcovej toxicity
spôsobenej daunorubicínom.
Celkové kumulatívne dávky nelipozómového daunorubicínu vyššie ako 550 mg/m2 sú spájané so zvýšeným výskytom kongestívneho zlyhania srdca spôsobeného liečbou. Tento limit sa zdá byť nižší (400 mg/m2) u pacientov, ktorí absolvovali rádioterapiu mediastína. Vzťah medzi kumulatívnou dávkou Vyxeosu a rizikom srdcovej toxicity nebol stanovený. Celková kumulatívna expozícia daunorubicínu je opísaná v tabuľke nižšie.
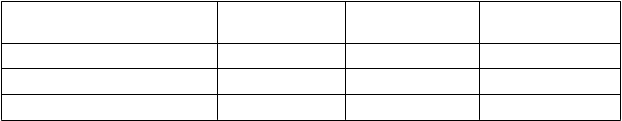
Tabuľka 1: Kumulatívna expozícia daunorubicínu v jednom cykle liečby Vyxeosom
T
erapia Daunorubicín v
j
ednej dávke
P
očet dávok v
li
e
čebnom cykle
D
aunorubicín v
j
ednom cykle
 P
rvá indukcia
P
rvá indukcia 44 mg/m2 3 132 mg/m2
Druhá indukcia 44 mg/m2 2 88 mg/m2
Každá konsolidácia 29 mg/m2 2 58 mg/m2
Odporúča sa vyhodnotenie východiskovej funkcie srdca elektrokardiogramom (ECG) a skenovaním
MUGA (multi-gated) rádionuklidovou angiografiou alebo echokardiografiou (ECHO), najmä u pacientov s rizikovými faktormi pre zvýšenú srdcovú toxicitu. Funkcia srdca sa má pozorne sledovať.
Liečba Vyxeosom sa má prerušiť u pacientov s poruchou funkcie srdca, pokiaľ prínos začatia liečby alebo pokračovania v liečbe prevažuje nad rizikom (pozri časti 4.5 a 4.8).
Upozornenietýkajúcesatehotenstva/ženyvreprodukčnomvekuPacientky treba poučiť, aby sa vyhýbali otehotneniu počas liečby Vyxeosom. Pacienti a pacientky v reprodukčnom veku musia počas liečby a počas 6 mesiacov po poslednej dávke Vyxeosu používať
účinnú metódu antikoncepcie (pozri časť 4.6).
ReakcieprecitlivenostiV súvislosti s užívaním daunorubicínu a cytarabínu boli hlásené závažné reakcie precitlivenosti, vrátane anafylaktických reakcií.
V prípade stredne závažných príznakov precitlivenosti (napr. stredne závažné vyrážky, sčervenanie, mierne dyspnoe, nevoľnosť v hrudníku) sa má liečba zastaviť. Je potrebné podať intravenózny difenhydramín (20 - 25 mg alebo ekvivalent) a intravenózny dexametazón (10 mg). S infúziou sa nemá pokračovať. Pri opakovanej liečbe pacienta sa Vyxeos má podať po predliečení pacienta v rovnakej dávke a rovnakou rýchlosťou infúzie.
V prípade závažných/život ohrozujúcich príznakov precitlivenosti (napr. hypotenzia, ktorá si vyžaduje liečbu vazopresormi, angioedém, respiračná tieseň, ktorá si vyžaduje bronchodilatačnú liečbu,
celotelová žihľavka) sa má liečba zastaviť. Je potrebné podať intravenózny difenhydramín (20 - 25
mg) a dexametazón (10 mg), a k tomu sa má pridať epinefrín (adrenalín) alebo bronchodilatanciá, ak
je to indikované. Nepokračujte s infúziou a neopakujte liečbu. Liečba Vyxeosom sa má trvalo prerušiť. Pacientov je potrebné monitorovať až do odoznenia príznakov (pozri časti 4.2 a 4.8).
Nekrózatkaniva
Daunorubicín sa spája s miestnou nekrózou tkaniva v mieste extravazácie lieku. V klinických štúdiách s Vyxeosom došlo k jednej udalosti extravazácie, ale nebola pozorovaná žiadna nekróza. Je potrebné zabezpečiť, aby pri podávaní Vyxeosu nedošlo k jeho extravazácii. Vyxeos sa má podávať len intravenózne. Nepodávajte intramuskulárne, intratekálne, ani subkutánne (pozri časť 4.2).
Hodnoteniefunkciepečeneaobličiek
Porucha funkcie pečene alebo obličiek môže zvýšiť riziko toxicity spojenej s daunorubicínom a cytarabínom. Pred podaním Vyxeosu a periodicky počas liečby sa odporúča vyhodnotenie funkcie
pečene a obličiek konvenčnými laboratórnymi testami. U pacientov s východiskovou hladinou
bilirubínu v sére vyššou ako 50 µmol/l, závažnou poruchou funkcie obličiek (klírens kreatinínu menej ako 30 ml/min) alebo v konečnom štádiu ochorenia obličiek nie sú skúsenosti s použitím Vyxeosu.
Vyxeos sa má použiť u pacientov so závažnou poruchou funkcie pečene a/alebo obličiek len ak
prínosy prevážia nad rizikami (pozri časť 4.2).
Laboratórnetesty
Vyxeos môže vyvolať hyperurikémiu následkom rýchlej lýzy leukemických buniek. Je potrebné monitorovať hladiny kyseliny močovej v krvi a v prípade, že sa rozvinie hyperurikémia, začať príslušnú liečbu.
Wilsonovachorobaainésmeďousúvisiaceporuchyvanamnéze
Jedna injekčná liekovka obsahuje 100 mg glukonátu meďnatého, čo zodpovedá 14 mg elementárnej mede. U pacientov s Wilsonovou chorobou alebo inými s meďou súvisiacimi poruchami v anamnéze sa Vyxeos má používať len ak prínosy prevažujú nad rizikami (pozri časť 6.1). U pacientov s prejavmi alebo príznakmi akútnej toxicity medi prerušte liečbu Vyxeosom.
Imunosupresívneúčinky/zvýšenánáchylnosťnainfekcie
Podanie živých alebo oslabených živých vakcín pacientom, ktorí majú následkom chemoterapie oslabenú imunitu môže viesť k závažným alebo fatálnym infekciám. U pacientov, ktorí dostávajú
Vyxeos, je potrebné vyhnúť sa vakcinácii živou vakcínou. Usmrtené alebo inaktivované vakcíny
možno podávať, avšak na také vakcíny môže byť znížená odpoveď.
Gastrointestinálnamukozitídaahnačka
Je potrebné vziať do úvahy, že absorpcia perorálne podávaných sprievodných liekov môže byť značne ovplyvnená prítomnosťou gastrointestinálnej mukozitídy a/alebo hnačky, ktoré sa často vyskytujú
v súvise s intenzívnou chemoterapiou.
4.5 Liekové a iné interakcie
S Vyxeosom sa neuskutočnili žiadne interakčné štúdie. Predpokladá sa, že dodávanie daunorubicínu a cytarabínu v lipozómovej formulácii Vyxeos znižuje možnosť interakcií, pretože systémové koncentrácie voľného daunorubicínu a cytarabínu sú omnoho nižšie ako v prípade, keď nie sú podané ako lipozómová formulácia.
Kardiotoxickélátky
Súbežné používanie kardiotoxických látok môže zvýšiť riziko kardiotoxicity. Použitie Vyxeosu u pacientov, ktorí v minulosti užili doxorubicín, zvyšuje riziko kardiotoxicity (pozri časť 4.4). Vyxeos nepodávajte v kombinácii s inými kardiotoxickými látkami, pokiaľ srdcová funkcia pacienta nie je pozorne monitorovaná.
H
epatotoxické
látky
Hepatotoxické lieky môžu narušiť funkciu pečene a zvýšiť toxicitu. Keďže daunorubicín sa metabolizuje v pečeni, zmeny funkcie pečene navodené súbežnou liečbou môžu ovplyvniť metabolizmus, farmakokinetiku, terapeutickú účinnosť a/alebo toxicitu Vyxeosu (pozri časť 5.2). Keď sa Vyxeos podáva súbežne s hepatotoxickými látkami, funkcia pečene sa má sledovať častejšie.
4.6 Fertilita, gravidita a laktácia
Ženyvreprodukčnomveku/antikoncepciaumužovažien
Ženy v reprodukčnom veku sa majú vyhýbať otehotneniu počas liečby Vyxeosom. Ženy v reprodukčnom veku majú používať účinnú antikoncepciu kým ony alebo ich partner podstupujú
liečbu. Ženy v reprodukčnom veku nemajú podstupovať liečbu, kým sa u nich nevylúči tehotenstvo.
Ženy v reprodukčnom veku majú absolvovať tehotenský test pred začiatkom liečby Vyxeosom. Muži, ktorých partnerky sú v reprodukčnom veku a ženy majú používať účinnú antikoncepciu počas liečby a počas 6 mesiacov po poslednej dávke Vyxeosu.
Gravidita
Nie sú k dispozícii údaje o použití Vyxeosu u gravidných žien. Na základe výsledkov štúdií na zvieratách a vlastného mechanizmu účinku, Vyxeos sa nemá používať počas tehotenstva, pokiaľ klinický stav ženy nevyžaduje liečbu a neodôvodňuje potenciálne riziko pre plod (pozri časť 5.3).
Ak sa liek použije počas tehotenstva alebo ak pacientka otehotnie počas liečby Vyxeosom, pacientka musí byť informovaná o potenciálnom nebezpečenstve pre plod. V každom prípade sa odporúča kardiologické vyšetrenie a vyšetrenie krvi u plodov a novorodencov narodených matkám, ktoré boli liečené týmto liekom počas tehotenstva.
Dojčenie
Nie je známe, či sa Vyxeos vylučuje do ľudského mlieka. Pretože existuje riziko závažných nežiaducich reakcií na Vyxeos u dojčených detí, matkám sa odporúča prerušiť dojčenie počas liečby Vyxeosom.
Fertilita
Zistenia u zvierat nasvedčujú, že liečba Vyxeosom môže znížiť plodnosť u mužov (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Vyxeos má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pri použití Vyxeosu boli hlásené únava a točenie hlavy. Preto sa odporúča pozornosť pri vedení vozidiel alebo obsluhovaní strojov.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Najčastejšie sa vyskytujúcimi nežiaducimi reakciami (NR) boli precitlivenosť vrátane vyrážky
(66,9 %), febrilná neutropénia (63,5 %), opuch (52,3 %), hnačka/kolitída (49,9 %), mukozitída (49,9 %), únava (46,4 %), bolesť kostí a svalov (44,5 %), bolesť brucha (36,3 %), znížená chuť do jedla (33,9 %), kašeľ (33,9 %), bolesť hlavy (32,3 %), triaška (31,2 %), arytmia (30,4 %), horúčka (29,6 %), poruchy spánku (25,1 %) a hypotenzia (23,7 %).
Najzávažnejšími a často sa vyskytujúcimi NR boli infekcia (58,7 %), kardiotoxicita (18,7 %)
a krvácanie (13,1 %).
Tabuľkovýprehľadnežiaducichreakcií
NR sú uvedené v tabuľke nižšie v zodpovedajúcej kategórii, podľa najvyššej frekvencie výskytu pozorovanej u ktorejkoľvek z hlavných klinických štúdií.
Frekvencie výskytu sú definované ako: veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté
(≥1/1 000 až < 1/100);zriedkavé (≥ 1/10 000 až < 1/1 000); neznáme (z dostupných údajov).
V rámci každej kategórie frekvencie sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti. Pre zatriedenie NR, ku ktorým dochádza na 3. - 5. stupni, je od NCI k dispozícii komplexný zoznam na NCI CTCAE. Toxicita sa člení na miernu (1. stupeň), strednú (2. stupeň), závažnú (3.stupeň), alebo život ohrozujúcu (4. stupeň), s osobitnými parametrami v závislosti od postihnutého orgánového systému. Úmrtie (5.stupeň) sa používa pre niektoré kritériá na označenie smrteľného následku.
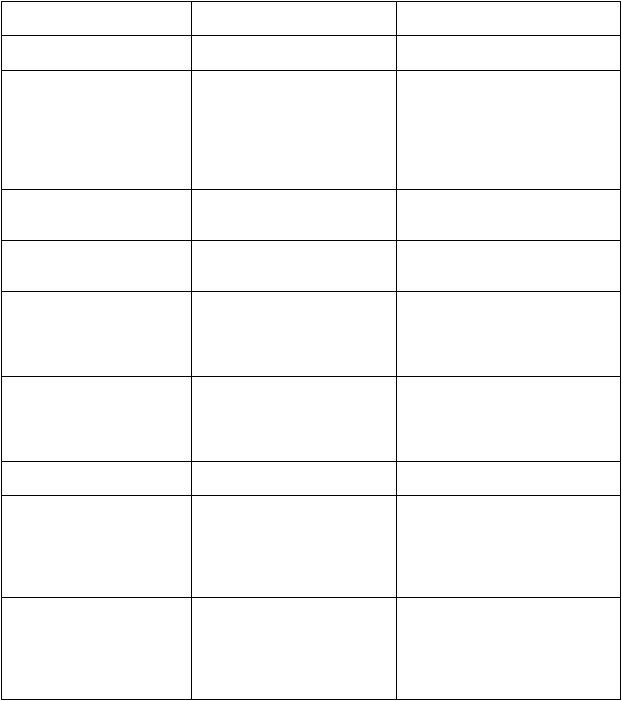
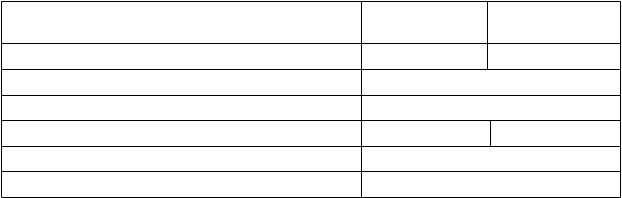
Tabuľka 2: Nežiaduce reakcie hlásené v klinických štúdiách u pacientov liečených Vyxeosom
(n=375)
T
rieda orgánových
systémov
NR/
f
rekvencia výskytu (%) 3. - 5. stupeň NR/frekvencia
výskytu (%)
Infekcie a nákazy Veľmičasté
Infekcia (78,1)
Veľmičasté
Infekcia (58,7)
P
oruchy krvi a lymfatického systému
P
oruchy imunitného systému
P
oruchy metabolizmu a výživy
V
eľmi
časté
Febrilná neutropénia (63,5)
ČastéTrombocytopénia (4,5) Neutropénia (3,7) Anémia (3,2)
Veľmičasté
Precitlivenosť (vrátane vyrážky)
(66,9)
Časté
Syndróm z rozpadu nádoru
(7,5)
Veľmičasté
Febrilná neutropénia (62,4)
ČastéTrombocytopénia (3,7) Neutropénia (3,5) Anémia (2,1)
Časté
Precitlivenosť (vrátane vyrážky)
(9,1)
Časté
Syndróm z rozpadu nádoru (2,7)
P
sychické poruchy Veľmičasté
Poruchy spánku (25,1)
Úzkosť (17,3) Delírium (15,5)
Časté
Delírium (2,4)
Menejčasté
Poruchy spánku (0,5)
P
oruchy nervového systému
V
eľmi
časté
Bolesť hlavy (32,3)
Točenie hlavy (23,2)
Časté
Bolesť hlavy (1,1)
Menejčasté
Točenie hlavy (0,8)
P
oruchy oka Veľmičasté
Porucha zraku (10,4)
Menejčasté
Porucha zraku (0,3)
P
oruchy srdca a srdcovej činnosti
V
eľmi
časté
Kardiotoxicita (72) Arytmiaa (30,4)
Bolesť v hrudníku (17,6)
Veľmičasté
Kardiotoxicita (18,7)
Časté
Arytmiaa (4,3)
Bolesť v hrudníku (1,9)
 P
oruchy ciev Veľmičasté
P
oruchy ciev VeľmičastéKrvácanie (69,1) Hypotenzia (23,7) Hypertenzia (17,3)
VeľmičastéKrvácanie (13,1)
ČastéHypertenzia (6,9) Hypotenzia (4,5)
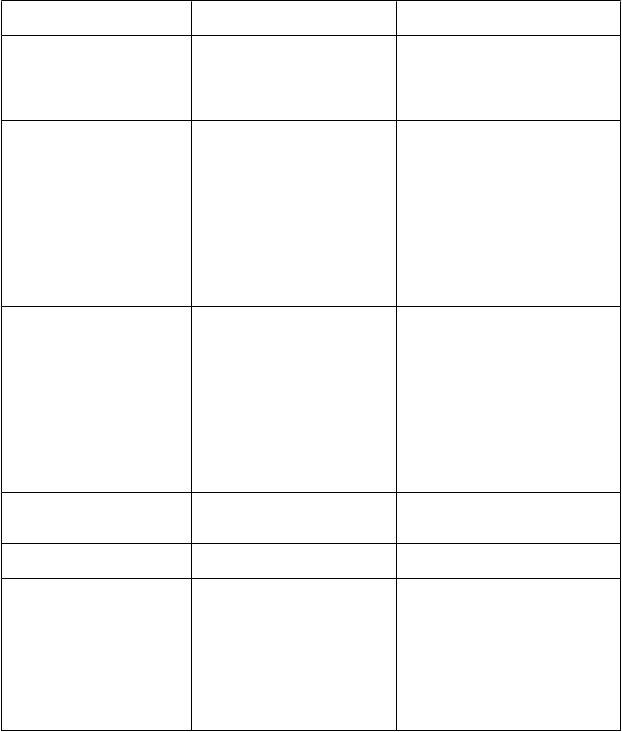
T
rieda orgánových systémov
NR/
f
rekvencia výskytu (%) 3. - 5. stupeň NR/frekvencia výskytu (%)
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
P
oruchy kože a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva Poruchy obličiek a močových ciest
C
elkové poruchy a reakcie v mieste podania
V
eľmi
časté
Dyspnoe (36,5) Kašeľ (33,9)
Pleurálny výpotok (13,9)
VeľmičastéNauzea (51,7) Hnačka/kolitída (49,9) Mukozitída (49,9) Zápcha (42,7)
Bolesť brucha (36,3)
Znížená chuť do jedla (33,9) Vracanie (27,7)
ČastéDyspepsia (9,6) VeľmičastéSvrbenie (17,3) Hyperhidróza (10,1)
Časté
Nočné potenie (8,3) Alopécia (3,2)
MenejčastéPalmárno-plantárna erytrodyzestézia (0,8) Veľmičasté
Bolesť kostí a svalov (44,5)
Veľmičasté
Nedostatočnosť obličiek (10,4)
VeľmičastéOpuch (52,3) Únava (46,4) Triaška (31,2) Horúčka (29,6)
Veľmičasté
Dyspnoe (13,1)
Menejčasté
Pleurálny výpotok (0,8)
ČastéHnačka/kolitída (6,1) Bolesť brucha (2,9) Mukozitída (2,1)
Znížená chuť do jedla (1,6) Zápcha (1,1)
Nauzea (1,1)
MenejčastéDyspepsia (0,5) Vracanie (0,3) MenejčastéHyperhidróza (0,3)
Časté
Bolesť kostí a svalov (5,1)
Časté
Nedostatočnosť obličiek (6,4)
Veľmičasté
Únava (10,4)
ČastéHorúčka (3,2) Opuch (2,7)
 Menej
časté
Menej
časté
Triaška (0,3)
a Skupinový pojem arytmia zahrnuje atriálnu fibriláciu, bradykardiu, a najčastejšie hlásenou arytmiou bola tachykardia
Popis vybraných nežiaducichreakciíInfekcieVzhľadom na neutropéniu, ku ktorej dochádza pri liečbe Vyxeosom, infekcie rôznych druhov boli veľmi častými NR. Zápal pľúc, sepsa a bakteriémia boli najčastejšie pozorovanými závažnými NR vyplývajúcimi z infekcií v populácii zúčastnenej v klinických štúdiách. Výskyt infekčných udalostí bol 78,1 %; výskyt nezávažných infekčných udalostí bol 73,1 %, výskyt závažných infekčných udalostí bol 28,5 %; výskyt infekcií, ktoré viedli k prerušeniu liečby bol 0,5 %. Výskyt infekcií so smrteľným koncom bol 6,9 %. Pozorované infekcie so smrteľným koncom boli sepsa a zápal pľúc (pozri časť 4.4).
K
rvácanie
Vzhľadom na trombocytopéniu vyskytujúcu sa pri liečbe Vyxeosom, v klinických štúdiách boli pozorované rôzne hemoragické príhody. Najčastejšou hemoragickou príhodou bolo krvácanie z nosa,
a väčšina týchto príhod bola považovaná za nezávažné (29,1 %). Výskyt hemoragických príhod bol
69,1 %; výskyt nezávažných hemoragických príhod bol 67,2 %, výskyt závažných hemoragických príhod bol 5,6 %; výskyt krvácaní, ktoré viedli k prerušeniu liečby bol 0. Výskyt krvácaní so smrteľným koncom bol 2,1 %. U pacientov liečených Vyxeosom boli pozorované závažné alebo smrteľné hemoragické príhody, vrátane smrteľných krvácaní v centrálnej nervovej sústave (CNS), spojené s ťažkou trombocytopéniou(pozri časť 4.4).
KardiotoxicitaV klinických štúdiách Vyxeosu boli pozorované prípady kardiotoxicity. Najčastejšie hlásenými závažnými NR boli znížená ejekčná frakcia a kongestívne zlyhanie srdca. Kardiotoxicita je známe
riziko liečby antracyklínmi. Výskyt všetkých kardiotoxických udalostí bol 72,0 %; výskyt
nezávažných kardiotoxických udalostí bol 68,5 %; výskyt závažných kardiotoxických udalostí bol
9,1 %; výskyt kardiotoxicity, ktorá viedla k prerušeniu liečby bol 0,5 %. Výskyt kardiotoxických udalostí so smrteľným koncom bol 0,5 %. Zastavenie srdca bolo hlásené ako príhoda so smrteľným
koncom; u pacienta došlo k trombocytopénii a neutropénii, ktoré prispeli k zastaveniu srdca (pozri časť 4.4).
PrecitlivenosťReakcie precitlivenosti boli veľmi častými nežiaducimi reakciami v klinických štúdiách s Vyxeosom. Najčastejšie hlásenými NR precitlivenosti boli vyrážky a väčšina z nich nebola závažná (38,9 %).
Výskyt všetkých prípadov precitlivenosti bol 66,9 %; výskyt nezávažných prípadov precitlivenosti bol
66,4 %, z ktorých 38,9 % boli vyrážky; výskyt závažných prípadov precitlivenosti bol 1,1 %; frekvencia výskytu precitlivenosti, ktorá viedla k prerušeniu liečby bola 0. Frekvencia výskytu smrteľných prípadov precitlivenosti bola 0 (pozri časť 4.4).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNeexistujú osobitné skúsenosti v liečbe predávkovania u pacientov. Ak dôjde k predávkovaniu, predpokladá sa exacerbácia nežiaducich reakcií spojených s Vyxeosom a v tom prípade sa má poskytnúť podporná liečba (vrátane protiinfekčných látok, transfúzií krvi a krvných doštičiek, faktorov stimulujúcich kolónie a intenzívnej starostlivosti, podľa potreby) až kým sa pacient nezotaví. Pozorne monitorujte pacienta s priebehom času, či sa u neho/nej neprejavia známky kardiotoxicity, a
poskytnite príslušnú podpornú liečbu podľa klinickej indikácie.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné cytostatiká, kombinácie cytostatík, ATC kód: L01XY01.
MechanizmusúčinkuVyxeos je lipozómová formulácia fixnej kombinácie daunorubicínu a cytarabínu v molárnom pomere
1:5. V pokusoch
in vitro a
in vivo bolo preukázané, že molárny pomer 1:5 maximalizuje synergistický protinádorový účinok u AML.
Daunorubicín má antimitotický a cytotoxický účinok, ku ktorému dochádza tvorbou komplexov s DNA, inhibíciou aktivity topoizomerázy II, inhibíciou aktivity DNA polymerázy, vplyvom na reguláciu expresie génov, a produkciou voľných radikálov poškodzujúcich DNA.
Cytarabín je cytostatikum špecifické pre jednu fázu bunkového cyklu, účinkujúce na bunky iba počas
S fázy bunkového delenia. Intracelulárne dochádza k premene cytarabínu na cytarabín-5-trisfosfát
(ara-CTP), ktorý je aktívnym metabolitom. Mechanizmus účinku nie je úplne jasný, ale sa zdá, že ara- CTP účinkuje predovšetkým prostredníctvom inhibície syntézy DNA. Jeho začleňovanie do DNA a
RNA môže tiež prispievať k cytotoxicite cytarabínu. Cytarabín je cytotoxický pre proliferujúce cicavčie bunky v bunkovej kultúre.
Lipozómy Vyxeosu vykazujú predĺžený biologický polčas v plazme po intravenóznej infúzii, kde viac ako 99 % daunorubicínu a cytarabínu v plazme zostáva enkapsulované v lipozómoch. Vyxeos prináša synergistickú kombináciu daunorubicínu a cytarabínu leukemickým bunkám počas dlhého obdobia.
Na základe údajov na zvieratách sa predpokladá, že lipozómy Vyxeosu sa hromadia a pretrvávajú vo vysokej koncentrácii v kostnej dreni, kde ich leukemické bunky preferenčne vychytávajú
nepoškodené, procesom aktívneho pohlcovania. U myší s leukémiou, leukemické bunky vychytávali lipozómy vo väčšej miere ako normálne bunky kostnej drene. Po internalizácii podstupujú lipozómy
Vyxeosu degradáciu, pričom uvoľňujú daunorubicín a cytarabín do vnútrobunkového prostredia, umožňujúc tak liekom, aby pôsobili svojím synergistickým cytostatickým účinkom.
Klinickáúčinnosťabezpečnosť
Účinnosť Vyxeosu v liečbe vysokorizikovej AML bola hodnotená v 1 kontrolovanej štúdii.
Štúdia 301 u pacientov s neliečenou vysokorizikovou AML
Štúdia 301 bola randomizovaná, multicentrická, otvorená štúdia superiority v 3. fáze, s paralelným ramenom, ktorá hodnotila Vyxeos v porovnaní so štandardnou kombináciou cytarabínu a daunorubicínu (7+3) u 309 pacientov vo veku 60 až 75 rokov, s neliečenou vysokorizikovou AML. Do štúdie boli zapojení pacienti s nasledovnými podtypmi AML: postterapeutická AML (t-AML), AML s myelodysplastickým syndrómom (MDS AML) a AML s chronickou myelomonocytickou leukémiou (CMMoL AML) s dokumentovanou anamnézou MDS alebo CMMoL pred transformáciou na AML, a de novo AML so zmenami karyotypu charakteristickými pre myelodyspláziu (podľa kritérií WHO z roku 2008).
Štúdia pozostávala z 2 fáz: 1) liečebná fáza, počas ktorej pacienti dostali maximálne 2 indukčné a 2 konsolidačné liečebné cykly, a 2) následná fáza, ktorá sa začala 30 dní po poslednom indukčnom alebo konsolidačnom cykle a pokračovala maximálne 5 rokov od randomizácie. Počet indukcií a konsolidácií, ktoré pacient dostal, závisel od kompletnej odpovede (CR, Complete Response) alebo kompletnej odpovede s neúplným zotavením (CRi, Complete Response with incomplete recovery), ktoré boli potvrdené vyšetrením kostnej drene. Iba v klinických štúdiách bol Vyxeos 100 jednotiek/m2/deň (ekvivalentné 44 mg/100 mg/m2) podaný intravenózne počas 90 minút v 1., 3. a 5. deň pre prvú indukciu a v 1. a 3. deň pre pacientov, ktorým bola potrebná druhá indukcia. Druhá indukcia bola dôrazne odporúčaná pacientom, ktorí nedosiahli CR alebo CRi v prvom indukčnom cykle a bola povinná pre pacientov dosahujúcich viac ako 50 %-nú redukciu v percente blastov. Liečba transplantáciou hematopoetických kmeňových buniek (HSCT, haematopoietic stem cell transplantation) po remisii bola povolená buď namiesto konsolidačnej chemoterapie, alebo po jej ukončení. Pre konsolidačné cykly, iba v klinických štúdiách, dávka Vyxeosu bola znížená na 65 jednotiek/m2/deň (ekvivalentné 29 mg/65 mg/m2) v 1. a 3. deň. V ramene 7+3, prvá indukcia pozostávala z cytarabínu 100 mg/m2/deň kontinuálnou infúziou v 1. až 7. deň, a daunorubicínu 60
mg/m2/deň v 1., 2. a 3. deň, kým druhá indukcia a konsolidácia cytarabínu bola podaná v 1. až 5. deň a daunorubicínu v 1. a 2. deň.
Na Vyxeos bolo randomizované 153 pacientov a na kontrolné rameno 7+3 bolo randomizované 156 pacientov. Randomizovaní pacienti mali medián veku 68 rokov (rozsah 60 -75 rokov), 61 % boli muži, a 88 % mali výkonnostný stav podľa ECOG 0-1. Na začiatku malo 20 % t-AML, 54 % malo AML s predchádzajúcou hematologickou poruchou a 25 % malo de novo AML s cytogenetickými abnormalitami spojených s myelodyspláziou; 34 % pacientov bolo liečených v minulosti
hypometylačnou látkou kvôli MDS; 54 % malo nepriaznivý karyotyp. Demografické charakteristiky a charakteristiky chorôb na začiatku štúdie boli vo všeobecnosti vyrovnané medzi ramenami štúdie. Mutácia FLT3 bola identifikovaná u 15 % (43/279) testovaných pacientov a mutácia NPM1 bola identifikovaná u 9 % (25/283) testovaných pacientov.
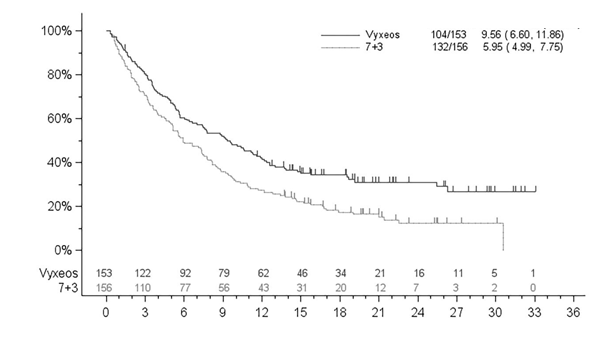
Primárnym ukazovateľom bolo celkové prežívanie merané od dátumu randomizácie po úmrtie bez ohľadu na príčinu. Vyxeos preukázal superioritu v celkovom prežívaní v populácii ITT (intention to treat, úmysel liečiť) v porovnaní s komparátorom, liečebným režimom 7+3 (Obrázok 1). Medián prežívania pre liečebnú skupinu Vyxeosu bol 9,56 mesiaca v porovnaní s 5,95 mesiaca pre liečebnú skupinu 7+3 (pomer rizika = 0,69, 95 % CI = 0,52, 0,90, obojstranný log-rank test p = 0,005).
Celková miera HSCT bola 34 % (52/153) vo ramene Vyxeosu a 25 % (39/156) v kontrolnom ramene.
 Obrázok 1: Kaplanova-Meierova krivka celkového prežívania, populácia ITT
Obrázok 1: Kaplanova-Meierova krivka celkového prežívania, populácia ITTPríhody / N Medián prežív. (95 % CI)
Mesiace po randomizácii
'
Tabuľka 4: Výsledky účinnosti pre štúdiu 301
C
elkové prežívanie
V
yxeos
N=
153
7+3
N=
156
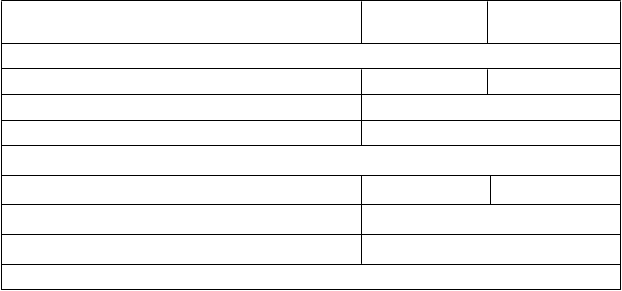
Medián prežívania, mesiace (95 % IS) 9,56 (6,60, 11,86) 5,95 (4,99, 7,75) Pomer rizika (95 % IS) 0,69 (0,52, 0,90)
hodnota p (obojstranná) a 0,005
Prežívanie bez udalostiMedián prežívania, mesiace (95 % IS) 2,53 (2,07, 4,99) 1,31 (1,08, 1,64)
Pomer rizika (95 % IS) 0,74 (0,58, 0,96)
hodnota p (obojstranná) a 0,021
Miera kompletnej odpovede
V
yxeos
N=
153
7+3
N=
156
CR, n (%) 57 (37) 40 (26) Pomer pravdepodobnosti (95 % CI) 1,69 (1,03, 2,78) hodnota p (obojstranná) b 0,040
CR + CRi, n (%) 73 (48) 52 (33) Pomer pravdepodobnosti (95 % CI) 1,77 (1,11, 2,81) hodnota p (obojstranná) b 0,016
Skratky: CI = interval spoľahlivosti (Confidence Interval); CR= kompletná odpoveď (Complete response); CRi=
kompletná odpoveď s neúplným zotavením (Complete response with incomplete recovery)
a hodnota p zo stratifikovaného log-rank testu, stratifikujúceho podľa veku a podtypu AML
b hodnota p zo stratifikovaného Cochranovho-Mantelovho-Haenszelovho testu stratifikovaného podľa veku a podtypu AML
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií Vyxeosu v jednej alebo vo viacerých podskupinách pediatrickej populácie s AML (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiFarmakokinetika daunorubicínu a cytarabínu, podaných ako Vyxeos, bola skúmaná u dospelých pacientov, ktorí dostali dávku daunorubicínu 44 mg/m2 a cytarabínu 100 mg/m2 podanú ako
90-minútová intravenózna infúzia v 1., 3. a 5. deň. Farmakokinetika každého z liekov bola založená na
celkovej koncentrácii v plazme (t.j. enkapsulovaný a neenkapsulovaný liek). Po dávke podanej
v 5. deň, priemerná hodnota (% variačný koeficient [CV]) maximálnych koncentrácií v plazme (Cmax)
daunorubicínu bola 26,0 (32,7 %) µg/ml, a cytarabínu 62,2 (33,7 %) µg/ml. Priemerná hodnota
(% CV) plochy pod krivkou (AUC, area under curve) počas jedného intervalu dávkovania pre daunorubicín bola 637 (38,4 %) µg.h/ml a pre cytarabín 1900 (44,3 %) µg.h/ml.
Keď sa daunorubicín a cytarabín podajú ako zložky Vyxeosu, zdá sa, že lipozómy riadia ich distribúciu v tkanive a rýchlosti eliminácie; preto, kým nelipozómové lieky majú výrazne rozdielny klírens (CL), distribučný objem (V) a terminálny biologický polčas (t1/2), Vyxeos spôsobuje konvergenciu týchto farmakokinetických parametrov.
Podiel akumulácie bol 1,3 pre daunorubicín a 1,4 pre cytarabín. V rozsahu dávok 1,3 mg/3 mg/m2 až
59 mg/134 mg/m2 (0,03- až 1,3-násobok schváleného odporúčaného dávkovania) sa nenašli žiadne dôkazy časovo-závislej kinetiky alebo veľkých odchýlok od dávkovej úmernosti.
DistribúciaDistribučný objem (% CV) daunorubicínu je 6,6 l (36,8 %) a cytarabínu 7,1 l (49,2 %). Väzba na plazmatické bielkoviny nebola hodnotená.
MetabolizmusabiotransformáciaPodobne ako je tomu u nelipozómového daunorubicínu a cytarabínu, po uvoľnení z lipozómov Vyxeosu sú daunorubicín aj cytarabín v tele vo veľkej miere metabolizované. Daunorubicín je prevažne katalyzovaný pečeňovou a mimopečeňovou aldoketoreduktázou a karbonylreduktázou na aktívny metabolit daunorubicinol. Cytarabín je metabolizovaný cytidíndeaminázou na inaktívny metabolit 1-β-D-arabinofuranozyluracil (AraU). Na rozdiel od nelipozómového daunorubicínu a cytarabínu, ktoré sú rýchlo metabolizované na príslušné metabolity, daunorubicín a cytarabín po podaní Vyxeosu sú voľné bázy enkapsulované v lipozómoch. Profily závislosti koncentrácie v plazme od času získané od 13 až 26 pacientov, ktorí dostali Vyxeos 100 jednotiek/m2 (čo sa rovná 44 mg/m2 daunorubicínu a 100 mg/m2 cytarabínu) v 1., 3. a 5. deň ukazujú, že priemerné pomery AUClast metabolitu k pôvodnej látke pre daunorubicinol a AraU boli 1,79 % a 3,22 % z AUClast daunorubicínu
a cytarabínu, v uvedenom poradí, čo znamená, že sú nižšie ako tie, ktoré sú bežne hlásené pre nelipozómové prípravky, ~40-60 % pre daunorubicinol:daunorubicín a ~80 % pre AraU:cytarabín. Nižšie percentá pomerov metabolitu k pôvodnej látke po podaní Vyxeosu poukazujú na to, že väčšina celkového daunorubicínu a cytarabínu v krvnom obehu je uväznená v lipozómoch Vyxeosu, kde nie sú dostupné enzýmom, ktoré ich metabolizujú.
Eliminácia
Vyxeos vykazuje predĺžený biologický polčas (% CV) 31,5 h (28,5 %) pre daunorubicín a 40,4 h
(24,2 %) pre cytarabín s tým, že viac ako 99 % daunorubicínu a cytarabínu v plazme zostáva enkapsulované v lipozómoch. Klírens (% CV) je 0,16 l/h (53,3 %) pre daunorubicín a 0,13 l/h (60,2 %) pre cytarabín.
Daunorubicín a daunorubicinol vylúčené močom tvoria 9 % podanej dávky daunorubicínu, a cytarabín a AraU vylúčené močom predstavujú 71 % podanej dávky cytarabínu.
Osobitnépopulácie
Vek, pohlavie, rasa, telesná hmotnosť, index telesnej hmotnosti a počet bielych krviniek nemajú klinicky významný účinok na expozíciu celkovému daunorubicínu alebo cytarabínu po úprave dávky
na plochu povrchu tela.
Pediatrická populácia
U pediatrických pacientov nebolo získané dostatočné množstvo farmakokinetických údajov na vyvodenie záverov.
Populácia starších ľudí
Farmakokinetika Vyxeosu u pacientov starších ako 85 rokov zatiaľ nebola vyhodnotená.Nie sú k dispozícii žiadne údaje.
Porucha funkcie pečene
Farmakokinetika celkového daunorubicínu a cytarabínu nebola zmenená u pacientov s hladinou bilirubínu ≤50 µmol/l. Farmakokinetika u pacientov s hladinou bilirubínu vyššou ako 50 µmol/l nie je
známa.
Porucha funkcie obličiek
Na základe populačnej farmakokinetickej analýzy, ktorá použila údaje z klinických štúdií u pacientov, nebol pozorovaný žiadny významný rozdiel v klírense daunorubicínu alebo cytarabínu u pacientov s
už prítomnou miernou alebo stredne závažnou poruchou funkcie obličiek (60 ml/min ≥ až
≤ 89 ml/min klírens kreatinínu [CrCL] v prípade miernej, a 30 ml/min ≥ až ≤ 59 ml/min klírens kreatinínu [CrCL] v prípade stredne závažnej poruchy funkcie) v porovnaní s pacientmi s normálnou východiskovou funkciou obličiek (CrCL ≥ 90 ml/min). Potenciálne účinky závažnej poruchy funkcie obličiek (CrCL 15 ml/min ≥ až ≤ 29 ml/min, podľa C-G) a konečného štádia ochorenia obličiek na farmakokinetiku daunorubicínu a cytarabínu, podaných ako Vyxeos, nie sú známe (pozri 4.2).
5.3 Predklinické údaje o bezpečnosti
Toxicita opakovaných dávok Vyxeosu bola testovaná v dvojcyklových štúdiách toxicity intravenóznych infúzií s 28-dňovými obdobiami zotavovania, vykonaných na potkanoch a na psoch. K nežiaducim účinkom Vyxeosu došlo na všetkých úrovniach dávkovania (nízke až nulové bezpečnostné rozpätia na základe systémových expozícií), boli vo všeobecnosti zhodné s tými, ktoré sú známe pre nelipozómový daunorubicín a/alebo cytarabín, a zahrnovali hlavne nálezy gastrointestinálnej a hematologickej toxicity. Napriek tomu, že parametre centrálnej nervovej sústavy (CNS) a kardiovaskulárneho systému boli zahrnuté v týchto štúdiách, vzhľadom na pozorovanú morbiditu a mortalitu nebol k dispozícii dostatok informácií na integrované vyhodnotenie bezpečnostnej farmakológie Vyxeosu. Vyxeos obsahuje daunorubicín, o ktorom je známe, že má výrazný kardiotoxický potenciál, a cytarabín, ktorý je spájaný s toxicitou voči CNS.
S Vyxeosom neboli vykonané štúdie karcinogenity, mutagenity a reprodukčnej toxicity.
Kým cytarabín nie je karcinogén, daunorubicín je možný karcinogén a preto Vyxeos môže byť
spojený s karcinogénnym potenciálom. Daunorubicín aj cytarabín sú genotoxické, takže Vyxeos môže byť spojený s genotoxickým rizikom.
Približne 120 dní po jedinej intravenóznej dávke daunorubicínu potkanom (vo výške približne 1,7- násobku dávky pre ľudí na základe mg/m2) bol pozorovaný vysoký výskyt nádorov prsníkov. Daunorubicín bol mutagénny v in vitro testoch (Amesov test, test buniek kmeňa V79) a klastogénny v in vitro (CCRF-CEM ľudské lymfoblasty) a in vivo (SCE test v kostnej dreni myší) testoch.
Cytarabín bol mutagénny v in vitro testoch a klastogénny in vitro (chromozómové aberácie a SCE v ľudských leukocytoch) a in vivo (chromozómové aberácie a SCE test v kostnej dreni hlodavcov, mikronukleový test u myší). Cytarabín spôsobil transformáciu buniek embryí škrečka and potkaních buniek línie H43 in vitro.
Cytarabín bol klastogénny voči bunkám v meióze.
Cytarabín aj daunorubicín, testované samostatne, preukázali teratogénne a embryotoxické účinky v štúdiách na zvieratách. Okrem toho, daunorubicín spôsobil atrofiu semenníkov a úplnú apláziu spermatocytov v semenotvorných tubuloch u psov a cytarabín spôsobil abnormality hlavy spermií u myší. Jedna dávka cytarabínu u potkanov, podaná v 14. deň gestácie, znížila prenatálnu a postnatálnu veľkosť mozgu a spôsobila trvalú poruchu schopnosti učiť sa.
Hodnotenieenvironmentálnehorizika(ERA)
Hodnotenie environmentálneho rizika preukázalo, že sa nepredpokladá, že Vyxeos by mal potenciál pretrvávať v životnom prostredí, bioakumulačný potenciál, alebo byť toxický pre životné prostredie.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Distearoylfosfatidylcholín Distearoylfosfatidylglycerol Cholesterol
Glukonát meďnatý
Trolamín (na úpravu pH) Sacharóza
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Neotvorenéinjekčnéliekovky
2 roky.
Stabilitarekonštituovanejsuspenzievinjekčnejliekovke
Chemická a fyzikálna stabilita počas používania bola preukázaná 4 hodiny pri teplote 2°C až 8°C, pri skladovaní vo vzpriamenej polohe. Z mikrobiologického hľadiska, ak metóda
otvárania/rekonštitúcie/riedenia nevylučuje riziko mikrobiálnej kontaminácie, liek sa má použiť ihneď. Ak sa nepoužije ihneď, obdobie a podmienky uskladňovania počas používania sú zodpovednosťou
používateľa.
Stabilita
z
ri
edeného
i
n
f
úzneho
roztoku
Chemická a fyzikálna stabilita počas používania bola preukázaná 4 hodiny pri teplote 2°C až 8°C. Z mikrobiologického hľadiska, ak metóda otvárania/rekonštitúcie/riedenia nevylučuje riziko mikrobiálnej kontaminácie, liek sa má použiť ihneď.
Ak sa nepoužije ihneď, obdobie a podmienky uskladňovania počas používania sú zodpovednosťou používateľa.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2°C – 8°C).
Injekčnú liekovku uchovávajte v pôvodnej škatuľke na ochranu pred svetlom. Uskladňujte vo vzpriamenej polohe.
Podmienky na uchovávanie po rekonštitúcii a riedení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Injekčná liekovka objemu 50 ml (sklo typu 1) so zátkou (chlórbutylová guma) a tesniacim krytom
(hliník), s obsahom 44 mg daunorubicínu a 100 mg cytarabínu.
Jedno balenie obsahuje buď 1 injekčnú liekovku, 2 injekčné liekovky alebo 5 injekčných liekoviek. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Vyxeos je cytotoxický liek. Je potrebné pridržiavať sa príslušných postupov na osobitné zaobchádzanie s liekom a jeho likvidáciu. Tento liek je určený iba na jednorazové použitie. Všetok nepoužitý liek sa má zlikvidovať v súlade s národnými požiadavkami pre cytotoxické látky.
Pokyny na prípravu:
• Určite dávku a počet injekčných liekoviek Vyxeosu na základe BSA individuálneho pacienta tak, ako bolo uvedené v časti 4.2.
• Vyberte potrebný počet injekčných liekoviek Vyxeosu z chladničky a nechajte ich položené 30
minút, aby sa ich teplota vyrovnala izbovej teplote (15°C až 30°C).
• Potom rekonštituujte každú injekčnú liekovku s 19 ml sterilnej vody na injekcie použitím 20 ml injekčnej striekačky a potom ihneď zapojte 5-minútový časovač.
• Krúživým pohybom pozorne miešajte obsah injekčnej liekovky 5 minút, a jemne prevráťte
injekčnú liekovku každých 30 sekúnd.
• Nezohrievajte, nepoužívajte trepačku (vortex), nepretrepávajte.
• Po rekonštitúcii ju nechajte odležať 15 minút.
• Rekonštituovaný prípravok má byť nepriehľadná, purpurová, homogénna disperzia, v podstate bez viditeľných častíc.
• Ak sa rekonštituovaný prípravok okamžite nezriedi do infúzneho vaku, uchovávajte ho v chladničke (2ºC až 8ºC) najviac 4 hodiny.
• Vypočítajte potrebný objem rekonštituovaného Vyxeosu pomocou nasledovného vzorca:
[potrebný objem (ml) = dávka daunorubicínu (mg/m2) x BSA pacienta (m2)/2,2 (mg/ml)]. Koncentrácia rekonštituovaného roztoku je 44 mg/20 ml (2,2 mg/ml) daunorubicínu
a 100 mg/20 ml (5 mg/ml) cytarabínu.
• Jemne prevráťte každú injekčnú liekovku 5-krát pred odobratím koncentrátu na riedenie.
• Aseptickým postupom odoberte sterilnou injekčnou striekačkou vypočítaný objem rekonštituovaného Vyxeosu z injekčnej liekovky/injekčných liekoviek a preneste ho do infúzneho vaku s obsahom 500 ml injekčného roztoku chloridu sodného v koncentrácii 9 mg/ml (0,9 %) alebo 5 % glukózy. V injekčnej striekačke môže zostať reziduálne množstvo prípravku. Nepoužitú časť zlikvidujte.
• Jemne prevráťte vak, aby sa roztok premiešal. Zriedenie rekonštituovaného prípravku má za výsledok modrofialovú, priesvitnú, homogénnu disperziu.
• Ak sa zriedený infúzny roztok okamžite nepoužije, uchovávajte ho v chladničke (2ºC až 8ºC)
najviac 4 hodiny.
• Po vybratí z chladničky jemne prevráťte vak, aby sa roztok premiešal.
Pokyny na podanie
• Vyxeos nemiešajte ani nepodávajte ako infúziu s inými liekmi.
• Vyxeos podajte konštantnou intravenóznou infúziou počas 90 minút pomocou infúznej pumpy a prostredníctvom centrálneho žilového katétra alebo periférne zavedeného centrálneho katétra.
Nepoužívajte líniový filter.
• Po podaní linku prepláchnite injekčným roztokom chloridu sodného 9 mg/ml (0,9 %).
Tento liek môže predstavovať potenciálne riziko pre životné prostredie vzhľadom na cytotoxické a antimitotické účinky, ktoré môžu spôsobiť reprodukčné účinky. Všetky materiály použité na riedenie a podanie sa majú zlikvidovať v súlade s národnými postupmi na likvidáciu cytostatík. Všetok
nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami pre cytotoxické látky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIJazz Pharmaceuticals Ireland Ltd
5th Floor
Waterloo Exchange
Waterloo Road
Dublin
D04 E5W7
Írsko
8. REGISTRAČNÉ ČÍSLOEU/1/18/1308/001 1 injekčná liekovka EU/1/18/1308/002 2 injekčné liekovky EU/1/18/1308/003 5 injekčných liekoviek
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.