
nitorované a/alebo liečené, boli z klinických štúdií vylúčení. Pre týchto pacientov sú k dispozícii obmedzené bezpečnostné údaje.
Závažná precitlivenosť
Boli hlásené závažné reakcie z precitlivenosti, vrátane anafylaktických reakcií, ktoré môžu vzniknúť
do niekoľkých minút po infúzii. Väčšina reakcií z precitlivenosti vznikla počas infúzie a tieto reakcie neboli závažné (pozri časť 4.8). Ak vznikne závažná reakcia z precitlivenosti, okamžite prestaňte podávať liek VYEPTI a začnite vhodnú liečbu. Ak nie je reakcia z precitlivenosti závažná, je pokračovanie v ďalšej liečbe liekom VYEPTI na rozhodnutí ošetrujúceho lekára, ktorý musí zohľadniť vyváženosť prínosu a rizika pre konkrétneho pacienta.
Pomocné látky
VYEPTI obsahuje sorbitol (E420). Pacientom s hereditárnou intoleranciou fruktózy (HFI, hereditary
fructose intolerance) nesmie byť podaný tento liek, ak to nie je striktne nevyhnutné.
Musí sa vykonať detailná anamnéza každého pacienta s ohľadom na symptómy HFI pred podaním
tohto lieku.
4.5 Liekové a iné interakcie
Eptinezumab nemetabolizujú enzýmy cytochrómu P450. Preto sú interakcie eptinezumabu a súčasne podávaných liekov, ktoré sú substrátmi, induktormi alebo inhibítormi enzýmov cytochrómu P450, považované za nepravdepodobné.
4.6 Fertilita, gravidita a laktácia
Gravidita
Sú k dispozícii obmedzené údaje týkajúce sa používania eptinezumabu u gravidných žien. Štúdie na
zvieratách s eptinezumabom nepreukázali priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej toxicity (pozri časť 5.3). O ľudskom imunoglobulíne G je známe, že prechádza placentárnou bariérou, preto sa môže eptinezumab preniesť z matky na vyvíjajúci sa plod.
Ako preventívne opatrenie je vhodnejšie vyvarovať sa používaniu VYEPTI počas gravidity.
Dojčenie
Nie je známe, či je eptinezumab prítomný v ľudskom mlieku, aké sú účinky na dojčené dieťa a na
tvorbu mlieka. O ľudskom imunoglobulíne G je známe, že sa vylučuje do materského mlieka počas prvých niekoľkých dní po narodení a krátko nato jeho koncentrácia klesá; z tohto dôvodu riziko u dojčiat nemôže byť počas tohto krátkeho obdobia vylúčené. O použití eptinezumabu počas dojčenia by sa preto malo uvažovať len vtedy, ak si to klinický stav vyžaduje.
Fertilita
Účinok eptinezumabu na ľudskú plodnosť nebol hodnotený. Štúdie na zvieratách s eptinezumabom
nepreukázali žiadny vplyv na samičiu ani samčiu plodnosť (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek VYEPTI nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať
stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofiluPočas klinických štúdií bolo liekom VYEPTI liečených viac ako 2 000 pacientov, z ktorých asi 1 000
bolo vystavených lieku počas 48 týždňov (štyri dávky).
Najčastejšími nežiaducimi reakciami bol zápal sliznice nosohltana a precitlivenosť. Väčšina reakcií z precitlivenosti sa vyskytla počas infúzie a nebola závažná. Nežiaduce udalosti súvisiace s miestom podania infúzie sa vyskytli zriedkavo a v podobných podieloch u pacientov, ktorým bol podaný liek VYEPTI a placebo (< 2 %) bez zjavného vzťahu k dávke lieku VYEPTI. Najčastejšou nežiaducou udalosťou súvisiacou s miestom podania infúzie bola extravazácia v mieste infúzie, ku ktorej došlo u
< 1 % pacientov, ktorým bol podaný liek VYEPTI a placebo.
Zoznam nežiaducich reakcií v tabuľkeNežiaduce reakcie z klinických skúšaní a skúseností po uvedení lieku na trh (tabuľka 1) sú
klasifikované podľa frekvencie a triedy orgánových systémov MedDRA. Frekvencie boli vyhodnotené
podľa týchto konvencií: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až
< 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000).
Tabuľka 1: Zoznam nežiaducich reakciíTrieda orgánových systémov
| Preferovaný názov
nežiaducej reakcie
| Kategória frekvencie
|
Infekcie a nákazy
| Nazofaryngitída
| Časté
|
Poruchy imunitného systému
| Reakcie z precitlivenosti
| Časté
|
Anafylaktická reakcia1
| Zriedkavé
|
Celkové poruchy a reakcie v mieste podania
| Únava
| Časté
|
1 Nehlásené v PROMISE 1 a PROMISE 2, ale hlásené v ostatných štúdiách a po uvedení lieku na trh.
Popis vybraných nežiaducich reakciíNazofaryngitídaNazofaryngitída sa vyskytla u približne 8 % pacientov, ktorým bola podaná dávka 300 mg, 6 % pacientov, ktorým bola podaná dávka 100 mg a 6 % pacientov, ktorým bola podaná dávka placeba v štúdii PROMISE 1 a PROMISE 2. Nazofaryngitída sa najčastejšie vyskytla po prvej dávke lieku VYEPTI v akomkoľvek množstve. Incidencia výrazne klesala s následnými dávkami a jej výskyt bol následne pomerne stabilný.
Reakcie z precitlivenostiBoli nahlásené závažné reakcie z precitlivenosti, vrátane anafylaktických reakcií, ktoré môžu vzniknúť do niekoľkých minút po infúzii (pozri časť 4.4). Nahlásené anafylaktické reakcie zahŕňali symptómy hypotenzie a respiračných problémov a viedli k prerušeniu podávania lieku VYEPTI. Ostatné reakcie
z precitlivenosti, vrátane angioedému, žihľavky, návalu tepla, vyrážok a svrbenia, boli hlásené u
približne 4 % pacientov, ktorým bola podaná dávka 300 mg, 3 % pacientov, ktorým bola podaná dávka 100 mg a 1 % pacientov, ktorým bolo podané placebo v štúdii PROMISE 1 a PROMISE 2.
ÚnavaU približne 3 % pacientov, ktorým bol podaný eptinezumab, a 2 % pacientov, ktorým bolo podané placebo v placebom kontrolovaných klinických skúšaniach, sa vyskytla únava. Únava bola najčastejšia v deň prvej infúzie. Po prvom týždni a pri ďalších infúziách bola únava hlásená s nižšou incidenciou a tieto incidencie boli porovnateľné s placebom.
I
m
unogenicita
V klinických štúdiách PROMISE 1 (do 56 týždňov) a PROMISE 2 (do 32 týždňov) bola incidencia výskytu protilátok proti eptinezumabu v obidvoch štúdiách 18 % (105/579) a 20 % (115/574) u pacientov, ktorým bola podávaná dávka 100 mg a 300 mg každých 12 týždňov v uvedenom poradí. V obidvoch štúdiách dosiahla incidencia protilátok proti eptinezumabu maximá v 24. týždni a potom vykazovala stabilný pokles aj po následnom podávaní dávok každých 12 týždňov. Incidencia neutralizujúcich protilátok v obidvoch štúdiách bola 8,3 % (48/579) a 6,1 % (35/574) v skupinách liečených 100 mg a 300 mg v uvedenom poradí.
V otvorenom klinickom skúšaní PREVAIL (do 96 týždňov liečby s dávkou 300 mg lieku VYEPTI každých 12 týždňov) sa u 18 % (23/128) pacientov vyskytli protilátky proti eptinezumabu s celkovou incidenciou neutralizujúcich protilátok 7 % (9/128). 5,3 % pacientov bolo pozitívnych na ADA v 48. týždni, 4 % bolo pozitívnych na ADA v 72. týždni a všetci pacienti, okrem jedného, ktorý štúdiu nedokončil, boli ADA negatívni v 104. týždni (posledné hodnotenie v štúdii).
V klinických skúšaniach boli koncentrácie eptinezumabu v plazme nižšie u pacientov, u ktorých sa objavili protilátky proti eptinezumabu. Neexistuje žiadny dôkaz o vplyve vzniku protilátok proti eptinezumabu na účinnosť alebo bezpečnosť v klinických štúdiách.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieDávky do 1 000 mg boli podávané intravenózne ľuďom bez problémov s toleranciou alebo klinicky
významných nežiaducich reakcií.
V prípade predávkovania sa musí pacient liečiť symptomaticky a podľa potreby sa musia zaviesť
podporné opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: analgetiká, antagonisty peptidu súvisiaceho s génom kalcitonínu
(CGRP), ATC kód: N02CD05.
Mechanizmus účinkuEptinezumab je rekombinantná humanizovaná protilátka typu imunoglobulín G1 (IgG1), ktorá sa
viaže na α a β formy ľudského ligandu peptidu súvisiaceho s génom kalcitonínu (CGRP, calcitonin gene-related peptide) s nízkou pikomolárnou afinitou (4 a 3 pM Kd v uvedenom poradí). Eptinezumab zabraňuje aktivácii receptorov CGRP, a tým následnej kaskáde fyziologických udalostí, ktoré sú spojené so spustením záchvatov migrény.
Eptinezumab inhibuje neurogénny zápal a vazodilatáciu sprostredkovanú α a β CGRP.
Eptinezumab je vysoko selektívny (> 100 000-násobne
vs. príbuzné neuropeptidy amylín , kalcitonín, adrenomedulín a intermedín).
K
li
n
i
cká účinnosť abezpečnosť
Liek VYEPTI (eptinezumab) bol hodnotený na preventívnu liečbu migrény v dvoch kľúčových
placebom kontrolovaných štúdiách: Štúdia PROMISE 1 sa uskutočnila na pacientoch s epizodickou migrénou (n = 888) a štúdia PROMISE 2 na pacientoch s chronickou migrénou (n = 1 072). Zaradení pacienti mali anamnézu migrény (s aurou alebo bez aury) v trvaní minimálne 12 mesiacov podľa diagnostických kritérií medzinárodnej klasifikácie bolestí hlavy (ICHD-II alebo III).
PROMISE 1: epizodická migréna
PROMISE 1 bola paralelná skupinová, dvojito zaslepená, placebom kontrolovaná štúdia na
vyhodnotenie účinnosti a bezpečnosti lieku VYEPTI na preventívnu liečbu epizodickej migrény u
dospelých. 665 pacientov bolo randomizovaných na placebo (N = 222), 100 mg eptinezumabu (N =
221) alebo 300 mg eptinezumabu (N = 222) každých 12 týždňov počas 48 týždňov (4 infúzie). Epizodická migréna bola definovaná ako ≥ 4 a ≤ 14 dní bolesti hlavy, z ktorých migréna trvala minimálne 4 dni v každom 28-dňovom období počas 3 mesiacov pred skríningom a bola potvrdená počas východiskového obdobia. Pacienti mohli počas štúdie zároveň užívať lieky na akútnu migrénu alebo bolesti hlavy, vrátane liekov určených na migrénu (t. j. triptány, deriváty ergotamínu). Pravidelné používanie (dlhšie ako 7 dní za mesiac) iných spôsobov liečby na prevenciu migrény nebolo povolené.
Primárnym cieľovým ukazovateľom účinnosti bola zmena od východiskovej hodnoty priemerného počtu dní migrény za mesiac (MMD) počas 1. – 12. týždňa. Kľúčové sekundárne cieľové ukazovatele zahŕňali miery odpovedí na migrénu ≥ 50 % a ≥ 75 %, ktoré boli definované ako podiel pacientov, ktorí dosiahli minimálne konkrétne percentuálne zníženie dní migrény počas 1. – 12. týždňa, ≥ 75 % miery odpovedí na migrénu počas 1. – 4. týždňa a percentuálnu hodnotu pacientov s migrénou v deň po prvej dávke (1. deň).
Priemerný vek pacientov bol 40 rokov (rozsah: 18 až 71 rokov), 84 % boli ženy a 84 % boli belosi. Priemerný počet dní migrény za mesiac vo východiskovom stave bolo 8,6 a miera pacientov s migrénou v daný deň bola 31 %; obidve hodnoty boli v liečených skupinách podobné.
Zníženie priemerného počtu dní migrény za mesiac v porovnaní so skupinou, ktorej bolo podané placebo, pri obidvoch dávkach bolo pozorované od prvého dňa po podaní.
O
brázok 1 Priemerné zmeny počtu dní migrény za mesiac od východiskového stavu v štúdii
PROMISE 1
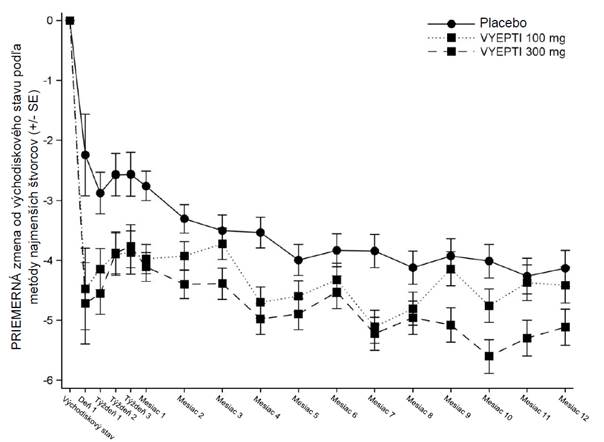
VYEPTI = eptinezumab
V každom časovom bode sa na vyhodnotenie priemernej zmeny od východiskovej hodnoty použil model ANCOVA vrátane využitia liečby a profylaktických liekov ako faktorov a počtu dní migrény vo východiskovom stave ako kovariátu.
T
abuľka 2: Výsledky primárnych a sekundárnych kľúčových ukazovateľov účinnosti v štúdii
PROMISE 1 (epizodická migréna)
|
VYEPTI
10
0 mg
N = 221
|
VYEPTI
30
0 mg
N = 222
|
Placebo
N = 222
|
Počet dní migrény za mesiac (MMD) – 1. – 12. týždeň
|
Východiskový stav
|
8,7
|
8,6
|
8,4
|
Priemerná zmena
|
-3,9
|
-4,3
|
-3,2
|
Rozdiel od placeba
|
-0,7
|
-1,1
|
|
CI95 %
|
(-1,3, -0,1)
|
(-1,7, -0,5)
|
|
h
odn
o
t
a p vs. placebo
|
0,0182
|
0,0001
|
|
≥ 75 % respondérov MMD – 1. – 4. týždeň
|
Respondéri
|
30,8 %
|
31,5 %
|
20,3 %
|
Rozdiel od placeba
|
10,5 %
|
11,3 %
|
|
h
odn
o
t
a p vs. placebo
|
0,0112
|
0,0066
|
|
≥ 75 % respondérov MMD – 1. – 12. týždeň
|
Respondéri
|
22,2 %
|
29,7 %
|
16,2 %
|
Rozdiel od placeba
|
6,0 %
|
13,5 %
|
|
h
odn
o
t
a p vs. placebo
|
0,1126
|
0,0007
|
|
≥ 50 % respondérov MMD – 1. – 12. týždeň
|
Respondéri
|
49,8 %
|
56,3 %
|
37,4 %
|
Rozdiel od placeba
|
12,4 %
|
18,9 %
|
|
h
odn
o
t
a p vs. placebo
|
0,0085
|
0,0001
|
|
PROMISE 2: chronická migréna
Štúdia PROMISE 2 bola paralelná skupinová, dvojito zaslepená, placebom kontrolovaná globálna
štúdia na vyhodnotenie účinnosti a bezpečnosti lieku VYEPTI na preventívnu liečbu chronickej migrény u dospelých. Celkovo bolo v štúdii randomizovaných 1 072 pacientov, ktorí dostali placebo (N = 366), 100 mg eptinezumabu (N = 356) alebo 300 mg eptinezumabu (N = 350) každých
12 týždňov počas 24 týždňov (2 infúzie). Chronická migréna bola definovaná ako ≥ 15 až ≤ 26 dní
bolesti hlavy, z ktorých ≥ 8 bolo vyhodnotených ako dni s migrénou počas 3 mesiacov pred skríningom a potvrdených počas 28-dňového trvania skríningu. Počas štúdie mohli pacienti užívať akútne alebo preventívne lieky proti migréne alebo bolestiam hlavy v stanovenom stabilnom režime (okrem liečiva onabotulinumtoxín A).
Do súboru štúdie bolo zaradených celkovo 431 pacientov (40 %) s duálnou diagnózou chronickej migrény a bolesti hlavy z nadmerného užívania liekov (ktorá súvisela s nadmerným užívaním triptánov, ergotamínu alebo kombinácie analgetík viac ako 10 dní/mesiac, alebo paracetamolu, kyseliny acetylsalicylovej alebo nesteroidných protizápalových liekov ≥ 15 dní/mesiac), ktorá bola potvrdená počas trvania skríningu.
Primárnym cieľovým ukazovateľom účinnosti bola zmena od východiskovej hodnoty priemerného počtu dní migrény za mesiac (MMD) počas 1. – 12. týždňa. Kľúčové sekundárne koncové ukazovatele zahŕňali miery respondérov ≥ 50 % a ≥ 75 %, ktoré boli definované ako podiel pacientov, ktorí dosiahli konkrétne percentuálne zníženie počtu dní migrény počas 1. – 12. týždňa, mieru respondérov
≥ 75 % počas 1. – 4. týždňa, percentuálnu hodnotu pacientov s migrénou v deň po podaní, zníženie
prevalencie migrény od východiskovej hodnoty po 4. týždeň, zmenu od východiskového stavu v
celkovom skóre testu postihnutia spôsobeného bolesťou hlavy (HIT-6) v 12. týždni (len 300 mg
dávka) a priemernú zmenu od východiskového stavu počas dní v mesiaci s akútnou migrénou počas 1.
– 12. týždňa (len 300 mg dávka).
Priemerný vek pacientov bol 41 rokov (rozsah: 18 až 65 rokov), 88 % boli ženy a 91 % tvorili belosi. Štyridsaťjeden percent pacientov užívalo súčasne preventívne lieky proti migréne. Vo východiskovom
stave bol priemerný počet dní s migrénou za mesiac 16,1 a miera pacientov s migrénou v daný deň
bola 57,6 %; obidve hodnoty boli podobné v obidvoch liečených skupinách.
Zníženie priemerného počtu dní migrény za mesiac v porovnaní so skupinou, ktorej bolo podané placebo, pri obidvoch dávkach bolo pozorované od prvého dňa po podaní.
Obrázok 2: Priemerné zmeny počtu dní migrény za mesiac od východiskového stavu v štúdiiPROMISE 2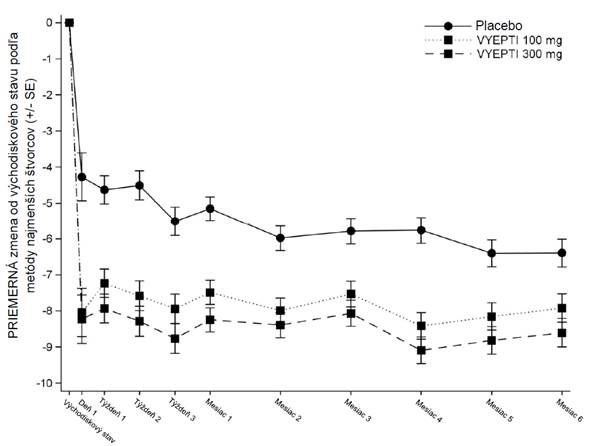
VYEPTI = eptinezumab
V každom časovom bode sa na vyhodnotenie priemernej zmeny od východiskovej hodnoty použil model
ANCOVA vrátane využitia liečby ako faktora a počtu dní migrény vo východiskovom stave ako kovariátu.
T
abuľka 3: Výsledky primárnych a sekundárnych kľúčových ukazovateľov účinnosti v štúdii
PROMISE 2 (chronická migréna)
|
VYEPTI
10
0 mg
N = 356
|
VYEPTI
30
0 mg
N = 350
|
Placebo
N = 366
|
Počet dní migrény za mesiac (MMD) – 1. – 12. týždeň
|
Východiskový stav
|
16,1
|
16,1
|
16,2
|
Priemerná zmena
|
-7,7
|
-8,2
|
-5,6
|
Rozdiel od placeba
|
-2,0
|
-2,6
|
|
CI95 %
|
(-2,9, -1,2)
|
(-3,5, -1,7)
|
|
h
odn
o
t
a p vs. placebo
|
< 0,0001
|
< 0,0001
|
|
≥ 75 % respondérov MMD – 1. – 4. týždeň
|
Respondéri
|
30,9 %
|
36,9 %
|
15,6 %
|
Rozdiel od placeba
|
15,3 %
|
21,3 %
|
|
h
odn
o
t
a p vs. placebo
|
< 0,0001
|
< 0,0001
|
|
≥ 75 % respondérov MMD – 1. – 12. týždeň
|
Respondéri
|
26,7 %
|
33,1 %
|
15,0 %
|
Rozdiel od placeba
|
11,7 %
|
18,1 %
|
|
h
odn
o
t
a p vs. placebo
|
0,0001
|
< 0,0001
|
|
≥ 50 % respondérov MMD – 1. – 12. týždeň
|
Respondéri
|
57,6 %
|
61,4 %
|
39,3 %
|
Rozdiel od placeba
|
18,2 %
|
22,1 %
|
|
h
odn
o
t
a p vs. placebo
|
< 0,0001
|
< 0,0001
|
|
Skóre HIT-6 – 12. týždeňa
|
Východiskový stav
|
65,0
|
65,1'
|
64,8
|
Priemerná zmena
|
-6,2
|
-7,3
|
-4,5
|
Rozdiel od placeba
|
-1,7
|
-2,9
|
|
CI95 %
|
(-2,8, -0,7)
|
(-3,9, -1,8)
|
|
h
odn
o
t
a p vs. placebo
|
0,0010
|
< 0,0001
|
|
Počet dní užívania liekov na akútnu migrénu za mesiac – 1. – 12. týždeňa,b
|
Východiskový stav
|
6,6
|
6,7
|
6,2
|
Priemerná zmena
|
-3,3
|
-3,5
|
-1,9
|
Rozdiel od placeba
|
-1,2
|
-1,4
|
|
CI95 %
|
(-1,7, -0,7)
|
(-1,9, -0,9)
|
|
h
odn
o
t
a p vs. placebo
|
< 0,0001
|
< 0,0001
|
|
a Koncový ukazovateľ pre dávku 100 mg nebol vopred špecifikovaný kľúčový sekundárny koncový ukazovateľ.
b Východiskový stav bola priemerná hodnota počas 28-dňového obdobia skríningu pred podaním liečby
Pacienti s diagnostikovanými bolesťami hlavy z nadmerného užívania liekovZ 431 (40 %) pacientov s diagnostikovanými bolesťami hlavy z nadmerného užívania liekov (MOH, medication-overuse headache) v štúdii PROMISE-2 bola priemerná zmena od východiskového stavu v MMD ( 1. – 12. týždeň) pre liek VYEPTI 100 mg -8,4 dní, VYEPTI 300 mg -8,6 dní a pre placebo -
5,4 dní (priemerný rozdiel od placeba -3,0 dni a -3,2 dni pre dávku 100 mg a 300 mg v uvedenom poradí).
PREVAIL: dl hodobá št údi a
Liek VYEPTI 300 mg sa podával každých 12 týždňov v i.v. infúziách až do 96 týždňov
128 pacientom s chronickou migrénou. Primárnym cieľom bolo vyhodnotiť dlhodobú bezpečnosť po opakovaných dávkach lieku VYEPTI. Sekundárne ciele zahŕňali charakterizáciu profilov farmakokinetiky a imunogenicity pre liek VYEPTI (časť 4.8) a vyhodnotenie terapeutického účinku lieku VYEPTI v niekoľkých výsledkoch hlásených pacientom týkajúcich sa migrény a kvality života vrátane testu vplyvu bolesti hlavy (HIT-6). Priemerný vek pacientov bol 41,5 rokov (rozsah: 18 až
65 rokov), 85 % boli ženy, 95 % boli belosi a 36 % zároveň užívalo lieky na prevenciu migrény.
Priemerný počet dní s migrénou počas 28-dňového obdobia počas 3 mesiacov pred skríningom bol
14,1 dní. Celkovo dokončilo štúdiu 100 pacientov (78,1 %) (104. týždeň). Vo východiskovom stave bol vplyv na pacientov závažný a priemerné celkové skóre testu HIT-6 bolo 65. Priemerná zmena od východiskového stavu počas 104. týždňa bola -9,7 (p < 0,0001). Bezpečnostný profil bol v súlade s bezpečnostnými profilmi pozorovanými v randomizovaných placebom kontrolovaných štúdiách a trvalý účinok vo výsledkoch relevantných pre pacientov bol pozorovaný až do 96 týždňov.
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s liekom VYEPTI v
jednej alebo vo viacerých podskupinách pediatrickej populácie v rámci preventívnej liečby migrény
(informácie o použití v pediatrickej populácii, pozri časť 4.2)
5.2 Farmakokinetické vlastnosti
Keďže sa liek VYEPTI podáva intravenózne, jeho biologická dostupnosť je 100 %. Eptinezumab vykazuje lineárnu farmakokinetiku a zvýšenie expozície úmerne dávkam od 10 do 1 000 mg. Rovnovážny stav sa dosiahne po prvej dávke počas dávkovacieho režimu podávania dávky každých
12 týždňov. Priemerný čas do dosiahnutia maximálnej koncentrácie (Cmax) je 30 minút (koniec
podávania infúzie) a priemerný polčas konečnej eliminácie je 27 dní. Priemerné pomery akumulácie na základe Cmax a AUC0-tau sú 1,08 a 1,15 v uvedenom poradí.
Absorpcia
Liek VYEPTI sa podáva intravenóznou infúziou, ktorá obchádza extravaskulárnu absorpciu a je
biologicky dostupná na 100 %. Priemerný čas maximálnej koncentrácie sa dosiahol na konci infúzie
(30 minút).
Distribúcia
Centrálny distribučný objem (Vc) pre eptinezumab bol približne 3,7 litrov.
Biotransformácia
Predpokladá sa, že eptinezumab sa rozkladá pomocou proteolytických enzýmov na malé peptidy a
aminokyseliny.
Eliminácia
Zdanlivý klírens eptinezumabu bol 0,15 l/deň a konečný polčas eliminácie bol približne 27 dní.
Osobitné populácie
Farmakokinetická analýza populácie, ktorá zahŕňala 2 123 subjektov, skúmala vplyv veku, pohlavia,
etnickej príslušnosti a telesnej váhy na farmakokinetiku eptinezumabu. Vzhľadom na účastníka s hmotnosťou 70 kg bola expozícia eptinezumabu v ustálenom stave u účastníka s hmotnosťou 190 kg až o 52 % nižšia, pričom by bola až o 50 % vyššia u účastníka s hmotnosťou 39 kg. Vyhodnotenie
reakcie na expozíciu ale neukázalo žiadny vplyv telesnej hmotnosti na klinickú účinnosť. Na základe telesnej hmotnosti nie je potrebná úprava dávky. Na farmakokinetiku eptinezumabu nemá vplyv vek (18 – 71), pohlavie ani rasa na základe farmakokinetiky populácie. Preto nie je potrebná úprava dávky.
Poškodenie obličiek alebopečene
Neuskutočnili sa žiadne špecializované štúdie poškodenia obličiek alebo pečene, ktoré by vyhodnotili
účinky poškodenia pečene alebo obličiek na farmakokinetiku eptinezumabu. Analýza farmakokinetiky populácie z integrovaných údajov z klinických štúdií lieku VYEPTI neodhalila žiadne rozdiely u pacientov s poškodením obličiek alebo pečene, ktoré by vyžadovali úpravu dávky. Nie sú dostupné žiadne údaje pre pacientov so závažným poškodením obličiek.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, juvenilnej toxicity alebo reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí
Genotoxicita a karcinogenéza
Keďže je nepravdepodobné, že eptinezumab bude interagovať priamo s DNA alebo iným
chromozómovým materiálom, neboli vyhodnotenia potenciálnej genotoxicity potrebné a neuskutočnili
sa.
Nakoľko pri rozsiahlom vyhodnotení literatúry týkajúcej sa inhibície CGRP nebolo zistené žiadne riziko karcinogenity a v dlhodobých štúdiách na opiciach neboli pozorované žiadne proliferačné nálezy týkajúce sa eptinezumabu, nebolo testovanie karcinogenity potrebné a neuskutočnilo sa.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Sorbitol (E420) L-histidín
Monohydrát L-histidínium-chloridu
Polysorbát 80
Voda na injekcie
6.2 Inkompatibility
Nevykonali sa žiadne štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
3 roky.
Po riedení sa musí infúzny roztok VYEPTI (VYEPTI a 0,9 % injekčný roztok chloridu sodného)
podať do 8 hodín (pozri časť 6.6).
6.4 Špeciálne upozornenia na uchovávanie Uchovávajte v chladničke (2°C – 8°C). Neuchovávajte v mrazničke ani nepretrepávajte.
Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Po riedení sa infúzny roztok VYEPTI (VYEPTI a 0,9 % injekčný roztok chloridu sodného) môže uchovávať pri izbovej teplote (do 25°C) alebo v chladničke pri teplote 2°C – 8°C.
6.5 Druh obalu a obsah balenia
4 ml injekčná liekovka zo skla typu I s chlórbutylovou gumovou zátkou. Zátka injekčnej liekovky je vyrobená bez použitia prírodnej gumy (latexu).
Každá škatuľa obsahuje jednu injekčnú liekovku.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Tento liek sa musí pred podaním zriediť. Riedenie musí vykonať zdravotnícky pracovník aseptickou technikou, aby sa zaistila sterilnosť pripraveného infúzneho roztoku.
Liek neobsahuje žiadnu konzervačnú látku a je určený len na jednorazové použitie a všetok nepoužitý
liek sa musí zlikvidovať.
Pred riedením liek (koncentrát v injekčných liekovkách) vizuálne skontrolujte; nepoužívajte ho, ak sa v koncentráte nachádzajú viditeľné častice alebo ak je zakalený alebo sfarbený (iný ako číry až jemne opalescenčný, bezfarebný až hnedasto-žltý).
Pri dávkach 100 mg a 300 mg sa musí použiť 100 ml vak s injekčným roztokom chloridu sodného s koncentráciou 9 mg/ml (0,9 %), aby sa infúzny roztok VYEPTI pripravil podľa popisu nižšie. Na prípravu infúzneho roztoku VYEPTI sa nesmú použiť žiadne iné intravenózne riediace látky ani iný objem.
Jemne prevráťte infúzny roztok VYEPTI, aby sa úplne premiešal. Nepretrepávajte.
Po riedení sa musí infúzny roztok VYEPTI podať do 8 hodín. Počas tohto času sa môže infúzny roztok VYEPTI uchovávať pri izbovej teplote (do 25°C) alebo v chladničke pri teplote 2°C – 8°C. Pri uchovávaní pri teplote 2°C – 8°C nechajte infúzny roztok VYEPTI pred podaním infúzie zohriať na izbovú teplotu. NEUCHOVÁVAJTE V MRAZNIČKE.
Dávka 100 mg lieku VYEPTI
Na prípravu infúzneho roztoku VYEPTI natiahnite 1,0 ml lieku VYEPTI z jednej injekčnej liekovky
na jednorazové použitie pomocou sterilnej ihly a striekačky. Vstreknite obsah 1,0 ml (100 mg) do
100 ml vaku s injekčným roztokom chloridu sodného s koncentráciou 0,9 %.
Dávka 300 mg lieku VYEPTI
Na prípravu infúzneho roztoku VYEPTI natiahnite 1,0 ml lieku VYEPTI z 3 injekčných liekoviek na
jednorazové použitie pomocou sterilnej ihly a striekačky. Vstreknite výsledný obsah 3,0 ml (300 mg)
do 100 ml vaku s injekčným roztokom chloridu sodného s koncentráciou 0,9 %.
Návod na podanie infúzie
Pred podaním parenterálnych liekov, a ak to roztok a obal umožňujú, vizuálne skontrolujte, či sa v
roztoku nenachádzajú častice alebo či nie je zafarbený. Tekutinu nepoužívajte, ak sú v nej viditeľné častice alebo je zakalená či zafarbená.
Po riedení obsahu injekčnej liekovky v 100 ml vaku s injekčným roztokom chloridu sodného s koncentráciou 0,9 % podávajte dávku 100 mg alebo 300 mg lieku VYEPTI infúziou podľa predpisu počas asi 30 minút. Použite intravenóznu infúznu súpravu s radovým (in-line) alebo prídavným (add- on) filtrom 0,2 alebo 0,22 μm. Po ukončení infúzie prepláchnite hadičku 20 ml injekčného roztoku chloridu sodného s koncentráciou 0,9 %.
Liek VYEPTI nepodávajte ako bolus injekciu.
Cez infúznu súpravu sa nesmú podávať žiadne iné lieky a nesmú sa ani miešať s liekom VYEPTI. Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIH. Lundbeck A/S Ottiliavej 9
2500 Valby
Dánsko
8. REGISTRAČNÉ ČÍSLOEU/1/21/1599/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu