ie, cievnych spazmov, ischemických cerebrálnych lézií, pokročilej mozgovej arteriosklerózy.
Liečba hypertonickej alebo sklerotickej retinopatie, makulárnej degenerácie spôsobenej arteriosklerózou alebo cievnym spazmom, ako aj parciálnej trombózy a sekundárneho glaukómu spôsobeného vaskulárnou oklúziou.
Liečba cirkulačných porúch vnútorného ucha, vertigo labyrintového pôvodu, presbyacusis spôsobená cievnymi poruchami.
Liečba postmenopauzálnych symptómov v kombinácii s hormonálnou substitučnou terapiou.
Liek nie je vhodný pre deti a dospievajúcich.
4.2 Dávkovanie a spôsob podávaniaDávkovanieDospelíPočiatočné dávkovanie: trikrát denne 1-2 tablety (5-10 mg vinpocetínu), maximálne 30 dní.
Dlhodobé dávkovanie: 1 tableta (5 mg vinpocetínu) 3-krát denne.
Deti a dospievajúciBezpečnosť a účinnosť Vinpocetine Covex 5 mg u detí a dospievajúcich nebola doteraz stanovená.
K dispozícii nie sú žiadne údaje.
Spôsob podania Tablety sa užívajú po jedle.
4.3 Kontraindikácie Precitlivenosť na vinpocetín alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Akútne intracerebrálne krvácanie, intrakraniálna hypertenzia.
Srdcová insuficiencia a ťažká srdcová arytmia.
Gravidita, laktácia.
Podávanie deťom a dospievajúcim.
4.4 Osobitné upozornenia a opatrenia pri používaníDeti a dospievajúciVinpocetine Covex 5 mg sa nesmie podávať deťom a dospievajúcim (pozri časť 4.3).
Osobitná opatrnost’ je potrebná u pacientov s arytmiami a u pacientov liečených hypotenzívami. Ďalej je potrebná zvýšená opatrnosť pri súčasnej liečbe liekmi, ktoré predlžujú QT interval a u pacientov s neznášanlivosťou Vinca-alkaloidov. V prípade predĺženia QT intervalu alebo súčasného používania liekov, ktoré predlžujú QT interval, sa odporúča kontrola EKG. Zvýšená opatrnosť je potrebná u pacientov s renálnym zlyhaním.
Liek obsahuje laktózu. Liek sa nemá podávať pacientom so zriedkavými dedičnými poruchami: intoleranciou galaktózy, laponskou deficienciou laktázy alebo s poruchou absorpcie glukózy a galaktózy.
4.5 Liekové a iné interakcieNeuskutočnili sa žiadne interakčné štúdie.
Interakcie vinpocetínu s inými liečivami dosiaľ nie sú známe.
Nie sú vylúčené interakcie s hypotenzívami, antiarytmikami a antikoagulanciami. Pacientov liečených súčasne týmito liekmi a vinpocetínom treba starostlivo sledovat’.
Doteraz sa nepozorovali interakcie vinpocetínu s týmito súbežne podávanými liekmi: beta-blokátory (napr. chloranolol, pindolol), digoxín, acenokumarol, glibenklamid, imipramín, klopamid, alfa-metyldopa, hydrochlorotiazid. Iba vo výnimočných a ojedinelých prípadoch bolo popísané zosilnenie hypotenzného účinku alfa-metyldopy vinpocetínom.
4.6 Fertilita, gravidita a laktáciaPoužívanie vinpocetínu počas gravidity a laktácie je kontraindikované (pozri časť 4.3).
Gravidita: Vinpocetín prechádza placentárnou bariérou; v placente a v plode však dosahuje nižšie koncentrácie ako v krvi matky. Nepozorovali sa žiadne teratogénne účinky. Po vysokých dávkach nastalo v niekoľkých prípadoch placentárne krvácanie a abortus, pravdepodobne ako výsledok zvýšeného prekrvenia placenty.
Laktácia: Vinpocetín sa vylučuje do materského mlieka. Koncentrácia rádioaktívne označeného vinpocetínu je 10 krát vyššia v materskom mlieku ako v krvi matky. Mliekom sa v priebehu 1 hodiny vylúči 0,25 % dávky podanej matke. Pretože sa vylučuje do materského mlieka a spoľahlivé údaje o jeho účinkoch na dojčatá nie sú k dispozícii, dojčiacim matkám sa nesmie liek podávať.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeVinpocetine Covex 5 mg má veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
Vinpocetine Covex 5 mg najmä v kombinácii s alkoholom, ovplyvňuje reakčnú schopnost’. Môže tak znížit’ schopnost’ viest’ vozidlá a obsluhovat’ stroje.
4.8 Nežiaduce účinkyNežiaduce účinky sú rozdelené podľa nasledujúcich početností:
veľmi časté (
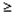
1/10),
časté (
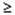
1/100 až < 1/10),
menej časté (
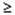
1/1000 až < 1/100),
zriedkavé (
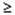
1/10 000 až < 1/1000),
veľmi zriedkavé (< 1/10 000) a neznáme (z dostupných údajov).
Poruchy nervového systému a psychické poruchyMenej časté: poruchy spánku (insomnia, somnolencia), závraty, úzkosť, bolesť hlavy (cefalea), excitovanosť, slabosť – uvedené poruchy môžu byť aj symptómami základnej choroby
Veľmi zriedkavé: parestézie
Poruchy srdca, srdcovej činnosti a poruchy cievMenej časté: pokles krvného tlaku, začervenanie
Zriedkavé: depresia ST intervalu, predĺženie QT intervalu, tachykardia, extrasystoly,
Poruchy gastrointestinálneho traktu Menej časté: nevoľnosť,pyróza, sucho v ústach
Zriedkavé: tráviace ťažkosti (dyspepsia), abdominálna bolesť, nauzea
Poruchy ucha a labyrintuZriedkavé: vertigo
Poruchy kože a podkožného tkanivaVeľmi zriedkavé: pruritus, exantémy
4.9 PredávkovanieNa základe literárnych údajov je bezpečné aj dlhodobé podávanie 60 mg vinpocetínu denne. Žiaden významný nežiaduci účinok nebol popísaný ani po jednorazovom podaní 10 násobku dávky používanej v klinickej praxi (360 mg p.o.).
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: psychostimulans, nootropikum, ATC kód: N06BX18
Farmakodynamické účinkyVinpocetine Covex 5 mg obsahuje v jednej tablete vinpocetinum (vinpocetín) 5 mg.
Vinpocetín je syntetický derivát vinkamínu. Vazodilatačný účinok vinpocetínu aktivuje mozgový metabolizmus a je sprostredkovaný inhibíciou fosfodiesteráz a následným zvýšením hladiny cAMP. V dôsledku zníženia cievneho odporu sa zvyšuje regionálny prietok krvi. Vinpocetín inhibuje agregáciu trombocytov, zlepšuje hemoreologické vlastnosti a mikrocirkuláciu v dôsledku zvýšenia elasticity krvných buniek. Zvyšuje toleranciu mozgových buniek na hypoxiu a/alebo ischémiu. Zvyšuje hladinu kyslíka v mozgu a utilizáciu glukózy mozgovými bunkami. Zlepšuje tvorbu neurotransmiterov, napríklad dopamínu a noradrenalínu, čo prispieva k nootropnému efektu vinpocetínu. Nebola preukázaná príčinná súvislost’ medzi týmito efektami a klinickými účinkami vinpocetínu. '
5.2 Farmakokinetické vlastnostiAbsorpciaVinpocetín sa vel’mi dobre absorbuje z gastrointestinálneho traktu.
DistribúciaBiologická dostupnost’ po orálnom podaní je okolo 57 %. Na plazmatické proteíny sa viaže 95 % vinpocetínu. Maximálna plazmatická koncentrácia sa dosahuje za 1,5 hodiny. Distribučný objem je u mladých dospelých 3 l/kg, u starších 7 l/kg. Optimálna terapeutická koncentrácia je 10-20 ng/ml.
BiotransformáciaVinpocetín sa rýchlo metabolizuje v pečeni, hlavný metabolit (kyselina apovinkamínová), nie je farmakologicky účinný.
ElimináciaVinpocetín a jeho metabolity sa vylučujú močom (40 %) a stolicou (60 %). Nepodlieha enterohepatálnej cirkulácii.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podaní, genotoxicity, karcinogénneho potenciálu, reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
Informácie z predklinických testov nevylučujú bezpečné používanie vinpocetínu u ľudí, okrem podávania počas gravidity a laktácie.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látoklaktóza, hyprolóza, magnéziumstearát, mastenec
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti5 rokov
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote 15 - 25°C, chráňte pred svetlom.
6.5 Druh obalu a obsah balenia Obal: Blister PVC/Al. Každá kartónová škatuľka, obsahuje 1 alebo 2 blistre po 25 tabletách.
Veľkosť balenia: 25, 50 tabliet
Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciua iné zaobchádzanie s liekomLieky sa nesmú likvidovať odpadovou vodou alebo domovým odpadom. Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIICOVEX S.A.
C/ Acero, 25 – Polígono Industrial Sur
28770 Colmenar Viejo
Madrid - Španielsko
tel.: +34 91 845 02 00
fax: +34 91 845 02 08
e-mail:
info@covex.com8. REGISTRAČNÉ ČÍSLO83/0208/00 - S
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 09.06.2000
Dátum posledného predĺženia: 07.02.2007 - bez časového obmedzenia
10. DÁTUM REVÍZIE TEXTUOktóber 2012