
u vrátane vazovagálnych reakcií (synkopa), hyperventilácie alebo reakcií súvisiacich so stresom. Je dôležité vykonať opatrenia na zabránenie poraneniu spôsobenému mdlobou.
Súbežné ochorenie
Očkovanie sa má odložiť u osôb so závažným akútnym ochorením s horúčkou alebo akútnou
infekciou. Prítomnosť miernej infekcie a/alebo nízkej horúčky nemá byť dôvodom na odloženie očkovania.
Trombocytopénia a poruchy koagulácie
Tak ako pri iných intramuskulárnych injekciách, aj očkovacia látka sa má podávať s opatrnosťou
u osôb liečených antikoagulanciami alebo u osôb s trombocytopéniou alebo s akoukoľvek poruchou koagulácie (ako je hemofília), pretože u týchto osôb sa môže po intramuskulárnom podaní vyskytnúť krvácanie alebo tvorba modrín.
Osoby s oslabeným imunitným systémom
Účinnosť, bezpečnosť a imunogenita očkovacej látky sa nehodnotila u osôb s oslabeným imunitným
systémom vrátane osôb užívajúcich imunosupresívnu liečbu. Imunitná odpoveď na VidPrevtyn Beta sa môže byť nižšia u osôb s potlačenou imunitou.
Trvanie ochrany
Trvanie ochrany vyvolanej očkovacou látkou nie je známe, keďže sa stále stanovuje v prebiehajúcich
klinických skúšaniach.
Obmedzenia účinnosti očkovacej látky
Tak ako každá očkovacia látka, ani očkovanie očkovacou látkou VidPrevtyn Beta nemusí poskytnúť
ochranu všetkým zaočkovaným osobám.
Pomocné látky
Sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v dávke, t. j. v podstate zanedbateľné množstvo sodíka.
Draslík
Tento liek obsahuje menej ako 1 mmol draslíka (39 mg) v dávke, t. j. v podstate zanedbateľné množstvo draslíka.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
Súbežné podávanie VidPrevtynu Beta s inými očkovacími látkami sa neskúmalo.
4.6 Fertilita, gravidita a laktácia
Gravidita
Skúsenosti s použitím VidPrevtynu Beta u gravidných žien sú obmedzené. Štúdie na zvieratách
nepreukázali priame alebo nepriame škodlivé účinky z hľadiska gravidity, ebryonálneho/fetálneho vývinu, pôrodu alebo postnatálneho vývinu (pozri časť 5.3).
Podanie VidPrevtynu Beta počas gravidity sa má zvážiť len v prípade, ak možné prínosy prevažujú nad akýmikoľvek možnými rizikami pre matku a plod.
Dojčenie
Nie je známe, či sa VidPrevtyn Beta vylučuje do ľudského mlieka.
Nepredpokladá sa žiadny účinok na dojčeného novorodenca/dojča, pretože systémová expozícia
dojčiacej ženy VidPrevtynu Beta je zanedbateľná.
Fertilita
Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej toxicity (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeVidPrevtyn Beta nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá
a obsluhovať stroje. Niektoré z účinkov uvedených v časti 4.8 však môžu dočasne ovplyvniť
schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinkySúhrn bezpečnostného profiluBezpečnosť VidPrevtynu Beta podávaného ako prvá posilňujúca dávka u osôb predtým očkovaných
primárnymi očkovacími cyklami proti ochoreniu COVID- 19 očkovacími látkami na báze mRNA, vektorovými adenovírusovými očkovacími látkami alebo očkovacími látkami na báze proteínu sa hodnotila v prebiehajúcej fáze 3 klinickej štúdie. Táto štúdia zahŕňala 705 účastníkov vo veku
18 rokov a starších, ktorí dostali očkovaciu látku 4 až 10 mesiacov po primárnom očkovaní. Vzhľadom na veľkosť bezpečnostnej databázy pre VidPrevtyn Beta sa nemuseli zistiť menej časté nežiaduce reakcie (≥ 1/1 000 až < 1/100). Medián trvania následného sledovania bezpečnosti bol
145 dní, pričom 610 (86,5 %) účastníkov ukončilo dlhšie ako 2-mesačné následné sledovanie
bezpečnosti po podaní posilňujúcej dávky.
Najčastejšie nežiaduce reakcie VidPrevtynu Beta boli bolesť v mieste podania injekcie (76,2 %),
bolesť hlavy (41,4 %), myalgia (37,8 %), malátnosť (33,0 %), artralgia (28,7 %) a triaška (19,9 %).
Medián trvania lokálnych a systémových nežiaducich reakcií bol 1 až 3 dni. Väčšina nežiaducich
reakcií sa vyskytla do 3 dní po podaní očkovacej látky a boli mierne až stredne závažné.
Podporné údaje o bezpečnosti sa zhromaždili od 7 093 účastníkov vo veku 18 rokov a starších, ktorí dostali primárnu alebo posilňujúcu dávku očkovacej látky obsahujúcu rovnaký antigén beta (monovalentný (B.1.351)/bivalentný (B.1.351 + D614)) a adjuvans AS03. Vo všeobecnosti je bezpečnostný profil založený na týchto podporných údajoch v súlade s najčastejšími nežiaducimi reakciami zistenými na základe bezpečnostnej databázy VidPrevtynu Beta (N=705). Väčšina z týchto účastníkov bola primárne imunizovaná bivalentnou (B.1.351 + D614) očkovacou látkou.
Tabuľkový zoznam nežiaducich reakciíNežiaduce reakcie pozorované počas klinických štúdií sú uvedené nižšie podľa nasledovných
kategórií frekvencie: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až
< 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
V rámci triedy orgánových systémov sú nežiaduce reakcie uvedené v poradí podľa klesajúcej frekvencie a následne s klesajúcou závažnosťou (tabuľka 1).
Tabuľka 1: Nežiaduce reakcieTrieda orgánových systémov podľa
MedDRA
| Frekvencia
| Nežiaduca reakcia
|
Poruchy krvi a lymfatického systému
| menej časté
| lymfadenopatia
|
Poruchy nervového systému
| veľmi časté
| bolesť hlavy
|
Poruchy gastrointestinálneho traktu
| časté
| nauzea
hnačka
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
| veľmi časté
| myalgia artralgia
|
Celkové poruchy a reakcie v mieste podania
|
veľmi časté
|
malátnosť
zimnica
bolesť v mieste podania injekcie
|
časté
|
horúčka
únava
opuch v mieste podania injekcie
erytém v mieste podania injekcie
|
menej časté
|
svrbenie v mieste podania injekcie
modrina v mieste podania injekcie
pocit tepla v mieste podania injekcie
|
Hlásenie
podozrení
n
a
nežiaduce
reakcie


Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohehttp://www.ema.europa.eu/docs/en_GB/document_library/Template_or_form/2013/03/WC500139752.doc.
4.9 PredávkovanieNeexistuje žiadna špecifická liečba pri predávkovaní VidPrevtynom Beta. V prípade predávkovania
sa má osoba sledovať a podľa potreby sa jej má poskytnúť symptomatická liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Očkovacia látka, iné vírusové očkovacie látky, ATC kód: J07BX03
Mechanizmus účinkuVidPrevtyn Beta je očkovacia látka s adjuvans, ktorá sa skladá z rozpustného trimérického
rekombinantného „spike“ (S) proteínu vírusu SARS-CoV-2 (kmeň B.1.351) stabilizovaného v jeho prefúznej konformácii a získaného odstránením jeho transmembránových a intracelulárnych domén. Kombinácia antigénu a adjuvans zvyšuje rozsah imunitnej odpovede, čo môže prispievať k ochrane proti ochoreniu COVID-19.
ImunogenitaÚčinnosť VidPrevtynu Beta bola odvodená z imunologického premostenia imunitných odpovedí na
schválenú očkovaciu látku proti ochoreniu COVID-19, pre ktorú už bola účinnosť očkovacej látky
stanovená.
Klinická imunogenita VidPrevtynu Beta podávaného ako prvá posilňujúca dávka vo forme injekcie sa hodnotila v dvoch klinických štúdiách: VAT00013 (Štúdia 1) s účastníkmi očkovanými mRNA očkovacou látkou proti ochoreniu COVID-19 a kohortovej štúdii 2 VAT00002, skupina s beta (Štúdia 2), ktorá zahŕňala účastníkov imunizovaných rôznymi typmi očkovacích látok proti ochoreniu COVID-19.
Výsledky imunogenity zo Štúdie 1
Štúdia 1 je randomizovaná, jednoducho zaslepená multicentrická klinická štúdia iniciovaná skúšajúcim, ktorá hodnotila imunitnú odpoveď vyvolanú posilňujúcou dávkou buď VidPrevtynom Beta alebo mRNA očkovacou látkou proti ochoreniu COVID -19 (modifikovaný nukleozid/tozinameran) u jedincov predtým očkovaných 2 dávkami mRNA očkovacej látky proti ochoreniu COVID-19 (tozinameran). Analýza populácie podľa protokolu zahŕňala
143 účastníkov vo veku 18 rokov a starších, ktorí boli zaočkovaní 2 dávkami mRNA očkovacej látky proti ochoreniu COVID-19 (tozinameran) 3 až 7 mesiacov pred podaním VidPrevtynu Beta (N=67), mRNA očkovacej látky proti ochoreniu COVID-19 (tozinameran) (N=76). Priemerný vek bol medzi skupinami porovnateľný, pri VidPrevtyne Beta bol vek 41,4 rokov a pri mRNA očkovacej látke proti ochoreniu COVID-19 (tozinameran) bol 40,4 rokov. Vekový rozsah bol
20,0 až 69,0 rokov. Priemerná dĺžka medzi druhou dávkou primárneho očkovacieho cyklu
a posilňujúcou dávkou bola medzi skupinami porovnateľná, pri VidPrevtyne Beta bola 171,0 dní a pri mRNA očkovacej látke proti ochoreniu COVID-19 bola 174,5 dní.
Z tejto populácie podľa protokolu boli od 114 účastníkov (54 po podaní VidPrevtynu Beta a 60 po podaní mRNA očkovacej látky proti ochoreniu COVID-19 (tozinameran)) odobraté vzorky pred očkovaním a 28 dní po podaní posilňujúcej dávky a boli testované pomocou pseudovírusového neutralizačného testu. U účastníkov zaočkovaných mRNA očkovacou látkou proti ochoreniu COVID-19 sa porovnali geometrické priemery titrov (
Geometric Mean Titers, GMT) neutralizačných protilátok 28 dní po podaní posilňujúcej dávky očkovacej látky VidPrevtynu Beta alebo mRNA očkovacej látky proti ochoreniu COVID -19 (tozinameran).
Superiorita GMT proti Omicron BA.1 sa preukázala v skupine s VidPrevtynom Beta v porovnaní so skupinou s mRNA očkovacou látkou proti ochoreniu COVID-19 (tozinameran), pozri tabuľku 2.
Tabuľka 2: Pomer GMT po posilňujúcej dávke VidPrevtynu Beta oproti mRNA očkovacej látke proti ochoreniu COVID-19 (tozinameran) s individuálnymi neutralizačnými titrami proti kmeňu Omicron BA.1 – 28 dní po posilňujúcej dávke – analýza podskupiny podľa protokoluVidPrevtyn Beta
(N=54)
| mRNA očkovacia látka proti
ochoreniu COVID-19 (tozinameran)
(N=60)
|
VidPrevtyn Beta/ mRNA očkovacia látka proti ochoreniu COVID-19 (tozinameran)
|
M
| GMT
| (95 % IS)
| M
| GMT
| (95 % IS)
| Pomer
GMT
|
(95 % CI)
| Potvrdená superiorita†
|
54
| 1 327,5
| (1 005,0; 1 753,4)
| 58
| 524,0
| (423,3; 648,6)
| 2,53
| (1,80; 3,57)
| áno
|
M: počet účastníkov s dostupnými údajmi pre príslušný koncový ukazovateľ;
N: počet účastníkov v analýze podskupiny podľa protokolu 28 dní po posilňujúcej dávke;
† Superiorita sa považuje za preukázanú, ak je spodná hranica 2-stranného 95 % intervalu spoľahlivosti (IS) pomeru GMT
> 1,2.
Po podaní VidPrevtynu Beta v porovnaní s mRNA očkovacou látkou proti ochoreniu COVID-19 (tozinameran) sa preukázala non-inferiorita miery sérologickej odpovede proti kmeňom Omicron BA.1 a D614G (pozri tabuľku 3). Miera sérologickej odpovede bola definovaná ako 4-násobné alebo väčšie zvýšenie sérového neutralizačného titra 28 dní po posilňujúcej dávke v porovnaní so stavom pred podaním posilňujúcej dávky.
Tabuľka 3: Miera sérologickej odpovede (seroresponse rate, SR) po očkovacej látke VidPrevtyn Beta oproti mRNA očkovacej látke proti ochoreniu COVID-19 (tozinameran) s individuálnym neutralizačným titrom proti kmeňu Omicron BA.1 a D614G – 28 dní po posilňujúcej dávke – analýza podskupiny podľa protokolu
|
VidPrevtyn Beta
(N=54)
|
mRNA očkovacia
látka proti ochoreniu COVID-19 (tozinameran) (N=60)
|
VidPrevtyn Beta/ mRNA očkovacia látka proti ochoreniu COVID-19 (tozinameran)
|
n/M
|
SR (%)
|
(95 % IS)
|
n/M
|
SR (%)
|
(95 % IS)
|
Rozdiel
(%)
|
(95 % IS)
|
Potvrdená non-
inferiorita†
|
D614G
|
51/53
|
96,2
|
(87,0; 99,5)
|
55/59
|
93,2
|
(83,5; 98,1)
|
3,0
|
(-6,9;12,8)
|
áno
|
Omicron BA.1
|
50/50
|
100,0
|
(92,9; 100,0)
|
51/53
|
96,2
|
(87,0; 99,5)
|
3,8
|
(-3,9;12,8)
|
áno
|
M: počet účastníkov s dostupnými údajmi pre príslušný koncový ukazovateľ;
N: počet účastníkov v analýze podskupiny podľa protokolu 28 dní po posilňujúcej dávke;
n: Počet účastníkov, ktorí dosiahnu sérologickú odpoveď;
† Non-inferiorita sa považuje za preukázanú, ak je spodná hranica 2-stranného 95 % intervalu spoľahlivosti (IS) rozdielu v miere sérologických odpovedí medzi skupinami > -10 %.
Hladiny titrov neutralizačných protilátok oproti kmeňu D614G 28 dní po posilňujúcej dávke pozorované v skupine s VidPrevtynom Beta boli vyššie ako v skupine s mRNA očkovacou látkou proti ochoreniu COVID-19 (tozinameran), s pomerom GMT 1,43 (95 %IS 1,06; 1,94), pozri tabuľku 4.
Tabuľka 4: Geometrické priemery titrov (GMT) neutralizačných protilátok oproti kmeňuD614G 28 dní po posilňujúcej dávke – analýza podskupiny podľa protokoluVidPrevtyn Beta
| mRNA očkovacia látka proti
ochoreniu COVID-19 (tozinameran)
| VidPrevtyn Beta/
mRNA očkovacia látka proti ochoreniu COVID-19 (tozinameran)
|
N
| GMT
| (95 % IS)
| N
| GMT
| (95 % IS)
| Pomer GMT
| (95 % IS)
|
54
| 6 459
| (5 103; 8 174)
| 60
| 4 507
| (3 695; 5 498)
| 1,43
| (1,06; 1,94)
|
N: počet účastníkov v analýze podskupiny podľa protokolu 28 dní po posilňujúcej dávke;
IS: Interval spoľahlivosti
Výsledky imunogenity zo Štúdie 2VidPrevtyn Beta podávaný ako posilňujúca dávka sa hodnotil v prebiehajúcej multicentrickej klinickej štúdii fázy 3 s účastníkmi vo veku 18 rokov a starších. Analýza populácie podľa protokolu zahŕňala 543 účastníkov, ktorí dostali VidPrevtyn Beta 4 až 10 mesiacov po primárnom očkovacom cykle s 2 dávkami mRNA očkovacej látky proti ochoreniu COVID-19 (tozinameran) (n=325) alebo mRNA očkovacej látky proti ochoreniu COVID-19 (modifikovaný
nukleozid/elazomeran) (n=93), očkovacej látky proti ochoreniu COVID-19 (ChAdOx1-S
[rekombinantná]) (n=94) alebo s 1 dávkou očkovacej látky proti ochoreniu COVID-19 (Ad26.COV2-S [rekombinantná]) (n=31).
V analýze populácie podľa protokolu očkovanej mRNA očkovacou látkou, ktorá dostávala
posilňujúcu dávku VidPrevtynu Beta, bol priemerný vek účastníkov 41,2 rokov (rozsah 18-
83 rokov); 347 (83,0 %) bolo vo veku 18 až 55 rokov, 71 (17,0 %) bolo vo veku 56 rokov
a vyššom, 25 (6,0 %) bolo vo veku 65 rokov a vyššom. Medzi nimi bolo 44,0 % mužov, 56,0 % žien, 67,7 % belochov, 13,2 % černochov alebo afroameričanov, 2,6 % Ázijcov a 1,0 % amerických indiánov alebo domorodých obyvateľov Aljašky.
V analýze populácie podľa protokolu očkovanej vektorovou adenovírusovou očkovacou látkou, ktorá dostávala posilňujúcu dávku VidPrevtynu Beta, bol priemerný vek účastníkov 50,4 rokov (rozsah 24-77 rokov); 84 (67,2 %) bolo vo veku 18 až 55 rokov, 41 (32,8 %) bolo vo veku
56 rokov a vyššom, 17 (13,6 %) bolo vo veku 65 rokov a vyššom. Medzi nimi bolo 52,8 % mužov, 47,2 % žien, 78,4 % belochov, 13,6 % černochov alebo afroameričanov, 4,0 % Ázijcov a 2,4 % amerických indiánov alebo domorodých obyvateľov Aljašky.
Imunogenita sa hodnotila meraním titrov neutralizačných protilátok (ID50) proti pseudovírusu exprimujúcemu spike proteín vírusu SARS-CoV-2 izolátu z USA_WA1/2020 s mutáciou D614G a variantu B.1.351 pomocou pseudovírusového neutralizačného testu pre vírus SARS-CoV-2.
Odpoveď na posilňujúcu dávku VidPrevtynu Beta proti kmeňu B.1.351 sa potvrdila bez ohľadu na očkovaciu látku použitú na primárny očkovací cyklus s pomerom geometrických priemerných titrov (GMTR, násobné zvýšenie) 14 dní po podaní posilňujúcej dávky v porovnaní so stavom pred posilňujúcou dávkou v rozsahu od 38,5 do 72,3 a pre kmeň D614G od 14,5 do 28,6, pozri tabuľku 5.
 Tabuľka 5: Geometrické priemerné titre neutralizačnej protilátky (ID50) 14 dní po posilňujúcej dávke a pomer geometrických priemerných titrov (14 dní po posilňujúcej dávke v porovnaní so stavom pred podaním posilňujúcej dávky) proti pseudovírusu exprimujúcemu spike proteín vírusu SARS-CoV-2 u účastníkov vo veku 18 rokov a starších - analýza súboru podľa protokolu
Tabuľka 5: Geometrické priemerné titre neutralizačnej protilátky (ID50) 14 dní po posilňujúcej dávke a pomer geometrických priemerných titrov (14 dní po posilňujúcej dávke v porovnaní so stavom pred podaním posilňujúcej dávky) proti pseudovírusu exprimujúcemu spike proteín vírusu SARS-CoV-2 u účastníkov vo veku 18 rokov a starších - analýza súboru podľa protokolu
|
po očkovaní mRNA očkovacou látkou
1
(N=418)
|
po očkovaní očkovacou látkou Ad-vektorom
2
(N=125)
|
GMT pred podaním posilňujúcej dávky
|
|
|
M
|
GMT
|
(95 % IS)
|
M
|
GMT
|
(95 % IS)
|
D614G
|
407
|
751
|
(633; 892)
|
118
|
228
|
(159; 325)
|
Beta
|
383
|
191
|
(158; 231)
|
117
|
69,9
|
(50,3; 97,2)
|
14 dní po podaní posilňujúcej dávky
|
|
|
M
|
GMT
|
(95 % IS)
|
M
|
GMT
|
(95 % IS)
|
D614G
|
418
|
10 814
|
(9 793; 11 941)
|
125
|
6 565
|
(5 397;7 986)
|
Beta
|
418
|
7 501
|
(6 754; 8 330)
|
124
|
5 077
|
(4 168; 6 185)
|
Pomer GMT - 14 dní po podaní posilňujúcej dávky v porovnaní so stavom pred podaním posilňujúcej dávky
|
|
|
M
|
GTMR
|
(95 % IS)
|
M
|
GMTR
|
(95 % IS)
|
D614G
|
407
|
14,5
|
(12,2;17,2)
|
118
|
28,6
|
(21,1;38,9)
|
Beta
|
383
|
38,5
|
(31,8; 46,6)
|
116
|
72,3
|
(52,4; 99,8)
|
|
|
|
|
|
|
|
|
|
|
|
M: počet účastníkov s dostupnými údajmi pre príslušný koncový ukazovateľ; N: počet účastníkov v analýze súboru podľa protokolu'
IS: Interval spoľahlivosti
ID50- zriedenie séra poskytujúce 50 % inhibíciu pseudovírusovej infekcie
GMTR (pomer geometrických priemerov titrov): pomery geometrických priemerov jednotlivých titrov (po očkovaní/pred očkovaním)
1-2 – Podané očkovacie látky: 1 – mRNA očkovacia látka proti ochoreniu COVID-19 (tozinameran) a mRNA očkovacia
látka proti ochoreniu COVID-19 (elazomeran); 2 – očkovacia látka proti ochoreniu COVID-19 (ChAdOx1-S
[rekombinantná]) a očkovacia látka proti ochoreniu COVID-19 (Ad26.COV2-S [rekombinantná])
Pediatrická populáciaEurópska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s VidPrevtynom
Beta v jednej alebo vo viacerých podskupinách pediatrickej populácie v prevencii ochorenia
COVID-19 (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiNetýka sa.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe obvyklých štúdií toxicity po opakovanom podávaní a reprodukčnej a vývinovej toxicity neodhalili žiadne osobitné riziko pre ľudí.
Genotoxicita a karcinogenitaNa základe testov
in vitro a
in vivo sa pre adjuvans nepozorovala žiadna genotoxicita. Genotoxicita
antigénu sa nehodnotila, pretože sa neočakáva, že jeho biologická povaha bude mať genotoxický potenciál. Štúdie karcinogenity neboli vykonané.
Reprodukčná toxicita a fertilitaV štúdii vývinovej toxicity a reprodukčnej toxicity sa samiciam králika podalo 0,5 ml očkovacej
látky obsahujúcej až 15 mikrogramov (tri dávky pre ľudí) rekombinantného proteínu s adjuvans AS03 vo forme intramuskulárnej injekcie v piatich podaniach: 24 a 10 dní pred párením a v 6., 12. a 27. gestačnom dni. Až do 35. dňa po narodení mláďat sa nepozorovali žiadne účinky na fertilitu samíc, embryonálny/fetálny vývin alebo postnatálny vývin súvisiace s očkovacou látkou. V tejto
štúdii bola zistená vysoká miera odpovede S-špecifického anti-SARS-CoV-2 IgG u samíc ako aj plodov a mláďat, čo naznačuje placentárny prestup protilátok vytvorených matkou. O vylučovaní očkovacej látky do mlieka nie sú k dispozícii žiadne údaje.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Injekčná liekovka s antigénom
Monohydrát dihydrogenfosforečnanu sodného
Dodekahydrát hydrogenfosforečnanu sodného
Chlorid sodný
Polysorbát 20
Voda na injekcie
Injekčná liekovka s adjuvans
Chlorid sodný
Hydrogenfosforečnan sodný Dihydrogenfosforečnan draselný Chlorid draselný
Voda na injekcie
Adjuvans, pozri časť 2.
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi alebo riediť.
6.3 Čas použiteľnosti
1 rok.
Po zmiešaní sa má liek použiť do 6 hodín, ak sa uchováva pri teplote 2°C – 8°C a je chránený pred svetlom.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2°C – 8°C). Neuchovávajte v mrazničke.
Injekčné liekovky uchovávajte vo vonkajšej škatuľke na ochranu pred svetlom. Podmienky na uchovávanie po zmiešaní lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
VidPrevtyn Beta je dostupný ako:
2,5 ml roztok obsahujúci antigén vo viacdávkovej injekčnej liekovke (sklo typu 1) so zátkou
(chlórbutylovou) a hliníkovým uzáverom so zeleným plastovým odklápacím viečkom;
2,5 ml emulzia obsahujúca adjuvans vo viacdávkovej injekčnej liekovke (sklo typu 1)
so zátkou (chlórbutylovou) a hliníkovým uzáverom so žltým plastovým odklápacím viečkom.
Každé balenie obsahuje 10 viacdávkových injekčných liekoviek obsahujúcich antigén
a 10 viacdávkových injekčných liekoviek obsahujúcich adjuvans.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pokyny na zaobchádzanie
Pri zaobchádzaní s touto očkovacou látkou má zdravotnícky pracovník používať aseptickú techniku
na zabezpečenie sterility každej dávky.
Pokyny na zmiešanie
VidPrevtyn Beta sa dodáva ako 2 samostatné injekčné liekovky: injekčná liekovka obsahujúca
antigén a injekčná liekovka obsahujúca adjuvans.
Pred podaním sa musia obe zložky zmiešať podľa krokov uvedených nižšie.
1. krok: Pred zmiešaním nechajte stáť injekčné liekovky pri izbovej teplote (až do 25°C) počas
minimálne 15 minút chránené pred svetlom.
2. krok: Každú injekčnú liekovku prevráťte (bez pretrepávania) a vizuálne skontrolujte či neobsahuje akékoľvek častice alebo či nedošlo k zmene zafarbenia. Ak je prítomný ktorýkoľvek z týchto javov, očkovaciu látku nepodávajte.
3. krok: Po odstránení odklápacích viečok očistite zátky na oboch injekčných liekovkách pomocou antiseptického tampónu.
4
. krok
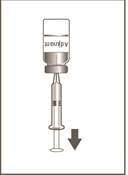
Injekčná liekovka 2 z 2
|
Sterilnou injekčnou ihlou s veľkosťou 21 G alebo tenšou a sterilnou injekčnou striekačkou odoberte celý objem z injekčnej liekovky
obsahujúcej adjuvans (žlté odklápacie viečko)
do injekčnej striekačky. Injekčnú liekovku obsahujúcu adjuvans prevráťte, aby ste uľahčili odobratie celého objemu.
|
5
. krok
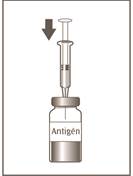
Injekčná liekovka 1 z 2
|
Celý objem v injekčnej striekačke preneste do injekčnej liekovky obsahujúcej antigén (zelené odklápacie viečko).
|
6
. krok

Injekčná liekovka 1 z 2
|
Z injekčnej liekovky obsahujúcej antigén vytiahnite injekčnú striekačku s injekčnou ihlou. Injekčnú liekovku 5-krát prevráťte, aby ste premiešali jej obsah. Nepretrepávajte. Zmiešaná očkovacia látka je belavá až žltkastá homogénna mliečna tekutá emulzia.
|
7
. krok: Na označení injekčnej liekovky zaznamenajte dátum a čas likvidácie (6 hodín po zmiešaní)
v mieste na to určenom.
Objem očkovacej látky po zmiešaní je minimálne 5 ml. Obsahuje 10 dávok po 0,5 ml.
V každej injekčnej liekovke je určitý objem navyše, aby sa zabezpečilo, že je možné odobrať
10 dávok po 0,5 ml.
Očkovaciu látku podajte okamžite po zmiešaní alebo ju uchovávajte pri teplote 2°C až 8°C
chránenú pred svetlom a použite ju do 6 hodín (pozri časť 6.3). Po uplynutí tohto času očkovaciu látku zlikvidujte.
Príprava jednotlivých dávok
Pred každým podaním injekčnú liekovku 5-krát prevráťte, aby ste ju dôkladne premiešali.
Nepretrepávajte. Vizuálne skontrolujte či neobsahuje akékoľvek častice alebo či nedošlo k zmene zafarbenia (vzhľad očkovacej látky, pozri 6. krok). Ak je prítomný ktorýkoľvek z týchto stavov, očkovaciu látku nepodávajte.
Pomocou vhodnej injekčnej striekačky a injekčnej ihly odoberte 0,5 ml z injekčnej liekovky obsahujúcej zmiešanú očkovaciu látku a podajte ju intramuskulárne (pozri časť 4.2).
LikvidáciaVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIISanofi Pasteur
14 Espace Henry Vallée
69007 Lyon
Francúzsko
8. REGISTRAČNÉ ČÍSLOEU/1/21/1580/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu------------------------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
SledovateľnosťAby sa zlepšila (do)sledovateľnosť biologického lieku, má sa zrozumiteľne zaznamenať názov
a číslo šarže podaného lieku.
DávkovanieVidPrevtyn Beta sa podáva intramuskulárne ako jednorazová dávka 0,5 ml minimálne 4 mesiace po
predchádzajúcom podaní očkovacej látky proti ochoreniu COVID-19. VidPrevtyn Beta sa môže podať jednorazovo ako posilňujúca dávka dospelým, ktorí dostali predchádzajúci očkovací cyklus buď s mRNA alebo vektorovými adenovírusovými očkovacími látkami proti ochoreniu COVID-19.
Uchovávanie pred zmiešanímUchovávajte v chladničke (2°C – 8°C). Neuchovávajte v mrazničke.
Injekčné liekovky uchovávajte vo vonkajšej škatuľke na ochranu pred svetlom.
Nepoužívajte túto očkovaciu látku po dátume exspirácie, ktorý je uvedený na označení obalu
a škatuľke po EXP. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Pokyny na zaobchádzaniePri zaobchádzaní s touto očkovacou látkou má zdravotnícky pracovník používať aseptickú techniku
na zabezpečenie sterility každej dávky.
VidPrevtyn Beta sa dodáva ako 2 samostatné injekčné liekovky: injekčná liekovka obsahujúca
antigén a injekčná liekovka obsahujúca adjuvans.
Pred podaním sa musia obe zložky zmiešať podľa krokov uvedených nižšie.
1. krok: Pred zmiešaním nechajte stáť injekčné liekovky pri izbovej teplote (až do 25°C) počas
minimálne 15 minút
chránené pred svetlom.
2. krok: Každú injekčnú liekovku prevráťte (bez pretrepávania) a vizuálne skontrolujte či neobsahuje akékoľvek častice alebo či nedošlo k zmene zafarbenia. Ak je prítomný ktorýkoľvek z týchto javov, očkovaciu látku nepodávajte.
3. krok: Po odstránení odklápacích viečok očistite zátky na oboch injekčných liekovkách pomocou antiseptického tampónu.
4
. krok
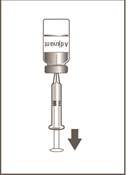
Injekčná liekovka 2 z 2
|
Sterilnou injekčnou ihlou s veľkosťou 21 G alebo tenšou a sterilnou injekčnou striekačkou odoberte celý objem z injekčnej liekovky
obsahujúcej adjuvans (žlté odklápacie viečko)
do injekčnej striekačky. Injekčnú liekovku obsahujúcu adjuvans prevráťte, aby ste uľahčili odobratie celého objemu.
|
5
. krok
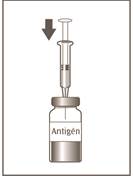
Injekčná liekovka 1 z 2
|
Celý objem v injekčnej striekačke preneste do injekčnej liekovky obsahujúcej antigén (zelené odklápacie viečko).
|
6
. krok
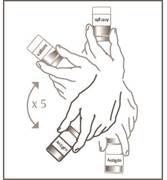
Injekčná liekovka 1 z 2
|
Z injekčnej liekovky obsahujúcej antigén vytiahnite injekčnú striekačku s injekčnou ihlou. Injekčnú liekovku 5-krát prevráťte, aby ste premiešali jej obsah. Nepretrepávajte. Zmiešaná očkovacia látka je belavá až žltkastá homogénna mliečna tekutá emulzia.
|
7
. krok: Na označení injekčnej liekovky zaznamenajte dátum a čas likvidácie (6 hodín po zmiešaní)
v mieste na to určenom.
Objem očkovacej látky po zmiešaní je minimálne 5 ml. Obsahuje 10 dávok po 0,5 ml.
V každej injekčnej liekovke je určitý objem navyše, aby sa zabezpečilo, že je možné odobrať
10 dávok po 0,5 ml.
Očkovaciu látku podajte okamžite po zmiešaní alebo ju uchovávajte pri teplote 2°C až 8°C
chránenú pred svetlom a použite ju do 6 hodín (pozri časť 6.3). Po uplynutí tohto času očkovaciu látku zlikvidujte.
Príprava jednotlivých dávok
Pred každým podaním injekčnú liekovku 5-krát prevráťte, aby ste ju dôkladne premiešali.
Nepretrepávajte. Vizuálne skontrolujte či neobsahuje akékoľvek častice alebo či nedošlo k zmene zafarbenia (vzhľad očkovacej látky, pozri 6. krok). Ak je prítomný ktorýkoľvek z týchto stavov, očkovaciu látku nepodávajte.
Pomocou vhodnej injekčnej striekačky a injekčnej ihly odoberte 0,5 ml z injekčnej liekovky obsahujúcej zmiešanú očkovaciu látku a podajte ju intramuskulárne.
Likvidácia
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami. Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Tieto opatrenia
pomôžu chrániť životné prostredie.