
t; 75,0 x 10
9/l) pred prvou liečbouAk je pokles počtu leukocytov, ANC alebo počtu trombocytov po liečbe Vidazou v porovnaní s hodnotou pred liečbou menší ako 50% alebo vyšší ako 50%, ale so súčasným zlepšením diferenciácie ktorejkoľvek bunkovej línie, nemá sa ďalší cyklus oneskoriť a dávka sa nemusí upraviť.
Ak je pokles počtu leukocytov, ANC alebo počtu trombocytov vyšší o viac ako 50% v porovnaní
s hodnotou pred liečbou a nedôjde k zlepšeniu diferenciácie bunkových línií, má sa ďalší cyklus liečby
Vidazou odložiť dovtedy, kým sa neobnoví počet trombocytov a ANC. Ak sa obnovenie dosiahne do
14 dní, nevyžaduje sa žiadna úprava dávky. Ak sa však obnovenie nedosiahne do 14 dní, má sa stanoviť celularita kostnej drene. Ak je hodnota celularity kostnej drene > 50%, dávka sa nemusí upraviť. Ak je hodnota celularity kostnej drene ≤ 50%, má sa liečba odložiť a dávka znížiť podľa nasledujúcej tabuľky:
Celularita kostnej drene
| % dávky v nasledujúcom cykle, ak sa obnovenie nedosiahne do 14 dní
|
| Obnovenie* ≤ 21 dní
| Obnovenie* > 21 dní
|
15 – 50%
| 100%
| 50%
|
< 15%
| 100%
| 33%
|
*Obnovenie = počty ≥ počet nadir + (0,5 x [začiatočný počet – počet nadir])
Po úprave dávky sa má trvanie cyklu vrátiť späť na 28 dní.
Osobitné populáciePoškodenie obličiek: U pacientov so zníženou činnosťou obličiek neboli vykonané žiadne oficiálne štúdie. Pacienti so závažným poškodením obličiek sa majú pozorne sledovať na výskyt nežiaducich účinkov. U pacientov s poškodením obličiek (napr. začiatočné hodnoty sérového kreatinínu alebo dusíka močoviny v krvi [
blood urea nitrogen, BUN] sú ≥ 2-násobne vyššie, než je horný limit normálnej hodnoty [
upper limit of normal, ULN], alebo hodnoty sérového bikarbonátu nižšie ako
20 mmol/l) sa pred začatím liečby neodporúča žiadna špecifická úprava úvodnej dávky; následné úpravy dávky majú vychádzať z hematologických a renálnych laboratórnych hodnôt. Ak sa vyskytnú nevysvetliteľné zníženia hodnôt sérového bikarbonátu na menej ako 20 mmol/l, dávka sa má
v nasledujúcom cykle znížiť o 50%. Ak sa vyskytnú nevysvetliteľné zvýšenia hodnôt sérového kreatinínu alebo BUN na úroveň ≥ 2-násobne vyššiu, ako sú začiatočné hodnoty, a nad hodnotu ULN, ďalší cyklus sa má odložiť dovtedy, kým sa hodnoty nevrátia na normálnu alebo začiatočnú úroveň a v nasledujúcom liečebnom cykle sa má znížiť dávka o 50% (pozri časť 4.4).
Poškodenie pečene: U pacientov s poškodením pečene neboli vykonané žiadne oficiálne štúdie (pozri časť 4.4). Pacienti so závažným poškodením pečene sa majú pozorne sledovať na výskyt nežiaducich účinkov. U pacientov s poškodením pečene sa pred začatím liečby neodporúča žiadna špecifická úprava úvodnej dávky a následné úpravy dávky majú vychádzať z hematologických laboratórnych hodnôt. Vidaza je kontraindikovaná u pacientov s malígnymi pečeňovými nádormi v pokročilom štádiu (pozri časti 4.3 a 4.4).
Starší pacienti: U starších pacientov sa neodporúčajú žiadne špecifické úpravy dávky. Keďže
u starších pacientov je vyššia pravdepodobnosť zníženia činnosti obličiek, môže byť užitočné sledovať
ich funkciu.
Deti a dospievajúci: Vidazu sa neodporúča používať u detí mladších ako 18 rokov kvôli nedostatočným údajom o bezpečnosti a účinnosti.
Laboratórne testy
Pred začatím liečby a pred každým liečebným cyklom je potrebné zistiť hodnoty pečeňových testov
a hodnotu sérového kreatinínu. Pred začatím liečby a v prípade potreby (minimálne však pred každým liečebným cyklom) sa majú zistiť kompletné počty krvných buniek s cieľom sledovania odozvy
a toxicity.
Spôsob podávania
Rekonštituovaná Vidaza sa má podávať subkutánnou injekciou do ramena, stehna alebo brucha. Miesta injekčnej aplikácie sa majú meniť. Nové injekcie sa majú aplikovať najmenej 2,5 cm od predchádzajúceho miesta vpichu a nikdy nie do oblastí, v ktorých je miesto vpichu bolestivé,
s podliatinami, začervenané alebo stvrdnuté.
Podrobné pokyny na rekonštitúciu a postup pri podávaní Vidazy sú uvedené v časti 6.6.
4.3 Kontraindikácie
Známa precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok. Malígne pečeňové nádory v pokročilom štádiu (pozri časť 4.4).
Laktácia (pozri časť 4.6).
4.4 Osobitné upozornenia a opatrenia pri používaní
Hematologická toxicita
Liečba azacitidínom je spojená s anémiou, neutropéniou a trombocytopéniou, najmä počas prvých
2 cyklov (pozri časť 4.8). V prípade potreby (avšak aspoň pred každým liečebným cyklom) sa majú zistiť kompletné počty krvných buniek s cieľom sledovania odozvy a toxicity. Po podaní odporúčanej dávky v prvom cykle sa má dávka na základe počtov nadir a hematologickej odozvy pre následné cykly znížiť alebo jej podanie odložiť na neskôr (pozri časť 4.2). Pacienti majú byť poučení, aby ihneď hlásili akékoľvek horúčkovité prípady. Pacienti a lekári majú taktiež sledovať znaky a príznaky krvácania.
Poškodenie pečene
U pacientov s poškodením pečene neboli vykonané žiadne oficiálne štúdie. U pacientov s rozsiahlou nádorovou záťažou z dôvodu metastatického ochorenia bola zriedkavo pozorovaná progresívna pečeňová kóma a smrť počas liečby azacitidínom, a to najmä u pacientov so začiatočnými hodnotami sérového albumínu < 30 g/l. Azacitidín je kontraindikovaný u pacientov s malígnymi pečeňovými nádormi v pokročilom štádiu (pozri časť 4.3).
Poškodenie obličiek
Obličkové abnormality siahajúce od zvýšených hodnôt sérového kreatinínu po zlyhanie obličiek
a smrť boli zriedkavo pozorované u pacientov intravenózne liečených azacitidínom v kombinácii
s inými chemoterapeutikami. Okrem toho sa u 5 pacientov s chronickou myeloidnou leukémiou (CML), ktorí boli liečení azacitidínom a etopozidom, vyvinula renálna tubulárna acidóza, definovaná ako pokles hladiny sérového bikarbonátu na < 20 mmol/l spojený s alkalickým močom
a hypokaliémiou (sérový draslík < 3 mmol/l). Ak sa vyskytnú nevysvetliteľné zníženia hodnoty sérového bikarbonátu (< 20 mmol/l) alebo zvýšenia sérového kreatinínu alebo BUN, dávka sa má znížiť alebo jej podanie odložiť na neskôr (pozri časť 4.2).
Pacienti s poškodením obličiek sa majú dôkladne sledovať na toxicitu, pretože azacitidín a/alebo jeho metabolity sa primárne vylučujú obličkami (pozri časť 4.2).
Ochorenie srdca a pľúc
Pacienti s anamnézou závažného kongestívneho zlyhávania srdca, klinicky nestabilného ochorenia srdca alebo pľúc boli vylúčení z pivotnej klinickej štúdie, a preto nebola u týchto pacientov stanovená bezpečnosť a účinnosť Vidazy.
4.5 Liekové a iné interakcie
Na základe údajov in vitro sa metabolizmus azacitidínu nezdá byť sprostredkovaný izoenzýmami cytochrómu P450 (CYP), UDP-glukuronosyltransferázami (UGT), sulfotransferázami (SULT) ani glutationtransferázami (GST). Interakcie súvisiace s týmito metabolickými enzýmami in vivo sú preto považované za nepravdepodobné.
Klinicky významné inhibičné alebo indukčné účinky azacitidínu na enzýmy cytochrómu P450 sú nepravdepodobné (pozri časť 5.2).
Neuskutočnili sa žiadne formálne klinické štúdie liekových interakcií s azacitidínom.
4.6 Gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné údaje o použití azacitidínu u gravidných žien. Štúdie u myší preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko u ľudí. Na základe výsledkov zo štúdií na zvieratách a mechanizmu jeho účinku sa azacitidín nemá používať počas gravidity, najmä počas prvého trimestra, pokiaľ jeho použitie nie je jednoznačne nevyhnutné. Výhody liečby sa majú
v jednotlivom prípade zvážiť vzhľadom na možné riziko pre plod.
Muži a plodné ženy musia počas liečby a do 3 mesiacov po jej ukončení používať účinnú antikoncepciu.
Laktácia
Nie je známe, či sa azacitidín alebo jeho metabolity vylučujú do materského mlieka. Z dôvodu potenciálne závažných nežiaducich účinkov na dojčené dieťa je laktácia počas liečby azacitidínom kontraindikovaná.
Plodnosť
Nie sú k dispozícii žiadne údaje o vplyve azacitidínu na plodnosť u ľudí. U zvierat boli dokumentované nežiaduce účinky azacitidínu na plodnosť samcov (pozri časť 5.3). Mužom sa má odporučiť, aby sa vyvarovali splodeniu dieťaťa počas liečby, pričom musia v priebehu liečby a do
3 mesiacov po jej ukončení používať účinnú antikoncepciu. Pred začatím liečby sa má mužom odporučiť, aby navštívili príslušnú poradňu ohľadne uchovania spermií.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti majú byť informovaní o tom, že sa u nich počas liečby môžu vyskytnúť nežiaduce účinky ako napríklad únava. Preto sa pri vedení vozidiel a obsluhovaní strojov odporúča opatrnosť.
4.8 Nežiaduce účinky
Nežiaduce účinky považované za možno alebo pravdepodobne súvisiace s podávaním Vidazy sa vyskytli u 97% pacientov.
Najčastejšie uvádzané nežiaduce účinky počas liečby azacitidínom boli hematologické reakcie (71,4%) vrátane trombocytopénie, neutropénie a leukopénie (zvyčajne stupňa 3-4), gastrointestinálne reakcie (60,6%) vrátane nevoľnosti, vracania (zvyčajne stupňa 1-2) alebo reakcií v mieste vpichu (77,1%, zvyčajne stupňa 1-2).
Najčastejšie závažné nežiaduce účinky (> 2%) pozorované v rámci pivotnej štúdie
(AZA PH GL 2003 CL 001), ktoré boli tiež pozorované v podporných štúdiách (CALGB 9221 a CALGB 8921) zahŕňali febrilnú neutropéniu (8,0%) a anémiu (2,3%). Ďalšie menej často hlásené závažné nežiaduce reakcie (< 2%) zahŕňali neutropenickú sepsu, zápal pľúc, trombocytopéniu
a prípady krvácania (napr. mozgové krvácanie).
Nižšie uvedená tabuľka obsahuje nežiaduce účinky, pre ktoré bolo možné určiť príčinnú súvislosť s liečbou azacitidínom. Udávané frekvencie vychádzajú zo zistení počas pivotnej klinickej štúdie alebo dvoch podporných štúdií.
Frekvencie výskytu sú definované nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda orgánových systémov
| Veľmi časté
| Časté
| Menej časté
|
Infekcie
a nákazy
| zápal pľúc, nazofaryngitída
| neutropenická sepsa, infekcia horných dýchacích ciest, infekcia močových ciest, sinusitída,
faryngitída, rinitída, herpes simplex
|
|
Poruchy krvi
a lymfatického systému
| febrilná neutropénia, neutropénia, leukopénia, trombocytopénia, anémia
| poruchy kostnej drene, pancytopénia
|
|
Poruchy imunitného systému
|
|
| reakcie
z precitlivenosti
|
Poruchy metabolizmu a výživy
| anorexia
| hypokaliémia
|
|
Psychické poruchy
|
| stav zmätenosti, úzkosť, nespavosť
|
|
Poruchy nervového systému
| závrat, bolesť hlavy
| intrakraniálne krvácanie, letargia
|
|
Poruchy oka
|
| krvácanie do oka, krvácanie spojiviek
|
|
Poruchy ciev
|
| hypertenzia, hypotenzia, hematóm
|
|
Trieda orgánových systémov
|
Veľmi časté
|
Časté
|
Menej časté
|
Poruchy dýchacej sústavy, hrudníka
a mediastína
|
dyspnoe
|
námahová dyspnoe, faryngolaryngeálna bolesť
|
|
Poruchy gastro- intestinálneho traktu
|
hnačka, vracanie, zápcha, nevoľnosť, bolesť brucha
|
gastrointestinálne krvácanie, hemoroidné krvácanie, stomatitída, krvácanie ďasien, dyspepsia
|
|
Poruchy kože a podkožného tkaniva
|
petechia, svrbenie, vyrážky, ekchymóza
|
purpura, alopécia, erytém, makulózne vyrážky
|
|
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
|
artralgia
|
myalgia, bolesť svalov a kostí
|
|
Poruchy obličiek a močových ciest
|
|
hematúria
|
|
Celkové poruchy a reakcie
v mieste podania
|
únava, pyrexia, bolesť
v hrudi, erytém
na mieste vpichu, bolesť miesta vpichu, reakcia miesta vpichu (nešpecifikovaná)
|
miesto vpichu: podliatiny, hematóm, stvrdnutie, vyrážky, svrbenie, zápal, zmena sfarbenia, uzlíky
a krvácanie nevoľnosť
|
|
Laboratórne a funkčné vyšetrenia
|
|
pokles telesnej hmotnosti
|
|
Hematologické nežiaduce reakcie
Najčastejšie pozorované nežiaduce účinky súvisiace s liečbou azacitidínom boli hematologického charakteru vrátane trombocytopénie, neutropénie a leukopénie (zvyčajne stupňa 3 alebo 4). V priebehu prvých 2 cyklov existuje vyššie riziko výskytu týchto reakcií, potom sa u pacientov tieto reakcie vyskytujú s menšou frekvenciou a obnovuje sa hematologická funkcia. Väčšina hematologických nežiaducich reakcií bola kontrolovaná bežným sledovaním kompletných počtov krvných buniek
a oneskorením podania azacitidínu v ďalšom cykle, profylaktickými antibiotikami a/alebo podľa potreby podpornou liečbou neutropénie rastovým faktorom (napr. G-CSF) a anémie alebo tromobocytopénie transfúziami.
InfekcieMyelosupresia môže viesť k neutropénii a zvýšenému riziku infekcie. U pacientov dostávajúcich azacitidín boli hlásené závažné nežiaduce účinky ako napríklad neutropenická sepsa (0,8%) a zápal pľúc (2,5%). Infekcie možno kontrolovať použitím liekov proti infekcii a podpornou liečbou neutropénie rastovým faktorom (napríklad G-CSF).
KrvácanieU pacientov dostávajúcich azacitidín sa môže vyskytnúť krvácanie. Boli hlásené závažné nežiaduce účinky ako napríklad gastrointestinálne krvácanie (0,8%) a intrakraniálne krvácanie (0,5%).
U pacientov sa majú sledovať znaky a príznaky krvácania, a to najmä u pacientov s existujúcou alebo s liečbou súvisiacou trombocytopéniou.
Precitlivenosť
U pacientov dostávajúcich azacitidín boli hlásené závažné reakcie z precitlivenosti (0,25%). V prípade reakcie podobnej anafylaktickému šoku sa má liečba azacitidínom ihneď ukončiť a má sa začať
vhodná symptomatická liečba.
Nežiaduce účinky na kožu a podkožné tkanivo
Väčšina nežiaducich účinkov na kožu a podkožné tkanivo súvisela s miestom vpichu. Žiaden z uvedených nežiaducich účinkov neviedol k dočasnému ani trvalému prerušeniu podávania azacitidínu, ani k zníženiu dávky azacitidínu počas pivotnej štúdie. Väčšina nežiaducich účinkov sa vyskytla počas prvých 2 cyklov a v následných cykloch sa ich počet znižoval. Subkutánne nežiaduce účinky, ako napríklad svrbenie, zápal, a vyrážky v mieste vpichu, vyrážky, erytém a kožné lézie, môžu vyžadovať súbežnú liečbu napríklad antihistaminikami, kortikosteroidmi a nesteroidnými protizápalovými liekmi (non-steroidal anti-inflammatory drugs, NSAID).
Gastrointestinálne nežiaduce reakcie
Najčastejšie hlásené nežiaduce gastrointestinálne reakcie súvisiace s liečbou azacitidínom zahŕňali zápchu, hnačku, nevoľnosť a vracanie. Tieto nežiaduce reakcie boli kontrolované symptomaticky pomocou antiemetík v prípade nevoľnosti a vracania, liekov proti hnačke v prípade hnačky a laxatív a/alebo prostriedkov na zmäkčenie stolice v prípade zápchy.
4.9 Predávkovanie
Počas klinických štúdií sa vyskytol jeden prípad predávkovania azacitidínom. U tohto pacienta sa vyskytla hnačka, nevoľnosť a vracanie po podaní jednej intravenóznej dávky približne 290 mg/m2, čo je takmer 4-násobok odporúčanej úvodnej dávky.
V prípade predávkovania sa majú u pacienta sledovať príslušné počty krvných buniek a podľa potreby sa mu má podať podporná liečba. Nie je známa žiadna špecifická protilátka na predávkovanie azacitidínom.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antineoplastická látka, analógy pyrimidínu; ATC kód: L01BC07
Mechanizmus účinku
U azacitidínu sa predpokladá, že vykazuje svoje antineoplastické účinky pomocou viacerých mechanizmov vrátane cytotoxicity na abnormálne hematopoetické bunky v kostnej dreni
a hypometylácie DNA. Cytotoxické účinky azacitidínu môžu byť výsledkom viacerých mechanizmov vrátane inhibície syntézy DNA, RNA a proteínov, inkorporácie do RNA a DNA a aktivácie deštrukčných ciest DNA. Neproliferujúce bunky sú relatívne necitlivé na azacitidín. Inkorporácia azacitidínu do DNA má za následok inaktiváciu DNA metyltransferáz, čo vedie k hypometylácii DNA. Hypometylácia DNA aberantne metylovaných génov zapojených do normálnej regulácie bunkového cyklu, diferenciácie a deštrukčných ciest môže spôsobiť opätovnú exprimáciu génov
a obnovenie funkcií potláčajúcich tvorbu nádorov v nádorových bunkách. Relatívny význam hypometylácie DNA v porovnaní s cytotoxicitou alebo inými účinkami azacitidínu na klinické výsledky nebola stanovená.
Klinická účinnosťa bezpečnosť
Účinnosť a bezpečnosť Vidazy boli študované v rámci medzinárodnej, multicentrickej, kontrolovanej, otvorenej, randomizovanej, komparatívnej štúdie fázy 3 s paralelnými skupinami
(AZA PH GL 2003 CL 001) u pacientov so stredne-2 a vysokorizikovými MDS podľa medzinárodného prognostického hodnotiaceho systému (IPSS), u pacientov s refraktérnou anémiou s prevahou blastov (refractory anaemia with excess blasts, RAEB), u pacientov s refraktérnou
anémiou s prevahou blastov v transformácii (refractory anaemia with excess blasts in transformation,
RAEB-T) a u pacientov s modifikovanou chronickou myelomonocytovou leukémiou (mCMML) podľa francúzsko-americko-britského (FAB) klasifikačného systému. Pacienti s RAEB-T (21-30% blastov) sa podľa aktuálneho klasifikačného systému WHO považujú za pacientov s AML. Azacitidín spolu s najlepšou podpornou liečbou (
best supportive care, BSC) (n = 179) sa porovnával
s konvenčnými režimami liečby (
conventional care regimens, CCR). CCR sa skladali zo samostatnej BSC (n = 105), nízkej dávky cytarabínu a BSC (n = 49) alebo zo štandardnej indukčnej chemoterapie a BSC (n = 25). Pacienti boli pred randomizáciou vyberaní ich lekárom do 1 z 3 režimov CCR. Ak neboli pacienti randomizovaní na liečbu Vidazou, boli liečení týmto vopred vybraným režimom. Ako súčasť kritérií pre zaradenie museli pacienti dosiahnuť výkonnostný stav podľa kritérií
Eastern Cooperative Oncology Group (ECOG) na úrovni 0-2. Pacienti so sekundárnym MDS boli vylúčení zo štúdie. Primárnym cieľom štúdie bola celková doba prežívania. Vidaza sa podávala vo forme subkutánnej dávky 75 mg/m2 denne po dobu 7 dní, po ktorých nasledovala 21-dňová prestávka
(28-dňový liečebný cyklus), pričom medián počtu cyklov bol 9 (rozsah = 1-39) a priemerný počet cyklov bol 10,2. V rámci populácie
intent to treat (ITT, populácia všetkých randomizovaných pacientov) bol stredný vek 69 rokov (rozsah bol 38 až 88 rokov).
V rámci ITT analýzy 358 pacientov (179 pacientov liečených azacitidínom a 179 liečených CCR), viedla liečba Vidazou k strednej dobe prežívania 24,46 mesiacov oproti 15,02 mesiacom u pacientov liečených CCR, čo je rozdiel 9,4 mesiacov, so stratifikovanou log-rank p-hodnotou = 0,0001. Miera rizika pre liečebný účinok bola 0,58 (95% CI: 0,43; 0,77). Dvojročné miery prežívania boli 50,8%
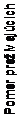
u pacientov dostávajúcich azacitidín oproti 26,2% u pacientov dostávajúcich CCR (p < 0,0001).
Log-rank p-hodnotou = 0,0001
HR 0,58 [95 % CI: 0,43-0,77] Úmrtia: AZA = 82, CCR = 113
mesiacov
mesiacov
Počet v ohrození
Č as (v mesiacoch) od randomizácie
LEGENDA: AZA = azacitidín, CCR = konvenčné režimy liečby (conventional care regimens), CI = interval spoľahlivosti
(confidence interval), HR = miera rizika (hazard ratio)
Prínosy v prežívaní pomocou Vidazy boli konzistentné oproti všetkým možnostiam liečby CCR (samostatne BSC, nízke dávky cytarabínu s BSC alebo štandardná indukčná chemoterapia s BSC) použitými v kontrolnej skupine.
Pri analýze cytogenetických podskupín IPSS boli zistené podobné nálezy mediánu celkovej doby prežívania vo všetkých skupinách (dobrá, stredná, nedostatočná cytogenetika vrátane monozómie 7).
V rámci analýz vekových podskupín bol vo všetkých skupinách (< 65 rokov, ≥ 65 rokov a ≥ 75 rokov)
zistený nárast mediánu celkovej doby prežívania.
Liečba Vidazou bola spojená s mediánom doby do úmrtia alebo do transformácie na AML
13,0 mesiaca oproti 7,6 mesiaca u pacientov podstupujúcich liečbu CCR, čo je zlepšenie o 5,4 mesiaca so stratifikovanou log-rank p-hodnotou = 0,0025.
Liečba Vidazou bola tiež spojená so znížením výskytu cytopénií a s nimi súvisiacich príznakov.
Liečba Vidazou viedla k zníženej potrebe transfúzie erytrocytov a trombocytov. Z pacientov v skupine liečenej azacitidínom, ktorí boli na začiatku liečby závislí od transfúzie erytrocytov, sa 45,0% počas liečby stalo nezávislými od transfúzie erytrocytov v porovnaní s 11,4% pacientov v kombinácii skupín CCR (štatisticky významný (p < 0,0001) rozdiel bol 33,6% (95% CI: 22,4; 44,6)). U pacientov
v skupine liečenej azacitidínom, ktorí boli na začiatku závislí od transfúzie erytrocytov a stali sa od nej nezávislými, bol medián doby nezávislosti od transfúzie erytrocytov 13 mesiacov.
Odozva bola vyhodnotená skúšajúcim alebo nezávislou revíznou komisiou (Independet Review Committee, IRC). Celková odpoveď (úplná remisia [CR] + čiastočná remisia [PR]) stanovená skúšajúcim bola 29% v skupine liečenej azacitidínom a 12% v kombinácii skupín CCR (p = 0,0001). Celková odozva (CR + PR) stanovená IRC v štúdii AZA PH GL 2003 CL 001 bola 7% (12/179)'
v skupine liečenej azacitidínom v porovnaní s 1% (2/179) v kombinácii skupín CCR (p = 0,0113). Rozdiely medzi hodnotením IRC a hodnotením skúšajúceho boli dôsledkom kritérií medzinárodnej pracovnej skupiny (International Working Group, IWG), vyžadujúcimi zlepšenie počtov krvných buniek v periférnej krvi a zachovanie týchto zlepšení po dobu najmenej 56 dní. Prínos v prežívaní bol preukázaný aj u pacientov, ktorí nedosiahli úplnú/čiastočnú odozvu na liečbu azacitidínom. Hematologické zlepšenie (značné alebo slabšie) stanovené IRC sa dosiahlo u 49% pacientov dostávajúcich azacitidín v porovnaní s 29% pacientov v kombinácii skupín CCR (p < 0,0001).
U pacientov s najmenej jednou cytogenetickou abnormalitou na začiatku liečby bolo percento pacientov s významnou cytogenetickou odpoveďou podobné v skupine s azacitidínom a v kombinácii skupín CCR. Slabšia cytogenetická odozva bola štatisticky významne (p = 0,0015) vyššia v skupine
s azacitidínom (34%) v porovnaní s kombináciou skupín CCR (10%).
5.2 Farmakokinetické vlastnosti
Farmakokinetické vlastnosti azacitidínu boli skúmané po jednorazovom subkutánnom a intravenóznom podaní dávky 75 mg/m2.
Absorpcia
Azacitidín sa rýchlo absorboval po subkutánnom podaní s maximálnymi plazmatickými koncentráciami azacitidínu 750 ± 403 ng/ml vyskytujúcimi sa po 0,5 h (prvý bod odberu) od podania dávky. Absolútna biologická dostupnosť azacitidínu po subkutánnom podaní v porovnaní
s intravenóznym podaním bola na základe plochy pod krivkou (AUC) približne 89%.
Distribúcia
Po intravenóznom podaní bol priemerný objem distribúcie 76 ± 26 l a systémový klírens bol
147 ± 47 l/h.
Metabolizmus
Na základe údajov in vitro sa metabolizmus azacitidínu nezdá byť sprostredkovaný izoenzýmami cytochrómu P450 (CYP), UDP-glukuronosyltransferázami (UGT), sulfotransferázami (SULT) ani glutationtransferázami (GST).
Metabolizmus azacitidínu sa uskutočňuje formou spontánnej hydrolýzy a deaminácie sprostredkovanej cytidín-deaminázou. Vo frakciách S9 ľudskej pečene bolo vytváranie metabolitov nezávislé od NADPH, čo naznačuje, že metabolizmus je katalyzovaný cytozolickými enzýmami. In vitro štúdie azacitidínu s kultivovanými ľudskými hepatocytmi naznačujú, že koncentrácie od 1,0 µM až 100 µM (t. j. až do 30-násobku hodnôt klinicky dosiahnuteľných koncentrácií) azacitidínu neindukuje
izoenzýmy cytochrómu P450 (CYP) 1A2, 2C19, 3A4 ani 3A5. V štúdii zameranej na vyhodnotenie inhibície série izoenzýmov P450 (CYP 1A2, 2C9, 2C19, 2D6, 2E1 a 3A4) inkubovaných so 100 µM azacitidínu sa hodnoty IC50 nedali určiť a preto je inhibícia enzýmov azacitidínom pri klinicky dosiahnuteľných plazmatických koncentráciách nepravdepodobná. Potenciál inhibície CYP2B6 alebo
2C8 sa neskúmal.
Vylučovanie
Azacitidín sa rýchlo vylučuje z plazmy s priemerným polčasom eliminácie (t½) 41 ± 8 minút po subkutánnom podaní. Vylučovanie močom je primárnou cestou eliminácie azacitidínu a/alebo jeho metabolitov. Po intravenóznom a subkutánnom podaní 14C-azacitidínu sa 50-85% podanej rádioaktivity vylúčilo močom a < 1% sa vylúčilo stolicou.
Osobitné populácie
Vplyvy poškodenia obličiek alebo pečene (pozri časť 4.2), pohlavia, veku alebo rasy na farmakokinetické vlastnosti azacitidínu sa oficiálne neskúmali.
Farmakogenomické vlastnosti
Účinok známeho polymorfizmu cytidín-deaminázy na metabolizmus azacitidínu sa oficiálne neskúmal.
5.3 Predklinické údaje o bezpečnosti
Azacitidín vyvoláva génové mutácie aj chromozómové aberácie v bunkových systémoch baktérií a cicavcov in vitro. Potenciálna karcinogenita azacitidínu bola hodnotená u myší a potkanov.
Azacitidín vyvolával nádory hematopoetického systému u samíc myší pri intraperitoneálnom podávaní
3-krát týždenne po dobu 52 týždňov. Zvýšený výskyt nádorov v lymforetikulárnom systéme, pľúcach, mliečnych žľazách a pokožke bol pozorovaný u myší, ktorým bol podávaný azacitidín intraperitoneálne po dobu 50 týždňov. Štúdia tumorigenicity u potkanov odhalila zvýšený výskyt testikulárnych nádorov.
Štúdie zamerané na skorú embryotoxicitu u myší odhalili 44% výskyt vnútromaternicových embryonálnych úmrtí (zvýšená resorpcia) po podaní jednej intraperitoneálnej injekcie azacitidínu počas organogenézy. U myší, ktorým sa podával azacitidín v čase uzatvorenia tvrdého podnebia alebo pred ním boli zistené vývojové abnormality mozgu. U potkanov azacitidín nespôsobil žiadne nežiaduce účinky pri podávaní pred uhniezdením oplodneného vajíčka, bol však jednoznačne embryotoxický pri podávaní počas organogenézy. Abnormality plodu spôsobené počas organogenézy zahŕňajú anomálie centrálneho nervového systému (exencefália/encefalokéla), anomálie končatín (mikromélia, vbočená noha, syndaktýlia, oligodaktýlia) a iné (mikrognatia, gastroschíza, edém
a abnormality rebier).
Podávanie azacitidínu samcom myší pred párením s neliečenými samicami myší viedlo k zníženiu plodnosti a strate potomstva počas následného embryonálneho a postnatálneho vývoja. Liečba samcov potkanov viedla k zníženiu hmotnosti semenníkov a nadsemenníkov, zníženiu počtu spermií, zníženiu frekvencie gravidity, zvýšeniu počtu abnormálnych embryí a k zvýšeným stratám embryí
u oplodnených samíc (pozri časť 4.4).
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol (E421)
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.
3 Čas použiteľnosti
Neotvorená injekčná liekovka:
4 roky
Po rekonštitúcii:
Chemická a fyzikálna stabilita rekonštituovaného lieku počas používania bola preukázaná pri teplote
25 °C po dobu 45 minút a pri teplote 2 °C až 8 °C po dobu 8 hodín.
Z mikrobiologického hľadiska sa má rekonštituovaný liek okamžite použiť. Ak sa nepoužije okamžite, za čas a podmienky uchovávania pred použitím zodpovedá používateľ, tento však nesmie byť dlhší
ako 8 hodín pri teplote 2 °C až 8 °C.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie. Podmienky na uchovávanie pripraveného lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Bezfarebná 30 ml sklenená (typ I) injekčná liekovka uzatvorená butyl elastomérovou zátkou s hliníkovým tesnením a polypropylénovým plastovým viečkom.
Veľkosť balenia: 1 injekčná liekovka obsahujúca 100 mg azacitidínu.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Odporúčania na bezpečné zaobchádzanie s liekom
Vidaza je cytotoxický liek a rovnako ako v prípade iných potenciálne toxických zlúčenín sa počas manipulácie a prípravy suspenzie azacitidínu musí postupovať opatrne. Je potrebné dodržiavať postupy na bezpečnú manipuláciu a likvidáciu protinádorových liekov.
Ak dôjde ku kontaktu rekonštituovaného azacitidínu s pokožkou, zasiahnuté miesto okamžite
a dôkladne umyte mydlom a vodou. Ak sa dostane do kontaktu so sliznicami, zasiahnuté miesto dôkladne opláchnite vodou.
Postup rekonštitúcie
1. Pripravte si nasledujúce materiály:
• Injekčnú liekovku (injekčné liekovky) s azacitidínom, injekčnú liekovku (injekčné liekovky) s vodou na injekciu, nesterilné chirurgické rukavice,
• Alkoholové tampóny, 5 ml injekčné striekačky s ihlami.
2. Odoberte 4 ml vody na injekciu do injekčnej striekačky a dbajte na vytlačenie všetkého zachyteného vzduchu zo striekačky.
3. Zasuňte ihlu injekčnej striekačky obsahujúcej 4 ml vody na injekciu cez gumené viečko injekčnej liekovky s azacitidínom a vstreknite vodu na injekciu do injekčnej liekovky.
4. Vytiahnite injekčnú striekačku a ihlu a silno pretrepte injekčnú liekovku, až kým sa nevytvorí homogénna zakalená suspenzia. Po rekonštitúcii obsahuje každý ml suspenzie 25 mg azacitidínu (100 mg/4 ml). Rekonštituovaný liek je homogénna, zakalená suspenzia, bez aglomerátov. Aksuspenzia obsahuje veľké častice alebo aglomeráty, treba ju zlikvidovať.
5. Očistite gumené viečko a zasuňte novú injekčnú striekačku s ihlou. Prevráťte injekčnú liekovku hore dnom, pričom dbajte na to, aby bol hrot ihly pod hladinou tekutiny. Potiahnutím piesta dozadu natiahnite množstvo lieku požadované pre správnu dávku a dbajte na vytlačenie všetkého zachyteného vzduchu zo striekačky. Vytiahnite injekčnú striekačku s ihlou z injekčnej liekovky a ihlu zlikvidujte.
6. Pevne nasaďte novú subkutánnu ihlu (odporúča sa kaliber 25) na injekčnú striekačku. Ihla sa nemá plniť pred injekčnou aplikáciou, aby sa znížil výskyt lokálnych reakcií v mieste vpichu.
7. V prípade potreby (dávky nad 100 mg) zopakujte všetky vyššie uvedené kroky na prípravu suspenzie. V prípade dávok vyšších než 100 mg (4 ml) treba dávku rovnomerne rozdeliť do
2 injekčných striekačiek (napríklad dávka 150 mg = 6 ml, 2 injekčné striekačky s 3 ml v každej injekčnej striekačke).
8. Obsah dávkovacej injekčnej striekačky sa musí premiešať tesne pred podaním. Teplota suspenzie v čase injekcie má byť približne 20 °C až 25 °C. Na premiešanie rýchlo rolujte injekčnú striekačku medzi dlaňami dovtedy, kým sa nevytvorí homogénna, zakalená suspenzia.
Ak suspenzia obsahuje veľké častice alebo aglomeráty, treba ju zlikvidovať.Suspenzia Vidazy sa má pripraviť bezprostredne pred použitím a rekonštituovaná suspenzia sa má
podať do 45 minút. Ak uplynie viac než 45 minút, rekonštituovaná suspenzia sa musí príslušným spôsobom zlikvidovať a musí sa pripraviť nová dávka. Ak sa liek musí rekonštituovať v dlhšom časovom odstupe pred podaním, musí sa ihneď po rekonštitúcii vložiť do chladničky (2 °C až 8 °C)
a uchovávať v chladničke maximálne 8 hodín. Ak doba uchovávania v chladničke presiahne 8 hodín, suspenzia sa musí príslušným spôsobom zlikvidovať a musí sa pripraviť nová dávka. Injekčná striekačka naplnená rekonštituovanou suspenziou sa má nechať ohriať na teplotu približne 20 °C až
25 °C po dobu do 30 minút pred podaním lieku. Ak uplynie viac než 30 minút, suspenzia sa musí príslušným spôsobom zlikvidovať a musí sa pripraviť nová dávka.
Výpočet individuálnej dávkyCelkovú dávku podľa povrchu tela (
body surface area, BSA) možno vypočítať nasledovne: Celková dávka (mg) = dávka (mg/m2) x BSA (m2)
Nasledujúca tabuľka je uvedená iba ako príklad výpočtu individuálnych dávok azacitidínu na základe priemernej hodnoty BSA na úrovni 1,8 m2.
Dávka mg/m2
(% odporúčanejúvodnej dávky)
| Celková dávka nazáklade hodnoty BSA
1,8m2
| Požadovaný početinjekčných liekoviek
| Celkový potrebnýobjem rekonštituovanejsuspenzie
|
75 mg/m2 (100%)
| 135 mg
| 2 injekčné liekovky
| 5,4 ml
|
37,5 mg/m2 (50%)
| 67,5 mg
| 1 injekčná liekovka
| 2,7 ml
|
25 mg/m2 (33%)
| 45 mg
| 1 injekčná liekovka
| 1,8 ml
|
Spôsob podávaniaRekonštituovaná Vidaza sa má podávať subkutánnou injekciou (ihlu zaveďte pod uhlom 45 – 90°) do ramena, stehna alebo brucha použitím injekčnej ihly s kalibrom 25.
Dávky väčšie než 4 ml sa majú injekčne aplikovať do dvoch rôznych miest vpichu.
Miesta injekčnej aplikácie sa majú meniť. Nové injekcie sa majú aplikovať najmenej 2,5 cm od predchádzajúceho miesta vpichu a nikdy nie do oblastí, v ktorých je miesto vpichu bolestivé,
s podliatinami, začervenané alebo stvrdnuté.
Nepoužitý liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIICelgene Europe Ltd Riverside House Riverside Walk Windsor
SL4 1NA Veľká Británia
Tel.: +44 1753 240600
Fax: +44 1753 240656
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU