ologické príhody, vrátane hemorágie spojenej
s trombocytopéniou a neutropenickými infekciami, boli hlásené počas sledovania po uvedení lieku
na trh.
Počas liečby sunitinibom bol pozorovaný včasný, ale aj neskorý výskyt anémie.
Na začiatku každého liečebného cyklu sunitinibom sa musí pacientom vyšetriť celkový krvný obraz
(pozri časť 4.8).
Poruchy srdca a srdcovej činnostiKardiovaskulárne príhody, vrátane zlyhania srdca, kardiomyopatie, zníženia ejekčnej frakcie ľavej
komory pod dolnú hranicu normy, myokarditídy, ischémie myokardu a infarktu myokardu, z ktorých
niektoré boli smrteľné, boli hlásené u pacientov liečených sunitinibom. Tieto údaje naznačujú, že
sunitinib zvyšuje riziko kardiomyopatie. U liečených pacientov neboli okrem účinku špecifického
pre liek identifikované žiadne špecifické dodatočné rizikové faktory pre kardiomyopatiu indukovanú
sunitinibom. Sunitinib používajte s opatrnosťou u pacientov, u ktorých sa vyskytuje riziko týchto
udalostí, alebo ktorí majú tieto udalosti v anamnéze (pozri časť 4.8).
Zo všetkých klinických skúšaní so sunitinibom boli vylúčení pacienti s prítomnosťou závažnej srdcovej príhody do 12 mesiacov pred podaním sunitinibu, ako je infarkt myokardu (vrátane závažnej/nestabilnej angíny), koronárny/periférny arteriálny bypass, symptomatické kongestívne zlyhávanie srdca (congestive heart failure,CHF), cievna mozgová príhoda alebo tranzitórny ischemický atak či pľúcna embólia. Nie je známe, či pacienti s týmito konkomitantnými stavmi môžu mať zvýšené riziko rozvoja dysfunkcie ľavej komory súvisiacej so sunitinibom.
Odporúča sa, aby lekár zvážil toto riziko v porovnaní s možným prínosom liečby sunitinibom.
U pacientov sa majú počas podávania sunitinibu starostlivo monitorovať klinické prejavy a príznaky
CHF, zvlášť u pacientov s kardiologickými rizikovými faktormi a/alebo ochoreniami koronárnych
artérií v anamnéze. Na začiatku liečby a potom v pravidelných intervaloch počas liečby sunitinibom sa
má zvážiť vyšetrenie LVEF. U pacientov bez rizikových kardiálnych faktorov sa má zvážiť vyšetrenie
ejekčnej frakcie pred začiatkom liečby.
Ak sú prítomné klinické prejavy kongestívneho zlyhávania srdca, odporúča sa liečbu sunitinibom
ukončiť. Pacientom bez klinických prejavov CHF, avšak s ejekčnou frakciou < 50 % a > 20 %
poklesom oproti východiskovej hodnote, sa musí podávanie sunitinibu prerušiť a/alebo znížiť dávka.
Predĺženie QT-intervaluU pacientov vystavených sunitinibu sa pozorovalo predĺženie QT-intervalu a
torsade de pointes..
Predĺženie QT intervalu môže viesť k zvýšenému riziku ventrikulárnej arytmie vrátane
torsade depointes.
Sunitinib sa má s opatrnosťou používať u pacientov so známou anamnézou predĺženia QT-intervalu,
u pacientov, ktorí užívajú antiarytmiká alebo lieky, ktoré môžu predlžovať QT-interval alebo u pacientov s už existujúcim závažným ochorením srdca, bradykardiou alebo s poruchou
elektrolytovej rovnováhy. Súbežné podávanie so silnými inhibítormi CYP3A4 sa musí obmedziť kvôli
možnému zvýšeniu koncentrácie sunitinibu v plazme (pozri časti 4.2, 4.5 a 4.8).
Venózne trombembolické príhodyU pacientov, ktorí dostávali sunitinib, boli hlásené venózne trombembolické príhody, ktoré súviseli
s liečbou – vrátane hlbokej žilovej trombózy a pľúcnej embólie (pozri časť 4.8). Po uvedení lieku na trh boli hlásené prípady pľúcnej embólie so smrteľným následkom.
Artériové trombembolické príhodyU pacientov liečených sunitinibom boli hlásené artériové trombembolické príhody (ATP),
v niektorých prípadoch smrteľné. Najčastejšie príhody zahŕňali cerebrovaskulárnu príhodu, tranzitórny
ischemický atak a mozgový infarkt. Rizikové faktory spojené s ATP, okrem základného malígneho
ochorenia a veku ≥ 65 rokov, zahŕňali hypertenziu, diabetes mellitus a predchádzajúce
trombembolické ochorenie.
Aneuryzmy aorty a disekcieBoli hlásené prípady aneuryzmy aorty a/alebo disekcie (vrátane fatálnych následkov). Pred začatím liečby sunitinibom sa má starostlivo zvážiť riziko u pacientov s rizikovými faktormi ako hypertenzia alebo aneuryzma v anamnéze.
Trombotická mikroangiopatia (TMA)Ak sa vyskytne hemolytická anémia, trombocytopénia, únava, kolísavá neurologická manifestácia,
porucha funkcie obličiek a horúčka, je potrebné zobrať do úvahy diagnózu TMA, vrátane trombotickej
trombocytopenickej purpury (TTP) a hemolytického uremického syndrómu (HUS), ktoré v niektorých
prípadoch môžu viesť k zlyhaniu obličiek alebo smrteľným následkom.
U pacientov, u ktorých sa vyvinula TMA, sa musí liečba sunitinibom prerušiť a je nevyhnutné
okamžite začať liečbu TMA. Po prerušení liečby sa pozorovalo vymiznutie príznakov TMA (pozri
časť 4.8).
Dysfunkcia štítnej žľazyU všetkých pacientov sa odporúča vykonať základné laboratórne vyšetrenia funkcie štítnej žľazy.
Pacienti s už prítomnou hypotyreózou alebo hypertyreózou majú byť liečení podľa štandardných
klinických postupov pred začiatkom liečby sunitinibom. Počas liečby sutinibom sa má každé
3 mesiace vykonávať rutinné monitorovanie funkcie štítnej žľazy. Okrem toho sa u pacientov počas
liečby sunitinibom majú dôsledne sledovať prejavy a príznaky dysfunkcie štítnej žľazy a pacientom, u ktorých sa objavia akékoľvek prejavy a/alebo príznaky poukazujúce na dysfunkciu štítnej žľazy, sa
má urobiť laboratórne vyšetrenie funkcie štítnej žľazy, ak je klinicky indikované. Pacientov, u ktorých
sa vyvinie dysfunkcia štítnej žľazy, treba liečiť podľa zásad platných v medicínskej praxi.
Výskyt hypotyreózy sa pozoroval na začiatku liečby sunitinibom, ale aj neskôr počas liečby (pozri
časť 4.8).
PankreatitídaU pacientov s rôznymi solídnymi nádormi, ktorí dostávali sunitinib, sa pozorovalo zvýšenie aktivity
sérovej lipázy a amylázy. Zvýšenie aktivity lipázy u pacientov s rôznymi solídnymi nádorni bolo
prechodné a tento nález vo všeobecnosti nesprevádzali prejavy či príznaky pankreatitídy (pozri
časť 4.8).
Boli hlásené závažné pankreatické príhody, niektoré so smrteľným koncom. Ak sú prítomné príznaky
pankreatitídy, sunitinib sa má pacientom vysadiť a má im byť poskytnutá primeraná podporná
starostlivosť.
HepatotoxicitaU pacientov liečených sunitinibom bola pozorovaná hepatotoxicita. Prípady zlyhania pečene, niektoré
so smrteľným koncom, sa pozorovali u < 1 % pacientov so solídnymi nádormi, ktorí boli liečení
sunitinibom. Pred začatím liečby, počas každého cyklu a vždy, keď je to z klinického hľadiska
indikované, monitorujte testy pečeňových funkcií (alanínaminotransferázu [ALT],
aspartátaminotransferázu [AST], hladiny bilirubínu). Ak sú prítomné prejavy a príznaky zlyhávania
pečene, liečba sunitinibom sa musí ukončiť a má sa poskytnúť vhodná podporná liečba (pozri časť 4.8).
Funkcia obličiekBoli hlásené prípady poruchy funkcie obličiek, obličkového zlyhania a/alebo akútneho obličkového
zlyhania, v niektorých prípadoch so smrteľným koncom (pozri časť 4.8).
Rizikové faktory spojené s poruchou funkcie/zlyhaním obličiek u pacientov užívajúcich sunitinib
zahŕňali okrem prítomného RCC, vyšší vek, diabetes mellitus, prítomnosť poruchy funkcie obličiek,
zlyhanie srdca, hypertenziu, sepsu, dehydratáciu/hypovolémiu a rabdomyolýzu.
Bezpečnosť pokračujúcej liečby sunitinibom u pacientov so stredne závažnou až závažnou proteinúriou sa systematicky nehodnotila.
Boli hlásené prípady proteinúrie a zriedkavé prípady nefrotického syndrómu. Odporúča sa vstupné
vyšetrenie moču a pacienti majú byť monitorovaní na rozvoj alebo zhoršenie proteinúrie. U pacientov
s nefrotickým syndrómom ukončite podávanie sunitinibu.
FistulaAk dôjde k vytvoreniu fistuly, liečba sunitinibom sa má prerušiť. O pokračovaní v liečbe sunitinibom
u pacientov s fistulou sú dostupné obmedzené informácie (pozri časť 4.8).
Zhoršené hojenie ránPočas liečby sunitinibom boli hlásené prípady zhoršeného hojenia rán.
Nevykonali sa žiadne formálne klinické štúdie zamerané na účinok sunitinibu na hojenie rán.
U pacientov podstupujúcich veľký chirurgický zákrok sa z preventívnych dôvodov odporúča dočasné
prerušenie liečby sunitinibom. Existujú iba limitované klinické skúsenosti týkajúce sa načasovania
opätovného začatia liečby následne po veľkom chirurgickom zákroku. Preto rozhodnutie pokračovať
v liečbe sunitinibom následne po veľkom chirurgickom zákroku má byť založené na klinickom
zhodnotení zotavovania sa po zákroku.
Osteonekróza čeľusteU pacientov liečených sunitinibom boli hlásené prípady osteonekrózy čeľuste. Väčšina prípadov bola
hlásená u pacientov, ktorí predtým alebo súbežne dostávali liečbu intravenóznymi bisfosfonátmi, pre
ktoré je osteonekróza čeľuste identifikovaným rizikom. Preto je potrebná zvýšená opatrnosť, keď sa
sunitinib používa s intravenóznymi bisfosfonátmi buď súbežne alebo následne.
Invazívne stomatologické zákroky sú tiež identifikovaným rizikovým faktorom. Pred liečbou sunitinibom treba zvážiť vyšetrenie zubov a náležité preventívne ošetrenie zubov. U pacientov, ktorí
predtým dostávali alebo dostávajú intravenózne bisfosfonáty, sa treba, ak je to možné, vyhnúť
invazívnym stomatologickým zákrokom (pozri časť 4.8).
Hypersenzitivita/angioedémAk sa v dôsledku hypersenzitivity vyskytne angioedém, má sa liečba sunitinibom prerušiť a poskytnúť
štandardná lekárska starostlivosť (pozri časť 4.8).
KŕčeV klinických skúšaniach so sunitinibom a po uvedení lieku na trh sa hlásili kŕče. Pacientov s kŕčmi a prejavmi/príznakmi, ktoré poukazujú na syndróm posteriórnej reverzibilnej leukoencefalopatie (reversible posterior leukoencephalopathy syndrome, RPLS), ako je hypertenzia, bolesť hlavy, zníženie bdelosti, zmenené mentálne funkcie a strata zraku, vrátane kortikálnej slepoty, treba kontrolovať a liečiť vrátane liečby hypertenzie. Odporúča sa dočasne prerušiť liečbu sunitinibom; po úprave stavu sa môže liečba obnoviť podľa uváženia ošetrujúceho lekára (pozri časť 4.8).
Syndróm z rozpadu nádoru (tumor lysis syndrome, TLS)Prípady TLS, niektoré smrteľné, boli zriedkavo pozorované v klinických skúšaniach a boli hlásené aj
u pacientov liečených sunitinibom v rámci sledovania po uvedení lieku na trh. Rizikové faktory pre
TLS zahŕňajú veľkú nádorovú masu, už existujúcu chronickú renálnu insuficienciu, oligúriu,
dehydratáciu, hypotenziu a kyslý moč. Títo pacienti majú byť prísne monitorovaní a liečení podľa
klinických indikácií a má sa zvážiť profylaktická hydratácia.
InfekcieBoli hlásené závažné infekcie, s neutropéniou alebo bez nej, vrátane niektorých so smrteľnými
následkami. Boli hlásené menej časté prípady nekrotizujúcej fasciitídy vrátane perinea, niektoré
smrteľné (pozri časť 4.8).
U pacientov, u ktorých sa rozvinie nekrotizujúca fasciitída, sa má liečba sunitinibom ukončiť
a okamžite sa má začať vhodná liečba.
HypoglykémiaPočas liečby sunitinibom boli zaznamenané poklesy v hladine glukózy v krvi, ktoré boli v niektorých
prípadoch klinicky symptomatické a vyžiadali si hospitalizáciu z dôvodu straty vedomia. V prípade
symptomatickej hypoglykémie sa má podávanie sunitinibu dočasne prerušiť. U pacientov s diabetes
mellitus sa majú pravidelne kontrolovať hladiny glukózy v krvi, aby sa posúdilo, či je na
minimalizáciu rizika hypoglykémie potrebné upraviť dávkovanie antidiabetického lieku (pozri
časť 4.8).
SodíkTento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednotke dávkovania, t.j. v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcieInterakčné štúdie sa uskutočnili len u dospelých.
Lieky, ktoré môžu zvýšiť plazmatické koncentrácie sunitinibuÚčinok inhibítorov CYP3A4Spoločné podávanie jednorazovej dávky sunitinibu zdravým dobrovoľníkom so silným inhibítorom
CYP3A4, ketokonazolom, viedlo ku 49 % zvýšeniu maximálnej koncentrácie (C
max) komplexu
[sunitinib + primárny metabolit] a k 51 % zvýšeniu plochy pod krivkou (AUC
0-∞) tohto komplexu.
Podávanie sunitinibu so silnými inhibítormi CYP3A4 (napr. ritonavirom, itrakonazolom,
erytromycínom, klaritromycínom, grapefruitovou šťavou) môže zvýšiť koncentrácie sunitinibu.
Preto sa má kombináciám s CYP3A4 inhibítormi vyhnúť alebo zvážiť výber alternatívneho súbežne
podávaného lieku so žiadnou alebo minimálnou schopnosťou inhibovať CYP3A4.
Ak to nie je možné, dávku Sunitinibu Sandoz bude možno potrebné znížiť na minimálnu dennú dávku 37,5 mg pre GIST a MRCC alebo 25 mg denne pre pNET na základe starostlivého monitorovania znášanlivosti (pozri časť 4.2).
Účinok inhibítorov proteínu rezistencie rakoviny prsníka (Breast Cancer Resistance Protein, BCRP)O interakcii medzi sunitinibom a inhibítormi BCRP je k dispozícii len obmedzené množstvo
klinických údajov a nedá sa vylúčiť možnosť interakcie medzi sunitinibom a inými inhibítormi BCRP
(pozri časť 5.2).
Lieky, ktoré môžu znížiť plazmatické koncentrácie sunitinibuÚčinok induktorov CYP3A4Spoločné podávanie jednorazovej dávky sunitinibu zdravým dobrovoľníkom s induktorom CYP3A4,
rifampicínom, viedlo k 23 % zníženiu C
max komplexu [sunitinib + primárny metabolit] a k 46 %
zníženiu AUC
0-∞ tohto komplexu.
Podávanie sunitinibu so silnými induktormi CYP3A4 (napr. dexametazónom, fenytoínom,
karbamazepínom, rifampicínom, fenobarbitalom alebo rastlinnými liekmi obsahujúcimi ľubovník bodkovaný/
Hypericum perforatum) môže znížiť koncentrácie sunitinibu. Preto sa má kombináciám s CYP3A4 induktormi vyhnúť, prípadne zvážiť výber alternatívneho súbežne podávaného lieku so žiadnou alebo minimálnou schopnosťou indukovať CYP3A4. Ak to nie je možné, dávku Sunitinibu Sandoz bude možno potrebné zvýšiť po 12,5 mg prídavkoch (až na 87,5 mg/deň pre GIST a MRCC alebo 62,5 mg pre pNET) na základe starostlivého monitorovania znášanlivosti (pozri časť 4.2).
4.6 Fertilita, gravidita a laktáciaAntikoncepcia u mužov a žienŽeny vo fertilnom veku majú byť poučené, aby počas liečby sunitinibom používali účinnú antikoncepciu a vyhli sa tak otehotneniu.
GraviditaNie sú k dispozícii žiadne štúdie o použití sunitinibu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu vrátane malformácií plodu (pozri časť 5.3). Sunitinib Sandoz sa má používať počas gravidity alebo u žien, ktoré nepoužívajú účinnú antikoncepciu iba v prípade, že potenciálny prínos prevyšuje potenciálne riziko pre plod. Ak sa sunitinib používa počas gravidity, alebo ak pacientka otehotnie počas liečby sunitinibom, musí byť oboznámená s možným rizikom pre plod.
DojčenieSunitinib a/alebo jeho metabolity sa u potkanov vylučujú do materského mlieka. Nie je známe, či sa
sunitinib alebo jeho primárny aktívny metabolit vylučujú do materského mlieka u človeka. Vzhľadom
na to, že u človeka sa liečivá obvykle vylučujú do materského mlieka ako aj kvôli potenciálnemu
riziku závažných nežiaducich reakcií u dojčených detí, ženy nesmú dojčiť počas užívania sunitinibu.
FertilitaPodľa výsledkov predklinických skúmaní môže liečba sunitinibom nepriaznivo vplývať na mužskú
a ženskú fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeSunitinib Sandoz má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti majú byť poučení, že sa u nich počas liečby sunitinibom môžu vyskytnúť závraty.
4.8 Nežiaduce účinky Súhrn bezpečnostného profiluNajzávažnejšie nežiaduce reakcie spájané so sunitinibom
, niekedy fatálne, sú renálne zlyhanie,
srdcové zlyhanie, pľúcna embólia, gastrointestinálna perforácia a hemorágie (napr. krvácanie
z dýchacej sústavy, gastrointestinálneho traktu, krvácanie do nádoru, krvácanie z močových ciest a do mozgu). Najčastejšie nežiaduce reakcie akéhokoľvek stupňa závažnosti (s výskytom u pacientov
v registračných klinických skúšaniach s RCC, GIST a pNET) zahŕňali zníženú chuť do jedla, poruchu
chuti, hypertenziu, únavu, gastrointestinálne poruchy (napr. hnačku, nevoľnosť, stomatitídu, dyspepsiu
a vracanie), zmeny sfarbenia kože, syndróm palmoplantárnej erytrodyzestézie. Tieto príznaky
môžu slabnúť pri pokračovaní liečby. Počas liečby sa môže vyvinúť hypotyreóza. Hematologické
poruchy (napr. neutropénia, trombocytopénia a anémia) patria medzi najčastejšie sa vyskytujúce
nežiaduce reakcie.
Smrteľné príhody, iné ako sú uvedené v časti 4.4 vyššie alebo v časti 4.8 nižšie, ktoré sa považovali za
pravdepodobne súvisiace so sunitinibom, zahŕňali multiorgánové zlyhanie, rozptýlenú intravaskulárnu
koaguláciu, peritoneálne krvácanie, insuficienciu nadobličiek, pneumotorax, šok a náhlu smrť.
Tabuľkový zoznam nežiaducich reakciíNežiaduce reakcie, ktoré boli hlásené u pacientov s GIST, MRCC a pNET v spoločnom súbore údajov
o 7 115 pacientoch, sú uvedené nižšie a zoradené podľa tried orgánových systémov a frekvencie
a stupňa závažnosti NCI-CTCAE). Uvedené sú aj nežiaduce reakcie identifikované v klinických
skúšaniach po uvedení lieku na trh. V rámci jednotlivých skupín frekvencií sú nežiaduce účinky
usporiadané v poradí klesajúcej závažnosti.
Frekvencie sú definované ako: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až
<1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) neznáme (z dostupných
údajov).
Tabuľka 1. Nežiaduce reakcie hlásené v klinických skúšaniachTrieda orgánových
systémov
| Veľmi časté
| Časté
| Menej časté
| Zriedkavé
| Neznáme
|
Infekcie a
nákazy
|
| Vírusové infekciea
Infekcie dýchacích
ciestb,*
Abscesc,*
Mykotické infekcied
Infekcia močového
traktu,
Kožné infekciee
sepsaf,*
| Nekrotizujúca
fasciitída*
Bakteriálne
infekcieg
|
|
|
Poruchy krvi a
lymfatického
systému
| Neutropénia
Trombocytopénia
Anémia
Leukopénia
| Lymfopénia
| Pancytopénia
| Trombotická
mikroangio-patiah,*
|
|
Poruchy
imunitného
systému
|
|
| Hypersenzitivita
| Angioedém
|
|
Poruchy
endokrinného
systému
| Hypotyreóza
|
| Hypertyreóza
| Tyreoitída
|
|
Poruchy
metabolizmu
a výživy
| Znížená chuť do
jedlai
| Dehydratácia
Hypoglykémia
|
| Syndróm
nádorového
rozpadu*
|
|
Psychické
poruchy
| Insomnia
| Depresia
|
|
|
|
Poruchy
nervového
systému
| Závrat
Bolesť hlavy
Poruchy chutij
| Periférna neuropatia
Parestézia
Hypestézia
Hyperestézia
| Cerebrálne krvácanie*
Cerebrovaskulárne
príhody*
Tranzitórny
ischemický atak
| Syndróm
posteriórnej
reverzibilnej
encefalopa-tie*
|
|
Poruchy oka
|
| Opuch okolo očí
Opuch očných viečok
Zvýšené slzenie
|
|
|
|
Poruchy srdca
a srdcovej
činnosti
|
| Ischémia myokarduk,*
Pokles ejekčnej frakciel
| Kongestívne
srdcové zlyhanie
Infarkt
myokardum,*
Srdcové zlyhanie*
Kardiomyopatia*
Perikardiálny
výpotok
Predĺženie QT na
elektrokardiogra-me
| Zlyhanie ľavej
srdcovej komory*
Torsade de pointes
|
|
Poruchy ciev
| Hypertenzia
| Hlboká žilová trombóza
Návaly tepla
Sčervenenie kože
| Krvácanie nádoru*
|
| Aneuryzmy aorty a disekcie*
|
Poruchy
dýchacej
sústavy,
hrudníka
a mediastína
| Dyspnoe
Epistaxa
Kašeľ
| Pľúcna embólia*
Pleurálny výpotok*
Hemoptýza
Ponámahové dyspnoe
Orofaryngeálna bolesťn
Nazálna kongescia
Sucho v nose
| Pľúcne krvácanie*
Respiračné zlyhanie
|
|
|
Poruchy
gastrointesti-nálneho traktu
| Stomatitídao,
Bolesť bruchap
Vracanie
Hnačka
Dyspepsia
Nauzea
Zápcha
| Gastroezofágová
refluxná choroba
Dysfágia
Gastrointestinálne
krvácanie*
Ezofagitída*
Abdominálna distenzia
Abdominálny
diskomfort
Krvácanie z konečníka
Krvácanie z ďasien
Ulcerácie v ústach
Proktalgia
Cheilitída
Hemoroidy
Glosodýnia
Bolesť v ústach
Sucho v ústach
Flatulencia
Diskomfort v ústach
Eruktácia
| Perforácia
gastrointestinálneho traktuq,*
Pankreatitída
Fistula v
Konečníku
Kolitídar
|
|
|
Poruchy
pečene
a žlčových ciest
|
|
| Zlyhanie pečene*
Cholecystitídas,*
Porucha funkcie
pečene
| Hepatitída
|
|
Poruchy kože
a podkožného
tkaniva
| Zmena sfarbenia
kožet
Syndróm palmoplantárnej
erytrodyzestézie
Vyrážkau
Zmeny sfarbenia
vlasov
Suchá koža
| Exfoliácia kože
Kožná reakciav
Ekzém
Pľuzgier
Erytém
Alopécia
Akné
Pruritus
Hyperpigmentácia kože
Kožná lézia
Hyperkeratóza
Dermatitída
Poruchy nechtovw
|
| Multiformný
erytém*
Stevensov-
Johnsonov
syndróm*
Pyoderma
gangreno-sum
Toxická
epidermálna
nekrolýza*
|
|
Poruchy
kostrovej
a svalovej
sústavy
a spojivového
tkaniva
| Bolesť
v končatinách
Artralgia
Bolesť chrbta
| Muskuloskeletálna
bolesť
Svalové kŕče
Myalgia
Svalová slabosť
| Osteonekróza
čeľuste
Fistula*
| Rabdomyo-lýza*
Myopatia
|
|
Poruchy
obličiek
a močových
ciest
|
| Zlyhanie obličiek*
Akútne zlyhanie
obličiek*
Chromatúria
Proteinúria
| Krvácanie z
močových ciest
| Nefrotický syndróm
|
|
Celkové
poruchy
a reakcie
v mieste
podania
| Zápal slizníc
Únavax
Edémy
Pyrexia
| Bolesť hrudníka
Bolesť
Ochorenie podobné
chrípke
Zimnica
| Zhoršené hojenie
|
|
|
Laboratórne
a funkčné
vyšetrenia
|
| Pokles hmotnosti
Znížený počet bielych
krviniek
Zvýšená hladina lipázy
Pokles počtu
trombocytov
Znížená hladina hemoglobínu
Zvýšená hladina amylázyz
Zvýšená hladina
aspartátaminotrans-ferázy
Zvýšená hladina
alanínaminotransfe-rázy
Zvýšená hladina kreatinínu v krvi
Zvýšený tlak krvi
Zvýšená hladina
kyseliny močovej v krvi
| Zvýšená hladina
kreatínfosfokinázy
v krvi
Zvýšená hladina
tyreostimulačného
hormónu v krvi
|
|
|
* Vrátane smrteľných udalostí.
Nasledujúce výrazy boli zlúčené:
a Zápal nosohltanu a ústny opar
b Zápal priedušiek, infekcia dolných dýchacích ciest, zápal pľúc a infekcia dýchacích ciest
c Absces, absces končatiny, análny absces, absces ďasien, absces pečene, absces pankreasu, perineálny absces, perirektálny absces, absces konečníka, podkožný absces a zubný absces
d Kvasinková infekcia pažeráka a úst
e Celulitída a infekcia kože
f Sepsa a septický šok
g Brušný absces, brušná sepsa, divertikulitída a osteomyelitída
h Trombotická mikroangiopatia, trombotická trombocytopenická purpura a hemolyticko-uremický syndróm
i Znížená chuť do jedla a anorexia
j Dysgeúzia, ageúzia a poruchy chuti
k Akútny koronárny syndróm, angína pektoris, nestabilná angína, oklúzia koronárnej artérie a ischémia myokardu
l Pokles ejekčnej frakcie/abnormálna ejekčná frakcia
m Akútny infarkt myokardu, infarkt myokardu a latentný infarkt myokardu
n Orofaryngálna a faryngolaryngálna bolesť
o Stomatitída a aftózna stomatitída
p Abdominálna bolesť, bolesť v dolnej časti brucha, bolesť v hornej časti brucha
q Perforácia gastrointestinálneho traktu a perforácia čreva
r Kolitída a ischemická kolitída
s Cholecystitída a akalkulózna cholecystitída
t Žlté sfarbenie kože, zmeny sfarbenia kože a porucha pigmentácie
u Psoriaziformná dermatitída, exfoliatívna vyrážka, vyrážka, erytémová vyrážka, folikulárna vyrážka, generalizovaná vyrážka, makulárna vyrážka, makulo-papulózna vyrážka, papulózna vyrážka a pruritická vyrážka
v Kožná reakcia a porucha kože
w Poškodenie a zmena sfarbenia nechtov
x Únava a asténia
y Opuch tváre, edém a periférny edém
z Amyláza a zvýšená hladina amylázy
Opis vybraných nežiaducich reakciíInfekcie a nákazyBoli hlásené prípady závažných infekcií (s neutropéniou alebo bez neutropénie), vrátane prípadov so
smrteľným koncom. Boli hlásené prípady nekrotizujúcej fascititídy, vrátane perinea, niekedy smrteľné
(pozri tiež časť 4.4).
Poruchy krvi a lymfatického systémuPokles absolútneho počtu neutrofilov 3. a 4. stupňa závažnosti bol v uvedenom poradí hlásený: u 10 %
a 1,7 % pacientov v štúdii fázy 3 s GIST, u 16 % a 1,6 % pacientov v štúdii fázy 3 s MRCC a u 13 % a
2,4 % pacientov v štúdii fázy 3 s pNET. Pokles počtu trombocytov 3. a 4. stupňa závažnosti bol
v uvedenom poradí hlásený: u 3,7 % a 0,4 % pacientov v štúdii fázy 3 s GIST, u 8,2 % a 1,1 %
pacientov v štúdii fázy 3 s MRCC a u 3,7 % a 1,2 % pacientov v štúdii fázy 3 s pNET (pozri časť 4.4).
Prípady krvácania boli hlásené u 18 % pacientov užívajúcich sunitinib v štúdii fázy 3 s GIST
v porovnaní so 17 % pacientov užívajúcich placebo. U pacientov užívajúcich sunitinib pre predtým
neliečený MRCC, sa krvácanie vyskytlo v 39 % v porovnaní s 11 % pacientov užívajúcich interferón-
α (IFN-α). U sedemnástich (4,5 %) pacientov liečených sunitinibom sa vyskytlo krvácanie 3. alebo
vyššieho stupňa v porovnaní s 5 (1,7 %) pacientami užívajúcimi IFN-α. U pacientov užívajúcich
sunitinib pre MRCC rezistentný na cytokíny sa u 26 % objavilo krvácanie. Prípady krvácania, okrem
epistaxy, sa vyskytli u 21,7 % pacientov užívajúcich sunitinib v štúdii fázy 3 s pNET v porovnaní
s 9,85 % pacientov, ktorí dostávali placebo (pozri časť 4.4).
V klinických skúšaniach bolo krvácanie do nádoru hlásené približne u 2 % pacientov s GIST.
Poruchy imunitného systémuBoli hlásené hypersenzitívne reakcie vrátane angioedému (pozri časť 4.4).
Endokrinné poruchyHypotyreóza bola hlásená ako nežiaduca reakcia u 7 pacientov (4 %), ktorí dostávali sunitinib
v 2 štúdiách s MRCC rezistentným na cytokíny; u 61 pacientov (16 %), ktorí dostávali sunitinib
a u 3 pacientov (< 1 %) v skupine s IFN-α v štúdii s predtým neliečeným MRCC.
Okrem toho bolo hlásené zvýšenie hormónu stimulujúceho štítnu žľazu (thyroid-stimulating hormone,
TSH) u 4 pacientov (2 %) s MRCC rezistentným na cytokíny. Celkovo malo 7 % pacientov z MRCC
populácie buď klinické, alebo laboratórne príznaky hypotyreózy, ktoré sa objavili počas liečby.
Získaná hypotyreóza bola zaznamenaná u 6,2 % pacientov s GIST liečených sunitinibom v porovnaní
s 1 % pacientov užívajúcich placebo. V štúdii fázy 3 s pNET sa u 6 pacientov (7,2 %) liečených
sunitinibom a u jedného pacienta (1,2 %) užívajúceho placebo hlásila hypotyreóza.
Funkcia štítnej žľazy bola prospektívne monitorovaná v 2 štúdiách u pacientov s karcinómom prsníka;
Sunitinib nie je schválený na použitie pri karcinóme prsníka. V jednej štúdii bola hypotyreóza hlásená u 15 (13,6 %) pacientov liečených sunitinibom a u 3 (2,9 %) pacientov so štandardnou liečbou. Zvýšenie hladín TSH v krvi bolo hlásené u 1 (0,9 %) pacienta liečeného sunitinibom a nebolo hlásené u žiadneho pacienta so štandardnou liečbou. Hypertyreóza nebola hlásená u žiadneho pacienta liečeného sunitinibom, bola však hlásená u 1 (1,0 %) pacienta so štandardnou liečbou.
V druhej štúdii bola hypotyreóza hlásená celkovo u 31 (13 %) pacientov liečených sunitinibom
a u 2 (0,8 %) pacientov liečených kapecitabínom. Zvýšenie hladín TSH v krvi bolo hlásené
u 12 (5,0 %) pacientov liečených sunitinibom a nebolo hlásené u žiadneho pacienta liečeného
kapecitabínom.
Hypertyreóza bola hlásená u 4 (1,7 %) pacientov liečených sunitinibom a nebola hlásená u žiadneho pacienta liečeného kapecitabínom. Zníženie hladín TSH v krvi bolo hlásené u 3 (1,3 %) pacientov liečených sunitinibom a nebolo hlásené u žiadneho pacienta liečeného kapecitabínom. Zvýšenie hladín T4 bolo hlásené u 2 (0,8 %) pacientov liečených sunitinibom a u 1 (0,4 %) pacienta liečeného kapecitabínom. Zvýšenie hladín T3 bolo hlásené u 1 (0,8 %) pacienta liečeného sunitinibom a nebolo hlásené u žiadneho pacienta liečeného kapecitabínom. Všetky hlásené príhody súvisiace so štítnou žľazou boli 1. – 2. stupňa (pozri časť 4.4).
Poruchy metabolizmu a výživyU pacientov s pNET bola hlásená vyššia miera incidencie hypoglykemických udalostí v porovnaní
s pacientami s MRCC a GIST. Väčšina týchto nežiaducich udalostí pozorovaných v klinických
skúšaniach sa však nepovažuje za súvisiacu s liečbou v rámci skúšania (pozri časť 4.4).
Poruchy nervového systémuV klinických skúšaniach so sunitinibom a po uvedení lieku na trh bolo u pacientov hlásených niekoľko prípadov (< 1 %), niektoré z nich smrteľné, v ktorých sa udávali záchvaty a prítomnosť rádiologicky potvrdeného RPLS. Záchvaty sa pozorovali u pacientov s rádiologicky potvrdenými metastázami do mozgu alebo bez nich (pozri časť 4.4).
Poruchy srdca a srdcovej činnostiV klinických skúšaniach boli poklesy ejekčnej frakcie ľavej komory (left ventricular ejection fraction,
LVEF) o ≥ 20 % a pod dolnú hranicu normy hlásené u približne 2 % pacientov s GIST liečených
sunitinibom, u 4 % pacientov s MRCC rezistentným na cytokíny a u 2 % pacientov s GIST, ktorí
užívali placebo. Tieto poklesy LVEF nejavili známky progresie a často sa upravili pri pokračovaní
liečby. V štúdii s predtým neliečeným MRCC malo 27 % pacientov liečených sunitinibom a 15 %
pacientov liečených INF-α hodnotu LVEF pod dolnou hranicou normy. Dvom pacientom (< 1 %),
ktorí dostávali sunitinib, bolo diagnostikované CHF.
U pacientov s GIST boli hlásené: „zlyhávanie srdca“, „kongestívne zlyhávanie srdca“ alebo „zlyhanie
ľavej komory“ – konkrétne u 1,2 % pacientov liečených sunitinibom a u 1 % pacientov, ktorí užívali
placebo. V pivotnej štúdii fázy 3 u pacientov s GIST (n = 312) boli smrteľné srdcové reakcie súvisiace
s liečbou hlásené u 1 % pacientov v každej skupine štúdie (t. j. v skupine so sunitinibom a v skupine
s placebom). V štúdii fázy 2 u pacientov s MRCC rezistentným na cytokíny sa u 0,9 % pacientov
vyskytol s liečbou súvisiaci smrteľný infarkt myokardu a v štúdii fázy 3 u predtým neliečených
pacientov s MRCC sa smrteľné srdcové udalosti vyskytli u 0,6 % pacientov v skupine s IFN-α a u 0 %
pacientov v skupine so sunitinibom. V štúdii fázy 3 u pacientov s pNET sa u jedného (1 %) pacienta,
ktorý dostával sunitinib, vyskytlo smrteľné zlyhanie srdca súvisiace s liečbou.
Poruchy cievHypertenziaV klinických skúšaniach bola hypertenzia veľmi častou nežiaducou reakciou. Dávka sunitinibu bola
znížená alebo jeho podávanie dočasne prerušené približne u 2,7 % pacientov, u ktorých sa
vyskytla hypertenzia. U žiadneho z týchto pacientov nebola liečba sunitinibom natrvalo ukončená.
U 4,7 % pacientov so solídnymi nádormi sa vyskytla závažná hypertenzia (> 200 mmHg systolického
alebo 110 mmHg diastolického tlaku krvi). Hypertenzia bola hlásená približne u 33,9 % pacientov,
ktorí dostávali sunitinib na liečbu predtým neliečeného MRCC, v porovnaní s 3,6 % pacientov liečených IFN-α. Závažná hypertenzia bola hlásená u 12 % predtým neliečených pacientov užívajúcich sunitinib a u < 1 % pacientov liečených IFN-α. Hypertenzia bola hlásená u 26,5 %
pacientov užívajúcich sunitinib v štúdii fázy 3 s pNET v porovnaní so 4,9 % pacientov užívajúcich
placebo. Závažná hypertenzia bola hlásená u 10 % pacientov s pNET užívajúcich sunitinib a u 3 %
pacientov užívajúcich placebo.
Venózne trombembolické príhody Venózne trombembolické príhody súvisiace s liečbou boli hlásené u približne 1,0 % pacientov
so solídnymi nádormi, ktorí dostávali sunitinib v rámci klinických skúšaní, vrátane GIST a RCC.
U siedmich pacientov (3 %) užívajúcich sunitinib a u žiadneho pacienta užívajúceho placebo sa
v štúdii fázy 3 s GIST vyskytli venózne trombembolické príhody; u 5 zo 7 išlo o hlbokú venóznu
trombózu (deep venous thrombosis, DVT) 3. stupňa a u 2 išlo o 1. alebo 2. stupeň. Štyria z týchto 7
pacientov s GIST ukončili liečbu po prvom spozorovaní DVT.
U trinástich pacientov (3 %) užívajúcich sunitinib v štúdii fázy 3 na predtým neliečený MRCC
a u 4 pacientov (2 %) v 2 štúdiách s MRCC rezistentným na cytokíny boli hlásené venózne
trombembolické príhody. U deviatich z týchto pacientov sa vyskytla pľúcna embólia; 1 bola 2. stupňa
a 8 bolo 4. stupňa. Osem z týchto pacientov malo DVT; jeden 1. stupňa, dvaja 2. stupňa, štyria
3. stupňa a jeden 4. stupňa. U jedného pacienta s pľúcnou embóliou v štúdii s MRCC rezistentným
na cytokíny bolo prerušené podávanie lieku.
U pacientov s predtým neliečeným MRCC užívajúcich IFN-α bolo hlásených 6 (2 %) venóznych
trombembolických príhod; 1 pacient (< 1 %) mal DVT 3. stupňa a 5 pacientov (1 %) malo pľúcnu
embóliu, všetci 4. stupňa.
V štúdii fázy 3 u pacientov s pNET boli venózne trombembolické príhody hlásené u 1 (1,2 %)
pacienta v skupine so sunitinibom a u 5 (6,1 %) pacientov v skupine s placebom. U dvoch z týchto
pacientov užívajúcich placebo išlo o DVT, pričom u 1 pacienta bola 2. stupňa a u 1 bola 3. stupňa.
V registračných štúdiách u pacientov s GIST, MRCC a pNET neboli hlásené žiadne prípady
so smrteľným koncom. Prípady so smrteľným koncom sa pozorovali po uvedení lieku na trh.
V štúdiách fázy 3 u pacientov, ktorí dostávali sunitinib, sa prípady pľúcnej embólie pozorovali
približne u 3,1 % pacientov s GIST a približne u 1,2 % pacientov s MRCC. V štúdii fázy 3 u pacientov
s pNET, ktorí dostávali sunitinib, nebola hlásená žiadna pľúcna embólia. Zriedkavé prípady
so smrteľným koncom sa pozorovali po uvedení lieku na trh.
Pacienti, u ktorých sa vyskytla pľúcna embólia v predchádzajúcich 12 mesiacoch, boli vylúčení
z klinických skúšaní so sunitinibom.
U pacientov, ktorí dostávali sunitinib v registračných štúdiách fázy 3, boli pľúcne príhody (t. j.
dyspnoe, pleurálny výpotok, pľúcna embólia alebo pľúcny edém) hlásené približne u 17,8 % pacientov
s GIST, približne u 26,7 % pacientov s MRCC a u 12 % pacientov s pNET.
Približne 22,2 % pacientov so solídnymi nádormi, vrátane GIST a MRCC, ktorí v klinických
skúšaniach dostávali sunitinib, malo pľúcne príhody.
Poruchy gastrointestinálneho traktuU pacientov liečených sunitinibom pre GIST alebo MRCC sa pankreatitída sa pozorovala menej často
(< 1 %). V štúdii fázy 3 u pacientov s pNET nebola hlásená žiadna pankreatitída súvisiaca s liečbou
(pozri časť 4.4).
Smrteľné gastrointestinálne krvácanie bolo hlásené u 0,98 % pacientov, ktorí dostávali placebo
v štúdii fázy 3 s GIST.
Poruchy pečene a žlčových ciestBola hlásená hepatálna dysfunkcia, ktorá môže zahŕňať odchýlky testov pečeňových funkcií,
hepatitídu alebo zlyhanie pečene (pozri časť 4.4).
Poruchy kože a podkožného tkanivaBoli hlásené prípady pyoderma gangrenosum, vo všeobecnosti reverzibilné po prerušení liečby
sunitinibom (pozri tiež časť 4.4).
Poruchy kostrovej a svalovej sústavy a spojivového tkanivaBoli hlásené prípady myopatie a/alebo rabdomyolýzy, niektoré s akútnym renálnym zlyhaním.
Pacienti s prejavmi alebo príznakmi svalovej toxicity majú byť liečení štandardnými lekárskymi
postupmi (pozri časť 4.4).
Boli hlásené prípady vytvorenia fistuly, niekedy spojené s nekrózou nádoru a regresiou, v niektorých
prípadoch so smrteľným koncom (pozri časť 4.4).
U pacientov liečených sunitinibom boli hlásené prípady osteonekrózy čeľuste, z ktorých sa väčšina
vyskytla u pacientov, ktorí mali identifikované rizikové faktory pre osteonekrózu čeľuste, zvlášť
expozíciu intravenóznym bifosfonátom a/alebo stomatologické ochorenie v anamnéze vyžadujúce
invazívny stomatologický zákrok (pozri tiež časť 4.4).
Laboratórne a funkčné vyšetreniaÚdaje z predklinických (
in vitro a
in vivo) štúdií pri dávkach vyšších, ako je odporúčaná dávka pre
ľudí, ukazujú, že sunitinib má potenciál inhibovať repolarizačný proces srdcového akčného potenciálu
(napr. predĺženie QT-intervalu).
Predĺženie QTc-intervalu na viac ako 500 ms bolo hlásené u 0,5 % a zmeny o viac ako 60 ms oproti
vstupnej hodnote boli hlásené u 1,1 % zo 450 pacientov so solídnym nádorom; oba z týchto
parametrov sú uznané ako potenciálne signifikantné zmeny. Pri približne dvojnásobných
terapeutických koncentráciách sa ukázalo, že sunitinib predlžuje QTcF-interval (korekcia QT-intervalu
podľa Fridericia).
Predĺženie QTc-intervalu sa skúmalo v skúšaní s 24 pacientmi vo veku 20 – 87 rokov s pokročilými
malignitami. Výsledky tejto štúdie ukázali, že sunitinib mal vplyv na QTc-interval (definovaný ako
priemerná zmena upravená vzhľadom k placebu o > 10 ms s 90 % horným limitom intervalu
spoľahlivosti (confidence interval, CI) > 15 ms) pri terapeutickej koncentrácii (3. deň) pri použití
korekčnej metódy oproti vstupnej hodnote v rámci dňa a pri koncentrácii väčšej, ako je terapeutická
(9. deň) pri použití oboch korekčných metód oproti vstupnej hodnote. Žiaden pacient nemal hodnotu
QTc-intervalu > 500 ms. Hoci sa vplyv na QTcF-interval pozoroval na 3. deň 24 hodín po podaní
dávky (t. j. pri terapeutickej koncentrácii v plazme očakávanej po podaní odporúčanej úvodnej dávky
50 mg) pri použití korekčnej metódy oproti vstupnej hodnote v rámci dňa, klinický význam tohto
nálezu nie je jasný.
Pri použití rozsiahlych sériových vyšetrení EKG v časoch korešpondujúcich buď s terapeutickou,
alebo vyššou ako terapeutickou expozíciou sa u žiadneho z pacientov v hodnotiteľnej alebo
ITT-populácii nepozoroval výskyt predĺženia QTc-intervalu, ktorý by sa považoval za „závažný“ (t. j.
rovný alebo väčší ako 3. stupeň podľa všeobecných terminologických kritérií pre nežiaduce účinky
[common terminology criteria for adverse events, CTCAE] verzia 3.0).
Pri terapeutických koncentráciách v plazme bola maximálna priemerná zmena QTcF-intervalu
(korekcia podľa Fridericia) oproti vstupnej hodnote 9 ms (90 % CI: 15,1 ms). Pri približne
dvojnásobných terapeutických koncentráciách bola maximálna zmena QTcF-intervalu oproti vstupnej
hodnote 15,4 ms (90 % CI: 22,4 ms). Moxifloxacín (400 mg), ktorý sa používal ako pozitívna kontrola, vykazoval maximálnu priemernú zmenu QTcF-intervalu 5,6 ms oproti vstupnej hodnote. Ani
u jedného účastníka nebol účinok na QTc-interval vyšší ako 2. stupeň (CTCAE, verzia 3.0) (pozri časť 4.4).
Dlhodobá bezpečnosť pri MRCCDlhodobá bezpečnosť sunitinibu u pacientov s MRCC sa analyzovala v 9 ukončených klinických
skúšaniach, realizovaných v prvej línii liečby u pacientov refraktérnych na bevacizumab a cytokíny.
Analýza zahŕňala 5 739 pacientov, z ktorých sa 807 (14 %) liečilo ≥ 2 roky až 6 rokov. U tých
807 pacientov, ktorí sa dlhodobo liečili sunitinibom, sa väčšina nežiaducich reakcií súvisiacich
s liečbou (treatment-related adverse events, TRAE) po prvýkrát zaznamenala v rámci prvých
6 mesiacov až 1 roka a potom boli stabilné alebo sa ich frekvencia časom znižovala. Výnimkou bola
hypotyreóza, ktorej výskyt časom postupne narastal, pričom sa počas 6-ročného obdobia
zaznamenávali nové prípady. Neukázalo sa, že by sa predĺžená liečba sunitinibom spájala s novými
typmi TRAE.
Pediatrická populáciaBezpečnostný profil sunitinibu bol stanovený na základe štúdie fázy 1 so zvyšujúcou sa dávkou sunitinibu, otvorenej štúdie fázy 2, štúdie fázy 1/2 s jednou liečebnou skupinou a na základe publikácií, ako je uvedené nižšie.
Štúdia fázy 1 so zvyšujúcou sa dávkou perorálneho sunitinibu sa uskutočnila u 35 pacientov, z ktorých bolo 30 pediatrických pacientov (vo veku od 3 do 17 rokov) a 5 mladých dospelých pacientov (vo veku od 18 do 21 rokov) s refraktérnymi solídnymi nádormi, pričom u väčšiny z nich sa primárne diagnostikoval mozgový nádor. U všetkých účastníkov štúdie došlo k nežiaducim reakciám na liek;
väčšina z týchto reakcií bola závažná (stupeň toxicity
≥ 3) a zahŕňala aj srdcovú toxicitu. Najčastejšie sa vyskytujúce nežiaduce reakcie boli gastrointestinálna (GI )toxicita, neutropénia, únava a zvýšenie ALT. Riziko srdcových nežiaducich reakcií na liek sa ukázalo byť vyššie u tých pediatrických
pacientov, ktorí boli predtým vystavení ožarovaniu srdca alebo antracyklínu, v porovnaní s pediatrickými pacientmi bez predchádzajúcej expozície. U týchto pediatrických pacientov, ktorí predtým neboli vystavení antracyklínom alebo ožarovaniu srdca, bola identifikovaná maximálna tolerovaná dávka (pozri časť 5.1).
Otvorená štúdia fázy 2 sa uskutočnila u 29 pacientov, z ktorých bolo 27 pediatrických pacientov (vo veku od 3 do 16 rokov) a 2 mladých dospelých pacientov (vo veku od 18 do 19 rokov) s rekurentným/progresívnym/refraktórnym vysokomalígnym gliómom (high grade glioma, HGG) alebo ependymómom. Ani v jednej skupine sa nevyskytli nežiaduce reakcie stupňa 5. Najčastejšie (≥10 %) nežiaduce udalosti súvisiace s liečbou boli znížený počet neutrofilov (6 [20,7%] pacientov) a intrakraniálne krvácanie (3[10,3%] pacientov).
Štúdia fázy 1/2 s jednou liečebnou skupinou sa uskutočnila u 6 pediatrických pacientov (vo veku od 13 do 16 rokov) s pokročilým neresekovateľným GIST. Najčastejšie nežiaduce reakcie boli hnačka, nauzea, znížený počet leukocytov, neutropénia a bolesť hlavy u 3 (50,0 %) pacientov, každá so stupňom závažnosti najmä 1 alebo 2. U štyroch zo 6 pacientov (66,7 %) sa v súvislosti s liečbou vyskytli nežiaduce reakcie stupňa 3-4 (hypofosfatémia, neutropénia a trombocytopénia stupňa 3 u 1 pacienta a neutropénia stupňa 4 u 1 pacienta). V tejto štúdii neboli hlásené žiadne závažné nežiaduce udalosti alebo nežiaduce reakcie stupňa 5. V klinickej štúdii, ako aj v publikáciách bezpečnostný profil zodpovedal známemu bezpečnostnému profilu u dospelých.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 PredávkovanieNeexistuje žiadne špecifické antidotum na predávkovanie Sunitinibom Sandoz a liečba predávkovania má spočívať vo všeobecných podporných opatreniach. V indikovaných prípadoch sa môže odstránenie
neabsorbovaného liečiva dosiahnuť vracaním alebo výplachom žalúdka. Boli hlásené prípady
predávkovania; niektoré prípady boli spojené s nežiaducimi reakciami v súlade so známym
bezpečnostným profilom sunitinibu.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: cytostatiká, inhibítory proteínkinázy, ATC kód: L01XE04
Mechanizmus účinkuSunitinib inhibuje početné RTK, ktoré sa podieľajú na raste nádoru, neoangiogenéze a metastatickom
šírení nádoru. Sunitinib bol identifikovaný ako inhibítor receptorov pre doštičkový rastový faktor
(PDGFRα a PDGFRβ), receptorov pre rastový faktor cievneho endotelu (VEGFR1, VEGFR2
a VEGFR3), receptoru pre faktor kmeňových buniek (KIT), tyrozínkinázy 3 podobnej Fms (FLT3),
receptoru pre faktor stimulujúci kolónie (CSF - 1R) a receptoru pre neurotrofický faktor odvodený od
gliálnej línie buniek (RET). V biochemických a bunkových testoch vykazuje primárny metabolit
podobnú účinnosť ako sunitinib.
Klinická účinnosť a bezpečnosťKlinická bezpečnosť a účinnosť sunitinibu bola skúmaná v liečbe pacientov s GIST, ktorí boli
rezistentní voči imatinibu (t.j. počas alebo po liečbe imatinibom u nich došlo k progresii ochorenia), alebo neznášali imatinib (t.j. počas liečby imatinibom u nich vznikli prejavy závažnej toxicity, ktoré
znemožnili pokračovať v liečbe), v liečbe pacientov s MRCC a liečbe pacientov s neresekovateľným
pNET.
Účinnosť je pri GIST založená na čase do progresie nádoru (time to tumour progression, TTP)
a zlepšení prežívania, u pacientov s predtým neliečeným MRCC na prežívaní bez progresie
(progression-free survival, PFS), resp. na miere objektívnej odpovede (objective response rates, ORR)
pri MRCC rezistentnom na cytokíny a na PFS u pacientov s pNET.
Gastrointestinálne stromálne tumoryU pacientov s GIST po zlyhaní liečby imatinibom (medián maximálnej dennej dávky 800 mg)
v dôsledku rezistencie alebo intolerancie bola vykonaná počiatočná otvorená štúdia so stúpajúcimi
dávkami sunitinibu. Deväťdesiatsedem pacientov bolo zaradených do štúdie pri rôznom dávkovaní
a schémach podávania; 55 pacientov dostávalo 50 mg sunitinibu v odporúčanej liečebnej Schéme
4 týždne liečba /2 týždne prestávka („Schéma 4/2“).
Medián TTP bol v tejto štúdii 34 týždňov (95 % CI: 22,0, 46,0).
U pacientov s GIST, ktorí neznášali imatinib alebo u nich počas alebo po tejto liečbe ochorenie
progredovalo (medián maximálnej dennej dávky imatinibu - 800 mg), bola vykonaná randomizovaná,
dvojito zaslepená, placebom kontrolovaná štúdia 3. fázy so sunitinibom. V tejto štúdii bolo
randomizovaných 312 pacientov (2 : 1) na perorálne podávanie 50 mg sunitinibu alebo placeba raz za
deň v Schéme 4/2 až do progresie ochorenia alebo do vyradenia zo štúdie kvôli inej príčine
(207 pacientov dostávalo sunitinib, 105 pacientov placebo). Primárny cieľ v rámci hodnotenia
účinnosti v tejto štúdii bol TTP definovaný ako čas od randomizácie po prvý objektívny dôkaz
progresie nádoru. V čase vopred stanovenej predbežnej analýzy bol medián TTP pri liečbe
sunitinibom 28,9 týždňa (95 % CI: 21,3, 34,1) podľa hodnotenia investigátorov a 27,3 týždňa
(95 % CI: 16,0, 32,1) podľa hodnotenia nezávislej komisie a zároveň bol štatisticky signifikantne dlhší
ako TTP pri liečbe placebom 5,1 týždňa (95 % CI: 4,4, 10,1) podľa hodnotenia investigátorov a
6,4 týždňa (95 % CI: 4,4, 10,0) podľa hodnotenia nezávislej komisie. Rozdiel v celkovom prežívaní
(overall survival, OS) vychádzal štatisticky v prospech sunitinibu [miera rizika [hazard ratio (HR):
0,491; (95 % CI: 0,290, 0,831)]; riziko úmrtia bolo v skupine s placebom dvakrát vyššie v porovnaní
so skupinou so sunitinibom.
Po predbežnej analýze účinnosti a bezpečnosti na základe odporúčania nezávislej komisie na
monitorovanie dát a bezpečnosti (data and safety monitoring board, DSMB) bola štúdia odslepená
a pacientom v skupine s placebom bola ponúknutá otvorená liečba sunitinibom.
V otvorenej fáze štúdie dostávalo sunitinib celkovo 255 pacientov vrátane 99 pacientov, ktorí boli
pôvodne liečení placebom.
Analýza primárnych a sekundárnych cieľov v otvorenej fáze štúdie opakovane potvrdila výsledky
získané v čase predbežnej analýzy, ako je uvedené v Tabuľke 2:
Tabuľka 2. Súhrn cieľov účinnosti (ITT populácia) pre GIST
| Dvojito zaslepená liečbaa
|
| Medián (95% CI)
| Miera rizika
| Liečebná
skupina
s placebom
s prestupom na
aktívnu liečbub
|
Cieľ
| Sunitinib
| Placebo
| (95% CI)
|
Hodnota
p
|
Primárny
|
|
TTP (týždne)
|
|
Predbežná analýza
| 27,3 (16,0, 32,1)
| 6,4 (4,4, 10,0)
| 0,329 (0,233, 0,466)
| <0,001
| -
|
Finálna analýza
| 26,6 (16,0, 32,1)
| 6,4 (4,4, 10,0)
| 0,339 (0,244, 0,472)
| <0,001
| 10,4 (4,3, 22,0)
|
Sekundárny
|
|
PFS (týždne)c
|
|
Predbežná analýza
| 24,1 (11,1, 28,3)
| 6,0 (4,4, 9,9)
| 0,333 (0,238, 0,467)
| <0,001
| -
|
Finálna analýza
| 22,9 (10,9, 28,0)
| 6,0 (4,4, 9,7)
| 0,347 (0,253, 0,475)
| <0,001
| -
|
ORR (%)d
|
|
Predbežná analýza
| 6,8 (3,7, 11,1)
| 0 (-)
| NA
| 0,006
| -
|
Finálna analýza
| 6,6 (3,8, 10,5)
| 0 (-)
| NA
| 0,004
| 10,1 (5,0, 17,8)
|
OS (týždne)e
|
|
Predbežná analýza
| -
| -
| 0,491 (0,290, 0,831)
| 0,007
| -
|
Finálna analýza
| 72,7 (61,3, 83,0)
| 64,9 (45,7, 96,0)
| 0,876 (0,679, 1,129)
| 0,306
| -
|
Skratky: CI = interval spoľahlivosti; ITT = intent-to-treat; NA = neaplikovateľné; ORR = miera objektívnej odpovede;
OS = celkové prežívanie; PFS = prežívanie bez progresie; TTP = čas do progresie nádoru.
a Výsledky dvojito zaslepenej liečby pochádzajú z ITT populácie s použitím merania centrálneho rádiológa tam, kde to bolo vhodné.
b Výsledky účinnosti pre 99 subjektov, ktorým bola zmenená liečba z placeba na sunitinib po odslepení. Vstupné hodnoty boli vymazané v čase zmeny liečby a analýza účinnosti je založená na hodnotení investigátorov.
c Predbežné hodnoty PFS boli aktualizované na základe prepočítania pôvodných údajov.
d Výsledky pre ORR sú udávané ako percento pacientov, u ktorých bola potvrdená odpoveď v rámci 95 % CI.
e Medián nebol dosiahnutý, pretože údaje ešte neboli zrelé.
Medián OS v ITT populácii bol 72,7 týždňa v skupine pacientov liečených sunitinibom a 64,9 týždňa
v skupine pacientov na placebe (HR: 0,876; 95 % CI: 0,679, 1,129; p = 0,306). V tejto analýze boli do
liečebného ramena s placebom zaradení aj pacienti pôvodne randomizovaní na placebo, ktorí následne
boli liečení sunitinibom v otvorenej fáze štúdie.
Doteraz neliečený metastatický karcinóm z obličkových buniekRandomizovaná multicentrická medzinárodná štúdia 3. fázy hodnotiaca účinnosť a bezpečnosť
sunitinibu v porovnaní s interferónom IFN-α bola vykonaná u pacientov s doteraz neliečeným
karcinómom z obličkových buniek MRCC. Sedemstopäťdesiat pacientov bolo randomizovaných do
liečebných ramien 1:1; pacienti boli liečení buď sunitinibom v opakovaných 6-týždňových cykloch
pozostávajúcich zo 4 týždňov perorálneho podávania 50 mg denne, po ktorých nasledovali 2 týždne
bez liečby (Schéma 4/2), alebo IFN-α podávaným ako subkutánna injekcia s 3 miliónmi jednotiek
(MU) prvý týždeň, 6 MU druhý týždeň a 9 MU tretí týždeň a potom 3-krát týždenne obdeň.
Medián trvania liečby sunitinibom bol 11,1 mesiacov (rozsah: 0,4 - 46,1) a 4,1 mesiacov (rozsah
0,1 - 45,6) pri liečbe IFN-α. S liečbou súvisiace závažné nežiaduce udalosti (treatment related serious
adverse events, TRSAEs) boli hlásené u 23,7 % pacientov liečených sunitinibom a u 6,9 % pacientov
liečených IFN-α. Avšak miera prerušenia z dôvodu nežiaducich udalostí bola 20 % pri sunitinibe
a 23 % pri IFN-α. Prerušenie podávania sa vyskytlo u 202 pacientov (54 %) na sunitinibe
a 141 pacientov (39 %) na IFN-α. Redukcia dávky sa vyskytla u 194 pacientov (52 %) na sunitinibe
a 98 pacientov (27 %) na IFN-α. Pacienti boli liečení do progresie ochorenia alebo do odstúpenia zo
štúdie. Primárnym cieľom hodnotenia účinnosti bolo PFS. Plánovaná priebežná analýza ukázala
štatisticky signifikantnú výhodu pre sunitinib oproti IFN-α, v tejto štúdii medián PFS pre sunitinibom
liečenú skupinu bol 47,3 týždňa v porovnaní s 22,0 týždňami pre skupinu liečenú IFN-α; HR bolo
0,415 (95 % CI = 0,320, 0,539, p-hodnota < 0,001). Ostatné ciele zahŕňali ORR, OS a bezpečnosť.
Centrálne rádiologické vyšetrenia boli pozastavené po dosiahnutí primárneho cieľa. V čase finálnej
analýzy bola ORR stanovená na podklade vyšetrení investigátormi 46 % (95 % CI: 41%, 51%) pre
skupinu so sunitinibom a 12,0 % (95 % CI: 9%, 16%) pre skupinu s IFN-α (p< 0,001).
Liečba sunitinibom bola spojená s dlhším prežívaním v porovnaní s IFN-α. Medián OS bol
114,6 týždňa pre skupinu so sunitinibom (95 % CI: 100,1, 142,9) a 94,9 týždňov pre skupinu s IFN-α
(95 % CI: 77,7, 117,0) pri HR 0,821 (95 % CI: 0,673, 1,001; p = 0,0510 podľa nestratifikovaného
“log-rank“ testu).
Celkové PFS a OS pozorované v ITT populácii, tak ako boli stanovené vyšetrením v centrálnom
rádiologickom laboratóriu, sú zhrnuté v Tabuľke 3:
Tabuľka 3. Súhrn cieľov účinnosti (ITT populácia) u predtým neliečeného mRCCSúhrn výsledkov prežívania bez progresie
| Sunitinib
(N = 375)
| IFN-α
(N = 375)
|
Pacienti, u ktorých ochorenie neprogredovalo,
alebo ktorí nezomreli [n (%)]
| 161 (42,9)
| 176 (46,9)
|
Pacienti, u ktorých bola pozorovaná progresia,
alebo ktorí zomreli [n (%)]
| 214 (57,1)
| 199 (53,1)
|
PFS (týždne)
|
Kvartil (95 % CI)
|
25 %
| 22,7 (18,0, 34,0)
| 10,0 (7,3, 10,3)
|
50 %
| 48,3 (46,4, 58,3)
| 22,1 (17,1, 24,0)
|
75 %
| 84,3 (72,9, 95,1)
| 58,1 (45,6, 82,1)
|
Nestratifikovaná analýza
|
Miera rizika (sunitinib oproti IFN-α)
| 0,5268
|
95 % CI pre mieru rizika
| (0,4316, 0,6430)
|
Hodnota pa
| <0,0001
|
Súhrn výsledkov celkového prežívania
|
Pacienti, o ktorých nie je známe, že zomreli
[n (%)]
| 185 (49,3)
| 175 (46,7)
|
Pacienti, u ktorých bolo zistené úmrtie [n (%)]
| 190 (50,7)
| 200 (53,3)
|
OS (týždne)
|
Kvartil (95 % CI)
|
25 %
| 56,6 (48,7, 68,4)
| 41,7 (32,6, 51,6)
|
50 %
| 114,6 (100,1, 142,9)
| 94,9 (77,7, 117,0)
|
75 %
| NA (NA, NA)
| NA (NA, NA)
|
Nestratifikovaná analýza
|
Miera rizika (sunitinib oproti IFN-α)
| 0,8209
|
95 % CI pre mieru rizika
| (0,6730, 1,0013)
|
Hodnota pa
| 0,0510
|
| | | |
Skratky: CI = interval spoľahlivosti; INF-α = interferón-alfa; ITT = intent-to-treat; n = počet pacientov;
NA = neaplikovateľné; OS = celkové prežívanie; PFS = prežívanie bez progresie.
a Podľa dvojstranného log-rank testu
Metastatický karcinóm z obličkových buniek rezistentný na cytokínyU pacientov refraktérnych na predchádzajúcu cytokínovú liečbu interleukínom 2 alebo IFN-α bola
vykonaná klinická štúdia 2. fázy so sunitinibom. Šesťdesiatim trom pacientom sa podávala úvodná
dávka sunitinibu 50 mg perorálne raz denne počas 4 po sebe nasledujúcich týždňov, po ktorých
nasledovali 2 týždne bez liečby, aby sa zavŕšil kompletný 6-týždňový cyklus (Schéma 4/2).
Primárnym cieľom v rámci hodnotenia účinnosti bola ORR hodnotená na podklade kritérií pre
odpoveď na liečbu u solídnych tumorov (Response Evaluation Criteria in Solid Tumours, RECIST).
V tejto štúdii bola miera objektívnej odpovede 36,5 % (95 % CI: 24,7 %, 49,6 %) a medián TTP bol
37,7 týždňa (95 % CI: 24,0, 46,4).
U pacientov s MRCC refraktérnych na predchádzajúcu cytokínovú liečbu bola vykonaná podporná,'
otvorená, multicentrická štúdia s jednou liečebnou skupinou, ktorá hodnotila účinnosť a bezpečnosť
sunitinibu. Sunitinib sa podával 106 pacientom v dávke minimálne 50 mg denne podľa Schémy 4/2.
Primárnym cieľom v rámci hodnotenia účinnosti bola v tejto štúdii ORR. Sekundárne ciele boli TTP,
trvanie odpovede (duration of response, DR) a OS.
V tejto štúdii bola ORR 35,8 % (95 % CI: 26,8%, 47,5 %). Medián pre DR a OS sa doteraz
nedosiahol.
Pankreatické neuroendokrinné nádoryPodporná otvorená, multicentrická štúdia 2. fázy hodnotila účinnosť a bezpečnosť monoterapie
sunitinibom v dávke 50 mg denne v Schéme 4/2 u pacientov s neresekovateľným pNET. V kohorte
66 pacientov s nádorom z buniek pankreatických ostrovčekov bola primárnym cieľom miera odpovede
17 %.
U pacientov s neresekovateľným pNET sa vykonala pivotná multicentrická, medzinárodná,
randomizovaná, dvojito zaslepená, placebom kontrolovaná štúdia 3. fázy s monoterapiou sunitinibom.
Pacienti, u ktorých sa vyžadovalo, aby mali potvrdenú progresiu za základe RECIST kritérií v rámci
predchádzajúcich 12 mesiacov, boli randomizovaní (1:1) na liečbu buď sunitinibom v dávke 37,5 mg
raz denne bez plánovanej prestávky v liečbe (N = 86) alebo placebom (N = 85).
Primárnym cieľom bolo porovnanie PFS u pacientov užívajúcich sunitinib a u pacientov užívajúcich
placebo. Ostatné ciele zahŕňali OS, ORR, PRO a bezpečnosť.
Demografické charakteristiky skupín liečených sunitinibom a placebom boli porovnateľné. Navyše
malo 49 % pacientov liečených sunitinibom a 52 % pacientov na placebe nefunkčné nádory a 92 %
pacientov v oboch ramenách malo metastázy v pečeni.
Použitie somatostatínových analógov bolo v štúdii povolené.
Celkovo 66 % pacientov na sunitinibe v porovnaní so 72 % pacientov na placebe dostávalo
predchádzajúcu systémovú liečbu. Navyše 24 % pacientov na sunitinibe v porovnaní s 22 % pacientov
na placebe dostávalo analógy somatostatínu.
Pri PFS hodnotenom investigátormi sa pozorovala klinicky signifikantná výhoda sunitinibu oproti
placebu. Medián PFS bol 11,4 mesiacov pre skupinu so sunitinibom v porovnaní s 5,5 mesiacmi pre
skupinu s placebom [HR: 0,418 (95 % CI: 0,263 - 0,662), p = 0,0001]; podobné výsledky sa
pozorovali, ak sa na stanovenie progresie ochorenia použili odvodené vyšetrenia odpovede nádorov
založené na aplikácii RECIST kritérií na merania nádorov investigátormi, ako je uvedené v tabuľke 4.
HR v prospech sunitinibu sa pozorovalo vo všetkých podskupinách pacientov odvodených od
hodnotených vstupných charakteristík vrátane analýzy podľa počtu predchádzajúcich systémových
terapií. Celkovo 29 pacientov v ramene so sunitinibom a 24 pacientov v ramene s placebom neužívalo
predtým žiadnu systémovú terapiu; u týchto pacientov bolo HR pre PFS 0,365 (95 % CI:
0,156 - 0,857), p = 0,0156. Podobne u 57 pacientov v ramene so sunitinibom (vrátane 28 pacientov
s 1 predchádzajúcou systémovou terapiou a 29 pacientov s 2 a viac predchádzajúcimi systémovými
terapiami) a u 61 pacientov v ramene s placebom (vrátane 25 pacientov s 1 predchádzajúcou
systémovou terapiou a 36 pacientov s 2 a viac predchádzajúcimi systémovými terapiami), bolo HR pre
PFS 0,456 (95 % CI: 0,264 - 0,787), p = 0,0036.
Tam, kde progresia bola založená na meraní nádorov udávanom investigátormi a kde všetci pacienti
cenzurovaní pre iné príčiny ako ukončenie štúdie boli považovaní za PFS príhody, sa vykonala
analýza senzitivity PFS. Táto analýza poskytla konzervatívny odhad liečebného efektu sunitinibu
a podporila primárnu analýzu tým, že demonštrovala HR 0,507 (95% CI 0,350 - 0,733), p = 0,000193.
Pivotná štúdia s pankreatickým NET bola predčasne ukončená na odporúčanie nezávislého Výboru pre
monitorovanie liekov (Drug Monitoring Committee) a primárny cieľ sa založil na hodnotení
investigátorov, pričom obe skutočnosti mohli ovplyvniť odhad efektu liečby.
S cieľom vylúčiť skreslenia (bias) v hodnotení PFS založenom na vyšetreniach investigátorov sa
vykonalo BICR skenov; toto hodnotenie potvrdilo hodnotenie investigátorov, ako je uvedené
v tabuľke 4.
Tabuľka 4. Výsledky účinnosti pNET zo štúdie 3. fázyParametre účinnosti
| Sunitinib
(N = 86)
| Placebo
(N = 85)
| Miera rizika
(95% CI)
| Hodnota p
|
Prežívanie bez progresie [medián, mesiace (95% CI)] podľa hodnotenia investigátorov
| 11,4
(7,4, 19,8)
| 5,5
(3,6, 7,4)
| 0,418
(0,263, 0,662)
| 0,0001a
|
Prežívanie bez progresie [medián,
mesiace (95% CI)] podľa
odvodených vyšetrení odpovede
nádorov založených na aplikácii
RECIST kritérií na merania nádorov
investigátormi
| 12,6
(7,4, 16,9)
| 5,4
(3,5, 6,0)
| 0,401
(0,252, 0,640)
| 0,000066a
|
Prežívanie bez progresie [medián,
mesiace (95% CI)] podľa
zaslepeného nezávislého centrálneho
prehodnotenia vyšetrení nádorov
| 12,6
(11,1, 20,6)
| 5,8
(3,8, 7,2)
| 0,315
(0,181, 0,546)
| 0,000015a
|
Celkové prežívanie [sledovanie počas 5 rokov] [medián, mesiace (95% CI)]
| 38,6
(25,6, 56,4)
| 29,1
(16,4, 36,8)
| 0,730
(0,504, 1,057)
| 0,0940a
|
Miera objektívnej odpovede
[%, (95% CI)]
| 9,3
(3,2, 15,4)
| 0
| NA
| 0,0066b
|
Skratky: CI = interval spoľahlivosti, N = počet pacientov; NA = neaplikovateľné,
pNET = pankreatické neuroendokrinné nádory, RECIST = kritériá na hodnotenie odpovede
u solídnych nádorov.
a2-stranný nestratifikovaný log-rank test
bFisherov exaktný test
Obr. 1 Kaplanova-Meierova krivka PFS v štúdii 3. fázy s pNET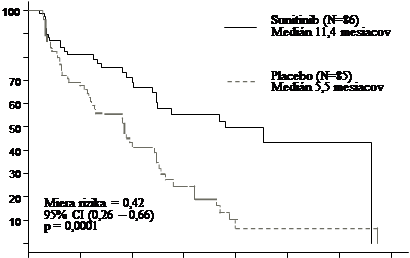
0 3 6 9 12 15 18 21
Čas (mesiace)
Počet pacientov v riziku
Sunitinib 86 88888886oo868688TEVA TEVA 86
| 86
|
| 52
| 34
| 20
| 15
| 4
| 2
|
Placebo 85
| 85
|
| 42
| 20
| 9
| 2
| 2
| 2
|
Skratky: CI = interval spoľahlivosti; N = počet pacientov; PFS = prežívanie bez progresie;
pNET = pankreatické neuroendokrinné nádory.
Údaje o OS neboli zrelé v čase ukončenia štúdie [20,6 mesiacov (95% Cl: 20,6; NR) pre skupinu so
sunitinibom v porovnaní s NR (95% Cl: 15,5; NR) pre skupinu s placebom, HR: 0,409 (95% Cl: 0,187;
0,894), p = 0,204]. V ramene so sunitinibom sa vyskytlo 9 úmrtí a v ramene s placebom 21 úmrtí.
Po progresii ochorenia boli pacienti odslepení a pacientom, ktorí užívali placebo, bola ponúknutá
nezaslepená liečba sunitinibom v samostatnej pokračovacej štúdii. V dôsledku predčasného ukončenia
štúdie bola liečba ostávajúcich pacientov odslepená a bola im ponúknutá nezaslepená liečba
sunitinibom v pokračovacej štúdii. Celkovo 59 z 85 pacientov (69,4%) z ramena s placebom prešlo na
nezaslepenú liečbu sunitinibom po progresii ochorenia alebo pri odslepení v čase predčasného
ukončenia. OS pozorované po 5 rokoch sledovania v pokračujúcej štúdii preukázalo HR 0,730 (95%
Cl: 0,504; 1,057).
Výsledky dotazníka kvality života od Európskej organizácie pre výskum a liečbu rakoviny (European
Organization for Research and Treatment of Cancer Quality of Life Questionnaire, EORTC QLQ-C-
30) ukázali, že celková všeobecná so zdravím súvisiaca kvalita života a 5 funkčných domén (fyzická,
funkčná, kognitívna, emočná a sociálna) sa zachovali u pacientov liečených sunitinibom v porovnaní
s placebom s obmedzenými nežiaducimi symptomatickými prejavmi.
Vykonala sa medzinárodná, multicentrická, jednoramenná, otvorená štúdia fázy 4 hodnotiaca účinnosť
a bezpečnosť sunitinibu u pacientov s progredujúcim, pokročilým/metastatickým, dobre
diferencovaným, neresekovateľným pNET.
Stošesť pacientov (61 pacientov v kohorte bez predchádzajúcej liečby a 45 pacientov v kohorte
neskoršej línie) dostalo perorálne liečbu sunitinibom s dávkou 37,5 mg jedenkrát denne v režime
kontinuálneho denného dávkovania (CDD – continuous daily dosing).
Medián PFS hodnotený skúšajúcim lekárom bol 13,2 mesiaca v celkovej populácii (95 % CI: 10,9;
16,7) aj v kohorte bez predchádzajúcej liečby (95 % CI: 7,4; 16,8).
Pediatrická populáciaSkúsenosti s používaním sunitinibu u pediatrických pacientov sú obmedzené (pozri časť 4.2).
Štúdia fázy 1 so zvyšujúcou sa dávkou perorálneho sunitinibu sa uskutočňila u 35 pacientov, z ktorých bolo 30 pediatrických pacientov (vo veku od 3 do 17 rokov) a 5 mladých dospelých pacientov (vek: 18 až 21 rokov) s refraktérnymi solídnymi nádormi, pričom väčšina z nich mala pri zaradení do štúdie primárne diagnostikovaný mozgový nádor. V prvej časti štúdie sa pozorovala dávku obmedzujúca kardiotoxicita, a preto sa štúdia zmenila tak, aby sa vylúčili pacienti, ktorí boli predtým vystavení potenciálne kardiotoxickým terapiám (vrátane antracyklínov) alebo ožarovaniu srdca. V druhej časti štúdie, do ktorej boli zahrnutí pacienti s predchádzajúcou protinádorovou liečbou, ale bez rizikových faktorov srdcovej toxicity, bol sunitinib vo všeobecnosti tolerovateľný a klinicky manažovateľný v dávke 15 mg/m
2/denne (maximálna tolerovaná dávka) v Schéme 4/2. U žiadneho zo subjektov sa nedosiahla kompletná odpoveď alebo čiastočná odpoveď. Stabilizované ochorenie sa pozorovalo u 6 pacientov (17 %). Jeden pacient s GIST sa zapojil do štúdie na dávkovej úrovni 15 mg/m
2, pričom sa nedokázal žiadny prínos terapie. Celkovo sa pozorovali podobné nežiaduce reakcie na liek ako u dospelých (pozri časť 4.8).
Otvorená štúdia fázy 2 sa uskutočnila u 29 pacientov, z ktorých bolo 27 pediatrických pacientov (vo veku od 3 do 16 rokov) a 2 mladých dospelých pacientov (vo veku od 18 do 19 rokov) s HGG alebo ependymómom. Štúdia bola uzavretá v čase plánovanej priebežnej analýzy z dôvodu nedostatočnej kontroly nad ochorením. Medián PFS bol 2,3 mesiaca v skupine s HGG a 2,7 mesiaca v skupine s ependymómom. Medián celkového OS bol 5,1 mesiaca v skupine s HGG a 12,3 mesiaca v skupine s ependymómom. Najčastejsšie (≥10 %) hlásené nežiaduce udalosti súvisiace s liečbou u pacientov v oboch skupinách boli znížený počet neutrofilov (6 pacientov [20,7 %]) a intrakraniálne krvácanie (3 pacienti [10,3 %]) (pozri časť 4.8).
Výsledky zo štúdie fázy 1/2 s perorálnym sunitinibom, ktorá sa uskutočnila u 6 pediatrických pacientov s GIST vo veku 13 až 16 rokov, ktorí užívali sunitinib podľa Schémy 4/2, v dávkach v rozsahu 15 mg/ m
2 denne až 30 mg/ m
2 denne a dostupné publikované údaje (20 pediatrických alebo mladých dospelých pacientov s GIST) naznačujú, že liečba sunitinibom viedla k stabilizácii ochorenia u 18 z 26 (69,2 %) pacientov, či už po zlyhaní liečby alebo intolerancii imatinibu (16 pacientov z 21 so stabilným ochorením) alebo de novo/po chirurgickom zákroku (2 pacienti z 5 so stabilným ochorením). V štúdii fázy 1/2 bolo pozorované stabilné ochorenie a progresia ochorenia u 3 zo 6 pacientov (1 pacient dostával neo adjuvans a 1 pacient dostával adjuvans imatinib, v tomto poradí). V tej istej štúdii sa u 4 zo 6 pacientov (66,7 %) vyskytli v súvislosti s liečbou nežiaduce udalosti stupňa 3-4 (hypofosfatémia, neutropénia a trombocytopénia stupňa 3 u 1 pacienta a neutropénia stupňa 4 u 1 pacienta). Okrem toho boli v publikáciách u 5 pacientov hlásené nasledovné nežiaduce reakcie stupňa 3: únava (2), gastrointestinálne nežiaduce reakcie (vrátane hnačky) (2), hematologické nežiaduce reakcie (vrátane anémie) (2), cholecystitída (1), hypertyreoidizmus (1) a mukozitída (1).
Uskutočnila sa populačná farmakokinetická (FK) a farmakokinetická/farmakodynamická (FK/FD) analýza za účelom extrapolovať FK a kľúčové cieľové ukazovatele bezpečnosti a účinnosti sunitinibu u pediatrických pacientov s GIST (vek: 6 až 17 rokov). Táto analýza bola založená na údajoch získaných od dospelých pacientov s GIST alebo solídnymi nádormi a od pediatrických pacientov so solídnymi nádormi. Na základe modelových analýz sa ukázalo, že nižší vek a menšia veľkosť tela nemajú negatívny vplyv na bezpečnosť a účinnosť vo vzťahu k plazmatickej expozícii sunitinibu. Neukázalo sa, že by bol pomer prínosu a rizika pre sunitinib negatívne ovplyvnený nižším vekom a menšou veľkosťou tela, a na tento pomer mala hlavný vplyv plazmatická expozícia lieku.
EMA udelila výnimku z povinnosti predložiť výsledky štúdií s referenčným liekom obsahujúcim sunitinib vo všetkých podskupinách pediatrickej populácie pre liečbu karcinómu z obličkových buniek alebo karcinómu obličkovej panvičky (okrem nefroblastómu, nefroblastomatózy, jasnobunkového sarkómu, mezoblastického nefrómu, renálneho medulárneho karcinómu a rabdoidného tumoru obličky) (pozri časť 4.2).
EMA udelila výnimku z povinnosti predložiť výsledky štúdií s referenčným liekom obsahujúcim sunitinib vo všetkých podskupinách pediatrickej populácie pre liečbu gastroenteropankreatických neuroendokrinných tumorov (okrem neuroblastómu, neuroganglioblastómu a feochromocytómu) (pozri časť 4.2).
5.2 Farmakokinetické vlastnostiFarmakokinetika sunitinibu bola hodnotená u 135 zdravých dobrovoľníkov a 266 pacientov so
solídnymi nádormi. Farmakokinetika bola podobná u celej sledovanej populácie so solídnymi nádormi
a u zdravých dobrovoľníkov.
Pri rozpätí dávok od 25 mg do 100 mg proporcionálne s dávkou rastie plocha pod krivkou plazmatickej koncentrácie v čase (AUC = area under curve) a C
max. Pri opakovanom dennom podávaní sa sunitinib kumuluje 3- až 4-násobne, jeho primárny metabolit sa kumuluje 7- až 10-násobne. Koncentrácie sunitinibu v rovnovážnom stave a jeho primárneho metabolitu sa dosiahnu do 10 až 14 dní. Na 14. deň sú kombinované plazmatické koncentrácie sunitinibu a jeho aktívneho metabolitu 62,9 - 101 ng/ml, čo predstavujú cieľové koncentrácie predpokladané z predklinických údajov na inhibíciu receptorovej fosforylácie
in vitro, ktorá vedie
in vivo k zastaveniu/redukcii rastu nádorov. Primárny aktívny metabolit tvorí 23 % až 37 % celkovej expozície. Pri opakovanom dennom podávaní alebo opakovaných liečebných cykloch v testovaných dávkových režimoch sa nepozorovali žiadne signifikantné zmeny farmakokinetiky sunitinibu alebo jeho primárneho aktívneho metabolitu.
AbsorpciaPo perorálnom podaní sunitinibu sa C
max obvykle pozoruje po 6 - 12 hodinách času do maximálnej
koncentrácie (t
max) po podaní.
Potrava neovplyvňuje biologickú dostupnosť sunitinibu.
DistribúciaV
in vitro testoch sa sunitinib, resp. jeho primárny aktívny metabolit viazal na bielkoviny ľudskej
plazmy v 95 %, resp. 90 % bez evidentnej závislosti od koncentrácie. Zdanlivý distribučný objem
sunitinibu (Vd) bol veľký – 2230 l, čo svedčí o distribúcii do tkanív.
Metabolické interakcieIn vitro kalkulované hodnoty Ki pre všetky cytochrómové testované izoformy P450 (CYP) (CYP1A2,
CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4/5 a CYP4A9/11)
ukazujú, že je nepravdepodobné, aby sunitinib a jeho primárny aktívny metabolit indukovali,
v akomkoľvek klinicky významnom rozsahu, metabolizmus iných liečiv, ktoré by mohli byť
metabolizované týmito enzýmami.
BiotransformáciaSunitinib je primárne metabolizovaný prostredníctvom CYP3A4, izoformy CYP, pričom vzniká jeho
primárny aktívny metabolit, deetylsunitinib, ktorý sa takisto ďalej metabolizuje prostredníctvom toho
istého izoenzýmu.
Treba sa vyhnúť súbežnému podávaniu sunitinibu so silným induktormi CYP3A4 alebo inhibítormi,
lebo môžu byť zmenené plazmatické hladiny sunitinibu (pozri časti 4.4 a 4.5).
ElimináciaVylučovanie sa deje predovšetkým prostredníctvom stolice (61 %), vylučovanie nezmeneného liečiva
a jeho metabolitov obličkami dosahuje 16 % podanej dávky. Sunitinib a jeho primárny aktívny
metabolit boli hlavnými zlúčeninami, ktoré boli identifikované v plazme, moči a stolici, čo
predstavovalo 91,5 %, 86,4 %, resp. 73,8 % rádioaktivity v odobratých vzorkách. Menej významné
metabolity boli identifikované v moči a stolici, ale spravidla sa nezistili v plazme. Celkový klírens
perorálnej dávky (CL/F) je 34 – 62 l/h. Po perorálnom podaní zdravým dobrovoľníkom boli
eliminačné polčasy sunitinibu a jeho primárneho aktívneho deetylmetabolitu približne 40 - 60 hodín
a 80 - 110 hodín.
Súbežné podávanie s liekmi, ktoré sú inhibítormi BCRPIn vitro je sunitinib substrátom pre efluxný transportér BCRP. V štúdii A6181038 súbežné podávanie
s gefitinibom, inhibítorom BCRP, nevyústilo do klinicky relevantného účinku na C
max a AUC
sunitinibu alebo celkového lieku (sunitinib + metabolit) (pozri časť 4.5). Táto štúdia bola
multicentrická, otvorená štúdia fázy 1/2 skúmajúca bezpečnosť/tolerovateľnosť, maximálnu
tolerovanú dávku a protinádorovú aktivitu sunitinibu v kombinácii s gefitinibom u pacientov s MRCC.
Ako sekundárny cieľ štúdie sa vyhodnocovala FK gefitinibu (250 mg denne) a sunitinibu (37,5 mg
[1. kohorta, n = 4] alebo 50 mg [2. kohorta, n = 7] denne s režimom 4 týždne s liečbou, po ktorej
nasledovali 2 týždne bez liečby), keď sa podávali súbežne. Zmeny vo farmakokinetických
parametroch sunitinibu nemali žiadny klinický význam a nepoukazovali na žiadne interakcie medzi
liekmi. Avšak vzhľadom na relatívne nízky počet pacientov (tzn. N = 7 + 4) a strednú až veľkú
variabilitu medzi pacientmi v ich farmakokinetických parametroch, sa farmakokinetické zistenia
z tejto štúdie, týkajúce sa interakcie medzi liekmi, musia interpretovať opatrne.
Osobitné skupiny pacientovPorucha funkcie pečeneSunitinib a jeho primárny metabolit sa metabolizujú prevažne v pečeni. Systémové expozície po
jednorazovej dávke sunitinibu boli u jedincov s miernou alebo stredne závažnou (trieda A a B klasifikácie podľa Childa-Pugha) poruchou funkcie pečene podobné v porovnaní s jedincami s normálnou funkciou pečene. Sunitinib sa neskúmal u jedincov so závažnou (trieda C klasifikácie podľa Childa-Pugha) poruchou funkcie pečene.
Zo štúdií u pacientov s nádorovým ochorením boli vylúčení pacienti s hodnotou ALT alebo AST > 2,5
x ULN (upper limit of normal = horný limit normy) alebo s hodnotou >5,0 x ULN, ak bolo zvýšenie
spôsobené metastázami do pečene.
Porucha funkcie obličiekPopulačné farmakokinetické analýzy ukázali, že zdanlivý klírens (CL/F) sunitinibu nebol ovplyvnený
klírensom kreatinínu (CLcr) v rámci meraného rozmedzia (42 - 347 ml/min). Systémové expozície po
podaní jednotlivej dávky sunitinibu boli podobné u pacientov so závažnou poruchou funkcie obličiek
(klírens kreatinínu CLcr < 30 ml/min) v porovnaní s pacientmi s normálnou funkciou obličiek
(CLcr > 80 ml/min). Aj keď sa sunitinib a jeho primárny metabolit neeliminovali prostredníctvom
hemodialýzy u pacientov s ESRD, celkové systémové expozície boli nižšie o 47 % pre sunitinib
a 31 % pre jeho primárny metabolit v porovnaní s pacientmi s normálnou funkciou obličiek.
Hmotnosť, skórePopulačné farmakokinetické analýzy hodnotiace demografické údaje svedčia, že nie sú potrebné
úpravy dávky vzhľadom na hmotnosť alebo skóre ECOG (Eastern Cooperative Oncology Group).
PohlavieDostupné údaje ukazujú, že ženy môžu mať asi o 30 % nižší zdanlivý klírens (CL/F) sunitinibu ako
muži, tento rozdiel však nevyžaduje úpravu dávky.
Pediatrická populáciaSkúsenosti s používaním sunitinibu u pediatrických pacientov sú obmedzené (pozri časť 4.2).
Realizovali sa populačné FK analýzy spojených dátových súborov od dospelých pacientov s GIST
a solídnymi nádormi a pediatrických pacientov so solídnymi nádormi. Uskutočnili sa postupné
kovariančné modelové analýzy na vyhodnotenie účinku veku a veľkosti tela (telesnej hmotnosti alebo
plochy povrchu tela), ako aj iných spoločných premenných na dôležité FK parametre pre sunitinib
a jeho aktívny metabolit. Pokiaľ ide o testované spoločné premenné súvisiace s vekom a veľkosťou
tela bol vek signifikantnou spoločnou premennou pre zdanlivý klírens sunitinibu (čím nižší vek
pediatrického pacienta, tým nižší zdanlivý klírens). Podobne signifikantnou spoločnou premennou
zdanlivého klírensu aktívneho metabolitu bola plocha povrchu tela (čím menšia plocha povrchu tela, tým nižší zdanlivý klírens).
Okrem toho, na základe integrovaných populačných farmakokinetických analýz zozbieraných údajov z 3 pediatrických štúdií (2 pediatrické štúdie so solídnym tumorom a 1 pediatrická štúdia s GIST; vek: 6 rokov až 11 rokov a 12 rokov až 17 rokov) bola vychodisková hodnota plochy povrchu tela (body surface area, BSA) signifikantnou spoločnou premennou pre zdanlivý klírens sunitinibu a jeho aktívneho metabolitu. Na základe tejto analýzy sa očakáva, že pri dávke približne 20 mg/m
2 denne u pediatrických pacientov s hodnotami BSA medzi 1,10 a 1,87 m
2 budú plazmatické expozície sunitinibu a jeho aktívnemu metabolitu porovnateľné (medzi 75 a 125 % AUC) s tými, ktoré sú pozorované u dospelých s GIST, ktorí užívajú sunitinib 50 mg denne podľa Schémy 4/2 (AUC 1233 ng.hod/ml). V pediatrických štúdiách bola začiatočná dávka sunitinibu 15 mg/m
2 (na základe maximálnej tolerovanej dávky identifikovanej v štúdii fázy 1 so zvyšujúcou sa dávkou sunitinibu, pozri časť 5.1), ktorá sa u pediatrických pacientov s GIST zvýšila na 22,5 mg/m
2 a následne na 30 mg/m
2 (nepresiahla celkovú dávku 50 mg/deň) v závislosti od individuálnej bezpečnosti a znášanlivosti pacientom. Okrem toho, podľa publikovanej literatúry u pediatrických pacientov s GIST sa vypočítaná začiatočná dávka pohybovala v rozsahu 16,6 mg/m
2 až 36 mg/m
2, zvýšená na dávku 40,4 mg/m
2 (nepresiahla celkovú dávku 50 mg/deň).
5.3 Predklinické údaje o bezpečnostiV štúdiách toxicity na potkanoch a opiciach boli pri opakovanom podávaní v trvaní do 9 mesiacov
primárne účinky na cieľové orgány zistené v tráviacom trakte (vracanie a hnačka u opíc);
v nadobličkách (kortikálna kongescia a/alebo hemorágia u potkanov a opíc, s nekrózou a následnou
fibrózou u potkanov); v hemolymfopoetickom systéme (hypocelularita kostnej drene a lymfoidná
deplécia týmu, sleziny a lymfatických uzlín); v exokrinnej časti pankreasu (degranulácia acinárnych
buniek s nekrózou jednotlivých buniek); v slinných žľazách (acinárna hypertrofia); v kostných
spojeniach (zhrubnutie rastových platničiek); v maternici (atrofia); a vo vaječníkoch (spomalený vývoj
folikulov). Všetky tieto nálezy sa vyskytli pri klinicky relevantných expozičných plazmatických
hladinách sunitinibu. Ďalšie účinky pozorované v iných štúdiách zahŕňali: predĺženie QTc intervalu,
pokles LVEF a atrofiu semenníkových tubulov, zmnoženie mezangia v obličke, hemorágie v
tráviacom trakte a na sliznici úst a hypertrofiu buniek prednej hypofýzy. Predpokladá sa, že zmeny na
maternici (atrofia endometria) a rastovej platničke kostí (zahustenie epifyzárnej chrupavky alebo
dysplázia chrupavky) súvisia s farmakologickým účinkom sunitinibu. Väčšina týchto prejavov bola
reverzibilná po 2 až 6 týždňoch bez liečby.
GenotoxicitaGenotoxický potenciál sunitinibu bol hodnotený
in vitro a
in vivo. Sunitinib nebol mutagénny pre
baktérie pri metabolickej aktivácii v pečeni potkanov.
In vitro nevyvolal sunitinib štrukturálne
chromozómové aberácie v lymfocytoch z periférnej krvi človeka.
In vitro sa pozorovala na
lymfocytoch z periférnej krvi človeka polyploidia (numerické chromozómové aberácie) v prítomnosti
aj neprítomnosti metabolickej aktivácie. U potkanov nebol sunitinib
in vivo klastogénny v kostnej
dreni. Hlavný aktívny metabolit sa nehodnotil z hľadiska genotoxického potenciálu.
KarcinogenitaV 1-mesačnej štúdii pre stanovenie rozmedzia perorálnej dávky CDD (v dávkach 0, 10, 25, 75 alebo 200 mg/kg/deň) žalúdočnou sondou pri kontinuálnom dennom podávaní u rasH2 transgénnych myší sa pri najvyššej testovanej dávke (200 mg/kg/deň) pozoroval karcinóm a hyperplázia Brunnerovych žliaz duodena.
U rasH2 transgénnych myší bola uskutočnená 6-mesačná štúdia karcinogenity s použitím žalúdočnej sondy s denným podávaním (v dávkach 0, 8, 25, 75 [znížená na 50]mg/kg/deň). Gastroduodenálne karcinómy, zvýšený výskyt sprievodných hemangiosarkómov a/alebo hyperplázia sliznice žalúdka boli pozorované pri dávkach ≥ 25 mg/kg/deň následne po 1- až 6-mesačnej dobe podávania (≥ 7,3-násobok AUC u pacientov, ktorým sa podávala odporúčaná denná dávka - recommended daily dose [RDD]).
V 2-ročnej štúdii zameranej na karcinogenicitu u potkanov (v dávkach 0, 0,33, 1 alebo 3 mg/kg/deň)
malo podávanie sunitinibu počas 28-dňového cyklu s následnou 7-dňovou prestávkou v liečbe za
následok zvýšenie incidencie feochromocytómu a hyperpláziu drene nadobličky potkanov mužského
pohlavia pri dávke 3 mg/kg/deň po > 1-ročnom podávaní (≥ 7,8-násobok AUC u pacientov liečených
odporúčanou dennou dávkou). Nádor Brunnerových žliaz duodéna sa objavil u samíc pri dávke
≥ 1 mg/kg/deň a u samcov pri dávke 3 mg/kg/deň a hyperplázia buniek sliznice v žľazovom tkanive
žalúdka bola evidentná u samcov pri dávke 3 mg/kg/deň, čo predstavuje ≥ 0,9-, 7,8- a 7,8-násobok
AUC v uvedenom poradí u pacientov, ktorým sa podávala odporúčaná denná dávka. Význam
malígnych nálezov pozorovaných u (rasH2 transgénnych) myší a potkanov v rámci štúdií
karcinogenicity počas liečby sunitinibom pre človeka nie je známy.
Reprodukčná a vývojová genotoxicitaV štúdiách reprodukčnej toxicity sa nepozorovalo žiadne ovplyvnenie fertility samcov alebo samíc.
Avšak v štúdiách toxicity na potkanoch a opiciach sa pri opakovanom podávaní pri dosiahnutí klinicky
významných systémových expozičných hladín pozorovalo ovplyvnenie fertility samíc vo forme
folikulárnej atrézie, degenerácie žltých teliesok, zmien na endometriu v maternici a poklese hmotnosti
maternice a vaječníkov. Pri plazmatických expozičných hladinách predstavujúcich 25-násobok
systémovej expozície u ľudí sa pozorovalo ovplyvnenie fertility potkaních samcov vo forme
tubulárnej atrofie v semenníkoch, zníženia počtu spermatozoí v nadsemenníkoch a koloidnej deplécie
v prostate a semenných vačkoch.
U potkanov bola zjavná embryonálno-fetálna mortalita vo forme signifikantného poklesu živých
plodov, zvýšeného počtu resorpcií, zvýšenia postimplantačných strát a celkovej straty vrhu
u 8 z 28 gravidných samíc pri plazmatických expozičných hladinách predstavujúcich 5,5-násobok
systémovej expozície u ľudí. U králikov došlo pri plazmatických expozičných hladinách
predstavujúcich 3-násobok systémovej expozície u ľudí k poklesu hmotnosti gravidnej maternice
a počtu živých plodov v dôsledku zvýšeného počtu resorpcií, zvýšených postimplantačných strát, ako
aj celkovej straty vrhu u 4 zo 6 gravidných samíc. Liečba sunitinibom počas organogenézy viedla
u potkanov k vývojovým chybám pozostávajúcim zo zvýšenej incidencie malformácií kostry plodu,
charakterizovaných predovšetkým ako spomalená osifikácia hrudných/bedrových stavcov, ktoré sa
vyskytli pri plazmatických expozičných hladinách predstavujúcich 5,5-násobok systémovej expozície
u ľudí. U králikov predstavovali vývojové chyby častejší výskyt rázštepu pery pri plazmatických
expozičných hladinách približne rovnakých ako hladiny pozorované v klinickej praxi; a rázštep pery
a podnebia sa vyskytol častejšie pri plazmatických expozičných hladinách predstavujúcich
2,7-násobok systémovej expozície u ľudí.
Sunitinib (v dávkach 0,3; 1,0; 3,0 mg/kg/deň) bol hodnotený v štúdii zameranej na pre- a postnatálny
vývoj u gravidných potkanov. Počas gestácie a laktácie sa znížili prírastky telesnej hmotnosti samíc
pri dávke > 1 mg/kg/deň, ale nepozorovala sa žiadna reprodukčná toxicita u samíc až do
3 mg/kg/deň (odhadovaná expozícia > 2,3-násobok AUC u pacientov, ktorým sa podávala odporúčaná
denná dávka). Pri dávke 3 mg/kg/deň sa u mláďat pozoroval pokles telesnej hmotnosti počas obdobia
pred aj po odstavení. Žiadna vývojová toxicita sa nepozorovala pri dávke 1 mg/kg/deň (približná
expozícia > 0,9-násobok AUC u pacientov, ktorým sa podávala odporúčaná denná dávka).
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokObsah kapsuly mikrokryštalická celulóza (E460)
manitol (E421)
sodná soľ kroskarmelózy
povidón (E1201)
stearan horečnatý (E470b)
Sunitinib Sandoz 12,5 mg tvrdé kapsulyTelo kapsulyčervený oxid železitý (E172)
oxid titaničitý (E171)
želatína
Potlačová farba, bielašelak
oxid titaničitý (E171)
propylénglykol (E1520)
Sunitinib Sandoz 25 mg tvrdé kapsulyTelo kapsulyčierny oxid železitý (E172)
červený oxid železitý (E172)
žltý oxid železitý (E172)
oxid titaničitý (E171)
želatína
Potlačová farba, bielašelak
oxid titaničitý (E171)
propylénglykol (E1520)
Sunitinib Sandoz 50 mg tvrdé kapsulyTelo kapsulyčierny oxid železitý (E172)
červený oxid železitý (E172)
žltý oxid železitý (E172)
oxid titaničitý (E171)
želatína
Potlačová farba, bielašelak
oxid titaničitý (E171)
propylénglykol (E1520)
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia Škatuľka s Al-OPA/Al/PVC blistrami obsahujúcimi 28, 30, 50, 56, 60, 70, 84, 90, 98, 100, 110, 120 tvrdých kaspúl.
Škatuľka s Al-OPA/Al/PVC perforovanými blistrami s jednotlivými dávkami obsahujúcimi 28 x 1, 30 x 1, 56 x 1, 84 x 1 tvrdú kapsulu.
Škatuľka s fľašami z polyetylénu s vysokou hustotou (HDPE) s polypropylénovým (PP) detským bezpečnostným uzáverom (skrutkovacím uzáverom) obsahujúcimi 30 tvrdých kapsúl.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIISandoz Pharmaceuticals d.d.
Verovškova 57
1000 Ľubľana
Slovinsko
8. REGISTRAČNÉ ČÍSLASunitinib Sandoz 12,5 mg tvrdé kapsuly: 44/0182/19-S
Sunitinib Sandoz 25 mg tvrdé kapsuly: 44/0183/19-S
Sunitinib Sandoz 50 mg tvrdé kapsuly: 44/0184/19-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU06/2019