
é pohotovostné vybavenie a personál vyškolený k jeho používaní.
D
ávkovanie
I
ntravenózne použitie:
Odporúčané dávky SonoVue pre dospelých sú:
· B-režim zobrazovania srdcových komôr, v pokoji alebo pri záťaži: 2 ml.
· Dopplerovské vyšetrenie ciev: 2,4 ml.
V priebehu jedného vyšetrenia sa môže podať aj druhá injekcia odporúčanej dávky, pokiaľ to lekár považuje za potrebné.
Staršípacienti
Odporúčané dávky pre intravenózne podanie platia aj pre starších pacientov.
Pediatrickípacienti
Bezpečnosť a účinnosť SonoVue u pacientov mladších ako 18 rokov nebola doposiaľ preukázaná pre intravenózne podanie a pre použitie pri echokardiografii a pri Dopplerovom vyšetrení ciev.
Intravezikálne použitie:
· Odporúčaná dávka SonoVue u pediatrických pacientov je 1 ml.
Spôsobpodávania
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
Intravenózne použitie:
SonoVue sa musí podať okamžite po natiahnutí do injekčnej striekačky injikovaním do periférnej žily. Po každej injekcii má nasledovať výplach aplikáciou 5 ml injekčného roztoku chloridu sodného
9 mg/ml (0,9%).
Intravezikálne použitie:
Po zavedení sterilného katétra 6F-8F za sterilných podmienok do močového mechúra sa z močového mechúra vyprázdni moč a mechúr sa naplní fyziologickým roztokom (normálny 0,9% sterilný roztok chloridu sodného) približne do 1/3 alebo do 1/2 predpokladaného celkového objemu [(vek v
rokoch + 2) x 30] ml. SonoVue sa potom aplikuje cez urinálny katéter. Po aplikácii SonoVue sa pokračuje v plnení mechúra fyziologickým roztokom až do vtedy, kým pacient nepociťuje nutkanie na
močenie alebo kým sa neobjaví prvý náznak mierneho protitlaku v infúzii. Ultrazvukové zobrazenie močového mechúra a obličiek sa sleduje v priebehu plnenia a vyprázdňovania mechúra. Ihneď po
prvom vyprázdnení mechúra môže byť mechúr opätovne naplnený fyziologickým roztokom a môže tak byť zahájený druhý cyklus naplnenia a vyprázdnenia mechúra bez potreby druhého podania SonoVue. Na zobrazenie močového mechúra, močovodov a obličiek sa pri ultrasonografii močového
traktu s kontrastnou látkou odporúča nízky mechanický index (≤ 0,4).
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Intravenózne podanie SonoVue je kontraindikované u pacientov so zistenou existenciou pravo-ľavých skratov, ťažkou pľúcnou hypertenziou (pľúcny arteriálny tlak > 90 mmHg), nekontrolovanou systémovou hypertenziou a u pacientov so syndrómom dychovej tiesne dospelých.
SonoVue sa nesmie používať v kombinácii s dobutamínom u pacientov s nestabilným stavom kardiovaskulárneho systému, kde je dobutamín kontraindikovaný.
4.4 Osobitné upozornenia a opatrenia pri pouţ ívaní
Reakciazprecitlivenosti
V prípade anafylaktickej reakcie môžu beta blokátory (vrátane očných kvapiek) zhoršiť reakciu. Pacienti nemusia reagovať na obvyklé dávky adrenalínu, používané na liečbu alergickej reakcie.
I
ntravenózne podanie
Pacienti
s
n
estálym
k
ardiopulmnálnym
stavom
EKG sa musí monitorovať aj u vysoko rizikových pacientov, keď je klinicky indikované. Odporúča sa udržiavať pacienta pod prísnym lekárskym dohľadom počas a najmenej 30 minút po podaní SonoVue.
Zvláštna opatrnosť je nutná pri zvažovaní podania SonoVue u pacientov s nedávnym akútnym koronárnym syndrómom alebo s klinicky nestabilnou ischemickou chorobou srdca, vrátane: vyvíjajúceho sa alebo pokračujúceho infarktu myokardu, typickej kľudovej angíny pectoris za posledných 7 dní, výrazného zhoršenia srdcových príznakov za posledných 7 dní, nedávneho zákroku u koronárnej artérie alebo ostatných faktorov naznačujúcich klinickú nestabilitu (napríklad nedávne zhoršenie EKG, laboratórnych alebo klinických výsledkov), akútneho zlyhania srdca, zlyhania srdca triedy III/IV alebo ťažkej arytmie, pretože u týchto pacientov reakcia podobná alergii a/alebo vazodilatačné reakcie môžu viesť k život ohrozujúcim stavom. SonoVue musí byť podávaný u týchto pacientov iba po dôkladnom zvážení rizika/prospechu a v priebehu podávania a po podaní sa musia pozorne monitorovať vitálne funkcie.
Tu sa musí zdôrazniť, že záťažová echokardiografia, ktorá môže napodobniť ischemické epizódy, by mohla potenciálne zvýšiť riziko použitia SonoVue. Preto, ak sa SonoVue použije v súvislosti so stresovou echokardiografiou, pacienti musia mať stabilizované podmienky, teda bez bolesti v hrudníku alebo EKG nálezu v priebehu dvoch predchádzajúcich dní. Okrem toho, EKG a krvný tlak sa musia monitorovať počas kontrastnej SonoVue echokardiografie s farmakologickou záťažou (napr. s dobutamínom).
Chronickáobštrukčnáchorobapľúc
Zvýšená opatrnosť sa odporúča, ak sa SonoVue podáva pacientom s klinicky významným pľúcnym ochorením, vrátane ťažkej chronickej obštrukčnej choroby pľúc.
Ďalšiesprievodnéochorenia
Zvýšená opatrnosť je potrebná pokiaľ sa tento liek podáva pacientom: s akútnou endokarditídou, umelými srdcovými chlopňami, s akútnym systémovým zápalom a/alebo sepsou, so stavmi zvýšenej
zrážavosti a/alebo nedávnou tromboembóliou a obličkovým alebo pečeňovým ochorením v konečnom
štádiu, pretože počet pacientov s vyššie uvedenými ťažkosťami, ktorí boli vystavení pôsobeniu
SonoVue v klinických štúdiách bol obmedzený
Pacientismechanickouventilácioualebosnestabilnýmineurologickýmiochoreniami SonoVue nie je vhodný na použitie u pacientov s umelou pľúcnou ventiláciou a u pacientov s nestabilnými neurologickými ochoreniami.
InterpretáciamikčnejurosonografiesoSonoVueaobmedzeniepoužitia
Pri vyšetrení sa môžu vyskytnúť falošne negatívne prípady, ktoré neboli pri mikčnej ultrasonografii so
SonoVue zistené (pozri časť 5.1).
Technickéodporúčanie
V štúdiách na zvieratách aplikácia echokontrastných látok odhalila biologické nežiaduce účinky (napr. poškodenie endotelových buniek, ruptúra kapilár) pri interakcii s ultrazvukovým lúčom. Aj keď tieto
biologické vedľajšie účinky neboli hlásené u ľudí, pri použití sa odporúča nízky mechanický index.
Pomocnélátky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v dávke, t.j. v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
4.6 Fertilita, gravidita a laktácia
G
r
avidita
Nie sú k dispozícii žiadne klinické údaje o gravidných ženách vystavených účinku SonoVue. Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky na graviditu, embryonálny/fetálny vývoj, pôrod alebo postnatálny vývoj (pozri časť 5.3). Z preventívnych dôvodov je vhodné vyhnúť sa použitiu SonoVue počas tehotenstva.
Laktácia
Nie je známe, či sa fluorid sírový vylučuje do materského mlieka. Avšak na základe rýchleho odbúravania z tela vo vydychovanom vzduchu sa predpokladá, že žena môže začať znova dojčiť za
dve až tri hodiny po podaní Sono Vue.
Fertilita
Nie sú k dispozícii žiadne klinické údaje. Štúdie na zvieratách nenaznačujú škodlivé účinky na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
SonoVue nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Neţ iaduce účinky
Dospelápopulácia–intravenóznepoužitie
Bezpečnosť SonoVue v rámci intravenózneho podania sa vyhodnotila v 58 klinických štúdiách, ktorých sa zúčastnilo 4653 pacientov. Nežiaduce účinky, ktoré boli hlásené v súvislosti
s intravenóznym použitím SonVue boli vo všeobecnosti nezávažné, prechodné a spontánne vymizli
bez trvalých účinkov. Najčastejšie hlásené nežiaduce účinky v priebehu klinických štúdií po intravenóznom podaní sú: bolesť hlavy, reakcia v mieste vpichu a nevoľnosť.
Nežiaduce účinky sa klasifikujú podľa triedy orgánových systémov a frekvencie nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až
< 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
T
rieda orgánových systémov
Poruchy imunitného
Menej časté
(> 1/1 000 aţ < 1/100)
Neţ iaduce účinky
Frekvencia výskytu
Zriedkavé
(> 1/10 000 aţ < 1/1 000)
Neznáme
(z dostupných údajov)
systému Hypersenzitivita*
Psychické poruchy Nespavosť
Poruchy nervového systému
Bolesť hlavy, zmenená citlivosť, závraty, porucha chuti

Bolesť v prínosových
dutinách Vazovagálna reakcia
Poruchy oka Neostré videnie
Poruchy ciev Sčervenanie Hypotenzia
Ochorenie srdca
Poruchy dýchacej
Infarkt myokardu** Ischémia srdečného svalu**
sústavy, hrudníka a mediastína Poruchy gastrointestinálneho traktu
Faryngitída
Nevoľnosť, Bolesť brucha
Poruchy kože Svrbenie,
a podkožného tkaniva
Poruchy kostrovej
a svalovej sústavy a spojivového tkaniva
Celkové poruchy a reakcie v mieste podania Laboratórne
a funkčné vyšetrenia
erytematózna vyrážka
Bolesť chrbta
Hrudný diskomfort, , reakcie v mieste podania, návaly tepla Zvýšená hladina glukózy v krvi
Bolesť na hrudi, bolesť, únava
* V prípadoch pripomínajúcich precitlivenosť sa môže vyskytnúť: začervenanie kože,
bradykardia, hypotenzia, dyspnoe, strata vedomia, srdcová/kardiorespiračná zástava, anafylaktická reakcia, anafylaktoidná reakcia alebo anafylaktický šok.
** V niektorých prípadoch sa počas hypersenzitívnych reakcií u pacientov s neznámym ochorením
koronárnych artérií zaznamenala myokardiálna ischémia a infarkt myokardu.
Vo veľmi zriedkavých prípadoch boli hlásené smrteľné prípady v priamej súvislosti po použití SonoVue. U všetkých týchto pacientov bolo základné riziko hlavných srdcových komplikácií, ktoré mohli viesť k fatálnemu výsledku.
IntravezikálnepodanieupediatrickejpopulácieBezpečnosť SonoVue po intravezikálnom podaní bola stanovená na základe vyhodnotenia literárnych zdrojov, ktoré zahrňujú použitie SonVue u viac ako 6000 pediatrických pacientov (vekové rozmedzie
2 dni až 18 rokov). Neboli hlásené žiadne nežiaduce účinky.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieKeďže doposiaľ neboli hlásené prípady predávkovania, žiadne prejavy alebo príznaky predávkovania nie sú identifikované. Dávky až do 56 ml SonoVue sa podávali zdravým dobrovoľníkom v klinickej štúdii 1. fázy, bez toho, aby boli hlásené vážne nežiaduce účinky. Pacient sa má v prípade predávkovania sledovať a liečiť symptomaticky.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Kontrastné látky, kontrastné látky na ultrazvuk
ATC kód: V08DA05
Fluorid sírový je inertný, neškodný plyn, ťažko rozpustný vo vodných roztokoch. V literatúre existujú štúdie o použití tohto plynu pri štúdiu respiračnej fyziológie a pneumatickej retinopexii. Pridanie injekčného roztoku chloridu sodného 9 mg/ml (0,9%) k lyofilizovanému prášku a nasledovné prudké pretrepanie má za následok tvorbu mikrobublín fluoridu sírového. Mikrobubliny majú priemer približne 2,5 µm, pričom 90% má priemer menší ako 6 µm a 99% má priemer menší ako 11 µm. Každý mililiter SonoVue obsahuje 8 µl mikrobublín. Intenzita odrazeného signálu závisí od koncentrácie mikrobublín a frekvencie ultrazvukového lúča. Styčná plocha medzi bublinou fluoridu sírového a vodným médiom funguje ako reflektor ultrazvukových lúčov, čo zlepšuje echogenitu krvi a zvyšuje kontrast medzi krvou a okolitým tkanivom.
I
ntravenózne použitie:
V navrhovaných klinických dávkach pre intravenózne použitie, SonoVue vyvolal značné zvýšenie intenzity signálu na viac ako 2 minúty pre B-režim zobrazovania v echokardiografii a na 3 až 8 minút pre Dopplerovské zobrazenie veľkých ciev a malých ciev.
Intravezikálne použitie:
Po intravezikálnom podaní pri ultrasonografii vývodných močových ciest u detí SonoVue zvyšuje intenzitu signálu tekutín vo vnútri močovej rúry, močového mechúra, močovodov a obličkovej
panvičky a uľahčuje tak detekciu refluxu tekutín z močového mechúra do močovodov.
Účinnosť SonoVue pri zistení/vylúčení vezikoureterálneho refluxu bola študovaná v dvoch publikovaných otvorených monocentrických štúdiách. Prítomnosť alebo neprítomnosť vezikoureterálneho refluxu pri ultrazvukovom vyšetrení so SonoVue bola porovnávaná
s rádiografickým referenčným štandardom. V prvej štúdii zahrňujúcej 183 pacientov (366 obličko- močovodných jednotiek) bolo ultrazvukové vyšetrenie so SonoVue správne pozitívne u 89 jednotiek'
zo 103 jednotiek s refluxom a správne negatívny u 226 z 263 jednotiek bez refluxu. V druhej štúdii zahrňujúcej 228 pacientov (463 obličko-močovodných jednotiek) bolo ultrazvukové vyšetrenie so SonoVue správne pozitívne u 57 zo 71 jednotiek s refluxom a správne negatívne u 302 z 392 jednotiek
bez refluxu.
5.2 Farmakokinetické vlastnosti
Celkové množstvo fluoridu sírového podaného v klinickej dávke je extrémne nízke (mikrobubliny v
2 ml dávke obsahujú 16 µl plynu). Fluorid sírový sa rozpúšťa v krvi a následne sa vydychuje.
Po jednorazovej vnútrožilovej injekcii 0,03 alebo 0,3 ml SonoVue/kg (asi 1 a 10 násobok maximálnej klinickej dávky) dobrovoľníkom sa fluorid sírový rýchlo eliminoval. Priemerný terminálny polčas bol
12 minút (rozsah 2 až 33 minút). Viac ako 80% podaného fluoridu sírového sa stanovilo vo vydychovanom vzduchu v priebehu 2 minút po injekcii a takmer 100% po 15 minútach.
U pacientov s difúznou intersticiálnou pľúcnou fibrózou sa vo vydychovanom vzduchu dokázalo priemerne 100% fluoridu sírového a terminálny polčas bol podobný polčasu nameranému u zdravých dobrovoľníkov.
5.3 Predklinické údaje o bezpečnosti
Neklinické údaje na základe obvyklých štúdií farmakologickej bezpečnosti, genotoxicity
a reprodukčnej toxicity neodhalili žiadne osobitné riziko pre ľudí. Cekálne lézie, ktoré boli pozorované v niektorých štúdiách s opakovanými dávkami u potkanov, ale nie u opíc, nie sú relevantné pre ľudských jedincov za normálnych podmienok podávania.
Intravezikálna lokálna tolerancia SonoVue bola taktiež hodnotená. Štúdia s jednorazovou dávkou a štúdia s opakovanou dávkou, po ktorej nasledovalo obdobie bez liečby, sa uskutočnili u samíc potkanov s lokálnou toxicitou hodnotenou makroskopickým a histopatologickým vyšetrením obličiek, močovodov, močového mechúra a močovej rúry. V žiadnom z vyšetrovaných orgánov, najmä v močovom mechúre, v štúdiách s jednorazovou dávkou ani v štúdii po opakovanej dávke sa neodhalili žiadne lézie súvisiace s testovanou položkou. Preto sa dospelo k záveru, že SonoVue je dobre znášaný v močovom trakte u potkanov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok: makrogol 4000 distearoylfosfatidylcholín
dipalmitoylfosfatidylglycerol sodný kyselina palmitová
Rozpúšťadlo
chlorid sodný 9 mg/ml (0,9%) injekčný roztok
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas pouţ iteľnosti
2 roky
Chemická a fyzikálna stabilita bola preukázaná počas 6 hodín po rekonštitúcii. Z mikrobiologického hľadiska sa má liek spotrebovať okamžite. Pokiaľ nie je spotrebovaný ihneď, za čas skladovania a vlastnosti lieku pred použitím je zodpovedný používateľ.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie. Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Bezfarebné sklenené injekčné liekovky typu I obsahujú 25 mg suchého, lyofilizovaného prášku v atmosfére fluoridu sírového uzavreté sivou butyl-kaučukovou zátkou utesnenou hliníkovým krimpovacím flip-off viečkom. Prenosový systém (MiniSpike).
Číra sklenená naplnená injekčná striekačka typu I obsahujúca 5 ml injekčného roztoku chloridu sodného 9 mg/ml (0,9%).
6.6 Špeciálne upozornenia na pouţ itie
Pred použitím produkt skontrolujte a uistite sa, že obal a uzáver nie sú poškodené.
SonoVue sa musí pred použitím pripraviť vstreknutím 5 ml injekčného roztoku chloridu sodného
9 mg/ml (0,9%) cez priehradku k obsahu injekčnej liekovky. Injekčná liekovka sa potom prudko asi
20 sekúnd pretrepe. Potom sa môže požadovaný objem disperzie natiahnuť do striekačky nasledovne:
 1 2 3
1 2 3
 4 5
4 5
 6 7 8
6 7 8
v1.0-08/2000 ©BRG 2000
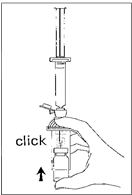
1. Pripojte piestovú tyčinku na injekčnú striekačku naskrutkovaním v smere hodinových ručičiek.
2. Otvorte blister MiniSpike prenosového systému a odstráňte hrotový uzáver injekčnej striekačky.
3. Otvorte kryt prenosového systému a pripojte injekčnú striekačku na prenosový systém naskrutkovaním v smere hodinových ručičiek.
4. Odstráňte uzatvárací ochranný kotúč injekčnej liekovky. Vsuňte injekčnú liekovku zľahka do
priehľadného puzdra stláčacieho systému a silným zatlačením zablokujte injekčnú liekovku na mieste.
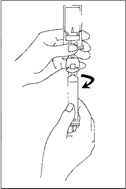
5. Vyprázdnite obsah injekčnej striekačky do injekčnej liekovky stlačením piestovej tyčinky.
6. Prudko pretrepte asi 20 sekúnd, aby bol celý obsah injekčnej liekovky premiešaný (k získaniu homogénnej mliečnej tekutiny).
7. Prevráťte systém a opatrne natiahnite SonoVue do injekčnej striekačky.
8. Odskrutkujte injekčnú striekačku od prenosového systému.
Nepoužívajte, ak získaná tekutina je číra a/alebo sú v suspenzii vidieť pevné častice lyofilizátu. SonoVue sa musí podávať okamžite injekciou do periférnej žily u dospelých pri použití pri
echokardiografii a pri vyšetrení veľkých ciev Dopplerom alebo intravezikálne pri ultrasonografii vývodných močových ciest u pediatrických pacientov.
Pokiaľ sa SonoVue nepoužije ihneď po rekonštitúcii, mikrobublinová disperzia sa má pred natiahnutím do injekčnej striekačky znovu obnoviť pretrepaním. Chemická a fyzikálna stabilita mikrobublinovej disperzie bola preukázaná počas 6 hodín.
Injekčná liekovka je určená iba na jednorazové použitie.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŢITEĽ ROZHODNUTIA O REGISTRÁCII
Bracco International B.V. Strawinskylaan 3051
NL - 1077 ZX Amsterdam
Holandsko
8. REGISTRAČNÉ ČÍSLAEU/1/01/177/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŢENIA REGISTRÁCIEDátum prvej registrácie: 26. marec 2001
Dátum posledného predĺženia registrácie: 24. apríl 2006
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.