
br />V krátkodobých klinických skúšaniach s teriparatidom sa pozorovali izolované epizódy prechodnej
ortostatickej hypotenzie. K tejto príhode typicky došlo v priebehu 4 hodín po podaní a príznaky spontánne odzneli v priebehu niekoľkých minút až niekoľkých hodín. Ak sa táto prechodná ortostatická hypotenzia objavila, vyskytla sa v priebehu prvých niekoľkých dávok. Problémy ustúpili po uložení pacienta do vodorovnej polohy a neviedli k prerušeniu liečby.
Poškodenie obličiek
Pacienti so stredne ťažkým poškodením obličiek majú byť sledovaní so zvýšenou opatrnosťou.
Mladá dospelá populácia
Skúsenosti s mladou dospelou populáciou (> 18 až 29 rokov), vrátane predmenopauzálnych žien, sú
obmedzené (pozri časť 5.1). Liečba sa má začať len v prípade, že jej prínos zreteľne prevýši riziká v tejto populácii.
Ženy v reprodukčnom veku majú používať účinné metódy antikoncepcie počas užívania teriparatidu. Ak žena otehotnie, Sondelbay sa má vysadiť.
Dĺžka liečby
Štúdie na potkanoch poukázali na zvýšený výskyt osteosarkómu pri dlhodobom podávaní teriparatidu
(pozri časť 5.3). Kým nebudú dostupné ďalšie klinické výsledky, nemá sa prekročiť odporučená dĺžka liečby teriparatidom 24 mesiacov.
Pomocnálátka
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t.j. v podstate zanedbateľné
množstvo sodíka.
4.5 Liekové a iné interakcie
V štúdii s 15 zdravými dobrovoľníkmi, ktorí denne užívali digoxín až do dosiahnutia rovnovážneho stavu, neovplyvnilo podanie jednorazovej dávky teriparatidu účinok digoxínu na srdce. Avšak zo sporadických hlásení vyplýva, že pacienti s hyperkalciémiou môžu mať sklon k digitalisovej toxicite. Pretože teriparatid prechodne zvyšuje koncentráciu vápnika v sére, má sa teda u pacientov užívajúcich digitalis podávať s opatrnosťou.
Teriparatid sa skúmal vo farmakodynamických interakčných štúdiách s hydrochlórtiazidom. Nezaznamenali sa žiadne klinicky významné interakcie.
Súčasné podávanie raloxifénu alebo hormonálnej substitučnej terapie spolu s teriparatidom nemalo vplyv na hladinu vápnika v sére alebo v moči alebo na výskyt klinických nežiaducich účinkov.
4.6 Fertilita, gravidita a laktácia
Ž
e
ny v reprodukčnom veku / antikoncepcia u žienŽeny v reprodukčnom veku majú používať účinné metódy antikoncepcie počas užívania teriparatidu.
Ak žena otehotnie, Sondelbay sa má vysadiť.
GraviditaSondelbay je kontraindikovaný na používanie počas gravidity (pozri časť 4.3).
DojčenieSondelbay je kontraindikovaný na používanie počas dojčenia. Nie je známe, či sa teriparatid vylučuje
do ľudského mlieka.
FertilitaŠtúdie na zajacoch preukázali reprodukčnú toxicitu (pozri časť 5.3). Neuskutočnili sa štúdie o vplyve
teriparatidu na vývoj ľudského plodu. Potencionálne riziko pre ľudí je neznáme.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeTeriparatid nemá, alebo má zanedbateľné účinky na schopnosť viesť vozidlá, alebo obsluhovať stroje. U niektorých pacientov bola pozorovaná prechodná ortostatická hypotenzia alebo závraty. Títo pacienti sa do ústupu príznakov majú zdržať vedenia vozidiel alebo obsluhovania strojov.
4.8 Nežiaduce účinkySúhrn bezpečnostného profiluMedzi najčastejšie hlásené nežiaduce reakcie u pacientov liečených teriparatidom patrili nevoľnosť,
bolesť v končatinách, bolesť hlavy a závraty.
Tabuľkový prehľad nežiaducich účinkovAspoň jeden nežiaduci účinok bol hlásený v klinických skúšaniach s teriparatidom u 82,8 % pacientov
užívajúcich teriparatid a u 84,5 % pacientov užívajúcich placebo.
Nežiaduce reakcie, ktoré súviseli s používaním teriparatidu pri osteoporóze v klinických skúšaniach a v priebehu postmarketingového pôsobenia, sú zahrnuté nižšie v tabuľke. Nežiaduce reakcie boli klasifikované nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až
< 1/100), zriedkavé (≥ 1/10 000 až <1/1 000), veľmi zriedkavé (< 1/10 000).
Tabuľka 1. Nežiaduce reakcie na liekTrieda orgánových
systémov
| Veľmi časté
| Časté
| Menej časté
| Zriedkavé
|
Poruchy krvi a
lymfatického systému
|
| Anémia
|
|
|
Poruchy imunitného
systému
|
|
|
| Anafylaxia
|
P
oruchy
m
e
t
a
b
olizmu a
výživy
|
|
Hypercholesterolé
mia
|
Hyperkalciémia
vyššia ako
2,76 mmol/l, hyperurikémia
|
Hyperkalciémia
vyššia ako
3,25 mmol/l
|
P
sychické
p
oruchy
|
|
Depresia
|
|
|
P
oruchy nervového systému
|
|
Závrat, bolesť hlavy, ischias,
synkopa
|
|
|
T
r
i
e
d
a
orgánových systémov
|
Veľmi časté
|
Časté
|
Menej časté
|
Zriedkavé
|
P
oruchy
u
c
h
a a labyrintu
|
|
Vertigo
|
|
|
P
oruchy
srdca a srdcovej činnosti
|
|
Palpitácie
|
Tachykardia
|
|
P
oruchy ciev
|
|
Hypotenzia
|
|
|
P
oruchy
d
ýchacej sústavy, hrudníka a mediastína
|
|
Dyspnoe
|
Emfyzém
|
|
P
oruchy gastrointesti
n
ál- neho traktu
|
|
Nauzea, vracanie, hiátová hernia, gastroezofageálna
refluxná choroba
|
Hemoroidy
|
|
P
oruchy kože a podkožného tkaniva
|
|
Zvýšené potenie
|
|
|
P
oruchy
k
ostrovej a svalovej sústavy a spojivového tkaniva
|
Bolesť končatín
|
Svalové kŕče
|
Myalgia, artralgia,
kŕč chrbtového svalstva/bolesť*
|
|
P
oruchy obličieka
m
očových ciest
|
|
|
Inkontinencia
moču, polyúria, nutkanie na močenie, nefrolitiáza
|
Zlyhanie/poškodenie obličiek
|
C
e
l
k
ové poruchy a reakcie v mieste
p
odania
|
|
Únava, bolesť
na hrudníku,
asténia, mierne a prechodné reakcie v mieste podania injekcie, vrátane bolesti, opuchu, erytému, modrín, pruritu a slabého krvácania v mieste podania injekcie
|
Erytém v mieste
podania injekcie,
reakcia v mieste podania injekcie
|
Možné alergické
udalosti ihneď
po injekcii: akútna
dýchavičnosť, orofaciálny edém, generalizovaná urtikária, bolesť na hrudníku, edém (najmä periférny)
|
L
a
b
oratórne a
f
u
n
k
č
n
é vyšetrenia
|
|
|
Zvýšenie
hmotnosti, srdcový šelest, zvýšenie hladiny alkalickej fosfatázy
|
|
*Závažné prípady kŕčov chrbtového svalstva alebo bolesti boli hlásené v priebehu niekoľkých minút po
aplikácii injekcie.
Popis vybraných nežiaducich reakciíV klinických skúšaniach boli hlásené nasledovné reakcie s ≥ 1 %-ným rozdielom vo frekvencii
v porovnaní s placebom: vertigo, nauzea, bolesť v končatinách, závrat, depresia, dýchavičnosť.
Teriparatid zvyšuje koncentráciu kyseliny močovej v sére. Zvýšenie koncentrácie kyseliny močovej v sére nad hornú hranicu normy sa v rámci klinických skúšaniach vyskytlo u 2,8% pacientov užívajúcich teriparatid v porovnaní s 0,7% pacientami užívajúcimi placebo. Hyperurikémia však nespôsobila zvýšený výskyt dny, bolesti kĺbov alebo urolitiázy.
Vo veľkom klinickom skúšaní s iným liekom obsahujúcom teriparatid boli u 2,8% žien preukázané protilátky vykazujúce skríženú reaktivitu s týmto liekom obsahujúcim teriparatid. Vo všeobecnosti protilátky boli prvýkrát preukázané po 12 mesiacoch liečby a po vysadení liečby dochádzalo k ich poklesu. V tejto súvislosti neboli preukázané žiadne reakcie precitlivenosti, alergickej reakcie, zmeny koncentrácie vápnika v sére alebo vplyv na vývoj minerálovej denzity kostí (Bone Mineral Density, BMD).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePríznaky a symptómyTeriparatid bol podávaný v jednotlivých dávkach až do množstva 100 mikrogramov a v opakovaných
dávkach až do množstva 60 mikrogramov/deň po dobu 6 týždňov.
Príznaky, ktoré možno očakávať pri predávkovaní, zahŕňajú oneskorenú hyperkalcémiu a riziko ortostatickej hypotenzie. Ďalej sa môžu vyskytnúť nauzea, vracanie, závraty a bolesť hlavy.
Poznatky o predávkovaní založené na spontánnych postmarketingových hláseniachV spontánnych postmarketingových hláseniach boli popísané omyly v dávkovaní, kedy bol celý obsah
(až 800 mikrogramov) teriparatidového pera podaný ako jedna dávka. Hlásené prechodné účinky
zahŕňali nevoľnosť, slabosť/letargiu a hypotenziu. V niektorých prípadoch nevznikli následkom predávkovania žiadne nežiaduce účinky. V súvislosti s predávkovaním neboli hlásené žiadne úmrtia.
Liečba predávkovaniaŽiadne špecifické antidotum pre teriparatid neexistuje. Pri podozrení na predávkovanie sa má
teriparatid dočasne vysadiť, má sa sledovať koncentrácia vápnika v sére a má sa začať príslušná
liečba, napr. hydratácia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: homeostáza vápnika, hormóny prištítnych teliesok a analógy, ATC kód: H05AA02.
Sondelbay je biologicky podobný liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.Mechanizmus účinkuEndogénny parathormón (PTH) obsahujúci 84 aminokyselín je hlavným regulátorom metabolizmu
vápnika a fosforu v kosti a v obličkách. Teriparatid (rhPTH(1-34)) je aktívny fragment (1-34)
endogénneho ľudského parathormónu. Fyziologické účinky PTH zahŕňajú stimuláciu kostnej novotvorby priamym pôsobením na bunky tvoriace kostnú hmotu (osteoblasty), a tým nepriame zvýšenie črevnej absorpcie vápnika, zvýšenie tubulárnej reabsorpcie vápnika a vylučovanie fosfátov obličkami.
Farmakodynamické účinkyTeriparatid je látka podporujúca tvorbu kostí určená na liečbu osteoporózy. Účinky teriparatidu na
skelet závisia od charakteru systémovej expozície. Podávanie teriparatidu jedenkrát denne zvyšuje
apozíciu novej kosti na povrchoch trámcovej a kortikálnej kosti preferenčnou stimuláciou aktivity osteoblastov, ktorá prevláda nad aktivitou osteoklastov.
Klinická účinnosťRizikové faktoryJe potrebné vziať do úvahy nezávislé rizikové faktory, napríklad nízku BMD, vek, výskyt zlomeniny v
minulosti, rodinnú anamnézu zlomeniny krčka stehnovej kosti, vysoký kostný obrat a nízky body mass index pri identifikácii žien a mužov so zvýšeným rizikom osteoporotických zlomenín, u ktorých môže byť liečba prínosom.
U predmenopauzálnych žien s osteoporózou indukovanou glukokortikoidmi je potrebné vziať do
úvahy vysoké riziko zlomenín, ak majú bežnú zlomeninu alebo kombináciu rizikových faktorov, ktoré ich zaraďujú do skupiny s vysokým rizikom zlomenín (napr. nízka kostná denzita [napr. T skóre ≤−2], pretrvávajúca liečba vysokými dávkami glukokortikoidov [napr. ≥7,5 mg/deň počas minimálne
6 mesiacov], vysoká aktivita základného ochorenia, nízka hladina pohlavných steroidných hormónov).
P
ostmenopauzálna osteoporóza
Do hlavného klinického skúšania bolo zaradených 1 637 postmenopauzálnych žien (priemerný vek
69,5 roka). Pri vstupe do klinického skúšania malo deväťdesiat percent pacientov jednu alebo viac zlomenín stavcov a v priemere vertebrálna BMD bola 0,82 g/cm2 (čo zodpovedá T skóre = - 2,6 SD). Všetky pacientky denne dostávali 1 000 mg vápnika a aspoň 400 IU vitamínu D. Výsledky liečby teriparatidom trvajúcej až 24 mesiacov (priemerná doba: 19 mesiacov) preukázali štatisticky významné zníženie rizika zlomenín (Tabuľka 2). Aby sa zabránilo jednej alebo viacerým zlomeninám stavcov je potrebné liečiť 11 žien počas priemerne 19 mesiacov.
Tabuľka 2. Výskyt zlomenín u postmenopauzálnych žien
| Placebo (n = 544) (%)
| Teriparatid
(n = 541) (%)
| Relatívne riziko
(95 % CI) oproti
placebu
|
Nová zlomenina stavcov (≥ 1)a
| 14,3
| 5,0b
| 0,35 (0,22; 0,55)
|
Mnohopočetné
zlomeniny stavcov
(≥ 2)a
| 4,9
| 1,1b
| 0,23 (0,09; 0,60)
|
Nevertebrálne
osteoporotické zlomeninyc
| 5,5
| 2,6d
| 0,47 (0,25; 0,87)
|
Závažné nevertebrálne osteoporotické zlomeniny
(krčka stehnovej kosti,
vretennej, ramennej kosti, rebier a panvy)
| 3,9
| 1,5d
| 0,38 (0,17; 0,86)
|
Skratky: N = počet pacientov náhodne pridelených do každej liečenej skupiny: CI = interval spoľahlivosti
a Výskyt zlomenín stavcov bol hodnotený u 448 pacientov dostávajúcich placebo a 444 pacientov dostávajúcich teriparatid, ktorí mali vstupné i kontrolné snímky chrbtice.

b p ≤ 0,001 v porovnaní s placebom.

c Signifikantné zníženie výskytu zlomeniny krčka stehnovej kosti nebolo preukázané.

d p ≤ 0,025 v porovnaní s placebom
Po 19 mesiacoch liečby (priemerná doba) sa v porovnaní s placebom zvýšila BMD v bedrovej chrbtici
o 9 % a v celkovom krčku stehnovej kosti o 4 % (p<0,001).
Sledovanie po ukončení liečby: Po ukončení liečby teriparatidom bolo 1 262 postmenopauzálnych žien z hlavného klinického skúšania zaradených do klinického skúšaní s následným sledovaním. Primárnym cieľom tejto fázy klinického skúšania bolo zhromaždiť viac informácií o bezpečnosti teriparatidu. V priebehu tejto observačnej fázy bola povolená iná liečba osteoporózy a bolo vykonané ďalšie zhodnotenie výskytu zlomenín stavcov.
V priebehu priemerného obdobia 18 mesiacov po vysadení teriparatidu bol počet pacientov s aspoň jednou novou zlomeninou stavca o 41 % nižší v porovnaní s placebom (p=0,004).
V otvorenom klinickom skúšaní sa liečilo teriparatidom 503 postmenopauzálnych žien so závažnou osteoporózou a zlomeninou v predošlých 3 rokoch (83 % z nich už predtým dostávalo osteoporotickú liečbu) počas až 24 mesiacov. Po 24 mesiacoch liečby bol priemerný nárast BMD (minerálnej denzity kostí) v porovnaní s východiskovými hodnotami 10,5 % v bedrovej chrbtici, 2,6 % v celom bedrovom kĺbe a 3,9 % v krčku stehnovej kosti. Priemerný nárast BMD medzi 18 a 24 mesiacmi bol 1,4 % v bedrovej chrbtici, 1,2 % v celom bedrovom kĺbe a 1,6 % v krčku stehnovej kosti.
Do 24-mesačného randomizovaného, dvojito zaslepeného, komparátorom kontrolovaného skúšaní fázy 4 bolo zahrnutých 1 360 postmenopauzálnych žien s rozvinutou osteoporózou. 680 pacientok bolo randomizovaných na teriparitid a 680 pacientok bolo randomizovaných na 35 mg/týždeň rizendronátu, perorálne. Na začiatku mali ženy vek v priemere 72,1 rokov a medián 2 bežných
vertebrálnych zlomenín; 57,9 % pacientok užívalo pôvodnú bisfosfonátovú liečbu a počas klinického skúšaní 18,8 % užívalo súbežne glukokortikoidy. 1 013 (74,5 %) pacientok ukončilo 24-mesačné následne sledovanie. Priemerná kumulatívna dávka (medián) glukokortikoidov bola 474,3 (66,2) mg
v teriparatidovej skupine a 898,0 (100,0) mg v rizendronátovej skupine. Priemerný príjem vitamínu D
(medián) v teriparatidovej skupine bol 1433 IU/deň (1400 IU/deň) a v rizendronátovej skupine 1 191
IU/deň (900 IU/deň). Výskyt nových vertebrálnych zlomenín u pacientok, ktorým vyhotovili vstupné aj následné rádiogramy chrbtice, bol 28/516 (5,4 %) u pacientok liečených teriparatidom a 64/533 (12,0 %) u pacientok liečených rizendronátom, relatívne riziko (95% CI) = 0,44 (0,29-0,68), P<0,0001. Kumulatívny výskyt združených klinických zlomenín (klinické vertebrálne a nevertebrálne zlomeniny) bol 4,8 % u pacientok liečených teriparatidom a 9,8 % u pacientok liečených rizedronátom, pomer rizika (95% CI) = 0,48 (0,32-0,74), P = 0,0009.
Osteoporóza u mužov
Do klinického skúšania u mužov bolo zaradených 437 pacientov (priemerný vek 58,7 roka)
s hypogonadálnou osteoporózou (definovanou ako nízky ranný voľný testosterón alebo zvýšený FSH alebo LH) alebo idiopatickou osteoporózou. Vstupná minerálna denzita kostí chrbtice a krčka stehnovej kosti, priemerné T skóre boli -2,2 resp. -2,1. Pri vstupe do klinického skúšania 35 % pacientov malo zlomeninu stavcov a 59 % malo nevertebrálnu zlomeninu.
Všetci pacienti denne dostávali 1 000 mg vápnika a aspoň 400 IU vitamínu D. Po 3 mesiacoch došlo k významnému zvýšeniu BMD v bedrovej časti chrbtice. Za 12 mesiacov sa BMD bedrovej časti chrbtice zvýšila v porovnaní s placebom o 5 %, celkového krčka stehnovej kosti o 1 %. Nebol však preukázaný významný účinok na výskyt zlomenín.
Osteoporóza indukovaná glukokortikoidmi
Účinnosť teriparatidu u mužov a žien (N=428), ktorí dostávajú pretrvávajúcu systémovú liečbu glukokortikoidmi (ekvivalentnú 5 mg alebo viac prednizónu počas minimálne 3 mesiacov) bola preukázaná v 18-mesačnej primárnej fáze randomizovaného, dvojito zaslepeného, 36-mesačného komparátorom kontrolovaného skúšania (alendronát 10 mg/deň). Dvadsaťosem percent pacientov malo na začiatku jednu alebo viac rádiograficky potvrdených vertebrálnych zlomenín. Všetci pacienti dostávali 1 000 mg vápnika denne a 800 IU vitamínu D denne.
Toto klinické skúšaní zahŕňalo postmenopauzálne ženy (N=277), predmenopauzálne ženy (N=67)
a mužov (N=83). Na začiatku mali postmenopauzálne ženy vekový priemer 61 rokov, stredné BMD T
skóre v bedrovej časti chrbtice -2,7, medián dávky glukokortikoidu zodpovedajúci dávke prednizónu
7,5 mg/deň a 34% pacientov malo jednu alebo viac rádiograficky potvrdených vertebrálnych
zlomenín; predmenopauzálne ženy mali vekový priemer 37 rokov, stredné BMD T skóre v bedrovej časti chrbtice -2,5, medián dávky glukokortikoidu zodpovedajúci dávke prednizónu 10 mg/deň a 9% pacientov malo jednu alebo viac rádiograficky potvrdených vertebrálnych zlomenín; a muži mali vekový priemer 57 rokov, stredné BMD T skóre v bedrovej časti chrbtice -2,2, medián dávky glukokortikoidu zodpovedajúci dávke prednizónu 10 mg/deň a 24% pacientov malo jednu alebo viac rádiograficky potvrdených vertebrálnych zlomenín.
Šesťdesiatdeväť percent pacientov dokončilo 18-mesačnú primárnu fázu. V koncovom hodnotení po
18 mesiacoch, teriparatid signifikantne zvýšil BMD v bedrovej časti chrbtice (7,2%) v porovnaní
s alendronátom (3,4%) (p<0,001). Teriparatid zvýšil BMD v oblasti celého bedrového kĺbu (3,6%)
v porovnaní s alendronátom (2,2%) (p<0,01), takisto ako krčka stehnovej kosti (3,7%) v porovnaní s alendronátom (2,1%) (p<0,05).
U pacientov liečených teriparatidom vzrástla hodnota BMD v období medzi 18 a 24 mesiacmi liečby
o ďalších 1,7% v bedrovej chrbtici, 0,9% v celom bedrovom kĺbe a 0,4% v krčku stehennej kosti.
Analýza röntgenových snímok chrbtice po 36 mesiacoch liečby 169 pacientov alendronátom a 173 pacientov teriparatidom preukázala, že u 13 pacientov v skupine liečenej alendronátom (7,7%) sa vyskytla nová vertebrálna zlomenina v porovnaní s 3 pacientmi v skupine užívajúcich teriparatid (1,7%) (p = 0,01). Okrem toho u 15 z 214 pacientov v skupine liečenej alendronátom (7,0%) sa
vyskytla nevertebrálna zlomenina v porovnaní so 16 pacientami z 214 v skupine užívajúcich teriparatid (7,5%) (p=0,84).
U predmenopauzálnych žien bolo zvýšenie BMD z východiskovej hodnoty na hodnotu koncového bodu po 18 mesiacoch signifikantne vyššie v skupine s teriparatidom v porovnaní s alendronátovou skupinou v bedrovej časti chrbtice (4,2% oproti −1,9%; p<0,001) a v oblasti celého bedrového kĺbu (3,8% oproti 0,9%; p=0,005). Žiadny signifikantný účinok na výskyt zlomeniny sa však nedokázal.
5.2 Farmakokinetické vlastnosti
Distribúcia
Distribučný objem je približne 1,7 l/kg. Po subkutánnom podaní je polčas teriparatidu približne
1 hodina, čo odráža čas potrebný na vstrebanie z miesta vpichu.
Biotransformácia
S teriparatidom neboli vykonané žiadne štúdie metabolizmu alebo exkrécie, zdá sa však, že periférny
metabolizmus parathormónu prebieha prevažne v pečeni a obličkách.
Eliminácia
Teriparatid sa vylučuje hepatálnym a extrahepatálnym klírensom (približne 62 l/hod u žien a 94 l/hod
u mužov)
Starší pacienti
Vo farmakokinetike teriparatidu neboli zaznamenané žiadne rozdiely s ohľadom na vek (rozpätie
od 31 do 85 rokov). Prispôsobenie dávky veku sa nevyžaduje.
5.3 Predklinické údaje o bezpečnosti
Teriparatid nebol genotoxický v žiadnom zo štandardne vykonávaných testov. Pri podávaní potkanom, myšiam alebo králikom neboli preukázané žiadne teratogénne účinky. Nepozorovali sa žiadne významné účinky u gravidných potkanov alebo myší, ktoré dostávali teriparatid v denných dávkach 30 až 1 000 µg/kg. Objavila sa však fetálna resorpcia a znížená veľkosť vrhu u gravidných králikov, ktoré dostávali teriparatid v denných dávkach 3 až 100 µg/kg. Embryotoxicita pozorovaná u králikov môže súvisieť s oveľa väčšou citlivosťou králikov na účinky PTH na ionizovaný vápnik v krvi v porovnaní
s hlodavcami.
U potkanov, liečených takmer celoživotne dennou injekciou teriparatidu, bolo preukázané dávkovo závislé zvýšenie kostnej novotvorby a zvýšený výskyt osteosarkómu, veľmi pravdepodobne epigenetickým mechanizmom. Podávanie teriparatidu potkanom nezvýšilo incidenciu žiadneho iného typu nádorového ochorenia. Klinický význam týchto nálezov je vďaka odlišnej fyziológii kosti
u potkanov a u ľudí pravdepodobne zanedbateľný. Žiadne kostné tumory neboli zaznamenané u opíc po ovarektómii liečených počas 18 mesiacov ani počas ďalších 3 rokov po ukončení liečby. Navyše
v klinických štúdiách alebo štúdiách nasledujúcich po ukončení liečby nebol žiadny osteosarkóm
preukázaný.
Štúdie na zvieratách preukázali, že významne znížený prietok krvi pečeňou znižuje expozíciu PTH
hlavnému štiepnemu systému (Kupfferove bunky) a následne klírens PTH(1-84).
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
ľadová kyselina octová octan sodný (bezvodý) manitol
metakrezol
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
voda na injekciu
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
Po prvom otvorení
Chemická, fyzikálna a mikrobiologická stabilita v priebehu užívania lieku bola preukázaná počas
28 dní pri 2°C – 8°C.
Po otvorení sa môže liek uchovávať pri 2°C – 8°C maximálne 28 dní. Za nedodržanie odporučených podmienok a doby uchovávania je zodpovedný užívateľ.
Ak nemáte k dispozícii chladničku, môže sa liek uchovávať pri teplote až 25 °C maximálne počas 3 dní. Po uplynutí tejto doby je treba ho vrátiť do chladničky a použiť počas 28 dní od podania prvej injekcie. Ak sa pero s liekom Sondelbay uchováva mimo chladničky pri teplote až 25 °C dlhšie ako 3 dni, má sa zlikvidovať.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke pri teplote (2°C – 8°C). Neuchovávajte v mrazničke. Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
2,4 ml roztoku v náplni (silikónové sklo typ I) s piestom (guma z promobutylu), tesniaci disk
(hliníkové uzávery potiahnuté bromobutylom) vložené do jednorazového pera.
Sondelbay sa dodáva v balení obsahujúcom 1 naplnené alebo 3 naplnená perá. Každé naplnené pero
obsahuje 28 dávok s obsahom 20 mikrogramov (na 80 mikrolitrov). Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Zaobchádzanie s liekom
Sondelbay je dostupné ako naplnené pero. Každé pero má používať len jeden pacient. Na každú
aplikáciu injekcie je potrebné použiť novú, sterilnú ihlu. Balenie neobsahuje ihly. K peru je možné
používať ihly určené k peru (31G alebo 32G; 4 mm, 5 mm alebo 8 mm). Sondelbay nepoužívajte, ak je roztok zakalený, sfarbený alebo obsahuje častice.
Po každej aplikácii musí byť pero s liekom Sondelbay ihneď vrátené do chladničky (2°C – 8°C). Ak pero nepoužívate, znova ho uzavrite, aby ste chránili náplň pred fyzickým poškodením a svetlom. Liek Sondelbay nepoužívajte, pokiaľ je alebo bol zmrazený.
Nenaťahujte liek do injekčnej striekačky. Naplnené pero neuchovávajte s nasadenou ihlou.
Dátum podania prvej injekcie má byť zapísaný na vonkajšom obale lieku Sondelbay (pozri poskytnutý priestor: dátum prvého použitia).
Inštrukcie na používanie pera je taktiež možné nájsť v Návode na použitie pera.
LikvidáciaNepoužitý liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s miestnymi
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAccord Healthcare S.L.U.
World Trade Centre, Moll de Barcelona s/n,
Edifici Est, 6ª Planta,
08039, Barcelona, Španielsko
8. REGISTRAČNÉ ČÍSLAEU/1/22/1628/001
EU/1/22/1628/002
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
N
á
vod na použitie pera
S
ondelbay 20 mikrogramov/80 mikrolitrov, injekčný roztok v naplnenom pere
Návod na použitieSkôr ako začnete používať nové pero s liekom Sondelbay, prečítajte si pozorne prednú a zadnú stranu Návodu na použitie. Zadná strana obsahuje pokyny k riešeniu problémov a ďalšie informácie.
Pri používaní pera s liekom Sondelbay postupujte presne podľa pokynov. Taktiež si prečítajte poskytnutý príbalový leták.
Pero s liekom Sondelbay ani injekčné ihly nedávajte nikomu inému, pretože infekcie alebo iné ochorenia sa šíria z jednej osoby na druhú.Vaše pero s liekom Sondelbay obsahuje liek na 28 dní.
Po 28 dňoch od podania prvej injekcie pero s liekom Sondelbay zlikvidujte, aj keď nie je úplneprázdne.Neaplikujte si viac ako jednu dávku lieku Sondelbay v ten istý deň. Časti pera s liekom Sondelbay
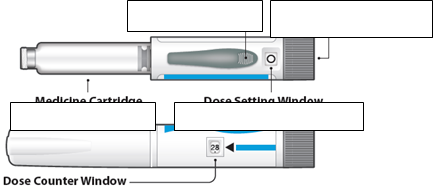
Uzáver pera Injekčné tlačidlo Koliesko na nastavenie dávky
Náplň s liekom Okienko na nastavenie dávky

Okienko s indikátorom počtu dávok
 I
h
l
y nie sú súčasťou pera
I
h
l
y nie sú súčasťou pera
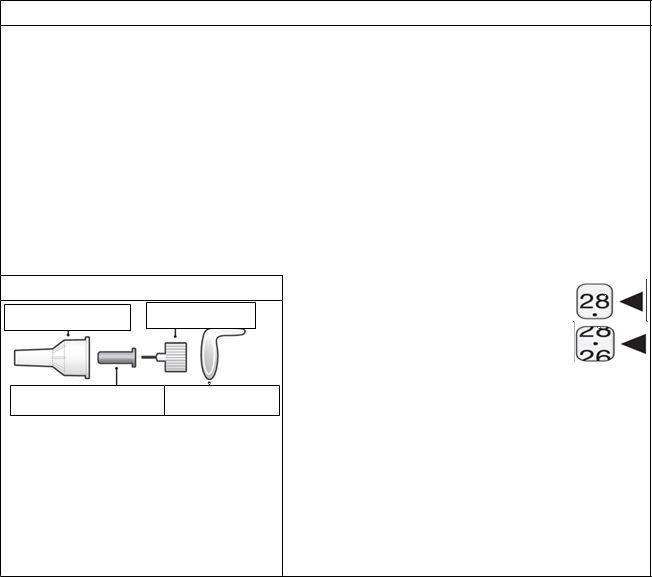
Veľký kryt ihly Ihla
Malý ochranný kryt ihly Papierová fólia
Použite ihly do pera (31G alebo 32G; 4 mm,
5 mm alebo 8mm).
Opýtajte sa svojho lekára alebo lekárnika, ktorá veľkosť a dĺžka ihly je pre vás najvhodnejšia.
Použite vždy novú ihlu na každú injekciu.Skontrolujte okienko s indikátorom počtu dávok, aby ste zistili počet zostávajúcich dávok. Šípka
ukazuje na počet zostávajúcich dávok. Nové pero obsahuje 28 dávok.
Čierne bodky v okienku s indikátorom počtu dávok predstavujú nepárny počet zostávajúcich dávok v pere.
Ak indikátor počtu dávok ukazuje „00“, pero nepoužívajte, pretože to znamená, že pero už neobsahuje žiadne dávky.'
Pero s liekom Sondelbay nevyžaduje žiadnu zvláštnu prípravu.
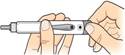
1
P
r
i
p
r
a
v te si miesto vpichu
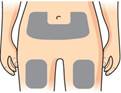
Pripravte si miesto vpichu (stehno alebo brucho) podľa pokynov vášho lekára alebo lekárnika.
• Pred každou
aplikáciou si
vždyumyte ruky.
•
Skontrolujteetiketu pera
a uistite sa, že máte správny liek.
•
Skontrolujte dobu použiteľnosti a uistite sa, že ešte neuplynula.
•
Skontrolujteokienko
s indikátorom počtu dávok
a uistite sa, že je
v pere dostatočné množstvo dávok. V novom pere by malo byť 28 dávok.
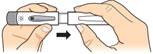
Stiahnite uzáver pera.
•
Skontrolujte, či
pero, vrátane náplne s liekom, nie je poškodené.
•
Skontrolujte, či je liek číry, bezfarebný a nie sú v ňom žiadne čiastočky.

 2
N
a
s
a
ď
t
e novú ihlu
2
N
a
s
a
ď
t
e novú ihlu
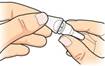
Použite novú ihlu do pera (pozri hore).
Odstráňte
papierovú fóliu.
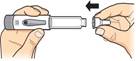
Zatlačte ihlu
priamona náplň s liekom.
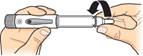 Otáčajte
Otáčajte ihlou, až kým
nie je
pevne nasadená.

Odstráňte veľký kryt ihly a
uschovajte si ho. Budete ho potrebovať na odstránenie ihly po jej použití.
3
N
a
sta vte si dávku
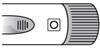 S
k
o
n
tr
o
l
u
j
te
S
k
o
n
tr
o
l
u
j
te, či je v okienku na nastavenie
dávky vidieť prázdne koliesko

.

Pevne
otočte kolieskom na nastavenie dávky v smere hodinových ručičiek. V okienku na nastavenie dávky sa objaví šípky.
Otáčajte kolieskom, kým nebudete
počuť cvaknutie a v okienku na nastavenie dávky
neuvidíte
plné koliesko 
.
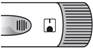
Koliesko na nastavenie dávky uvoľnite.
V okienku na nastavenie dávky sa objaví plné koliesko so zvislou čiarkou

, ktorým potvrdíte nastavenie dávky.
Odstráňte malý ochranný kryt ihly
a
zlikvidujteho.
4
A
p
li
ku
j
t
e
d
á
v
ku
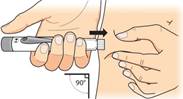
Držte jemne kožnú riasu na stehne alebo bruchu. Vpichnite ihlu rovno do kože. Uistite sa pritom, že je
vidieť okienko na nastavenie dávky.
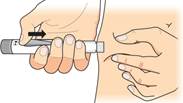
Nechajte ihlu vpichnutú pod kožou a
posunujte injekčným tlačidlom, kým sa nezastaví. Tým dôjde k aplikácii
injekcie.
Pridržte päť sekúnd
Nechajte ihlu vpichnutú pod kožou a počkajte, kým sa
v okienku na nastavenie dávky
neobjaví prázdne koliesko

. Teraz
počítajte pomaly do 5. Potom ihlu vytiahnete z kože.



 5
O
verte si podanie dávky
P
o aplikácii injekcie
5
O
verte si podanie dávky
P
o aplikácii injekcie
a vytiahnutí ihly z
kože
skontrolujte, či je v okienku na nastavenie dávky vidieť prázdne koliesko

.
Ak sa v okienku na nastavenie dávky
neobjaví prázdne koliesko
•
Neaplikujte si ďalšiu dávku znova v ten istý deň.• Namiesto toho si
musíte znova nastaviť pero. Pozri Riešenie problémov
– Problém D.
 6
O
d
s
tr
áňte
i
h
lu
6
O
d
s
tr
áňte
i
h
lu
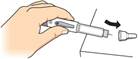
Nasaďte veľký kryt ihly na ihlu tak, ako je zobrazené hore,
a potom ho pevným
zatlačením zacvaknite na miesto.
Nepokúšajte sa znova nasadzovať malý kryt na ihlu ani sa nedotýkajte ihly, aby ste zabránili poraneniu injekčnou ihlou.
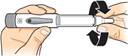
Odskrutkujte ihlu
z pera tak, že otočíte
veľký kryt ihly najmenej o 5 celých otáčok proti smeru hodinových ručičiek.
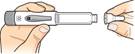 Vytiahnite
Vytiahnite ihlu
a zlikvidujte ju podľa pokynov vášho lekára alebo lekárnika.
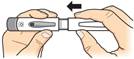
Nasaďte uzáver späť na pero. Ihneď po použití odložte pero do
chladničky.
 R
i
e
šenie problémov
P
r
o
b
l
é
m Riešenie
R
i
e
šenie problémov
P
r
o
b
l
é
m Riešenie
A.
|
V pere s liekom Sondelbay
vidím vzduchovú bublinku.
|
Malá vzduchová bublinka neovplyvní vašu dávku, ani vám neuškodí. Môžete pokračovať v podávaní vašej dávky ako zvyčajne.
|
B.
|
N
e
m
ô
ž
e
m nastaviť dávku.
|
1. Skontrolujte okienko s indikátorom počtu dávok a overte, či v pere s liekom Sondelbay zostala najmenej jedna dávka. Ak indikátor počtu dávok ukazuje „00“, znamená to, že pero s liekom Sondelbay už neobsahuje žiadne dávky. V náplni môže byť ešte malé množstvo lieku,
ktoré však nie je možné aplikovať. Na podanie ďalšej dávky použite nové pero s liekom Sondelbay.
2. Ak v pere s liekom Sondelbay zostala najmenej jedna dávka, ale stále nie je možné dávku nastaviť, otáčajte kolieskom na nastavenie dávky v smeru hodinových ručičiek, kým nebudete počuť cvaknutie a v okienku na nastavenie dávky neuvidíte plné koliesko  . Otáčajte kolieskom na nastavenie dávky pre nastavenie dávky, kým nebudete počuť cvaknutie a neuvidíte plné koliesko, ináč sa koliesko na nastavenie dávky vráti do pôvodnej polohy. Potom, čo sa ozve cvaknutie, koliesko na nastavenie dávky uvoľnite. V okienku na nastavenie dávky sa objaví plné koliesko so zvislou čiarkou . Otáčajte kolieskom na nastavenie dávky pre nastavenie dávky, kým nebudete počuť cvaknutie a neuvidíte plné koliesko, ináč sa koliesko na nastavenie dávky vráti do pôvodnej polohy. Potom, čo sa ozve cvaknutie, koliesko na nastavenie dávky uvoľnite. V okienku na nastavenie dávky sa objaví plné koliesko so zvislou čiarkou  . .
|
C.
|
P
o odstránení malého ochranného krytu ihly pred podaním injekcie je na hrote ihly vidieť kvapka roztoku s liekom.
|
Malá kvapka roztoku s liekom na hrote ihly neovplyvní vašu dávku. Môžete pokračovať v podávaní vašej dávky, ako je opísané v Návode na použitie v 4. kroku.
|
D.
|
V okienku na nastavenie dávky sa neobjavil symbol kolieska  , a to ani po úplnom stlačení injekčného tlačidla a počkaní. Ako mám postupovať? , a to ani po úplnom stlačení injekčného tlačidla a počkaní. Ako mám postupovať?
|
P
r
o opätovné nastavení pera s liekom Sondelbay
p
ostupujte podľa týchto krokov:
1. Ak ste si už podali dávku, NEAPLIKUJTE si znova ďalšiu dávku v ten istý deň.
2. Odstráňte použitú ihlu tak, že na ihlu opatrne znova nasadíte veľký kryt. Nedotýkajte sa ihly. Nenasadzujte už na ihlu malý ochranný kryt. Ihlu
odskrutkujte a zlikvidujte ju podľa pokynov vášho
lekára nebo lekárnika.
3. Nasaďte novú ihlu, stiahnite veľký kryt ihly a
uschovajte ho.
4. Držte malý ochranný kryt ihly tak, aby smeroval do prázdnej nádobky.
5. Odstráňte malý ochranný kryt ihly. Po jeho odstránení môže z ihly vystreknúť malé množstvo roztoku s liekom. Je takisto možné, že malé množstvo roztoku s
liekom už mohlo vytiecť do malého ochranného krytu ihly. Zlikvidujte malý ochranný kryt ihly.
6. Teraz by v okienku na nastavenie dávky malo byt’
vidieť malé prázdne koliesko. Ak ho nevidíte, kontaktujte prosím svojho lekára alebo lekárnika.
7. Nasaďte veľký kryt na ihlu. Nedotýkajte sa ihly.
Nenasadzujte už na ihlu malý ochranný kryt.
|
|
|
Ihlu odskrutkujte a zlikvidujte ju podľa pokynov
vášho lekára alebo lekárnika.
8. Nasaďte kryt znova na pero s liekom Sondelbay. Pero s liekom Sondelbay odložte do chladničky.
9. Umyte si ruky.
Tomuto problému môžete predchádzať, ak vždy použijete NOVÚ ihlu na každú injekciu a ak úplne zatlačíte injekčné tlačidlo.
Vyčkajte, kým sa neobjaví prázdne koliesko, a potom pred vytiahnutím ihly z kože pomaly počítajte do 5.
|
E.
|
A
k
o môžem zistiť, či moje pero s liekom Sondelbay funguje?
|
Pero s liekom Sondelbay je určené na injekčné podanie celej
dávky vždy, keď sa používa presne podľa Návodu na použitie. V okienku na nastavenie dávky sa po podaní injekcie objaví prázdne koliesko  , čo znamená, že bola podaná celá dávka lieku. , čo znamená, že bola podaná celá dávka lieku.
Okienko s indikátorom počtu dávok ukazuje počet
zostávajúcich dávok v pere. Pri každej aplikácii injekcie sa budú odpočítavať po 1. Znamená to takisto, že pero funguje správne. Nezabudnite používať pri každej aplikácii novú ihlu, aby ste zabezpečili, že pero s liekom Sondelbay bude fungovať správne.
|
F.
|
N
e
m
ô
ž
e
m z pera s liekom
S
ondelbay odstrániť ihlu.
|
1. Nasaďte veľký kryt ihly na ihlu tak, ako je zobrazené na prednej strane v 6. kroku.
2. Ihlu odskrutkujete tak, že ju zatlačíte do pera
a niekoľkokrát ju otočíte v smere hodinových ručičiek.
3. Vytiahnite ihlu a zlikvidujte ju podľa pokynov vášho
lekára alebo lekárnika.
4. Ak stále nemôžete odstrániť ihlu, požiadajte niekoho
o pomoc.
|
Č
i
s
t
e
n
i
e a uchovávanie
Č
i
s
t
e
n
i
e pera s liekom Sondelbay:
• Očistite vonkajšiu časť pera s liekom Sondelbay vlhkou utierkou.

• Neponárajte pero s liekom Sondelbay do vody ani ho nečistite žiadnou tekutinou.
Uchovávanie vášho pera s liekom Sondelbay:• Prečítajte si pokyny týkajuce sa uchovávania pera s liekom Sondelbay uvedené v písomnej informácii pre používateľa.
Likvidácia pera s liekom Sondelbay a ihielLikvidácia pera s liekom Sondelbay• Po 28 dňoch od podania prvej injekcie pero s liekom Sondelbay zlikvidujte, aj keď nie je úplne prázdne.

• Pred likvidáciou pera s liekom Sondelbay vždy odstráňte ihlu.
• Opýtajte sa svojho lekára alebo lekárnika, ako zlikvidovať pero s liekom Sondelbay.
Likvidácia ihiel


• Použité ihly dajte do nádoby na ostré predmety alebo do nádoby z tvrdého plastu s bezpečným uzáverom.
• Nehádžte ihly priamo do domového odpadu.
• Naplnenú nádobu na ostré predmety nerecyklujte.
• Opýtajte sa vášho lekára alebo lekárnika, ako správne zlikvidovať nádobu na ostré predmety.
• Pokyny týkajúce sa zaobchádzania s ihlami nemajú nahradiť miestne, zdravotnícke alebo inštitucionálne predpisy.
Ďalšie informácie• Prečítajte si informácie v písomnej informácii pre používateľa pre tento liek a postupujte podľa nich.
• Pero s liekom Sondelbay sa neodporúča používať u nevidiacich osôb alebo osôb s poruchou zraku bez pomoci osoby, ktorá je poučená o správnom používaní pera.
• Uchovávajte pero s liekom Sondelbay mimo dohľadu a dosahu detí.
• Nenaťahujte liek do injekčnej striekačky.
• Použite novú ihlu na každú aplikáciu injekcie.
• Skontrolujte etiketu na pere s liekom Sondelbay a uistite sa, že máte správny liek a že jeho použiteľnosť ešte neuplynula.
• Kontaktujte svojho lekára alebo lekárnika, ak sa u vás objaví akákoľvek z nasledovných situácií:
• pero s liekom Sondelbay sa zdá byť poškodené,
• roztok NIE JE číry, bezfarebný a bez častíc.
• Pero s liekom Sondelbay obsahuje liek na 28 dní.
• Zapíšte si dátum aplikácie prvej injekcie na vonkajší obal pera s liekom Sondelbay (pozri poskytnutý priestor: dátum prvého použitia). Pero s liekom Sondelbay zlikvidujte do 28 dní od aplikácie prvej injekcie.