
4,8 6*
33-37 1,4 2,8 4,2 5,6 6
38-42 1,6 3,2 4,8 6* 6
43-47 1,8 3,6 5,4 6 6
≥48 2 4 6* 6 6
1 vzťahuje sa na µg/kg glykopyrónia
*maximálna individuálna dávka v tomto hmotnostnom rozsahu
Pediatrická populácia – deti mladšie ako 3 roky
Sialanar sa neodporúča používať pri symptomatickej liečbe sialorey (chronického patologického slinenia) u detí mladších ako 3 roky (pozri časť 4.4).
Populácia dospelých pacientov
Sialanar je indikovaný len pre pediatrickú populáciu. K dispozícii sú obmedzené dôkazy z klinických skúšaní o používaní glykopyrónia v populácii dospelých pacientov s patologickým slinením.
Populácia starších pacientov
Sialanar je indikovaný len pre pediatrickú populáciu. Starší pacienti majú dlhší polčas eliminácie a znížený klírens lieku, ako aj obmedzené údaje na podporu účinnosti pri krátkodobom používaní.
Sialanar sa preto nemá používať u pacientov starších ako 65 rokov.
Porucha funkcie pečene
Neuskutočnili sa klinické štúdie u pacientov s poruchou funkcie pečene. Glykopyrónium sa vylučuje zo systémového obehu prevažne renálnou exkréciou a nepredpokladá sa, že porucha funkcie pečene
bude viesť ku klinicky významnému zvýšeniu systémovej expozície glykopyrónia.
Porucha funkcie obličiek
Závažná porucha funkcie obličiek (pozri časť 4.3).
Pri miernej až stredne závažnej poruche funkcie obličiek (eGFR < 90 – ≥ 30 ml/min/1,73 m2) sa dávky majú znížiť o 30 % (pozri tabuľku 2).
T
abuľka 2. Tabuľka s dávkovaním pre deti a dospievajúcich s miernou až stredne závažnou poruchou funkcie obličiek.
Hm
o
t
nosť 1. dávková
úroveň
2. dávková
úroveň
3. dávková
úroveň
4. dávková
úroveň
5. dávková
úroveň
K
g (~8,8 µg/kg) 1
(~17,6 µg/kg)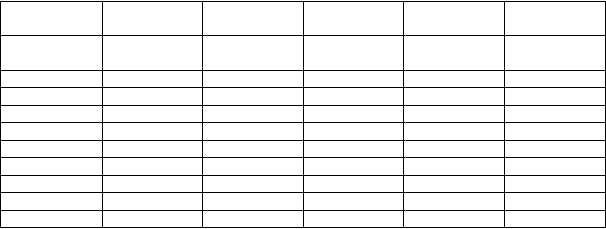
1
(~27,2 µg/kg)1
(~36 µg/kg) 1
(~44,8 µg/kg)1
m
l ml ml ml ml
13-17 0,4 0,8 1,2 1,7 2,1
18-22 0,6 1,1 1,7 2,2 2,8
23-27 0,7 1,4 2,1 2,8 3,5
28-32 0,8 1,7 2,5 3,4 4,2
33-37 1 2 2,9 3,9 4,2
38-42 1,1 2,2 3,4 4,2 4,2
43-47 1,2 2,5 3,8 4,2 4,2
≥48 2 2,8 4,2 4,2 4,2
1 vzťahuje sa na µg/kg glykopyrónia
Spôsob podávania
Len na perorálne použitie.
Súbežné podávanie s jedlom vedie k výraznému zníženiu systémovej expozície lieku. Dávku treba podať aspoň jednu hodinu pred jedlom alebo aspoň dve hodiny po jedle, alebo v konzistentnom čase, pokiaľ ide o príjem jedla. Treba sa vyhnúť jedlu s vysokým obsahom tuku. Keď špecifické potreby dieťaťa vyžadujú súbežné podávanie lieku s jedlom, dávky lieku treba konzistentne podávať počas príjmu jedla.
Ak sa používajú nazogastrické/kŕmiace hadičky, treba ich ihneď po podaní dávky vypláchnuť 10 ml vody.
Pokyny na použitie, pozri časť 6.6.
4.3. Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Gravidita a dojčenie.
Glaukóm. Retencia moču.
Závažná porucha funkcie obličiek (eGFR < 30 ml/min/1,73 m2) vrátane porúch súvisiacich s ochorením obličiek v poslednom štádiu vyžadujúcich dialýzu.
Anamnéza črevnej obštrukcie, ulceratívnej kolitídy, paralytického ilea, pylorickej stenózy a myasténie gravis.
Súbežná liečba s (pozri časť 4.5);
perorálnou dávkou pevnej liekovej formy chloridu draselného;
anticholínergikami;
4.4. Osobitné upozornenia a opatrenia pri používaní
A
nticholínergické
ú
činky
Anticholínergické účinky, ako je retencia moču, zápcha a prehriatie v dôsledku inhibície potenia môžu závisieť od dávky a u postihnutého dieťaťa sa ťažko posudzujú. Je potrebné monitorovanie lekármi a opatrovateľmi, pričom treba dodržiavať ďalej uvedené pokyny pre manažment:
Manažmentdôležitýchanticholínergickýchvedľajšíchúčinkov
Opatrovateľ má liečbu zastaviť a poradiť sa s predpisujúcim lekárom v prípade:
• zápchy,
• retencie moču,
• pneumónie,
• alergickej reakcie,
• pyrexie,
• veľmi horúceho počasia,
• zmien v správaní.
Po posúdení udalosti predpisujúci lekár rozhodne, či má byť liečba naďalej zastavená alebo či má pokračovať nižšou dávkou.
Nedostatokúdajovodlhodobejbezpečnosti
Nie sú k dispozícii publikované údaje o bezpečnosti v prípade trvania liečby viac ako 24 týždňov. Vzhľadom na dostupné obmedzené údaje o dlhodobej bezpečnosti a vzhľadom na nejasnosti v
súvislosti s možným rizikom karcinogenity má byť celkové trvanie liečby čo najkratšie. Ak je
potrebná nepretržitá liečba (napr. v paliatívnych podmienkach) alebo ak sa liečba prerušovane opakuje
(napr. v nepaliatívnych podmienkach pri liečbe chronického ochorenia), treba pozorne zvážiť prínosy a riziká v závislosti od prípadu a liečbu treba pozorne sledovať.
Miernaažstrednezávažnásialorea
Vzhľadom na nízku pravdepodobnosť prínosu a známy profil nežiaducich účinkov sa Sialanar nemá podávať deťom s miernou až stredne závažnou sialoreou.
Poruchysrdcaasrdcovejčinnosti
Glykopyrónium sa má používať obozretne u pacientov s akútnym infarktom myokardu, hypertenziou, ischemickou chorobou srdca, srdcovými arytmiami a stavmi charakterizovanými tachykardiou
(vrátane tyreotoxikózy, srdcovej nedostatočnosti a operácie srdca) vzhľadom na možné zvýšenie srdcovej frekvencie, krvného tlaku a poruchy srdcového rytmu v dôsledku podávania lieku.
Opatrovateľa treba informovať, aby dieťaťu zmeral tep, ak sa zdá, že dieťa nie je v poriadku a aby nahlásil veľmi rýchlu alebo veľmi pomalú srdcovú frekvenciu.
Poruchygastrointestinálnehotraktu
Antimuskariniká, ako je glykopyrónium, sa majú používať obozretne u pacientov s chorobou gastroezofágového refluxu, s existujúcou zápchou a hnačkou.
Dentálneproblémy
Keďže znížená tvorba slín môže zvýšiť riziko ochorení ústnej dutiny a periodontu, je dôležité zabezpečiť u pacientov primeranú každodennú dentálnu hygienu a pravidelné kontroly u zubného lekára.
Respiračnéproblémy
Glykopyrónium môže spôsobiť zahustenie sekrétov, čo môže zvýšiť riziko respiračnej infekcie a pneumónie. Ak je prítomná pneumónia, glykopyrónium treba vysadiť.
NežiaduceudalostisúvisiacesCNS
V klinických skúšaniach boli hlásené zvýšené účinky na centrálny nervový systém vrátane podráždenosti, ospalosti, nepokoja, hyperaktivity, krátkeho rozsahu pozornosti, frustrácie, zmien
nálady, výbuchov hnevu alebo výbušného správania, nadmernej citlivosti, vážnosti alebo smútku, častých epizód plaču a bojazlivosti. Je potrebné sledovať zmeny v správaní.
V dôsledku kvartérneho náboja má glykopyrónium obmedzenú schopnosť prenikať cez krvno- mozgovú bariéru, hoci rozsah penetrácie nie je známy. Obozretnosť je potrebná u detí s narušenou
krvno-mozgovou bariérou, napr. v dôsledku intraventrikulárneho shuntu, mozgového nádoru a
encefalitídy.
Detimladšieako3rokySialanar sa neodporúča u detí mladších ako 3 roky, keďže sú k dispozícii veľmi obmedzené údaje o účinnosti a bezpečnosti glykopyrónia v tejto vekovej skupine.
RastavývinÚčinky glykopyrónia na reprodukčný systém sa neskúmali.
Hoci v klinických štúdiách nebol hlásený krátkodobý ani dlhodobý účinok glykopyrónia na rast alebo vývin nervového systému, neuskutočnili sa žiadne štúdie, ktoré by sa konkrétne zaoberali touto problematikou.
SodíkTento liek obsahuje menej ako 1 mmolu sodíka (23 mg) v maximálnej dávke, t. j. v podstate sodík neobsahuje.
BenzoansodnýTento liek obsahuje 2,3 mg benzoanu sodného (E211) v každom ml.
4.5. Liekové a iné interakcie Neuskutočnili sa žiadne interakčné štúdie.
PediatrickápopuláciaK dispozícii sú obmedzené údaje týkajúce sa interakcií s inými liekmi v pediatrickej vekovej skupine.
Nasledujúce informácie o liekových interakciách sa týkajú glykopyrónia.
KontraindikáciesúbežnéhopoužitiaSúbežné použitie nasledujúcich liekov je kontraindikované (pozri časť 4.3):
Perorálna dávka pevnej liekovej formy chloridu draselného: glykopyrónium môže zvýšiť riziko poškodenia hornej časti gastrointestinálneho traktu súvisiace s perorálnymi pevnými formami chloridu draselného v dôsledku predĺženého času prechodu gastrointestinálnym traktom, čo vedie k vysokej lokalizovanej koncentrácii iónov draslíka. Pozorovala sa súvislosť s krvácaním v hornej časti gastrointestinálneho traktu a ulceráciou tenkého čreva, stenózou, perforáciou a obštrukciou.
Anticholínergiká: súbežné použitie anticholínergík môže zvýšiť riziko anticholínergických vedľajších účinkov. Anticholínergiká môžu oddialiť gastrointestinálnu absorpciu iných anticholínergík podávaných perorálne a tiež zvýšiť riziko anticholínergických vedľajších účinkov.
SúbežnépoužitietrebapozornezvážiťSúbežné použitie nasledujúcich liekov treba pozorne zvážiť:
 Antispazmodiká
Antispazmodiká: glykopyrónium môže antagonizovať farmakologické účinky gastrointestinálnych prokinetických účinných látok, ako je domperidón a metoklopramid.
Topiramát: glykopyrónium môže zvýšiť účinky oligohidrózy a hypertermie súvisiacich s použitím topiramátu, najmä u pediatrických pacientov;
Sedatívne antihistaminiká: môžu mať aditívne anticholínergické účinky. Možno bude potrebné znížiť dávkovanie anticholínergika a/alebo antihistaminika;
N
euroleptiká/antipsychotiká: môže sa zvýšiť účinok účinných látok, ako sú fenotiazíny, klozapín a haloperidol. Možno bude potrebné znížiť dávkovanie anticholínergika a/alebo neuroleptika/antipsychotika;
Relaxanty kostrového svalstva: Použitie anticholínergík po podaní botulotoxínu môže zvýšiť systémové anticholínergické účinky;
Tricyklické antidepresíva a MAOI: môžu mať aditívne anticholínergické účinky. Možno bude potrebné znížiť dávkovanie anticholínergika a/alebo tricyklických antidepresív a MAOI.
Opioidy: účinné látky, ako je petidín a kodeín, môžu mať aditívne nežiaduce účinky na centrálny nervový systém a gastrointestinálny trakt a zvýšiť riziko závažnej zápchy alebo paralytického ilea a útlmu CNS. Ak sa nedá vyhnúť súbežnému použitiu, pacientov treba sledovať z hľadiska možného nadmerného alebo predĺženého útlmu CNS a zápchy;
Kortikosteroidy: Po topickom, inhalačnom, perorálnom alebo intravenóznom podaní steroidov sa môže vyvinúť glaukóm indukovaný steroidmi. Súbežné použitie môže viesť k zvýšenému vnútroočnému tlaku prostredníctvom mechanizmu otvoreného alebo zatvoreného uhla;
Iné
Lieky s anticholínergickými vlastnosťami (napr. antihistaminiká, antidepresíva) môžu spôsobiť kumulatívne parasympatolytické účinky vrátane sucha v ústach, retencie moču, zápchy a zmätenosti a zvýšené riziko anticholínergického intoxikačného syndrómu.
4.6. Fertilita, gravidita a laktácia
Ženyvofertilnomveku
Pred liečbou žien vo fertilnom veku treba v prípade potreby zvážiť účinnú antikoncepciu.
Gravidita
Nie sú k dispozícii žiadne údaje o použití lieku Sialanar u gravidných žien. Hodnotenie reprodukčných parametrov v prípade glykopyrónia je obmedzené (pozri časť 5.3). Glykopyrónium je
kontraindikované počas gravidity (pozri časť 4.3).
Dojčenie
Bezpečnosť počas dojčenia nebola stanovená. Použitie počas dojčenia je kontraindikované (pozri časť
4.3).
Fertilita
Nie sú k dispozícii žiadne údaje o účinkoch lieku Sialanar na mužskú ani ženskú fertilitu. Reprodukčná výkonnosť u potkanov, ktorým sa podávalo glykopyrónium, je znížená, pokiaľ ide o
mieru počatia a mieru prežívania po odstavení. Nie sú k dispozícii dostatočné uverejnené údaje na
primerané posúdenie účinkov na reprodukčný systém u mladých dospelých (pozri časť 5.3).
4.7. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Sialanar má mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Anticholínergické účinky glykopyrónia môžu spôsobiť rozmazané videnie, závraty a ďalšie účinky, ktoré môžu narušiť schopnosť pacienta vykonávať náročnejšie úlohy, ako je vedenie vozidla, jazdenie na bicykli a obsluha strojov. Nežiaduce účinky sa zvyšujú so stúpajúcou dávkou.
4.8. Nežiaduce účinky
Zhrnutiebezpečnostnéhoprofilu
Nežiaduce reakcie pri použití glykopyrónia sú časté v dôsledku jeho známych farmakodynamických anticholínergických účinkov. Účinnosť lieku má byť v rovnováhe s nežiaducimi reakciami a dávku
reakcie v štúdiách kontrolovaných placebom (pozri časť 5.1) súvisiace s gastrointestinálnym systémom boli sucho v ústach, zápcha, hnačka a vracanie, pričom všetky sa vyskytovali v miere ≥ 15
%. Bezpečnostný profil je charakterizovaný aj ďalšími symptómami súvisiacimi s anticholínergickými účinkami v miere ≥ 15 % vrátane retencie moču, návalov horúčavy a nazálnej
kongescie.
Nežiaduce reakcie sú častejšie pri vyšších dávkach a predĺženom používaní.
Prehľadnežiaducichreakciízoradenýchvtabuľke
Nežiaduce reakcie uvedené v literatúre, ktoré sa vyskytovali v skúšaniach s glykopyróniom použitým na sialoreu v pediatrickej populácii (vrátane dvoch skúšaní kontrolovaných placebom, nekontrolovanej štúdie bezpečnosti, v ktorej sa glykopyrónium používalo počas 6 mesiacov a troch podporných štúdií s údajmi o nežiaducich udalostiach v cieľovej populácii), sú uvedené na základe triedy orgánových systémov podľa databázy MedDRA (tabuľka 3). Nežiaduce reakcie sú v každej triede orgánových systémov zoradené podľa frekvencie, pričom ako prvé sú uvedené najčastejšie reakcie. V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí podľa klesajúcej závažnosti. Zodpovedajúca kategória frekvencie pre každú nežiaducu reakciu je založená na nasledujúcej konvencii: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000) a neznáme (nemožno ich odhadnúť z dostupných údajov).
Tabuľka 3. Zoznam nežiaducich reakcií podľa frekvencie
Nežiaduce reakcie Kategória frekvencie
Infekcie a nákazy
Infekcia horných dýchacích ciest Časté Pneumónia Časté Infekcia močových ciest Časté Psychické poruchy
Podráždenosť Veľmi časté
Nepokoj Časté Ospalosť Časté Nepokoj Neznáme Hyperaktivita Neznáme Krátky rozsah pozornosti Neznáme Frustrácia Neznáme Premenlivá nálada Neznáme Výbuchy hnevu Neznáme Intermitentná explozívna porucha Neznáme
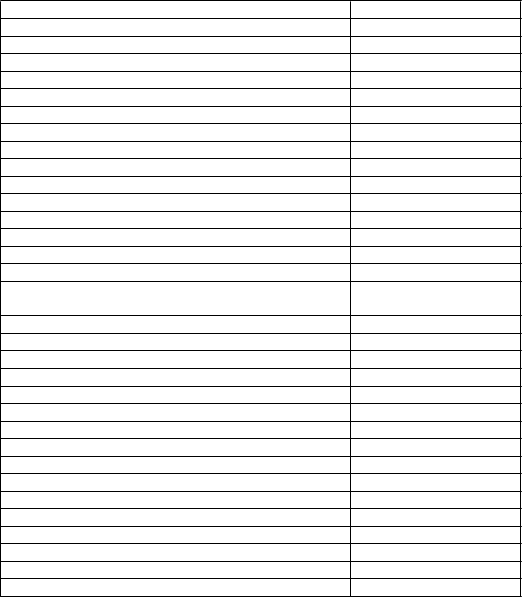
Citlivosť, plachosť a porucha sociálnych vzťahov typické pre obdobie detstva a dospievania
Neznáme
Pocit smútku Neznáme Plač Neznáme Strach Neznáme Poruchy nervového systému
Bolesť hlavy Menej časté
Insomnia Neznáme
Poruchy oka
Mydriáza Menej časté Nystagmus Menej časté Glaukóm so zatvoreným uhlom Neznáme Fotofóbia Neznáme Suché oči Neznáme Poruchy srdca a srdcovej činnosti
Návaly horúčavy Veľmi časté
Prechodná bradykardia Neznáme
Poruchy dýchacej sústavy, hrudníka a mediastína
N
ežiaduce reakcie Kategória frekvencie
Nazálna kongescia Veľmi časté Epistaxa Časté Znížená bronchiálna sekrécia Veľmi časté Sínusitída Neznáme
Poruchy gastrointestinálneho traktuSucho v ústach Veľmi časté
Zápcha Veľmi časté Hnačka Veľmi časté Vracanie Veľmi časté Halitóza Menej časté Ezofágová kandidóza Menej časté Poruchy gastrointestinálnej motility Menej časté Pseudoobštrukcia Menej časté Nauzea Neznáme
Poruchy kože a podkožného tkaniva
Vyrážka Časté Suchosť kože Neznáme Inhibícia potenia Neznáme
Poruchy obličiek a močových ciestRetencia moču Veľmi časté
Nutkanie na močenie Neznáme
Celkové poruchy a reakcie v mieste podaniaPyrexia Časté Dehydratácia Menej časté Smäd v horúcom počasí Menej časté Angioedém Neznáme Alergická reakcia Neznáme
OpisvybranýchnežiaducichreakciíRetenciamočuRetencia moču je známa nežiaduca reakcia súvisiaca s anticholínergickými liekmi (15 %). Liečba glykopyróniom sa má prerušiť dovtedy, kým sa retencia moču nevyrieši.
PneumóniaPneumónia je známa nežiaduca reakcia súvisiaca s anticholínergickými liekmi (7,9 %). Liečba glykopyróniom sa má prerušiť dovtedy, kým sa pneumónia nevyrieši.
ZápchaZápcha je známa nežiaduca reakcia súvisiaca s anticholínergickými liekmi (30 %). Liečba glykopyróniom sa má prerušiť dovtedy, kým sa zápcha nevyrieši.
CentrálnynervovýsystémHoci má glykopyrónium obmedzenú schopnosť prenikať cez krvno-mozgovú bariéru, v klinických skúšaniach boli hlásené zvýšené účinky na centrálny nervový systém (23 %). O týchto účinkoch treba informovať opatrovateľa pri kontrolách a treba zvážiť zníženie dávky.
PoruchysrdcaasrdcovejčinnostiJe známe, že glykopyrónium má vplyv na srdcovú frekvenciu a krvný tlak pri dávkach používaných počas anestézie, aj keď v klinických skúšaniach u detí s chronickým slinením sa tento vplyv nepreukázal. Pri posudzovaní znášanlivosti sa má vyhodnotiť účinok na kardiovaskulárny systém.
Hematológiaachémia
Pozoroval sa >10 % pokles absolútneho počtu neutrofilov (11,2 %) a počtu červených krviniek (11,1
%) oproti normálnemu referenčnému rozsahu vo východiskovom bode a >10 % zvýšenie počtu monocytov (16,7 %) a absolútneho počtu monocytov (11,2 %) oproti normálnemu referenčnému rozsahu vo východiskovom bode. Pozoroval sa >10 % pokles koncentrácie oxidu uhličitého (15,1 %), hydrogénuhličitanu (13,3 %) a kreatinínu (10,7 %) oproti normálnemu referenčnému rozsahu vo východiskovom bode.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v PríloheV.
4.9. Predávkovanie
Symptómy
Predávkovanie glykopyróniom môže viesť k anticholínergickému syndrómu v dôsledku inhibície cholínergickej neurotransmisie na miestach muskarínových receptorov. Klinické prejavy sú zapríčinené účinkami na CNS, účinkami na periférny nervový systém, alebo obidvomi. K častým prejavom patria návaly horúčavy, suchá koža a sliznice, mydriáza so stratou akomodácie, zmena
psychického stavu a horúčka. K ďalším prejavom patrí sínusová tachykardia, znížené zvuky v črevách, funkčný ileus, retencia moču, hypertenzia, chvenie a myoklonické zášklby.
Manažment
Pacientov s prejavmi anticholínergickej toxicity treba previezť na najbližšiu pohotovosť, kde je k dispozícii moderné vybavenie na udržiavanie vitálnych funkcií. Gastrointestinálna dekontaminácia aktívnym uhlím pred hospitalizáciou sa neodporúča pre potenciálnu ospalosť a záchvaty a následné riziko pľúcnej aspirácie. Aktívne uhlie sa môže podať v nemocnici v prípade, ak môžu byť dýchacie cesty pacienta primerane chránené. Fysostigmín salicylát sa odporúča v prípade, keď je prítomná tachydysrytmia s následným hemodynamickým kompromisom, neovládateľný záchvat, závažný nepokoj alebo psychóza.
Pacientov a/alebo rodičov/opatrovateľov treba poučiť, aby vždy zabezpečili podanie presnej dávky, a tak predišli škodlivým následkom anticholínergických reakcií glykopyrónia pozorovaným pri chybách v dávkovaní alebo pri predávkovaní.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1. Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Lieky na funkčné gastrointestinálne poruchy, syntetické anticholínergiká, kvartérne amóniové zlúčeniny. ATC kód: A03AB02.
Glykopyrónium je kvartérne amóniové antimuskarinikum s periférnymi účinkami podobnými účinkom atropínu.
Antimuskariniká sú kompetitívne inhibítory pôsobenia acetylcholínu na muskarínových receptoroch na autonónmych efektorových miestach inervovaných parasympatickými (cholínergickými postganglionickými) nervami. Inhibujú tiež pôsobenie acetylcholínu, keď hladký sval nemá cholínergickú inerváciu.
Vylučovanie slín je sprostredkované hlavne parasympatickou inerváciou slinných žliaz. Glykopyrónium kompetitívne inhibuje cholínergické muskarínové receptory v slinných žľazách a
iných periférnych tkanivách, čím sa nepriamo zníži miera tvorby slín. Glykopyrónium má malý účinok
na cholínergické stimuly na nikotínových acetylcholínových receptoroch, na štruktúrach inervovaných postganglionickými cholínergickými neurónmi a na hladkých svaloch, ktoré reagujú na acetylcholín,
Periférne antimuskarínové účinky, ktoré vznikajú pri zvyšovaní dávky, sú znížená produkcia sekrétov zo slinných, bronchiálnych a potných žliaz, rozšírenie zreníc (mydriáza) a paralýza akomodácie (cykloplégia), zvýšená srdcová frekvencia, inhibícia mikturície a zníženie gastrointestinálneho tonusu a inhibícia vylučovania žalúdočnej kyseliny.
Údaje o účinnosti kontrolované placebom zahŕňajú pacientov liečených dlhšie ako 8 týždňov. Nie sú k dispozícii údaje kontrolované placebom alebo porovnávacím liekom pri trvaní liečby viac ako 8 týždňov.
Zeller et al 2012a hodnotili účinnosť perorálneho roztoku glykopyróniumbromidu (1 mg/5 ml) pri manažmente problému slinenia súvisiaceho s mozgovou obrnou a inými neurologickými stavmi. Tridsaťosem pacientov vo veku 3 – 23 rokov s hmotnosťou aspoň 12,2 kg so závažným slinením (vlhké oblečenie 5 – 7 dní/týždeň) bolo randomizovaných na osemtýždňovú liečbu glykopyróniom (n'
= 20) v dávke 20 – 100 μg/kg (celkovo maximálne 3 mg) trikrát denne alebo zodpovedajúcim placebom (n = 18). Prvé štyri týždne predstavovali individuálne titračné obdobie v pevných krokoch v
závislosti od reakcie a potom nasledovala 4-týždňová udržiavacia liečba. Primárnym parametrom účinnosti bola miera pacientov reagujúcich na liečbu definovaná ako percentuálne zlepšenie najmenej
o 3 body na modifikovanej Teacherovej stupnici slinenia (modified Teacher’s Drooling Scale, mTDS). Populácia zahrnutá do primárnej analýzy sa obmedzila len na pacientov vo veku 3 – 16 rokov, čo
predstavovalo 19 pacientov v skupine liečenej perorálnym roztokom glykopyrolátu a 17 pacientov v skupine liečenej placebom. Miera pacientov reagujúcich na liečbu bola definovaná ako zlepšenie na modifikovanej Teacherovej stupnici slinenia (mTDS) aspoň o 3 body.
Miera pacientov reagujúcich na
liečbu v 8. týždni
Zlepšenie na mTDS aspoň o 3

body
Priemerné zlepšenie na mTDS
Glykopyrónium 14 z 19 pacientov (73,7 %) 3,94 bodu
(SD: 1,95; 95 %; IS: 2,97 – 4,91)
Placebo 3 zo 17 pacientov (17,6 %) 0,71 bodu
(SD: 2,14; 95 % IS: – 0,43 – 1,84)
p-hodnota p = 0,0011 p < 0,0001
Okrem toho, 84 % lekárov a 100 % rodičov/opatrovateľov považovalo glykopyrolát za prínos v
porovnaní s placebom v prípade 41 % lekárov a 56 % rodičov/opatrovateľov (p ≤ 0,014). Najčastejšie hlásené nežiaduce udalosti, ktoré sa vyskytli počas liečby (glykopyrolát v porovnaní s placebom) boli sucho v ústach, zápcha, vracanie a nazálna kongescia.
Bezpečnosť a účinnosť glykopyrónia sa skúmali v otvorenej štúdii bez kontrolnej skupiny počas 24- týždňového obdobia u detí vo veku 3 – 18 rokov. V 24. týždni/pri výstupnej kontrole sa pozorovalo zníženie na mTDS oproti východiskovej úrovni aspoň o tri body u 52,3 % (95 % interval spoľahlivosti
43,7 – 60,9) pacientov (n = 130), pričom títo pacienti boli klasifikovaní ako reagujúci na liečbu perorálnym roztokom glykopyrolátu. Profil nežiaducich udalostí bol konzistentný s profilom pozorovaným v prípade anticholínergík (pozri časti 4.4 a 4.8).
5.2. Farmakokinetické vlastnosti
Priemerná absolútna perorálna biologická dostupnosť glykopyrónia v porovnaní s jednou perorálnou dávkou 50 µg/kg a jednou i.v. dávkou 5 µg/kg bola nízka, približne 3 % (rozsah 1,3 – 13,3 %) u detí
vo veku 7 – 14 rokov podstupujúcich vnútroočnú operáciu (n = 6) v dôsledku nízkej rozpustnosti lieku v tukoch. Z údajov niekoľkých farmakokinetických vzoriek u detí vyplýva farmakokinetika úmerná
dávke.
Biologická dostupnosť perorálneho glykopyrónia u detí bola v rozmedzí hodnôt u dospelých v podmienkach užívania lieku s jedlom a nalačno. Súbežné podávanie s jedlom vedie k výraznému zníženiu systémovej expozície glykopyrónia.
Distribúcia glykopyrónia u dospelých po jednej i.v. dávke 6 µg/kg bola rýchla; distribučný polčas bol
2,2 ± 1,3 minúty. Po podaní glykopyrónia označeného vodíkom 3H sa viac než 90 % rádioaktívne označenej látky vylúčilo z plazmy do 5 minút a takmer 100 % do 30 minút, čo odzrkadľuje rýchlu
distribúciu. Populačné analýzy farmakokinetických údajov od zdravých dospelých a detí s chronickým stredne závažným až závažným slinením súvisiacim s mozgovou obrnou, ktoré dostávali
glykopyrónium (cesta podávania a dávkovanie nie sú uvedené), nepreukázali lineárnu farmakokinetiku lieku.
Distribučný objem 0,64 ± 0,29 l/kg u dospelých je podobný ako v prípade celkovej vody v tele. Distribučný objem je trochu vyšší v pediatrickej populácii (populáciách) v rozsahu 1,31 – 1,83 l/kg.
Preukázalo sa, že farmakokinetika glykopyrónia v podstate nezávisí od veku u detí vo vekovom rozsahu 0,19 – 14 rokov, keď bolo podané ako jedna i.v. dávka 5 µg/kg. Vzťah medzi hladinou glykopyrónia v plazme a časovými úsekmi predstavoval u väčšiny pediatrických pacientov trojexponenciálnu krivku; dospelí majú zvyčajne dvojexponenciálnu krivku. U detí vo veku 1 – 3 roky sa pozorovala mierna zmena distribučného objemu (Vss) a klírensu (Cl), čo vedie k štatisticky významne kratšiemu polčasu eliminácie (t½, z) než u mladších (< 1 rok veku; p = 0,037) alebo starších (> 3 roky veku; p = 0,042) skupín.
V štúdii u zdravých dospelých jedna 2 000 µg dávka glykopyróniumbromidu (400 µg/ml) viedla k AUC 2,39 µg.h/l (pri užívaní lieku nalačno). AUC0-6 h 8,64 µg.h/l sa pozorovala po i.v. podaní glykopyrónia v dávke 6 µg/kg.
Na základe teoretických fyzikálno-chemických úvah by sa očakávalo, že kvartérna amóniová zlúčenina glykopyrónium bude mať nízku centrálnu biologickú dostupnosť; v CSF pacientov, ktorí dostali anestéziu v rámci operácie alebo u pacientok, ktoré podstúpili cisársky rez po i.v. dávke 6 –
8 µg/kg, sa glykopyrónium nezistilo. V pediatrickej populácii má i.v. glykopyrónium v dávke 5 µg/kg nízku centrálnu biologickú dostupnosť s výnimkou prípadu narušenia krvno-mozgovej bariéry (napr.
pri infekcii po zavedení shuntu).
Hlavnou cestou eliminácie glykopyrónia je renálna exkrécia, najmä vo forme nezmeneného lieku. Približne 65 % i.v. dávky sa vylúči obličkami do prvých 24 hodín. Malé množstvo (~5 %) sa vylúči žlčou.
Zdá sa, že polčas eliminácie glykopyrónia závisí od cesty podania a je 0,83 ± 0,27 hodiny po i.v. podaní, 75 minút po i.m. podaní a 2,5 – 4 hodiny po perorálnom (roztok) podaní, hoci sa pozoruje vysoká variabilita. Posledné dva polčasy a najmä polčas v prípade perorálneho podania sú dlhšie ako v prípade i.v. podania, čo pravdepodobne odzrkadľuje zložitú absorpciu a distribúciu glykopyrónia pri každej ceste podania. Je možné, že predĺžená absorpcia po perorálnom podaní sa premieta do rýchlejšej eliminácie než absorpcie (známe ako skoková kinetika charakterizovaná tým, že Ka < Ke).
Celkový klírens lieku z tela po i.v. dávke je relatívne vysoký, v rozsahu 0,54 ± 0,14 l/h/kg až 1,14 ±
0,31 l/h/kg. Keďže to prevyšuje rýchlosť glomerulárnej filtrácie a zdá sa, že viac ako 50 % dávky sa vylúči v nezmenenej forme močom, je pravdepodobné, že renálna eliminácia glykopyrónia zahŕňa glomerulárnu filtráciu aj sekréciu prostredníctvom proximálnych tubulov na základe základného sekrečného mechanizmu.
Priemerné zvýšenie celkovej systémovej expozície (AUClast) až do 1,4-násobku sa pozorovalo u dospelých pacientov s miernou a stredne závažnou poruchou funkcie obličiek (GFR ≥ 30 ml/min/1,73 m2) a až do 2,2-násobku u pacientov so závažnou poruchou funkcie obličiek alebo s ochorením obličiek v poslednom štádiu (odhadnutá hodnota GFR < 30 ml/min/1,73 m2). U pacientov s miernou až stredne závažnou poruchou funkcie obličiek sa vyžaduje 30 % zníženie dávky (pozri tabuľku 2). Glykopyrónium je kontraindikované u pacientov so závažnou poruchou funkcie obličiek.
Základné charakteristiky (vek, hmotnosť, pohlavie a rasa) neovplyvňujú farmakokinetiku glykopyrónia.
Neočakáva sa, že porucha funkcie pečene ovplyvní farmakokinetiku glykopyrónia, keďže väčšina lieku sa vylúči obličkami.
Súbežné podávanie s jedlom vedie k výraznému zníženiu systémovej expozície glykopyrónia (pozri časť 4.2.).
5.3. Predklinické údaje o bezpečnosti
S liekom Sialanar sa neuskutočnili štúdie genotoxicity alebo karcinogenity a nie sú k dispozícii predklinické údaje.
Obmedzené predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti alebo toxicity po opakovanom podávaní neodhalili žiadne osobitné riziko pre ľudí.
Toxicita glykopyrónia po podaní jednej dávky sa testovala v rôznych skúšaniach, hoci sú k dispozícii len obmedzené experimentálne informácie. Po perorálnom podaní boli u myší hlásené vysoké hodnoty LD50 550 mg/kg a u potkanov hodnoty vyššie ako 1 000 mg/kg. Pri vyšších dávkach (1 500 – 2 000 mg/kg) sa u potkanov pred smrťou pozorovala triaška, klonické a tonické kŕče a namáhavé dýchanie v dôsledku zlyhávania dýchania.
Dlhodobé perorálne podávanie glykopyrónia v dávkach 4, 16 a 64 mg/kg až počas 27 týždňov u psov viedlo k mydriáze, cykloplégii, xerostómii, eméze, občasnému slzeniu, injekcii skléry a rinorei.
Extrapolácia hraníc bezpečnosti na pediatrickú populáciu nie je možná, keďže nie sú k dispozícii žiadne údaje o expozícii z toxikologických štúdií s opakovaním dávky a s glykopyróniom sa neuskutočnili žiadne štúdie u mladých zvierat.
Údaje o reprodukčných parametroch glykopyrónia sú veľmi obmedzené. U samíc potkanov, ktorým sa podávalo glykopyrónium, sa pozorovalo zmenšenie žltého telieska. U samcov potkanov sa nepozorovali žiadne účinky na fertilitu. Reprodukčná výkonnosť u potkanov, ktorým sa podávalo glykopyrónium, je znížená, pokiaľ ide o mieru počatia a mieru prežívania po odstavení. Význam
týchto predklinických zistení pre ľudí nie je jasný a nedostatočné údaje o lieku u ľudí vedú ku kontraindikácii glykopyrónia u gravidných žien. K dispozícii nie sú dostatočné uverejnené údaje na primerané posúdenie účinkov na reprodukčný systém u mladých dospelých a bezpečnosť v prípade ľudskej gravidity nebola stanovená.
6. FARMACEUTICKÉ INFORMÁCIE
6.1. Zoznam pomocných látok
Benzoan sodný (E211),
malinová príchuť (obsahujúca propylénglykol E1520), sukralóza (E955),
kyselina citrónová (E330),
čistená voda.
6.2. Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3. Čas použiteľnosti
2 roky
2 mesiacov po prvom otvorení
6.4. Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 25°C.
6.5. Druh obalu a obsah baleniaFľaša z jantárového skla s poistným krúžkom a detským bezpečnostným uzáverom z polyetylénu s vysokou hustotou a podložkou z expandovaného polyetylénu s nízkou hustotou. Fľaša obsahuje 60 ml alebo 250 ml perorálneho roztoku.
Veľkosť balenia: jedna fľaša, jedna 8 ml perorálna striekačka z polyetylénu s nízkou hustotou (s odstupňovaním po 0,1 ml) a jeden adaptér na striekačku.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6. Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomPokynynapoužitieZasuňte adaptér striekačky do hrdla fľaše. Zasuňte koniec perorálnej striekačky do adaptéra striekačky a zaistite. Otočte fľašu hore dnom. Jemne zatláčajte piest na správnu úroveň (správna dávka je
uvedená v tabuľkách 1 a 2). Otočte fľašu do vzpriamenej polohy. Odstráňte perorálnu striekačku. Vložte perorálnu striekačku do úst dieťaťa a piest pomaly stláčajte, aby sa liek jemne uvoľňoval. Ak sa dieťaťu liek podáva cez kŕmiacu hadičku, po podaní lieku vypláchnite hadičku 10 ml vody.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIProveca Pharma Limited Marine House Clanwilliam Place Dublin 2
Írsko
8. REGISTRAČNÉ ČÍSLOEU/1/16/1135/001 (250 ml fľaša) EU/1/16/1135/002 (60 ml fľaša)
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 15. septembra 2016
10. DÁTUM REVÍZIE TEXTUMM/RRRR
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu