
a infúzia
(liečba pooperačnej bolesti)
2,0
|
6 – 14 ml/h
|
12 – 28 mg/h
|
n/a
|
n/a
|
B
l
okáda nervových vlákien v okolí rany/operačného poľa (field block)
|
|
|
|
|
|
(napr. blokády malých nervov
a infiltrácia)
|
2,0
|
1 – 100
|
2,0 – 200
|
1 – 5
|
2 – 6
|
P
e
riférna nervová blokáda (femorálny alebo interskalenický blok)
|
|
|
|
|
|
Kontinuálna infúzia alebo prerušované injekcie (napr. liečba pooperačnej bolesti)
|
2,0
|
5 – 10 ml/h
|
10 – 20 mg/h
|
n/a
|
n/a
|
Dávky uvedené v tabuľke sú dávky považované za nevyhnutné na vyvolanie úspešnej blokády a majú sa považovať za
usmernenia pre použitie u dospelých. Vyskytujú sa individuálne zmeny nástupu a trvania. Údaje v stĺpci „Dávka“ odzrkadľujú očakávaný potrebný priemerný rozsah dávky. Pre faktory ovplyvňujúce špecifické techniky blokád aj individuálne požiadavky týkajúce sa pacienta je potrebné brať do úvahy štandardné príručky.
n/a = nevzťahuje sa
Spôsob podávania
Na zamedzenie intravaskulárneho podania injekcie sa pred a počas injekčného podania odporúča
opatrná aspirácia. V prípade potreby injekčného podania veľkej dávky sa odporúča skúšobná dávka 3
– 5 ml lidokaínu (lignokaínu) s adrenalínom (epinefrínom). Neúmyselné intravaskulárne podanie injekcie možno rozpoznať na základe dočasného zvýšenia srdcovej frekvencie a náhodné intratekálne podanie injekcie na základe prejavov spinálnej blokády.
Aspiráciu je potrebné vykonať pred a počas podania hlavnej dávky, ktorú je potrebné injekčne podať pomaly alebo ako postupne zvyšujúce sa dávky, rýchlosťou 25 – 50 mg/min, za dôkladného sledovania životných funkcií pacienta a udržiavania verbálneho kontaktu. Ak sa objavia príznaky toxicity, injekčné podanie je potrebné okamžite ukončiť.
Pri použití dlhotrvajúcich blokád, buď prostredníctvom kontinuálnej infúzie alebo opakovaného bolusového podania, sa musí zvážiť riziko dosiahnutia toxickej plazmatickej koncentrácie alebo indukcie lokálneho nervového poškodenia. U dospelých boli dobre znášané kumulatívne dávky až do
675 mg ropivakaínu pri chirurgickom zákroku a pooperačnej analgézii podávané počas 24 hodín rovnako, ako aj pooperačné kontinuálne epidurálne infúzie podávané rýchlosťou až do 28 mg/h počas
72 hodín. U obmedzeného počtu pacientov sa podávali vyššie dávky až do 800 mg/deň s relatívne
nízkym výskytom nežiaducich reakcií.
Na liečbu pooperačnej bolesti je možné odporučiť nasledujúcu techniku: Epidurálna blokáda s liekom Ropivacaine Kabi 7,5 mg/ml sa indukuje prostredníctvom epidurálneho katétra, pokiaľ je zavedený predoperačne. Analgézia sa udržiava infúziou lieku Ropivacaine Kabi 2 mg/ml. Rýchlosti infúzie 6 –
14 ml (12 – 28 mg) za hodinu poskytujú primeranú analgéziu s iba miernou a neprogresívnou motorickou blokádou vo väčšine prípadov stredne silnej až silnej pooperačnej bolesti. Maximálne trvanie epidurálnej blokády je 3 dni. Má sa však vykonávať dôkladné sledovanie analgetického účinku s cieľom odstránenia katétra hneď, ako to bolestivý stav umožňuje. Pri tejto technike sa pozorovalo významné zníženie potreby opioidov.
V klinických štúdiách sa epidurálna infúzia ropivakaínu 2 mg/ml samostatne alebo v zmesi
s fentanylom 1 – 4 µg/ml podávala na liečbu pooperačnej bolesti až počas 72 hodín. Kombinácia ropivakaínu a fentanylu poskytla zlepšenú úľavu od bolesti, spôsobila však opioidné vedľajšie účinky. Kombinácia ropivakaínu a fentanylu sa skúmala iba v prípade ropivakaínu 2 mg/ml.
Pri použití dlhotrvajúcich periférnych nervových blokád, buď prostredníctvom kontinuálnej infúzie alebo opakovaných injekcií, sa musí zvážiť riziko dosiahnutia toxickej plazmatickej koncentrácie alebo indukcie lokálneho nervového poškodenia. V klinických štúdiách sa pred chirurgickým zákrokom dosiahol femorálny nervový blok s 300 mg ropivakaínu 7,5 mg/ml a interskalenický blok s 225 mg ropivakaínu 7,5 mg/ml. Analgézia sa následne udržiavala s ropivakaínom 2 mg/ml. Rýchlosti infúzie alebo prerušované injekcie 10 – 20 mg za hodinu počas 48 hodín poskytovali primeranú analgéziu a boli dobre znášané.
Pri cisárskom reze neboli zdokumentované koncentrácie vyššie ako 7,5 mg/ml ropivakaínu.
Porucha funkcie obličiekU pacientov s poruchou funkcie obličiek pri použití jednorazovej dávky alebo v rámci krátkodobej liečby zvyčajne nie je potrebná žiadna úprava dávky (pozri časti 4.4 a 5.2).
Porucha funkcie pečeneRopivakaín sa metabolizuje v pečeni a u pacientov so závažným ochorením pečene sa má preto používať s opatrnosťou. Môže byť potrebné zníženie opakovaných dávok z dôvodu oneskorenej
eliminácie (pozri časti 4.4 a 5.2).
Pediatrická populácia Epidurál na bl okáda: Pediatrickí pacienti vo veku od 0 (donosení novorodenci) až do a vrátane 12rokov
| Koncentrácia
mg/ml
| Objem
ml/kg
| Dávka
mg/kg
|
LIEČBA AKÚTNEJ BOLESTI
(perioperačná a pooperačná)
|
|
|
|
Jednorazová kaudálna
epidurálna blokáda
|
|
|
|
Blokády pod T12, u detí s telesnou
hmotnosťou až do 25 kg
|
2,0
|
1
|
2
|
Kontinuálna epidurálna infúzia
|
|
|
|
U detí s telesnou hmotnosťou až do
25 kg
|
|
|
|
0 až do 6 mesiacov
|
|
|
|
Bolusová dávkaa
|
2,0
|
0,5 – 1
|
1 – 2
|
Infúzia až do 72 hodín
|
2,0
|
0,1 ml/kg/h
|
0,2 mg/kg/h
|
6 až do 12 mesiacov
|
|
|
|
Bolusová dávkaa
|
2,0
|
0,5 – 1
|
1 – 2
|
Infúzia až do 72 hodín
|
2,0
|
0,2 ml/kg/h
|
0,4 mg/kg/h
|
1 až 12 rokov
|
|
|
|
Bolusová dávkab
|
2,0
|
1
|
2
|
Infúzia až do 72 hodín
|
2,0
|
0,2 ml/kg/h
|
0,4 mg/kg/h
|
Dávky uvedené v tabuľke sa majú považovať za usmernenia pre použitie u pediatrických pacientov. Vyskytujú sa
individuálne zmeny. U detí s vysokou telesnou hmotnosťou je častokrát potrebné postupné zníženie dávkovania a má byť založené na ideálnej telesnej hmotnosti. Objem použitý na jednorazovú kaudálnu epidurálnu blokádu a objem epidurálnych bolusových dávok nemá u žiadneho pacienta presiahnuť 25 ml. Pre faktory ovplyvňujúce špecifické techniky blokád aj
individuálne požiadavky týkajúce sa pacienta je potrebné brať do úvahy štandardné príručky.
a Na torakálne epidurálne blokády sa odporúčajú dávky na dolnej hranici dávkového intervalu, zatiaľ čo na lumbálne alebo kaudálne epidurálne blokády sa odporúčajú dávky na hornej hranici.
b Odporúčaná na lumbálne epidurálne blokády. Pri torakálnej epidurálnej analgézii je správnou praxou zníženie bolusovej
dávky.
Použitie ropivakaínu u predčasne narodených detí nebolo zdokumentované.
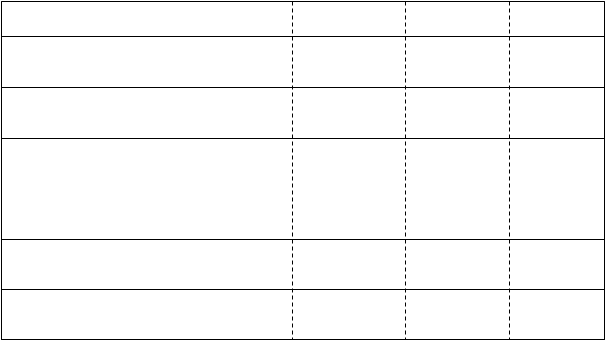 Perif ér na nerv ová bl okáda: Dojčatá a deti vo veku 1 – 12 rokov
Perif ér na nerv ová bl okáda: Dojčatá a deti vo veku 1 – 12 rokov
| Koncentrácia
mg/ml
| Objem
ml/kg
| Dávka
mg/kg
|
LIEČBA AKÚTNEJ BOLESTI
(perioperačná a pooperačná)
|
|
|
|
Jednorazové injekcie na periférnu nervovú blokádu
|
|
|
|
napr. ilioinguinálny nervový blok, blok brachiálneho plexu, blok iliakálneho- fasciálneho priestoru
|
2,0
|
0,5 – 0,75
|
1,0 – 1,5
|
Viacnásobné blokády
|
2,0
|
0,5 – 1,5
|
1,0 – 3,0
|
Kontinuálna infúzia na periférnu nervovú blokádu u detí vo veku 1 až 12 rokov
|
|
|
|
Infúzia až do 72 hodín
|
2,0
|
0,1 –
0,3 ml/kg/h
|
0,2 –
0,6 mg/kg/h
|
Dávky uvedené v tabuľke sa majú považovať za usmernenia pre použitie u pediatrických pacientov. Vyskytujú sa
individuálne zmeny. U detí s vysokou telesnou hmotnosťou je častokrát potrebné postupné zníženie dávkovania a má byť založené na ideálnej telesnej hmotnosti. Pre faktory ovplyvňujúce špecifické techniky blokád aj individuálne požiadavky týkajúce sa pacienta je potrebné brať do úvahy štandardné príručky.
Jednorazové injekcie na periférnu nervovú blokádu (napr. ilioinguinálny nervový blok, blok brachiálneho plexu, blok iliakálneho-fasciálneho priestoru) nemajú presiahnuť 2,5 – 3,0 mg/kg.
Dávky na periférnu blokádu u dojčiat a detí poskytujú usmernenia pre použitie u detí bez závažného ochorenia. U detí so závažnými ochoreniami sa odporúčajú konzervatívnejšie dávky a dôkladné sledovanie.






 Spôsob podávani a
Spôsob podávani a
Na zamedzenie intravaskulárneho podania injekcie sa pred a počas injekčného podania odporúča
opatrná aspirácia. Počas injekčného podania je potrebné dôkladne sledovať životné funkcie pacienta. Ak sa objavia príznaky toxicity, injekčné podanie je potrebné okamžite ukončiť.
Keď sa použije dávka 2 mg/kg v objeme 1 ml/kg, jednorazová kaudálna epidurálna injekcia ropivakaínu 2 mg/ml vyvolá primeranú pooperačnú analgéziu pod T12 u väčšiny pacientov. Podľa odporúčania v štandardných príručkách sa objem kaudálnej epidurálnej injekcie môže prispôsobiť na dosiahnutie rozdielnej distribúcie senzorickej blokády. U detí vo veku viac ako 4 roky sa skúmali dávky až do 3 mg/kg pri koncentrácii ropivakaínu 3 mg/ml. Táto koncentrácia sa však spája s vyšším výskytom motorickej blokády.
Bez ohľadu na cestu podania sa odporúča frakcionácia vypočítanej dávky lokálneho anestetika.
V prípade odporúčania infúzneho podania ropivakaínu sa môže použiť Ropivacaine Kabi infúzny
roztok.
Ropivacaine Kabi 7,5 mg/ml i njekč ný rozt ok a Ropivacaine Kabi 10 mg/ml i nj ekčný r ozt okDospelí a dospievajúci vo veku viac ako 12 rokovV nasledujúcej tabuľke je uvedený návod na dávkovanie pri častejšie využívaných blokádach. Má sa
použiť najnižšia dávka potrebná na vyvolanie účinnej blokády. Pri rozhodovaní o dávke sú dôležité skúsenosti a vedomosti lekára o fyzickom stave pacienta.
| Koncentrácia
mg/ml
| Objem
ml
| Dávka
mg
| Nástup
minúty
| Trvanie
hodiny
|
CHIRURGICKÁ ANESTÉZIA
|
|
|
|
|
|
Lumbálne epidurálne podanie
|
|
|
|
|
|
Chirurgický zákrok
| 7,5
| 15 – 25
| 113 – 188
| 10 – 20
| 3 – 5
|
| 10,0
| 15 – 20
| 150 – 200
| 10 – 20
| 4 – 6
|
Cisársky rez
| 7,5
| 15 – 20
| 113 – 1501)
| 10 – 20
| 3 – 5
|
Torakálne epidurálne podanie
|
|
|
|
|
|
Na dosiahnutie blokády pre úľavu od pooperačnej bolesti
| 7,5
| 5 – 15
(v závislosti od koncentrácie injekcie)
| 38 – 113
| 10 – 20
| n/a2)
|
Blokáda veľkých nervov*
|
|
|
|
|
|
Blok brachiálneho plexu
| 7,5
| 30 – 40
| 225 – 3003)
| 10 – 25
| 6 – 10
|
Blokáda nervových vlákien v okolí rany/operačného poľa (field
block)
|
|
|
|
|
|
(napr. blokády malých nervov
a infiltrácia)
|
7,5
| 1 – 30
| 7,5 – 225
| 1 – 15
| 2 – 6
|
Dávky uvedené v tabuľke sú dávky považované za nevyhnutné na vyvolanie úspešnej blokády a majú sa považovať za
usmernenia pre použitie u dospelých. Vyskytujú sa individuálne zmeny nástupu a trvania. Údaje v stĺpci „Dávka“
odzrkadľujú očakávaný potrebný priemerný rozsah dávky. Pre faktory ovplyvňujúce špecifické techniky blokád aj
individuálne požiadavky týkajúce sa pacienta je potrebné brať do úvahy štandardné príručky.
* S ohľadom na blokády veľkých nervov je možné uviesť odporúčanie na dávkovanie iba pre blok brachiálneho plexu. Pre iné blokády veľkých nervov môžu byť potrebné nižšie dávky. V súčasnosti však nie sú žiadne skúsenosti so špecifickými odporúčaniami na dávkovanie pri iných blokádach.
1) Má sa použiť postupné zvyšovanie dávkovania, začiatočná dávka približne 100 mg (97,5 mg = 13 ml; 105 mg
= 14 ml) sa má podať v priebehu 3 – 5 minút. Podľa potreby sa môžu podať dve dodatočné dávky, celkovo ďalších 50 mg.
2) n/a = nevzťahuje sa
3) Dávka na blokádu veľkých nervov sa musí prispôsobiť podľa miesta podania a stavu pacienta. Interskalenický a supraklavikulárny blok brachiálneho plexu sa môže spájať s vyššou frekvenciou závažných nežiaducich reakcií bez ohľadu na použité lokálne anestetikum (pozri časť 4.4).
Vo všeobecnosti si chirurgická anestézia (napr. epidurálne podanie) vyžaduje použitie vyšších koncentrácií a dávok. Na epidurálnu anestéziu, pri ktorej je pre chirurgický zákrok nevyhnutná úplná motorická blokáda, sa odporúča liek Ropivacaine Kabi 10 mg/ml. Na analgéziu (napr. epidurálne podanie na liečbu akútnej bolesti) sa odporúčajú nižšie koncentrácie a dávky.
Spôsob podávani a
Na zamedzenie intravaskulárneho podania injekcie sa pred a počas injekčného podania odporúča
opatrná aspirácia. V prípade potreby injekčného podania veľkej dávky sa odporúča skúšobná dávka 3
– 5 ml lidokaínu (lignokaínu) s adrenalínom (epinefrínom). Neúmyselné intravaskulárne podanie injekcie možno rozpoznať na základe dočasného zvýšenia srdcovej frekvencie a náhodné intratekálne podanie injekcie na základe prejavov spinálnej blokády.
Aspiráciu je potrebné vykonať pred a počas podania hlavnej dávky, ktorú je potrebné injekčne podať pomaly alebo v postupne zvyšujúcich sa dávkach, rýchlosťou 25 – 50 mg/min, za dôkladného sledovania životných funkcií pacienta a udržiavania verbálneho kontaktu. Ak sa objavia príznaky toxicity, injekčné podanie je potrebné okamžite ukončiť.
Pri epidurálnej blokáde pri chirurgickom zákroku boli použité a dobre znášané jednorazové dávky až
do 250 mg ropivakaínu.
Pri bloku brachiálneho plexu bola u obmedzeného počtu pacientov použitá a dobre znášaná jednorazová dávka 300 mg.
Pri použití dlhotrvajúcich blokád, buď prostredníctvom kontinuálnej infúzie alebo opakovaného bolusového podania, sa musí zvážiť riziko dosiahnutia toxickej plazmatickej koncentrácie alebo indukcie lokálneho nervového poškodenia. U dospelých boli dobre znášané kumulatívne dávky až do
675 mg ropivakaínu pri chirurgickom zákroku a pooperačnej analgézii podávané počas 24 hodín rovnako, ako aj pooperačné kontinuálne epidurálne infúzie podávané rýchlosťou až do 28 mg/h počas
72 hodín. U obmedzeného počtu pacientov sa podávali vyššie dávky až do 800 mg/deň s relatívne nízkym výskytom nežiaducich reakcií.
Na liečbu pooperačnej bolesti je možné odporučiť nasledujúcu techniku: Epidurálna blokáda s liekom Ropivacaine Kabi 7,5 mg/ml sa indukuje prostredníctvom epidurálneho katétra, pokiaľ je zavedený predoperačne. Analgézia sa udržiava infúziou lieku Ropivacaine Kabi 2 mg/ml. Rýchlosti infúzie 6 –
14 ml (12 – 28 mg) za hodinu poskytujú primeranú analgéziu s iba miernou a neprogresívnou motorickou blokádou vo väčšine prípadov stredne silnej až silnej pooperačnej bolesti. Maximálne
trvanie epidurálnej blokády je 3 dni. Má sa však vykonávať dôkladné sledovanie analgetického účinku
s cieľom odstránenia katétra hneď, ako to bolestivý stav umožňuje. Pri tejto technike sa pozorovalo významné zníženie potreby opioidov.
V klinických štúdiách sa epidurálna infúzia ropivakaínu 2 mg/ml samostatne alebo v zmesi
s fentanylom 1 – 4 µg/ml podávala na liečbu pooperačnej bolesti až počas 72 hodín. Kombinácia ropivakaínu a fentanylu poskytla zlepšenú úľavu od bolesti, spôsobila však opioidné vedľajšie účinky.
Kombinácia ropivakaínu a fentanylu sa skúmala iba v prípade ropivakaínu 2 mg/ml.
Pri použití dlhotrvajúcich periférnych nervových blokád, buď prostredníctvom kontinuálnej infúzie alebo opakovaných injekcií, sa musí zvážiť riziko dosiahnutia toxickej plazmatickej koncentrácie alebo indukcie lokálneho nervového poškodenia. V klinických štúdiách sa pred chirurgickým zákrokom dosiahol femorálny nervový blok s 300 mg ropivakaínu 7,5 mg/ml a interskalenický blok s 225 mg ropivakaínu 7,5 mg/ml. Analgézia sa následne udržiavala s ropivakaínom 2 mg/ml. Rýchlosti infúzie alebo prerušované injekcie 10 – 20 mg za hodinu počas 48 hodín poskytovali primeranú analgéziu a boli dobre znášané.
Pri cisárskom reze neboli zdokumentované koncentrácie vyššie ako 7,5 mg/ml ropivakaínu.
Porucha funkcie obličiek
U pacientov s poruchou funkcie obličiek pri použití jednorazovej dávky alebo v rámci krátkodobej liečby zvyčajne nie je potrebná žiadna úprava dávky (pozri časti 4.4 a 5.2).
Porucha funkcie pečene
Ropivakaín sa metabolizuje v pečeni a u pacientov so závažným ochorením pečene sa má preto používať s opatrnosťou. Môže byť potrebné zníženie opakovaných dávok z dôvodu oneskorenej
eliminácie (pozri časti 4.4 a 5.2).
Pediatrická populácia
Pedi at ri ckí paci ent i vo veku od 0 (donosen í novorodenci ) až do a vrát ane 12 rokov
U detí sa použitie lieku Ropivacaine Kabi 7,5 a 10 mg/ml môže spájať s udalosťami systémovej
a centrálnej toxicity. V tejto populácii je vhodnejšie podávať nižšie sily (2 mg/ml, 5 mg/ml).
4.3 Kontraindikácie
· Precitlivenosť na ropivakaín alebo iné lokálne anestetiká amidového typu alebo na ktorúkoľvek
z pomocných látok uvedených v časti 6.1.
· Do úvahy je potrebné vziať všeobecné kontraindikácie súvisiace s epidurálnou anestéziou, bez ohľadu na použité lokálne anestetikum.
· Intravenózna regionálna anestézia.
· Pôrodnícka paracervikálna anestézia.
· Hypovolémia.
4.4 Osobitné upozornenia a opatrenia pri používaní
Regionálne anestetické postupy sa vždy majú vykonávať v náležite vybavenom prostredí s príslušným personálom. Okamžite má byť k dispozícii vybavenie a lieky potrebné na monitorovanie a núdzovú resuscitáciu.
Pacienti podstupujúci blokády veľkých nervov majú byť v optimálnom stave a pred výkonom blokády majú mať zavedený intravenózny katéter.
Lekár zodpovedný za výkon má prijať potrebné opatrenia na zamedzenie intravaskulárneho podania injekcie (pozri časť 4.2) a má byť náležite vyškolený a oboznámený s diagnostikou a liečbou nežiaducich účinkov, systémovej toxicity a iných komplikácií (pozri časti 4.8 a 4.9) ako je neúmyselné subarachnoidálne podanie injekcie, ktorá môže vyvolať úplnú spinálnu blokádu s apnoe
a hypotenziou. Kŕče sa vyskytli najčastejšie po bloku brachiálneho plexu a epidurálnej blokáde. Je to pravdepodobne následok náhodného intravaskulárneho podania injekcie alebo rýchlej absorpcie
z miesta podania injekcie.
Je potrebná opatrnosť na zamedzenie podania injekcií do zapálených oblastí.
K
ardiovaskulárne účinky
Epidurálna a intratekálna anestézia môže viesť k hypotenzii a bradykardii. Hypotenziu je potrebné liečiť okamžite intravenóznym podaním vazopresíva a vhodnou cievnou náplňou.
Pacienti liečení antiarytmikami triedy III (napr. amiodarón) majú byť pod starostlivým dohľadom, pričom je potrebné zvážiť monitorovanie EKG, keďže účinky na srdce môžu byť aditívne (pozri časť
4.5).
Počas použitia ropivakaínu na epidurálnu anestéziu alebo periférnu nervovú blokádu sa vyskytli
zriedkavé hlásenia zástavy srdca, najmä po neúmyselnom intravaskulárnom podaní u starších
pacientov a u pacientov so súbežným ochorením srdca. Resuscitácia bola v niektorých prípadoch náročná. V prípade výskytu zástavy srdca môže byť potrebná predĺžená resuscitácia na zvýšenie pravdepodobnosti úspešného výsledku.
Blokády v oblasti hlavy a krku
Určité lokálne anestetické postupy, ako sú injekcie do oblastí hlavy a krku, sa môžu spájať s vyššou frekvenciou závažných nežiaducich reakcií, bez ohľadu na použité lokálne anestetikum.
Blokády veľkých periférnych nervov
Blokády veľkých periférnych nervov môžu zahŕňať podanie veľkého objemu lokálneho anestetika do
vysoko vaskularizovaných oblastí, často v blízkosti veľkých ciev, kde je zvýšené riziko intravaskulárneho podania injekcie a/alebo rýchlej systémovej absorpcie, čo môže viesť k vysokým plazmatických koncentráciám.
Precitlivenosť
Do úvahy je potrebné vziať možnú skríženú precitlivenosť s inými lokálnymi anestetikami amidového
typu (pozri časť 4.3).
Hypovolémia
U pacientov s hypovolémiou z akejkoľvek príčiny sa počas epidurálnej anestézie, bez ohľadu na použité lokálne anestetikum, môže objaviť náhla a závažná hypotenzia (pozri časť 4.3).
Pacienti s celkovým zlým zdravotným stavom
Pacienti s celkovým zlým zdravotným stavom v dôsledku starnutia alebo iných kompromitujúcich
faktorov, ako je čiastočná alebo úplná blokáda vodivosti srdca, pokročilé ochorenie pečene alebo závažná dysfunkcia obličiek, si vyžadujú osobitnú pozornosť, hoci regionálna anestézia je u týchto pacientov indikovaná často.
Pacienti s poruchou funkcie pečene a obličiek
Ropivakaín sa metabolizuje v pečeni a u pacientov so závažným ochorením pečene sa má preto
používať s opatrnosťou; môže byť potrebné zníženie opakovaných dávok z dôvodu oneskorenej eliminácie. U pacientov s poruchou funkcie obličiek pri použití jednorazovej dávky alebo v rámci
krátkodobej liečby zvyčajne nie je potrebná žiadna úprava dávky. Acidóza a znížená plazmatická koncentrácia proteínov, ktoré sa často pozorujú u pacientov s chronickým zlyhávaním obličiek, môžu
zvýšiť riziko systémovej toxicity.
Akútna porfýria
Ropivacaine Kabi injekčný roztok je pravdepodobne porfyrinogénny a pacientom s akútnou porfýriou sa má predpisovať len v prípade, keď nie je k dispozícii žiadna bezpečnejšia alternatíva. V prípade
citlivých pacientov je potrebné prijať primerané opatrenia podľa štandardných príručiek a/alebo po
konzultácii s odborníkmi na toto ochorenie.
Chondrolýza
U pacientov, ktorí dostali pooperačnú intraartikulárnu kontinuálnu infúziu lokálnych anestetík vrátane
ropivakaínu, sa po uvedení lieku na trh hlásili prípady chondrolýzy. Väčšina hlásených prípadov chondrolýzy sa týkala ramenného kĺbu. Intraartikulárna kontinuálna infúzia nie je schválenou indikáciou pre ropivakaín. Keďže účinnosť a bezpečnosť neboli stanovené, je potrebné vyhnúť sa intraartikulárnej kontinuálnej infúzii lieku Ropivacaine Kabi.
Pomocné látky so známym účinkom
Ropivacaine Kabi 2 mg/ml:
Tento liek obsahuje 3,4 mg sodíka na ml, čo zodpovedá 0,17 % WHO odporúčaného maximálneho denného príjmu 2 g sodíka pre dospelú osobu.
Ropivacaine Kabi 7,5 mg/ml:
Tento liek obsahuje 2,99 mg sodíka na ml, čo zodpovedá 0,15 % WHO odporúčaného maximálneho denného príjmu 2 g sodíka pre dospelú osobu.
Ropivacaine Kabi 10 mg/ml:
Tento liek obsahuje 2,8 mg sodíka na ml, čo zodpovedá 0,14 % WHO odporúčaného maximálneho denného príjmu 2 g sodíka pre dospelú osobu.
Predĺžené podávanie
Predĺženému podávaniu ropivakaínu je potrebné sa vyhnúť u pacientov súbežne liečených silnými
inhibítormi CYP1A2, ako je fluvoxamín a enoxacín (pozri časť 4.5).
Pediatrická populácia
Ropivacaine Kabi 2 mg/ml:
U novorodencov môže byť potrebná osobitná starostlivosť z dôvodu nezrelosti metabolických dráh. Výraznejšie kolísanie plazmatických koncentrácií ropivakaínu pozorované v klinických skúšaniach
u novorodencov naznačuje, že v tejto vekovej skupine môže byť zvýšené riziko systémovej toxicity, najmä počas kontinuálnej epidurálnej infúzie. Odporúčané dávky u novorodencov sú založené na obmedzených klinických údajoch. Keď sa ropivakaín používa v tejto skupine pacientov, je potrebné
pravidelné monitorovanie pre systémovú toxicitu (napr. podľa prejavov toxicity pre CNS, EKG, SPO2)
a lokálnu neurotoxicitu (napr. predĺžené zotavovanie sa), v ktorom je potrebné pokračovať po
ukončení infúzie z dôvodu pomalej eliminácie u novorodencov.
- Bezpečnosť a účinnosť ropivakaínu 2 mg/ml pri použití na blokádu nervových vlákien v okolí rany/operačného poľa (field block) u detí vo veku až do a vrátane 12 rokov neboli stanovené.
- Bezpečnosť a účinnosť ropivakaínu 2 mg/ml pri použití na periférnu nervovú blokádu u dojčiat
vo veku menej ako 1 rok neboli stanovené.
Ropivacaine Kabi 7,5 mg/ml a Ropivacaine Kabi 10 mg/ml:
- Bezpečnosť a účinnosť ropivakaínu 7,5 a 10 mg/ml u detí vo veku až do a vrátane 12 rokov neboli stanovené.
4.5 Liekové a iné interakcie
Ropivacaine Kabi sa má používať s opatrnosťou u pacientov dostávajúcich iné lokálne anestetiká alebo liečivá štrukturálne podobné lokálnym anestetikám amidového typu, napr. určité antiarytmiká ako sú lidokaín a mexiletín, keďže systémové toxické účinky sú aditívne. Súbežné použitie lieku Ropivacaine Kabi s celkovými anestetikami alebo opioidmi môže vzájomne zosilniť (nežiaduce)
účinky. Neuskutočnili sa špecifické interakčné štúdie s ropivakaínom a antiarytmikami triedy III (napr.
amiodarón), odporúča sa však opatrnosť (pozri tiež časť 4.4).
Cytochróm P450 (CYP) 1A2 je zapojený do tvorby hlavného metabolitu, 3-hydroxy-ropivakaínu. Plazmatický klírens ropivakaínu in vivo bol počas súbežného podávania fluvoxamínu, selektívneho a silného inhibítora CYP1A2, znížený až o 77 %. Silné inhibítory CYP1A2, ako sú fluvoxamín
a enoxacín, podávané súbežne počas predĺženého podávania lieku Ropivacaine Kabi môžu preto ovplyvňovať liek Ropivacaine Kabi. Predĺženému podávaniu ropivakaínu je potrebné sa vyhnúť u pacientov súbežne liečených silnými inhibítormi CYP1A2, pozri tiež časť 4.4.
Plazmatický klírens ropivakaínu in vivo bol počas súbežného podávania ketokonazolu, selektívneho a silného inhibítora CYP3A4, znížený o 15 %. Nie je však pravdepodobné, že inhibícia tohto izoenzýmu má klinický význam.
Ropivakaín je in vitro kompetitívnym inhibítorom CYP2D6, zdá sa však, že pri klinicky dosiahnutých plazmatických koncentráciách neinhibuje tento izoenzým.
4.6 Fertilita, gravidita a laktácia
G
r
avidita
S výnimkou epidurálneho podania v rámci použitia v pôrodníctve nie sú k dispozícii dostatočné údaje
o použití ropivakaínu počas gravidity u ľudí. Experimentálne štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky z hľadiska gravidity, embryonálneho/fetálneho vývinu, pôrodu alebo postnatálneho vývinu (pozri časť 5.3).
DojčenieK dispozícii nie sú žiadne údaje o vylučovaní ropivakaínu do ľudského materského mlieka.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeuskutočnili sa žiadne štúdie týkajúce sa účinku na schopnosť viesť vozidlá a obsluhovať stroje.
V závislosti od dávky môžu mať lokálne anestetiká mierny vplyv na mentálne funkcie a koordináciu
dokonca aj v prípade absencie zjavnej toxicity pre CNS a môžu dočasne narúšať lokomóciu
a ostražitosť.
4.8 Nežiaduce účinkyVšeobecné informácieProfil nežiaducich reakcií lieku Ropivacaine Kabi je podobný ako v prípade iných dlhodobo
pôsobiacich lokálnych anestetík amidového typu. Nežiaduce liekové reakcie je potrebné odlíšiť od fyziologických účinkov samotnej nervovej blokády, napr. hypotenzia a bradykardia počas
spinálnej/epidurálnej blokády a udalosti spôsobené vpichom ihly (napr. spinálny hematóm,
postpunkčná bolesť hlavy, meningitída a epidurálny absces).
Najčastejšie hlásené nežiaduce reakcie, nevoľnosť a hypotenzia, sú počas anestézie a chirurgického zákroku vo všeobecnosti veľmi časté a nie je možné odlíšiť nežiaduce reakcie zapríčinené klinickou situáciou od nežiaducich reakcií spôsobených liekom alebo blokádou.
Percento pacientov, u ktorých možno očakávať výskyt nežiaducich reakcií, sa líši podľa cesty podania lieku Ropivacaine Kabi. Systémové a lokalizované nežiaduce reakcie ropivakaínu sa vyskytujú zvyčajne z dôvodu nadmerného dávkovania, rýchlej absorpcie alebo neúmyselného intravaskulárneho podania injekcie.
Tabuľkový zoznamnežiaducichreakciíFrekvencie použité v tabuľke v časti 4.8 sú: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej
časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000)
a neznáme (nie je možné odhadnúť z dostupných údajov).
Trieda orgánových systémov
| Frekvencia
| Nežiaduci účinok
|
Poruchy imunitného systému
| Zriedkavé
| Alergické reakcie (anafylaktické
reakcie, angioneurotický edém
a urtikária)
|
Psychické poruchy
| Menej časté
| Úzkosť
|

Poruchy nervového systému
|
Časté
|
Parestézia, závrat, bolesť hlavy
|
|
Menej časté
|
Príznaky toxicity pre CNS (kŕče,
veľké epileptické záchvaty, záchvaty, pocit točenia, cirkumorálna parestézia, necitlivosť jazyka, hyperakúzia, tinitus,
poruchy zraku, dyzartria, svalové zášklby, triaška)*, hypestézia
|
|
Neznáme
|
Dyskinéza
|
Poruchy srdca a srdcovej činnosti
|
Časté
|
Bradykardia, tachykardia
|
|
Zriedkavé
|
Zástava srdca, srdcové arytmie
|
Poruchy ciev
|
Veľmi časté
|
Hypotenziaa
|
|
Časté
|
Hypertenzia
|
|
Menej časté
|
Synkopa
|
Poruchy dýchacej sústavy,
hrudníka a mediastína
|
Menej časté
|
Dyspnoe
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté
|
Nevoľnosť
|
|
Časté
|
Vracanieb
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
|
Časté
|
Bolesť chrbta
|
Poruchy obličiek a močových ciest
|
Časté
|
Retencia moču
|
Celkové poruchy a reakcie v mieste
podania
|
Časté
|
Zvýšenie teploty, stuhnutosť,
zimnica
|
|
Menej časté
|
Hypotermia
|
|
|
a Hypotenzia je menej častá u detí (> 1/100 až < 1/10).
b Vracanie je častejšie u detí (> 1/10).
* Tieto príznaky sa zvyčajne vyskytujú z dôvodu neúmyselného intravaskulárneho podania injekcie, predávkovania alebo rýchlej absorpcie, pozri časť 4.9.
Popis vybraných nežiaducich reakciíNeurologické komplikácieS regionálnou anestéziou bez ohľadu na použité lokálne anestetikum sa spája neuropatia a dysfunkcia miechy (napr. syndróm prednej spinálnej artérie, arachnoiditída,
cauda equina), ktoré môžu
v zriedkavých prípadoch viesť k trvalým následkom.
Úplný spinálny blokAk sa epidurálna dávka neúmyselne podá intratekálne, môže sa vyskytnúť úplný spinálny blok.
Akútna systémová toxicitaSystémové toxické reakcie zahŕňajú najmä centrálny nervový systém (CNS) a kardiovaskulárny systém (CVS). Takéto reakcie sú spôsobené vysokou koncentráciou lokálneho anestetika v krvi, ktorá
sa môže objaviť v dôsledku (náhodného) intravaskulárneho podania injekcie, predávkovania alebo výnimočne rýchlej absorpcie z vysoko vaskularizovaných oblastí, pozri tiež časť 4.4. Reakcie týkajúce
sa CNS sú podobné v prípade všetkých amidových lokálnych anestetík, zatiaľ čo kardiálne reakcie sú
viac závislé od lieku, kvantitatívne aj kvalitatívne.
Toxicita pre centrálny nervový systémToxicita pre centrálny nervový systém je stupňovitá odpoveď s príznakmi a prejavmi stúpajúcej závažnosti. Na začiatku sa pozorujú príznaky ako sú poruchy zraku alebo sluchu, periorálna
necitlivosť, závrat, pocit točenia, mravčenie a parestézia. Dyzartria, svalová stuhnutosť a svalové
zášklby sú závažnejšie a môžu predchádzať nástupu generalizovaných záchvatov. Tieto prejavy si nemožno mýliť s neurotickým správaním. Nasledovať môže bezvedomie a veľké epileptické záchvaty,
ktoré môžu trvať pár sekúnd až niekoľko minút. Počas záchvatov dochádza rýchlo k hypoxii
a hyperkapnii z dôvodu zvýšenej svalovej aktivity spolu s narušením dýchania. V závažných prípadoch sa môže dokonca vyskytnúť apnoe. Respiračná a metabolická acidóza zvyšuje a predlžuje toxické účinky lokálnych anestetík.
Po redistribúcii liečiva z centrálneho nervového systému nasleduje zotavenie a následne sa liečivo
metabolizuje a vylúči. Zotavenie môže byť rýchle, ak nebolo injekčne podané veľké množstvo lieku.
Toxicita pre kardiovaskulárny systémKardiovaskulárna toxicita naznačuje závažnejšiu situáciu. V dôsledku vysokých systémových koncentrácií lokálnych anestetík sa môže vyskytnúť hypotenzia, bradykardia, arytmia a dokonca zástava srdca. Intravenózna infúzia ropivakaínu viedla u dobrovoľníkov k prejavom útlmu vodivosti a kontraktility.
Kardiovaskulárnym toxickým účinkom zvyčajne predchádzajú prejavy toxicity v centrálnom nervovom systéme, ak pacient nedostáva celkové anestetikum alebo nie je pod vplyvom silných sedatív ako sú benzodiazepíny alebo barbituráty.'
PediatrickápopuláciaOčakáva sa, že frekvencia, typ a závažnosť nežiaducich reakcií bude u detí rovnaká ako u dospelých s výnimkou hypotenzie, ktorá sa u detí vyskytuje menej často (> 1 zo 100 až < 1 z 10), a vracania, ktoré sa u detí vyskytuje častejšie (> 1 z 10).
U detí môže byť náročné zaznamenať skoré prejavy toxicity lokálnych anestetík, keďže nemusia byť schopné ich verbálne vyjadriť, pozri tiež časť 4.4.
LiečbaakútnejsystémovejtoxicityPozri časť 4.9.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 Predávkovanie Prí z nakyNáhodné intravaskulárne podanie injekcie lokálnych anestetík môžu spôsobiť okamžité (v priebehu
sekúnd až pár minút) systémové toxické reakcie. V prípade predávkovania sa maximálne plazmatické koncentrácie nemusia dosiahnuť počas jednej až dvoch hodín, v závislosti od miesta podania injekcie, a prejavy toxicity preto môžu byť oneskorené (pozri časť 4.8).
Lie čbaAk sa objavia prejavy akútnej systémovej toxicity, injekčné podanie lokálneho anestetika sa má
okamžite zastaviť a príznaky týkajúce sa CNS (kŕče, útlm CNS) sa musia okamžite liečiť vhodnou
podporou dýchacích ciest/dýchania a podaním antikonvulzív.
V prípade výskytu zástavy krvného obehu, je potrebné ihneď začať kardiopulmonálnu resuscitáciu. Životne dôležitá je optimálna oxygenácia, ventilácia a podpora krvného obehu, ako aj liečba acidózy.
Ak sa vyskytne kardiovaskulárny útlm (hypotenzia, bradykardia), je potrebné zvážiť vhodnú liečbu intravenóznymi tekutinami, vazopresívom a/alebo inotropnými liekmi. Deťom je potrebné podať dávky úmerné veku a hmotnosti.
V prípade výskytu zástavy srdca si môže úspešný výsledok vyžadovať predĺženú resuscitáciu.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: lokálne anestetiká, amidy; ATC kód: N01BB09
Ropivakaín je dlhodobo pôsobiace lokálne anestetikum amidového typu s anestetickým aj analgetickým účinkom. Ropivakaín vo vysokých dávkach vyvoláva chirurgickú anestéziu, zatiaľ čo pri nižších dávkach vyvoláva senzorickú blokádu s obmedzenou a neprogresívnou motorickou blokádou.
Mechanizmus predstavuje reverzibilné zníženie priepustnosti membrány nervového vlákna pre sodíkové ióny. Zníži sa tak rýchlosť depolarizácie a zvýši sa prah excitability, čo vedie k lokálnej blokáde nervových impulzov.
Najcharakteristickejšou vlastnosťou ropivakaínu je dlhé trvanie účinku. Nástup a trvanie lokálnej anestetickej účinnosti závisia od miesta podania a dávky, nie sú však ovplyvnené prítomnosťou vazokonstrikčnej látky (napr. adrenalínu (epinefrínu)). Pre podrobnosti týkajúce sa nástupu a trvania účinku lieku Ropivacaine Kabi, pozri časť 4.2.
Zdraví dobrovoľníci vystavení intravenóznym infúziám dobre znášali ropivakaín v nízkych dávkach
a pri maximálnej znášanej dávke sa vyskytli očakávané príznaky týkajúce sa CNS. Klinické skúsenosti s ropivakaínom naznačujú priaznivé bezpečnostné rozpätie, keď sa liek používa primerane
v odporúčaných dávkach.
5.2 Farmakokinetické vlastnosti
Absorpcia a distribúcia
Ropivakaín má chirálne centrum a je k dispozícii ako čistý S-(-)-enantiomér. Je vysoko rozpustný
v lipidoch. Všetky metabolity majú lokálny anestetický účinok, ale výrazne nižšiu účinnosť a kratšie
trvanie účinku než ropivakaín.
Neexistuje žiadny dôkaz in vivo racemizácie ropivakaínu.
Plazmatická koncentrácia ropivakaínu závisí od dávky, cesty podania a vaskularizácie miesta podania
injekcie. Ropivakaín má lineárnu farmakokinetiku a Cmax je úmerná dávke.
Ropivakaín vykazuje u dospelých úplnú a dvojfázovú absorpciu z epidurálneho priestoru s polčasom týchto dvoch fáz približne 14 minút a 4 hodiny. Pomalá absorpcia je faktor obmedzujúci rýchlosť pri eliminácii ropivakaínu, čo vysvetľuje, prečo je zjavný polčas eliminácie dlhší po epidurálnom podaní než po intravenóznom podaní. Ropivakaín vykazuje dvojfázovú absorpciu z kaudálneho epidurálneho priestoru aj u pediatrických pacientov.
Ropivakaín má po intravenóznom podaní priemerný celkový plazmatický klírens približne
440 ml/min, renálny klírens 1 ml/min, distribučný objem v rovnovážnom stave 47 litrov a terminálny
polčas 1,8 h. Ropivakaín má stredný pomer hepatálnej extrakcie okolo 0,4. Viaže sa najmä na α1-kyslý glykoproteín (α1-acid glycoprotein, AAG) v plazme s neviazanou frakciou približne 6 %.
Počas kontinuálnej epidurálnej a interskalenickej infúzie sa pozorovalo zvýšenie celkových
plazmatických koncentrácií, čo je spojené s pooperačným zvýšením hladiny α1-kyslého glykoproteínu.
Kolísanie neviazanej, t. j. farmakologicky aktívnej koncentrácie bolo oveľa nižšie než kolísanie celkovej plazmatickej koncentrácie.
Keďže ropivakaín má stredný až nízky pomer hepatálnej extrakcie, rýchlosť jeho eliminácie by mala závisieť od plazmatickej koncentrácie neviazanej frakcie. V pediatrických štúdiách a v štúdiách
u dospelých sa pozorovalo, že pooperačným zvýšením AAG sa zníži neviazaná frakcia v dôsledku
zvýšenej väzby na proteíny, čím sa zníži celkový klírens a výsledkom je zvýšenie celkových plazmatických koncentrácií. Klírens neviazaného ropivakaínu ostáva nezmenený, čo dokazujú stabilné koncentrácie neviazanej frakcie počas pooperačnej infúzie. Práve plazmatická koncentrácia neviazanej frakcie súvisí so systémovými farmakodynamickými účinkami a toxicitou.
Ropivakaín ľahko prechádza cez placentu, pričom sa rýchlo dosiahne rovnováha, pokiaľ ide
o koncentráciu neviazanej frakcie. Stupeň väzby na plazmatické proteíny u plodu je nižší než u matky,
čo vedie k nižším celkovým plazmatickým koncentráciám u plodu než u matky.
Biotransformáciaaeliminácia
Ropivakaín je v rozsiahlej miere metabolizovaný, prevažne aromatickou hydroxyláciou. Po intravenóznom podaní sa celkovo 86 % dávky vylúči močom, z toho asi len 1 % vo forme nezmeneného liečiva. Hlavný metabolit je 3-hydroxy-ropivakaín, z ktorého sa asi 37 % vylúči močom, najmä v konjugovanej forme. Urinárna exkrécia 4-hydroxy-ropivakaínu, N-dealkylovaného metabolitu (PPX) a 4-hydroxy-dealkylovaného metabolitu tvorí 1 – 3 %. Konjugovaný a nekonjugovaný
3-hydroxy-ropivakaín vykazuje len sotva detegovateľné koncentrácie v plazme.
U pediatrických pacientov vo veku viac ako jeden rok sa v porovnaní s dospelými zistil podobný profil
metabolitov.
Porucha funkcie obličiek má malý alebo žiadny vplyv na farmakokinetiku ropivakaínu. Renálny klírens PPX výrazne súvisí s klírensom kreatinínu. Nedostatok vzájomnej súvislosti medzi celkovou expozíciou vyjadrenou ako AUC a klírensom kreatinínu naznačuje, že celkový klírens PPX zahŕňa okrem renálnej exkrécie aj nerenálnu elimináciu. Niektorí pacienti s poruchou funkcie obličiek môžu vykazovať zvýšenú expozíciu PPX vyplývajúcu z nízkeho nerenálneho klírensu. Vzhľadom na
zníženú toxicitu PPX pre CNS v porovnaní s ropivakaínom sa klinické následky pri krátkodobej liečbe považujú za zanedbateľné. Pacienti s ochorením obličiek v konečnom štádiu podstupujúci dialýzu sa
neskúmali.
Pediatrickápopulácia
Farmakokinetika ropivakaínu bola charakterizovaná v spojenej populačnej FK analýze na údajoch
u 192 detí vo veku v rozsahu 0 a 12 rokov. Klírens neviazaného ropivakaínu a PPX a distribučný
objem neviazaného ropivakaínu závisia až do zrelosti hepatálnej funkcie od telesnej hmotnosti aj veku,
následne závisia prevažne od telesnej hmotnosti. Dozrievanie klírensu neviazaného ropivakaínu sa zdá byť úplné do veku 3 rokov, klírensu PPX do veku 1 roku a distribučného objemu neviazaného
ropivakaínu do veku 2 rokov. Distribučný objem neviazaného PPX závisí iba od telesnej hmotnosti.
Vzhľadom na to, že PPX má dlhší polčas a nižší klírens, môže sa počas epidurálnej infúzie akumulovať.
Klírens neviazaného ropivakaínu (Cln) pri veku nad 6 mesiacov dosahoval hodnoty v rámci rozsahu hodnôt u dospelých. Hodnoty celkového klírensu (Cl) ropivakaínu uvedené v tabuľke nižšie sú hodnoty, ktoré nie sú ovplyvnené pooperačným zvýšením AAG.
Odhady farmakokinetických parametrov odvodených zo spojenej pediatrickej populačnej FK
analýzy
V
eková
skupina
|
B
W
a
kg
|
C
l
u
b
(
l
/
h/kg)
|
V
u
c
(
l
/
kg)
|
C
l
d
(
l
/
h/kg)
|
e
(
h)
|
f
(
h)
|
Novorodenec
|
3,27
|
2,40
|
21,86
|
0,096
|
6,3
|
43,3
|
1 mesiac
|
4,29
|
3,60
|
25,94
|
0,143
|
5,0
|
25,7
|
6 mesiacov
|
7,85
|
8,03
|
41,71
|
0,320
|
3,6
|
14,5
|
1 rok
|
10,15
|
11,32
|
52,60
|
0,451
|
3,2
|
13,6
|
4 roky
|
16,69
|
15,91
|
65,24
|
0,633
|
2,8
|
15,1
|
10 rokov
|
32,19
|
13,94
|
65,57
|
0,555
|
3,3
|
17,8
|
|
|
t
1/2
t
1/2ppx
a Medián telesnej hmotnosti pre príslušný vek podľa databázy WHO.
b Klírens neviazaného ropivakaínu
c Distribučný objem neviazaného ropivakaínu
d Celkový klírens ropivakaínu
e Terminálny polčas ropivakaínu
f Terminálny polčas PPX
Simulovaná priemerná maximálna plazmatická koncentrácia neviazanej frakcie (Cumax) po jednorazovej kaudálnej blokáde bola vyššia skôr u novorodencov a čas do dosiahnutia Cumax (tmax) sa znižoval so zvyšujúcim sa vekom. Simulované priemerné plazmatické koncentrácie neviazanej frakcie na konci 72 h kontinuálnej epidurálnej infúzie pri odporúčaných rýchlostiach dávky tiež preukázali vyššie hladiny u novorodencov v porovnaní s hladinami u dojčiat a detí. Pozri tiež časť 4.4.
Simulovaný priemerný a pozorovaný rozsah Cumax neviazanej frakcie po jednorazovej
kaudálnej blokáde
V
eková skupina
|
D
ávka
(m
g
/
kg)
|
a
(m
g
/
l
)
|
b
(
h)
|
c
(m
g
/
l
)
|
0 – 1 mesiac
|
2,00
|
0,0582
|
2,00
|
0,05 – 0,08 (n = 5)
|
1 – 6 mesiacov
|
2,00
|
0,0375
|
1,50
|
0,02 – 0,09 (n = 18)
|
6 – 12 mesiacov
|
2,00
|
0,0283
|
1,00
|
0,01 – 0,05 (n = 9)
|
1 – 10 rokov
|
2,00
|
0,0221
|
0,50
|
0,01 – 0,05 (n = 60)
|
|
|
C
u
m
a
x
t
m
ax
C
u
m
a
x
a Maximálna plazmatická koncentrácia neviazanej frakcie
b Čas do dosiahnutia maximálnej plazmatickej koncentrácie neviazanej frakcie
c Pozorovaná a dávkovo štandardizovaná maximálna plazmatická koncentrácia neviazanej frakcie
Vo veku 6 mesiacov, hraničnej hodnote pre zmenu odporúčanej rýchlosti dávky pri kontinuálnej epidurálnej infúzii, dosiahol klírens neviazaného ropivakaínu 34 % jeho zrelej hodnoty a klírens neviazaného PPX 71 %. Systémová expozícia je vyššia u novorodencov a tiež o niečo vyššia u dojčiat vo veku medzi 1 a 6 mesiacov v porovnaní so staršími deťmi, čo súvisí s nezrelosťou ich hepatálnej funkcie. Je to však čiastočne vykompenzované odporúčanou o 50 % nižšou rýchlosťou dávky kontinuálnej infúzie u dojčiat vo veku menej ako 6 mesiacov.
Simulácie na súčte plazmatických koncentrácií neviazaného ropivakaínu a PPX na základe FK parametrov a ich odlišnosti v populačnej analýze naznačujú, že na jednorazovú kaudálnu blokádu sa odporúčaná dávka musí zvýšiť na základe koeficientu 2,7 v najmladšej skupine a koeficientu 7,4
v skupine vo veku 1 až 10 rokov, aby horná hranica predikovaného 90 % intervalu spoľahlivosti
siahala k prahu pre systémovú toxicitu. Príslušné koeficienty pre kontinuálnu epidurálnu infúziu sú 1,8
a 3,8, v uvedenom poradí.
Simulácie na súčte plazmatických koncentrácií neviazaného ropivakaínu a PPX na základe FK parametrov a ich odlišnosti v populačnej analýze naznačujú, že pre dojčatá a deti vo veku 1 až 12 rokov podstupujúce jednorazovú periférnu (ilioinguinálnu) nervovú blokádu s podaním 3 mg/kg, bol medián maximálnej koncentrácie neviazanej frakcie dosiahnutý po 0,8 h je 0,0347 mg/l, čo predstavuje jednu desatinu prahu toxicity (0,34 mg/l). Horná hranica 90 % intervalu spoľahlivosti pre maximálnu plazmatickú koncentráciu neviazanej frakcie je 0,074 mg/l, čo predstavuje jednu pätinu
prahu toxicity. Podobne pri kontinuálnej periférnej blokáde (0,6 mg ropivakaínu/kg počas 72 h), ktorej predchádzala jednorazová periférna nervová blokáda s podaním 3 mg/kg, je medián maximálnej koncentrácie neviazanej frakcie 0,053 mg/l. Horná hranica 90 % intervalu spoľahlivosti pre
maximálnu plazmatickú koncentráciu neviazanej frakcie je 0,088 mg/l, čo predstavuje jednu štvrtinu prahu toxicity.
5.3 Predklinické údaje o bezpečnosti
Na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po jednorazovom podaní a po opakovanom podávaní, reprodukčnej toxicity, mutagénneho potenciálu a lokálnej toxicity sa neodhalili žiadne riziká pre ľudí okrem tých, ktoré možno očakávať na základe farmakodynamického účinku vysokých dávok ropivakaínu (napr. prejavy týkajúce sa CNS vrátane kŕčov a kardiotoxicity).
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
chlorid sodný
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
voda na injekcie
6.2 Inkompatibility
Nevykonali sa žiadne štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
V alkalických roztokoch sa môže objaviť precipitácia, keďže ropivakaín vykazuje slabú rozpustnosť
pri pH > 6,0.
6.3 Čas použiteľnosti
Časpoužiteľnostipredotvorením
3 roky
Časpoužiteľnostipo otvorení
Musí sa použiť ihneď.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Ropivacaine Kabi 2 mg/ml:
10 ml priehľadná polypropylénová ampulka.
20 ml priehľadná polypropylénová ampulka.
Ropivacaine Kabi 7,5 mg/ml:
10 ml priehľadná polypropylénová ampulka.
20 ml priehľadná polypropylénová ampulka.
Ropivacaine Kabi 10 mg/ml:
10 ml priehľadná polypropylénová ampulka.
20 ml priehľadná polypropylénová ampulka.
Polypropylénové ampulky sú špeciálne navrhnuté tak, aby sedeli na striekačky Luer lock a Luer fit.
Veľkosti balenia:
1, 5, 10 ampuliek (ampulka) v blistrovom balení.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Zaobchádzanie
Lieky Ropivacaine Kabi sú určené len na jednorazové použitie. Všetok nepoužitý roztok zlikvidujte.
Pred použitím sa má liek vizuálne skontrolovať. Roztok sa má použiť iba v prípade, že je číry,
prakticky bez prítomnosti častíc a obal nie je poškodený. Neporušený obal sa nesmie opätovne autoklávovať.
Likvidácia
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Fresenius Kabi s.r.o.
Na strži 1702/65, Nusle
140 00 Praha 4
Česká republika
8. REGISTRAČNÉ ČÍSLA
Ropivacaine Kabi 2 mg/ml injekčný roztok: 01/0109/22-S Ropivacaine Kabi 7,5 mg/ml injekčný roztok: 01/0111/22-S Ropivacaine Kabi 10 mg/ml injekčný roztok: 01/0112/22-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 29. apríla 2022
10. DÁTUM REVÍZIE TEXTU
06/2022