
A4. Tým inhibuje CYP3A4. Preto je REYATAZ kontraindikovaný pri podávaní s liekmi, ktoré sú substrátmi CYP3A4 a majú úzky terapeutický index: astemizol, terfenadín, cisaprid, pimozid, chinidín, bepridil, triazolam, perorálne podávaný midazolam a námeľové alkaloidy, hlavne ergotamín a dihydroergotamín (pozri časť 4.3).
Iné interakcie
Interakcie medzi atazanavirom a inými liekmi sú uvedené v tabuľke nižšie (zvýšenie je uvedené ako “↑”, zníženie ako “↓”, bez zmeny ako “↔”). V prípade dostupnosti sú v zátvorke uvedené 90 % intervaly spoľahlivosti (IS). Štúdie uvedené v tabuľke 2 boli vykonané na zdravých dobrovoľníkoch, pokiaľ nie je inak uvedené. Je dôležité poznamenať, že mnohé štúdie boli vykonané s atazanavirom bez potencovania jeho účinku, čo nie je odporúčaný režim pre atazanavir (pozri časť 4.4). Ak je ukončenie liečby ritonavirom požadované z medicínskeho hľadiska za reštriktívnych podmienok (pozri časť 4.4), špeciálna pozornosť sa má venovať interakciám atazanaviru, ktoré sa môžu pri absencii ritonaviru zmeniť (pozri informácie nižšie Tabuľka 2).
Tabuľka 2: Interakcie medzi REYATAZOM a inými liekmi
L
i
eky podľa terapeutickej
oblasti
Interakcie Odporúčania týkajúce sa
s
úbežného podávania
ANT
IRETROVÍRUSOVÉ LIEKY
P
roteázové inhibítory: Súbežné podávanie REYATAZU/ritonaviru a iných proteázových inhibítorov nebolo skúmané, ale dá sa očakávať zvýšenie expozície na iné proteázové inhibítory. Preto sa súbežné podávanie neodporúča.
R
it
onavir 100 mg raz denne
(atazanavir 300 mg raz denne)
Štúdie vykonané na HIV
infikovaných pacientoch.
Atazanavir AUC: ↑250 % (↑144 %
↑403 %)*
Atazanavir Cmax: ↑120 % (↑56 %
↑211 %)*
Atazanavir Cmin: ↑713 % (↑359 %
↑1 339 %)*
Ritonavir 100 mg raz denne sa používa ako booster pre farmakokinetiku atazanaviru.
* V kombinovaných analýzach sa
atazanavir v dávke 300 mg a ritonavir
v dávke 100 mg (n=33) porovnával
s atazanavirom v dávke 400 mg bez ritonaviru (n=28).
Mechanizmus interakcie medzi
atazanavirom a ritonavirom je
CYP3A4 inhibícia.
Indinavir Indinavir sa spája s nepriamou nekonjugovanou hyperbilirubinémiou vplyvom inhibície UGT.
Nukleozidové/nukleotidové inhibítory reverznej transkriptázy (NRTI)
Súbežné podávanie REYATAZU a indinaviru sa neodporúča (pozri časť 4.4).
L
amivudín 150 mg dvakrát denne + zidovudín 300 mg dvakrát denne
(atazanavir 400 mg raz denne)
Nepozoroval sa signifikantný účinok na koncentrácie lamivudínu
a zidovudínu.
Na základe týchto údajov
a z dôvodu, že sa u ritonaviru
neočakáva významný vplyv na farmakokinetiku NRTI, sa pri súbežnom podávaní týchto liekov a REYATAZU neočakáva signifikantná zmena expozície súbežne podávaných liekov.
 A
bakavir
A
bakavir Pri súbežnom podávaní abakaviru a REYATAZU sa neočakáva siginifikantná zmena expozície abakaviru.
 D
i
danozín (pufrované tablety)
200 mg/stavudín 40 mg,
obidva ako jednorazová dávka
D
i
danozín (pufrované tablety)
200 mg/stavudín 40 mg,
obidva ako jednorazová dávka (atazanavir 400 mg jednorazová dávka)
Didanozín (gastrorezistentné kapsuly) 400 mg jednorazová dávka(atazanavir 300 mg raz denne
s ritonavirom 100 mg raz denne)
Atazanavir, súbežne podávaný
s ddI+d4T (nalačno)
Atazanavir AUC ↓87 % (↓92 %
↓79 %)
Atazanavir Cmax ↓89 % (↓94 % ↓82 %)
Atazanavir Cmin ↓84 % (↓90 % ↓73 %)
Atazanavir, podávaný 1 hodinu po ddI+d4T (nalačno)
Atazanavir AUC ↔3 % (↓36 %
↑67 %)
Atazanavir Cmax ↑12 % (↓33 % ↑18 %)
Atazanavir Cmin ↔3 % (↓39 % ↑73 %)
Koncentrácie atazanaviru boli značne znížené, keď sa podával súbežne
s didanozínom (pufrované tablety)
a stavudínom. Mechanizmus interakcie je v redukovaní solubility atazanaviru so zvýšením pH vo vzťahu
k prítomnosti antacíd v pufrovaných tabletách didanozínu.
Nepozoroval sa signifikantný účinok na koncentrácie didanozínu
a stavudínu.
Didanozín (s jedlom)
Didanozín AUC ↓34 % (↓41 % ↓27 %)
Didanozín Cmax ↓38 % (↓48 % ↓26 %) Didanozín Cmin ↑25 % (↓8 % ↑69 %)
Nepozoroval sa signifikantný účinok na koncentrácie atazanaviru, keď sa podával s didanozínom vo forme gastrorezistentných kapsúl, ale podávanie s jedlom znížilo koncentrácie didanozínu.
Didanozín sa má podávať nalačno 2 hodiny po podaní REYATAZU užitého s jedlom. Pri súbežnom podávaní stavudínu a REYATAZU sa neočakáva signifikantná zmena expozície stavudínu.
T
enofovir-dizoproxilfumarát
300 mg raz denne
(atazanavir 300 mg raz denne
s ritonavirom 100 mg raz denne)
Štúdie vykonané na HIV
infikovaných pacientoch
Tenofovir-dizoproxilfumarát
300 mg raz denne
(atazanavir 300 mg raz denne
s ritonavirom 100 mg raz denne)
Atazanavir AUC ↓22 % (↓35 % ↓6 %)
*
Atazanavir Cmax ↓16 % (↓30 % ↔0 %)
*
Atazanavir Cmin ↓23 % (↓43 % ↑2 %) *
* V kombinovaných analýzach
z niekoľkých klinických štúdií bol atazanavir/ritonavir 300/100 mg súbežne podávaný s tenofovir- dizoproxilfumarátom v dávke 300 mg (n=39) porovnávaný
s atazanavirom/ritonavirom v dávke
300/100 mg (n=33).
Účinnosť REYATAZU/ritonaviru v kombinácii s tenofovir- dizoproxilfumarátom u pacientov po predchádzajúcej liečbe bola demonštrovaná v klinickej štúdii 045 a v liečbe pacientov bez predchádzajúcej liečby v klinickej štúdii 138 (pozri časti 4.8 a 5.1). Mechanizmus interakcie medzi atazanavirom a tenofovir- dizoproxilfumarátom nie je známy. Tenofovir-dizoproxilfumarát AUC
↑37 % (↑30 % ↑45 %)
Tenofovir-dizoproxilfumarát Cmax
↑34 % (↑20 % ↑51 %)
Tenofovir-dizoproxilfumarát Cmin
↑29 % (↑21 % ↑36 %)
Ak sa súbežne podáva s tenofovir-dizoproxilfumarátom, odporúča sa, aby sa podával REYATAZ 300 mg so 100 mg ritonaviru a 300 mg tenofovir- dizoproxilfumarátu (všetky ako jednorazová dávka s jedlom).
Pacienti majú byť starostlivo monitorovaní na nežiaduce reakcie súvisiace s tenofovir- dizoproxilfumarátom vrátane renálnych ochorení.
N
enukleozidové inhibítory reverznej transkriptázy (NNRTI)
 E
f
a
virenz 600 mg raz denne
E
f
a
virenz 600 mg raz denne
(atazanavir 400 mg raz denne
s ritonavirom 100 mg raz denne)
Atazanavir (popoludní): všetky podania s jedlom
Atazanavir AUC ↔0 %(↓9 % ↑10 %)*
Atazanavir Cmax ↑17 %(↑8 % ↑27 %)*
Atazanavir Cmin ↓42 %(↓51 % ↓31 %)*
Súbežné podávanie efavirenzu a REYATAZU sa neodporúča (pozri časť 4.4).
 E
f
a
virenz 600 mg raz denne
E
f
a
virenz 600 mg raz denne
(atazanavir 400 mg raz denne
s ritonavirom 200 mg raz denne)
Nevirapín 200 mg dvakrát denne(atazanavir 400 mg raz denne
s ritonavirom 100 mg raz denne)
Štúdia vykonaná na HIV
infikovaných pacientoch
Inhibítory integrázyRaltegravir 400 mg dvakrát denne(atazanavir/ritonavir)
HCV proteázové inhibítoryAtazanavir (popoludní): všetky podania s jedlom
Atazanavir AUC ↔6 % (↓10 %
↑26 %) */**
Atazanavir Cmax ↔9 % (↓5 % ↑26 %)
*/**
Atazanavir Cmin ↔12 % (↓16 %
↑49 %) */**
* Keď je porovnávaný
s REYATAZOM 300 mg/ritonavirom
100 mg raz denne večer bez efavirenzu. Zníženie Cmin atazanaviru môže mať negatívny vplyv na účinnosť atazanaviru. Mechanizmus interakcie efavirenzu/atazanaviru je CYP3A4 indukcia.
** Založené na historickom porovnávaní.
Nevirapín AUC ↑26 % (↑17 % ↑36 %) Nevirapín Cmax ↑21 % (↑11 % ↑32 %) Nevirapín Cmin ↑35 % (↑25 % ↑47 %)
Atazanavir AUC ↓19 % (↓35 % ↑2 %)
*
Atazanavir Cmax ↔2 % (↓15 % ↑24 %)
*
Atazanavir Cmin ↓59 % (↓73 % ↓40 %)
*
* Keď je porovnávaný
s REYATAZOM v dávke 300 mg a ritonavirom v dávke 100 mg bez
nevirapínu. Zníženie Cmin atazanaviru
môže mať negatívny vplyv na
účinnosť atazanaviru. Mechanizmus interakcií nevirapínu/atazanaviru je CYP3A4 indukcia.
Raltegravir AUC ↑41 % Raltegravir Cmax ↑24 % Raltegravir C12hr ↑77 %
Mechanizmom je UGT1A1 inhibícia.
Súbežné podávanie nevirapínu a REYATAZU sa neodporúča (pozri časť 4.4).
Nie je potrebná úprava dávkovania raltegraviru.
B
oceprevir 800 mg trikrát denne
(atazanavir 300 mg/ritonavir
100 mg jedenkrát denne)
boceprevir AUC ↔5 % boceprevir Cmax ↔7 % boceprevir Cmin ↔18 %
atazanavir AUC ↓ 35 % atazanavir Cmax ↓ 25 % atazanavir Cmin ↓ 49 %
ritonavir AUC ↓ 36 % ritonavir Cmax ↓ 27 % ritonavir Cmin ↓ 45 %
Následkom súbežného
podávania atazanaviru/ritonaviru s boceprevirom je znížená
expozícia atazanaviru, ktorá môže byť spojená s nižšou
účinnosťou a stratou kontroly nad HIV. Toto súbežné
podávanie môže byť zvážené prípad od prípadu, ak je to nevyhnutné, u pacientov s
potlačenou záťažou HIV a s vírusovým kmeňom HIV bez
akéhokoľvek podozrenia na rezistenciu liečby HIV. Je potrebné zabezpečiť zvýšené
klinické a laboratórne sledovanie pre HIV supresiu.
ANT
IBIOTIKÁ
Kl
a
ritromycín 500 mg dvakrát denne
(atazanavir 400 mg raz denne)
FUNGICÍDNE LÁTKY Ketokonazol 200 mg raz
denne
(atazanavir 400 mg raz denne)
Klaritromycín AUC ↑94 % (↑75 %
↑116 %)
Klaritromycín Cmax ↑50 % (↑32 %
↑71 %)
Klaritromycín Cmin ↑160 % (↑135 %
↑188 %)
14-OH klaritromycín
14-OH klaritromycín AUC ↓70 %
(↓74 % ↓66 %)
14-OH klaritromycín Cmax ↓72 %
(↓76 % ↓67 %)
14-OH klaritromycín Cmin ↓62 %
(↓66 % ↓58 %)
Atazanavir AUC ↑28 % (↑16 %
↑43 %)
Atazanavir Cmax ↔6 % (↓7 % ↑20 %)
Atazanavir Cmin ↑91 % (↑66 %
↑121 %)
Redukcia dávky klaritromycínu môže viesť k subterapeutickým koncentráciám 14-OH klaritromycínu. Mechanizmus interakcie klaritromycínu/atazanaviru je CYP3A4 inhibícia.
Nepozoroval sa žiaden signifikantný účinok na koncentrácie atazanaviru.
Nie je možné urobiť žiadne odporúčania týkajúce sa redukcie dávky; opatrnosť je preto potrebná, ak sa REYATAZ podáva súbežne
s klaritromycínom.
Ketokonazol a itrakonazol sa
majú
s REYATAZOM/ritonavirom
 Itrakonazol
Itrakonazol Itrakonazol, podobne aj ketokonazol, je silným inhibítorom ako aj substrátom CYP3A4.
používať opatrne, vysoké dávky ketokonazolu a itrakonazolu (>200 mg/deň) sa neodporúčajú.
V
orikonazol 200 mg dvakrát denne (atazanavir
300 mg/ritonavir 100 mg
jedenkrát denne)
Jedinci s minimálne jednou funkčnou alelou pre CYP2C19.
Vorikonazol 50 mg dvakrát denne (atazanavir
300 mg/ritonavir 100 mg
jedenkrát denne)
Jedinci bez funkčnej alely pre
CYP2C19.
Flukonazol 200 mg raz denne
(atazanavir 300 mg a ritonavir
100 mg raz denne)
Vychádzajúc z údajov získaných
z iných potencovaných inhibítorov proteáz a ketokonazolu, v ktorých bola
AUC ketokonazolu 3-násobne vyššia,
sa u REYATAZU/ritonaviru očakáva zvýšenie koncentrácií ketokonazolu
alebo itrakonazolu.
Vorikonazol AUC ↓33 % (↓42 %
↓22 %)
Vorikonazol Cmax ↓10 % (↓22 % ↓4 %) Vorikonazol Cmin ↓39 % (↓49 %
↓28 %)
Atazanavir AUC ↓12 % (↓18 % ↓5 %) Atazanavir Cmax ↓13 % (↓20 % ↓4 %) Atazanavir Cmin ↓ 20 % (↓28 % ↓
10 %)
Ritonavir AUC ↓12 % (↓17 % ↓7 %) Ritonavir Cmax ↓9 % (↓17 % ↔0 %) Ritonavir Cmin ↓25 % (↓35 % ↓14 %)
U väčšiny pacientov s minimálne jednou funkčnou alelou pre CYP2C19 sa očakáva zníženie expozícií vorikonazolu aj atazanaviru.
Vorikonazol AUC ↑561 % (↑451 % ↑
↑699 %)
Vorikonazol Cmax ↑438 % (↑355 %
↑539 %)
Vorikonazol Cmin ↑765 % (↑571 %
↑1 020 %)
Atazanavir AUC ↓20 % (↓35 % ↓3 %)
Atazanavir Cmax ↓19 % (↓34 %
↔0,2 %)
Atazanavir Cmin ↓ 31 % (↓46 % ↓
13 %)
Ritonavir AUC ↓11 % (↓20 % ↓1 %) Ritonavir Cmax ↓11 % (↓24 % ↑4 %) Ritonavir Cmin ↓19 % (↓35 % ↑1 %)
U malého počtu pacientov bez funkčnej alely pre CYP2C19 sa očakávajú významne zvýšené expozície vorikonazolu. Koncentrácie atazanaviru
a flukonazolu neboli signifikantne
ovplyvnené, keď sa REYATAZ/ritonavir podával súbežne s flukonazolom.
Súbežné podávanie vorikonazolu a REYATAZU s ritonavirom sa neodporúča, pokiaľ použitie vorikonazolu
u pacientov nie je opodstatnené pomerom prínosu/rizika (pozri
časť 4.4).
V čase, keď sa vyžaduje liečba vorikonazolom sa má, ak je to možné, zistiť CYP2C19 genotyp pacienta.
Preto, ak je kombinácia nevyhnutná, majú sa vykonať nasledovné odporúčania
v súlade so stavom CYP2C19:
- u pacientov s minimálne jednou funkčnou alelou pre CYP2C19 sa odporúča dôkladné klinické sledovanie straty účinnosti vorikonazolu (klinické znaky) aj atazanaviru (virologická odpoveď).
- u pacientov bez funkčnej alely pre CYP2C19 sa odporúča dôkladné klinické a laboratórne sledovanie výskytu nežiaducich udalostí spojených
s vorikonazolom.
Ak nie je možné zistiť genotyp, má sa vykonať celkový monitoring bezpečnosti
a účinnosti.
Nie sú potrebné úpravy dávkovania flukonazolu a REYATAZU.
 ANT
IMYKOBAKTERIÁLNE LÁTKY
ANT
IMYKOBAKTERIÁLNE LÁTKY
Ri
f
abutín 150 mg dvakrát
t
ýždenne
(atazanavir 300 mg a ritonavir
100 mg raz denne)
Rifabutín AUC ↑48 % (↑19 % ↑84 %)
**
Rifabutín Cmax ↑149 % (↑103 %
↑206 %) **
Rifabutín Cmin ↑40 % (↑5 % ↑87 %) **
25-O-desacetyl-rifabutín AUC ↑990 %
(↑714 % ↑1 361 %) **
25-O-desacetyl-rifabutín Cmax ↑677 %
(↑513 % ↑883 %) **
25-O-desacetyl-rifabutín Cmin
↑1 045 % (↑715 % ↑1 510 %) **
** Keď je porovnávaný so samotným rifabutínom 150 mg raz denne. Celková AUC rifabutínu a 25-O- desacetyl-rifabutínu ↑119 % (↑78 %
↑169 %).
Farmokokinetika atazanaviru
v predchádzajúcich štúdiách nebola rifabutínom pozmenená.
Ak sa podáva s REYATAZOM, odporúčaná dávka rifabutínu je
150 mg 3-krát týždenne
v stanovených dňoch (napríklad pondelok-streda-piatok). Zvýšené monitorovanie treba zabezpečiť pre nežiaduce reakcie spojené s rifabutínom, vrátane neutropénie a uveitídy kvôli očakávanému zvýšeniu expozície rifabutínu. Okrem toho, zníženie dávky rifabutínu na 150 mg dvakrát týždenne
v stanovených dňoch je odporučené pacientom, ktorí
netolerujú dávku 150 mg 3-krát týždenne. Má sa myslieť na to,
že dávkovanie 150 mg dvakrát týždenne nemôže poskytnúť optimálnu expozíciu rifabutínu,
takto vedie k riziku
rifamycínovej rezistencie
a zlyhaniu liečby. Nie je potrebná úprava dávky REYATAZU.
Ri
f
a
m
picín Rifampicín je silný CYP3A4 induktor, ktorý zapríčiňuje 72 % zníženie AUC atazanaviru, ktoré môže viesť
k virologickému zlyhaniu a vývoju rezistencie. Vyskytla sa vysoká
frekvencia pečeňových reakcií počas
pokusov prekonať zníženú expozíciu zvýšením dávky REYATAZU alebo
iných proteázových inhibítorov
s ritonavirom.
Kombinácia rifampicínu a REYATAZU je kontraindikovaná (pozri časť 4.3).
ANT
IPSYCHOTIKÁ
K
vetiapín V dôsledku inhibície CYP3A4
REYATAZOM sa očakáva zvýšenie koncentrácií kvetiapínu.
LÁTKY REDUKUJÚCE ŽALÚDOČNÚ KYSELINU
Antagonisty H2-receptorov
Bez tenofovir-dizoproxilfumarátu
U HIV infikovaných pacientov s atazanavirom/ritonavirom pri odporúčanej dávke 300/100 mg raz denne
Súbežné podávanie kvetiapínu a REYATAZU je kontraindikované, pretože REYATAZ môže zvýšiť toxicitu týkajúcu sa kvetiapínu. Zvýšené plazmatické koncentrácie kvetiapínu môžu viesť ku kóme (pozri časť 4.3).
U pacientov, ktorí neužívajú tenofovir-dizoproxilfumarát,
 F
a
m
otidín 20 mg dvakrát denne
F
a
m
otidín 40 mg dvakrát denne
F
a
m
otidín 20 mg dvakrát denne
F
a
m
otidín 40 mg dvakrát denne
Atazanavir AUC ↓18 % (↓25 % ↑1 %) Atazanavir Cmax ↓20 % (↓32 % ↓7 %) Atazanavir Cmin ↔1 % (↓16 % ↑18 %) Atazanavir AUC ↓23 % (↓32 %
↓14 %)
Atazanavir Cmax ↓23 % (↓33 % ↓12 %)
Atazanavir Cmin ↓20 % (↓31 % ↓8 %)
ak sú REYATAZ
300 mg/ritonavir 100 mg
a antagonisty H2-receptorov podávané súbežne, nemá byť
prekročená dávka zodpovedajúca famotidínu
20 mg dvakrát denne. Ak je
U zdravých dobrovoľníkov s atazanavirom/ritonavirom pri zvýšenej dávke 400/100 mg raz denne
potrebné podať vyššiu dávku antagonistu H2-receptora (napr.
F
a
m
otidín 40 mg dvakrát
denne
Atazanavir AUC ↔3 % (↓14 %
↑22 %)
Atazanavir Cmax ↔2 % (↓13 % ↑8 %)
Atazanavir Cmin ↓14 % (↓32 % ↑8 %)
famotidín 40 mg dvakrát denne
alebo iný ekvivalent), je možné zvážiť zvýšenie dávky REYATAZU/ritonaviru
z 300/100 mg na 400/100 mg.
S tenofovir-dizoproxilfumarátom 300 mg raz denne
U HIV infikovaných pacientov s atazanavirom/ritonavirom pri odporúčanej dávke 300/100 mg raz denne
U pacientov, ktorí užívajú tenofovir-dizoproxilfumarát,
F
a
m
otidín 20 mg dvakrát denne
F
a
m
otidín 40 mg dvakrát denne
Atazanavir AUC ↓21 % (↓34 % ↓4 %)
*
Atazanavir Cmax ↓21 % (↓36 % ↓4 %)
*
Atazanavir Cmin ↓19 % (↓37 % ↑5 %) *
Atazanavir AUC ↓24 % (↓36 %
↓11 %) *
Atazanavir Cmax ↓23 % (↓36 % ↓8 %)
*
Atazanavir Cmin ↓25 % (↓47 % ↑7 %) *
ak je REYATAZ/ritonavir
súbežne podávaný s tenofovir--
dizoproxilfumarátom
a antagonistom H2-receptoru, odporúča sa zvýšiť dávku REYATAZU na 400 mg s tenofovirom 100 mg. Dávka ekvivalentná 40 mg famotidínu dvakrát denne sa nesmie prekročiť.
U HIV infikovaných pacientov s atazanavirom/ritonavirom pri zvýšenej
dávke 400/100 mg raz denne
F
a
m
otidín 20 mg dvakrát denne
Atazanavir AUC ↑18 % (↑6,5 %
↑30 %)*
Atazanavir Cmax ↑18 % (↑6,7 %
↑31 %)*
Atazanavir Cmin ↑24 % (↑10 %
↑39 %)*
F
a
m
otidín 40 mg dvakrát
denne
Atazanavir AUC ↔2,3 % (↓13 %
↑10 %)*
Atazanavir Cmax ↔5 % (↓17 %
↑8,4 %)*
Atazanavir Cmin ↔1,3 % (↓10 % ↑15)*
* V porovnaní atazanaviru 300 mg raz
denne s ritonavirom 100 mg raz denne
a tenofovir-dizoproxil fumarátom
300 mg v jednorazovej dávke podanej
s jedlom. V porovnaní atazanaviru
300 mg s ritonavirom 100 mg bez tenofovir-dizoproxilfumarátu sa
koncentrácie atazanaviru pravdepodobne dodatočne znížia približne o 20 %.
 I
nhibítory protónovej pumpy
I
nhibítory protónovej pumpy
Mechanizmus interakcie je daný
zníženou solubilitou atazanaviru, ktorá je spôsobená zvýšením intra- žalúdočného pH prostredníctvom H2 blokátorov.
O
m
eprazol 40 mg raz denne
(atazanavir 400 mg raz denne
s ritonavirom 100 mg raz denne)
Omeprazol 20 mg raz denne
(atazanavir 400 mg raz denne
s ritonavirom 100 mg raz denne)
Antacidá
Antacidá a lieky obsahujúce
pufre
Atazanavir (dopoludnia): 2 hod. po omeprazole
Atazanavir AUC ↓61 % (↓65 %
↓55 %)
Atazanavir Cmax ↓66 % (↓62 % ↓49 %)
Atazanavir Cmin ↓65 % (↓71 % ↓59 %)
Atazanavir (dopoludnia): 1 hod. po omeprazole
Atazanavir AUC ↓30 % (↓43 % ↓14 %)
*
Atazanavir Cmax ↓31 % (↓42 % ↓17 %)
*
Atazanavir Cmin ↓31 % (↓46 % ↓12 %) *
* Keď je porovnávaný s atazanavirom
v dávke 300 mg raz denne
s ritonavirom 100 mg raz denne. Zníženie AUC, Cmax a Cmin nebolo oslabené, keď zvýšená dávka REYATAZU/ritonaviru (400/100 mg raz denne) bola prechodne oddelená od omeprazolu 12 hodinami. Aj keď nebolo skúmané, podobné výsledky sa dajú očakávať aj u iných inhibítorov protónovej pumpy. Toto zníženie expozície na atazanavir môže mať negatívny vplyv na účinnosť atazanaviru. Mechanizmus interakcie
je daný zníženou solubilitou atazanaviru, ktorá je spôsobená zvýšením intra-žalúdočného pH prostredníctvom inhibítorov protónovej pumpy.
Zníženie plazmatických koncentrácií atazanaviru môže byť následkom zvýšeného žalúdočného pH, ak sa antacidá vrátane pufrovaných liekov podávali s REYATAZOM.
Súbežné podávanie
REYATAZU s ritonavirom
a inhibítormi protónovej pumpy sa neodporúča. Ak sa
kombinácii nedá vyhnúť,
odporúča sa starostlivé klinické monitorovanie v kombinácii so zvýšením dávky REYATAZU
na 400 mg so 100 mg ritonaviru;
dávky inhibítorov protónovej pumpy porovnateľné s 20 mg
omeprazolu sa nemajú prekročiť
(pozri časť 4.4).
REYATAZ sa má podávať
2 hodiny pred alebo 1 hodinu po podaní antacíd alebo
pufrovaných liekov.
ANTAG
O
N
I
STY ΑLFA 1-ADRENORECEPTOROV
Alfuzosín Možnosť zvýšených koncentrácií alfuzosínu, ktoré môžu viesť
k hypotenzii. Mechanizmus interakcie je inhibícia CYP3A4 REYATAZOM a/alebo ritonavirom.
Súbežné podávanie alfuzosínu a REYATAZU je kontraindikované (pozri
časť 4.3).
 ANT
IKOAGULANCIÁ
Warfarín
ANT
IKOAGULANCIÁ
Warfarín Súbežné podávanie s REYATAZOM môže eventuálne zvýšiť alebo znížiť koncentrácie warfarínu.
ANTIEPILEPTIKÁPočas liečby REYATAZOM, hlavne na začiatku liečby sa odporúča starostlivé sledovanie medzinárodného normalizovaného pomeru (International Normalised Ratio, INR).
K
arbamazepín REYATAZ môžu zvýšiť plazmatické hladiny karbamazepínu v dôsledku inhibície CYP3A4.
Z dôvodu indukčného účinku karbamazepínu nemožno vylúčiť zníženie expozície REYATAZU.
Fenytoín, fenobarbital Ritonavir môže znížiť plazmatické hladiny fenytoínu a/alebo fenobarbitalu v dôsledku indukcie CYP2C9 a CYP2C19.
Z dôvodu indukčného účinku fenytoínu/fenobarbitalu nemožno vylúčiť zníženie expozície REYATAZU.
Lamotrigín Súbežné podávanie lamotrigínu a REYATAZU/ritonaviru môže znížiť plazmatické koncentrácie lamotrigínu v dôsledku indukcie UGT1A4.
ANTINEOPLASTIKÁ A IMUNOSUPRESÍVA
Antineoplastiká
Irinotekán Atazanavir inhibuje UGT a môže interferovať s metabolizmom irinotekánu a tým viesť k zvýšeniu toxicity irinotekánu.
Imunosupresíva
Karbamazepín sa má
v kombinácii s REYATAZOM
používať s opatrnosťou. Ak je to potrebné, monitorujte sérové
koncentrácie karbamazepínu
a príslušne upravte dávku. Má sa vykonať dôsledné sledovanie virologickej odpovede pacienta. Fenobarbital a fenytoín sa majú
v kombinácii s REYATAZOM/ritonavirom používať s opatrnosťou.
Ak sa REYATAZ/ritonavir súbežne podávajú s fenytoínom alebo fenobarbitalom, môže byť potrebná úprava dávky
fenytoínu alebo fenobarbitalu.
Má sa vykonať dôsledné sledovanie virologickej odpovede pacienta.
Lamotrigín sa má v kombinácii s REYATAZOM/ritonavirom používať s opatrnosťou.
Ak je to potrebné, monitorujte koncentrácie lamotrigínu
a príslušne upravte dávku.
Ak sa REYATAZ podáva súbežne s irinotekánom pacienti majú byť starostlivo monitorovaní na nežiaduce udalosti súvisiace
s irinotekánom.
C
yklosporín Takrolimus Sirolimus
Koncentrácie týchto imunosupresív môžu byť zvýšené, keď sa súbežne podávajú s REYATAZOM vzhľadom na CYP3A4 inhibíciu.
Odporúča sa častejšie monitorovanie terapeutickej koncentrácie týchto liekov, kým sa ustália plazmatické hladiny.
K
ARD
IOVASKULÁRNE LIEKY
A
ntiarytmiká
 A
mi
odarón, systémový lidokaín, chinidín
B
l
okátory kalciových kanálov
A
mi
odarón, systémový lidokaín, chinidín
B
l
okátory kalciových kanálov
Koncentrácie týchto antiarytmík môžu byť zvýšené, keď sa podávajú súbežne s REYATAZOM. Mechanizmus interakcie amiodarónu alebo systémového lidokaínu/atazanaviru je inhibícia CYP3A. Chinidín má úzky terapeutický rozsah a je kontraindikovaný vzhľadom na potenciálnu inhibíciu CYP3A REYATAZOM.
Odporúča sa opatrnosť
a monitorovanie terapeutických koncentrácií, ak je to možné.
Súbežné použitie chinidínu je kontraindikované (pozri
časť 4.3).
B
epridil REYATAZ sa nemá používať
v kombinácii s liekmi, ktoré sú
substrátmi pre CYP3A4 a majú úzky terapeutický index.
Súbežné podávanie s bepridilom je kontraindikované (pozri
časť 4.3).
D
il
t
i
azem 180 mg raz denne
(atazanavir 400 mg raz denne)
Diltiazem AUC ↑125 % (↑109 %
↑141 %)
Diltiazem Cmax ↑98 % (↑78 % ↑119 %) Diltiazem Cmin ↑142 % (↑114 %
↑173 %)
Desacetyl-diltiazem AUC ↑165 %
(↑145 % ↑187 %)
Desacetyl-diltiazem Cmax ↑172 %
(↑144 % ↑203 %)
Desacetyl-diltiazem Cmin ↑121 %
(↑102 % ↑142 %)
Odporúča sa redukcia úvodnej dávky diltiazemu o 50 %
s následnou titráciou podľa
potreby a monitorovaním EKG.
Nepozoroval sa signifikantný účinok
na koncentrácie atazanaviru. Pozoroval sa nárast maximálneho intervalu
tepovej frekvencie v porovnaní
s podávaním samotného atazanaviru. Súbežné podávanie diltiazemu
a REYATAZU/ritonaviru nebolo
skúmané. Mechanizmus interakcie diltiazemu/atazanaviru je inhibícia CYP3A4.
Verapamil Sérové koncentrácie verapamilu môžu byť REYATAZOM zvýšené
vzhľadom na inhibíciu CYP3A4.
Odporúča sa opatrnosť, ak sa verapamil podáva súbežne
s REYATAZOM.
 KO
RT
I
K
O
STEROIDY
Flutikazónpropionát intranazálne 50 µg 4-krát denne počas 7 dní
KO
RT
I
K
O
STEROIDY
Flutikazónpropionát intranazálne 50 µg 4-krát denne počas 7 dní (ritonavir 100 mg kapsuly dvakrát denne)
EREKTILNÁ DYSFUNKCIAPDE5 inhibítoryPlazmatické hladiny flutikazónpropionátu signifikantne vzrástli, zatiaľ čo hladiny vlastného kortizolu poklesli približne o 86 % (90% interval spoľahlivosti 82-89 %). Väčšie účinky sa dajú očakávať, keď je flutikazón inhalovaný. Systémové kortikosteroidové účinky vrátane Cushingovho syndrómu a adrenálnej supresie sa vyskytli u pacientov užívajúcich ritonavir a ktorým sa inhalačne alebo intranazálne podával flutikazónpropionát; ktoré sa môžu vyskytnúť aj u iných kortikosteroidov
metabolizovaných dráhou cytochrómu
P450 3A, napr. budezonid. Účinky vysokej systémovej expozície
flutikazónu na plazmatické hladiny
ritonaviru ešte nie sú známe. Mechanizmus interakcie je inhibícia CYP3A4.
Súbežné podávanie REYATAZU/ritonaviru a týchto glukokortikoidov sa neodporúča, pokiaľ potenciálny prínos liečby neprevýši riziko systémových účinkov kortikosteroidov (pozri časť 4.4). Je potrebné zvážiť redukciu dávky glukokortikoidu
s dôkladným monitorovaním lokálnych a systémových
účinkov alebo prejsť na
glukokortikoid, ktorý nie je substrátom pre CYP3A4 (napr. beklometazón). Navyše,
v prípade vysadenia glukokortikoidov sa môže počas
dlhšej doby postupne znižovať dávka.
Sildenafil, tadalafil, vardenafil Sildenafil, tadalafil a vardenafil sú metabolizované prostredníctvom CYP3A4. Súbežné podávanie
s REYATAZOM môže viesť
k zvýšeným koncentráciám PDE5
inhibítora a k zvýšeniu nežiaducich udalostí súvisiacich s PDE5 vrátane hypotenzie, vizuálnych zmien
a priapizmu. Mechanizmus tejto interakcie je inhibícia CYP3A4.
RASTLINNÉ PRÍPRAVKY
Pacienti majú byť upozornení na tieto možné nežiaduce účinky
pri používaní PDE5 inhibítorov
na erektilnú dysfunkciu
s REYATAZOM/ritonavirom
(pozri časť 4.4). Pozri tiež PĽÚCNU ARTÉRIOVÚ HYPERTENZIU v tejto tabuľke pre viac informácií o súbežnom podávaní REAYATAZU so sildenafilom.
Ľ
ubovník bodkovaný
(H
y
pericum perforatum
)
Pri súbežnom použití ľubovníka bodkovaného s REYATAZOM sa môže očakávať signifikantná redukcia plazmatickej hladiny atazanaviru. Tento účinok môže byť výsledkom indukcie CYP3A4. Existuje riziko straty terapeutického účinku a vývoj rezistencie (pozri časť 4.3).
Súbežné podávanie REYATAZU s prípravkami obsahujúcimi ľubovník bodkovaný je kontraindikované.
HO
R
MONÁLNE KONTRACEPTÍVA
 E
ti
nylestradiol 25 μg +
norgestimát
E
ti
nylestradiol 25 μg +
norgestimát
(atazanavir 300 mg raz denne
s ritonavirom 100 mg raz denne)
Etinylestradiol AUC ↓19 % (↓25 %
↓13 %)
Etinylestradiol Cmax ↓16 % (↓26 %
↓5 %)
Etinylestradiol Cmin ↓37 % (↓45 %
↓29 %)
Norgestimát AUC ↑85 % (↑67 %
↑105 %)
Norgestimát Cmax ↑68 % (↑51 %
↑88 %)
Norgestimát Cmin ↑102 % (↑77 %
↑131 %)
Podávaním samotného atazanaviru sa koncentrácia etinylestradiolu zvýšila vďaka inhibícii UGT a CYP3A4 atazanavirom. Čistý účinok atazanaviru/ritonaviru je znížený hladinami etinylestradiolu kvôli indukčnému účinku ritonaviru.
Zvýšenie expozície progestínom môže viesť k súvisiacim vedľajším účinkom (napr. inzulínovej rezistencii, dyslipidémii, akné a škvrnitosti), čo môže ovplyvniť compliance.
Ak sa perorálne kontraceptívum podáva
s REYATAZOM/ritonavirom,
odporúča sa, aby perorálne kontraceptívum obsahovalo aspoň 30 μg etinylestradiolu, a aby pacientka presne dodržiavala dávkovací režim kontraceptíva. Súbežné podávanie
REYATAZU/ritonaviru s inými
hormonálnymi kontraceptívami alebo perorálnymi kontraceptívami, obsahujúcimi iné progestogény ako norgestimát, sa neskúmalo,
a preto je potrebné sa mu vyhnúť. Odporúča sa
alternatívna spoľahlivá metóda antikoncepcie.
E
ti
nylestradiol 35 µg +
noretindrón
(atazanavir 400 mg raz denne)
Etinylestradiol AUC ↑48 % (↑31 %
↑68 %)
Etinylestradiol Cmax ↑15 % (↓1 %
↑32 %)
Etinylestradiol Cmin ↑91 % (↑57 %
↑133 %)
Noretindrón AUC ↑110 % (↑68 %
↑162 %)
Noretindrón Cmax ↑67 % (↑42 %
↑196 %)
Noretindrón Cmin ↑262 % (↑157 %
↑409 %)
Zvýšenie expozície progestínu môže
viesť k súvisiacim nežiaducim účinkom (napr. inzulínová rezistencia, dyslipidémia, akné a špinenie), teda pravdepodobne ovplyvňuje compliancie.
LIEKY ZNIŽUJÚCE HLADINU LIPIDOV
Inhibítory HMG-CoA reduktázy
Simvastatín
L
ovastatín
Metabolizmus simvastatínu
a lovastatínu je vysoko závislý na
CYP3A4 a súbežné podávanie
s REYATAZOM môže viesť
k zvýšeniu ich koncentrácií.
Súbežné podávanie simvastatínu alebo lovastatínu
s REYATAZOM je
kontraindikované z dôvodu zvýšeného rizika myopatie vrátane rabdomyolýzy (pozri časť 4.3).
A
t
orvastatín Riziko myopatie vrátane rabdomyolýzy môže byť zvýšené aj atorvastatínom, ktorý sa tiež metabolizuje prostredníctvom CYP3A4.
Súbežné podávanie atorvastatínu s REYATAZOM sa neodporúča. Ak sa použitie atorvastatínu považuje za striktne nevyhnutné, má sa podať najnižšia možná dávka atorvastatínu so dôkladným monitoringom bezpečnosti (pozri časť 4.4).
P
ravastatín
F
l
uvastatín
I napriek tomu, že sa to neskúmalo, existuje možnosť zvýšenia expozície pravastatínu alebo fluvastatínu, ak sa súbežne podajú s inhibítormi proteázy. Pravastatín sa nemetabolizuje prostredníctvom CYP3A4. Fluvastatín sa čiastočne metabolizuje prostredníctvom CYP2C9.
Je potrebná opatrnosť.
I
N
H
ALAČN
É BETA AGONISTY
Salmeterol Súbežné podávanie REYATAZU
môže viesť k zvýšeným koncentráciám salmeterolu a zvýšiť nežiaduce
udalosti spojené so salmeterolom.
Súbežné podávanie salmeterolu
s REYATAZOM sa neodporúča
(pozri časť 4.4).
 O
P
I
O
IDY
O
P
I
O
IDY
Mechanizmus interakcie je inhibícia
CYP3A4 atazanavirom a/alebo ritonavirom.
B
uprenorfín, raz denne, stabilná udržiavacia dávka (atazanavir 300 mg raz denne
s ritonavirom 100 mg raz denne)
Metadon, stabilná udržiavacia
dávka
(atazanavir 400 mg raz denne)
Buprenorfín AUC ↑67 % Buprenorfín Cmax ↑37 % Buprenorfín Cmin ↑69 %
Norbuprenorfín AUC ↑105 % Norbuprenorfín Cmax ↑61 % Norbuprenorfín Cmin ↑101 %
Mechanizmus interakcie je inhibícia
CYP3A4 a UGT1A1. Koncentrácie atazanaviru (ak sa
podáva s ritonavirom) neboli
signifikantne ovplyvnené. Nepozoroval sa signifikantný účinok na koncentrácie metadonu. Pokiaľ vezmeme do úvahy, že nízka dávka ritonaviru (100 mg dvakrát denne) nepreukázala signifikantný účinok na koncentrácie metadonu, na základe týchto údajov sa neočakáva interakcia pri súbežnom podávaní metadonu
s REYATAZOM.
Súbežné podávanie s REYATAZOM a ritonavirom si vyžaduje klinické sledovanie sedácie a kognitívnych účinkov. Môže sa zvážiť redukcia dávky buprenorfínu.
Nie je potrebná úprava dávkovania, ak sa metadon podáva súbežne
s REYATAZOM.
 P
ĽÚCN
A ARTERIÁLNA HYPERTENZIA
PDE5 inhibítory
Sildenafil
P
ĽÚCN
A ARTERIÁLNA HYPERTENZIA
PDE5 inhibítory
Sildenafil Súbežné podávanie REYATAZU
môže viesť k zvýšeným koncentráciám
PDE5 inhibítora a zvýšiť nežiaduce udalosti spojené s PDE5 inhibítorom.
Mechanizmus interakcie je inhibícia CYP3A4 atazanavirom a/alebo ritonavirom.
SEDATÍVABenzodiazepínyNebola stanovená bezpečná
a účinná dávka sildenafilu
v kombinácii s REYATAZOM, keď sa používa na liečbu
pľúcnej arteriálnej hypertenzie.
Použitie sildenafilu na liečbu pľúcnej arteriálnej hypertenzie je kontraindikované (pozri
časť 4.3).
Midazolam
T
riazolam
Midazolam a triazolam sú metabolizované vo veľkej miere prostredníctvom CYP3A4. Súbežné podávanie s REYATAZOM môže zapríčiniť veľké zvýšenie koncentrácie týchto benzodiazepínov. Nevykonala
sa žiadna lieková interakčná štúdia súbežného podávania REYATAZU
s benzodiazepínmi. Na základe údajov
pre iné inhibítory CYP3A4 sa očakáva významné zvýšenie plazmatických
koncentrácií, ak sa midazolam podáva
perorálne. Údaje o súbežnom použití parenterálneho midazolamu s inými proteázovými inhibítormi naznačujú možné 3 – 4-násobné zvýšenie plazmatických hladín midazolamu.
Súbežné podávanie REYATAZU s triazolamom alebo perorálne podávaným midazolamom je kontraindikované (pozri
časť 4.3), zatiaľ čo pri súbežnom používaní REYATAZU
a parenterálneho midazolamu je potrebná opatrnosť. REYATAZ sa má súbežne podávať
s parenterálnym midazolamom na jednotkách intenzívnej
starostlivosti (JIS) alebo podobných miestach, aby sa zabezpečilo dôsledné klinické
monitorovanie a zodpovedajúca medicínska starostlivosť
v prípade respiračnej depresie a/alebo prolongovanej sedácie. Je potrebné zvážiť úpravu
dávkovania midazolamu, najmä ak sa podala viac ako jedna
dávka midazolamu.
 V prípade ukončenia liečby ritonavirom z odporúčaného režimu na zosilnenie účinku atazanaviru
(
pozri časť 4.4)
V prípade ukončenia liečby ritonavirom z odporúčaného režimu na zosilnenie účinku atazanaviru
(
pozri časť 4.4)
Budú platiť rovnaké odporúčania interakcií liečiv s výnimkou:
§ že sa súbežné podávanie neodporúča s tenofovirom, boceprevirom, karbamazepínom, fenytoínom, fenobarbitalom, inhibítormi protónovej pumpy a buprenorfínom.
§ že sa súbežné podávanie s famotidínom neodporúča, ale ak sa vyžaduje, atazanavir bez ritonaviru sa má podať buď 2 hodiny po famotidíne alebo 12 hodín pred jeho podaním. Žiadna jednorazová dávka famotidínu nemá presiahnuť 20 mg, a celková denná dávka famotidínu nemá presiahnuť
40 mg.
§ potrebné zohľadniť, že
§ súbežné podávanie vorikonazolu a REYATAZU bez ritonaviru môže ovplyvniť koncentrácie atazanaviru
§ súbežné podávanie flutikazónu a REYATAZU bez ritonaviru môže zvýšiť koncentrácie flutikazónu v porovnaní so samostatne podaným flutikazónom
§ ak sa podávajú perorálne kontraceptíva s REYATAZOM bez ritonaviru, odporúča sa, aby
perorálne kontraceptíva neobsahovali viac než 30 µg etinylestradiolu
§ nevyžaduje sa žiadna úprava dávky lamotrigínu
Pediatrická populáciaInterakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktáciaGraviditaPriemerný počet údajov u gravidných žien (medzi 300-1 000 výsledkami gravidít) nepreukázal žiadnu malformačnú toxicitu atazanaviru. Štúdie na zvieratách nepreukázali reprodukčnú toxicitu (pozri
časť 5.3). Užívanie REYATAZU s ritonavirom sa môže zvážiť počas gravidity len vtedy, ak
predpokladaný prínos prevýši potenciálne riziko.
V klinickom skúšaní AI424-182 sa REYATAZ/ritonavir (300/100 mg alebo 400/100 mg) podával
v kombinácii so zidovudínom/lamivudínom 41 gravidným ženám v priebehu druhého alebo tretieho trimestra. U šiestich z 20 (30 %) žien na REYATAZE/ritonavire 300/100 mg a u 13 z 21 (62 %) žien
na REYATAZE/ritonavire 400/100 mg sa vyskytla hyperbilirubinémia 3. až 4. stupňa. V klinickom skúšaní AI424-182 sa nepozorovali žiadne prípady laktátovej acidózy.
Štúdia hodnotila 40 detí, ktoré dostávali antiretrovírusovú profylaktickú liečbu (ktorá nezahŕňala REYATAZ), a ktoré boli negatívne na HIV-1 DNA v čase pôrodu a/alebo počas prvých 6 mesiacov po pôrode. U troch z 20 detí (15 %) narodených ženám liečeným REYATAZOM/ritonavirom
300/100 mg a u štyroch z 20 detí (20 %) narodených ženám liečeným REYATAZOM/ritonavirom
400/100 mg sa vyskytol bilirubín 3.-4. stupňa. Neexistujú žiadne dôkazy o patologickej žltačke a šesť zo 40 detí v tejto štúdii dostávalo fototerapiu maximálne 4 dni. Nevyskytli sa žiadne hlásené prípady
jadrového ikteru u novorodencov.
Pre odporúčania dávkovania pozri časť 4.2. a pre farmakokinetické údaje pozri časť 5.2. Nie je známe, či podávanie REYATAZU s ritonavirom matkám počas gravidity spôsobuje
fyziologickú hyperbilirubinémiu a jadrový ikterus u novorodencov a dojčiat. V predpôrodnom období sa má zvážiť dodatočné sledovanie.
Dojčenie
Nie je známe, či sa atazanavir alebo metabolity atazanaviru vylučujú do ľudského mlieka. Štúdie na potkanoch preukázali vylučovanie atazanaviru do mlieka. Všeobecne sa odporúča, aby ženy infikované HIV nedojčili deti a vyhli sa tak prenosu infekcie HIV.
Fertilita
V neklinických štúdiách fertility a skorého embryonálneho vývinu potkanov atazanavir zmenil cyklus ruje bez účinku na párenie alebo fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pacienti majú byť informovaní, že počas liečby režimami, ktoré zahŕňajú REYATAZ, boli hlásené závraty (pozri časť 4.8).
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Profil bezpečnosti REYATAZU v kombinovanej terapii s inými antiretrovírusovými liekmi sa hodnotil klinickými štúdiami u 1 806 dospelých pacientov užívajúcich REYATAZ v dávke 400 mg
jedenkrát denne (1 151 pacientov, medián trvania 52 týždňov a maximum trvania 152 týždňov) alebo
REYATAZ 300 mg s ritonavirom jedenkrát denne (655 pacientov, medián trvania 96 týždňov
a maximum trvania 108 týždňov).
Nežiaduce reakcie boli konzistentné medzi pacientmi, ktorí užívali REYATAZ 400 mg a pacientmi, ktorí užívali REYATAZ 300 mg s ritonavirom 100 mg raz denne, okrem žltačky a zvýšenia hladín celkového bilirubínu, ktoré boli častejšie hlásené pri kombinovanom podávaní REYATAZU plus ritonaviru.
Medzi pacientmi, ktorí užívali REYATAZ 400 mg raz denne alebo REYATAZ 300 mg s ritonavirom
100 mg raz denne boli bez ohľadu na závažnosť najčastejšie hlásenými nežiaducimi reakciami,
u ktorých sa predpokladala aspoň minimálna súvislosť s režimom zahŕňajúcim REYATAZ a jeden alebo viac NRTI: nauzea (20 %), hnačka (10 %) a žltačka (13 %). Medzi pacientmi užívajúcimi REYATAZ 300 mg s ritonavirom 100 mg bola frekvencia žltačky 19 %. Vo väčšine prípadov sa výskyt žltačky pozoroval do niekoľkých dní až niekoľkých mesiacov po začatí liečby (pozri časť 4.4).
Tabuľkovýzoznamnežiaducichreakcií
Hodnotenie nežiaducich reakcií pri REYATAZE je založené na údajoch o bezpečnosti z klinických skúšaní a postmarketingových skúseností. Frekvencia je definovaná podľa nasledujúcej konvencie:
veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé
(≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Poruchy imunitného systému: menej časté: hypersenzitivita
Poruchy metabolizmu a výživy: menej časté: zníženie hmotnosti, prírastok hmotnosti, anorexia, zvýšenie chuti do jedla
Psychické poruchy: menej časté: depresia, dezorientácia, anxieta, insomnia, poruchy spánku, abnormálne sny
Poruchy nervového systému: časté: bolesť hlavy
menej časté: periférna neuropatia, synkopa, amnézia, závrat, spavosť, porucha chuti
Poruchy oka: časté: ikterus očného bielka
Poruchy srdca a srdcovej činnosti: menej časté: torsades de pointesa
zriedkavé: predĺženie QT intervalua, edém, palpitácie
Poruchy ciev: menej časté: hypertenzia
P
oruchy dýchacej sústavy,
hrudníka a mediastína:
menej časté: dyspnoe
P
oruchy gastrointestinálneho
t
raktu:
časté: vracanie, hnačka, abdominálna bolesť, nauzea,
dyspepsia
menej časté: pankreatitída, gastritída, abdominálna distenzia, aftózna stomatitída, flatulencia, suchosť v ústach
P
oruchy pečene a žlčových ciest: časté: žltačka
menej časté: hepatitída, cholelitiázaa, cholestázaa
zriedkavé: hepatosplenomegália, cholecystitídaa
P
oruchy kože a podkožného
t
kaniva:
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva:
časté: vyrážka;
menej časté: multiformný erytéma,b, toxické kožné výsevya,b, lieková vyrážka s eozinofíliou a príznakmi
systémového syndrómu (DRESS)a,b, angioedéma,
urtikária, alopécia, pruritus
zriedkavé: Stevensov-Johnsonov syndróma,b, vezikulobulózna vyrážka, ekzém, vazodilatácia
menej časté: svalová atrofia, bolesť kĺbov, myalgia;
zriedkavé: myopatia
P
oruchy obličiek a močových
ciest:
menej časté: nefrolitiázaa, hematúria, proteinúria,
polakiúria, intersticiálna nefritída zriedkavé: bolesť obličiek
P
oruchy reprodukčného systému
a prsníkov:
menej časté: gynekomastia
C
elkové poruchy a reakcie
v mieste podania:
časté: únava
menej časté: bolesť na hrudníku, nevoľnosť, pyrexia,
asténia
zriedkavé: porucha chôdze
a Tieto nežiaduce reakcie boli identifikované počas postmaketingového sledovania, frekvencie však boli odhadnuté zo štatistického výpočtu založeného na celkovom počte pacientov vystavených REYATAZU v randomizovaných kontrolovaných a iných dostupných klinických skúšaniach (n=2321).
b Pre viac informácií pozri popis vybraných nežiaducich reakcií.
Popisvybranýchnežiaducichreakcií
U HIV-infikovaných pacientov s ťažkou imunodeficienciou môže v čase začatia kombinovanej antiretrovírusovej terapie (CART) vzniknúť zápalová reakcia na asymptomatické alebo reziduálne
oportúnne infekcie. Boli tiež zaznamenané aj poruchy imunitného systému (ako je Gravesova
choroba); avšak zaznamenaný čas do ich nástupu je rôznorodejší a tieto udalosti sa môžu vyskytnúť mnoho mesiacov po začatí liečby (pozri časť 4.4).
Boli hlásené prípady osteonekrózy, najmä u pacientov so všeobecne uznávanými rizikovými faktormi, pokročilým HIV ochorením alebo dlhodobou expozíciou kombinovanej antiretrovírusovej terapii (CART). Frekvencia osteonekrózy nie je známa (pozri časť 4.4).
Metabolické parametre
Počas antiretrovírusovej liečby sa môže zvýšiť telesná hmotnosť a hladiny lipidov a glukózy v krvi
(pozri časť 4.4).
Vyrážka a súvisiace syndrómy
Vyrážky sú zvyčajne mierne až stredne ťažké makulopapulárne kožné výsevy, ktoré sa objavia počas prvých 3 týždňov od začiatku liečby REYATAZOM.
Stevensov-Johnsonov syndróm (SJS), multiformný erytém, toxické kožné výsevy a lieková vyrážka s eozinofíliou a príznakmi systémového syndrómu (DRESS) boli hlásené u pacientov užívajúcich REYATAZ (pozri časť 4.4).
Laboratórne abnormality
Najčastejšie hlásenou laboratórnou abnormalitou u pacientov s režimom zahŕňajúcim REYATAZ
a jeden alebo viac NRTI bol zvýšený bilirubín vo forme predovšetkým ako nepriamy [nekonjugovaný]
bilirubín (87 % stupňa 1, 2, 3 alebo 4). Zvýšenie celkového bilirubínu stupňa 3 alebo 4 bolo zaznamenané u 37 % (6 % stupňa 4). Medzi už liečenými pacientmi REYATAZOM 300 mg raz denne s ritonavirom 100 mg raz denne bol výskyt zvýšenia celkového bilirubínu stupňa 3-4 s mediánom trvania 95 týždňov 53 %. Medzi pacientmi predtým neliečenými sa podával REYATAZ 300 mg raz denne s ritinavirom v dávke 100 mg raz denne s mediánom trvania 96 týždňov, 48 % malo zvýšenie celkového bilirubínu stupňa 3-4 (pozri časť 4.4).
Medzi iné významné klinické laboratórne abnormality (stupňa 3 alebo 4) hlásené u ≥ 2 % pacientov s režimom zahŕňajúcim REYATAZ a jeden alebo viac NRTI patria: zvýšenie hladín kreatínkinázy (7 %), alanínaminotransferázy/sérovej glutamylpyruváttransaminázy (ALT/SGPT) (5 %), nízka hladina neutrofilov (5 %), zvýšená hladina aspartátaminotransferázy/sérovej glutamyloxalacetáttransaminázy (AST/SGOT) (3 %) a zvýšená hladina lipázy (3 %).
U dvoch percent pacientov liečených REYATAZOM došlo k súčasnému zvýšeniu ALT/AST
stupňa 3-4 a zvýšeniu celkového bilirubínu stupňa 3-4.
Pediatrická populácia
V klinickej štúdii AI424-020 s pediatrickými pacientmi vo veku od 3 mesiacov do 18 rokov, ktorí
dostali buď liekovú formu perorálny prášok alebo kapsuly bola priemerná doba trvania liečby
REYATAZOM 115 týždňov. Bezpečnostný profil v tejto štúdii bol celkovo porovnateľný s tým, ktorý sa pozoroval u dospelých. U pediatrických pacientov boli hlásené nielen asymptomatická átrioventrikulárna blokáda prvého stupňa (23 %) ale aj druhého stupňa (1 %). Najčastejšie hlásenou laboratórnou abnormalitou u pediatrických pacientov užívajúcich REYATAZ bolo zvýšenie celkového bilirubínu (≥ 2,6-krát ULN, stupeň 3-4), ktoré sa vyskytlo u 45 % pacientov.
V klinických štúdiách AI424-397 a AI424-451 s pediatrickými pacientmi vo veku od 3 mesiacov do
11 rokov, bola priemerná doba trvania liečby REYATAZOM perorálnym práškom 80 týždňov. Nehlásili sa žiadne úmrtia. Bezpečnostný profil v týchto štúdiách bol celkovo porovnateľný s tým,
ktorý sa pozoroval v predchádzajúcich pediatrických štúdiách a v štúdiách s dospelými. Najčastejšie
hlásenými laboratórnymi abnormalitami u pediatrických pacientov užívajúcich REYATAZ perorálny prášok bolo zvýšenie celkového bilirubínu (≥ 2,6-násobok ULN, 3.-4. stupňa; 16 %) a zvýšená amyláza (3.-4. stupňa; 33 %), vo všeobecnosti nepankreatického pôvodu. V týchto štúdiách sa zvýšenie hladín ALT hlásilo častejšie u pediatrických pacientov ako u dospelých.
InéosobitnépopuláciePacienti súčasne infikovaní vírusom hepatitídy B a/alebo hepatitídy CMedzi 1 151 pacientmi liečenými atazanavirom v dávke 400 mg raz denne bolo 177 pacientov súčasne infikovaných chronickou hepatitídou B alebo C a medzi 655 pacientmi užívajúcimi atazanavir 300 mg
raz denne s ritonavirom 100 mg raz denne bolo 97 pacientov infikovaných chronickou hepatitídou B
alebo C. U týchto infikovaných pacientov bola vyššia pravdepodobnosť zvýšenia hladiny pečeňových transamináz oproti normálu ako u pacientov bez chronickej vírusovej hepatitídy. Nepozorovali sa rozdiely vo frekvencii zvýšenia bilirubínu medzi týmito pacientmi a pacientmi bez vírusovej hepatitídy. Frekvencia liečbou vyvolanej hepatitídy alebo zvýšenia transaminázy u pacientov súčasne infikovaných týmito vírusmi bola porovnateľná pri použití REYATAZU a s ním porovnateľnými režimami (pozri časť 4.4).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieSkúsenosti s akútnym predávkovaním REYATAZOM sú obmedzené. Jednorazové dávky do 1 200 mg u zdravých dobrovoľníkov sa ukázali bez symptomaticky neočakávaných účinkov. Pri vysokých dávkach, ktoré vedú k vysokej expozícii, sa môže pozorovať žltačka súvisiaca s nepriamou (nekonjugovanou) hyperbilirubinémiou (bez zmien pečeňovej funkcie) alebo s predĺžením PR
intervalu (pozri časti 4.4 a 4.8).
Liečba predávkovania REYATAZOM pozostáva zo všeobecných podporných opatrení vrátane sledovania vitálnych funkcií a elektrokardiogramu (EKG) a pozorovania klinického stavu pacienta. Ak je to indikované, je potrebné dosiahnuť vylúčenie neabsorbovaného atazanaviru vracaním alebo výplachom žalúdka. Odstránenie neabsorbovaného lieku môže urýchliť aj podanie aktívneho uhlia. Neexistuje špecifické antidotum pri predávkovaní REYATAZOM. Pretože sa atazanavir významne metabolizuje v pečeni a vo vysokej miere sa viaže na väzbové proteíny, je nepravdepodobné, že sa vo veľkom rozsahu vylúči dialýzou.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antivirotiká na systémové použitie, inhibítory proteázy, ATC kód: J05AE08
MechanizmusúčinkuAtazanavir je azapeptidový inhibítor HIV-1 proteázy (PI). Látka selektívne inhibuje vírusovo-
špecifické štiepenie vírusových proteínov Gag-Pol v bunkách infikovaných vírusmi HIV-1, čím bráni tvorbe zrelých viriónov a infikovaniu ďalších buniek.





 A
ntivírusová aktivita in vitro:
A
ntivírusová aktivita in vitro: atazanavir vykazuje anti-HIV-1 (vrátane všetkých testovaných vzoriek)
a anti-HIV-2 aktivitu v bunkovej kultúre.
RezistenciaAniretrovírusová terapia u dospelých pacientov bez predchádzajúcej liečbyV klinických štúdiách pacientov bez predchádzajúcej antiretrovírusovej terapie liečených atazanavirom bez potencovania jeho účinku, je substitúcia I50L, niekedy v kombinácii s A71V zmenou, signálnou rezistentnou substitúciou atazanaviru. Stupeň rezistencie na atazanavir sa pohyboval v rozmedzí od 3,5- do 29-násobku bez existencie fenotypovej skríženej rezistencie na ostatné PI. V klinických štúdiách pacientov bez predchádzajúcej antiretrovírusovej terapie liečených atazanavirom s potencovaním jeho účinku, substitúcia I50L nebola zaznamenaná u žiadneho pacienta bez základných substitúcií PI. N88S substitúcia sa zriedkavo vyskytla u pacientov s virologickým zlyhaním vyvolaným atazanavirom (s alebo bez ritonaviru). Zatiaľ čo môže prispievať k zníženiu vnímavosti na atazanavir, ak sa vyskytne s inou proteázovou substitúciou, v klinických štúdiách nevedie vždy k fenotypovej rezistencii na atazanavir alebo trvalému vplyvu na klinickú účinnosť.
Tabuľka 3. De novo substitúcie u pacientov bez predchádzajúcej terapie nereagujúcich na terapiu atazanavirom + ritonavirom (štúdia 138, 96 týždňov)Frekvencia de novo PI substitúcia (n=26)a> 20 % žiadna
10-20 % žiadna
a Počet pacientov s genotypmi klasifikovaný ako virologické zlyhanie (HIV RNA ≥ 400 kópií/ml).
M1841/V substitúcia sa vyskytla u 5/26 pacientov s REYATAZOM/ritonavirom a 7/26 pacientov
s lopinavirom/ritonavirom vyvolaná virologickým zlyhaním.
Antiretrovírusová terapia dospelých pacientov s predchádzajúcou liečbouMedzi 100 izolátmi získanými u pacientov zo štúdií 009, 043 a 045 po predchádzajúcej antiretrovírusovej terapii označených ako virologické zlyhania počas terapie atazanavirom, atazanavirom + ritonavirom alebo atazanavirom + sachinavirom bol zistený rozvoj rezistencie na atazanavir. Zo 60 izolátov od pacientov liečených buď atazanavirom alebo
atazanavirom + ritonavirom sa u 18 (30 %) objavil I50L fenotyp predtým zaznamenaný u pacientov bez predchádzajúcej liečby.
Tabuľka 4. De novo substitúcie u liečených pacientov nereagujúcich na terapiuatazanavirom + ritonavirom (štúdia 045, 48 týždňov)Frekvencia de novo PI substitúcia (n=35)a,b> 20 % M36, M46, I54, A71, V82
10-20 % L10, I15, K20, V32, E35, S37, F53, I62, G73, I84, L90
a Počet pacientov s genotypmi klasifikovaný ako virologické zlyhanie (HIV RNA ≥ 400 kópií/ml).
b Desať pacientov zaznamenalo základnú fenotypovú rezistenciu na atanazavir + ritonavir (zmena násobku [ZN] > 5,2). FC
vnímavosť v bunkovej kultúre vo vzťahu k štandardnému typu bola skúmaná pomocou PhenoSenseTM (Monogram
Biosciences, South San Francisco, Kalifornia, USA).
Žiadna z de novo substitúcií (pozri tabuľku 4) nie je špecifická voči atazanaviru a nebol zaznamenaný
opätovný vznik dosiahnutej rezistencie na atazanavir + ritonavir u pacientov liečených v štúdii 045.
K rezistencii u pacientov po predchádzajúcej antiretrovírusovej terapii dochádza hlavne akumuláciou hlavnej a vedľajšej rezistencie už opísanými substitúciami, ktoré spôsobujú rezistenciu na inhibítory proteáz.
Klinické výsledkyDospelí pacienti bez predchádzajúcej antiretrovírusovej terapieŠtúdia 138 je medzinárodná, randomizovaná, otvorená, multicentrická, prospektívna štúdia
s pacientmi bez predchádzajúcej liečby porovnávajúca REYATAZ/ritonavir (300 mg/100 mg raz denne) s lopinavirom/ritonavirom (400 mg/100 mg dvakrát denne), každá v kombinácii s fixnou dávkou tenofovir-dizoproxilfumarátu/emtricitabinu (300 mg/200 mg tablety jedenkrát denne). Rameno
s ramenom lopinavir/ritonavir, ako je odhadnuté pomerom pacientov s HIV RNA < 50 kópii/ml
v týždni 48 (Tabuľka 5).
Analýza údajov počas 96 týždňov liečby preukázala pretrvávanie antivírusovej aktivity (Tabuľka 5).
T
abuľka 5: Výsledky účinnosti v štúdii 138
a
Pa
rameter
REYATAZ/ritonavir
b
(30
0 mg/100 mg raz denne) n=440
L
o
pinavir/ritonavir
c
(40
0 mg/100 mg dvakrát denne) n=443
H
IV RNA < 50 kópií/ml, %
T
ýždeň 48 Týždeň 96 Týždeň 48 Týždeň 96
Všetci pacientid 78 74 76 68
Odhadovaný rozdiel [95 %
IS]d
Týždeň 48: 1,7 % [-3,8 %, 7,1 %] Týždeň 96: 6,1 % [0,3 %, 12,0 %]
Analýza podľa protokolue 86 (n=392f)
91 (n=352)
89 (n=372)
89 (n=331)
Odhadovaný rozdiele [95 %
IS]
Týždeň 48: -3 % [-7,6 %, 1,5 %] Týždeň 96: 2,2 % [-2,3 %, 6,7 %]
HIV RNA < 50 kópií/ml, % na základe počiatočných vlastnostíd
HIV RNA
< 100 000 kópií/ml 82 (n=217) 75 (n=217) 81 (n=218) 70 (n=218)
≥ 100 000 kópií/ml
CD4 počet
74 (n=223) 74 (n=223) 72 (n=225) 66 (n=225)
< 50 buniek/mm3 78 (n=58) 78 (n=58) 63 (n=48) 58 (n=48)
50 až < 100 buniek/mm3
100 až < 200 buniek/mm3
≥ 200 buniek/mm3
76 (n=45) 71 (n=45) 69 (n=29) 69 (n=29)
75 (n=106) 71 (n=106) 78 (n=134) 70 (n=134)
80 (n=222) 76 (n=222) 80 (n=228) 69 (n=228)
 P
r
i
e
m
erná zmena počiatočného počtu HIV RNA, log
10
kópií/ml
P
r
i
e
m
erná zmena počiatočného počtu HIV RNA, log
10
kópií/ml
Všetci pacienti -3,09 (n=397) -3,21 (n=360) -3,13 (n=397) -3,19 (n=340)
Priemerná zmena počiatočného počtu CD4, bunky/mm3Všetci pacienti 203 (n=370) 268 (n=336) 219 (n=363) 290 (n=317) Priemerná zmena počiatočného počtu CD4, bunky/mm3 na základe počiatočných vlastností
HIV RNA
< 100 000 kópií/ml 179 (n=183) 243 (n=163) 194 (n=183) 267 (n=152)
≥ 100 000 kópií/ml
227 (n=187) 291 (n=173) 245 (n=180) 310 (n=165)
a Priemerný počiatočný počet buniek CD4 bol 214 buniek/mm3 (rozsah 2 až 810 buniek/mm3) a priemerná počiatočná plazma HIV-1 RNA bola 4,94 log10 kópií/ml (rozsah 2,6 až 5,88 log10 kópií/ml).
b REYATAZ/RTV s tenofovir-dizoproxilfumarátom/emtricitabínom (fixná dávka 300 mg/200 mg tablety raz
denne).
c Lopinavir/RTV s tenofovir-dizoproxilfumarátom/emtricitabínom (fixná dávka 300 mg/200 mg tablety raz denne).
d Intent-to-treat analýza s chýbajúcimi hodnotami považovanými ako zlyhanie.
e Analýza podľa protokolu: Okrem pacientov, ktorí prerušili liečbu a ktorí vykazovali vážnu odchýlku od protokolu.
f Hodnotený počet pacientov.
Údaje o ukončení liečby ritonavirom z režimu na zosilnenie účinku atazanaviru (pozri tiež časť 4.4) Štúdia 136 (INDUMA)V otvorenej, randomizovanej, komparatívnej štúdii, v ktorej nasledovala po 26- až 30-týždni indukčnej
fázy s REYATAZOM 300 mg + ritonavirom 100 mg jedenkrát denne a dvoma NRTI udržiavacia fáza s REYATAZOM 400 mg bez zosilneného účinku jedenkrát denne a dvoma NRTI, ktoré sa podávali počas 48-týždňov (n=87), malo podobnú antivírusovú účinnosť v porovnaní s
REYATAZOM + ritonavirom a dvoma NRTI (n=85) u jedincov infikovaných HIV s úplnou supresiou replikácie HIV podľa hodnotenia pomocou podielu jedincov s HIV RNA < 50 kópiami/ml: 78 % jedincov s REYATAZOM bez zosilneného účinku a dvoma NRTI v porovnaní so 75 % s REYATAZOM + ritonavirom a dvoma NRTI.
Jedenásť jedincov (13 %) v skupine s REYATAZOM bez zosilneného účinku a 6 (7 %) v skupine s REYATAZOM + ritonavirom malo virologický rebound. Štyria jedinci v skupine s REYATAZOM bez zosilneného účinku a 2 v skupine s REYATAZOM + ritonavirom mali HIV RNA > 500 kópií/ml počas udržiavacej fázy. Žiadny jedinec v ani jednej skupine nevykazoval objavenie sa rezistencie na inhibítor proteázy. Substitúcia M184V v reverznej transkriptáze, ktorá vykazuje rezistenciu na lamivudín a emtricitabín, sa detekovala u 2 jedincov s REYATAZOM bez zosilneného účinku a
1 jedinca v skupine s REYATAZOM + ritonavirom.
V skupine s REYATAZOM bez zosilneného účinku bolo niekoľko ukončení liečby (1 verzus 4 jedinci v skupine s REYATAZOM + ritonavirom). V skupine s REYATAZOM bez zosilneného účinku bolo
v porovnaní so skupinou s REYATAZOM + ritonavirom menej hyperbilirubinémie a žltačky
(18 a 28 jedincov, v uvedenom poradí).
Dospelí pacienti s predchádzajúcou antiretrovírusovou terapiou
Štúdia 045je randomizovaná, multicentrická štúdia porovnávajúca REYATAZ (300 mg raz denne)
s ritonavirom (100 mg raz denne) voči REYATAZU (400 mg raz denne) so sachinavirom (1 200 mg raz denne) a voči lopinaviru + ritonaviru (kombinácia fixných dávok 400/100 mg dvakrát denne), každá v kombinácii s tenofovir-dizoproxilfumarátom (pozri časti 4.5 a 4.8) a jedným NRTI,
u pacientov s virologickým zlyhaním pri dvoch alebo viacerých predchádzajúcich režimoch obsahujúcich najmenej jeden PI, NRTI a NNRTI. U randomizovaných pacientov predstavoval
priemerný čas predchádzajúcej antiretrovírusovej expozície 138 týždňov pre PI, 281 týždňov pre
NRTI a 85 týždňov pre NNRTI. Na začiatku 34 % pacientov užívalo PI a 60 % užívalo NNRTI. Pätnásť zo 120 (13 %) pacientov v liečebnom ramene REYATAZ + ritonavir a 17 zo 123 (14 %)
pacientov v ramene lopinavir + ritonavir malo štyri alebo viac PI substitúcií L10, M46, I54, V82, I84
a L90. U tridsaťdva percent pacientov v štúdii bol zistený vírusový kmeň s horúčkou s menej než dvoma substitúciami NRTI.
Primárnym koncovým ukazovateľom bol časový rozdiel v zmenách oproti východiskovým hodnotám
HIV RNA počas 48 týždňov (Tabuľka 6).
Tabuľka 6: Výsledky účinnosti v týždni 48a a 96 (štúdia 045)
P
arameter
ATV
/
RTV
b
(
300 mg/
100 mg raz denne)
n=120
L
P
V
/
RTV
c
(
4
00 mg/
100 mg dvakrát denne)
n=123
Č
asovo priemerný rozdiel ATV/RTV- LPV/RTV
[
97,5% IS
d
]
T
ýždeň 48 Týždeň 96 Týždeň 48 Týždeň 96 Týždeň 48 Týždeň 96
P
r
i
e
m
erná zmena počiatočného počtu HIV RNA, log
10
kópií/ml
Všetci pacienti
-1,93 (n=90 e)
-2,29 (n=64)
-1,87 (n=99)
-2,08 (n=65)
0,13
[-0,12,
0,39]
0,14
[-0,13,
0,41]
 H
IV RNA < 50 kópií/ml, %
f
(
respondent/vyhodnotenie)
H
IV RNA < 50 kópií/ml, %
f
(
respondent/vyhodnotenie)
Všetci
pacienti 36 (43/120) 32 (38/120) 42 (52/123) 35 (41/118) NA NA
HIV RNA < 50 kópií/ml podľa počiatočných PI substitúciíf, g % (respondent/vyhodnotenie)0-2 44 (28/63) 41 (26/63) 56 (32/57) 48 (26/54) NA NA
3 18 (2/11) 9 (1/11) 38 (6/16) 33 (5/15) NA NA
≥ 4 27 (12/45) 24 (11/45) 28 (14/50) 20 (10/49) NA NA
Priemerná zmena počiatočného počtu CD4, bunky/mm3Všetci
pacienti 110 (n=83) 122 (n=60) 121 (n=94) 154 (n=60) NA NA
a Priemerný počiatočný počet CD4 buniek bol 337 buniek/mm3 (rozpätie: 14 až 1 543 buniek/mm3) a priemerná počiatočná plazmatická hladina HIV-1 RNA bola 4,4 log10 kópií/ml (rozpätie: 2,6 až 5,88 log10 kópií/ml).
b ATV/RTV s tenofovir-dizoproxilfumarátom/emtricitabínom (fixná dávka 300 mg/200 mg tablety raz denne).
c LPV/RTV s tenofovir-dizoproxilfumarátom/emtricitabínom (fixná dávka 300 mg/200 mg tablety raz denne).
d Interval spoľahlivosti.
e Počet hodnotených pacientov.
f Intent-to-treat analýza s chýbajúcimi hodnotami považovanými ako zlyhanie. Respondenti na LPV/RTV, ktorí dokončili liečbu pred 96. týždňom, sú vylúčení z analýzy 96. týždňa. Počet pacientov s HIV RNA
< 400 kópií/ml bol 53 % a 43 % pre ATV/RTV a 54 % a 46 % pre LPV/RTV v týždni 48, respektíve 96.
g Selektívne substitúcie zahŕňajú akúkoľvek zmenu v polohe L10, K20, L24, V32, L33, M36, M46, G48, I50, I54, L63, A71, G73, V82, I84 a L90 (0-2, 3, 4 alebo viac) na začiatku.
NA = neaplikovateľné.
Počas 48 týždňov terapie boli priemerné zmeny hladín HIV RNA v porovnaní s počiatočnými hodnotami pre REYATAZ + ritonavir a pre lopinavir + ritonavir (neinferiórna) podobné. Zhodné výsledky boli získané počas predošlého sledovania použitou metódou analýzy (priemerný časový rozdiel 0,11, 97,5% interval spoľahlivosti, [-0,15, 0,36]). Podľa analýzy „as-treated“ (liečených pacientov), vylučujúcou chýbajúce hodnoty, bol podiel pacientov s HIV RNA < 400 kópií/ml
(< 50 kópií/ml) v ramene REYATAZ + ritonavir 55 % (40 %) a v ramene lopinavir + ritonavir 56 %
(46 %).
Počas 96 týždňov liečby, priemerné zmeny HIV RNA oproti východiskovej hodnote pre
REYATAZ + ritonavir a lopinavir + ritonavir splnili kritériá neinferiority založené na pozorovaných prípadoch. Zhodné výsledky sa získali počas predošlého sledovania s použitím rovnakej metódy analýzy. Analýzou "as treated" (liečených pacientov), vylučujúcou chýbajúce hodnoty, podiel pacientov s HIV RNA < 400 kópií/ml (< 50 kópií/ml) pre REYATAZ + ritonavir bol 84 % (72 %)
a pre lopinavir + ritonavir 82 % (72 %). Je dôležité poznamenať, že počas 96-týždňovej analýzy zostalo v štúdii celkovo 48 % pacientov.
REYATAZ + sachinavir sa ukázal menej účinný ako lopinavir + ritonavir.
Pediatrická populáciaZhodnotenie farmakokinetiky, bezpečnosti, tolerability a účinnosti REYATAZU je založené na údajoch z otvorenej multicentrickej klinickej štúdie AI424-020 vykonanej na pacientoch vo veku od
3 mesiacov do 21 rokov. Celkovo v tejto štúdii 182 pediatrických pacientov (81 bez predchádzajúcej antiretrovírusovej liečby a 101 s predchádzajúcou antiretrovírusovou liečbou) užívali REYATAZ jedenkrát denne (kapsuly alebo práškovú formu) s alebo bez ritonaviru v kombinácii s dvomi NRTI.
Klinické údaje získané z tejto štúdie sú nedostatočné na to, aby podporili používanie atazanaviru
(s alebo bez ritonaviru) u detí mladších ako 6 rokov.
Údaje o účinnosti, ktoré boli pozorované u 41 pediatrických pacientov od 6 rokov do menej ako
18 rokov, ktorí užívali REYATAZ kapsuly s ritonavirom, sú uvedené v tabuľke 7. U pediatrických pacientov bez predchádzajúcej liečby bol priemerný počiatočný počet buniek CD4 344 buniek/mm3 (rozpätie: 2 až 800 buniek/mm3) a priemerná počiatočná plazmatická hladina HIV-1 RNA bola
4,67 log10 kópií/ml (rozpätie: 3,70 až 5,00 log10 kópií/ml). U pediatrických pacientov
s predchádzajúcou liečbou bol priemerný počiatočný počet buniek CD4 522 buniek/mm3 (rozpätie:
100 až 1 157 buniek/mm3) a priemerná počiatočná plazmatická hladina HIV-1 RNA bola 4,09 log10
kópií/ml (rozpätie: 3,28 až 5,00 log10 kópií/ml).
Tabuľka 7: Výsledky účinnosti (pediatrickí pacienti vo veku od 6 rokov do menej ako 18 rokov veku) v 48. týždni (štúdia AI424-020)
P
arameter Pacienti bez predchádzajúcej
li
e
čby kapsulami REYATAZU/ritonaviru (300 mg/100 mg jedenkrát denne) n=16
P
acienti s predchádzajúcou liečbou kapsulami REYATAZU/ritonaviru (300 mg/100 mg jedenkrát denne) n=25
 H
IV RNA < 50 kópií/ml, %
a
H
IV RNA < 50 kópií/ml, %
a
Všetci pacienti 81 (13/16) 24 (6/25)
HIV RNA < 400 kópií/ml, % aVšetci pacienti 88 (14/16) 32 (8/25)
Priemerná zmena počiatočného počtu CD4, bunky/mm3Všetci pacienti 293 (n=14b) 229 (n=14b)
HIV RNA < 50 kópií/ml podľa počiatočných PI substitúcií, c % (respondenti/vyhodnoteníd)0-2 NA 24 (4/15)
3 NA -
≥ 4 NA 0 (0/3)
a Intent-to-treat analýza s chýbajúcimi hodnotami považovanými ako zlyhanie.
b Počet hodnotených pacientov.
c PI významné L24I, D30N, V32I, L33F, M46IL, I47AV, G48V, I50LV, F53LY, I54ALMSTV, L76V, V82AFLST, I84V, N88DS, L90M; PI nevýznamné: L10CFIRV, V11I, E35G, K43T, Q58E, A71ILTV,
G73ACST, T74P, N83D, L89V.
d Zahŕňa pacientov s počiatočnými údajmi o rezistencii. NA = neaplikovateľné.
5.2 Farmakokinetické vlastnostiFarmakokinetické vlastnosti atazanaviru sa hodnotili u zdravých dospelých dobrovoľníkov a HIV- infikovaných pacientov; medzi oboma skupinami sa pozorovali signifikantné rozdiely. Farmakokinetika atazanaviru vykazovala nelineárnu dispozíciu.
Absorpcia: u HIV infikovaných pacientov (n=33, kombinované štúdie) viedli opakované dávky REYATAZU 300 mg raz denne s ritonavirom v dávke 100 mg v kombinácii s jedlom ku geometrickému priemeru (CV%) pre atazanavir, Cmax 4 466 (42 %) ng/ml s časom pre Cmax približne
2,5 hodiny. Geometrický priemer (CV%) pre atazanavir Cmin a AUC bol 654 (76 %) ng/ml a 44 185
(51 %) ng•h/ml.
U pacientov infikovaných HIV (n=13) viedlo opakované podávanie REYATAZU 400 mg (bez ritonaviru) jedenkrát denne s jedlom ku geometrickému priemeru (CV %) Cmax atazanaviru
2 298 (71) ng/ml, s časom dosiahnutia Cmax približne 2,0 hodiny. Geometrický priemer (CV %) Cmin
atazanaviru bol 120 (109) ng/ml a AUC 14 874 (91) ng•h/ml.
Vplyvjedla: súbežné podávanie REYATAZU a ritonaviru s jedlom optimalizuje biologickú dostupnosť atazanaviru. Súbežné podávanie jednotlivej dávky 300 mg REYATAZU a 100 mg ritonaviru s ľahkým jedlom viedlo k 33 % zvýšeniu AUC a 40 % zvýšeniu oboch Cmax a 24-hodinovej
koncentrácie atazanaviru v pomere k stavu nalačno. Súbežné podávanie s vysoko tukovým jedlom neovplyvnilo AUC atazanaviru v pomere k podmienkam nalačno a Cmax bol v medziach 11 % hodnôt nalačno. 24-hodinová koncentrácia po vysoko tukovom jedle bola zvýšená priemerne o 33 % vzhľadom na oneskorenú absorpciu; medián Tmax bol zvýšený z 2,0 na 5,0 hodín. Podávanie REYATAZU s ritonavirom a s ľahkým alebo jedlom s vysokým obsahom tukov znížilo koeficient zmeny AUC a Cmax približne o 25 % v porovnaní so stavom nalačno. Aby sa zlepšila biologická dostupnosť a minimalizovala variabilita, REYATAZ sa má užívať s jedlom.
Distribúcia: atazanavir sa viaže asi z 86 % na ľudské sérové proteíny v rozsahu koncentrácie 100 až
10 000 ng/ml. Na kyslý α-1-glykoproteín (AAG) a albumín sa atazanavir viaže v podobnom rozsahu
(89 % a 86 % pri 1 000 ng/ml). V štúdii s viacnásobnými dávkami u HIV-infikovaných pacientov liečených dávkami atazanaviru 400 mg raz denne v kombinácii s ľahkým jedlom počas 12 týždňov bol atazanavir zistený v cerebrospinálnej tekutine a sperme.
Biotransformácia: štúdie u ľudí a in vitro štúdie využívajúce ľudské pečeňové mikrozómy preukázali, že atazanavir sa metabolizuje hlavne izoenzýmom CYP3A4 na oxidačné metabolity. Metabolity sa vylučujú do žlče voľné alebo ako glukuronidové metabolity. Ďalšie menej významné metabolické cesty pozostávajú z N-dealkylácie a hydrolýzy. Boli charakterizované dva vedľajšie metabolity atazanaviru v plazme. Žiaden z metabolitov nevykazoval in vitro antivírusovú aktivitu.
Eliminácia: po podaní jednorazovej 400-mg dávky 14C-atazanaviru sa v stolici a moči zistilo 79 %
a 13 % z celkovej rádioaktivity. Približne 20 % a 7 % podanej dávky predstavovalo nezmenené liečivo
v stolici a v moči. Priemerné vylučovanie nezmeneného liečiva močom predstavovalo 7 % po 2-
týždňovom podávaní 800 mg raz denne. U dospelých HIV-infikovaných pacientov (n=33, kombinované štúdie) bol priemerný polčas v rozsahu dávkovacieho intervalu pre atazanavir 12 hodín v rovnovážnom stave po dávke 300 mg denne s ritonavirom 100 mg denne s ľahkým jedlom.
Osobitné skupiny pacientov
Porucha funkcie obličiek: renálne vylučovanie nezmeneného atazanaviru zdravými jedincami
predstavovalo približne 7 % podanej dávky. Nie sú k dispozícii farmakokinetické údaje dostupné pre REYATAZ s ritonavirom u pacientov s obličkovou insuficienciou. REYATAZ (bez ritonaviru) bol skúmaný u dospelých pacientov s ťažkým poškodením obličiek (n=20), vrátane hemodialyzovaných pacientov, pri viacnásobných dávkach 400 mg raz denne. Hoci sa v tejto štúdii vyskytli určité obmedzenia (t.j. ohraničenie liekových koncentrácií nebolo sledované), výsledky naznačujú, že farmakokinetické parametre atazanaviru sa o 30 % až 50 % znížia u pacientov podrobujúcich sa hemodialýze v porovnaní s pacientmi s normálnou obličkovou funkciou. Tento mechanizmus zníženia nie je známy.(Pozri časť 4.2 a 4.4.)
Porucha funkcie pečene: atazanavir sa primárne metabolizuje a vylučuje pečeňou. REYATAZ (bez ritonaviru) sa skúmal u dospelých jedincov so stredne ťakou až ťažkou poruchou funkcie pečene
(14 jedincov s Childovou-Pughovou triedou B a 2 s Childovou-Pughovou triedou C) po jednorazovej
dávke 400 mg. Priemerná AUC(0-∞) bola o 42 % vyššia u jedincov s poruchou funkcie pečene ako u
zdravých jedincov. Priemerný polčas atazanaviru u jedincov s poruchou funkcie pečene bol
12,1 hodiny v porovnaní so 6,4 hodinami u zdravých jedincov. Účinky poruchy funkcie pečene na farmakokinetiku atazanaviru podaného v dávke 300 mg s ritonavirom neboli skúmané. Očakávajú sa
zvýšené koncentrácie atazanaviru podaného s ritonavirom alebo bez neho u pacientov so stredne
ťažkou alebo ťažkou poruchou funkcie pečene (pozri časti 4.2, 4.3 a 4.4).
Vek/pohlavie: uskutočnila sa štúdia farmakokinetiky atazanaviru u 59 zdravých mužov a žien
(29 mladých, 30 starších). Neexistovali klinicky významné farmakokinetické rozdiely týkajúce sa veku alebo pohlavia.
Rasa: farmakokinetická analýza vzoriek z klinických štúdií vo fáze II nepreukázala žiaden vplyv rasy na farmakokinetiku atazanaviru.
Gravidita:
Farmakokinetické údaje HIV infikovaných gravidných žien užívajúcich REYATAZ kapsule
s ritonavirom sú uvedené v Tabuľke 8.
Tabuľka 8: Farmakokinetika atazanaviru s ritonavirom v rovnovážnom stave u HIV
infikovaných gravidných žien po jedle
atazanavir 300 mg s ritonavirom 100 mg
F
armakokinetický parameter
Cmax ng/ml
Geometrický priemer
(CV%)
AUC ng•h/ml
Geometrický priemer
(CV%)
Cmin ng/mlb
Geometrický priemer
(CV%)
2. trimester
(n=9)
3 729,09 (39)
34 399,1 (37)
663,78 (36)
3. trimester(n=20)
3 291,46 (48)
34 251,5 (43)
668,48 (50)
po pôrodea(n=36)
5 649,10 (31)
60 532,7 (33)
1 420,64 (47)
a Zistilo sa, že maximálne koncentrácie atazanaviru a AUC sú približne o 26-40 % vyššie počas obdobia po pôrode (4-12 týždňov) ako tie, ktoré sa pozorovali u v minulosti HIV infikovaných negravidných pacientok. Minimálne plazmatické koncentrácie atazanaviru boli približne 2-násobne vyššie počas obdobia po pôrode
v porovnaní s tými, ktoré sa pozorovali u v minulosti HIV infikovaných negravidných pacientok.
b Cmin je koncentrácia 24 hodín po užití dávky.
Pediatrická populácia
Po normalizácii telesnej hmotnosti je tendencia k vyššiemu klírensu u mladších detí. Následkom toho boli pozorované väčšie pomery maximum:minimum, no pri odporúčaných dávkach sa očakáva, že geometrické priemery expozícií atazanaviru (Cmin, Cmax a AUC) u pediatrických pacientov budú podobné tým, ktoré sa pozorovali u dospelých.
5.3 Predklinické údaje o bezpečnosti
V štúdiách s opakovanou dávkou uskutočnených na myšiach, potkanoch a psoch sa nálezy súvisiace s atazanavirom vo všeobecnosti viazali na pečeň a zahŕňali minimálne až mierne zvýšenie sérového bilirubínu a pečeňových enzýmov, hepatocelulárnu vakuolizáciu a hypertrofiu a iba u samičiek myší aj hepatickú nekrózu bunky. Systémové expozície atazanaviru u myší (samce), potkanov a psov pri dávkach spájaných s hepatálnymi zmenami boli prinajmenšom rovnaké ako tie, ktoré sa pozorovali
u ľudí pri dávkach 400 mg raz denne. Expozícia atazanaviru predstavovala u samičiek myší po dávke spôsobujúcej nekrózu bunky 12-násobok expozície u ľudí po dávke 400 mg raz denne. Sérový cholesterol a glukóza sa minimálne až mierne zvýšili u potkanov, ale nezvýšili sa u myší alebo psov.
Počas in vitro štúdií boli draslíkové kanáliky klonovaných ľudských kardiocytov (hERG) v 15 % inhibované v koncentrácii (30 μM) atazanaviru zodpovedajúcej 30-násobku koncentrácie voľného liečiva pri Cmax u ľudí. Podobné koncentrácie atazanaviru zvýšili o 13 % trvanie akčného potenciálu (ADP90) v štúdii s Purkyňovými vláknami u králikov. Elektrokardiografické zmeny (sínusová bradykardia, predĺženie PR intervalu, predĺženie QT intervalu a predĺženie QRS komplexu) sa pozorovali len v počiatočnej 2-týždňovej štúdii perorálnej toxicity uskutočnenej na psoch. Následné 9- mesačné štúdie perorálnej toxicity na psoch nepreukázali elektrokardiografické zmeny súvisiace
s liekom. Klinický význam týchto predklinických údajov nie je známy. Potenciálne účinky tohto lieku na srdce nie je možné u ľudí vylúčiť (pozri časti 4.4 a 4.8). Možnosť predĺženia PR intervalu je
potrebné vziať do úvahy pri predávkovaní (pozri časť 4.9).
V štúdii fertility a skorých vývojových štádií embryí u potkanov atazanavir menil cyklus pohlavného pudu bez vplyvu na párenie alebo fertilitu. U potkanov alebo králikov sa pri dávkach toxických pre matku nepozorovali žiadne teratogénne účinky. V štúdii na gravidných králikoch sa pozorovali
u mŕtvych alebo skonávajúcich samičiek lézie na žalúdku a črevách pri maternálnych dávkach 2 až 4- krát prevyšujúcich najvyššiu dávku podávanú v definitívnej vývojovej štúdii týkajúcej sa embryí. Pri skúmaní prenatálneho a postnatálneho vývoja potkanov atazanavir spôsoboval prechodné zníženie hmotnosti organizmu mláďat pri dávkach toxických pre matku. Systémová expozícia atazanaviru pri dávkach, ktoré boli toxické pre matku, bola rovnaká alebo o niečo vyššia ako tá, ktorá sa pozorovala
u ľudí, ktorým sa podávala dávka 400 mg raz denne.
Atazanavir bol negatívny v Amesovom teste reverznej mutácie, ale indukoval chromozomálne aberácie in vitro ako pri absencii, tak aj v prítomnosti metabolickej aktivácie. V in vivo štúdiách na potkanoch atazanavir neindukoval mikrojadrá v kostnej dreni, poškodenie DNA v dvanástniku (stanovenie komét) alebo neplánovanú reparáciu DNA v pečeni pri plazmatických a tkanivových koncentráciách prevyšujúcich koncentrácie, ktoré boli klastogénne in vitro.
V dlhodobých štúdiách karcinogenity atazanaviru na myšiach a potkanoch bol pozorovaný zvýšený výskyt benígnych pečeňových adenómov iba u myších samičiek. Zvýšený výskyt benígnych pečeňových adenómov u myších samičiek je pravdepodobne následkom cytotoxických pečeňových zmien manifestujúcich sa ako jednoduchá nekróza buniek a tento nález je považovaný za irelevantný u ľudí v určených terapeutických expozíciách. U myších samcov a potkanov neboli potvrdené nijaké známky karcinogénneho pôsobenia.
Atazanavir zvyšoval zákal bovinnej rohovky v in vitro štúdii okulárnej dráždivosti, čím indikoval, že by pri priamom kontakte s očami mohol mať dráždivé účinky.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
REYATAZ 100 mg tvrdé kapsuly
Kapsula obsahuje: krospovidón, monohydrát laktózy, magnéziumstearát
Obal kapsuly:
želatína, indigokarmín (E132), oxid titaničitý (E171)
Biely atrament obsahuje:
šelak, oxid titaničitý (E171), hydroxid amónny, propylénglykol, simetikón
REYATAZ 150 mg tvrdé kapsuly
Kapsula obsahuje: krospovidón, monohydrát laktózy, magnéziumstearát
Obal kapsuly: želatína, indigokarmín (E132), oxid titaničitý (E171),
Modrý atrament obsahuje: šelak, propylénglykol, hydroxid amónny, indigokarmín (E132)
Biely atrament obsahuje: šelak, oxid titaničitý (E171), hydroxid amónny, propylénglykol, simetikón
REYATAZ 200 mg tvrdé kapsuly
Kapsula obsahuje: krospovidón, monohydrát laktózy, magnéziumstearát
Obal kapsuly: želatína, indigokarmín (E132), oxid titaničitý (E171)
Biely atrament obsahuje: šelak, oxid titaničitý (E171), hydroxid amónny, propylénglykol, simetikón
REYATAZ 300 mg tvrdé kapsuly
Kapsula obsahuje: krospovidón, monohydrát laktózy, magnéziumstearát
Obal kapsuly: želatína, červený oxid železitý, čierny oxid železitý, žltý oxid železitý, indigokarmín
(E132), oxid titaničitý (E171)
Biely atrament obsahuje: šelak, oxid titaničitý (E171), hydroxid amónny, propylénglykol, simetikón
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 25 °C.
6.5 Druh obalu a obsah balenia
REYATAZ 100 mg tvrdé kapsuly
Každá škatuľa obsahuje jednu polyetylénovú (HDPE) fľašu s polypropylénovým uzáverom so závitom bezpečným pred deťmi. Každá fľaša obsahuje 60 tvrdých kapsúl.
Každá škatuľa obsahuje 60 x 1 kapsúl, 10 blistrov obsahujúcich 6 x 1 kapsúl v Alu/Alu perforovaných blistroch.
REYATAZ 150 mg tvrdé kapsuly
Každá škatuľa obsahuje jednu polyetylénovú (HDPE) fľašu s polypropylénovým uzáverom so závitom bezpečným pred deťmi. Každá fľaša obsahuje 60 tvrdých kapsúl.
Každá škatuľa obsahuje 60 x 1 kapsúl, 10 blistrov obsahujúcich 6 x 1 kapsúl v Alu/Alu perforovaných blistroch.
REYATAZ 200 mg tvrdé kapsuly
Každá škatuľa obsahuje jednu polyetylénovú (HDPE) fľašu alebo tri fľaše z polyetylénu s vysokou hustotou (HDPE) s polypropylénovým uzáverom so závitom bezpečným pred deťmi. Každá fľaša
obsahuje 60 tvrdých kapsúl.
Každá škatuľa obsahuje 60 x 1 kapsúl, 10 blistrov obsahujúcich 6 x 1 kapsúl v Alu/Alu perforovaných blistroch.
REYATAZ 300 mg tvrdé kapsuly
Každá škatuľa obsahuje jednu polyetylénovú (HDPE) fľašu alebo tri fľaše z polyetylénu s vysokou hustotou (HDPE) s polypropylénovým uzáverom so závitom bezpečným pred deťmi. Každá fľaša obsahuje 30 tvrdých kapsúl.
Každá škatuľa obsahuje 30 x 1 kapsúl, 5 blistrov obsahujúcich 6 x 1 kapsúl v Alu/Alu perforovaných blistroch.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
BRISTOL-MYERS SQUIBB PHARMA EEIG Uxbridge Business Park
Sanderson Road
Uxbridge UB8 1DH Vel'ká Británia
8. REGISTRAČNÉ ČISLAEU/1/03/267/001-006; 008-011
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 02. marca 2004
Dátum posledného predĺženia registrácie: 02. marca 2009
10. DÁTUM REVÍZIE TEXTU{MM/RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
REYATAZ 50 mg perorálny prášok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každé vrecko s 1,5 g perorálneho prášku obsahuje 50 mg atazanaviru (vo forme sulfátu). Pomocná látka so známym účinkom: 63 mg aspartámu; 1 305,15 mg sacharózy vo vrecku (1,5 g
perorálneho prášku).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Perorálny prášok
Sivobiely až bledožltý prášok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
REYATAZ perorálny prášok, súčasne podávaný s nízkou dávkou ritonaviru, je indikovaný v kombinácii s inými antiretrovírusovými liekmi na liečbu pediatrických pacientov infikovaných HIV-
1 vo veku minimálne 3 mesiacov a s telesnou hmotnosťou minimálne 5 kg (pozri časť 4.2).
Na základe dostupných virologických a klinických údajov u dospelých pacientov sa neočakáva prínos u pacientov s výskytom kmeňov rezistentných na viacero proteázových inhibítorov (≥ 4 PI mutácií). Výber REYATAZU u dospelých a pediatrických pacientov po predchádzajúcej liečbe sa má zakladať na výsledkoch individuálnej vírusovej rezistencie a terapeutickej anamnéze pacienta (pozri časti 4.4
a 5.1).
4.2 Dávkovanie a spôsob podávania
Liečbu má začať lekár, ktorý má skúsenosti s liečbou infekcie HIV. Dávkovanie
Pediatrickí pacienti (vo veku minimálne 3 mesiacov a s telesnou hmotnosťou minimálne 5 kg)
Dávky perorálneho prášku atazanaviru a ritonaviru pre pediatrických pacientov sú založené na telesnej hmotnosti, ako je uvedené v tabuľke 1. REYATAZ perorálny prášok sa musí užívať s jedlom.
Dávkovanie
Pediatrickí pacienti (vo veku minimálne 3 mesiacov a s telesnou hmotnosťou minimálne 5 kg) Dávky perorálneho prášku atazanaviru a ritonaviru pre pediatrických pacientov sa zakladajú na telesnej hmotnosti, ako je uvedené v tabuľke 1. REYATAZ perorálny prášok sa musí užívať s ritonavirom a má sa užívať s jedlom.
Tabuľka 1 Dávka REYATAZU perorálneho prášku s ritonavirom pre pediatrických pacientova
(vo veku minimálne 3 mesiacov a s telesnou hmotnosťou minimálne 5 kg)
T
elesná hmotnosť (kg)
D
ávka REYATAZU jedenkrát denne
D
ávka ritonaviru jedenkrát denne

minimálne 5 až menej ako 15 200 mg (4 vreckáb) 80 mgc
minimálne 15 až menej ako 35 250 mg (5 vreciekb) 80 mgc

minimálne 35 300 mg (6 vreciekb) 100 mgd
a Pre pediatrických pacientov sa tiež vzťahujú rovnaké odporúčania týkajúce sa načasovania a maximálnych dávok súčasne podávaných inhibítorov protónovej pumpy a antagonistov H2-receptora ako u dospelých (pozri časť 4.5).
b Každé vrecko obsahuje 50 mg atazanaviru.
c Ritonavir perorálny roztok.
d Ritonavir perorálny roztok alebo kapsula/tableta.
REYATAZ kapsuly sú dostupné pre pediatrických pacientov vo veku minimálne 6 rokov, ktorých telesná hmotnosť je minimálne 15 kg a ktorí sú schopní kapsuly prehĺtať (pozri Súhrn charakteristických vlastností lieku REYATAZ kapsuly). Prestavenie liečby na REYATAZ kapsuly z REYATAZU perorálny prášok sa odporúča hneď, ako sú pacienti schopní tvalo kapsuly prehĺtať.
Pri prestavovaní liekových foriem môže byť potrebná zmena dávky. Pozrite si tabuľku dávkovania pre špecifické liekové formy (pozri Súhrn charakteristických vlastností lieku REYATAZ kapsuly).
Osobitné skupiny pacientovPorucha funkcie obličiekNie je potrebná úprava dávkovania. REYATAZ s ritonavirom sa neodporúča u pacientov podrobujúcich sa hemodialýze (pozri časti 4.4 a 5.2).
Porucha funkcie pečeneREYATAZ s ritonavirom nebol skúmaný u pacientov s poruchou funkcie pečene. Pacientom
s miernou poruchou funkcie pečene sa má REYATAZ s ritonavirom podávať opatrne. REYATAZ s ritonavirom sa nesmie podávať pacientom so stredne ťažkou až ťažkou poruchou funkcie pečene
(pozri časti 4.3, 4.4 a 5.2).
Gravidita a obdobie po pôrode:Počas druhého a tretieho trimestra gravidity:
REYATAZ 300 mg s ritonavirom 100 mg nemôžu poskytnúť dostatočnú expozíciu atazanaviru, obzvlášť vtedy, keď účinnosť atazanaviru alebo celého režimu môže byť znížená v dôsledku
rezistencie na liek. Pretože sú k dispozícii obmedzené dostupné údaje a vzhľadom na individuálnu
variabilitu pacienta počas gravidity, môže sa na zabezpečenie adekvátnej expozície zvážiť terapeutické monitorovanie liekov (Theraputic Drug Monitoring-TDM).
Ak sa atazanavir podáva s liekmi o ktorých je známe, že znižujú expozíciu atazanaviru (napr.
tenofovir-dizoproxilfumarát alebo antagonisty H2-receptorov) očakáva sa riziko ďašieho zníženia jeho expozície.
§ Ak je potrebný tenofovir-dizoproxilfumarát alebo antagonista H2-receptorov, môže sa zvážiť zvýšenie dávky na REYATAZ 400 mg s ritonavirom 100 mg s terapeutickým monitorovaním
liekov (pozri časti 4.6 a 5.2).
§ Použitie REYATAZU s ritonavirom u gravidných pacientok, ktoré dostávajú aj tenofovir-
dizoproxilfumarát a aj antagonistu H2-receptorov sa neodporúča.
Počas obdobia po pôrode:
Po možnom znížení expozície atazanaviru počas druhého a tretieho trimestra sa môžu expozície atazanaviru prvé dva mesiace po pôrode zvýšiť (pozri časť 5.2). Preto pacientky po pôrode majú byť
starostlivo monitorované pre výskyt nežiaducich reakcií.
§ V tomto období pacientky po pôrode majú dodržiavať rovnaké odporúčanie týkajúce sa dávky ako pacientky, ktoré nie sú gravidné, vrátane tých odporúčaní pre súbežné užívanie liekov o ktorých je
známe, že ovplyvňujú expozíciu atazanaviru (pozri časť 4.5).
Pediatrickí pacienti (vo veku do 3 mesiacov)REYATAZ sa nemá používať u detí vo veku do 3 mesiacov z dôvodu bezpečnostných obáv, najmä po zohľadnení možného rizika vzniku novorodeneckej žltačky.
Spôsobpodávania:
Na perorálne použitie.
REYATAZ perorálny prášok majú dojčatá, ktoré môžu piť z pohára, užívať/dostávať s jedlom (napr. jablkovým pyré alebo jogurtom) alebo nápojmi (napr. mliekom, dojčenskou výživou alebo vodou). Pre malé deti (do 6 mesiacov), ktoré nevedia jesť pevnú potravu alebo piť z pohára, sa má REYATAZ perorálny prášok vmiešať do dojčenskej výživy a podať pomocou perorálnej injekčnej striekačky,
ktorá sa môže získať od lekárnika. Podávanie REYATAZU a dojčenskej výživy pomocou dojčenskej fľašky sa neodporúča, pretože sa tak nemusí podať úplná dávka.
Podrobnosti o príprave a podávaní REYATAZU perorálneho prášku a pokyny na používanie, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok (uvedených v časti 6.1).
Pacienti so stredne ťažkou až ťažkou insuficienciou pečene (pozri časti 4.2 a 4.4). Súbežné podávanie so simvastatínom alebo lovastatínom (pozri časť 4.5).
Kombinácia s rifampicínom pri súbežnom podávaní s nízkou dávkou ritonaviru (pozri časť 4.5).
Súbežné podávanie s PDE5 inhibítorom sildenafilom, len ak sa používa na liečbu pľúcnej artériovej hypertenzie (PAH) (pozri časť 4.5). Súbežné podávanie sildenafilu na liečbu erektilnej dysfunkcie pozri časti 4.4 a 4.5.
Súbežné podávanie s liekmi, ktoré sú substrátmi CYP3A4 izoformy cytochrómu P450 a majú úzku terapeutickú šírku (napr. kvetiapín, alfuzosín, astemizol, terfenadín, cisaprid, pimozid, chinidín, bepridil, triazolam, midazolam podávaný perorálne (opatrnosť pri parenterálnom podávaní midazolamu, pozri časť 4.5) a námeľové alkaloidy, najmä ergotamín, dihydroergotamín, ergonovín, metylergonovín) (pozri časť 4.5).
Súbežné podávanie s liekmi obsahujúcimi Ľubovník bodkovaný (Hypericum perforatum) (pozri časť 4.5).
4.4 Osobitné upozornenia a opatrenia pri používaní
Hoci sa preukázalo, že účinná vírusová supresia dosiahnutá pri antiretrovírusovej terapii značne znižuje riziko prenosu HIV pohlavným stykom, reziduálne riziko nie je možné vylúčiť. Je potrebné prijať opatrenia na zabránenie prenosu HIV v súlade s národnými odporúčaniami.
Súbežné podávanie REYATAZU s ritonavirom v dávkach vyšších ako 100 mg jedenkrát denne nebolo klinicky vyhodnotené. Použitie vyšších dávok ritonaviru môže zmeniť bezpečnostný profil atazanaviru (účinky na srdce, hyperbilirubinémia), a preto sa neodporúča. Zvýšenie dávky ritonaviru na 200 mg jedenkrát denne sa môže zvážiť, len keď sa azatanavir s ritonavirom súbežne podávajú s efavirenzom. V tomto prípade treba zabezpečiť starostlivé klinické sledovanie (pozri nižšie Liekové a iné
interakcie).
Pacienti s koexistujúcimi stavmi
Porucha funkcie pečene
Atazanavir sa primárne metabolizuje pečeňou a u pacientov s poruchou funkciou pečene sa pozorovali jeho zvýšené plazmatické koncentrácie (pozri časti 4.2 a 4.3). Bezpečnosť a účinnosť REYATAZU nebola u pacientov s významným existujúcim ochorením pečene stanovená. Pacienti s chronickou hepatitídou B alebo C liečení kombinovanou antiretrovírusovou terapiou majú zvýšené riziko závažných a potenciálne smrteľných nežiaducich reakcií. V prípade súbežnej antivírusovej liečby hepatitídy B alebo C sa tiež oboznámte s príslušnými súhrnmi charakteristických vlastností pre tieto lieky (pozri časť 4.8).
Pacienti s existujúcou pečeňovou dysfunkciou vrátane chronickej aktívnej hepatitídy, majú zvýšený výskyt funkčných abnormalít pečene počas kombinovanej antiretrovírusovej terapie a majú sa sledovať štandardným spôsobom. Ak sa u týchto pacientov preukáže zhoršenie ochorenia pečene, musí sa zvážiť prerušenie alebo ukončenie liečby.
Porucha funkcie obličiek
Nie je potrebná úprava dávkovania u pacientov s poruchou funkcie obličiek. REYATAZ sa však neodporúča u pacientov podrobujúcich sa hemodialýze (pozri časti 4.2 a 5.2).
Predĺženie QT intervalu
V klinických štúdiách sa pozorovalo asymptomatické od dávky závislé predĺženie PR intervalu súvisiaceho s podávaním REYATAZU. Pri podávaní liekov, u ktorých je známe, že indukujú
predĺženia PR, sa má postupovať obozretne. Pacienti s existujúcimi poruchami konduktivity
(atrioventrikulárna blokáda druhého alebo vyššieho stupňa alebo komplexná ramienková blokáda)
majú REYATAZ užívať opatrne a len vtedy, ak prínos prevýši riziko (pozri časť 5.1). Mimoriadna opatrnosť je potrebná pri predpisovaní REYATAZU súčasne s liekmi, ktoré majú potenciál zvyšovať QT interval a/alebo u pacientov s existujúcimi rizikovými faktormi (bradykardia, predĺžený kongenitálny QT interval, elektrolytová nerovnováha (pozri časti 4.8 a 5.3)).
Pacienti s hemofíliou
U pacientov s hemofíliou typu A a B liečených inhibítormi proteáz sa vyskytli prípady zvýšeného krvácania vrátane spontánnych kožných hematómov a hemartróz. Niektorým pacientom bol dodatočne
podávaný faktor VIII. U viac ako polovice hlásených prípadov, liečba inhibítormi proteáz naďalej pokračovala alebo sa znovu obnovila, ak bola predtým prerušená. Predpokladá sa kauzálny vzťah, aj
keď spôsob účinku nie je známy. Pacienti s hemofíliou sa majú preto upozorniť na zvýšenú možnosť krvácania.
Telesnáhmotnosťametabolicképarametre
Počas antiretrovírusovej liečby môže dôjsť k zvýšeniu telesnej hmotnosti a hladín lipidov a glukózy
v krvi. Takéto zmeny môžu čiastočne súvisieť s kontrolou ochorenia a životným štýlom. Pokiaľ ide
o lipidy, v niektorých prípadoch sú dôkazy o vplyve liečby, kým pri prírastku telesnej hmotnosti nie sú silné dôkazy o tom, že súvisí s niektorou konkrétnou liečbou. Pri monitorovaní hladín lipidov
a glukózy v krvi sa treba riadiť zavedenými odporúčaniami na liečbu infekcie HIV. Poruchy
metabolizmu lipidov majú byť klinicky vhodne liečené.
V klinických štúdiách, REYATAZ (s alebo bez ritonaviru) preukázal indukciu dyslipidémie nižšieho rozsahu v porovnaní s komparátormi.
Hyperbilirubinémia
U pacientov užívajúcich REYATAZ sa vyskytli prípady reverzibilného zvýšenia nepriameho
(nekonjugovaného) bilirubínu súvisiaceho s inhibíciou UDP-glukuronyltransferázy (UGT)
(pozri časť 4.8). Odlišné etiológie sa majú posúdiť v prípadoch zvýšenia hepatálnej transaminázy, ktorá sa vyskytne spolu so zvýšenou hladinou bilirubínu u pacientov liečených REYATAZOM. Ak je
žltačka alebo sklérový ikterus neakceptovateľná pacientom, je možné namiesto REYATAZU zvážiť alternatívnu antiretrovírusovú terapiu. Zníženie dávky atazanaviru sa neodporúča, pretože môže
spôsobiť stratu terapeutického účinku a vývoj rezistencie.
Indinavir je tiež spojený s nepriamou (nekonjugovanou) hyperbilirubinémiou vzhľadom na inhibíciu UGT. Kombinácia REYATAZU s indinavirom sa neskúmala a súbežné podávanie týchto liekov sa neodporúča (pozri časť 4.5).
C
holelitiáza
U pacientov, ktorí dostávali REYATAZ sa hlásila cholelitiáza (pozri časť 4.8). U niektorých pacientov bola potrebná hospitalizácia z dôvodu ďalšej liečby a niektorí mali komplikácie. Ak sa vyskytnú prejavy alebo symptómy cholelitiázy, možno zvážiť dočasné prerušenie alebo ukončenie liečby.
Nefrolitiáza
U pacientov, ktorí dostávali REYATAZ sa hlásila nefrolitiáza (pozri časť 4.8). U niektorých pacientov bola potrebná hospitalizácia z dôvodu ďalšej liečby a niektorí mali komplikácie. V niektorých
prípadoch sa nefrolitiáza spájala s akútnym zlyhaním obličiek alebo insuficienciou obličiek. Ak sa vyskytnú prejavy alebo symptómy nefrolitiázy, možno zvážiť dočasné prerušenie alebo ukončenie
liečby.
Syndrómimunitnejreaktivácie
U HIV-infikovaných pacientov s ťažkou imunodeficienciou môže v čase začatia kombinovanej antiretrovírusovej terapie (Combination Antiretroviral Therapy, CART) vzniknúť zápalová reakcia na asymptomatické alebo reziduálne oportúnne patogény a spôsobiť závažné klinické stavy alebo zhoršenie symptómov. Takéto reakcie sú pozorované počas prvých niekoľkých týždňov alebo mesiacov po začatí CART. Relevantnými príkladmi sú cytomegalovírusová retinitída, generalizované a/alebo fokálne mykobakteriálne infekcie a pneumónia spôsobená Pneumocystis carinii. Akékoľvek zápalové symptómy sa majú zhodnotiť a v prípade potreby sa má začať liečba.
Boli tiež zaznamenané aj poruchy imunitného systému (ako je Gravesova choroba) objavujúce sa v dôsledku imunitnej reaktivácie; avšak zaznamenaný čas do ich nástupu je rôznorodejší a tieto udalosti sa môžu vyskytnúť mnoho mesiacov po začatí liečby.
Osteonekróza
Aj keď sa etiológia považuje za mnohofaktorovú (vrátane používania kortikosteroidov, konzumácie alkoholu, ťažkej imunosupresie, vyššieho indexu telesnej hmotnosti), boli hlásené prípady osteonekrózy, najmä u pacientov s pokročilým HIV ochorením a/alebo dlhodobou expozíciou kombinovanej antiretrovírusovej terapii (CART). Pacientom sa má odporučiť, aby vyhľadali lekársku pomoc, ak budú mať bolesť kĺbov, stuhnutosť kĺbov alebo ťažkosti s pohybom.
Vyrážkaasúvisiacesyndrómy
Vyrážky sú zvyčajne mierne až stredne závažné makulopapulárne kožné výsevy, ktoré sa objavia počas prvých 3 týždňov od začiatku liečby REYATAZOM.
Stevensov-Johnsonov syndróm (SJS), multiformný erytém, toxické kožné výsevy a lieková vyrážka s eozinofíliou a príznakmi systémového syndrómu (DRESS) boli hlásené u pacientov liečených REYATAZOM. Pacienti majú byť upozornení na prejavy a príznaky a starostlivo sledovaní na kožné reakcie. Liečba REYATAZOM sa má ukončiť, ak sa objaví ťažká vyrážka.
Najlepšie výsledky pri manažovaní týchto udalostí vychádzajú z včasnej diagnostiky a okamžitého prerušenia podávania akýkoľvek podozrivých liekov. Ak sa u pacienta v súvislosti s užívaním REYATAZU objaví SJS alebo DRESS, liečba REYATAZOM sa nesmie opakovane podať.
Interakciesinýmiliekmi
Kombinácia REYATAZU s atorvastatínom sa neodporúča (pozri časť 4.5).
Súbežné podávanie REYATAZU s nevirapínom alebo efavirenzom sa neodporúča (pozri časť 4.5). Ak sa vyžaduje súbežné podávanie REYATAZU s NNRTI, je potrebné zvážiť zvýšenie dávky REYATAZU na 400 mg a ritonaviru na 200 mg v kombinácii s efavirenzom spolu so starostlivým klinickým sledovaním.
Atazanavir sa metabolizuje najmä prostredníctvom CYP3A4. Súbežné podávanie REYATAZU
a liekmi, ktoré indukujú CYP3A4, sa neodporúča (pozri časti 4.3 a 4.5).
PDE5 inhibítory používané na liečbu erektilnej dysfunkcie: mimoriadna opatrnosť je potrebná pri predpisovaní PDE5 inhibítorov (sildenafil, tadalafil alebo vardenafil) na liečbu erektilnej dysfunkcie
u pacientov užívajúcich REYATAZ so súbežne podávanou nízkou dávkou ritonaviru. Predpokladá sa, že súbežné podávanie REYATAZU s týmito liekmi významne zvýši ich koncentrácie, čo môže viesť
k nežiaducim reakciám spojeným s PDE5 inhibítormi, ako je hypotenzia, vizuálne zmeny a priapizmus
(pozri časť 4.5).
Súbežné podávanie vorikonazolu a REYATAZU s ritonavirom sa neodporúča, pokiaľ zhodnotenie prínosu/rizika neodôvodňuje použitie vorikonazolu.
U väčšiny pacientov sa očakáva zníženie expozícií vorikonazolu aj atazanaviru. U malého počtu pacientov bez funkčnej alely pre CYP2C19 sa očakávajú významne zvýšené expozície vorikonazolu (pozri časť 4.5).
Súbežné použitie REYATAZU/ritonaviru a flutikazónu alebo iných glukokortikoidov, ktoré sú metabolizované CYP3A4 sa neodporúča, pokiaľ potenciálny prínos liečby neprevýši riziko systémových účinkov kortikosteroidov, vrátane Cushingovho syndrómu a supresie nadobličiek (pozri časť 4.5).
Súbežné použitie salmeterolu a REYATAZU/ritonaviru môže viesť k zvýšeniu kardiovaskulárnych nežiaducich udalostí spojených so salmeterolom. Súbežné podávanie salmeterolu a REYATAZU sa neodporúča (pozri časť 4.5).
Absorpcia atazanaviru sa môže znížiť v prípadoch, keď sa žalúdočné pH zvýši bez ohľadu na príčinu. Súbežné podávanie REYATAZU s inhibítormi protónovej pumpy sa neodporúča (pozri časť 4.5). Ak
je kombinácia REYATAZU s inhibítormi protónovej pumpy nevyhnutná, odporúča sa starostlivé
klinické sledovanie kombinácie so zvýšenou dávkou REYATAZU na 400 mg so 100 mg ritonaviru, dávky inhibítorov protónovej pumpy porovnateľné s 20 mg omeprazolu sa nemajú prekročiť.
Súbežné podávanie REYATAZU s inými hormonálnymi kontraceptívami alebo perorálnymi kontraceptívami, obsahujúcimi iné progestogény ako norgestimát alebo noretindrón, sa neskúmalo, a preto je potrebné sa mu vyhnúť (pozri časť 4.5).
Pediatrickápopulácia
Bezpečnosť
Asymptomatický predĺžený PR interval sa vyskytol častejšie u pediatrických pacientov ako
u dospelých. Asymptomatická AV blokáda prvého a druhého stupňa bola hlásená u pediatrických pacientov (pozri časť 4.8). Lieky, o ktorých je známe, že spôsobujú predĺženie PR, majú byť používané s opatrnosťou. U pediatrických pacientov s preexistujúcimi problémami vodivosti (druhý a vyšší stupeň átrioventrikulárnej blokády alebo komplexná blokáda ramienkového zväzku) má byť REYATAZ používaný s opatrnosťou a iba vtedy, ak prínos prevyšuje riziko. Monitorovanie srdca sa odporúča na základe prítomných klinických výsledkov (napr. bradykardia).
Účinnosť
Atazanavir/ritonavir nie je účinný na vírusové kmene, ktoré nesú početné mutácie rezistencie.
Pomocnélátky
Fenylketonúria
REYATAZ perorálny prášok obsahuje aspartám ako sladidlo. Aspartám poskytuje zdroj fenylalanínu, a preto môže byť škodlivý pre ľudí s fenylketonúriou.
Diabetická populácia
REYATAZ perorálny prášok obsahuje 1 305,15 mg sacharózy vo vrecku. V odporúčanom dávkovaní pre deti obsahuje REYATAZ perorálny prášok 3 915,45 mg sacharózy v 150 mg atazanaviru,
5 220,60 mg sacharózy v 200 mg atazanaviru, 6 525,75 mg sacharózy v 250 mg atazanaviru a
7 830,90 mg sacharózy v 300 mg atazanaviru. Je potrebné to zohľadniť u pacientov s diabetes mellitus. Pacienti so zriedkavými dedičnými problémami intolerancie fruktózy, glukózo-galaktózovej malabsorpcie alebo deficitu sacharázy a izomaltázy nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Pri súbežnom podávaní REYATAZU s ritonavirom je profil metabolických liekových interakcií pre ritonavir určujúci, pretože ritonavir je silnejším CYP3A4 inhibítorom než atazanavir. Je nevyhnutné konzultovať súhrn charakteristických vlastností pre ritonavir pred začatím liečby REYATAZOM
s ritonavirom.
Atazanavir sa metabolizuje v pečeni prostredníctvom CYP3A4. Tým inhibuje CYP3A4. Preto je
REYATAZ s ritonavirom kontraindikovaný pri podávaní s liekmi, ktoré sú substrátmi CYP3A4
a majú úzky terapeutický index: astemizol, terfenadín, cisaprid, pimozid, chinidín, bepridil, triazolam, perorálne podávaný midazolam a námeľové alkaloidy, hlavne ergotamín a dihydroergotamín
(pozri časť 4.3).
Iné interakcie
Interakcie medzi atazanavirom/ritonavirom a inhibítormi proteáz, antiretrovírusovými liečivami inými ako inhibítory proteáz a inými neantiretrovírusovými liekmi sú uvedené v tabuľke nižšie (zvýšenie je
uvedené ako “↑”, zníženie ako “↓”, bez zmeny ako “↔”). V prípade dostupnosti sú v zátvorke uvedené 90 % intervaly spoľahlivosti (IS). Štúdie uvedené v tabuľke 2 boli vykonané so zdravými
dobrovoľníkmi, pokiaľ nie je uvedené inak. Je dôležité poznamenať, že mnohé štúdie boli vykonané
s atazanavirom bez zosilnenia jeho účinku, čo nie je schválený režim pre atazanavir (pozri časť 4.4).
Tabuľka 2: Interakcie medzi REYATAZOM a inými liekmi
L
i
eky podľa terapeutickej
oblasti
Interakcie Odporúčania týkajúce sa
s
úbežného podávania
ANT
IRETROVÍRUSOVÉ LIEKY
P
roteázové inhibítory: Súbežné podávanie REYATAZU/ritonaviru a iných inhibítorov proteáz sa neskúmalo, ale dá sa očakávať zvýšenie expozície na iné inhibítory proteáz. Preto sa súbežné podávanie neodporúča.
R
it
onavir 100 mg raz denne
(atazanavir 300 mg raz denne)
Štúdie vykonané s HIV
infikovanými pacientmi.
Atazanavir AUC: ↑250 % (↑144 %
↑403 %)*
Atazanavir Cmax: ↑120 % (↑56 %
↑211 %)*
Atazanavir Cmin: ↑713 % (↑359 %
↑1 339 %)*
Ritonavir 100 mg raz denne sa používa na zosilnenie farmakokinetiky atazanaviru.
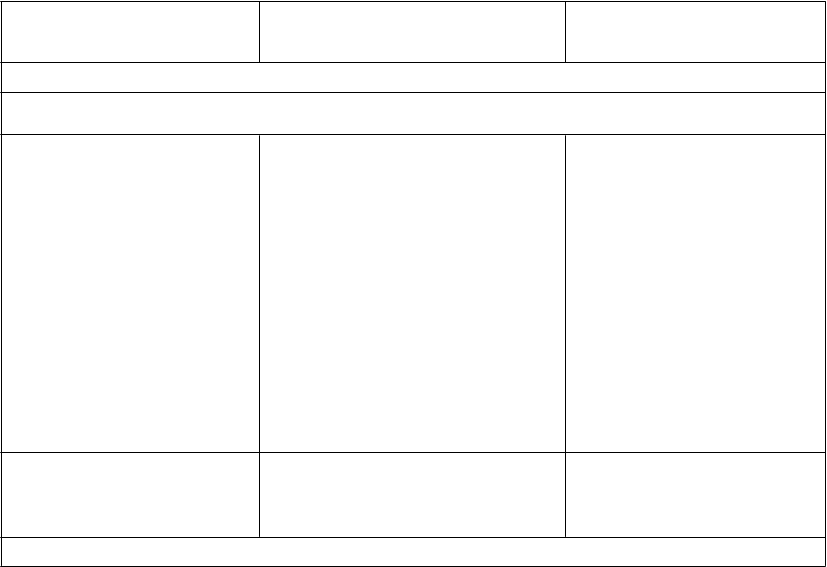
* V kombinovaných analýzach sa
atazanavir v dávke 300 mg a ritonavir
v dávke 100 mg (n=33) porovnával
s atazanavirom v dávke 400 mg bez ritonaviru (n=28).
Mechanizmus interakcie medzi atazanavirom a ritonavirom je
CYP3A4 inhibícia.
Indinavir Indinavir sa spája s nepriamou nekonjugovanou hyperbilirubinémiou vplyvom inhibície UGT.
Nukleozidové/nukleotidové inhibítory reverznej transkriptázy (NRTI)Súbežné podávanie
REYATAZU/ritonaviru
a indinaviru sa neodporúča
(pozri časť 4.4).
L
amivudín 150 mg dvakrát denne + zidovudín 300 mg dvakrát denne
(atazanavir 400 mg raz denne)
Nepozoroval sa signifikantný účinok na koncentrácie lamivudínu
a zidovudínu.
Na základe týchto údajov
a z dôvodu, že sa u ritonaviru neočakáva významný vplyv na
farmakokinetiku NRTI, sa pri súbežnom podávaní
REYATAZU/ritonaviru s týmito liekmi neočakáva signifikantná
zmena expozície súbežne podávaných liekov.
A
bakavir Pri súbežnom podávaní REYATAZU/ ritonaviru s abakavirom sa neočakáva siginifikantná zmena expozície abakaviru.
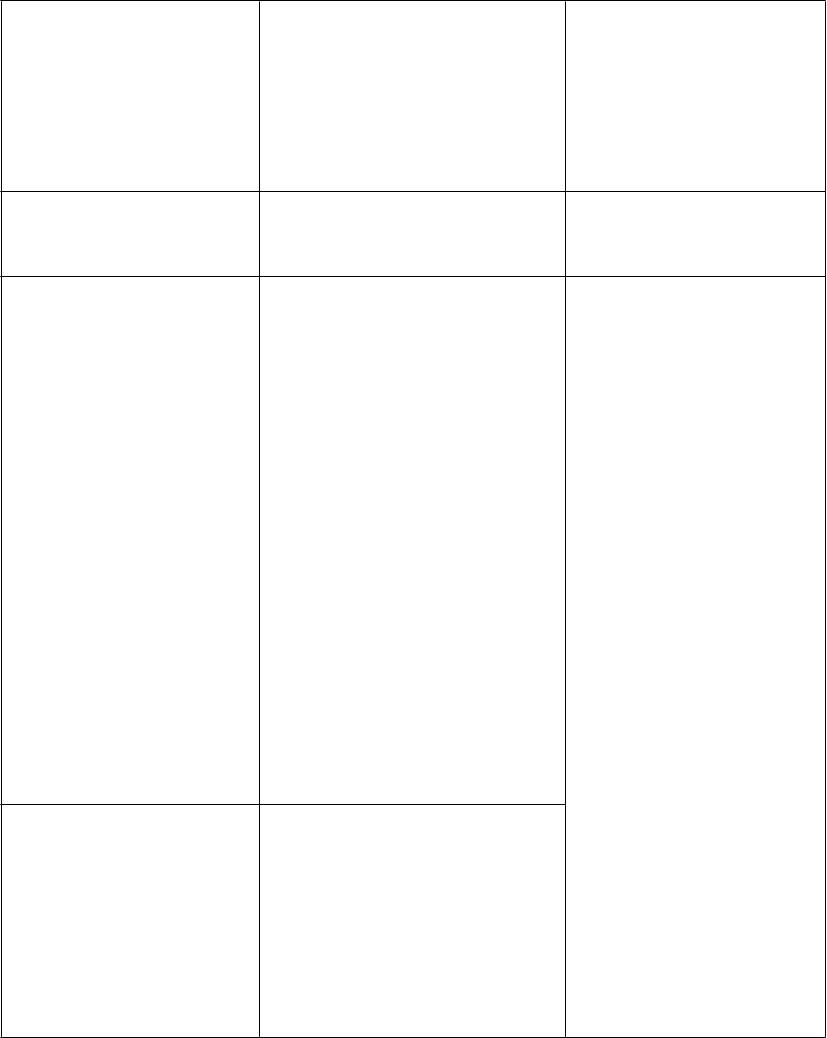 D
i
danozín (pufrované tablety)
200 mg/stavudín 40 mg,
obidva ako jednorazová dávka
D
i
danozín (pufrované tablety)
200 mg/stavudín 40 mg,
obidva ako jednorazová dávka (atazanavir 400 mg jednorazová dávka)
Didanozín (gastrorezistentné kapsuly) 400 mg jednorazová dávka(atazanavir 300 mg raz denne
s ritonavirom 100 mg raz denne)
Atazanavir, súbežne podávaný
s ddI+d4T (nalačno)
Atazanavir AUC ↓87 % (↓92 %
↓79 %)
Atazanavir Cmax ↓89 % (↓94 % ↓82 %)
Atazanavir Cmin ↓84 % (↓90 % ↓73 %)
Atazanavir, podávaný 1 hodinu po ddI+d4T (nalačno)
Atazanavir AUC ↔3 % (↓36 %
↑67 %)
Atazanavir Cmax ↑12 % (↓33 % ↑18 %)
Atazanavir Cmin ↔3 % (↓39 % ↑73 %)
Koncentrácie atazanaviru boli značne znížené, keď sa podával súbežne
s didanozínom (pufrované tablety)
a stavudínom. Mechanizmus interakcie je v redukovaní solubility atazanaviru
so zvýšením pH vo vzťahu
k prítomnosti antacíd v pufrovaných tabletách didanozínu.
Nepozoroval sa signifikantný účinok
na koncentrácie didanozínu
a stavudínu.
Didanozín (s jedlom)
Didanozín AUC ↓34 % (↓41 % ↓27 %) Didanozín Cmax ↓38 % (↓48 % ↓26 %) Didanozín Cmin ↑25 % (↓8 % ↑69 %)
Nepozoroval sa signifikantný účinok na koncentrácie atazanaviru, keď sa podával s didanozínom vo forme gastrorezistentných kapsúl, ale podávanie s jedlom znížilo koncentrácie didanozínu.
Didanozín sa má podávať nalačno 2 hodiny po podaní REYATAZU/ritonaviru užitých s jedlom. Pri súbežnom podávaní REYATAZU/ritonaviru so stavudínom sa neočakáva signifikantná zmena expozície stavudínu.
T
enofovir-dizoproxilfumarát
300 mg raz denne
(atazanavir 300 mg raz denne
s ritonavirom 100 mg raz denne)
Štúdie vykonané s HIV
infikovanými pacientmi
Atazanavir AUC ↓22 % (↓35 % ↓6 %)
*
Atazanavir Cmax ↓16 % (↓30 % ↔0 %)
*
Atazanavir Cmin ↓23 % (↓43 % ↑2 %) *
* V kombinovaných analýzach
z niekoľkých klinických štúdií bol atazanavir/ritonavir 300/100 mg súbežne podávaný s tenofovir- dizoproxilfumarátom v dávke 300 mg (n=39) porovnávaný
s atazanavirom/ritonavirom v dávke
300/100 mg (n=33).
T
enofovir-dizoproxilfumarát
300 mg raz denne
(atazanavir 300 mg raz denne
s ritonavirom 100 mg raz denne)
Účinnosť REYATAZU/ritonaviru
v kombinácii s tenofovirom-
dizoproxilfumarátom u pacientov po predchádzajúcej liečbe bola demonštrovaná v klinickej štúdii 045 a v liečbe pacientov bez predchádzajúcej liečby v klinickej štúdii 138 (pozri časti 4.8 a 5.1). Mechanizmus interakcie medzi atazanavirom a tenofovirom- dizoproxilfumarátom nie je známy. Tenofovir-dizoproxilfumarát AUC
↑37 % (↑30 % ↑45 %)
Tenofovir-dizoproxilfumarát Cmax
↑34 % (↑20 % ↑51 %)
Tenofovir-dizoproxilfumarát Cmin
↑29 % (↑21 % ↑36 %)
Pacienti majú byť starostlivo sleodvaní na nežiaduce reakcie súvisiace s tenofovirom vrátane renálnych ochorení.
N
enukleozidové inhibítory reverznej transkriptázy (NNRTI)
 E
f
a
virenz 600 mg raz denne
E
f
a
virenz 600 mg raz denne
(atazanavir 400 mg raz denne
s ritonavirom 100 mg raz denne)
Atazanavir (popoludní): všetky podania s jedlom
Atazanavir AUC ↔0 %(↓9 % ↑10 %)*
Atazanavir Cmax ↑17 %(↑8 % ↑27 %)*
Atazanavir Cmin ↓42 %(↓51 % ↓31 %)*
Súbežné podávanie efavirenzu a REYATAZU/ritonaviru sa neodporúča (pozri časť 4.4).
 E
f
a
virenz 600 mg raz denne
E
f
a
virenz 600 mg raz denne
(atazanavir 400 mg raz denne
s ritonavirom 200 mg raz denne)
Nevirapín 200 mg dvakrát denne(atazanavir 400 mg raz denne
s ritonavirom 100 mg raz denne)
Štúdia vykonaná s HIV
infikovanými pacientmi
Inhibítory integrázyRaltegravir 400 mg dvakrát denne(atazanavir/ritonavir)
HCV proteázové inhibítoryAtazanavir (popoludní): všetky podania s jedlom
Atazanavir AUC ↔6 % (↓10 %
↑26 %) */**
Atazanavir Cmax ↔9 % (↓5 % ↑26 %)
*/**
Atazanavir Cmin ↔12 % (↓16 %
↑49 %) */**
* Keď je porovnávaný
s REYATAZOM 300 mg/ritonavirom
100 mg raz denne večer bez efavirenzu. Zníženie Cmin atazanaviru môže mať negatívny vplyv na účinnosť atazanaviru. Mechanizmus interakcie efavirenzu/atazanaviru je CYP3A4 indukcia.
** Založené na historickom porovnávaní.
Nevirapín AUC ↑26 % (↑17 % ↑36 %) Nevirapín Cmax ↑21 % (↑11 % ↑32 %) Nevirapín Cmin ↑35 % (↑25 % ↑47 %)
Atazanavir AUC ↓19 % (↓35 % ↑2 %)
*
Atazanavir Cmax ↔2 % (↓15 % ↑24 %)
*
Atazanavir Cmin ↓59 % (↓73 % ↓40 %)
*
* Keď je porovnávaný
s REYATAZOM v dávke 300 mg a ritonavirom v dávke 100 mg bez
nevirapínu. Zníženie Cmin atazanaviru
môže mať negatívny vplyv na
účinnosť atazanaviru. Mechanizmus interakcií nevirapínu/atazanaviru je CYP3A4 indukcia.
Raltegravir AUC ↑41 % Raltegravir Cmax ↑24 % Raltegravir C12hr ↑77 %
Mechanizmom je UGT1A1 inhibícia.
Súbežné podávanie nevirapínu a REYATAZU/ritonaviru sa neodporúča (pozri časť 4.4).
Nie je potrebná úprava dávkovania raltegraviru.
B
oceprevir 800 mg trikrát denne
(atazanavir 300 mg/ritonavir
100 mg jedenkrát denne)
boceprevir AUC ↔5 % boceprevir Cmax ↔7 % boceprevir Cmin ↔18 %
atazanavir AUC ↓ 35 % atazanavir Cmax ↓ 25 % atazanavir Cmin ↓ 49 %
ritonavir AUC ↓ 36 % ritonavir Cmax ↓ 27 % ritonavir Cmin ↓ 45 %
Následkom súbežného
podávania atazanaviru/ritonaviru s boceprevirom je znížená
expozícia atazanaviru, ktorá môže byť spojená s nižšou
účinnosťou a stratou kontroly nad HIV. Toto súbežné
podávanie môže byť zvážené prípad od prípadu, ak je to nevyhnutné, u pacientov s
potlačenou záťažou HIV a s vírusovým kmeňom HIV bez
akéhokoľvek podozrenia na rezistenciu liečby HIV. Je potrebné zabezpečiť zvýšené
klinické a laboratórne sledovanie pre HIV supresiu.
ANT
IBIOTIKÁ
Kl
a
ritromycín 500 mg dvakrát denne
(atazanavir 400 mg raz denne)
FUNGICÍDNE LÁTKY Ketokonazol 200 mg raz
denne
(atazanavir 400 mg raz denne)
Klaritromycín AUC ↑94 % (↑75 %
↑116 %)
Klaritromycín Cmax ↑50 % (↑32 %
↑71 %)
Klaritromycín Cmin ↑160 % (↑135 %
↑188 %)
14-OH klaritromycín
14-OH klaritromycín AUC ↓70 %
(↓74 % ↓66 %)
14-OH klaritromycín Cmax ↓72 %
(↓76 % ↓67 %)
14-OH klaritromycín Cmin ↓62 %
(↓66 % ↓58 %)
Atazanavir AUC ↑28 % (↑16 %
↑43 %)
Atazanavir Cmax ↔6 % (↓7 % ↑20 %)
Atazanavir Cmin ↑91 % (↑66 %
↑121 %)
Redukcia dávky klaritromycínu môže viesť k subterapeutickým koncentráciám 14-OH klaritromycínu. Mechanizmus interakcie klaritromycínu/atazanaviru je CYP3A4 inhibícia.
Nepozoroval sa žiaden signifikantný účinok na koncentrácie atazanaviru.
Nie je možné urobiť žiadne odporúčania týkajúce sa redukcie dávky; opatrnosť je preto potrebná, ak sa REYATAZ/ritonavir podáva súbežne s klaritromycínom.
Ketokonazol a itrakonazol sa majú
s REYATAZOM/ritonavirom
 Itrakonazol
Itrakonazol Itrakonazol, podobne aj ketokonazol, je silným inhibítorom ako aj substrátom CYP3A4.
používať opatrne, vysoké dávky ketokonazolu a itrakonazolu (>200 mg/deň) sa neodporúčajú.
V
orikonazol 200 mg dvakrát denne (atazanavir
300 mg/ritonavir 100 mg
jedenkrát denne)
Jedinci s minimálne jednou funkčnou alelou pre CYP2C19.
Vorikonazol 50 mg dvakrát denne (atazanavir
300 mg/ritonavir 100 mg
jedenkrát denne)
Jedinci bez funkčnej alely pre
CYP2C19.
Flukonazol 200 mg raz denne
(atazanavir 300 mg a ritonavir
100 mg raz denne)
Vychádzajúc z údajov získaných z iných inhibítorov proteáz so zosilneným účinkom a ketokonazolu, v ktorých bola AUC ketokonazolu 3- násobne vyššia, sa pri REYATAZE/ritonavire očakáva zvýšenie koncentrácií ketokonazolu alebo itrakonazolu.
Vorikonazol AUC ↓33 % (↓42 %
↓22 %)
Vorikonazol Cmax ↓10 % (↓22 % ↓4 %) Vorikonazol Cmin ↓39 % (↓49 %
↓28 %)
Atazanavir AUC ↓12 % (↓18 % ↓5 %) Atazanavir Cmax ↓13 % (↓20 % ↓4 %) Atazanavir Cmin ↓ 20 % (↓28 % ↓
10 %)
Ritonavir AUC ↓12 % (↓17 % ↓7 %) Ritonavir Cmax ↓9 % (↓17 % ↔0 %) Ritonavir Cmin ↓25 % (↓35 % ↓14 %)
U väčšiny pacientov s minimálne jednou funkčnou alelou pre CYP2C19 sa očakáva zníženie expozícií vorikonazolu aj atazanaviru.
Vorikonazol AUC ↑561 % (↑451 % ↑
↑699 %)
Vorikonazol Cmax ↑438 % (↑355 %
↑539 %)
Vorikonazol Cmin ↑765 % (↑571 %
↑1 020 %)
Atazanavir AUC ↓20 % (↓35 % ↓3 %)
Atazanavir Cmax ↓19 % (↓34 %
↔0,2 %)
Atazanavir Cmin ↓ 31 % (↓46 % ↓
13 %)
Ritonavir AUC ↓11 % (↓20 % ↓1 %) Ritonavir Cmax ↓11 % (↓24 % ↑4 %) Ritonavir Cmin ↓19 % (↓35 % ↑1 %)
U malého počtu pacientov bez funkčnej alely pre CYP2C19 sa očakávajú významne zvýšené expozície vorikonazolu. Koncentrácie atazanaviru
a flukonazolu neboli signifikantne ovplyvnené, keď sa REYATAZ/ritonavir podával súbežne
s flukonazolom.
Súbežné podávanie vorikonazolu
a REYATAZU/ritonaviru sa
neodporúča, pokiaľ použitie vorikonazolu u pacientov nie je
opodstatnené pomerom
prínosu/rizika (pozri časť 4.4).
V čase, keď sa vyžaduje liečba vorikonazolom sa má, ak je to možné, zistiť CYP2C19 genotyp pacienta.
Preto, ak je kombinácia nevyhnutná, majú sa vykonať nasledovné odporúčania
v súlade so stavom CYP2C19:
- u pacientov s minimálne jednou funkčnou alelou pre CYP2C19 sa odporúča dôkladné klinické sledovanie straty účinnosti vorikonazolu (klinické znaky) aj atazanaviru (virologická odpoveď).
- u pacientov bez funkčnej alely pre CYP2C19 sa odporúča dôkladné klinické a laboratórne sledovanie výskytu nežiaducich udalostí spojených
s vorikonazolom.
Ak nie je možné zistiť genotyp, má sa vykonať celkový monitoring bezpečnosti
a účinnosti.
Nie sú potrebné úpravy dávkovania REYATAZU/ritonaviru a flukonazolu.
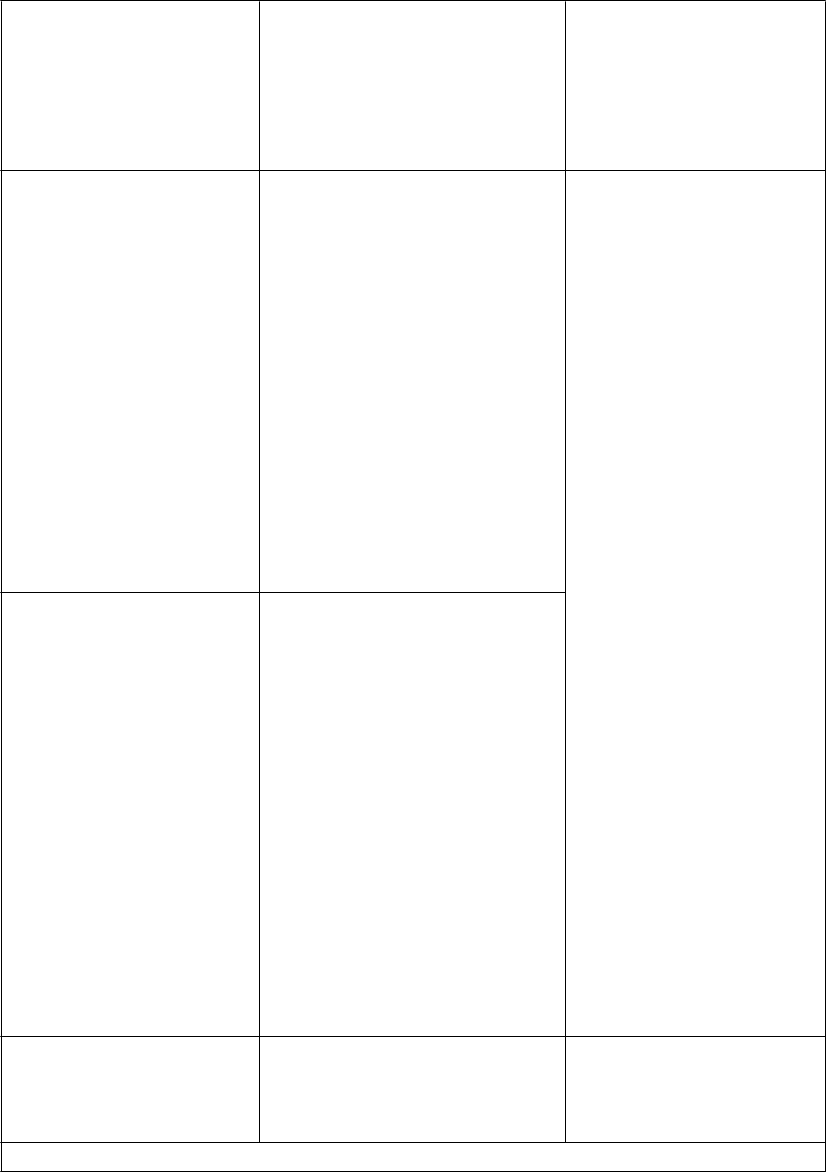 ANT
IMYKOBAKTERIÁLNE LÁTKY
ANT
IMYKOBAKTERIÁLNE LÁTKY
Ri
f
abutín 150 mg dvakrát
t
ýždenne
(atazanavir 300 mg a ritonavir
100 mg raz denne)
Rifabutín AUC ↑48 % (↑19 % ↑84 %)
**
Rifabutín Cmax ↑149 % (↑103 %
↑206 %) **
Rifabutín Cmin ↑40 % (↑5 % ↑87 %) **
25-O-desacetyl-rifabutín AUC ↑990 %
(↑714 % ↑1 361 %) **
25-O-desacetyl-rifabutín Cmax ↑677 %
(↑513 % ↑883 %) **
25-O-desacetyl-rifabutín Cmin
↑1 045 % (↑715 % ↑1 510 %) **
** Keď je porovnávaný so samotným rifabutínom 150 mg raz denne. Celková AUC rifabutínu a 25-O- desacetyl-rifabutínu ↑119 % (↑78 %
↑169 %).
Farmokokinetika atazanaviru
v predchádzajúcich štúdiách nebola rifabutínom pozmenená.
Ak sa podáva
s REYATAZOM/ritonavirom, odporúčaná dávka rifabutínu je
150 mg 3-krát týždenne
v stanovených dňoch (napríklad
pondelok-streda-piatok). Zvýšené sledovanie treba zabezpečiť pre nežiaduce reakcie spojené s rifabutínom, vrátane neutropénie a uveitídy kvôli očakávanému zvýšeniu expozície rifabutínu. Okrem toho, zníženie dávky rifabutínu na 150 mg dvakrát týždenne
v stanovených dňoch je odporučené pre pacientov, ktorí
netolerujú dávku 150 mg 3-krát
týždenne. Má sa zohľadniť, že dávkovanie 150 mg dvakrát týždenne nemôže poskytnúť optimálnu expozíciu rifabutínu, takto vedie k riziku rifamycínovej rezistencie
a zlyhaniu liečby. Nie je potrebná úprava dávky
REYATAZU/ritonaviru.
Ri
f
a
m
picín Rifampicín je silný CYP3A4 induktor, ktorý zapríčiňuje 72 % zníženie AUC atazanaviru, ktoré môže viesť
k virologickému zlyhaniu a vývoju rezistencie. Vyskytla sa vysoká frekvencia pečeňových reakcií počas pokusov prekonať zníženú expozíciu zvýšením dávky REYATAZU alebo iných proteázových inhibítorov
s ritonavirom.
Kombinácia rifampicínu
a REYATAZU so súbežne podávanou nízkou dávkou ritonaviru je kontraindikovaná (pozri časť 4.3).
ANT
IPSYCHOTIKÁ
K
vetiapín V dôsledku inhibície CYP3A4
REYATAZOM sa očakáva zvýšenie
koncentrácií kvetiapínu.
LÁTKY REDUKUJÚCE ŽALÚDOČNÚ KYSELINU
Antagonisty H2-receptorov
Bez tenofoviru
U HIV infikovaných pacientov s atazanavirom/ritonavirom pri odporúčanej dávke 300/100 mg raz denne
Súbežné podávanie kvetiapínu a REYATAZU/ritonaviru s kvetiapínom je kontraindikované, pretože
REYATAZ môže zvýšiť toxicitu týkajúcu sa kvetiapínu. Zvýšené
plazmatické koncentrácie
kvetiapínu môžu viesť ku kóme
(pozri časť 4.3).
U pacientov, ktorí neužívajú tenofovir, ak sú REYATAZ
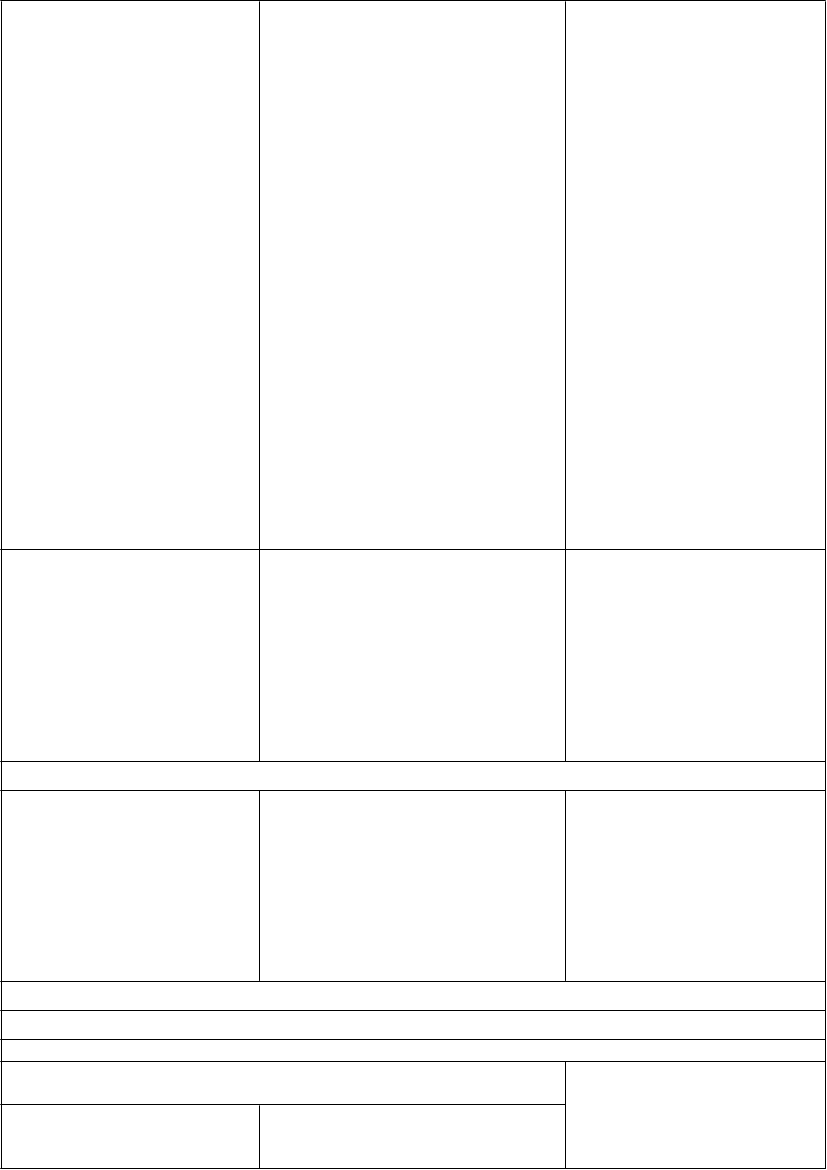 F
a
m
otidín 20 mg dvakrát denne
F
a
m
otidín 20 mg dvakrát denne
Atazanavir AUC ↓18 % (↓25 % ↑1 %) Atazanavir Cmax ↓20 % (↓32 % ↓7 %) Atazanavir Cmin ↔1 % (↓16 % ↑18 %)
300 mg/ritonavir 100 mg
a antagonisty H2-receptorov podávané súbežne, nemá byť
F
a
m
otidín 40 mg dvakrát denne
Atazanavir AUC ↓23 % (↓32 %
↓14 %)
Atazanavir Cmax ↓23 % (↓33 % ↓12 %)
Atazanavir Cmin ↓20 % (↓31 % ↓8 %)
prekročená dávka zodpovedajúca famotidínu
20 mg dvakrát denne. Ak je
potrebné podať vyššiu dávku
U zdravých dobrovoľníkov s atazanavirom/ritonavirom pri zvýšenej dávke 400/100 mg raz denne
antagonistu H2-receptora (napr. famotidín 40 mg dvakrát denne
F
a
m
otidín 40 mg dvakrát denne
S tenofovirom 300 mg raz denne
Atazanavir AUC ↔3 % (↓14 %
↑22 %)
Atazanavir Cmax ↔2 % (↓13 % ↑8 %)
Atazanavir Cmin ↓14 % (↓32 % ↑8 %)
alebo iný ekvivalent), je možné
zvážiť zvýšenie dávky
REYATAZU/ritonaviru
z 300/100 mg na 400/100 mg.
U HIV infikovaných pacientov s atazanavirom/ritonavirom pri odporúčanej dávke 300/100 mg raz denne
U pacientov, ktorí užívajú tenofovir, ak je
F
a
m
otidín 20 mg dvakrát denne
F
a
m
otidín 40 mg dvakrát denne
Atazanavir AUC ↓21 % (↓34 % ↓4 %)
*
Atazanavir Cmax ↓21 % (↓36 % ↓4 %)
*
Atazanavir Cmin ↓19 % (↓37 % ↑5 %) *
Atazanavir AUC ↓24 % (↓36 %
↓11 %) *
Atazanavir Cmax ↓23 % (↓36 % ↓8 %)
*
Atazanavir Cmin ↓25 % (↓47 % ↑7 %) *
REYATAZ/ritonavir súbežne podávaný s tenofovir--
dizoproxilfumarátom
a antagonistom H2-receptoru, odporúča sa zvýšiť dávku
REYATAZU na 400 mg s
tenofovirom 100 mg. Dávka ekvivalentná 40 mg famotidínu
dvakrát denne sa nesmie
prekročiť.
U HIV infikovaných pacientov s atazanavirom/ritonavirom pri zvýšenej
dávke 400/100 mg raz denne
F
a
m
otidín 20 mg dvakrát denne
Atazanavir AUC ↑18 % (↑6,5 %
↑30 %)*
Atazanavir Cmax ↑18 % (↑6,7 %
↑31 %)*
Atazanavir Cmin ↑24 % (↑10 %
↑39 %)*
F
a
m
otidín 40 mg dvakrát
denne
Atazanavir AUC ↔2,3 % (↓13 %
↑10 %)*
Atazanavir Cmax ↔5 % (↓17 %
↑8,4 %)*
Atazanavir Cmin ↔1,3 % (↓10 % ↑15)*
* V porovnaní atazanaviru 300 mg raz
denne s ritonavirom 100 mg raz denne
a tenofovir-dizoproxilfumarátom
300 mg v jednorazovej dávke podanej
s jedlom. V porovnaní atazanaviru
300 mg s ritonavirom 100 mg bez tenofoviru sa koncentrácie atazanaviru pravdepodobne dodatočne znížia približne o 20 %.
 I
nhibítory protónovej pumpy
I
nhibítory protónovej pumpy
Mechanizmus interakcie je daný
zníženou solubilitou atazanaviru, ktorá je spôsobená zvýšením intra-
žalúdočného pH prostredníctvom H2
blokátorov.
O
m
eprazol 40 mg raz denne
(atazanavir 400 mg raz denne
s ritonavirom 100 mg raz denne)
Omeprazol 20 mg raz denne
(atazanavir 400 mg raz denne
s ritonavirom 100 mg raz denne)
Antacidá
Antacidá a lieky obsahujúce
pufre
Atazanavir (dopoludnia): 2 hod. po omeprazole
Atazanavir AUC ↓61 % (↓65 %
↓55 %)
Atazanavir Cmax ↓66 % (↓62 % ↓49 %)
Atazanavir Cmin ↓65 % (↓71 % ↓59 %)
Atazanavir (dopoludnia): 1 hod. po omeprazole
Atazanavir AUC ↓30 % (↓43 % ↓14 %)
*
Atazanavir Cmax ↓31 % (↓42 % ↓17 %)
*
Atazanavir Cmin ↓31 % (↓46 % ↓12 %) *
* Keď je porovnávaný s atazanavirom
v dávke 300 mg raz denne
s ritonavirom 100 mg raz denne. Zníženie AUC, Cmax a Cmin nebolo oslabené, keď zvýšená dávka REYATAZU/ritonaviru (400/100 mg raz denne) bola prechodne oddelená od omeprazolu 12 hodinami. Aj keď nebolo skúmané, podobné výsledky sa dajú očakávať aj u iných inhibítorov protónovej pumpy. Toto zníženie expozície na atazanavir môže mať negatívny vplyv na účinnosť atazanaviru. Mechanizmus interakcie
je daný zníženou solubilitou atazanaviru, ktorá je spôsobená zvýšením intra-žalúdočného pH prostredníctvom inhibítorov protónovej pumpy.
Zníženie plazmatických koncentrácií atazanaviru môže byť následkom zvýšeného žalúdočného pH, ak sa antacidá vrátane pufrovaných liekov podávali
s REYATAZOM/ritonavirom.
Súbežné podávanie
REYATAZU/ritonaviru
a inhibítormi protónovej pumpy sa neodporúča. Ak sa
kombinácii
REYATAZU/ritonaviru
a inhibítora protónovej pumpy nedá vyhnúť, odporúča sa
starostlivé klinické sledovanie
v kombinácii so zvýšením dávky
REYATAZU na 400 mg so
100 mg ritonaviru; dávky inhibítorov protónovej pumpy
porovnateľné s 20 mg
omeprazolu sa nemajú prekročiť
(pozri časť 4.4).
REYATAZ/ritonavir sa má podávať 2 hodiny pred alebo'
1 hodinu po podaní antacíd alebo pufrovaných liekov.
ANTAG
O
N
I
STY ΑLFA 1-ADRENORECEPTOROV
Alfuzosín Možnosť zvýšených koncentrácií alfuzosínu, ktoré môžu viesť
k hypotenzii. Mechanizmus interakcie je inhibícia CYP3A4
atazanavirom/ritonavirom.
Súbežné podávanie REYATAZU/ritonaviru a alfuzosínu je kontraindikované (pozri časť 4.3).
ANT
IKOAGULANCIÁ
Warfarín Súbežné podávanie s REYATAZOM/ritonavirom má potenciál znížiť, alebo menej často zvýšiť INR (Medzinárodný normalizovaný pomer).
Počas liečby REYATAZOM/ritonavirom, najmä na začiatku liečby sa odporúča starostlivé sledovanie INR.
 ANT
IEPILEPTIKÁ
ANT
IEPILEPTIKÁ
K
arbamazepín REYATAZ/ritonavir môže zvýšiť plazmatické hladiny karbamazepínu v dôsledku inhibície CYP3A4.
Z dôvodu indukčného účinku karbamazepínu nemožno vylúčiť zníženie expozície REYATAZU/ ritonaviru.
Fenytoín, fenobarbital Ritonavir môže znížiť plazmatické hladiny fenytoínu a/alebo fenobarbitalu v dôsledku indukcie CYP2C9 a CYP2C19.
Z dôvodu indukčného účinku fenytoínu/fenobarbitalu nemožno
vylúčiť zníženie expozície
REYATAZU/ritonaviru.
Lamotrigín Súbežné podávanie lamotrigínu a REYATAZU/ritonaviru môže znížiť plazmatické koncentrácie lamotrigínu v dôsledku indukcie UGT1A4.
ANTINEOPLASTIKÁ A IMUNOSUPRESÍVA
Antineoplastiká
Irinotekán Atazanavir inhibuje UGT a môže interferovať s metabolizmom irinotekánu a tým viesť k zvýšeniu toxicity irinotekánu.
Imunosupresíva
Karbamazepín sa má
v kombinácii s REYATAZOM/
ritonavirom používať
s opatrnosťou. Ak je to potrebné, sledujte sérové koncentrácie karbamazepínu
a príslušne upravte dávku. Má sa vykonať dôsledné sledovanie
virologickej odpovede pacienta.
Fenobarbital a fenytoín sa majú v kombinácii s REYATAZOM/ritonavirom používať s opatrnosťou.
Ak sa REYATAZ/ritonavir súbežne podávajú s fenytoínom alebo fenobarbitalom, môže byť potrebná úprava dávky
fenytoínu alebo fenobarbitalu.
Má sa vykonať dôsledné sledovanie virologickej odpovede pacienta.
Lamotrigín sa má v kombinácii s REYATAZOM/ritonavirom používať s opatrnosťou.
Ak je to potrebné, monitorujte koncentrácie lamotrigínu
a príslušne upravte dávku.
Ak sa REYATAZ/ritonavir podávajú súbežne
s irinotekánom pacienti majú byť starostlivo sledovaní na
nežiaduce udalosti súvisiace
s irinotekánom.
C
yklosporín Takrolimus Sirolimus
Koncentrácie týchto imunosupresív môžu byť zvýšené, keď sa súbežne podávajú s REYATAZOM/ ritonavirom vzhľadom na CYP3A4 inhibíciu.
Odporúča sa častejšie sledovanie terapeutickej koncentrácie
týchto liekov, kým sa ustália
plazmatické hladiny.
 K
ARD
IOVASKULÁRNE LIEKY
A
ntiarytmiká
K
ARD
IOVASKULÁRNE LIEKY
A
ntiarytmiká
A
mi
odarón, systémový lidokaín, chinidín
B
l
okátory kalciových kanálov
Koncentrácie týchto antiarytmík môžu byť zvýšené, keď sa podávajú súbežne s REYATAZOM/ritonavirom. Mechanizmus interakcie amiodarónu alebo systémového lidokaínu/atazanaviru je inhibícia CYP3A. Chinidín má úzky terapeutický rozsah a je kontraindikovaný vzhľadom na potenciálnu inhibíciu CYP3A REYATAZOM/ritonavirom.
Odporúča sa opatrnosť
a sledovanie terapeutických koncentrácií, ak je to možné.
Súbežné použitie chinidínu je kontraindikované (pozri
časť 4.3).
B
epridil REYATAZ/ritonavir sa nemá používať v kombinácii s liekmi, ktoré sú substrátmi pre CYP3A4 a majú úzky terapeutický index.
Súbežné podávanie s bepridilom je kontraindikované (pozri
časť 4.3).
D
il
t
i
azem 180 mg raz denne
(atazanavir 400 mg raz denne)
Diltiazem AUC ↑125 % (↑109 %
↑141 %)
Diltiazem Cmax ↑98 % (↑78 % ↑119 %) Diltiazem Cmin ↑142 % (↑114 %
↑173 %)
Desacetyl-diltiazem AUC ↑165 %
(↑145 % ↑187 %)
Desacetyl-diltiazem Cmax ↑172 %
(↑144 % ↑203 %)
Desacetyl-diltiazem Cmin ↑121 %
(↑102 % ↑142 %)
Odporúča sa redukcia úvodnej dávky diltiazemu o 50 %
s následnou titráciou podľa potreby a sledovaním EKG.
Nepozoroval sa signifikantný účinok
na koncentrácie atazanaviru. Pozoroval sa nárast maximálneho intervalu tepovej frekvencie v porovnaní
s podávaním samotného atazanaviru. Súbežné podávanie diltiazemu
a REYATAZU/ritonaviru nebolo skúmané. Mechanizmus interakcie
diltiazemu/atazanaviru je inhibícia
CYP3A4.
Verapamil Sérové koncentrácie verapamilu môžu byť REYATAZOM/ritonavirom zvýšené vzhľadom na inhibíciu CYP3A4.
Odporúča sa opatrnosť, ak sa verapamil podáva súbežne
s REYATAZOM/ritonavirom.
 KO
RT
I
K
O
STEROIDY
KO
RT
I
K
O
STEROIDY
Flutikazónpropionát intranazálne 50 µg 4-krát denne počas 7 dní (ritonavir 100 mg kapsuly dvakrát denne)
EREKTILNÁ DYSFUNKCIA
PDE5 inhibítory
Plazmatické hladiny flutikazónpropionátu signifikantne vzrástli, zatiaľ čo hladiny vlastného kortizolu poklesli približne o 86 % (90% interval spoľahlivosti 82-89 %). Väčšie účinky sa dajú očakávať, keď je flutikazón inhalovaný. Systémové kortikosteroidové účinky vrátane Cushingovho syndrómu a adrenálnej supresie sa vyskytli u pacientov užívajúcich ritonavir, a ktorým sa inhalačne alebo intranazálne podával flutikazónpropionát; ktoré sa môžu vyskytnúť aj u iných kortikosteroidov
metabolizovaných dráhou cytochrómu
P450 3A, napr. budezonid. Účinky vysokej systémovej expozície flutikazónu na plazmatické hladiny ritonaviru ešte nie sú známe. Mechanizmus interakcie je inhibícia CYP3A4.
Súbežné podávanie REYATAZU/ritonaviru a týchto glukokortikoidov sa neodporúča, pokiaľ potenciálny prínos liečby neprevýši riziko systémových účinkov kortikosteroidov (pozri časť 4.4). Je potrebné zvážiť redukciu dávky glukokortikoidu
s dôkladným sledovaním lokálnych a systémových
účinkov alebo prejsť na glukokortikoid, ktorý nie je
substrátom pre CYP3A4 (napr. beklometazón). Navyše,
v prípade vysadenia
glukokortikoidov sa môže počas dlhšej doby postupne znižovať dávka.
Sildenafil, tadalafil, vardenafil Sildenafil, tadalafil a vardenafil sú metabolizované prostredníctvom CYP3A4. Súbežné podávanie
s REYATAZOM/ritonavirom môže viesť k zvýšeným koncentráciám
PDE5 inhibítora a k zvýšeniu
nežiaducich udalostí súvisiacich s PDE5 vrátane hypotenzie, vizuálnych zmien a priapizmu. Mechanizmus tejto interakcie je inhibícia CYP3A4.
RASTLINNÉ PRÍPRAVKY
Pacienti majú byť upozornení na tieto možné nežiaduce účinky
pri používaní PDE5 inhibítorov na erektilnú dysfunkciu
s REYATAZOM/ritonavirom
(pozri časť 4.4). Pozri tiež PĽÚCNU
ARTÉRIOVÚ HYPERTENZIU
v tejto tabuľke pre viac informácií o súbežnom podávaní
REAYATAZU/ritonaviru so
sildenafilom.
Ľ
ubovník bodkovaný
(H
y
pericum perforatum
)
Pri súbežnom použití ľubovníka bodkovaného
s REYATAZOM/ritonavirom sa môže očakávať signifikantná redukcia
plazmatickej hladiny atazanaviru. Tento účinok môže byť výsledkom indukcie CYP3A4. Existuje riziko
straty terapeutického účinku a vývoj rezistencie (pozri časť 4.3).
Súbežné podávanie
REYATAZU/ritonaviru
s prípravkami obsahujúcimi ľubovník bodkovaný je kontraindikované.
 HO
R
MONÁLNE KONTRACEPTÍVA
HO
R
MONÁLNE KONTRACEPTÍVA
E
ti
nylestradiol 25 μg +
norgestimát
(atazanavir 300 mg raz denne
s ritonavirom 100 mg raz denne)
Etinylestradiol AUC ↓19 % (↓25 %
↓13 %)
Etinylestradiol Cmax ↓16 % (↓26 %
↓5 %)
Etinylestradiol Cmin ↓37 % (↓45 %
↓29 %)
Norgestimát AUC ↑85 % (↑67 %
↑105 %)
Norgestimát Cmax ↑68 % (↑51 %
↑88 %)
Norgestimát Cmin ↑102 % (↑77 %
↑131 %)
Podávaním samotného atazanaviru sa koncentrácia etinylestradiolu zvýšila vďaka inhibícii UGT a CYP3A4 atazanavirom. Čistý účinok atazanaviru/ritonaviru je znížený hladinami etinylestradiolu kvôli indukčnému účinku ritonaviru.
Ak sa perorálne kontraceptívum podáva
s REYATAZOM/ritonavirom,
odporúča sa, aby perorálne kontraceptívum obsahovalo aspoň 30 μg etinylestradiolu, a aby pacientka presne dodržiavala dávkovací režim kontraceptíva. Súbežné podávanie
REYATAZU/ritonaviru s inými hormonálnymi kontraceptívami alebo perorálnymi kontraceptívami, obsahujúcimi iné progestogény, ako je norgestimát, sa neskúmalo,
a preto je potrebné sa mu vyhnúť. Odporúča sa
alternatívna spoľahlivá metóda
antikoncepcie.
Zvýšenie expozície progestínom môže
viesť k súvisiacim vedľajším účinkom
(napr. inzulínovej rezistencii, dyslipidémii, akné a škvrnitosti), čo
môže ovplyvniť compliance.
LIEKY ZNIŽUJÚCE HLADINU LIPIDOV
Inhibítory HMG-CoA reduktázy
Simvastatín
L
ovastatín
Metabolizmus simvastatínu
a lovastatínu je vysoko závislý na
CYP3A4 a súbežné podávanie
s REYATAZOM/ritonavirom môže viesť k zvýšeniu ich koncentrácií.
Súbežné podávanie simvastatínu alebo lovastatínu
s REYATAZOM je
kontraindikované z dôvodu zvýšeného rizika myopatie vrátane rabdomyolýzy (pozri časť 4.3).
A
t
orvastatín Riziko myopatie vrátane rabdomyolýzy môže byť zvýšené aj atorvastatínom, ktorý sa tiež metabolizuje prostredníctvom CYP3A4.
Súbežné podávanie atorvastatínu s REYATAZOM sa neodporúča. Ak sa použitie atorvastatínu považuje za striktne nevyhnutné, má sa podať najnižšia možná dávka atorvastatínu so dôkladným monitoringom bezpečnosti (pozri časť 4.4).
P
ravastatín
F
l
uvastatín
I napriek tomu, že sa to neskúmalo, existuje možnosť zvýšenia expozície pravastatínu alebo fluvastatínu, ak sa súbežne podajú s inhibítormi proteázy. Pravastatín sa nemetabolizuje prostredníctvom CYP3A4. Fluvastatín sa čiastočne metabolizuje prostredníctvom CYP2C9.
Je potrebná opatrnosť.
 I
N
H
ALAČN
É BETA AGONISTY
I
N
H
ALAČN
É BETA AGONISTY
Salmeterol Súbežné podávanie REYATAZU/ritonaviru môže viesť k zvýšeným koncentráciám salmeterolu a zvýšiť nežiaduce udalosti spojené so salmeterolom.
Súbežné podávanie salmeterolu
s REYATAZOM/ritonavirom sa
neodporúča (pozri časť 4.4).
O
P
I
O
IDY
B
uprenorfín, raz denne, stabilná udržiavacia dávka (atazanavir 300 mg raz denne
s ritonavirom 100 mg raz denne)
Metadon, stabilná udržiavacia
dávka
(atazanavir 400 mg raz denne)
Mechanizmus interakcie je inhibícia
CYP3A4 atazanavirom/ritonavirom.
Buprenorfín AUC ↑67 % Buprenorfín Cmax ↑37 % Buprenorfín Cmin ↑69 %
Norbuprenorfín AUC ↑105 % Norbuprenorfín Cmax ↑61 % Norbuprenorfín Cmin ↑101 %
Mechanizmus interakcie je inhibícia
CYP3A4 a UGT1A1. Koncentrácie atazanaviru (ak sa podáva s ritonavirom) neboli signifikantne ovplyvnené. Nepozoroval sa signifikantný účinok na koncentrácie metadonu. Pokiaľ vezmeme do úvahy, že nízka dávka ritonaviru (100 mg dvakrát denne) nepreukázala signifikantný účinok na koncentrácie metadonu, na základe týchto údajov sa neočakáva interakcia pri súbežnom podávaní metadonu
s REYATAZOM a ritonavirom.
Súbežné podávanie si vyžaduje klinické sledovanie sedácie
a kognitívnych účinkov. Môže sa zvážiť redukcia dávky
buprenorfínu.
Nie je potrebná úprava dávkovania, ak sa metadon podáva súbežne
s REYATAZOM a ritonavirom.
P
ĽÚCN
A ARTERIÁLNA HYPERTENZIA
PDE5 inhibítory
Sildenafil Súbežné podávanie REYATAZU/ ritonaviru môže viesť k zvýšeným koncentráciám PDE5 inhibítora
a zvýšiť nežiaduce udalosti spojené
s PDE5 inhibítorom.
Mechanizmus interakcie je inhibícia CYP3A4 atazanavirom a/alebo ritonavirom.
Nebola stanovená bezpečná
a účinná dávka sildenafilu
v kombinácii s REYATAZOM/ ritonavirom, keď sa používa na liečbu pľúcnej arteriálnej hypertenzie. Použitie sildenafilu na liečbu pľúcnej arteriálnej hypertenzie je kontraindikované (pozri časť 4.3).
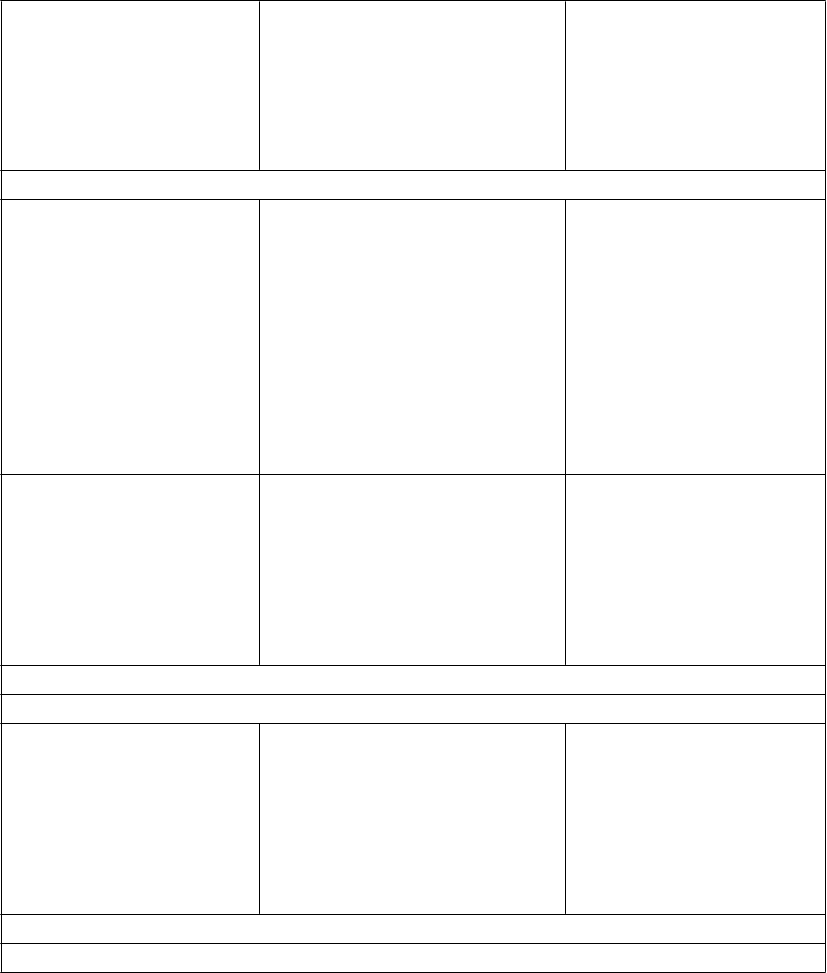 SEDATÍVA
Benzodiazepíny
SEDATÍVA
Benzodiazepíny
Midazolam
T
riazolam
Midazolam a triazolam sú metabolizované vo veľkej miere prostredníctvom CYP3A4. Súbežné podávanie s REYATAZOM/ ritonavirom môže zapríčiniť veľké zvýšenie koncentrácie týchto benzodiazepínov. Nevykonala sa žiadna lieková interakčná štúdia súbežného podávania REYATAZU/ ritonaviru s benzodiazepínmi. Na základe údajov pre iné inhibítory CYP3A4 sa očakáva významné zvýšenie plazmatických koncentrácií, ak sa midazolam podáva perorálne. Údaje o súbežnom použití parenterálneho midazolamu s inými proteázovými inhibítormi naznačujú možné 3 – 4-násobné zvýšenie plazmatických hladín midazolamu.
REYATAZ/ritonavir sa nemajú súbežne podávať s triazolamom alebo perorálne podávaným midazolamom (pozri časť 4.3), zatiaľ čo pri súbežnom podávaní REYATAZU/ritonaviru
a parenterálneho midazolamu je potrebná opatrnosť. Ak sa
REYATAZ súbežne podáva
s parenterálnym midazolamom má sa tak spraviť na jednotke
intenzívnej starostlivosti (JIS)
alebo na podobných miestach, aby sa zabezpečilo dôsledné klinické sledovanie
a zodpovedajúca medicínska starostlivosť v prípade
respiračnej depresie a/alebo prolongovanej sedácie. Je potrebné zvážiť úpravu
dávkovania midazolamu, najmä ak sa podala viac ako jedna
dávka midazolamu.
 P
ediatrická populácia
P
ediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktáciaGraviditaPriemerný počet údajov u gravidných žien (medzi 300-1 000 výsledkami gravidít) nepreukázal žiadnu malformačnú toxicitu atazanaviru. Štúdie na zvieratách nepreukázali reprodukčnú toxicitu (pozri
časť 5.3). Užívanie REYATAZU sa môže zvážiť počas gravidity len vtedy, ak predpokladaný prínos prevýši potenciálne riziko.
V klinickom skúšaní AI424-182 sa REYATAZ/ritonavir (300/100 mg alebo 400/100 mg) podával
v kombinácii so zidovudínom/lamivudínom 41 gravidným ženám v priebehu druhého alebo tretieho trimestra. U šiestich z 20 (30 %) žien na REYATAZE/ritonavire 300/100 mg a u 13 z 21 (62 %) žien na REYATAZE/ritonavire 400/100 mg sa vyskytla hyperbilirubinémia 3. až 4. stupňa. V klinickom skúšaní AI424-182 sa nepozorovali žiadne prípady laktátovej acidózy.
Štúdia hodnotila 40 detí, ktoré dostávali antiretrovírusovú profylaktickú liečbu (ktorá nezahŕňala REYATAZ), a ktoré boli negatívne na HIV-1 DNA v čase pôrodu a/alebo počas prvých 6 mesiacov po pôrode. U troch z 20 detí (15 %) narodených ženám liečeným REYATAZOM/ritonavirom
300/100 mg a u štyroch z 20 detí (20 %) narodených ženám liečeným REYATAZOM/ritonavirom
400/100 mg sa vyskytol bilirubín 3.-4. stupňa. Neexistujú žiadne dôkazy o patologickej žltačke a šesť zo 40 detí v tejto štúdii dostávalo fototerapiu maximálne 4 dni. Nevyskytli sa žiadne hlásené prípady
novorodeneckej žltačky u novorodencov.
Odporúčania pre dávkovania, pozri časť 4.2. a farmakokinetické údaje, pozri časť 5.2.
Nie je známe, či podávanie REYATAZU matkám počas gravidity spôsobuje fyziologickú hyperbilirubinémiu a novorodeneckú žltačku u novorodencov a dojčiat. V predpôrodnom období sa má zvážiť dodatočné sledovanie.
Dojčenie
Nie je známe, či sa atazanavir alebo metabolity atazanaviru vylučujú do ľudského mlieka. Štúdie na potkanoch preukázali vylučovanie atazanaviru do mlieka. Všeobecne sa odporúča, aby ženy infikované HIV nedojčili deti a vyhli sa tak prenosu infekcie HIV.
Fertilita
V neklinických štúdiách fertility a skorého embryonálneho vývinu potkanov atazanavir zmenil cyklus ruje bez účinku na párenie alebo fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pacienti majú byť informovaní, že počas liečby režimami, ktoré zahŕňajú REYATAZ, boli hlásené závraty (pozri časť 4.8).
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Bezpečnosť REYATAZU v kombinovanej terapii s inými antiretrovírusovými liekmi sa hodnotila v
kontrolovaných klinickými štúdiách s 1 806 dospelými pacientmi užívajúcimi REYATAZ v dávke
400 mg jedenkrát denne (1 151 pacientov, medián trvania 52 týždňov a maximum trvania
152 týždňov) alebo REYATAZ 300 mg s ritonavirom 100 mg jedenkrát denne (655 pacientov, medián trvania 96 týždňov a maximum trvania 108 týždňov).
Nežiaduce reakcie boli konzistentné medzi pacientmi, ktorí dostali REYATAZ 400 mg jedenkrát denne a pacientmi, ktorí užívali REYATAZ 300 mg s ritonavirom 100 mg jedenkrát denne, okrem žltačky a zvýšenia hladín celkového bilirubínu, ktoré boli častejšie hlásené pri kombinovanom podávaní REYATAZU plus ritonaviru.
U pacientov, ktorí užívali REYATAZ 400 mg jedenkrát denne alebo REYATAZ 300 mg s ritonavirom
100 mg jedenkrát denne boli bez ohľadu na závažnosť veľmi často hlásenými nežiaducimi reakciami s
minimálnou možnou súvislosťou s režimom zahŕňajúcim REYATAZ a jeden alebo viac NRTI nauzea
(20 %), hnačka (10 %) a žltačka (13 %). U pacientov užívajúcich REYATAZ 300 mg s ritonavirom
100 mg bola frekvencia žltačky 19 %. Vo väčšine prípadov sa výskyt žltačky hlásili do niekoľkých dní až niekoľkých mesiacov po začatí liečby (pozri časť 4.4).
Tabuľkovýzoznamnežiaducichreakcií
Hodnotenie nežiaducich reakcií pri REYATAZE je založené na údajoch o bezpečnosti z klinických štúdií a zo skúseností po uvedení lieku na trh. Frekvencia je definovaná podľa nasledovnej konvencie: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé
(≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Poruchy imunitného systému: menej časté: hypersenzitivita
Poruchy metabolizmu a výživy: menej časté: zníženie hmotnosti, prírastok telesnej hmotnosti, anorexia, zvýšenie chuti do jedla
Psychické poruchy: menej časté: depresia, dezorientácia, anxieta, insomnia, porucha spánku, nezvyčajné sny
Poruchy nervového systému: časté: bolesť hlavy
menej časté: periférna neuropatia, synkopa, amnézia, závrat, spavosť, porucha chuti
Poruchy oka: časté: okulárny ikterus
Poruchy srdca a srdcovej činnosti: menej časté: torsades de pointesa
zriedkavé: predĺženie QT intervalua, edém, palpitácie
Poruchy ciev: menej časté: hypertenzia
P
oruchy dýchacej sústavy,
hrudníka a mediastína:
menej časté: dyspnoe
P
oruchy gastrointestinálneho
t
raktu:
časté: vracanie, hnačka, abdominálna bolesť, nauzea,
dyspepsia
menej časté: pankreatitída, gastritída, abdominálna distenzia, aftózna stomatitída, flatulencia, suchosť v ústach
P
oruchy pečene a žlčových ciest: časté: žltačka
menej časté: hepatitída, cholelitiázaa, cholestázaa
zriedkavé: hepatosplenomegália, cholecystitídaa
P
oruchy kože a podkožného
t
kaniva:
časté: vyrážka;
menej časté: multiformný erytéma,b, toxické kožné výsevya,b, lieková vyrážka s eozinofíliou a príznakmi
systémového syndrómu (DRESS)a,b, angioedéma,
urtikária, alopécia, pruritus
zriedkavé: Stevensov-Johnsonov syndróma,b, vezikulobulózna vyrážka, ekzém, vazodilatácia
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva:
menej časté: svalová atrofia, bolesť kĺbov, myalgia;
zriedkavé: myopatia
P
oruchy obličiek a močových
ciest:
menej časté: nefrolitiázaa, hematúria, proteinúria,
polakiúria, intersticiálna nefritída zriedkavé: bolesť obličiek
P
oruchy reprodukčného systému
a prsníkov:
menej časté: gynekomastia
C
elkové poruchy a reakcie
v mieste podania:
časté: únava
menej časté: bolesť na hrudníku, nevoľnosť, pyrexia,
asténia
zriedkavé: porucha chôdze
a Tieto nežiaduce reakcie boli identifikované počas sledovania po uvedení lieku na trh, frekvencie boli
odhadnuté zo štatistického výpočtu založeného na celkovom počte pacientov vystavených účinku
REYATAZU v randomizovaných kontrolovaných a iných dostupných klinických skúšaniach
(n=2 321).
b Viac informácií, pozri popis vybraných nežiaducich reakcií.
Popisvybranýchnežiaducichreakcií
U HIV-infikovaných pacientov s ťažkou imunodeficienciou môže v čase začatia kombinovanej antiretrovírusovej terapie (CART) vzniknúť zápalová reakcia na asymptomatické alebo reziduálne
oportúnne infekcie. Hlásili sa aj autoimunitné ochorenia (ako je Gravesova choroba); hlásený čas do
ich nástupu je však variabilnejší a tieto udalosti sa môžu vyskytnúť mnoho mesiacov po začatí liečby
(pozri časť 4.4).
Boli hlásené prípady osteonekrózy, najmä u pacientov so všeobecne uznávanými rizikovými faktormi, pokročilým HIV ochorením alebo dlhodobou expozíciou kombinovanej antiretrovírusovej terapii (CART). Frekvencia osteonekrózy nie je známa (pozri časť 4.4).
Metabolické parametre
Počas antiretrovírusovej liečby sa môže zvýšiť telesná hmotnosť a hladiny lipidov a glukózy v krvi
(pozri časť 4.4).
Vyrážka a súvisiace syndrómy
Vyrážky sú zvyčajne mierne až stredne závažné makulopapulárne kožné výsevy, ktoré sa objavia počas prvých 3 týždňov od začiatku liečby REYATAZOM.
Stevensov-Johnsonov syndróm (SJS), multiformný erytém, toxické kožné výsevy a lieková vyrážka s eozinofíliou a príznakmi systémového syndrómu (DRESS) sa hlásili u pacientov užívajúcich REYATAZ (pozri časť 4.4).
Laboratórne abnormality
Najčastejšie hlásenou laboratórnou abnormalitou u pacientov užívajúcich režim zahŕňajúci REYATAZ
a jeden alebo viac NRTI bol zvýšený celkový bilirubín hlásený predovšetkým ako zvýšený nepriamy
[nekonjugovaný] bilirubín (87 % 1., 2., 3. alebo 4. stupňa). Zvýšenie celkového bilirubínu
3. alebo 4. stupňa sa zaznamenalo u 37 % (6 % 4. stupňa). U pacientov liečených REYATAZOM
300 mg jedenkrát denne s ritonavirom 100 mg jedenkrát denne s mediánom dĺžky liečby 95 týždňov bol výskyt zvýšení celkového bilirubínu 3.-4. stupňa 53 %. U pacientov predtým neliečených REYATAZOM 300 mg jedenkrát denne s ritonavirom 100 mg jedenkrát denne s mediánom dĺžky liečby 96 týždňov bol výskyt zvýšení celkového bilirubínu 3.-4. stupňa 48 % (pozri časť 4.4).
Iné očividné klinické laboratórne abnormality (3. alebo 4. stupňa) hlásené u ≥ 2 % pacientov užívajúcich režim zahŕňajúci REYATAZ a jeden alebo viac NRTI patria: zvýšená kreatínkináza (7 %), zvýšená alanínaminotransferáza/sérová glutamylpyruváttransamináza (ALT/SGPT) (5 %), nízke neutrofily (5 %), zvýšená aspartátaminotransferáza/sérová glutamyloxalacetáttransamináza (AST/SGOT) (3 %) a zvýšená lipáza (3 %).
U dvoch percent pacientov liečených REYATAZOM došlo k súčasnému zvýšeniu ALT/AST 3. -
4. stupňa a celkového bilirubínu 3. - 4. stupňa.
Pediatrickápopulácia
V klinickej štúdii AI424-020 s pediatrickými pacientmi vo veku od 3 mesiacov do 18 rokov, ktorí dostali buď liekovú formu perorálny prášok alebo kapsuly bola priemerná doba trvania liečby
REYATAZOM 115 týždňov. Bezpečnostný profil v tejto štúdii bol celkovo porovnateľný s tým, ktorý sa pozoroval u dospelých. U pediatrických pacientov boli hlásené nielen asymptomatická
átrioventrikulárna blokáda prvého stupňa (23 %) ale aj druhého stupňa (1 %). Najčastejšie hlásenou laboratórnou abnormalitou u pediatrických pacientov užívajúcich REYATAZ bolo zvýšenie celkového bilirubínu (≥ 2,6-násobok ULN, 3. - 4. stupňa), ktoré sa vyskytlo u 45 % pacientov.
V klinických štúdiách AI424-397 a AI424-451 s pediatrickými pacientmi vo veku od 3 mesiacov do
11 rokov, bola priemerná doba trvania liečby REYATAZOM perorálnym práškom 80 týždňov. Nehlásili sa žiadne úmrtia. Bezpečnostný profil v týchto štúdiách bol celkovo porovnateľný s tým, ktorý sa pozoroval v predchádzajúcich pediatrických štúdiách a v štúdiách s dospelými. Najčastejšie hlásenými laboratórnymi abnormalitami u pediatrických pacientov užívajúcich REYATAZ perorálny prášok bolo zvýšenie celkového bilirubínu (≥ 2,6-násobok ULN, 3.-4. stupňa; 16 %) a zvýšená amyláza (3.-4. stupňa; 33 %), vo všeobecnosti nepankreatického pôvodu. V týchto štúdiách sa zvýšenie hladín ALT hlásilo častejšie u pediatrických pacientov ako u dospelých.
Inéosobitnépopulácie
Pacienti súčasne infikovaní vírusom hepatitídy B a/alebo hepatitídy C
Medzi 1151 pacientmi užívajúcimi atazanavir v dávke 400 mg jedenkrát denne bolo 177 pacientov súčasne infikovaných chronickou hepatitídou B alebo C a medzi 655 pacientmi užívajúcimi atazanavir
300 mg jedenkrát denne s ritonavirom 100 mg jedenkrát denne bolo 97 pacientov súčasne infikovaných chronickou hepatitídou B alebo C. U pacientov súčasne infikovaných bola vyššia pravdepodobnosť zvýšenia pečeňových transamináz oproti východiskovému stavu ako u pacientov bez

chronickej vírusovej hepatitídy. Medzi týmito pacientmi a pacientmi bez vírusovej hepatitídy sa nepozorovali rozdiely vo frekvencii zvýšenia bilirubínu. Frekvencia liečbou vyvolanej hepatitídy alebo zvýšenia transaminázy u pacientov súčasne infikovaných týmito vírusmi bola porovnateľná pri použití REYATAZU a s ním porovnateľnými režimami (pozri časť 4.4).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieSkúsenosti s akútnym predávkovaním REYATAZOM u ľudí sú obmedzené. Jednorazové dávky do
1 200 mg užívané zdravými dobrovoľníkmi sa ukázali bez symptomaticky neočakávaných účinkov.
Pri vysokých dávkach, ktoré vedú k vysokým expozíciám liečiva, sa môže pozorovať žltačka súvisiaca s nepriamou (nekonjugovanou) hyperbilirubinémiou (bez súvisiacich zmien testov funkcie pečene) alebo s predĺženiami PR intervalu (pozri časti 4.4 a 4.8).
Liečba predávkovania REYATAZOM má pozostávať zo všeobecných podporných opatrení vrátane sledovania vitálnych funkcií a elektrokardiogramu (EKG) a pozorovaní klinického stavu pacienta. Ak je to indikované, je potrebné dosiahnuť vylúčenie neabsorbovaného atazanaviru vracaním alebo výplachom žalúdka. Odstránenie neabsorbovaného lieku sa môže urýchliť aj podaním aktívneho uhlia. Pri predávkovaní REYATAZOM neexistuje špecifické antidotum. Keďže sa atazanavir významne metabolizuje v pečeni a silne sa viaže na bielkoviny, nie je pravdepodobné, že bude dialýza prospešná na významné odstraňovanie tohto lieku.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antivirotiká na systémové použitie, inhibítory proteázy, ATC kód: J05AE08
Mechanizmus účinkuAtazanavir je azapeptidový inhibítor HIV-1 proteázy (PI). Zložka selektívne inhibuje vírusovo-
špecifické štiepenie vírusových proteínov Gag-Pol v bunkách infikovaných vírusmi HIV-1, čím bráni tvorbe zrelých viriónov a infikovaniu ďalších buniek.
Antivírusová aktivita in vitro: atazanavir vykazuje anti-HIV-1 (vrátane všetkých testovaných vzoriek)
a anti-HIV-2 aktivitu v bunkovej kultúre.
RezistenciaAniretrovírusová terapia u dospelých pacientov bez predchádzajúcej liečbyV klinických štúdiách s pacientmi bez predchádzajúcej antiretrovírusovej terapie liečených atazanavirom bez zosilnenia účinku, je substitúcia I50L, niekedy v kombinácii s A71V zmenou, signálnou rezistentnou substitúciou atazanaviru. Stupne rezistencie na atazanavir sa pohybovali od 3,5- do 29-násobku bez existencie fenotypovej skríženej rezistencie na ostatné PI. V klinických skúšaniach
s pacientmi bez predchádzajúcej antiretrovírusovej terapie liečených atazanavirom so zosilneným účinkom sa nehlásila substitúcia I50L u žiadneho pacienta bez základných substitúcií PI. N88S
substitúcia sa zriedkavo vyskytla u pacientov s virologickým zlyhaním vyvolaným atazanavirom
(s ritonavirom alebo bez neho). Zatiaľ čo môže prispievať k zníženiu vnímavosti na atazanavir, ak sa vyskytne s inou proteázovou substitúciou, v klinických štúdiách samotná N88S substitúcia neviedla vždy k fenotypovej rezistencii na atazanavir alebo trvalému vplyvu na klinickú účinnosť.
Tabuľka 3. De novo substitúcie u pacientov bez predchádzajúcej liečby so zlyhaním liečby





 atazanavir + ritonavir (Štúdia 138, 96 týždňov)
F
r
ekvencia de novo PI substitúcia (n=26)
a
atazanavir + ritonavir (Štúdia 138, 96 týždňov)
F
r
ekvencia de novo PI substitúcia (n=26)
a
> 20 % žiadna
10-20 % žiadna
a Počet pacientov s genotypmi klasifikovaný ako virologické zlyhanie (HIV RNA ≥ 400 kópií/ml).
M1841/V substitúcia sa vyskytla u 5/26 pacientov s REYATAZOM/ritonavirom a 7/26 pacientov
s lopinavirom/ritonavirom vyvolaná virologickým zlyhaním.
Antiretrovírusová terapia dospelých pacientov s predchádzajúcou liečbouMedzi 100 izolátmi získanými u pacientov zo štúdií 009, 043 a 045 po predchádzajúcej antiretrovírusovej terapii označených ako virologické zlyhania počas liečby atazanavirom,
atazanavirom + ritonavirom alebo atazanavirom + sachinavirom bol zistený rozvoj rezistencie na atazanavir. Zo 60 izolátov od pacientov liečených buď atazanavirom alebo
atazanavirom + ritonavirom sa u 18 (30 %) objavil I50L fenotyp predtým popísaný u pacientov bez predchádzajúcej liečby.
Tabuľka 4. De novo substitúcie u liečených pacientov so zlyhaním liečby atazanavir + ritonavir(Štúdia 045, 48 týždňov)Frekvencia de novo PI substitúcia (n=35)a,b> 20 % M36, M46, I54, A71, V82
10-20 % L10, I15, K20, V32, E35, S37, F53, I62, G73, I84, L90
a Počet pacientov s genotypmi klasifikovaný ako virologické zlyhanie (HIV RNA ≥ 400 kópií/ml).
b Desať pacientov malo fenotypovú rezistenciu na atanazavir + ritonavir (zmena násobku [ZN] > 5,2) na začiatku liečby. FC vnímavosť v bunkovej kultúre vo vzťahu k štandardnému typu bola skúmaná pomocou PhenoSenseTM (Monogram Biosciences, South San Francisco, Kalifornia, USA).
Žiadna z de novo substitúcií (pozri tabuľku 4) nie je špecifická pre atazanavir a v liečenej populácii
pacientov v Štúdii 045 sa nezaznamenal opätovný vznik dosiahnutej rezistencie na
atazanavir + ritonavir.
K rezistencii u pacientov po predchádzajúcej antiretrovírusovej terapii dochádza hlavne akumuláciou hlavnej a vedľajšej rezistencie už popísanými substitúciami, ktoré spôsobujú rezistenciu na inhibítory proteáz.
Klinické výsledkyDospelí pacienti bez predchádzajúcej antiretrovírusovej terapieŠtúdia 138 je medzinárodné, randomizované, otvorené, multicentrické, prospektívne klinické skúšanie s 883 pacientmi bez predchádzajúcej liečby porovnávajúce REYATAZ/ritonavir (300 mg/100 mg jedenkrát denne) s lopinavirom/ritonavirom (400 mg/100 mg dvakrát denne), každá v kombinácii
s fixnou dávkou tenofoviru/emtricitabinu (300 mg/200 mg tablety jedenkrát denne). V skupine
REYATAZ/ritonavir bola podobná (non-inferiórna) antiretrovírusová účinnosť v porovnaní so skupinou lopinavir/ritonavir, podľa odhadnutého pomeru pacientov s HIV RNA < 50 kópii/ml v
48. týždni (Tabuľka 5).
Analýza údajov počas 96 týždňov liečby preukázala pretrvávanie antivírusovej aktivity (Tabuľka 5). Priemerný východiskový počet CD4 buniek bol 214 buniek/mm3 (rozsah: 2 až 810 buniek/mm3) a
priemerná východisková hladina HIV-1 RNA v plazme bola 4,94 log10 kópií/ml (rozsah: 2,6 až
5,88 log10 kópií/ml). V skupine REYATAZ/ritonavir bola podobná (neinferiórna) antiretrovírusová účinnosť v porovnaní so skupinou lopinavir/ritonavir, podľa odhadnutého pomeru pacientov s HIV RNA < 50 kópii/ml v 48. týždni: 78 % pacientov s REYATAZOM/ritonavirom v porovnaní so 76 % s
lopinavirom/ritonavirom (odhadovaný rozdiel ATV/RTV-LPV/RTV: 1,7 % [95 % CI, -3,8 %; 7,1 %] podľa potvrdenej virologickej odpovede (Confirmed Virologic Response, CVR), definícia odpovede bez ukončenia = zlyhanie (NC = F).
V analýze podľa protokolu, z ktorej sa vylúčili pacienti, ktorí neukončili liečbu (t.j. pacienti, ktorí ukončili liečbu pred hodnotením hladiny HIV RNA v 48. týždni) a pacienti s významnými odchýlkami
od protokolu, bol pomer pacientov s HIV RNA < 50 kópií/ml v 48. týždni 86 % (338/392) pri REYATAZE/ritonavire a 89 % (332/372) pri lopinavire/ritonavire (odhadovaný rozdiel ATV/RTV- LPV/RTV: -3 % [95 % CI, -7,6 %; 1,5 %].
T
abuľka 5: Výsledky účinnosti v Štúdii 138
a
Pa
rameter
REYATAZ/ritonavir
b
(30
0 mg/100 mg jedenkrát denne)
n=440
L
o
pinavir/ritonavir
c
(40
0 mg/100 mg dvakrát denne) n=443
H
IV RNA < 50 kópií/ml, %
48. týždeň 96. týždeň 48. týždeň 96. týždeň
Všetci pacientid 78 74 76 68
Odhadovaný rozdiel [95 %
IS]d
48. týždeň: 1,7 % [-3,8 %; 7,1 %]
96. týždeň: 6,1 % [0,3 %; 12,0 %]
Analýza podľa protokolue 86 (n=392f)
91 (n=352)
89 (n=372)
89 (n=331)
Odhadovaný rozdiele [95 %
IS]
48. týždeň: -3 % [-7,6 %; 1,5 %]
96. týždeň: 2,2 % [-2,3 %; 6,7 %]
HIV RNA < 50 kópií/ml, % na základe východiskových vlastnostíd
HIV RNA
< 100 000 kópií/ml 82 (n=217) 75 (n=217) 81 (n=218) 70 (n=218)
≥ 100 000 kópií/ml
CD4 počet
74 (n=223) 74 (n=223) 72 (n=225) 66 (n=225)
< 50 buniek/mm3 78 (n=58) 78 (n=58) 63 (n=48) 58 (n=48)
50 až < 100 buniek/mm3
100 až < 200 buniek/mm3
≥ 200 buniek/mm3
76 (n=45) 71 (n=45) 69 (n=29) 69 (n=29)
75 (n=106) 71 (n=106) 78 (n=134) 70 (n=134)
80 (n=222) 76 (n=222) 80 (n=228) 69 (n=228)
 P
r
i
e
m
erná zmena východiskového počtu HIV RNA, log
10
kópií/ml
P
r
i
e
m
erná zmena východiskového počtu HIV RNA, log
10
kópií/ml
Všetci pacienti -3,09 (n=397) -3,21 (n=360) -3,13 (n=397) -3,19 (n=340)
Priemerná zmena východiskového počtu CD4, bunky/mm3Všetci pacienti 203 (n=370) 268 (n=336) 219 (n=363) 290 (n=317) Priemerná zmena východiskového počtu CD4, bunky/mm3 na základe východiskových vlastností HIV RNA
< 100 000 kópií/ml 179 (n=183) 243 (n=163) 194 (n=183) 267 (n=152)
≥ 100 000 kópií/ml
227 (n=187) 291 (n=173) 245 (n=180) 310 (n=165)
a Priemerný východiskový počet buniek CD4 bol 214 buniek/mm3 (rozsah 2 až 810 buniek/mm3) a priemerná východisková HIV-1 RNA v plazme bola 4,94 log10 kópií/ml (rozsah 2,6 až 5,88 log10 kópií/ml).
b REYATAZ/RTV s tenofovirom/emtricitabínom (fixná dávka 300 mg/200 mg tablety raz denne).
c Lopinavir/RTV s tenofovirom/emtricitabínom (fixná dávka 300 mg/200 mg tablety raz denne).
d Intent-to-treat analýza s chýbajúcimi hodnotami považovanými ako zlyhania.
e Analýza podľa protokolu: Okrem pacientov, ktorí neukončili liečbu a pacienti s významnými odchýlkami od protokolu.
f Hodnotený počet pacientov.
Dospelí pacienti s predchádzajúcou antiretrovírusovou terapiouŠtúdia 045je randomizované, multicentrické skúšanie porovnávajúce REYATAZ/ritonavir
(300/100 mg jedenkrát denne) a REYATAZ/sachinavir (400/1 200 mg jedenkrát denne) oproti lopinaviru + ritonaviru (fixná kombinácia dávky 400/100 mg dvakrát denne), každá v kombinácii
s tenofovirom (pozri časti 4.5 a 4.8) a jedným NRTI u pacientov s virologickým zlyhaním pri dvoch
alebo viacerých predchádzajúcich režimoch obsahujúcich najmenej jeden PI, NRTI a NNRTI. U randomizovaných pacientov predstavoval priemerný čas predchádzajúcej antiretrovírusovej expozície 138 týždňov pre PI, 281 týždňov pre NRTI a 85 týždňov pre NNRTI. Na začiatku užívalo
34 % pacientov PI a 60 % užívalo NNRTI. Pätnásť zo 120 (13 %) pacientov v skupine liečenej REYATAZOM + ritonavirom a 17 zo 123 (14 %) pacientov v skupine s lopinavirom + ritonavirom malo štyri alebo viac PI substitúcií L10, M46, I54, V82, I84 a L90. U tridsiatich dvoch percent pacientov v štúdii sa zistil vírusový kmeň s horúčkou s menej ako dvoma substitúciami NRTI.
Primárnym koncovým ukazovateľom bol časový rozdiel v zmenách oproti východiskovým hodnotám
HIV RNA počas 48 týždňov (Tabuľka 6).
Tabuľka 6: Výsledky účinnosti v 48. a 96. týždnia (Štúdia 045)
P
arameter
ATV
/
RTV
b
(
300 mg/
100 mg raz denne)
n=120
L
P
V
/
RTV
c
(
4
00 mg/
100 mg dvakrát denne)
n=123
Č
asovo priemerný rozdiel ATV/RTV- LPV/RTV
[
97,5 CI
d
]
48. týždeň 96. týždeň 48. týždeň 96. týždeň 48. týždeň 96. týždeň
P
r
i
e
m
erná zmena východiskového počtu HIV RNA, log
10
kópií/ml
Všetci pacienti
-1,93 (n=90 e)
-2,29
(n=64)
-1,87 (n=99)
-2,08 (n=65)
0,13
[-0,12,
0,39]
0,14
[-0,13,
0,41]
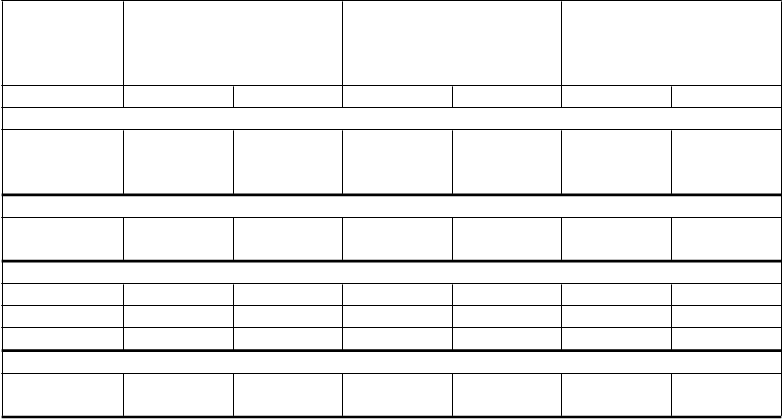 H
IV RNA < 50 kópií/ml, %
f
(
respondent/vyhodnotenie)
H
IV RNA < 50 kópií/ml, %
f
(
respondent/vyhodnotenie)
Všetci
pacienti 36 (43/120) 32 (38/120) 42 (52/123) 35 (41/118) NA NA
HIV RNA < 50 kópií/ml podľa východiskových PI substitúciíf, g % (respondent/vyhodnotenie)0-2 44 (28/63) 41 (26/63) 56 (32/57) 48 (26/54) NA NA
3 18 (2/11) 9 (1/11) 38 (6/16) 33 (5/15) NA NA
≥ 4 27 (12/45) 24 (11/45) 28 (14/50) 20 (10/49) NA NA
Priemerná zmena východiskového počtu CD4, bunky/mm3Všetci
pacienti 110 (n=83) 122 (n=60) 121 (n=94) 154 (n=60) NA NA
a Priemerný východiskový počet CD4 buniek bol 337 buniek/mm3 (rozsah: 14 až 1 543 buniek/mm3) a priemerná východisková hladina HIV-1 RNA v plazme bola 4,4 log10 kópií/ml (rozsah: 2,6 až 5,88 log10 kópií/ml).
b ATV/RTV s tenofovirom/emtricitabínom (fixná dávka 300 mg/200 mg tablety raz denne).
c LPV/RTV s tenofovirom/emtricitabínom (fixná dávka 300 mg/200 mg tablety raz denne).
d Interval spoľahlivosti.
e Počet hodnotených pacientov.
f Intent-to-treat analýza s chýbajúcimi hodnotami považovanými ako zlyhanie. Respondenti na LPV/RTV, ktorí dokončili liečbu pred 96. týždňom, sú vylúčení z analýzy 96. týždňa. Počet pacientov s HIV RNA
< 400 kópií/ml bol 53 % a 43 % pre ATV/RTV a 54 % a 46 % pre LPV/RTV v 48. týždni, respektíve 96.
g Selektívne substitúcie zahŕňajú akúkoľvek zmenu v polohe L10, K20, L24, V32, L33, M36, M46, G48, I50, I54, L63, A71, G73, V82, I84 a L90 (0-2, 3, 4 alebo viac) na začiatku.
NA = neaplikovateľné.
Počas 48 týždňov liečby boli priemerné zmeny hladín HIV RNA v porovnaní s východiskovými hodnotami pre REYATAZ + ritonavir a pre lopinavir + ritonavir (neinferiórna) podobné. Zhodné výsledky boli získané počas predošlého sledovania použitou metódou analýzy (priemerný časový rozdiel 0,11; 97,5 % interval spoľahlivosti, [-0,15; 0,36]). Podľa analýzy „as-treated“ (liečených pacientov), vylučujúcou chýbajúce hodnoty, bol podiel pacientov s HIV RNA < 400 kópií/ml
(< 50 kópií/ml) v skupine REYATAZ + ritonavir 55 % (40 %) a v skupine lopinavir + ritonavir 56 %
(46 %).
Počas 96 týždňov liečby, priemerné zmeny HIV RNA oproti východiskovej hodnote pre
REYATAZ + ritonavir a lopinavir + ritonavir splnili kritériá neinferiority založené na pozorovaných prípadoch. Zhodné výsledky sa získali počas predošlého sledovania s použitím rovnakej metódy
analýzy. Analýzou "as treated" (liečených pacientov), vylučujúcou chýbajúce hodnoty, podiel
pacientov s HIV RNA < 400 kópií/ml (< 50 kópií/ml) pre REYATAZ + ritonavir bol 84 % (72 %) a pre lopinavir + ritonavir 82 % (72 %). Je dôležité poznamenať, že počas 96-týždňovej analýzy zostalo v štúdii celkovo 48 % pacientov.
REYATAZ + sachinavir sa ukázal menej účinný ako lopinavir + ritonavir.
Pediatrická populácia
Pediatrické klinické skúšania s kapsulami REYATAZU
Zhodnotenie farmakokinetiky, bezpečnosti, tolerability a účinnosti REYATAZU je založené na údajoch z otvoreného multicentrického klinického skúšania AI424-020 vykonaného s pacientmi vo
veku od 3 mesiacov do 21 rokov. Celkovo v tejto štúdii 182 pediatrických pacientov (81 bez
predchádzajúcej antiretrovírusovej liečby a 101 s predchádzajúcou antiretrovírusovou liečbou) užívalo
REYATAZ jedenkrát denne (kapsuly alebo práškovú formu) s ritonavirom alebo bez neho
v kombinácii s dvomi NRTI.
Klinické údaje získané z tejto štúdie sú nedostatočné na to, aby podporili používanie kapsúl
atazanaviru (s ritonavirom alebo bez neho) u detí vo veku do 6 rokov.
Údaje o účinnosti, ktoré boli pozorované u 41 pediatrických pacientov od 6 rokov do menej ako
18 rokov, ktorí užívali kapsuly REYATAZU s ritonavirom, sú uvedené v tabuľke 7. U pediatrických pacientov bez predchádzajúcej liečby bol priemerný východiskový počet buniek CD4 344 buniek/mm3 (rozsah: 2 až 800 buniek/mm3) a priemerná východisková hladina HIV 1 RNA v plazme bola
4,67 log10 kópií/ml (rozsah: 3,70 až 5,00 log10 kópií/ml). U pediatrických pacientov s predchádzajúcou liečbou bol priemerný východiskový počet buniek CD4 522 buniek/mm3 (rozsah: 100 až
1 157 buniek/mm3) a priemerná východisková hladina HIV 1 RNA v plazme bola 4,09 log10 kópií/ml
(rozsah: 3,28 až 5,00 log10 kópií/ml).
Tabuľka 7: Výsledky účinnosti (pediatrickí pacienti vo veku od 6 rokov do menej ako 18 rokov)
v 48. týždni (Štúdia AI424-020)
P
arameter Pacienti bez predchádzajúcej
li
e
čby kapsulami
RE
Y
ATA
Z
U
/rit
onaviru (300 mg/100 mg jedenkrát denne) n=16
P
acienti s predchádzajúcou liečbou kapsulami REYATAZU/ritonaviru (300 mg/100 mg jedenkrát denne) n=25
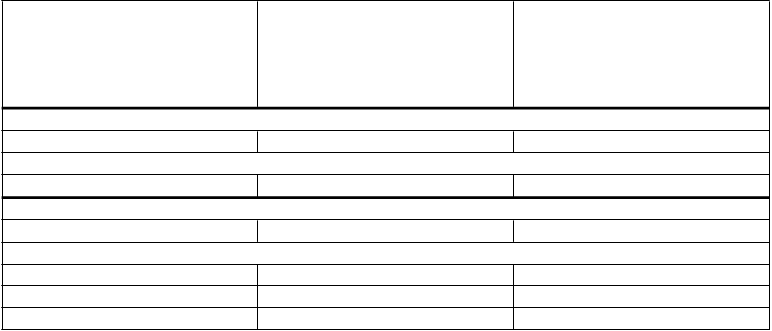 H
IV RNA < 50 kópií/ml, %
a
H
IV RNA < 50 kópií/ml, %
a
Všetci pacienti 81 (13/16) 24 (6/25)
HIV RNA < 400 kópií/ml, % aVšetci pacienti 88 (14/16) 32 (8/25)
Priemerná zmena začiatočného počtu CD4, bunky/mm3Všetci pacienti 293 (n=14b) 229 (n=14b)
HIV RNA < 50 kópií/ml podľa začiatočných PI substitúcií, c % (respondenti/vyhodnoteníd)0-2 NA 24 (4/15)
3 NA -
≥ 4 NA 0 (0/3)
a Intent-to-treat analýza s chýbajúcimi hodnotami považovanými ako zlyhanie.
b Počet hodnotených pacientov.
c PI významné L24I, D30N, V32I, L33F, M46IL, I47AV, G48V, I50LV, F53LY, I54ALMSTV, L76V, V82AFLST, I84V, N88DS, L90M; PI nevýznamné: L10CFIRV, V11I, E35G, K43T, Q58E, A71ILTV, G73ACST, T74P, N83D, L89V.
d Zahŕňa pacientov so začiatočnými údajmi o rezistencii. NA = neaplikovateľné.
Pediatrické klinické skúšania s perorálnym práškom REYATAZUHodnotenie farmakokinetiky, bezpečnosti, tolerability a virologickej odpovede na perorálny prášok
REYATAZU je založené na údajoch z dvoch otvorených, multicentrických klinických skúšaní.
§ AI424-397 (PRINCE I): S pediatrickými pacientmi vo veku od 3 mesiacov do menej ako 6 rokov
§ AI424-451 (PRINCE II): S pediatrickými pacientmi vo veku od 3 mesiacov do menej ako
11 rokov
V týchto štúdiách dostalo 155 pacientov (59 bez predchádzajúcej antiretrovírusovej liečby a
96 s predchádzajúcou antiretrovírusovou liečbou) perorálny prášok REYATAZU jedenkrát denne
s ritonavirom v kombinácii s dvomi NRTI.
Na zaradenie do oboch skúšaní museli mať pacienti bez predchádzajúcej antiretrovírusovej liečby genotypovú citlivosť na REYATAZ a dva NRTI a pacienti s predchádzajúcou antiretrovírusovou liečbou museli mať zdokumentovanú genotypovú a fenotypovú citlivosť vyšetrenia na REYATAZ a minimálne 2 NRTI. Pacienti vystavený účinku antiretrovírusovej liečby iba in utero alebo počas pôrodu boli považovaní za pacientov bez predchádzajúcej antiretrovírusovej liečby. Pacienti, ktorí dostali REYATAZ alebo REYATAZ/ritonavir kedykoľvek pre zaradením do štúdie alebo ktorí mali zlyhanie liečby na dva alebo viac inhibítorov proteázy, rezistenciu na inhibítor proteázy alebo potvrdené existujúce abnormality srdca v anamnéze boli zo skúšaní vylúčení. Rezistencia na inhibítor proteázy bola definovaná ako genotypová rezistencia na atazanavir alebo nejakú zložku lokálneho základného režimu NRTI na základe kritéria 1) akékoľvek veľké mutácie: I50L, I84V, N88S a kritéria
2) ≥ 2 z nasledovných malých mutácií alebo mutácií spôsobujúcich skrížené rezistencie: M46I/L, G48V, I54L/V/M/T/A, V82A/T/FI, L90M, V32I.
V 48. týždni bolo 134 pediatrických pacientov vo veku od 3 mesiacov do menej ako 11 rokov, ktorí dostali perorálny prášok REYATAZU s ritonavirom vyhodnotených z hľadiska účinnosti. Tieto údaje sú uvedené v tabuľke 8. U pediatrických pacientov bez predchádzajúcej antiretrovírusovej liečby bol priemerný východiskový počet CD4 buniek 930 buniek/mm3 (rozsah: 46 až
2 291 buniek/mm3) a priemerná východisková hladina HIV 1 RNA v plazme bola
4,81 log10 kópií/ml (rozsah: 3,4 až 5,9 log10 kópií/ml). U pediatrických pacientov s predchádzajúcou antiretrovírusovou liečbou bol priemerný východiskový počet CD4 buniek 1 441 buniek/mm3
(rozsah: 84 až 5 703 buniek/mm3) a priemerná východisková hladina HIV 1 RNA v plazme bola
4,67 log10 kópií/ml (rozsah: 2,0 až 5,9 log10 kópií/ml).
Tabuľka 8: Výsledky účinnosti perorálneho prášku (pediatrickí pacienti vo veku od 3 mesiacov
a s telesnou hmotnosťou minimálne 5 mg) v 48. týždni (Štúdie AI424-397 a AI424-451)
P
arameter
H
IV RNA < 50 kópií/ml, %
a
minimálne 5 až < 10 kg (REYATAZ
150 a 200 mg)
minimálne 10 až < 15 kg
minimálne 15 až < 25 kg
minimálne 25 až < 35 kg
HIV RNA < 400 kópií/ml, %a
minimálne 5 až < 10 kg (REYATAZ
150 a 200 mg)
minimálne 10 až < 15 kg minimálne 15 až < 25 kg minimálne 25 až < 35 kg
Pacienti bez predchádzajúcej
liečby
REYATAZ prášok/ritonavir n=52
33 (4/12)
59 (13/22)
61 (11/18)
-
75 (9/12)
82 (18/22)
78 (14/18)
-
Pacienti s predchádzajúcou
liečbou
REYATAZ prášok/ritonavir n=82
52 (17/33)
35 (6/17)
57 (17/30)
50,0 (1/2)
61 (20/33)
59 (10/17)
67 (20/30)
50,0 (1/2)
P
r
i
e
m
erná zmena začiatočného počtu CD4, bunky/mm
3
minimálne 5 až < 10 kg (REYATAZ
150 a 200 mg)
minimálne 10 až < 15 kg
minimálne 15 až < 25 kg
minimálne 25 až < 35 kg
293 (n=7)
293 (n=11)
305 (n=9)
-
63 (n=16)
307 (n=8)
374 (n=12)
213 (n=1)
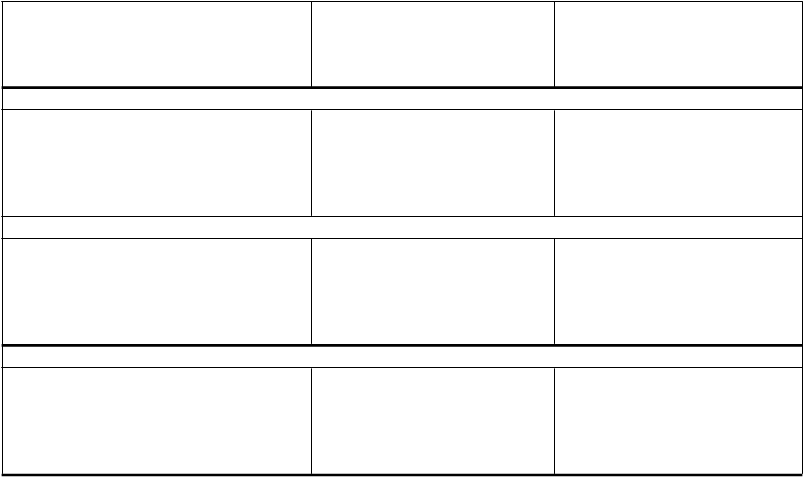
a Intent-to-treat analýza s chýbajúcimi hodnotami považovanými ako zlyhania.
5.2 Farmakokinetické vlastnosti
Absorpcia: u HIV infikovaných pacientov (n=33, kombinované štúdie) viedli opakované dávky REYATAZU 300 mg jedenkrát denne s ritonavirom v dávke 100 mg jedenkrát denne v kombinácii s jedlom ku geometrickému priemeru (CV%) pre Cmax atazanaviru 4 466 (42 %) ng/ml s časom pre
Cmax približne 2,5 hodiny. Geometrický priemer (CV%) pre Cmin a AUC atazanaviru bol 654 (76 %)
ng/ml a 44 185 (51 %) ng•h/ml.
Vplyvjedla: súbežné podávanie REYATAZU a ritonaviru s jedlom optimalizuje biologickú dostupnosť atazanaviru. Súbežné podávanie jednorazovej dávky 300 mg REYATAZU a 100 mg ritonaviru s ľahkým jedlom viedlo k 33 % zvýšeniu AUC a 40 % zvýšeniu oboch Cmax a 24-hodinovej koncentrácie atazanaviru v pomere k stavu nalačno. Súbežné podávanie s jedlom s vysokým obsahom tuku neovplyvnilo AUC atazanaviru v pomere k podmienkam nalačno a Cmax bola v medziach 11 % hodnôt nalačno. 24-hodinová koncentrácia po jedle s vysokým obsahom tuku bola zvýšená priemerne o 33 % vzhľadom na oneskorenú absorpciu; medián Tmax bol zvýšený z 2,0 na 5,0 hodín. Podávanie REYATAZU s ritonavirom a s ľahkým alebo jedlom s vysokým obsahom tukov znížilo koeficient zmeny AUC a Cmax približne o 25 % v porovnaní so stavom nalačno. Na zlepšenie biologickej dostupnosti a na minimalizovanie variability, sa má REYATAZ užívať s jedlom.
Distribúcia: atazanavir sa viaže približne z 86 % na ľudské sérové proteíny v rozsahu koncentrácie
100 až 10 000 ng/ml. Na kyslý α-1-glykoproteín (AAG) a albumín sa atazanavir viaže v podobnom rozsahu (89 % a 86 % pri 1 000 ng/ml). V štúdii s opakovaným podávaním dávok u HIV-infikovaných pacientov liečených dávkami atazanaviru 400 mg jedenkrát denne v kombinácii s ľahkým jedlom
počas 12 týždňov bol atazanavir detekovaný v cerebrospinálnej tekutine a sperme.
Biotransformácia: štúdie s ľuďmi a in vitro štúdie využívajúce ľudské pečeňové mikrozómy preukázali, že atazanavir sa metabolizuje hlavne izoenzýmom CYP3A4 na oxidačné metabolity. Metabolity sa vylučujú do žlče buď ako voľné alebo ako glukuronidové metabolity. Ďalšie menej významné metabolické cesty pozostávajú z N-dealkylácie a hydrolýzy. Boli charakterizované dva vedľajšie metabolity atazanaviru v plazme. Žiaden z metabolitov nevykazoval in vitro antivírusovú aktivitu.
Eliminácia: po podaní jednorazovej 400-mg dávky 14C-atazanaviru sa v stolici zistilo 79 % a moči
a 13 % z celkovej rádioaktivity. Približne 20 % podanej dávky predstavovalo nezmenené liečivo
v stolici a 7 % v moči. Priemerné vylučovanie nezmeneného liečiva močom predstavovalo 7 % po 2-
týždňovom podávaní 800 mg jedenkrát denne. U dospelých HIV-infikovaných pacientov (n=33, kombinované štúdie) bol v rovnovážnom stave po dávke 300 mg denne s ritonavirom 100 mg jedenkrát denne s ľahkým jedlom priemerný polčas v rozsahu dávkovacieho intervalu pre atazanavir
12 hodín.
Linearita/nelinearita:farmakokinetika atazanaviru sa hodnotila u zdravých dospelých dobrovoľníkov a HIV-infikovaných pacientov; medzi oboma skupinami sa pozorovali signifikantné rozdiely. Farmakokinetika atazanaviru vykazovala nelineárnu dispozíciu.
Osobitné populácie
Porucha funkcie obličiek: renálne vylučovanie nezmeneného atazanaviru u zdravých jedincov
predstavovalo približne 7 % podanej dávky. Nie sú k dispozícii farmakokinetické údaje dostupné pre REYATAZ s ritonavirom u pacientov s obličkovou insuficienciou. REYATAZ (bez ritonaviru) bol skúmaný u dospelých pacientov s ťažkou poruchou obličiek (n=20) vrátane hemodialyzovaných pacientov, pri opakovanom podávaní dávok 400 mg jedenkrát denne. Hoci sa v tejto štúdii vyskytli určité obmedzenia (t.j. koncentrácie voľného liečiva sa neskúmali), výsledky naznačujú, že farmakokinetické parametre atazanaviru sa o 30 % až 50 % znížia u pacientov podrobujúcich sa hemodialýze v porovnaní s pacientmi s normálnou funkciou obličiek. Mechanizmus tohto zníženia nie je známy (pozri časti 4.2 a 4.4.).
Porucha funkcie pečene: atazanavir sa primárne metabolizuje a vylučuje pečeňou. Účinky poruchy funkcie pečene na farmakokinetiku atazanaviru podaného v dávke 300 mg s ritonavirom neboli skúmané. U pacientov so stredne ťažkou alebo ťažkou poruchou funkcie pečene sa očakávajú zvýšené koncentrácie atazanaviru podaného s ritonavirom alebo bez neho (pozri časti 4.2, 4.3 a 4.4).
Vek/pohlavie: uskutočnila sa štúdia farmakokinetiky atazanaviru s 59 zdravými mužmi a ženami
(29 mladých, 30 starších). Nezistili sa klinicky významné farmakokinetické rozdiely týkajúce sa veku alebo pohlavia.
Rasa: populačná farmakokinetická analýza vzoriek z klinických skúšaní v 2. fáze nepreukázala žiaden vplyv rasy na farmakokinetiku atazanaviru.
Gravidita:
Farmakokinetické údaje od HIV infikovaných gravidných žien užívajúcich REYATAZ kapsuly s ritonavirom sú uvedené v tabuľke 9.
Tabuľka 9: Farmakokinetika atazanaviru s ritonavirom v rovnovážnom stave u HIV
infikovaných gravidných žien po jedle
atazanavir 300 mg s ritonavirom 100 mg
F
armakokinetický parameter
Cmax ng/ml
Geometrický priemer
(CV%)
AUC ng•h/ml
Geometrický priemer
(CV%)
Cmin ng/mlb
Geometrický priemer
(CV%)
2. trimester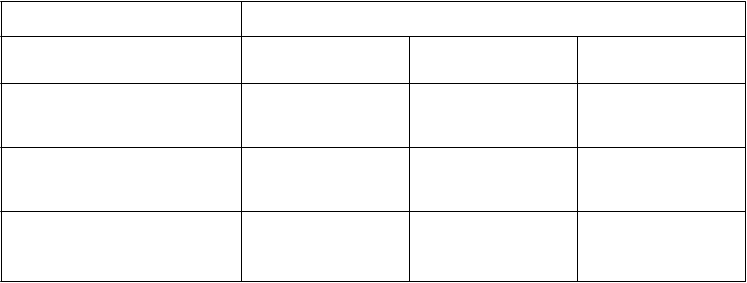
(n=9)
3 729,09 (39)
34 399,1 (37)
663,78 (36)
3. trimester(n=20)
3 291,46 (48)
34 251,5 (43)
668,48 (50)
po pôrodea(n=36)
5 649,10 (31)
60 532,7 (33)
1 420,64 (47)
a Zistilo sa, že maximálne koncentrácie atazanaviru a AUC sú približne o 26-40 % vyššie počas obdobia po pôrode (4-12 týždňov) ako tie, ktoré sa pozorovali u v minulosti HIV infikovaných negravidných pacientok. Minimálne plazmatické koncentrácie atazanaviru boli približne 2-násobne vyššie počas obdobia po pôrode
v porovnaní s tými, ktoré sa pozorovali u v minulosti HIV infikovaných negravidných pacientok.
b Cmin je koncentrácia 24 hodín po užití dávky.
Pediatrická populácia
Po normalizácii telesnej hmotnosti je tendencia k vyššiemu klírensu u mladších detí. Následkom toho boli pozorované väčšie pomery maximum:minimum, no pri odporúčaných dávkach sa očakáva, že geometrické priemery expozícií atazanaviru (Cmin, Cmax a AUC) u pediatrických pacientov budú podobné tým, ktoré sa pozorovali u dospelých.
5.3 Predklinické údaje o bezpečnosti
V štúdiách toxicity s opakovaným podávaním dávky uskutočnených na myšiach, potkanoch a psoch sa nálezy súvisiace s atazanavirom vo všeobecnosti viazali na pečeň a zahŕňali minimálne až mierne zvýšenie sérového bilirubínu a pečeňových enzýmov, hepatocelulárnu vakuolizáciu a hypertrofiu a iba u samičiek myší aj hepatickú nekrózu bunky. Systémové expozície atazanaviru u myší (samce), potkanov a psov pri dávkach spájaných s hepatálnymi zmenami boli prinajmenšom rovnaké ako tie, ktoré sa pozorovali u ľudí pri dávkach 400 mg jedenkrát denne. Expozícia atazanaviru predstavovala
u samičiek myší po dávke spôsobujúcej nekrózu bunky 12-násobok expozície u ľudí po dávke 400 mg
jedenkrát denne. Sérový cholesterol a glukóza sa minimálne až mierne zvýšili u potkanov, ale nezvýšili sa u myší alebo psov.
Počas in vitro štúdií boli draslíkové kanáliky klonovaných ľudských kardiocytov (hERG) v 15 % inhibované v koncentrácii (30 μM) atazanaviru zodpovedajúcej 30-násobku koncentrácie voľného liečiva pri Cmax u ľudí. Podobné koncentrácie atazanaviru zvýšili o 13 % trvanie akčného potenciálu (ADP90) v štúdii s Purkyňovými vláknami u králikov. Elektrokardiografické zmeny (sínusová bradykardia, predĺženie PR intervalu, predĺženie QT intervalu a predĺženie QRS komplexu) sa pozorovali len v počiatočnej 2-týždňovej štúdii perorálnej toxicity uskutočnenej na psoch. Následné 9- mesačné štúdie perorálnej toxicity na psoch nepreukázali elektrokardiografické zmeny súvisiace
s liečivom. Klinický význam týchto predklinických údajov nie je známy. Potenciálne účinky tohto lieku na srdce nie je možné u ľudí vylúčiť (pozri časti 4.4 a 4.8). Možnosť predĺženia PR intervalu je
potrebné vziať do úvahy pri predávkovaní (pozri časť 4.9).
V štúdii fertility a skorých vývojových štádií embryí u potkanov atazanavir menil cyklus pohlavného pudu bez vplyvu na párenie alebo fertilitu. U potkanov alebo králikov sa pri dávkach toxických pre matku nepozorovali žiadne teratogénne účinky. V štúdii na gravidných králikoch sa pozorovali
u mŕtvych alebo skonávajúcich samičiek lézie na žalúdku a črevách pri maternálnych dávkach 2 až 4-
krát prevyšujúcich najvyššiu dávku podávanú v definitívnej vývojovej štúdii týkajúcej sa embryí. Pri skúmaní prenatálneho a postnatálneho vývoja potkanov atazanavir spôsoboval prechodné zníženie telesnej hmotnosti mláďat pri dávkach toxických pre matku. Systémová expozícia atazanaviru pri dávkach, ktoré boli toxické pre matku, bola rovnaká alebo o niečo vyššia ako tá, ktorá sa pozorovala u ľudí, ktorým sa podávala dávka 400 mg jedenkrát denne.
Atazanavir bol negatívny v Amesovom teste reverznej mutácie, ale indukoval chromozomálne aberácie in vitro ako pri absencii, tak aj v prítomnosti metabolickej aktivácie. V in vivo štúdiách na potkanoch atazanavir neindukoval mikrojadrá v kostnej dreni, poškodenie DNA v dvanástniku (stanovenie komét) alebo neplánovanú reparáciu DNA v pečeni pri plazmatických a tkanivových koncentráciách prevyšujúcich koncentrácie, ktoré boli klastogénne in vitro.
V dlhodobých štúdiách karcinogenity atazanaviru na myšiach a potkanoch bol pozorovaný zvýšený výskyt benígnych pečeňových adenómov iba u myších samičiek. Zvýšený výskyt benígnych pečeňových adenómov u myších samičiek je pravdepodobne následkom cytotoxických pečeňových zmien manifestujúcich sa ako jednoduchá nekróza buniek a tento nález je považovaný za irelevantný u ľudí v určených terapeutických expozíciách. U myších samcov a potkanov neboli potvrdené žiadne známky karcinogénneho pôsobenia.
Atazanavir zvyšoval zákal bovinnej rohovky v in vitro štúdii okulárnej dráždivosti, čím indikoval, že by pri priamom kontakte s očami mohol mať dráždivé účinky.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Aspartám (E951) Sacharóza
Pomarančovo-vanilková aróma
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
Po zmiešaní s jedlom alebo nápojom sa môže zmes uchovávať v priebehu 1 hodiny pri teplote neprevyšujúcej 30°C.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
REYATAZ perorálny prášok sa má uchovávať v pôvodnom vrecku a nemá sa otvoriť pokým nie je pripravený na použitie.
Podmienky na uchovávanie po zmiešaní lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Vrecko z polyesterového filmu/hliníka/polyetylénového filmu na utesnenie. Každá škatuľka obsahuje 30 vreciek.
6.6 Špeciálne opatrenia na likvidáciu
Pokyny na používanie:
Dávku a počet vreciek REYATAZU perorálneho prášku je potrebné určiť na základe telesnej hmotnosti (pozri časť 4.2).
1. Pred zmiešaním vrecko poklepte, aby sa prášok usadil. Na prestrihnutie každého vrecka
pozdĺž bodkovanej čiary použite čisté nožnice.
2. Na zmiešavanie a podávanie s tekutými dojčenskými mliekami, nápojmi alebo pokrmami sú vybraté vhodné možnosti uvedené nižšie. Na podávanie lieku možno použiť väčšie objemy alebo množstvá tekutého dojčenského mlieka, nápoja alebo pokrmu. Je potrebné zabezpečiť, aby pacient zjedol alebo vypil celé dojčenské mlieko, nápoj alebo pokrm, ktorý obsahuje prášok.
A: Odporúčaný počet vreciek REYATAZU perorálneho prášku zmiešajte s tekutým dojčenským mliekom v malom medicínskom pohári alebo v malej nádobe a podajte perorálnou injekčnou striekačkou, ktorú môžete dostať od lekárnika:
§ Na zmiešanie obsahu primeraného počtu vreciek (4 alebo 5 vreciek v závislosti od
telesnej hmotnosti dieťaťa) s 10 ml pripraveného tekutého dojčenského mlieka v malom medicínskom pohári alebo v malej nádobe sa používa lyžica. Celé množstvo zmesi sa natiahne do perorálnej injekčnej striekačky a podá sa buď na pravú alebo ľavú vnútornú stranu líca dojčaťa. Na vypláchnutie zvyšného REYATAZU perorálneho prášku v pohári alebo v nádobe sa do medicínskeho pohára alebo malej nádoby pridá ďalších 10 ml mlieka. Zvyšná zmes sa natiahne do perorálnej injekčnej striekačky a podá sa buď na pravú alebo ľavú vnútornú stranu líca dojčaťa.
B: V malom pohári na pitie zmiešajte odporúčaný počet vreciek REYATAZU perorálneho prášku s nápojom, ako je mlieko alebo voda:
§ Na zmiešanie obsahu vreciek s 30 ml nápoja sa používa lyžica. Dieťa má zmes vypiť. Na
dôkladné vypláchnutie pohára sa do pohára na pitie pridá ďalších 15 ml nápoja a obsah sa zamieša. Dieťa má celú zvyšnú zmes vypiť.
§ Ak sa použije voda, v tom istom čase sa má požiť aj potrava.
C: V malej nádobe zmiešajte odporúčaný počet vreciek REYATAZU perorálneho prášku s jedlom, ako je jablkové pyré alebo jogurt:
§ Na zmiešanie obsahu vreciek sa použije jedna polievková lyžica jedla. Zmes sa podá
dojčaťu alebo malému dieťaťu. Na úplné podanie prášku z nádoby sa do malej nádoby pridá ďalšia polievková lyžica jedla a obsah sa zamieša.Celá zvyšná zmes sa podá dieťaťu.
3. Celá dávka REYATAZU perorálneho prášku (zmiešaného s tekutým dojčenským mliekom, nápojom alebo jedlom) sa podá v priebehu jednej hodiny od prípravy (počas tohto obdobia sa môže zmes uchovávať pri izbovej teplote nepresahujúcej 30 °C).
4. Po požití celej zmesi sa môže podať ďalšie dojčenské mlieko, nápoj alebo potrava.
5. Ritonavir sa podáva okamžite po podaní prášku REYATAZ.
Ďalšie detaily o príprave a podávaní REYATAZU perorálneho prášku, pozri Písomná informácia pre používateľa, časť Pokyny na používanie.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBRISTOL-MYERS SQUIBB PHARMA EEIG Uxbridge Business Park
Sanderson Road
Uxbridge UB8 1DH Veľká Británia
8. REGISTRAČNÉ ČISLOEU/1/03/267/012
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 02. marca 2004
Dátum posledného predĺženia registrácie: 02. marca 2009
10. DÁTUM REVÍZIE TEXTU{MM/RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.