
sa odporúča počkať s podávaním Qdengy najmenej 6 týždňov, ale ak je to možné až 3 mesiace, od ukončenia liečby, aby sa zabránilo neutralizácii atenuovaných vírusov obsiahnutých v očkovacej látke.
Qdenga sa nemá podávať jedincom, ktorí počas 4 týždňov pred očkovaním užívajú imunosupresívnu liečbu, napr. chemoterapiu alebo vysoké dávky systémových kortikosteroidov (pozri časť 4.3).
Použitie s inými očkovacími látkami
Ak sa má Qdenga podať v čase podania inej očkovacej látky, každá očkovacia látka sa má vždy podať
do iného miesta podania injekcie.
Qdenga sa môže podávať súbežne s očkovacou látkou proti hepatitíde typu A. Súbežné podávanie sa skúmalo u dospelých.
Qdenga sa môže podávať súbežne s očkovacou látkou proti žltej zimnici. V klinickej štúdii zahŕňajúcej približne 300 dospelých osôb, ktoré dostali Qdengu súčasne s očkovacou látkou proti kmeňu 17D žltej zimnice, nebol pozorovaný žiaden vplyv na mieru séroprotekcie v prípade žltej zimnice. Tvorba protilátok proti horúčke dengue boli znížené po súbežnom podaní Qdengy
s očkovacou látkou proti kmeňu 17D žltej zimnici. Klinický význam tohto nálezu nie je známy.
4.6 Fertilita, gravidita a laktácia
Ženy vo fertilnom veku
Ženy vo fertilnom veku nesmú otehotnieť po dobu najmenej jedného mesiaca od očkovania. Ženám,
ktoré plánujú otehotnieť, je potrebné odporučiť odklad očkovania (pozri časti 4.4 a 4.3).
Gravidita
Štúdie na zvieratách sú nedostatočné z hľadiska reprodukčnej toxicity (pozri časť 5.3).
Je iba obmedzené množstvo údajov o použití Qdengy u gravidných žien. Tieto údaje nie sú dostatočné na to, aby sa vylúčil potenciálny vplyv Qdengy na graviditu, embryo-fetálny vývin, pôrod
a postnatálny vývin.
Qdenga je živá atenuovaná očkovacia látka, preto je Qdenga počas gravidity kontraindikovaná (pozri časť 4.3).
Dojčenie
Nie je známe, či sa Qdenga vylučuje do ľudského mlieka. Riziko u novorodencov/dojčiat nemôže byť
vylúčené.
Qdenga je kontraindikovaná počas laktácie (pozri časť 4.3).
Fertilita
Štúdie na zvieratách sú nedostatočné z hľadiska reprodukčnej toxicity (pozri časť 5.3).
Neuskutočnili sa žiadne špecifické štúdie zamerané na fertilitu u ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Qdenga má mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn profilubezpečnostiV klinických skúšaniach najčastejšie hlásenými reakciami u subjektov vo veku od 4 do 60 rokov boli
bolesť v mieste podania injekcie (50 %), bolesť hlavy (35 %), myalgia (31 %), erytém v mieste
podania injekcie (27 %), malátnosť (24 %), asténia (20 %) a horúčka (11 %).
Tieto nežiaduce reakcie sa zvyčajne vyskytli do 2 dní od podania injekcie, boli mierne až stredne závažné, trvali krátko (1 až 3 dni) a boli menej časté po podaní druhej injekcie Qdengy než po prvej injekcii.
Virémia po vakcináciiV klinickej štúdii DEN-205 bola prechodná vakcinačná virémia pozorovaná po očkovaní Qdengou u
49 % subjektov klinickej štúdie, ktorí predtým neboli infikovaní dengue, a u 16 % subjektov klinickej štúdie, ktorí predtým boli infikovaní dengue. Virémia po vakcinácii sa zvyčajne začala v druhom týždni po podaní prvej injekcie a priemerná doba trvania bola 4 dni. Virémia po vakcinácii u niektorých subjektov súvisela s prechodnými, miernymi až stredne závažnými príznakmi, ako sú bolesť hlavy, artralgia, myalgia a vyrážka. Virémia po vakcinácii bola v zriedkavých prípadoch pozorovaná po druhej dávke.
Tabuľkový zoznam nežiaducich reakciíNežiaduce reakcie súvisiace s Qdengou získané z klinických štúdií sú zosumarizované v nižšie
uvedenej tabuľke (
Tabuľka č. 1).Nižšie uvedený profil bezpečnosti vychádza zo súhrnnej analýzy zahŕňajúcej 14 627 subjektov klinickej štúdie vo veku od 4 do 60 rokov (13 839 detí a 788 dospelých), ktorým bola podaná Qdenga. Zahŕňal podskupinu 3 830 účastníkov (3 042 detí a 788 dospelých) na rozbor reaktogénnosti.
Nežiaduce reakcie sú uvedené podľa nasledujúcich kategórií frekvencie: Veľmi časté: ³1/10
Časté: ³1/100 až < 1/10
Menej časté: ³1/1 000 až < 1/100
Zriedkavé: ³1/10 000 až < 1/1 000
Veľmi zriedkavé: < 1/10 000
Tabuľka č. 1: Nežiaduce reakcie z klinických štúdií (vek od 4 do 60 rokov)Trieda orgánových systémov
podľa databázy MedDRA
| Frekvencia
| Nežiaduce reakcie
|
Infekcie a nákazy
| Veľmi časté
| Infekcia horných dýchacích ciesta
|
Časté
| Nazofaryngitída
Faryngotonzilitídab
|
Menej časté
| Bronchitída
Rinitída
|
Poruchy metabolizmu a výživy
| Veľmi časté
| Znížená chuť na jedloc
|
Psychické poruchy
| Veľmi časté
| Podráždenosťc
|
Poruchy nervového systému
| Veľmi časté
| Bolesť hlavy
Somnolenciac
|
Menej časté
| Závrat
|
Poruchy gastrointestinálneho traktu
| Menej časté
| Hnačka
Nevoľnosť Bolesť brucha Vracanie
|
T
ri
eda orgánových systémov
podľa databázy MedDRA
|
Frekvencia
|
N
ežiaduce reakcie
|
Poruchy kože a podkožného tkaniva
|
Menej časté
|
Vyrážkad Prurituse Žihľavka
|
Veľmi zriedkavé
|
Angioedém
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
Veľmi časté
|
Myalgia
|
Časté
|
Artralgia
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté
|
Bolesť v mieste podania injekcie
Erytém v mieste podania injekcie
Malátnosť Asténia Horúčka
|
Časté
|
Opuch v mieste podania injekcie
Tvorba modrín v mieste podania injekciee
Pruritus v mieste podania injekciee
Ochorenie podobné chrípke
|
Menej časté
|
Krvácanie v mieste podania injekciee
Únavae
Zmena sfarbenia v mieste podania injekciee
|
a Zahŕňa infekciu horných dýchacích ciest a vírusovú infekciu horných dýchacích ciest
b Zahŕňa faryngotonzilitídu a tonzilitídu
c Zistené u detí mladších ako 6 rokov v klinických skúšaniach
d Zahŕňa vyrážky, vírusové vyrážky, makulopapulárne vyrážky, svrbivé vyrážky
e Hlásené u dospelých v klinických skúšaniach
Pediatrická populáciaPediatrické údaje od účastníkov vo veku od 4 do 17 rokovSúhrnné údaje o bezpečnosti z klinických skúšaní sú k dispozícii od 13 839 detí (9210 vo veku od 4 do
11 rokov a 4629 vo veku od 12 do 17 rokov). Patria k nim údaje o reaktogénnosti získané u 3042 detí
(1865 vo veku od 4 do 11 rokov a 1177 vo veku od 12 do 17 rokov).
Frekvencia, druh a závažnosť nežiaducich reakcií u detí boli prevažne konzistentné s reakciami
u dospelých. Nežiaducimi reakciami hlásenými častejšie u detí než u dospelých boli horúčka (11 %
oproti 3 %), infekcia horných dýchacích ciest (11 % oproti 3 %), nazofaryngitída (6 % oproti 0,6 %), faryngotonzilitída (2 % oproti 0,3 %) a ochorenie podobné chrípke (1 % oproti 0,1 %). Nežiaducimi reakciami hlásenými menej často u detí než u dospelých boli erytém v mieste podania injekcie (2 % oproti 27 %), nevoľnosť (0,03 % oproti 0,8 %) a artralgia (0,03 % oproti 1 %).
Nasledujúce reakcie boli zistené u 357 detí mladších ako 6 rokov zaočkovaných Qdengou:
znížená chuť na jedlo (17 %), somnolencia (13 %) a iritabilita (12 %).
Pediatrické údaje od účastníkov mladších ako 4 roky, t. j. mimo vekovej indikácieReaktogénnosť u subjektov mladších ako 4 roky bola hodnotená u 78 subjektov, ktorým bola podaná najmenej jedna dávka Qdengy, pričom 13 účastníkov užívalo indikovanú 2-dávkovú schému. Reakciami hlásenými s frekvenciou veľmi časté boli iritabilita (25 %), horúčka (17%), bolesť v mieste podania injekcie (17%) a strata chuti na jedlo (15%). Somnolencia (8 %) a erytém v mieste podania injekcie (3 %) boli hlásené s frekvenciou časté. Opuch v mieste podania injekcie nebol pozorovaný
u subjektov mladších ako 4 roky.
H
l
ásenie podozrení na nežiaduce reakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNeboli hlásené žiadne prípady predávkovania.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Očkovacie látky, vírusové očkovacie látky, ATC kód: J07BX04
Mechanizmus účinkuQdenga obsahuje živé oslabené vírusy dengue. Primárnym mechanizmom účinku Qdengy je lokálne
replikovanie a vyvolanie humorálnej a bunkovej imunitnej reakcie na štyri sérotypy vírusu dengue.
Klinická účinnosťKlinická účinnosť Qdengy bola hodnotená v klinickej štúdii DEN-301, hlavnom dvojito zaslepenom,
randomizovanom, placebom kontrolovanom klinickom skúšaní v 3. fáze vykonávanom v 5 krajinách v Latinskej Amerike (Brazília, Kolumbia, Dominikánska republika, Nikaragua, Panama) a v 3
krajinách v Ázii (Srí Lanka, Thajsko, Filipíny). Celkovo bolo randomizovaných 20 099 detí vo veku
od 4 do 16 rokov (pomer 2:1) pre užívanie Qdengy alebo placeba bez ohľadu na infekciu dengue
v minulosti.
Účinnosť sa hodnotila prostredníctvom aktívneho sledovania počas celého trvania klinickej štúdie. Každý subjekt s horúčkovitým ochorením (definovaným ako horúčka ≥ 38 °C počas ktorýchkoľvek 2 z 3 po sebe nasledujúcich dní) musel v skúšajúcom pracovisku absolvovať zhodnotenie horúčky dengue skúšajúcim lekárom. Subjekt opatrovníkom bola táto požiadavka pripomenutá najmenej raz týždenne, aby boli v čo najväčšej miere zachytené všetky symptomatické virologicky potvrdené prípady dengue (virologically confirmed dengue, VCD). Febrilné epizódy boli potvrdené overeným, kvantitatívnym testom RT-PCR dengue na detekciu špecifických sérotypov dengue.
Údaje klinickejúčinnostiusubjektov
vo veku od 4 do 16 rokovVýsledky účinnosti očkovacej látky (vaccine efficacy, VE) podľa primárneho ukazovateľa (VCD
horúčka vyskytujúca sa počas 12 mesačného obdobia začínajúceho po 30 dňoch od druhého očkovania) sú uvedené v
Tabuľke č. 2. Priemer veku populácie skúšania podľa protokolu bola 9,6
roka (štandardná odchýlka 3,5 roka), pričom 12,7 % subjektov bolo vo veku 4 – 5 rokov, 55,2 %
subjektov bolo vo veku 6 – 11 rokov a 32,1 % subjektov bolo vo veku 12 – 16 rokov. Z nich 46,5 %
bolo v Ázii a 53,5 % v Latinskej Amerike, 49,5 % bolo žien a 50,5 % bolo mužov. Sérostatus dengue vo východiskovom stave (pred podaním prvej injekcie) bol hodnotený u všetkých subjektov mikroneutralizačným testom (MNT50) s cieľom umožniť hodnotenie účinnosti očkovacej látky (Vaccine Efficacy, VE) podľa východiskového sérostatusu. Východisková miera séronegativity dengue u celkovej populácii podľa protokolu bola 27,7 %.
T
abuľka č. 2:
Účinnosť očkovacej látky pri prevencii VCD horúčky vyvolanej akýmkoľvek sérotypom počas 12 mesačného obdobia začínajúceho po 30 dňoch od druhého očkovania
 v klinickej štúdii DEN-301 (súbor podľa protokolu)a
v klinickej štúdii DEN-301 (súbor podľa protokolu)a
Q
denga
n = 12 700
b
Placebo
N = 6316
b
VCD horúčka, n (%) 61 (0,5) 149 (2,4)
Účinnosť očkovacej látky (95 % IS) (%) 80,2 (73,3; 85,3)
p-hodnota < 0,001

IS: interval spoľahlivosti; n: počet účastníkov s horúčkou; VCD: virologicky potvrdená dengue
a Primárna analýza údajov o účinnosti vychádzala zo súboru podľa protokolu, ktorý pozostával zo všetkých randomizovaných
subjektov bez žiadneho závažného porušenia protokolu vrátane neužitia oboch dávok správne priradenej Qdengy alebo placeba.
b Počet hodnotených účastníkov
Výsledky VE podľa sekundárnych ukazovateľov, prevencia hospitalizácie pre VCD horúčku, prevencia VCD horúčky podľa sérostatusu, podľa sérotypu, a prevencia závažnej VCD horúčky sú uvedené v
Tabuľke č. 3. Pri závažnej VCD horúčke sa zvažovali dva druhy ukazovateľov: klinicky závažné prípady VCD a prípady VCD, ktoré spĺňali kritériá WHO z roku 1997 pre hemoragickú horúčku dengue (Dengue Haemorrhagic Fever, DHF). Kritériá uplatnené v skúšaní DEN-301 na vyhodnotenie závažnosti VCD nezávislou „komisiou pre posudzovanie závažnosti prípadu dengue“ (Dengue Case severity Adjudication Committee, DCAC) vychádzali zo smerníc WHO z roku 2009. DCAC hodnotila všetky prípady hospitalizácie pred VCD na základe vopred definovaných kritérií, ktoré zahŕňali zhodnotenie abnormálneho krvácania, úniku plazmy, fungovania pečene, fungovania obličiek, fungovania srdca, centrálneho nervového systému a šoku. V skúšaní DEN-301 boli prípady VCD spĺňajúce kritériá WHO z roku 1997 pre DHF zisťované pomocou naprogramovaného algoritmu, t. j. bez lekárskeho úsudku. Kritériá vo všeobecnosti zahŕňali prítomnosť horúčky trvajúcej 2 až 7 dní, hemoragické tendencie, trombocytopéniu a dôkaz o úniku plazmy.
T
abuľka č 3: Účinnosť očkovacej látky pri prevencii hospitalizácie pre VCD horúčku, pri prevencii VCD horúčky spôsobenej sérotypom dengue, pri prevencii VCD horúčky podľa východiskového sérostatusu dengue a pri prevencii závažných foriem dengue počas 18 mesačného obdobia začínajúceho po 30 dňoch od druhého očkovania v klinickej štúdii DEN-301 (súbor podľa protokolu)
|
Q
denga
N = 12 700a
|
P
l
acebo
N = 6316a
|
V
E (95 % IS)
|
V
E pri prevencii hospitalizácií pre VCD horúčku
b
, n (%)
|
Hospitalizácie pre VCD horúčkuc
|
13 (0,1)
|
66 (1,0)
|
90,4 (82,6; 94,7)d
|
V
E pri prevencii VCD horúčky podľa sérotypu dengue, n (%)
|
VCD horúčka spôsobená DENV-1
|
38 (0,3)
|
62 (1,0)
|
69,8 (54,8; 79,9)
|
VCD horúčka spôsobená DENV-2
|
8 (< 0,1)
|
80 (1,3)
|
95,1 (89,9; 97,6)
|
VCD horúčka spôsobená DENV-3
|
63 (0,5)
|
60 (0,9)
|
48,9 (27,2; 64,1)
|
VCD horúčka spôsobená DENV-4
|
5 (< 0,1)
|
5 (< 0,1)
|
51,0 (-69,4; 85,8)
|
V
E pri prevencii VCD horúčky podľa východiskového sérostatusu dengue, n (%)
|
VCD horúčka u všetkých účastníkov
|
114 (0,9)
|
206 (3,3)
|
73,3 (66,5; 78,8)
|
VCD horúčka pri východiskovej séropozitivite u účastníkov
|
75 (0,8)
|
150 (3,3)
|
76,1 (68,5; 81,9)
|
VCD horúčka pri východiskovej séronegativite u účastníkov
|
39 (1,1)
|
56 (3,2)
|
66,2 (49,1; 77,5)
|
V
E pri prevencii DHF vyvolanej akýmkoľvek sérotypom dengue, n (%)
|
Celkovo
|
2 (< 0,1)
|
7 (0,1)
|
85,9 (31,9; 97,1)
|
V
E pri prevencii závažnej dengue vyvolanej akýmkoľvek sérotypom dengue, n (%)
|
Celkovo
|
2 (< 0,1)
|
1 (< 0,1)
|
2,3 (-977,5; 91,1)
|
VE: účinnosť očkovacej látky; IS: interval spoľahlivosti; n: počet účastníkov; VCD: virologicky potvrdená dengue; DENV:
sérotyp vírusu dengue
a Počet hodnotených subjektov
b Kľúčový sekundárny ukazovateľ
c Väčšina pozorovaných prípadov bola spôsobená DENV-2 (0 prípadov v ramene s Qdengou a 46 prípadov v ramene
s placebom)
d p-hodnota < 0,001
Bol pozorovaný včasný nástup ochrany s exploratívnou VE 81,1 % (95 % IS: 64,1 %, 90,0 %) proti
VCD horúčke spôsobenej kombináciou všetkých sérotypov od prvého očkovania po druhé očkovanie.
Dlhodobá ochranaV klinickej štúdii DEN-301 sa vykonalo niekoľko exploratívnych analýz s cieľom odhadnúť dlhodobú
ochranu v období od podania prvej dávky po uplynutie 4,5 roka od podania druhej dávky (
Tabuľka č.4).
|
Q
denga n/N
|
Placebo n/N
|
V
E (95 % IS) pri prevencii VCD horúčky
a
|
Q
denga n/N
|
P
l
acebo n/N
|
V
E (95% IS) pri prevencii hospitalizácie pre VCD horúčku
a
|
C
elkovo
|
442/13380
|
547/6687
|
61,2 (56,0; 65,8)
|
46/13380
|
142/6687
|
84,1 (77,8; 88,6)
|
V
ýchodisková séropozitivita, N=5,546
|
A
kýkoľvek
sé
rotyp
|
147/3714
|
153/1832
|
53,5 (41,6; 62,9)
|
17/3714
|
41/1832
|
79,3 (63,5; 88,2)
|
DEN
V
-
1
|
89/3714
|
79/1832
|
45,4 (26,1; 59,7)
|
6/3714
|
14/1832
|
78,4 (43,9; 91,7)
|
DEN
V
-
2
|
14/3714
|
58/1832
|
88,1 (78,6; 93,3)
|
0/3714
|
23/1832
|
100 (88,5; 100)b
|
DEN
V
-
3
|
36/3714
|
16/1832
|
-15,5
(-108,2; 35,9)
|
11/3714
|
3/1832
|
-87,9 (-573,4; 47,6)
|
DEN
V
-
4
|
12/3714
|
3/1832
|
-105,6
(-628,7; 42,0)
|
0/3714
|
1/1832
|
NPc
|
V
ýchodisková séropozitivita, N=14,517
|
|
A
kýkoľvek
sé
rotyp
|
295/9663
|
394/4854
|
64,2 (58,4;69,2)
|
29/9663
|
101/4854
|
85,9 (78,7; 90,7)
|
DEN
V
-
1
|
133/9663
|
151/4854
|
56,1 (44,6; 65,2)
|
16/9663
|
24/4854
|
66,8 (37,4; 82,3)
|
DEN
V
-
2
|
54/9663
|
135/4854
|
80,4 (73,1; 85,7)
|
5/9663
|
59/4854
|
95,8 (89,6; 98,3)
|
DEN
V
-
3
|
96/9663
|
97/4854
|
52,3 (36,7; 64,0)
|
8/9663
|
15/4854
|
74,0 (38,6; 89,0)
|
DEN
V
-
4
|
12/9663
|
20/4854
|
70,6 (39,9; 85,6)
|
0/9663
|
3/4854
|
NPc
|
|
|
T
abuľka č. 4: Účinnosť očkovacej látky pri prevencii VCD horúčky a hospitalizácie celkovo, podľa východiskového sérostatusu dengue a proti jednotlivým sérotypom podľa východiskového sérostatusu v období od podania prvej dávky po uplynutie 54 mesiacov od podania druhej dávky v klinickej štúdii DEN-301 (súbor na zhodnotenie bezpečnosti)
VE: účinnosť očkovacej látky, IS: interval spoľahlivosti, VCD: virologicky potvrdená dengue, n: počet subjektov, N: počet
hodnotených subjektov, NP: neposkytnuté
a Exploratívne analýza; klinická štúdia nemala silu ani zámer preukázať rozdiel medzi skupinou s očkovacou látkou a
skupinou s placebom
b Rámcovo použitím jednostranného 95 % IS
c Odhad VE neposkytnutý, pretože bol pozorovaný počet nižší ako 6 pri TDV aj placebe
Okrem toho VE pri prevencii DHF spôsobeného akýmkoľvek sérotypom bola 70,0 % (95 % IS:
31,5 %, 86,9 %) a pri prevencii klinicky závažných prípadov VCD spôsobených akýmkoľvek
sérotypom bola 70,2 % (95 % IS: –24,7 %, 92,9 %).
Pri každoročnej analýze až po uplynutie štyroch a pol roka od podania druhej dávky sa preukázala VE pri prevencii VCD pri všetkých štyroch sérotypoch u subjektov s východiskovou séropozitivitou dengue. U subjektov s východiskovou séronegativitou sa VE preukázala pri DENV-1 a DENV-2, ale nenaznačila sa pri DENV-3 a nepreukázala sa pri DENV-4 z dôvodu nižšieho výskytu prípadov (
Tabuľka č. 5).
T
abuľka č. 5: Účinnosť očkovacej látky pri prevencii VCD horúčky a hospitalizácie celkovo
|
V
E (95 % IS) pri prevencii VCD horúčky
N
a
= 19 021
|
V
E (95 % IS) pri prevencii
hospitalizácie pre VCD horúčku N
a
= 19 021
|
1. rokb
|
Celkovo
|
80,2 (73,3; 85,3)
|
95,4 (88,4; 98,2)
|
Podľa východiskového
sérostatusu dengue
Séropozitivita
Séronegativita
|
82,2 (74,5; 87,6)
74,9 (57,0; 85,4)
|
94,4 (84,4; 98,0)
97,2 (79,1; 99,6)
|
2. rokc
|
Celkovo
|
56,2 (42,3; 66,8)
|
76,2 (50,8; 88,4)
|
Podľa východiskového
sérostatusu dengue
Séropozitivita
Séronegativita
|
60,3 (44,7; 71,5)
45,3 (9,9; 66,8)
|
85,2 (59,6; 94,6)
51,4 (-50,7; 84,3)
|
3. rokd
|
Celkovo
|
45,0 (32,9; 55,0)
|
70,8 (49,6; 83,0)
|
Podľa východiskového
sérostatusu dengue Séropozitivita Séronegativita
|
48,7 (34,8; 59,6)
35,5 (7,4; 55,1)
|
78,4 (57,1; 89,1)
45,0 (-42,6; 78,8)
|
4. roke
|
Celkovo
|
62,8 (41,4; 76,4)
|
96,4 (72,2; 99,5)
|
Podľa východiskového
sérostatusu dengue
Séropozitivita
Séronegativita
|
64,1 (37,4; 79,4)
60,2 (11,1; 82,1)
|
94,0 (52,2; 99,3) NPf
|
|
|
a podľa východiskového sérostatusu dengue počas ročných období začínajúcich po 30 dňoch od druhého očkovania v klinickej štúdii DEN-301 (súbor na hodnotenie bezpečnosti)
VE: účinnosť očkovacej látky, IS: interval spoľahlivosti, VCD: virologicky potvrdená dengue, NP: neposkytnuté , N: celkový
počet subjektov v každom súbore na analýzu, a počet hodnotených subjektov je v každom roku iný.
b 1. rok sa vzťahuje na 11 mesiacov začínajúcich po 30 dňoch od podania druhej dávky.
c 2. rok sa vzťahuje na 13 až 24 mesiacov od podania druhej dávky. d 3. rok sa vzťahuje na 25 až 36 mesiacov od podania druhej dávky. e 4. rok sa vzťahuje na 37 až 48 mesiacov od podania druhej dávky.
f Odhad VE neposkytnutý, pretože bol pozorovaný počet nižší ako 6 pri TDV aj placebe
Klinická účinnosť u subjektov vo vekuod17rokovNeuskutočnila sa žiadna štúdia klinickej účinnosti u subjektov vo veku od 17 rokov. Účinnosť Qdengy
u subjektov vo veku od 17 rokov sa odvodzuje od klinickej účinnosti vo vekovej kategórie od 4 do 16
rokov prepojením údajov imunogenicity (pozri nižšie).
ImunogenicitaV prípade neprítomnosti vzájomných súvisov s ochranou pri dengue je potrebné plne porozumieť
klinickej relevantnosti údajov imunogenicity.
Údaje imunogenicity u subjektov vo veku od 4 do 16 rokov v endemických oblastiachGMT podľa východiskového sérostatusu dengue u subjektov vo veku od 4 do 16 rokov v klinickej
štúdii DEN-301 sú uvedené v
Tabuľke č. 6.
T
abuľka č. 6: Imunogenicita podľa východiskového sérostatusu dengue v klinickej štúdii DEN-
301 (súbor podľa protokolu na zhodnotenie imunogenicity)
a
|
V
ýchodisková séropozitivita
|
V
ýchodisková séronegativita
|
Pred očkovaním
N = 1816*
|
1 mesiac po 2. dávke
N = 1621
|
Pred očkovaním
N = 702
|
1 mesiac po 2. dávke
N = 641
|
DEN
V-
1
GMT
95 % IS
|
411,3 (366,0; 462,2)
|
2115,2 (1957,0; 2286,3)
|
5,0
NE*
|
184,2 (168,6; 201,3)
|
DEN
V-
2
GMT
95 % IS
|
753,1 (681,0; 832,8)
|
4897,4 (4645,8; 5162,5)
|
5,0
NO**
|
1729,9 (1613,7; 1854,6)
|
DEN
V-
3
GMT
95 % IS
|
357,7 (321,3; 398,3)
|
1761,0 (1645,9; 1884,1)
|
5,0
NO**
|
228,0 (211,6; 245,7)
|
DEN
V-
4
GMT
95 % IS
|
218,4 (198,1; 240,8)
|
1129,4 (1066,3; 1196,2)
|
'
5,0
NO**
|
143,9 (133,6; 155,1)
|
N: počet hodnotených subjektov; DENV: vírus dengue; GMT: geometrický priemer titrov; IS: interval spoľahlivosti; NO:
neodhadované
a Podskupina na zhodnotenie imunogenicity bola náhodným spôsobom vybraná podskupina subjektov a súbor podľa protokolu na zhodnotenie imunogenicity bol výberom subjektov z tejto podskupiny, ktorí takisto patrili do súboru podľa
protokolu
* Pri DENV-2 a DENV-3: N = 1815
** Všetci účastníci mali hodnoty GMT pod LLOD (10), preto boli hlásení ako 5 bez hodnôt IS
Údaje imunogenicity u subjektov vo veku od 18 do 60 rokov v neendemických oblastiachImunogenicita Qdengy u dospelých vo veku od 18 do 60 rokov bola hodnotená v štúdii DEN-304,
dvojito zaslepenom, randomizovanom, placebom kontrolovanom klinickom skúšaní v 3. fáze v neendemickej krajine (USA). GMT po podaní 2. dávky sú uvedené v
Tabuľke č. 7.Tabuľka č 7: GMT neutralizujúcich protilátok proti dengue v štúdii DEN-304 (súbor podľaprotokolu)
| Východisková séropozitivita*
| Východisková séronegativita*
|
Pred očkovaním
N = 68
| 1 mesiac po 2. dávke
N = 67
|
Pred očkovaním
N = 379
| 1 mesiac po 2. dávke
N = 367
|
DENV-1
GMT
95 % IS
|
13,9 (9,5; 20,4)
|
365,1 (233,0; 572,1)
|
5,0
NO**
|
268,1 (226,3; 317,8)
|
DENV-2
GMT
95 % IS
|
31,8 (22,5; 44,8)
|
3098,0 (2233,4; 4297,2)
|
5,0
NO**
|
2956,9 (2635,9; 3316,9)
|
DENV-3
GMT
95 % IS
|
7,4 (5,7; 9,6)
|
185,7 (129,0; 267,1)
|
5,0
NO**
|
128,9 (112,4; 147,8)
|
DENV-4
GMT
95 % IS
|
7,4 (5,5; 9,9)
|
229,6 (150,0; 351,3)
|
5,0
NO**
|
137,4 (121,9; 155,0)
|
N: počet hodnotených subjektov; DENV: vírus dengue; GMT: geometrický priemer titrov; CI: interval spoľahlivosti; NO:
neodhadované
* Súhrnné údaje zo šarží 1, 2 a 3 tetravalentnej očkovacej látky proti dengue
** Všetky subjekty mali hodnoty GMT pod LLOD (10), preto boli hlásení ako 5 bez hodnôt CI
Prepojenie účinnosti vychádza z údajov o imunogenicite a z výsledkov analýzy non-inferiority
a porovnáva GMT po očkovaní u populácií s východiskovou séronegativitou dengue v štúdii DEN-301
a DEN-304
(Tabuľka č. 8). Očakáva sa ochrana pred ochorením dengue u dospelých, hoci skutočný stupeň účinnosti v porovnaní s účinnosťou pozorovanou u detí a dospievajúcich nie je známy.
Tabuľka č. 8: Podiely GMT u účastníkov s východiskovou séronegativitou dengue v štúdii DEN-301 (vek 4 – 16 rokov) a DEN-304 (vek 18 – 60 rokov) (súbor podľa protokolu na zhodnotenieimunogenicity)Podiel GMT* (95 % IS)
| DENV-1
| DENV-2
| DENV-3
| DENV-4
|
1 m. po 2. dávke
| 0,69 (0,58; 0,82)
| 0,59 (0,52; 0,66)
| 1,77 (1,53; 2,04)
| 1,05 (0,92; 1,20)
|
6 m. po 2. dávke
| 0,62 (0,51; 0,76)
| 0,66 (0,57; 0,76)
| 0,98 (0,84; 1,14)
| 1,01 (0,86; 1,18)
|
DENV: vírus dengue; GMT: geometrický priemer titrov; IS: interval spoľahlivosti; m.: mesiac (mesiace)
*Non-inferiorita: horná hranica 95 % IS menej ako 2,0.
Dlhodobé pretrvávanie protilátokDlhodobé pretrvávanie neutralizujúcich protilátok bolo preukázané v štúdii DEN-301, pričom titre sa
zachovali výrazne nad hladinami pred očkovaním pri všetkých štyroch sérotypoch až po dobu 51
mesiacov od podania prvej dávky.
5.2 Farmakokinetické vlastnostiNeuskutočnili sa žiadne farmakokinetické štúdie Qdengy.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje o bezpečnosti získané na základe obvyklých štúdií jednorazovej dávky, lokálnej znášanlivosti, toxicity po opakovanom podávaní, reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí. V štúdii distribúcie a uvoľňovania nebolo pozorované žiadne uvoľňovanie RNA Qdengy do stolice a moču, čo potvrdzuje nízke riziko uvoľňovania očkovacej látky do životného prostredia alebo prenosu z očkovacích látok. Štúdia neurovirulencie preukazuje, že Qdenga nie je neurotoxická.
Nezistilo sa síce žiadne relevantné riziko, ale relevantnosť štúdií zameraných na reprodukčnú toxicitu je obmedzená, pretože králiky nemožno použiť na infekciu vírusom dengue.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokPrášok:Dihydrát α,α-trehalózy
Poloxamér 407
Ľudský sérový albumín Dihydrogénfosforečnan draselný Hydrogénfosforečnan disodný Chlorid draselný
Chlorid sodný
Rozpúšťadlo:Chlorid sodný
Voda na injekčné podávanie
6.2 InkompatibilityNevykonali sa žiadne štúdie kompatibility, preto sa tento liek nesmie miešať s inými očkovacími látkami alebo liekmi, s výnimkou dodaného rozpúšťadla.
6.3 Čas použiteľnosti
18 mesiacov.
Po rekonštitúcii s dodaným rozpúšťadlom: Qdenga sa má ihneď použiť.
Ak sa Qdenga ihneď nepoužije, musí sa použiť do 2 hodín.
Bola preukázaná chemická a fyzikálna stabilita počas používania pri izbovej teplote (do 32,5 °C) pošas 2 hodín od rekonštituovania injekčnej liekovky s očkovacou látkou. Po uplynutí tohto času sa očkovacia látka musí zlikvidovať. Nedávajte ju späť do chladničky.
Z mikrobiologického hľadiska sa Qdenga musí použiť ihneď. Ak sa nepoužije ihneď, za časy a podmienky uchovávania počas používania zodpovedá používateľ.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale.
Podmienky na uchovávanie po rekonštitúcii Qdengy, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Qdenga prášok a rozpúšťadlo na injekčný roztok:
· Prášok (1 dávka) v sklenenej injekčnej liekovke (sklo typu I) so zátkou (butylová guma)
a hliníkovým zapečatením so zeleným vyklápacím plastovým uzáverom + 0,5 ml rozpúšťadlo
(1 dávka) v sklenenej injekčnej liekovke (sklo typu I) so zátkou (brómbutylová guma)
a hliníkovým zapečatením s fialovým vyklápacím plastovým uzáverom
Veľkosť balenia po 1 alebo 10.
Qdenga prášok a rozpúšťadlo na injekčný roztok v naplnenej injekčnej striekačke:
· Prášok (1 dávka) v injekčnej liekovke (sklo typu I) so zátkou (butylová guma) a hliníkovým
zapečatením so zeleným vyklápacím plastovým uzáverom + 0,5 ml rozpúšťadlo (1 dávka)
v naplnenej injekčnej striekačke (sklo typu I) so zátkou (brómbutyl) piestu a krytom hrotu
(polypropylén) s 2 samostatnými ihlami
Veľkosť balenia po 1 alebo 5.
· Prášok (1 dávka) v injekčnej liekovke (sklo typu I) so zátkou (butylová guma) a hliníkovým
zapečatením so zeleným vyklápacím plastovým uzáverom + 0,5 ml rozpúšťadlo (1 dávka)
v naplnenej injekčnej striekačke (sklo typu I) so zátkou (brómbutyl) piestu a krytom hrotu
(polypropylén) bez ihiel
Veľkosť balenia po 1 alebo 5.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pokyny narekonštitúciuočkovacejlátkyrozpúšťadlomdodanýmvinjekčnejliekovke
Qdenga je 2-zložková očkovacia látka, ktorá pozostáva z injekčnej liekovky obsahujúcej lyofilizovanú
očkovaciu látku a injekčnej liekovky obsahujúcej rozpúšťadlo. Lyofilizovaná očkovacia látka sa musí pred podaním rekonštituovať rozpúšťadlom.
Na rekonštitúciu a injekčné podanie Qdengy používajte len sterilné striekačky. Qdenga sa nesmie miešať v tej istej striekačke s inými očkovacími látkami.
Na rekonštitúciu Qdengy používajte iba rozpúšťadlo (0,22 % roztok chloridu sodného), ktoré sa dodáva s očkovacou látkou, pretože neobsahuje konzervačné látky ani iné antivírusové látky. Je potrebné zabrániť kontaktu s konzervačnými látkami, antiseptikami, detergentmi a inými antivírusovými látkami, pretože môžu inaktivovať očkovaciu látku.
Vyberte injekčné liekovky s očkovacou látkou a rozpúšťadlom z chladničky a nechajte ich pri izbovej
teplote približne 15 minút.
I
njekčná liekovka s rozpúšťadlom
· Odoberte uzávery z oboch injekčných liekoviek
a očistite vrch zátok injekčných liekoviek alkoholovým
tampónom.
· Nasaďte sterilnú ihlu na sterilnú 1 ml striekačku a ihlu vpichnite do injekčnej liekovky s rozpúšťadlom. Odporúča sa veľkosť ihly 23G.
· Pomaly stláčajte piest až celkom do konca.
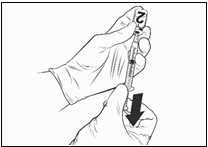
· Prevráťte injekčnú liekovku hore dnom, odoberte celý obsah injekčnej liekovky a potom vytiahnite piest po
0,75 ml. V striekačke majú byť bubliny.
· Prevráťte striekačku, aby sa bubliny premiestnili k
piestu.
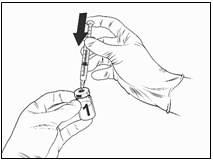
· Vpichnite ihlu nasadenú na striekačke do injekčnej
liekovky s lyofilizovanou očkovacou látkou.
· Nasmerujte prúdenie rozpúšťadla na stenu injekčnej liekovky, pričom pomaly stláčajte piest, aby sa znížila tvorba bublín.
I
njekčná liekovka
 s lyofilizovanou očkovacou látkou
R
e
konštituovaná očkovacia látka
s lyofilizovanou očkovacou látkou
R
e
konštituovaná očkovacia látka
· Uvoľnite prst z piestu, injekčnú zostavu držte na rovnom povrchu a opatrne krúživým pohybom v oboch smeroch premiešajte obsah injekčnej liekovky s pripojenou zostavou ihly a striekačky.
· NEPRETREPÁVAJTE. V rekonštituovanom lieku sa
môže tvoriť pena a bubliny.
· Počkajte chvíľu, kým nebude v zostave injekčnej
liekovky a striekačky roztok číry. Trvá to približne 30 –
60 sekúnd.
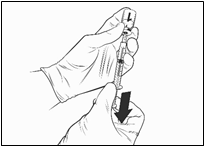
Po rekonštitúcii má byť výsledný roztok číry, bezfarebný až svetložltý, a nesmie obsahovať cudzorodé častice. Očkovaciu látku zlikvidujte, ak sú v nej čiastočky a/alebo ak je sfarbená.
R
e
konštituovaná očkovacia látka
· Odoberte celý objem rekonštituovaného roztoku Qdengy
tou istou striekačkou, kým v striekačke nebude
vzduchová bublina.
· Odpojte zostavu ihly a striekačky od injekčnej liekovky.
· Držte striekačku s ihlou smerom nahor, poklepte po stene striekačky, aby sa vzduchová bublina premiestnila nahor, vyhoďte pripojenú ihlu a nahraďte ju novou sterilnou ihlou, vytlačte vzduchovú bublinu, až kým sa na hrote ihly nevytvorí malá kvapka tekutiny. Odporúča sa veľkosť ihly 25G 16 mm.
· Qdenga je pripravená na podanie subkutánnou injekciou.
Po rekonštitúcii sa má Qdenga ihneď podať. Bola preukázaná chemická a fyzikálna stabilita počas
používania pri izbovej teplote (do 32,5 °C) po dobu 2 hodín od rekonštituovania injekčnej liekovky s očkovacou látkou. Po uplynutí tejto doby sa očkovacia látka musí zlikvidovať. Nedávajte ju späť do
chladničky. Z mikrobiologického hľadiska sa Qdenga musí použiť ihneď. Ak sa nepoužije ihneď, za
časy a podmienky uchovávania počas používania zodpovedá používateľ.

Pokyny na rekonštitúciu očkovacej látky rozpúšťadlom dodaným v naplnenej injekčnej striekačke

Qdenga je 2-zložková očkovacia látka, ktorá pozostáva z injekčnej liekovky obsahujúcej lyofilizovanú
očkovaciu látku a rozpúšťadla dodaného v naplnenej injekčnej striekačke. Lyofilizovaná očkovacia látka sa musí pred podaním rekonštituovať rozpúšťadlom.
Qdenga sa nesmie miešať v tej istej striekačke s inými očkovacími látkami.
Na rekonštitúciu Qdengy používajte iba rozpúšťadlo (0,22 % roztok chloridu sodného) v naplnenej

injekčnej striekačke, ktoré sa dodáva s očkovacou látkou, pretože neobsahuje konzervačné látky ani iné antivírusové látky. Je potrebné zabrániť kontaktu s konzervačnými látkami, antiseptikami,
detergentmi a inými antivírusovými látkami, pretože môžu inaktivovať očkovaciu látku.

Vyberte injekčnú liekovku s očkovacou látkou a naplnenú injekčnú striekačku s rozpúšťadlom
z chladničky a nechajte ich pri izbovej teplote približne 15 minút.
|
| Injekčná liekovka s lyofilizovanou
|
| očkovacou látkou
|
| | | | |
|
|
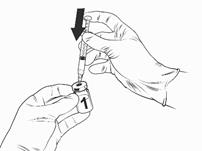
· Odoberte uzáver z injekčnej liekovky s očkovacou
látkou a očistite vrch zátky injekčnej liekovky
alkoholovým tampónom.
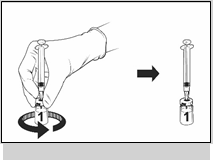
· Nasaďte sterilnú ihlu na naplnenú injekčnú striekačku a ihlu vpichnite do injekčnej liekovky s očkovacou látkou. Odporúča sa veľkosť ihly 23G.
· Nasmerujte prúdenie rozpúšťadla na stenu injekčnej liekovky, pričom pomaly stláčajte piest, aby sa znížila tvorba bublín.
 R
e
konštituovaná očkovacia látka
R
e
konštituovaná očkovacia látka
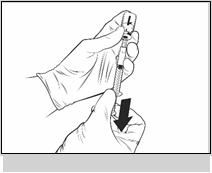
· Uvoľnite prst z piestu, injekčnú zostavu držte na rovnom povrchu a opatrne krúživým pohybom v oboch smeroch premiešajte obsah injekčnej liekovky s pripojenou zostavou ihly a striekačky.
· NEPRETREPÁVAJTE. V rekonštituovanom lieku sa
môže tvoriť pena a bubliny.
· Počkajte chvíľu, kým nebude v zostave injekčnej
liekovky a striekačky roztok číry. Trvá to približne 30 –
60 sekúnd.

Po rekonštitúcii má byť výsledný roztok číry, bezfarebný až svetložltý, a nesmie obsahovať cudzorodé
častice. Očkovaciu látku zlikvidujte, ak sú v nej čiastočky a/alebo ak je sfarbená.
 R
e
konštituovaná očkovacia látka
R
e
konštituovaná očkovacia látka
· Odoberte celý objem rekonštituovaného roztoku Qdengy
tou istou striekačkou, kým v striekačke nebude
vzduchová bublina.
· Odpojte zostavu ihly a striekačky od injekčnej liekovky.
Držte striekačku s ihlou smerom nahor, poklepte po
stene striekačky, aby sa vzduchová bublina premiestnila nahor, vyhoďte pripojenú ihlu a nahraďte ju novou sterilnou ihlou, vytlačte vzduchovú bublinu, až kým sa na hrote ihly nevytvorí malá kvapka tekutiny. Odporúča sa veľkosť ihly 25G 16 mm.
· Qdenga je pripravená na podanie subkutánnou injekciou.
Po rekonštitúcii sa má Qdenga ihneď podať. Bola preukázaná chemická a fyzikálna stabilita počas
používania pri izbovej teplote (do 32,5 °C) po dobu 2 hodín od rekonštituovania injekčnej liekovky s očkovacou látkou. Po uplynutí tejto doby sa očkovacia látka musí zlikvidovať. Nedávajte ju späť do

chladničky. Z mikrobiologického hľadiska sa Qdenga musí použiť ihneď. Ak sa nepoužije ihneď, za
časy a podmienky uchovávania počas používania zodpovedá používateľ.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIITakeda GmbH
Byk-Gulden-Str. 2
78467 Konstanz
Nemecko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/22/1699/001
EU/1/22/1699/002
EU/1/22/1699/003
EU/1/22/1699/004
EU/1/22/1699/005
EU/1/22/1699/006
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: {DD. mesiac RRRR}
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu