na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo na neomycín. Anamnéza kontaktnej dermatitídy na neomycín nie je kontraindikáciou. Alergia na vajcia, pozri časť 4.4.
Precitlivenosť po predošlom podaní očkovacích látok proti osýpkam, príušniciam, ružienke a/alebo ovčím kiahňam.
Závažná humorálna alebo bunková (primárna alebo získaná) imunodeficiencia, napr. závažná kombinovaná imunodeficiencia, agamaglobulinémia a AIDS alebo symptomatická infekcia HIV alebo vekovo špecifické percentuálne zastúpenie CD4+ T-lymfocytov u detí mladších ako 12 mesiacov: CD4+ < 25 %, detí medzi 12. a 35. mesiacom: CD4+ < 20 %, detí medzi 36. a 59. mesiacom: CD4+ < 15 % (pozri časť 4.4).
Gravidita. Okrem toho sa treba gravidite vyhnúť počas 1 mesiaca po očkovaní (pozri časť 4.6).
4.4 Osobitné upozornenia a opatrenia pri používaní
Tak ako u všetkých injekčne podávaných očkovacích látok, musí byť pre prípad zriedkavej anafylaktickej reakcie po podaní očkovacej látky vždy okamžite k dispozícii zodpovedajúca liečba a lekársky dohľad.
Alkohol a iné dezinfekčné látky sa pred podaním očkovacej látky musia nechať odpariť z kože, pretože môžu inaktivovať oslabené vírusy v očkovacej látke.
Zložka osýpok a zložka príušníc v očkovacej látke je pomnožená na bunkových kultúrach z kuracích embryí, a preto môže obsahovať stopy vaječnej bielkoviny. Osoby, ktoré majú v anamnéze anafylaktické, anafylaktoidné alebo iné okamžité reakcie (napr. generalizovanú urtikáriu, opuch úst a hrdla, dýchacie ťažkosti, hypotenziu alebo šok), ktoré nasledovali po požití vajca, môžu byť vystavené zvýšenému riziku vzniku reakcií z precitlivenosti okamžitého typu po očkovaní, aj keď sa dokázalo, že tieto typy reakcií sú veľmi zriedkavé. Jedinci, ktorí mali anafylaxiu po požití vajca, majú byť očkovaní veľmi opatrne a pre prípad výskytu takejto reakcie musí byť k dispozícii zodpovedajúca liečba anafylaxie.
Je potrebné vyhnúť sa užívaniu salicylátov počas 6 týždňov po každom očkovaní očkovacou látkou Priorix‑Tetra, pretože po použití salicylátov počas prirodzenej infekcie vírusom ovčích kiahní bol hlásený Reyeov syndróm.
Podaním očkovacej látky do 72 hodín po expozícii prirodzenému ochoreniu je možné získať obmedzenú ochranu pred osýpkami alebo ovčími kiahňami.
Febrilné kŕčeV priebehu 5 až 12 dní po podaní prvej dávky očkovacej látky Priorix‑Tetra sa v porovnaní so súbežným podaním očkovacej látky MMR a očkovacej látky proti ovčím kiahňam pozorovalo zvýšené riziko horúčky a febrilných kŕčov (pozri časti 4.8 a 5.1).
Očkovanie jedincov, ktorí majú v osobnej alebo rodinnej anamnéze výskyt kŕčov (vrátane febrilných kŕčov), je potrebné obozretne zvážiť. U týchto jedincov sa má pri podaní prvej dávky zvážiť alternatívna imunizácia samostatnou očkovacou látkou MMR a samostatnou očkovacou látkou proti ovčím kiahňam (pozri časť 4.2). V každom prípade treba očkovaných jedincov v priebehu rizikového obdobia sledovať kvôli prípadnej horúčke.
Po podaní prvej dávky očkovacích látok obsahujúcich vírus osýpok je výskyt horúčky zvyčajne vysoký. Po podaní druhej dávky sa zvýšené riziko horúčky nepreukázalo.
Imunokompromitovaní pacientiOčkovanie sa môže zvážiť u pacientov s vybranými imunodeficienciami, keď prínosy prevážia riziká (napr. asymptomatickí pacienti s HIV, deficiencie podtriedy IgG, vrodená neutropénia, chronická granulomatózna choroba a deficity zložiek komplementu).
Imunokompromitovaní pacienti, u ktorých toto očkovanie nie je kontraindikované (pozri časť 4.3), nemusia odpovedať tak dobre ako imunokompetentní pacienti, niektorí z týchto pacientov môžu preto v prípade kontaktu dostať osýpky, príušnice, ružienku a ovčie kiahne, napriek podaniu náležitej očkovacej látky. Títo pacienti sa majú pozorne sledovať na príznaky osýpok, príušníc, ružienky a ovčích kiahní.
PrenosPrenos vírusu osýpok, príušníc a ružienky z očkovaných jedincov na vnímavé kontakty nebol nikdy zaznamenaný, aj keď je známe, že dochádza k vylučovaniu vakcinačného vírusu ružienky z hltanu, a to približne po 7 až 28 dňoch po očkovaní, pričom maximálne množstvo sa vylúči okolo 11. dňa. Preukázalo sa, že veľmi zriedkavo dochádza k prenosu vakcinačného kmeňa Oka vírusu ovčích kiahní z očkovaných jedincov s vyrážkou na séronegatívne osoby, ktoré s nimi prišli do kontaktu. Prenos vakcinačného kmeňa Oka vírusu ovčích kiahní z očkovaného jedinca, u ktorého nevznikla vyrážka, na séronegatívne osoby, ktoré s ním prišli do kontaktu, nie je možné vylúčiť.
Očkovaní jedinci, dokonca aj tí, u ktorých nevznikne vyrážka podobná ovčím kiahňam, sa majú vždy, keď je to možné, snažiť vyhnúť blízkemu kontaktu s vysoko rizikovými osobami vnímavými na ovčie kiahne počas až 6 týždňov po očkovaní. V prípadoch, v ktorých sa nedá vyhnúť kontaktu s vysoko rizikovými osobami vnímavými na ovčie kiahne, sa má zvážiť možné riziko prenosu vakcinačného vírusu ovčích kiahní oproti riziku nákazy a prenosu divokého typu vírusu ovčích kiahní.
Medzi vysoko rizikové osoby, ktoré sú vnímavé na ovčie kiahne, patria:
· imunokompromitované osoby (pozri časti 4.3 a 4.4).
· gravidné ženy bez dokumentácie pozitívnej anamnézy ovčích kiahní alebo laboratórneho dôkazu o predošlej infekcii,
· novorodenci matiek bez dokumentácie pozitívnej anamnézy ovčích kiahní alebo laboratórneho dôkazu o predošlej infekcii.
Očkovacia látka Priorix-Tetra sa nesmie za žiadnych okolností podať intravaskulárne alebo intradermálne.
TrombocytopéniaPo očkovaní živou očkovacou látkou proti osýpkam, príušniciam a ružienke boli u jedincov s trombocytopéniou hlásené prípady zhoršenia trombocytopénie a prípady opakovaného výskytu trombocytopénie po podaní prvej dávky. V takýchto prípadoch sa má dôkladne zhodnotiť pomer medzi rizikom a prínosom imunizácie očkovacou látkou Priorix‑Tetra.
Títo pacienti majú byť očkovaní s opatrnosťou a prednostne subkutánnou cestou.
Synkopa (strata vedomia) sa môže vyskytnúť po, alebo dokonca pred akýmkoľvek očkovaním zvlášť u dospievajúcich ako psychogénna odpoveď na vpich ihlou. Môže to byť sprevádzané viacerými neurologickými symptómami ako je prechodná porucha zraku, parestézia a tonicko-klonické pohyby končatín počas zotavovania. Je dôležité, aby sa zaviedli postupy na predchádzanie zranenia zo straty vedomia.
Tak ako u každej očkovacej látky, ochranná imunitná odpoveď sa nemusí vyvolať u všetkých očkovaných. Ako pri iných očkovacích látkach proti ovčím kiahňam, prípady ochorenia ovčích kiahní sa vyskytli u osôb, ktoré predtým dostali Priorix-Tetra. Tieto zistené prípady sú zvyčajne mierne, s menším množstvom lézií a nižšou teplotou, v porovnaní s prípadmi u neočkovaných jedincov.
Existuje veľmi málo hlásení o diseminovaných ovčích kiahňach, so zasiahnutím vnútorných orgánov, po očkovaní očkovacou látkou obsahujúcou kmeň Oka vírusu ovčích kiahní, najmä u imunokompromitovaných osôb.
Interferencia so sérologickým testovaním (pozri časť 4.5).
4.5 Liekové a iné interakcieKlinické štúdie preukázali, že očkovacia látka Priorix‑Tetra sa môže podávať súbežne s akoukoľvek z nasledujúcich monovalentných alebo kombinovaných očkovacích látok [zahŕňajúcich hexavalentné očkovacie látky (DTPa-HBV-IPV/Hib)]: s očkovacou látkou proti diftérii-tetanu-pertussis (acelulárna zložka) (DTPa), očkovacou látkou proti
Haemophilus influenzae typ b (Hib), inaktivovanou očkovacou látkou proti poliomyelitíde (IPV), očkovacou látkou proti hepatitíde B (HBV), očkovacou látkou proti meningokokom séroskupiny B (MenB), konjugovanou očkovacou látkou proti meningokokom séroskupiny C (MenC), konjugovanou očkovacou látkou proti meningokokom séroskupín A, C, W‑135 a Y (MenACWY) a s 10‑valentnou konjugovanou pneumokokovou očkovacou látkou.
Vzhľadom na zvýšené riziko výskytu horúčky, citlivosti v mieste vpichu, zmeny stravovacích zvyklostí a podráždenosti, keď bola očkovacia látka Bexsero podávaná súbežne s očkovacou látkou Priorix‑Tetra, sa môže zvážiť podanie týchto očkovacích látok v samostatných termínoch, ak je to možné.
V súčasnosti nie sú k dispozícii dostatočné údaje podporujúce použitie očkovacej látky Priorix‑Tetra s inými očkovacími látkami.
Ak sa má očkovacia látka Priorix‑Tetra podať v rovnakom čase ako iná injekčne podávaná očkovacia látka, očkovacie látky sa vždy majú podať do rôznych miest vpichu.
Sérologické testovanieAk sa musí urobiť tuberkulínový test, má sa vykonať pred očkovaním alebo súbežne s očkovaním, pretože bolo hlásené, že kombinované očkovacie látky proti osýpkam, príušniciam a ružienke môžu spôsobiť prechodne zníženú citlivosť tuberkulínového testu. Vzhľadom na to, že táto anergia môže pretrvávať maximálne až 6 týždňov, tuberkulínový test sa nemá vykonať v priebehu takejto doby po očkovaní, aby sa zabránilo falošne negatívnym výsledkom.
U jedincov, ktorí dostali ľudský gamaglobulín alebo transfúziu krvi, sa má očkovanie odložiť aspoň o tri mesiace kvôli pravdepodobnosti zlyhania účinnosti očkovacej látky v dôsledku pasívne získaných protilátok.
Očkovaní jedinci sa majú vyhnúť používaniu salicylátov počas 6 týždňov po každom očkovaní očkovacou látkou Priorix‑Tetra (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
FertilitaOčkovacia látka Priorix-Tetra sa nehodnotila vo fertilitných štúdiách.
GraviditaGravidné ženy nesmú byť očkované očkovacou látkou Priorix-Tetra.
Pri podaní očkovacích látok proti osýpkam, príušniciam, ružienke alebo ovčím kiahňam gravidným ženám sa však nezaznamenalo poškodenie plodu.
Gravidite sa má zabrániť počas 1 mesiaca po očkovaní. Ženy, ktoré plánujú otehotnieť, majú byť poučené, aby s otehotnením počkali.
DojčenieNie sú k dispozícii dostatočné údaje o použití očkovacej látky Priorix‑Tetra u dojčiacich žien.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch očkovacej látky Priorix‑Tetra na schopnosť viesť vozidlá a obsluhovať stroje. Predpokladá sa, že očkovacia látka Priorix‑Tetra nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Zhrnutie bezpečnostného profiluNižšie uvedený bezpečnostný profil je založený na údajoch z klinických štúdií, v ktorých bolo viac ako 6 700 dávok očkovacej látky Priorix‑Tetra subkutánne podaných viac ako 4 000 deťom vo veku od 9 do 27 mesiacov. Nežiaduce udalosti sa zaznamenávali až do 42 dní po očkovaní.
Najčastejšie nežiaduce reakcie po podaní očkovacej látky Priorix-Tetra boli bolesť a začervenanie v mieste vpichu injekcie, ako aj horúčka ≥ 38 °C (meraná rektálne) alebo ≥ 37,5 °C (meraná axilárne/orálne).
Tabuľkový zoznam nežiaducich reakciíHlásené nežiaduce reakcie sú uvedené podľa nasledujúcej frekvencie:
Veľmi časté: (³ 1/10)
Časté: (³ 1/100 až < 1/10)
Menej časté: (³ 1/1 000 až < 1/100)
Zriedkavé: (³ 1/10 000 až < 1/1 000)
Veľmi zriedkavé: (< 1/10 000)
Údaje z klinických skúšaníTrieda orgánových systémov
| Frekvencia
| Nežiaduce reakcie
|
Infekcie a nákazy
| Menej časté
| infekcia horných dýchacích ciest
|
Zriedkavé
| otitis media
|
Poruchy krvi a lymfatického systému
| Menej časté
| lymfadenopatia
|
Poruchy metabolizmu a výživy
| Menej časté
| anorexia
|
Psychické poruchy
| Časté
| podráždenosť
|
Menej časté
| plač, nervozita, insomnia
|
Poruchy nervového systému
| Zriedkavé
| febrilné kŕče*
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| Menej časté
| rinitída
|
Zriedkavé
| kašeľ, bronchitída
|
Poruchy gastrointestinálneho traktu
| Menej časté
| zväčšenie príušnej žľazy, hnačka, vracanie
|
Poruchy kože a podkožného tkaniva
| Časté
| vyrážka
|
Celkové poruchy a reakcie v mieste podania
| Veľmi časté
| bolesť a začervenanie v mieste vpichu, horúčka (meraná v konečníku ³ 38 °C ‑ £ 39,5 °C; meraná v podpazuší/ústach: ³ 37,5 °C ‑ £ 39 °C)**
|
Časté
| opuch v mieste vpichu, horúčka (meraná v konečníku > 39,5°C; meraná v podpazuší/ústach > 39 °C)**
|
Menej časté
| letargia, malátnosť, únava
|
* V retrospektívnej analýze údajov z databázy sa hodnotilo riziko febrilných kŕčov po očkovaní detí vo veku od 9 do 30 mesiacov prvou dávkou očkovacej látky Priorix‑Tetra v porovnaní s očkovacou látkou MMR alebo súbežným očkovaním samostatnou očkovacou látkou MMR a samostatnou očkovacou látkou proti ovčím kiahňam.
Do štúdie bolo zahrnutých 82 656 detí imunizovaných očkovacou látkou MMRV, 149 259 detí imunizovaných očkovacou látkou MMR a 39 203 detí imunizovaných samostatnou očkovacou látkou MMR a samostatnou očkovacou látkou proti ovčím kiahňam.
V závislosti od definície prípadu použitej na identifikáciu febrilných kŕčov v hlavnom rizikovom období 5 až 12 dní po prvej dávke bol výskyt febrilných kŕčov 2,18 (95 % IS: 1,38; 3,45) alebo 6,19 (95 % IS: 4,71; 8,13) na 10 000 jedincov v skupine s MMRV a 0,49 (95 % IS: 0,19; 1,25) alebo 2,55 (95 % IS: 1,67; 3,89) na 10 000 jedincov v zodpovedajúcich kontrolných skupinách.
Tieto údaje poukazujú na jeden dodatočný prípad febrilných kŕčov na 5 882 alebo 2 747 jedincov očkovaných očkovacou látkou Priorix‑Tetra v porovnaní so zodpovedajúcimi kontrolnými skupinami, v ktorých jedinci dostali očkovaciu látku MMR alebo súbežne dostali samostatnú očkovaciu látku MMR a samostatnú očkovaciu látku proti ovčím kiahňam (pripísateľné riziko 1,70 (95 % IS:‑1,86; 3,46) a 3,64 (95 % IS: ‑6,11; 8,30) na 10 000 jedincov, v uvedenom poradí) ‑ pozri časť 5.1.
**Po aplikácii prvej dávky kombinovanej očkovacej látky proti osýpkam, príušniciam, ružienke a ovčím kiahňam bola v porovnaní so súbežnou aplikáciou očkovacej látky proti osýpkam, príušniciam, ružienke a očkovacej látky proti ovčím kiahňam v samostatných miestach aplikácie, pozorovaná vyššia incidencia horúčky (približne 1,5‑krát).
Neuskutočnili sa žiadne klinické štúdie s očkovacou látkou Priorix‑Tetra (MMRV) u osôb vo veku > 6 rokov. Bezpečnostný profil očkovacej látky Priorix‑Tetra u osôb vo veku > 6 rokov je extrapolovaný z dostupných údajov o očkovacej látke MMR (Priorix) a monovalentnej očkovacej látke obsahujúcej kmeň Oka vírusu ovčích kiahní (Varilrix) (obe od spoločnosti GlaxoSmithKline). Spektrum nežiaducich reakcií ako horúčka, vyrážka, bolesť v mieste vpichu, opuch v mieste vpichu a začervenanie v mieste vpichu u osôb vo veku > 6 rokov, ktoré dostali Priorix alebo Varilrix, bol porovnateľný so spektrom nežiaducich reakcií pozorovaným u detí vo veku < 6 rokov, ktoré dostali očkovaciu látku Priorix‑Tetra. V týchto klinických štúdiách sa získali dôkazy umožňujúce dospieť k záveru, že druhá dávka očkovacej látky MMR je lepšie znášaná v zmysle horúčky ako prvá dávka, zatiaľ čo reaktogenita očkovacej látky proti ovčím kiahňam zvyčajne zostáva podobná bez ohľadu na podanú dávku. Opuch v mieste vpichu je hlásený „často“ u detí, ktoré dostali očkovaciu látku Priorix‑Tetra, kým v štúdiách s očkovacou látkou Varilrix u dospievajúcich a dospelých je hlásený „veľmi často“.
Údaje z postmarketingového pozorovaniaNasledujúce nežiaduce reakcie boli identifikované v zriedkavých prípadoch v rámci sledovania po uvedení lieku na trh. Keďže ide o dobrovoľné hlásenia z populácie neznámej veľkosti, nie je možné poskytnúť presný odhad frekvencie ich výskytu.
Trieda orgánových systémov
| Nežiaduce reakcie
|
Infekcie a nákazy
| meningitída, herpes zoster*, príznaky podobné osýpkam, príznaky podobné príušniciam (vrátane orchitídy, epididymitídy, a parotitídy)
|
Poruchy krvi a lymfatického systému
| trombocytopénia, trombocytopenická purpura
|
Poruchy imunitného systému
| alergické reakcie (vrátane anafylaktických a anafylaktoidných reakcií)
|
Poruchy nervového systému
| encefalitída, cerebelitída, cerebrovaskulárna príhoda, Guillainov‑Barrého syndróm, transverzná myelitída, periférna neuritída, príznaky podobné cerebelitíde (vrátane prechodnej poruchy chôdze a prechodnej ataxie)
|
Poruchy ciev
| vaskulitída
|
Poruchy kože a podkožného tkaniva
| multiformný erytém, vyrážka podobná ovčím kiahňam
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
| artralgia, artritída
|
* Táto nežiaduca reakcia na liek po očkovaní je taktiež dôsledkom infekcie divokým typom vírusu ovčích kiahní. Nebolo preukázané zvýšené riziko výskytu herpes zoster po očkovaní v porovnaní s infekciou divokým typom vírusu.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 Predávkovanie
Nebol hlásený žiaden prípad predávkovania.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: očkovacie látky, vírusová očkovacia látka, ATC kód J07BD54.
ÚčinnosťÚčinnosť monovalentnej očkovacej látky proti ovčím kiahňam obsahujúcej kmeň Oka (Varilrix) a očkovacej látky Priorix‑Tetra (obe od spoločnosti GlaxoSmithKline (GSK)) v prevencii ovčích kiahní sa hodnotila v rozsiahlej randomizovanej medzinárodnej klinickej štúdii, ktorá ako účinnú kontrolnú očkovaciu látku zahŕňala kombinovanú očkovaciu látku proti osýpkam‑príušniciam‑ružienke (Priorix) od spoločnosti GSK. Štúdia sa uskutočnila v Európe, kde v tom čase nebolo zavedené plošné očkovanie proti ovčím kiahňam. Deťom vo veku od 12 do 22 mesiacov boli podané buď dve dávky očkovacej látky Priorix‑Tetra so šesťtýždňovým časovým odstupom, alebo jedna dávka Varilrixu. Účinnosť očkovacej látky voči epidemiologicky potvrdeným ovčím kiahňam alebo ovčím kiahňam potvrdeným metódou PCR (polymerázovej reťazovej reakcie) akejkoľvek závažnosti (definovanej s použitím vopred špecifikovanej stupnice) a voči stredne závažným alebo závažným potvrdeným ovčím kiahňam bola preukázaná po hlavnom období sledovania trvajúcom 2 roky (medián trvania 3,2 roka). Pretrvávajúca účinnosť bola pozorovaná v tej istej štúdii počas období dlhodobého sledovania trvajúcich 6 rokov (medián trvania 6,4 roka) a 10 rokov (medián trvania 9,8 roka). Údaje sú uvedené v nasledujúcej tabuľke.
Skupina
| Čas hodnotenia
| Účinnosť voči potvrdeným ovčím kiahňam akejkoľvek závažnosti
| Účinnosť voči stredne závažným alebo závažným potvrdeným ovčím kiahňam
|
Priorix-Tetra
(2 dávky)
N = 2 489
| 2. rok
| 94,9 %
(97,5 % IS: 92,4;96,6)
| 99,5 %
(97,5 % IS: 97,5;99,9)
|
6. rok(1)
| 95,0 %
(95 % IS: 93,6;96,2)
| 99,0 %
(95 % IS: 97,7;99,6)
|
| 10. rok(1)
| 95,4 %
(95 % IS: 94,0;96,4)
| 99,1 %
(95 % IS: 97,9;99,6)
|
Varilrix
(1 dávka)
N = 2 487
| 2. rok
| 65,4 %
(97,5 % IS: 57,2;72,1)
| 90,7 %
(97,5 % IS: 85,9;93,9)
|
6. rok(1)
| 67,0 %
(95 % IS: 61,8;71,4)
| 90,3 %
(95 % IS: 86,9;92,8)
|
| 10. rok(1)
| 67,2 %
(95 % IS: 62,3;71,5)
| 89,5 %
(95 % IS: 86,1;92,1)
|
N = počet osôb zaradených do štúdie a zaočkovaných
(1) deskriptívna analýza
EfektívnosťÚdaje o efektívnosti svedčia o vyššej miere ochrany a znížení výskytu prípadov prielomovej infekcie ovčími kiahňami po dvoch dávkach očkovacej látky obsahujúcej vírus ovčích kiahní ako po jednej dávke.
Efektívnosť dvoch dávok očkovacej látky Priorix‑Tetra v období vypuknutia ovčích kiahní v denných opatrovateľských centrách v Nemecku, kde sa plošné očkovanie proti ovčím kiahňam odporúča pre deti od 11 mesiacov veku, bola 91 % (95 % IS: 65;98) voči akémukoľvek ochoreniu a 94 % (95 % IS: 54;99) voči stredne závažnému ochoreniu.
Efektívnosť jednej dávky Varilrixu bola stanovená v rôznych typoch štúdií (štúdie uskutočnené v období vypuknutia ochorenia, retrospektívne štúdie (typu prípad-kontrola) a štúdie zamerané na údaje z databázy) a pohybovala sa v rozsahu od 20 % do 92 % voči akýmkoľvek ovčím kiahňam a od 86 % do 100 % voči stredne závažnému alebo závažnému ochoreniu.
Imunitná odpoveďImunitnú odpoveď vyvolanú očkovacou látkou Priorix‑Tetra
podávanou subkutánne hodnotilo niekoľko klinických štúdií. Titre protilátok proti osýpkam, proti príušniciam a proti ružienke boli stanovené pomocou komerčne dostupnej enzýmovej imunosorbentovej analýzy (ELISA). Okrem toho boli protilátky proti príušniciam titrované pomocou plak‑redukčného neutralizačného testu. Tieto sérologické parametre sú všeobecne akceptované ako náhradné markery pre imunitnú ochranu. Na porovnanie imunitnej odpovede proti vírusu ovčích kiahní vyvolanej očkovacou látkou Priorix‑Tetra s imunitnou odpoveďou pozorovanou pri očkovacej látke proti ovčím kiahňam od spoločnosti GSK sa použili modifikovaný komerčný nepriamy imunofluorescenčný test (IFA, medzičasom sa prestal používať) a komerčná ELISA.
V troch klinických štúdiách uskutočnených v Európe (Rakúsko, Fínsko, Nemecko, Grécko, Poľsko) približne 2 000 predtým nezaočkovaných detí vo veku od 11 do 23 mesiacov dostalo 2 dávky očkovacej látky Priorix‑Tetra so 6‑týždňovým časovým odstupom medzi dávkami. Nižšie v tabuľke je zosumarizovaná miera sérokonverzie a geometrický priemer koncentrácií/titrov protilátok (GMC/GMT).
Test na protilátky (hraničná hodnota)
| Po 1. dávke
| Po 2. dávke
|
| Miera sérokonverzie(95 % IS)
| GMC/GMT
(95 % IS)
| Miera sérokonverzie
(95 % IS)
| GMC/GMT
(95 % IS)
|
Osýpky
ELISA (150 mIU/ml)
|
96,4 %
(IS: 95,5;97,2)
|
3184,5
(IS: 3046,5;3328,7)
|
99,1 %
(IS: 98,6;99,5)
|
4828,6
(IS: 4644,3;5020,1)
|
Príušnice
ELISA (231 U/ml)
Neutralizácia (1:28)
|
91,3 %
(IS: 90,0;92,5)
95,4 %
(IS: 94,3;96,3)
|
976,7
(IS: 934,8;1020,5)
147,0
(IS: 138,6;155,8)
|
98,8 %
(IS: 98,2;99,2)
99,4 %
(IS: 98,9;99,7)
|
1564,4
(IS: 1514,6;1615,8)
478,4
(IS: 455,1;503,0)
|
Ružienka
ELISA (4 IU/ml)
|
99,7 %
(IS: 99,4; 99,9)
|
62,2
(IS: 60,0;64,5)
|
99,9 %
(IS: 99,6;100)
|
119,7
(IS: 116,4;123,1)
|
Ovčie kiahne
IFA (1:4)
ELISA
(50 mIU/ml)
|
97,2 %
(IS: 96,3;97,9)
89,4 %
(IS: 87,8;90,8)
|
97,5
(IS: 92,2;103,1)
112,0'
(IS: 93,5;134,0)
|
99,8 %
(IS: 99,5;100)
99,2 %
(IS: 98,5; 99,6)
|
2587,8
(IS: 2454,0;2728,9)
2403,9
(IS: 1962,4;2944,6)
|
Miera sérokonverzie a geometrický priemer koncentrácií/titrov protilátok boli podobné ako miera sérokonverzie a geometrický priemer koncentrácií/titrov protilátok pozorované po oddelenom očkovaní Varilrixom a Priorixom.
U dojčiat očkovaných vo veku 11 mesiacov je podiel dojčiat s ochrannými titrami proti osýpkam (t. j. > 150 mIU/ml) po prvej dávke 91 ‑ 92 %, čo je nižší ako podiel pozorovaný po podaní prvej dávky vo veku od 12 mesiacov.
Druhá dávka očkovacej látky Priorix‑Tetra spôsobila zvýšenie miery sérokonverzie a/alebo hladín protilátok proti zložkám osýpok, príušníc a ružienky očkovacej látky. Preto je najlepšie podať druhú dávku v priebehu troch mesiacov po prvej dávke, aby sa zabránilo vzniku infekcie počas časového odstupu medzi dávkami.
Údaje svedčia o vyššej účinnosti a znížení výskytu prípadov prielomovej infekcie ovčími kiahňami po dvoch dávkach očkovacej látky v porovnaní s jednou dávkou. Toto koreluje so zvýšením hladín protilátok proti ovčím kiahňam vyvolaným druhou dávkou, čo poukazuje na to, že druhá dávka antigénu vírusu ovčích kiahní pôsobí ako posilňovacia (booster) dávka.
Imunitná odpoveď vyvolaná očkovacou látkou Priorix‑Tetra podanou ako druhá dávka očkovacej látky MMR u detí vo veku 24 mesiacov až 6 rokov sa hodnotila v 2 klinických štúdiách. Deti v predchádzajúcom období dostali základné očkovanie buď očkovacou látkou MMR, alebo očkovacou látkou MMR súbežne podanou so živou oslabenou očkovacou látkou proti ovčím kiahňam. Miera séropozitivity na protilátky proti ovčím kiahňam bola 98,1 % (IFA) u detí, ktoré boli v predchádzajúcom období očkované očkovacou látkou MMR, a 100 % u detí, ktoré boli v predchádzajúcom období očkované očkovacou látkou MMR súbežne podanou so živou oslabenou očkovacou látkou proti ovčím kiahňam. Miera séropozitivity na protilátky proti osýpkam, príušniciam, ružienke bola 100 % v oboch štúdiách.
Imunitná odpoveď u detí vo veku > 6 rokovNeuskutočnili sa žiadne klinické štúdie hodnotiace imunogenicitu očkovacej látky Priorix‑Tetra u osôb vo veku > 6 rokov
. Imunogenicita očkovacej látky Priorix‑Tetra u osôb vo veku > 6 rokov bola extrapolovaná z dostupných údajov o očkovacích látkach Priorix a Varilrix.
Imunitná odpoveď u detí vo veku od 9 do 10 mesiacovKlinická štúdia uskutočnená v Ázii (Singapure) zahŕňala 300 zdravých detí vo veku 9 až 10 mesiacov v čase podania prvej dávky očkovacej látky. Z týchto jedincov, 153 dostalo 2 dávky očkovacej látky Priorix‑Tetra s 3‑mesačným časovým odstupom medzi dávkami a 147 jedincov dostalo očkovaciu látku Priorix a očkovaciu látku Varilrix. Miera sérokonverzie a geometrický priemer koncentrácií/titrov protilátok boli podobné ako miera sérokonverzie a geometrický priemer koncentrácií/titrov protilátok pozorované po oddelenom očkovaní Varilrixom a Priorixom. Miera sérokonverzie po prvej dávke očkovacej látky Priorix‑Tetra bola u všetkých antigénov, okrem antigénu vírusu osýpok, porovnateľná s mierou sérokonverzie pozorovanou u 12‑ až 24‑mesačných detí v iných klinických štúdiách. Miera sérokonverzie hlásená pre osýpky u detí vo veku 9 až 10 mesiacov po 1. dávke očkovacej látky Priorix-Tetra bola 93,3 % (95 % IS: 87,6; 96,9). Dojčatá v prvom roku života nemusia dosiahnuť dostatočnú odpoveď na zložky očkovacej látky kvôli možnej interferencii s materskými protilátkami. Z tohto dôvodu má byť druhá dávka očkovacej látky Priorix‑Tetra podaná po uplynutí troch mesiacov po prvej dávke.
Imunogenicita a bezpečnosť očkovacej látky Priorix‑Tetra podávanej intramuskulárne bola hodnotená v jednej komparatívnej štúdii uskutočnenej u 328 detí vo veku 11 ‑ 21 mesiacov, ktoré dostali 2 dávky očkovacej látky Priorix‑Tetra buď intramuskulárnou, alebo subkutánnou cestou. Štúdia preukázala porovnateľné profily imunogenicity a bezpečnosti pri obidvoch cestách podania.
Pretrvávanie imunitnej odpovede na vírusy osýpok, príušníc a ružienkyV nasledujúcej tabuľke je uvedená miera séropozitivity na protilátky proti osýpkam, príušniciam a ružienke, v zmysle percenta osôb s koncentráciou protilátok rovnou alebo vyššou ako definovaná prahová koncentrácia, ktorá bola pozorovaná v klinickom skúšaní, v ktorom sa deťom vo veku 12 ‑ 22 mesiacov podali dve dávky očkovacej látky Priorix‑Tetra (N = 2 489), po obdobiach sledovania trvajúcich 2, 6 a 10 rokov:
Čas hodnotenia
| Test na protilátky
(hraničná hodnota)
|
Osýpky
ELISA (150 mIU/ml)
| Príušnice
ELISA (231 U/ml)
| Ružienka
ELISA (4 IU/ml)
|
2. rok
| 99,1 %
| 90,5 %
| 100 %
|
6. rok
| 99,0 %
| 90,5 %
| 99,8 %
|
10. rok
| 98,5 %
| 90,0 %
| 97,7 %
|
ELISA: enzýmová imunosorbentová analýza
Keďže robustné údaje o účinnosti voči ovčím kiahňam počas až 10 rokov sú poskytnuté vyššie (pozri podčasť „Účinnosť“) a vzhľadom na to, že pri získaných imunologických údajoch nie je stanovená prahová hodnota ochrany pred ovčími kiahňami, údaje o pretrvávaní protilátok proti ovčím kiahňam nie sú poskytnuté.
Postmarketingová observačná štúdia zameraná na sledovanie bezpečnostiV retrospektívnej analýze údajov z databázy bolo hodnotené riziko febrilných kŕčov po podaní prvej dávky očkovacej látky Priorix‑Tetra u detí vo veku od 9 do 30 mesiacov (pozri časť 4.8).
5.2 Farmakokinetické vlastnosti
Neaplikovateľné.
5.3 Predklinické údaje o bezpečnosti
Štúdie toxicity po opakovanom podávaní u zvierat neodhalili žiadnu lokálnu alebo systémovú toxicitu očkovacej látky.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok:Aminokyseliny
Bezvodá laktóza
Manitol
Sorbitol
Živná pôda 199
Rozpúšťadlo:Voda na injekcie
6.2 Inkompatibility
Nevykonali sa žiadne štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
18 mesiacov.
Po rekonštitúcii sa má očkovacia látka podať ihneď, alebo uchovávať v chladničke (2 °C – 8 °C). Ak sa nepoužije do 24 hodín, musí sa zlikvidovať.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v chlade (2 °C – 8 °C).
Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah baleniaPrášok v injekčnej liekovke (sklo typu I) so zátkou (butylkaučuk).
0,5 ml rozpúšťadla v naplnenej injekčnej striekačke (sklo typu I) s piestovou zátkou (butylkaučuk) s oddelenými ihlami alebo bez ihiel v nasledujúcich veľkostiach balenia:
- s 2 oddelenými ihlami: veľkosti balenia: 1 alebo 10 ks.
- bez ihly: veľkosti balenia: 1, 10, 20 alebo 50 ks.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Rekonštituovaná očkovacia látka sa má pred podaním opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo abnormálnu zmenu fyzikálneho vzhľadu. V prípade ich výskytu očkovaciu látku nepodajte.
Očkovacia látka sa rekonštituuje pridaním celého obsahu naplnenej injekčnej striekačky s rozpúšťadlom do injekčnej liekovky obsahujúcej prášok.
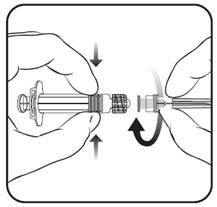
Pripojte ihlu k injekčnej striekačke
podľa pokynov uvedených pre obrázok č. 1. a obrázok č. 2, ktoré si pozorne prečítajte. Injekčná striekačka dodávaná s očkovacou látkou Priorix-Tetra sa však môže trochu odlišovať (môže byť bez skrutkovacieho závitu) od znázornenej injekčnej striekačky.
V tomto prípade sa má ihla pripojiť bez skrutkovania.


Ihla
Injekčná striekačka

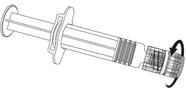
piest injekčnej striekačky
|
|


 Injekčnú striekačku vždy držte za valec a nie za piest injekčnej striekačky ani za adaptér typu Luer Lock (Luer Lock Adaptor, LLA) a ihlu držte stále v smere osi injekčnej striekačky (ako je znázornené na obrázku č. 2). Nesprávne držanie ihly môže spôsobiť zdeformovanie LLA a vytekanie očkovacej látky.
Injekčnú striekačku vždy držte za valec a nie za piest injekčnej striekačky ani za adaptér typu Luer Lock (Luer Lock Adaptor, LLA) a ihlu držte stále v smere osi injekčnej striekačky (ako je znázornené na obrázku č. 2). Nesprávne držanie ihly môže spôsobiť zdeformovanie LLA a vytekanie očkovacej látky.Ak počas manipulácie s injekčnou striekačkou dôjde k odpojeniu LLA, má sa použiť nová dávka očkovacej látky (nová injekčná striekačka a injekčná liekovka).
1. Odskrutkujte uzáver injekčnej striekačky tak, že ho otočíte proti smeru hodinových ručičiek (ako je znázornené na obrázku č. 1).
2. Pripojte ihlu k injekčnej striekačke tak, že kónus ihly jemne priložíte k LLA a pootočíte ho o štvrtinu otočky v smere hodinových ručičiek, až kým sa nezablokuje (ako je znázornené na obrázku č. 2).
3. Odstráňte ochranný kryt ihly, čo môže ísť ťažšie.
4. Pridajte rozpúšťadlo k prášku. Zmes sa má dobre pretrepať, až kým sa prášok v rozpúšťadle úplne nerozpustí.
Farba rekonštituovanej očkovacej látky sa kvôli miernym zmenám jej pH môže meniť od číro ružovkastožltej po fuksiovo ružovú. Toto je normálne a nemá to nepriaznivý vplyv na účinnosť očkovacej látky. V prípade výskytu inej zmeny očkovaciu látku nepodajte.
5. Do injekčnej striekačky natiahnite celý obsah injekčnej liekovky.
6. Na podanie očkovacej látky sa má použiť nová ihla.
Odskrutkujte ihlu z injekčnej striekačky a pripojte k nej ihlu tak, že zopakujete vyššie uvedený krok č. 2.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
GlaxoSmithKline Slovakia s.r.o.
Galvaniho 7/A
821 04 Bratislava
Slovenská republika
8. REGISTRAČNÉ ČÍSLO
59/0298/07-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 30. augusta 2007
Dátum posledného predĺženia registrácie: 30. apríla 2012
10. DÁTUM REVÍZIE TEXTU05/2020