iu na kontrastnú látku,
- máte zníženú funkciu obličiek.Používanie niektorých kontrastných látok s obsahom gadolínia sa u pacientov s týmito stavmi spájalo s ochorením nazývaným nefrogénna systémová fibróza (NSF). NSF je ochorenie zahŕňajúce zhrubnutie kože a spojivových tkanív. NSF môže viesť k oslabeniu pohyblivosti kĺbov, svalovej slabosti alebo poškodeniu funkcie vnútorných orgánov, ktoré môžu byť potenciálne život ohrozujúce.
- máte závažné ochorenie srdca a krvných ciev,
- máte nízke hladiny draslíka,
- ste niekedy mali alebo niekto z vašej rodiny problémy s elektrickým rytmom srdca (syndróm dlhého intervalu QT),
- ste mali zmeny srdcového rytmu alebo srdcovej frekvencie po užívaní liekov.
Ak sa vás týkajú niektoré z týchto bodov, povedzte to svojmu lekárovi pred tým, než dostanete Primovist.
Váš lekár rozhodne, či sa môže vykonať plánované vyšetrenie, alebo nie.
- Po použití Primovistu sa môžu vyskytnúť alergii podobné reakcie. Sú možné závažné reakcie.
Môžu sa vyskytnúť oneskorené reakcie (po hodinách alebo dňoch) (pozrite časť 4 „Možné vedľajšie
účinky“).
- Ak máte v tele kardiostimulátor alebo akékoľvek implantáty alebo svorky obsahujúce železo, povedzte to svojmu lekárovi.
Povedzte svojmu lekárovi, ak:
· vaše obličky nepracujú správne
· vám nedávno transplantovali pečeň alebo očakávate, že vám ju budú čoskoro transplantovať
Pred tým, ako sa lekár rozhodne použiť Primovist sa môže rozhodnúť vykonať krvné testy, aby preveril, nakoľko správne vaše obličky pracujú, najmä ak ste vo veku 65 rokov alebo starší.
Deti a dospievajúciBezpečnosť a účinnosť Primovistu u pacientov mladších ako 18 rokov nebola stanovená, z dôvodu obmedzených skúseností s jeho použitím v tejto vekovej skupine. Ďalšie informácie týkajúce sa použitia Primovistu u detí sú uvedené na konci tejto písomnej informácie pre používateľa.
Iné lieky a PrimovistAk teraz užívate alebo ste v poslednom čase užívali, či práve budete užívať ďalšie lieky, povedzte to svojmu lekárovi. Týka sa to najmä:
- beta-blokátorov, liekov používaných na liečbu vysokého krvného tlaku alebo iných ťažkostí so srdcom,
- liekov, ktoré menia srdcový rytmus alebo srdcovú frekvenciu (napr. amiodarón, sotalol),
- rifampicínu (liek, ktorý sa používa na liečbu tuberkulózy).
Tehotenstvo a dojčenieTehotenstvoAk ste tehotná alebo ak si myslíte, že môžete byť tehotná, musíte to oznámiť svojmu lekárovi, pretože ak
to nie je úplne nevyhnutné, Primovist sa počas tehotenstva nemá používať.
DojčenieAk dojčíte alebo chcete začať dojčiť, povedzte to svojmu lekárovi. Váš lekár s vami prediskutuje, či máte
pokračovať v dojčení alebo máte dojčenie prerušiť na obdobie 24 hodín po podaní Primovistu.
Primovist obsahuje sodíkPrimovist obsahuje 82 mg sodíka v jednej dávke Primovistu (na základe priemerného množstva podávaného osobám s hmotnosťou 70 kg). Toto sa musí zohľadniť ak máte diétu s kontrolovaným prísunom sodíka.
3. Ako používať PrimovistPrimovist podáva injekčne lekár prostredníctvom malej ihly do žily. Primovist sa bude podávať tesne pred
vyšetrením NMR.
Po injekčnom podaní vás budú najmenej 30 minút pozorovať.
Odporučené dávkovanie Skutočná dávka Primovistu, ktorá je pre vás správna, bude závisieť od vašej telesnej hmotnosti:
0,1 ml Primovistu na kg telesnej hmotnosti.
Dávkovanie u osobitných skupín pacientovU pacientov so závažnými problémami s obličkami alebo u pacientov, ktorým nedávno transplantovali pečeň alebo u tých, ktorí očakávajú, že im ju budú čoskoro transplantovať sa použitie Primovistu neodporúča. Ak sa však jeho použitie vyžaduje, máte počas vyšetrenia dostať iba jednu dávku Primovistu a v priebehu nasledujúcich aspoň 7 dní nesmiete dostať ďalšiu injekciu.
Starší pacientiAk máte 65 rokov alebo viac, nie je potrebné upravovať vašu dávku, ale môžu vám vykonať krvné
testy, aby sa zistilo, nakoľko správne vaše obličky pracujú.
Ďalšie informácie o podávaní a manipulácii s Primovistom sú uvedené na konci tejto písomnej informácie pre používateľa.
Ak použijete viac Primovistu, ako máte Predávkovanie nie je pravdepodobné. Ak k nemu dôjde, lekár bude liečiť všetky následné príznaky.
4. Možné vedľajšie účinkyTak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
Väčšina vedľajších účinkov sú mierne až stredne závažné.
Najčastejšie pozorované vedľajšie účinky u pacientov, ktorí dostali Primovist (môžu postihnúť 5 alebo viac z 1000 pacientov) sú nevoľnosť (pocit na vracanie), bolesť hlavy, pocit horúčavy, zvýšený tlak krvi, bolesť chrbta a závrat.
Najzávažnejším vedľajším účinkom u pacientov, ktorým sa podal Primovist je anafylaktický šok (závažná reakcia podobná alergickej).
Ako pri iných kontrastných látkach, v zriedkavých prípadoch sa môžu vyskytnúť alergii podobné reakcie, vrátane veľmi zriedkavých prípadov závažných reakcií (šok), ktoré môžu vyžadovať okamžitý lekársky zásah. Mierny opuch tváre, pier, jazyka alebo hrdla, kašeľ, svrbenie, nádcha, kýchanie a žihľavka (vyrážky ako od žihľavy) môžu byť prvými znakmi vzniku závažnej reakcie.
Ak sa u vás vyskytne akýkoľvek z týchto príznakov alebo ak máte dýchacie ťažkosti, ihneď to povedzte pracovníkom oddelenia NMR.Hodiny až dni po podaní Primovistu sa môžu vyskytnúť oneskorené reakcie. V takomto prípade to povedzte vášmu lekárovi alebo rádiológovi.
Nižšie uvádzame zoznam hlásení/výskytu vedľajších účinkov podľa frekvencie:
Časté
Môžu postihovať až 1 pacienta z 10
| Menej časté
Môžu postihovať až 1 pacienta zo 100
| Zriedkavé
Môžu postihovať až 1 pacienta z 1 000
| Neznáme
Častosť nemožno odhadnúť z dostupných údajov
|
Bolesť hlavy
Nevoľnosť (pocit na vracanie)
| Pocit, že sa točíte (závrat)
Pocit nestability
Znížená citlivosť a mravčenie
Problémy s vnímaním chuti
Problémy s čuchom
Návaly tepla
Zvýšenie krvného tlaku
Dýchacie ťažkosti
Vracanie
Sucho v ústach
Kožné vyrážky
Závažné svrbenie*
Bolesť chrbta
Bolesť na hrudníku
Reakcia v mieste vpichu**
Pocit tepla
Zimnica
Únava
Abnormálne pocity
| Nepokoj (neschopnosť sedieť alebo stáť v pokoji)
Tras
Abnormálne silná alebo rýchla činnosť srdca (palpitácia)
Nepravidelná činnosť srdca (znaky srdcovej blokády)
Nepríjemný pocit v ústach
Zvýšená tvorba slín
Červená kožná vyrážka s pupienkami alebo škvrnami
Zvýšené potenie
Pocit nepohodlia
Celkovo sa necítite dobre
| Zrýchlený srdcový rytmus
Nepokoj
Precitlivenosť / reakcia podobná alergickej [napr. šok, nízky tlak krvi, opuch jazyka alebo hrdla, vyrážky (vyrážka typu žihľavky), opuch tváre, nádcha, zápal spojoviek, bolesť žalúdka, znížený pocit citlivosti alebo citlivosť kože, kýchanie, kašeľ, svrbenie, bledá koža]
|
*Závažné svrbenie (generalizované svrbenie – vyskytujúce sa na celom tele, svrbenie očí)
** Reakcie v mieste vpichu (rôzne druhy) zahŕňajú tieto pojmy: presakovanie kontrastnej látky a krvácanie do priľahlých tkanív v mieste vpichu injekcie, pálenie v mieste vpichu injekcie, pocit chladu v mieste vpichu injekcie, podráždenie v mieste vpichu injekcie, bolesť v mieste vpichu injekcie.
Nasledovné vedľajšie účinky boli v niektorých prípadoch život ohrozujúce alebo smrteľné: šok a problémy s dýchaním.
Zmeny laboratórnych hodnôt sa môžu vyskytnúť krátko po podaní Primovistu. Preto, ak budete dávať krv alebo moč na rozbor, informujte zdravotnícky personál, že ste nedávno absolvovali vyšetrenie s podaním Primovistu.
V súvislosti s použitím iných kontrastných látok obsahujúcich gadolínium sa hlásili prípady nefrogénnej systémovej fibrózy (ktorá zapríčiňuje stvrdnutie kože a môže mať vplyv taktiež na mäkké tkanivo a vnútorné orgány) .
Hlásenie vedľajších účinkovAk sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo rádiológa. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Vedľajšie účinky môžete hlásiť aj priamo prostredníctvom národného systému hlásenia uvedeného v
Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať PrimovistTento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na štítku striekačky alebo škatuľke po EXP. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Tento liek nevyžaduje žiadne špeciálne podmienky na uchovávanie.
Tento liek sa musí použiť okamžite po otvorení.
Tento liek je číry, bezfarebný až žltkastý roztok. Pred použitím sa musí vizuálne skontrolovať. Tento liek sa nesmie použiť v prípade závažnej zmeny farby, výskytu mechanických nečistôt alebo poškodeného obalu.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo Primovist obsahuje
- Liečivo je disodná soľ kyseliny gadoxetovej. Každý ml obsahuje 0,25 mmol disodnej soli kyseliny gadoxetovej (čo zodpovedá 181,43 mg disodnej soli kyseliny gadoxetovej).
- Ďalšie zložky sú trojsodná soľ kyseliny kaloxetovej; trometamol, hydroxid sodný (na úpravu pH), kyselina chlorovodíková (na úpravu pH) a voda na injekciu.
1 naplnená injekčná striekačka s 5,0 ml obsahuje 907 mg disodnej soli kyseliny gadoxetovej,
1 naplnená injekčná striekačka so 7,5 ml obsahuje 1361 mg disodnej soli kyseliny gadoxetovej [len sklenená naplnená injekčná striekačka],
1 naplnená injekčná striekačka s 10,0 ml obsahuje 1814 mg disodnej soli kyseliny gadoxetovej.
Ako vyzerá Primovist a obsah baleniaPrimovist je číra, bezfarebná až žltkastá tekutina bez viditeľných čiastočiek.
Obsahy balení sú:
1, 5 alebo 10 naplnených injekčných striekačiek s 5,0 ml injekčného roztoku (v 10 ml sklenenej/plastovej naplnenej injekčnej striekačke)
1, 5 alebo 10 naplnených injekčných striekačiek so 7,5 ml injekčného roztoku (v 10 ml sklenenej naplnenej injekčnej striekačke) [len sklenené naplnené injekčné striekačky]
1, 5 alebo 10 naplnených injekčných striekačiek s 10,0 ml injekčného roztoku (v 10 ml sklenenej/plastovej naplnenej injekčnej striekačke)
Nie všetky veľkosti balenia musia byť uvedené na trh.
Držiteľ rozhodnutia o registrácii a výrobca
Bayer Pharma AG
Müllerstrasse 178
133 53 Berlín
Nemecko
Tento liek je pod názvom Primovist schválený v nasledovných členských štátoch Európskeho hospodárskeho priestoru (EHP): Rakúsko, Belgicko, Chorvátsko, Cyprus, Česká republika, Estónsko, Fínsko,
Nemecko, Grécko, Maďarsko, Írsko, Taliansko, Lotyšsko, Litva, Luxembursko, Malta, Holandsko,
Nórsko, Poľsko, Portugalsko, Slovenská republika, Slovinsko, Španielsko, Švédsko, Veľká Británia.
Táto písomná informácia pre používateľa bola naposledy aktualizovaná v 12/2015.-----------------------------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre lekárov a zdravotníckych pracovníkov:
·
Poškodenie obličiekPred podaním Primovistu sa odporúča, aby sa všetci pacienti podrobili skríningu dysfunkcie obličiek pomocou laboratórnych vyšetrení.U pacientov s akútnym alebo chronickým ťažkým poškodením funkcie obličiek (GFR < 30 ml/min/1,73 m
2) sú hlásenia o nefrogénnej systémovej fibróze (NSF) spojenej s používaním niektorých iných kontrastných látok obsahujúcich gadolínium. Pacienti, ktorí podstupujú transplantáciu pečene sú vystavení osobitnému riziku, pretože výskyt akútneho renálneho zlyhania je v tejto skupine vysoký. Keďže pri používaní Primovistu existuje možnosť výskytu NSF, u pacientov s ťažkým poškodením funkcie obličiek a u pacientov v perioperačnom období transplantácie pečene sa treba jeho použitiu vyhnúť, pokiaľ nie je diagnostická informácia nevyhnutná a nedá sa získať nekontrastným zobrazovaním NMR. Ak sa použitiu Primovistu nemožno vyhnúť, dávka nemá prekročiť 0,025 mmol/kg telesnej hmotnosti. Počas vyšetrenia na nesmie použiť viac ako jedna dávka. Z dôvodu chýbajúcich informácií o opakovanom podávaní sa injekcie Primovistu nesmú opakovať pokiaľ nie je interval medzi injekciami minimálne 7 dní.
Keďže u starších pacientov môže byť renálny klírens kyseliny gadoxetovej poškodený, je osobitne dôležité pacientov vo veku 65 rokov a starších podrobiť skríningu dysfunkcie obličiek.
Hemodialýza krátko po podaní Primovistu môže byť prospešná na odstránenie Primovistu z organizmu. Neexistujú dôkazy, ktoré podporujú zavedenie hemodialýzy na prevenciu alebo na liečbu NSF u pacientov, u ktorých sa doposiaľ hemodialýza nevykonávala.
·
Tehotenstvo a dojčeniePrimovist sa nemá používať počas gravidity pokiaľ si klinický stav ženy nevyžaduje použitie kyseliny gadoxetovej.
Pokračovanie v dojčení alebo prerušenie dojčenia na obdobie 24 hodín po podaní Primovistu má byť na uvážení lekára a dojčiacej matky.
·
Pediatrická populáciaObservačná štúdia bola vykonaná u 52 pediatrických pacientov (vo veku> 2 mesiace a <18 rokov).
Pacienti podstúpili magnetickú rezonanciu pečene s podaním Primovistu, s cieľom vyhodnotiť prítomnosť suspektných alebo potvrdených fokálnych lézií pečene. '
Porovnanie snímok pečene z kombinovanej magnetickej rezonancie bez použitia a s použitím kontrastnej látky a snímok pečene z magnetickej rezonancie bez použitia kontrastnej látky poskytlo ďalšie diagnostické informácie. Boli hlásené závažné nežiaduce účinky, avšak u žiadneho z nich nebola preukázaná súvislosť s použitím Primovistu. Z výsledkov štúdie nie je možné vyvodiť konečné rozhodnutie o účinnosti a bezpečnosti použitia v tejto populácii, z dôvodu retrospektívneho charakteru štúdie a malého počtu pacientov zahrnutých do tejto štúdie.
·
Pred podaním injekciePrimovist je číry, bezfarebný až žltkastý roztok bez viditeľných čiastočiek. Kontrastná látka sa musí pred použitím vizuálne skontrolovať. Kontrastná látka sa nesmie použiť v prípade závažnej zmeny farby, výskytu mechanických nečistôt alebo poškodeného obalu.
·
Podanie Primovist sa má podávať neriedený ako intravenózna bolusová injekcia pri prietoku približne 2 ml/s. Po injekcii kontrastnej látky sa intravenózna kanyla/hadička musí prepláchnuť fyziologickým roztokom chloridu sodného (9 mg/ml).
- Pacient má byť pozorovaný minimálne 30 minút po podaní injekcie.
- Primovist sa nesmie miešať s inými liekmi.
- Intramuskulárne podanie sa musí zamedziť.
·
ManipuláciaPrimovist je pripravený na použitie.
Naplnená injekčná striekačka sa musí vybrať z obalu a pripraviť na injekciu tesne pred vyšetrením.
Viečko sa musí z naplnenej injekčnej striekačky odstrániť tesne pred použitím.
Roztok, ktorý sa nepoužil pri vyšetrení, sa musí odstrániť podľa národných požiadaviek.
Na záznam z vyšetrenia pacienta sa má nalepiť odlepovací označovací štítok z injekčných striekačiek, aby bolo možné presne zaznamenať, ktorá kontrastná látka obsahujúca gadolínium sa použila. Má sa zaznamenať aj použitá dávka.
Ak sa používa elektronická zdravotná dokumentácia, má sa do záznamu z vyšetrenia pacienta vložiť názov lieku, číslo šarže a použitá dávka.
Sklenená naplnená injekčná striekačka:
1.
|
|
|

|
| 
|
1. Otvorte balenie
|
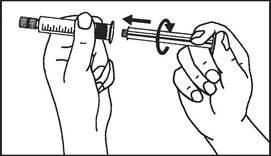
| 2. Piest zaskrutkujte na injekčnú striekačku
|

|
| 
|
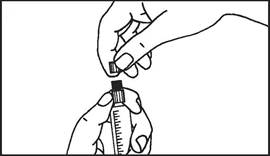
3. Odlomte ochranný kryt
|
| 4. Odstráňte ochranný kryt
|

|
| 
|
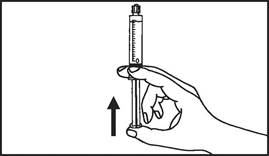
5. Odstráňte gumový uzáver
|
| 6. Vytlačte vzduch z injekčnej striekačky
|
Plastová naplnená injekčná striekačka:
RUČNÉ PODANIE INJEKCIE
|
| PODANIE INJEKCIE POMOCOU INJEKTORA
|
|
| 
|
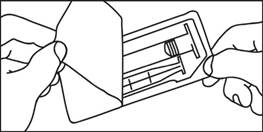
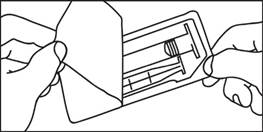
1. Otvorte balenie
|
| 1. Otvorte balenie
|
|
| 
|
2. Vyberte injekčnú striekačku a piest z obalu
|
| 2. Vyberte injekčnú striekačku z obalu
|

|
| 
|
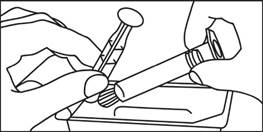
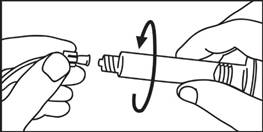
3. Zasuňte piest do injekčnej striekačky otáčaním v smere hodinových ručičiek
|
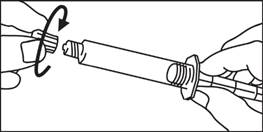
| 3. Odskrutkujte uzáver
|
|
| 
|
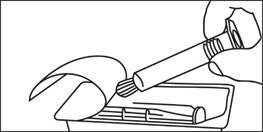
 4. Odskrutkujte uzáver 4. Odskrutkujte uzáver
|
| 4. Pripojte pripájací kužeľ injekčnej striekačky na hadičku injektora a pokračujte podľa pokynov výrobcu injektora
|
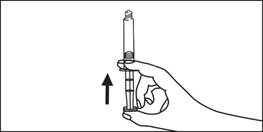
5. Vytlačte vzduch z injekčnej striekačky
|
|
Ďalšie informácie týkajúce sa použitia Primovistu sú uvedené v časti 3 tejto písomnej informácie pre používateľa.