
alebo 4. stupňa podľa NYHA* alebo pretrvávajúci pokles LVEF**
Oddialenie liečby a sledovanie až do návratu. Pri pretrvávajúcom poklese LVEF** o ≥ 15 %
oproti východiskovej hodnote zvážiť prerušenie
liečby.
| * NYHA: Newyorské kardiologické združenie
** LVEF: ejekčná frakcia ľavej komory
|
Osobitné skupiny pacientov
Pediatrická populácia
Bezpečnosť a účinnosť lieku Pixuvri u detí vo veku do 18 rokov neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Starší pacienti
U starších pacientov (vo veku ≥ 65 rokov) nie je potrebná úprava dávky.
Pacienti s poškodením funkcie obličiek
Bezpečnosť a účinnosť lieku Pixuvri sa nestanovili u pacientov s poškodením funkcie obličiek. Pacienti s hladinou sérového kreatinínu > 1,5 x horný limit normálneho rozsahu (ULN) boli vylúčení z randomizovanej štúdie. Liek Pixuvri sa má teda používať opatrne u pacientov s poškodením
funkcie obličiek.
Pacienti s poškodením funkcie pečene
Bezpečnosť a účinnosť lieku Pixuvri sa nestanovil3i u pacientov s poškodením funkcie pečene. Liek
Pixuvri sa má používať opatrne u pacientov s miernym alebo stredne závažným poškodením funkcie pečene. Liek Pixuvri sa neodporúča používať u pacientov, ktorí majú závažne poškodenú exkrečnú funkciu pečene (pozri časť 4.3).
Pacienti so slabým stavom výkonnosti
V súčasnosti nie sú k dispozícii žiadne informácie o bezpečnosti a účinnosti u pacientov so slabým stavom výkonnosti (ECOG > 2). Pri liečbe takýchto pacientov je potrebné postupovať opatrne.
Spôsob podávania
Liek Pixuvri je len na intravenózne použitie. Bezpečnosť intratekálneho použitia sa nestanovila.
Liek Pixuvri je určený na podávanie formou pomalej intravenóznej infúzie pomocou zabudovaného filtra (v trvaní najmenej 60 minút) len po rekonštitúcii s 5 ml injekčného roztoku chloridu sodného
9 mg/ml (0,9 %) a po následnom zriedení injekčným roztokom chloridu sodného 9 mg/ml (0,9 %) na konečný
objem 250 ml.
Pokyny na rekonštitúciu a riedenie lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
- precitlivenosť na pixantrón dimaleát alebo na ktorúkoľvek z pomocných látok uvedených v časti
6.1,
- imunizácia vakcínami obsahujúcimi živé vírusy,
- závažná supresia kostnej drene,
- závažná abnormálna funkcia pečene.
4.4 Osobitné upozornenia a opatrenia pri používaní
Liečbe liekom Pixuvri musí vždy predchádzať dôkladné počiatočné vyhodnotenie krvného obrazu, hladín celkového bilirubínu v sére, hladín celkového kreatinínu v sére, ako aj funkcie srdca zmeraním ejekčnej frakcie ľavej komory (LVEF).
Myelosupresia
Môže sa vyskytnúť závažná myelosupresia. Pacienti liečení liekom Pixuvri môžu trpieť myelosupresiou
(neutropénia, leukopénia, anémia, trombocytopénia a lymfopénia), pričom prevládajúcim prejavom je neutropénia. Pri odporúčanej dávke a dávkovacej schéme je neutropénia zvyčajne prechodná a najnižšiu hodnotu dosahuje na 15. až 22. deň po podaní v 1., 8. a 15. deň, pričom normálna hladina sa dosiahne zvyčajne do 28. dňa.
Je potrebné pozorne sledovať počet krvných buniek vrátane počtu leukocytov, červených krviniek, krvných doštičiek a absolútneho počtu neutrofilov. Podľa inštitucionálnych usmernení alebo usmernení Európskej spoločnosti pre lekársku onkológiu (ESMO) sa môžu použiť rekombinantné hematopoetické rastové faktory. Mala by sa zvážiť úpravy dávky (pozri časť 4.2).
Kardiotoxicita
Počas liečby alebo po liečbe liekom Pixuvri sa môžu vyskytnúť zmeny vo funkcii srdca vrátane zníženej hodnoty LVEF alebo kongestívneho zlyhávania srdca s následkom smrti (CHF).
Aktívne alebo skryté kardiovaskulárne ochorenie, predchádzajúca liečba antracyklínmi alebo antracéndiónmi, predchádzajúca alebo súbežná rádioterapia mediastinálnej oblasti alebo súbežné použitie iných kardiotoxických liekov môžu zvýšiť riziko kardiotoxicity. Kardiotoxicita sa pri použití lieku Pixuvri môže vyskytnúť bez ohľadu na to, či sú prítomné rizikové faktory pre srdce.
U pacientov s ochorením srdca alebo rizikovými faktormi, ako je počiatočná hodnota LVEF < 45 % na základe multisynchronizovanej rádionuklidovej (MUGA) snímky, s klinicky významnými kardiovaskulárnymi abnormalitami (čo zodpovedá 3. alebo 4. stupňu podľa Newyorského kardiologického združenia [NYHA]), s infarktom myokardu za posledných 6 mesiacov, so závažnou arytmiou, s nekontrolovanou hypertenziou, nekontrolovanou angínou alebo s predchádzajúcou kumulatívnou dávkou doxorubicínu alebo ekvivalentu presahujúcou 450 m4g/m2, sa pred začatím liečby liekom Pixuvri má dôkladne
zvážiť pomer prínosu a rizík.
Funkcia srdca sa má sledovať pred začatím liečby liekom Pixuvri a potom v pravidelných intervaloch. Ak sa počas liečby prejaví kardiotoxicita, musí sa vyhodnotiť riziko v porovnaní s prínosmi pokračujúcej liečby liekom Pixuvri.
Sekundárne malignity
Vývoj hematologických malignít ako je sekundárna akútna myeloická leukémia (AML) alebo myelodysplastický syndróm (MDS) je známe riziko asociované s antracyklínovou liečbou a inými inhibítormi topoizomerázy II. Počas alebo po liečbe liekom Pixuvri sa môže vyskytnúť výskyt sekundárnych rakovín vrátane AML a MDS.
Infekcia
Počas klinických skúšaní boli hlásené infekcie vrátane pneumónie, celulitídy, bronchitídy a sepsy
(pozri časť 4.8). Infekcie boli spojené s hospitalizáciou, septickým šokom a smrťou. Pacienti
s neutropéniou sú náchylnejší na infekcie, hoci v klinických štúdiách sa nepozoroval zvýšený výskyt atypických, ťažko liečiteľných infekcií, ako sú systémové mykotické infekcie alebo infekcie zapríčinené oportúnnymi organizmami, ako je Pneumocystis jiroveci.
Liek Pixuvri sa nemá podávať pacientom s aktívnou, závažnou infekciou, ani pacientom
s anamnézou opakovaných alebo chronických infekcií alebo so základnými ochoreniami, ktoré môžu znamenať predispozíciu na závažnú infekciu.
Syndróm rozpadu tumoru
Pixantrón môže vyvolať hyperurikémiu v dôsledku rozsiahleho katabolizmu purínov, ktorý sprevádza rýchly rozpad neoplastických buniek vyvolaný liekom (syndróm rozpadu tumoru) a môže viesť k nerovnováhe elektrolytov, v dôsledku čoho sa môžu poškodiť obličky. U pacientov, ktorí majú vysoké riziko rozpadu tumoru (zvýšená hladina LDH, veľký objem tumoru, vysoká začiatočná hladina kyseliny močovej alebo sérová hladina fosfátov), sa musí po liečbe vyhodnotiť krvná hladina kyseliny močovej, draslíka, fosforečnanu vápenatého a kreatinínu. Potenciálne komplikácie
syndrómu rozpadu tumoru môže minimalizovať hydratácia, alkalizácia moču a profylaxia pomocou alopurinolu alebo iných látok na prevenciu hyperurikémie.
Imunizácia
Počas liečby liekom Pixuvri môže byť imunizácia neúčinná. Imunizácia pomocou vakcín obsahujúcich živé vírusy je kontraindikovaná vzhľadom na imunosupresiu spojenú s liečbou liekom Pixuvri (pozri časť 4.3).
Extravazácia
Ak sa vyskytne extravazácia, podávanie lieku sa má ihneď zastaviť a liek sa má znovu začať podávať do inej žily. Nevezikantné vlastnosti lieku Pixuvri minimalizujú riziko lokálnej reakcie po extravazácii.
Prevencia fotosenzitívnych reakcií
Fotosenzitivita je potenciálneriziko založené na neklinických údajoch in vitro a in vivo a v programe klinických skúšaní neboli hlásené žiadne potvrdené prípady. V rámci prevencie treba pacientom odporučiť, aby sa chránili pred slnkom vrátane nosenia ochranného odevu a používania ochranných krémov. Keďže väčšina fotosenzitívnych reakcií vyvolaných liekmi je zapríčinená vlnovými dĺžkami v rozsahu UV-A, odporúča sa ochranný krém , ktorý silno absorbuje UV-A.
Pacienti s diétou s kontrolovaným príjmom sodíka
Tento liek obsahuje približne 1 000 mg (43 mmolov) sodíka v dávke po zriedení. To treba vziať do úvahy pri podávaní lieku pacientom, ktorí držia diétu s kontrolovaným príjmom sodíka.
4.5 Liekové a iné interakcie
U ľudí neboli hlásené žiadne liekové interakcie a neuskutočnili sa žiadne liekové interakčné štúdie u
ľudí.
I
nhibičné
štúdie in vitro
V štúdiách in vitro skúmajúcich najčastejšie izoformy ľudského cytochrómu P450 (vrátane CYP1A2,
2B6, 2C8, 2C9, 2C19, 2D6 a 3A4) sa preukázala možná zmiešaná inhibícia CYP1A2 a CYP2C8, ktorá môže mať klinický význam. Nepozorovali sa žiadne ďalšie klinicky významné interakcie
s cytochrómami CYPP450.
Teofylín: pri súbežnom podávaní teofylínu, lieku s úzkym terapeutickým indexom, ktorý sa metabolizuje primárne prostredníctvom CYP1A2, je teoretická obava, že koncentrácia tohto substrátu sa môže zvýšiť, čo povedie k toxicite teofylínu. Hladiny teofylínu sa majú pozorne sledovať v prvých týždňoch po začatí súbežnej liečby liekom Pixuvri.
Warfarín sa čiastočne metabolizuje prostredníctvom CYP1A2, a preto existuje teoretická obava týkajúca sa súbežného podávania tohto lieku a možného inhibičného účinku na jeho metabolizmus, čo by mohlo ovplyvniť jeho plánovaný účinok. V prvých dňoch po začatí súbežnej liečby liekom Pixuvri sa majú sledovať parametre koagulácie, najmä medzinárodný normalizovaný pomer (INR).
Amitriptylín, haloperidol, klozapín, ondansetrón a propranolol sa metabolizujú prostredníctvom CYP1A2, a preto existuje teoretická obava, že súbežné podávanie lieku Pixuvri môže zvýšiť krvnú hladinu tohto lieku.
Hoci sa nemohlo určiť riziko inhibície pixantrónu vo vzťahu k CYP2C8, pri súbežnom podávaní látok, ktoré sa metabolizujú primárne prostredníctvom CYP2C8, ako je repaglinid, rosiglitazón alebo paklitaxel, je potrebné postupovať opatrne, napr. pozorne sledovať nežiaduce účinky.
Na základe štúdií in vitro sa zistilo, že pixantrón je substrát pre membránové transportné proteíny P- gp/BRCP a OCT1, a látky, ktoré inhibujú tieto transportéry, môžu znížiť príjem pixantrónu pečeňou a účinnosť vylučovania pixantrónu. Pri súbežnom podávaní s liekmi, ktoré inhibujú takéto transportéry, ako je cyklosporín A alebo takrolimus, ktoré sa bežne používajú na kontrolu chronického ochorenia štep verzus hostiteľ, a s liekmi proti HIV, ako je ritonavir, sachinavir alebo nelfinavir, treba pozorne sledovať krvný obraz.
Je potrebné postupovať opatrne aj vtedy, keď sa pixantrón podáva súbežne s induktormi efluxného transportu, ako je rifampicín, karbamazepín a glukokortikoidy, pretože vylučovanie pixantrónu by sa mohlo zvýšiť s následným poklesom systémovej expozície.
4.6 Fertilita, gravidita a laktácia
Ženy v reprodukčnomveku
Ženám v reprodukčnom veku a ich partnerom sa má odporučiť, aby zabránili gravidite.
Ženy a muži musia používať účinnú antikoncepciu počas liečby a až do 6 mesiacov po liečbe.
Gravidita
Nie sú k dispozícii žiadne údaje o použití pixantrónu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3).
Liek Pixuvri sa neodporúča používať počas gravidity a u žien v reprodukčnom veku, ktoré nepoužívajú antikoncepciu.
Laktácia
Nie je známe, či sa liek Pixuvri alebo jeho metabolity vylučujú do ľudského mlieka. Riziko u novorodencov/dojčiat nemôže byť vylúčené.
Laktácia má byť počas liečby liekom Pixuvri ukončená.
Fertilita
Po opakovaných podaniach lieku Pixuvri sa v takých nízkych dávkach, ako je 0,1 mg/kg/deň, zistila u psov atrofia semenníkov závislá od dávky. Tento účinok sa u ľudí nehodnotil. Liek Pixuvri môže byť spojený s narušením plodnosti podobne ako pri použití ďalších liekov zo skupiny látok poškodzujúcich kyselinu deoxyribonukleovú (DNA). Keďže účinok na plodnosť nebol stanovený, mužov treba informovať, aby počas liečby a 6 mesiacov po liečbe používali antikoncepčné metódy (prednostne bariérové), čo umožní dozretie nových spermií. Na zabránenie rizika dlhodobej neplodnosti treba zvážiť uchovanie spermií v spermobanke.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNie je známe, či liek Pixuvri ovplyvňuje schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinkySúhrn bezpečnostného profiluBezpečnosť lieku Pixuvri sa hodnotila u 407 pacientov.
Najčastejšou toxicitou je supresia kostnej drene, najmä línie neutrofilov. Napriek tomu, že výskyt závažnej supresie kostnej drene s klinickými dôsledkami je relatívne nízky, pacientom liečeným liekom Pixuvri sa pozorne a často sledoval krvný obraz, najmä z dôvodu neutropénie. Výskyt závažných infekcií bol nízky a oportúnne infekcie spojené s narušením imunity sa nepozorovali.
Hoci sa zdá, že výskyt kardiotoxicity prejavujúcej sa kongestívnym zlyhávaním srdca je nižší, ako by sa predpokladalo u príbuzných liekov, ako sú antracyklíny, odporúča sa sledovať hodnotu LVEF buď na základe snímok MUGA, alebo sa odporúča vyšetrenie ECHO na stanovenie subklinickej kardiotoxicity. Skúsenosti s pixantrónom sú obmedzené na pacientov s hodnotou LVEF ≥ 45 %
a väčšina pacientov má hodnoty ≥ 50 %. Skúsenosti s podávaním lieku Pixuvri pacientom, ktorí majú výraznejšie poškodenú funkciu srdca, sú obmedzené a majú sa brať do úvahy len v kontexte
klinického skúšania. Ďalšie toxicity, ako je nauzea, vracanie a hnačka, boli zvyčajne zriedkavé, mierne, reverzibilné, kontrolovateľné a očakávané u pacientov liečených cytotoxickými liekmi. Účinky na funkciu pečene alebo obličiek boli minimálne alebo neboli žiadne.
Tabuľkovézhrnutie nežiaducich reakciíNežiaduce reakcie lieku (ADR) hlásené v súvislosti s liekom Pixuvri pochádzajú z posledných údajov zo všetkých uskutočnených štúdií. Nežiaduce reakcie lieku sú uvedené v tabuľke 3 podľa triedy orgánových systémov na základe terminológie MedDRA a podľa frekvencie: veľmi časté (≥
1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až <1/100), zriedkavé (≥ 1/10 000 až
<1/1 000), veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Tabuľka 3
Nežiaduce reakcie lieku hlásené v súvislosti s liekom
Pixuvri usporiadané podľa frekvencie v dokončených štúdiách skúmajúcich liek Pixuvri
|
Trieda orgánových systémov
| Frekvencia
| Nežiaduci účinok
|
Infekcie a nákazy
|
Časté
| Neutropenická infekcia, infekcia dýchacích ciest,
infekcia
|
Menej časté
| Bronchitída, kandidóza, celulitída, herpes zoster,
meningitída, infekcia nechtov, hubová infekcia v ústach, herpes na ústach, pneumónia,
gastroenteritída zapríčinená salmonelou, septický šok
|
Benígne a malígne nádory
vrátane nešpecifikovaných novotvarov (cysty a polypy)
|
Menej časté
|
Zhoršenie neoplazmy
Sekundárna malignita (vrátane hlásení AML a MDS)
|
Poruchy krvi a lymfatického systému*
|
Veľmi časté
| Neutropénia, leukopénia, lymfopénia, anémia, trombocytopénia
|
| Časté
| Febrilná neutropénia, porucha krvi
7
|
T
abuľka 3
N
ežiaduce reakcie lieku hlásené v súvislosti s liekom
Pixuvri usporiadané podľa frekvencie v dokončených štúdiách skúmajúcich liek Pixuvri
|
T
rieda orgánových systémov
|
F
r
ekvencia
|
N
ežiaduci účinok
|
|
M
enej časté
|
Zlyhávanie kostnej drene, eozinofília
|
Poruchy imunitného systému
|
M
enej časté
|
Precitlivenosť na liek
|
Poruchy metabolizmu a výživy
|
Č
asté
|
Anorexia, hypofosfatémia
|
M
enej časté
|
Hyperurikémia, hypokalciémia, hyponatriémia,
|
Psychické poruchy
|
M
enej časté
|
Úzkosť, nespavosť, poruchy spánku
|
Poruchy nervového systému
|
Č
asté
|
Poruchy vnímania chutí, parestézia, bolesť hlavy,
ospalosť
|
M
enej časté
|
Závraty, letargia
|
Poruchy oka
|
Č
asté
|
Konjunktivitída
|
M
enej časté
|
Suché oko, keratitída
|
Poruchy ucha a labyrintu
|
M
enej časté
|
Vertigo
|
Poruchy srdca a srdcovej
činnosti*
|
Č
asté
|
Dysfunkcia ľavej komory, srdcová porucha,
kongestívne zlyhávanie srdca, blokáda ramienka, tachykardia
|
M
enej časté
|
Arytmia
|
Poruchy ciev
|
Č
asté
|
Bledosť, zmena sfarbenia žíl, hypotenzia
|
M
enej časté
|
Porucha žíl
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Č
asté
|
Dyspnoe, kašeľ
|
M
enej časté
|
Pleurálna efúzia, pneumonitída, rinorea
|
Poruchy gastrointestinálneho traktu
|
Veľmi časté
|
Nauzea, vracanie
|
Č
asté
|
Stomatitída, hnačka, zápcha, abdominálna bolesť,
sucho v ústach, dyspepsia
|
M
enej časté
|
Ezofagitída, orálna parestézia, rektálna hemorágia
|
Poruchy pečene a žlčových ciest
|
M
enej časté
|
Hyperbilirubinémia
|
Poruchy kože a podkožného tkaniva*
|
Veľmi časté
|
Zmena sfarbenia kože, alopécia
|
Č
asté
|
Erytém, porucha nechtov, svrbenie
|
M
enej časté
|
Nočné potenie, petechie, makulárna vyrážka, kožný vred
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
Č
asté
|
Bolesť kostí
|
M
enej časté
|
Artralgia, artritída, bolesť chrbta, svalová slabosť,
bolesť svalov a kostí v hrudníku, stuhnutosť kostí a svalov, bolesť krku, bolesť končatín
|
Poruchy obličiek a močových
ciest
|
Veľmi časté
|
Chromatúria
|
Č
asté
|
Proteinúria, hematúria
|
M
enej časté
|
Oligúria
|
Poruchy reprodukčného systému a prsníkov
|
M
enej časté
|
Spontánna erekcia penisu
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté
|
Asténia
|
Č
asté
|
Únava, zápal slizníc, horúčka, bolesť v hrudníku, edém
|
T
abuľka 3
N
ežiaduce reakcie lieku hlásené v súvislosti s liekom
Pixuvri usporiadané podľa frekvencie v dokončených štúdiách skúmajúcich liek Pixuvri
|
T
rieda orgánových systémov
|
F
r
ekvencia
|
N
ežiaduci účinok
|
|
M
enej časté
|
Zimnica, chlad v mieste vpichu, lokálna reakcia
|
Laboratórne a funkčné
vyšetrenia
|
Č
asté
|
Zvýšená hladina alanínaminotransferázy, zvýšená hladina aspartátaminotransferázy, zvýšená hladina
alkalickej fosfatázy v krvi, zvýšená hladina kreatinínu v krvi
|
M
enej časté
|
Bilirubín v moči, zvýšená hladina fosforu v krvi, zvýšená hladina močoviny v krvi, zvýšená hladina
gama-glutamyltransferázy, zvýšený počet neutrofilov, znížená hmotnosť
|
* Nežiaduce reakcie lieku diskutované ďalej
O
pis vybraných nežiaducich reakcií
H
ematologické toxicity a komplikácie neutropénie
Hematologické toxicity sú najčastejšou pozorovanou toxicitou, ale zvyčajne sa ľahko kontrolujú pomocou imunostimulantov a v prípade potreby podaním transfúzie. Kým neutropénia 3./4. stupňa sa vyskytovala v randomizovanom skúšaní častejšie u pacientov užívajúcich liek Pixuvri, vo väčšine prípadov bola nekomplikovaná, nekumulatívna a bola spojená s nízkym výskytom febrilnej neutropénie alebo infekcií. Je dôležité, že podávanie rastového faktora sa bežne nevyžadovalo a transfúzie červených krviniek a krvných doštičiek boli menej časté. (Pozri časť 4.4).
KardiotoxicitaV štúdii PIX 301 sa pozorovala znížená ejekčná frakcia u 13 pacientov (19,1 %) v skupine užívajúcej liek Pixuvri. U 11 pacientov liečených liekom Pixuvri dosiahli tieto udalosti 1./2. stupeň a u 2 pacientov dosiahli 3. stupeň; tieto udalosti boli prechodné a nesúviseli s dávkou lieku Pixuvri. Udalosti spojené so zlyhávaním srdca (výrazy podľa terminológie MedDRA zlyhávanie srdca a kongestívne zlyhávanie srdca) sa vyskytli u 6 pacientov (8,8 %) liečených liekom Pixuvri (2 pacienti mali 1./2. stupeň, 1 pacient mal 3. stupeň a 3 pacienti mali 5. stupeň). Traja pacienti liečení liekom Pixuvri (4,4 %) mali tachykardiu, arytmiu, sínusovú tachykardiu alebo bradykardiu.
Na začiatku sa odporúča vyhodnotiť funkciu srdca na základe snímky MUGA alebo vyšetrenia ECHO, najmä u pacientov, ktorí majú rizikové faktory pre zvýšenú kardiotoxicitu. U pacientov s rizikovými faktormi, ako je vysoká predchádzajúca kumulatívna expozícia antracyklínom alebo významné už existujúce ochorenie srdca, treba zvážiť zopakovanie snímky MUGA
alebo vyšetrenia ECHO na zistenie hodnôt LVEF. (Pozri časť 4.4).
Ďalšie časté toxicityK známym účinkom súvisiacim s podávaním lieku Pixuvri patria zmena sfarbenia pokožky a chromatúria spôsobené farbou zlúčeniny (modrá). Zmena sfarbenia pokožky zvyčajne vymizne v priebehu niekoľkých dní až týždňov, keď sa liek odstráni z tela.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieNeboli hlásené žiadne prípady predávkovania liekom Pixuvri.
Jednotlivé dávky pixantrónu do 158 mg/m2 sa podávali v klinických skúšaniach skúmajúcich postupné zvyšovanie dávky bez dôkazu toxicity súvisiacej s dávkou.
V prípade predávkovania sa odporúča podporná liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antineoplastiká, antracyklíny a príbuzné látky. Kód ATC: L01DB11
Mechanizmus účinku
Účinná látka lieku Pixuvri je pixantrón, cytotoxický azaantracéndión.
Na rozdiel od schválených antracyklínov (doxorubicín a ďalšie) a antracéndiónov (mitoxantrón) je pixantrón len slabý inhibítor topoizomerázy II. Okrem toho liek Pixantrón na rozdiel od antracyklínov alebo antracéndiónov priamo alkyluje DNA vytvárajúc stabilné adukty a dvojité reťazce DNA. Keďže pixantrón začleňuje heteroatóm dusíka do prstencovej štruktúry a nemá
ketónové skupiny, má menší potenciál tvorby reaktívnych druhov kyslíka, naviazania železa a tvorby alkoholových metabolitov, čo zrejme spôsobuje kardiotoxicitu antracyklínov. Vzhľadom na túto
unikátnu štruktúru pixantrón vyvolal minimálnu kardiotoxicitu na živočíšnych modeloch v porovnaní s doxorubicínom alebo mitoxantrónom.
V jednej komplexnej retrospektívnej farmakokinetickej/farmakodynamickej analýze populácií
v skúšaniach fázy 1 a kombinovaných režimov (fáza 1/2) sa dokázalo, že prežitie bez progresie a neutropénia 2./3. stupňa súvisia s expozíciou lieku Pixuvri.
Klinická účinnosťa bezpečnosť
Bezpečnosť a účinnosť lieku Pixuvri ako monoterapie sa hodnotili v jednom multicentrickom randomizovanom skúšaní s aktívnou kontrolou, na ktorej sa zúčastnili pacienti s recidivujúcim alebo
refraktérnym agresívnym NHL, ktorí podstúpili najmenej dve predchádzajúce terapie (PIX301). V tejto štúdii sa náhodne rozdelilo 140 pacientov (1:1) buď na liečbu liekom Pixuvri, alebo na chemoterapeutickú monoterapiu zvolenú skúšajúcim lekárom pre skupinu užívajúcu porovnávací liek. Demografické charakteristiky pacientov a charakteristiky ochorenia vo východiskovom bode boli medzi liečebnými skupinami vyvážené a nezaznamenali sa štatisticky významné rozdiely.
V štúdii bol priemerný vek pacientov 59 rokov, 61 % tvorili muži, 64 % boli belosi, 76 % pacientov malo vo východiskovom bode ochorenie III./IV. stupňa podľa klasifikácie Ann Arbor, 74 % pacientov malo vo východiskovom bode skóre medzinárodného prognostického indexu (IPI) ≥ 2
a 60 % pacientov podstúpilo ≥ 3 predchádzajúce chemoterapie. Do hlavnej štúdie neboli zaradení pacienti s lymfómom plášťových buniek. Pacienti v štúdii PIX 301 museli byť citliví na predchádzajúcu antracyklínovú terapiu (potvrdená alebo nepotvrdená odpoveď CR alebo PR).
U pacientov, ktorí sa predtým liečili rituximabom (38 pacientov v skupine užívajúcej liek Pixuvri a
39 pacientov v skupine užívajúcej porovnávací liek), sú obmedzené údaje.
Reakciu tumoru hodnotil zaslepený nezávislý centrálny hodnotiaci výbor podľa medzinárodného seminára pre štandardizáciu kritérií reakcie NHL. U pacientov liečených liekom Pixuvri sa preukázala významne vyššia miera úplnej reakcie a nepotvrdená úplná reakcia (CR/CRu) a vyššia miera objektívnej reakcie (ORR) v porovnaní so skupinou užívajúcou porovnávací liek (pozri tabuľku 4).
T
abuľka 4
Súhrn reakcie podľa hodnotenia nezávislej skupiny lekárov (populácia ITT)
|
|
K
oniec liečby
|
K
oniec štúdie
|
L
i
ek
Pixuvri
(n=70)
|
P
orovnávací
li
ek
(n=70)
|
H
odnota p
|
L
i
ek
Pixuvri
(n=70)
|
P
orovnávací
li
ek
(n=70)
|
H
odnota p
|
CR/CRu
|
14
(20,0 %)
|
4 (5,7 %)
|
0,021
|
17
(24,3 %)
|
'
5 (7,1 %)
|
0,009
|
CR
|
8 (11,4 %)
|
0 (0 %)
|
|
11
(15,7 %)
|
0 (0,0 %)
|
|
CRu
|
6 (8,6 %)
|
4 (5,7 %)
|
6 (8,6 %)
|
5 (7,1 %)
|
ORR (CR, CRu a PR)
|
26
(37,1 %)
|
10 (14,3 %)
|
0,003
|
28
(40,0 %)
|
10 (14,3 %)
|
0,001
|
Na porovnanie pomerov v skupine liečenej liekom Pixuvri a v porovnávacej chemoterapeutickej skupine sa
použil Fisherov presný test.
|
U pacientov liečených liekom Pixuvri sa dosiahlo 40 % zlepšenie prežitia bez progresie v porovnaní s
pacientmi liečenými porovnávacími liekmi, pričom medián prežitia bez progresie bol dlhší o 2,7 mesiaca (pomer rizika (HR)=0,60, logrank p=0,005) (pozri obrázok 1).
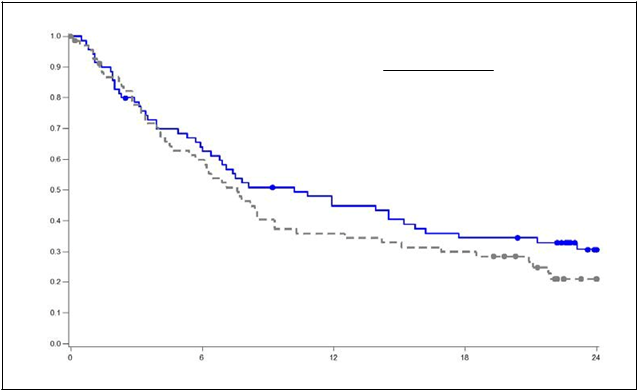
Medián celkového prežitia pacientov liečených liekom Pixuvri bol o 2,6 mesiaca dlhší v porovnaní s pacientmi, ktorí sa liečili porovnávacím liekom (HR=0,79, logrank p=0,25) (pozri obrázok 2).
Obrázok 1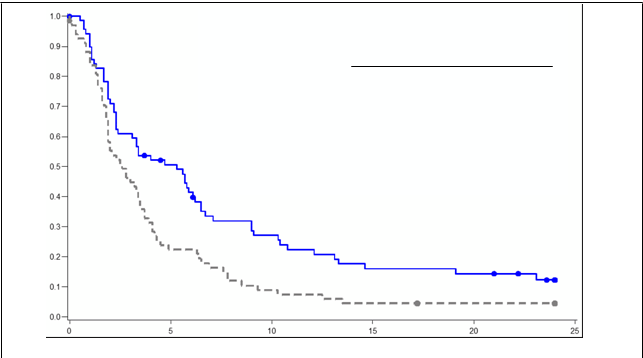 Prežitie bez progresie (PFS) - na konci štúdie PIX301Pixantrón Porovnávací liekN=70 N=70
Prežitie bez progresie (PFS) - na konci štúdie PIX301Pixantrón Porovnávací liekN=70 N=70
Ud
a
l
o
sť (PD alebo
s
m
r
ť)
58 (83 %) 64 (91 %)
M
e
di
á
n PFS (mesiace) 5,3 (2,3, 6,2) 2,6 (1,9, 3,5)
logrank, hodnota p = 0,005
HR = 0,60 (95 % IS 0,42, 0,86)
Pixantrón Porovnávacie lieky
Porovnávacie liekyČas od randomizácie (mesiace)
O
brázok 2
C
elkové prežitie - na konci štúdie PIX 301
|
Pixantrón
N=
70
|
Porovnávací liek
N
=70
|
Ud
a
l
o
sť (smrť)
|
47 (67 %)
|
52 (74 %)
|
M
e
di
á
n OS (95 % IS)
|
10,2 (6,4, 15,7)
|
7,6 (5,4, 9,3)
|
logrank, hodnota p = 0,251
HR = 0,79 (95 % IS 0,53, 1,18)
 Pixantrón
Pixantrón Porovnávacie lieky
Porovnávacie liekyČas od randomizácie (mesiace)
Výsledky u pacientov premedikovaných rituximabom preukázali lepší prínos liečby pri použití lieku Pixuvri oproti porovnávaciemu lieku, pokiaľ ide o mieru celkovej odpovede (31,6 % pri použití lieku Pixuvri oproti 17,9 % pri použití porovnávacieho lieku) a priemerné prežitie bez progresie
(3,3 mesiaca pri použití lieku Pixuvri oproti 2,5 mesiaca pri použití porovnávacieho lieku). Prínos lieku Pixuvri sa však nestanovil, keď sa použil ako liek aspoň piatej línie u pacientov refraktérnych
voči poslednej terapii, a preto existujú v tejto skupine pacientov veľmi obmedzené údaje.
Pediatrická populáciaEurópska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií pre liek Pixuvri u dojčiat od narodenia do veku menej ako 6 mesiacov z toho dôvodu, že NHL sa v tejto vekovej
podskupine detí nevyskytuje.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií pre liek Pixuvri
u pacientov vo veku od 6 mesiacov do 18 rokov, ktorí majú NHL (pozri časť 4.2, kde sa nachádzajú informácie o použití u detí a dospievajúcich).
Tento liek bol registrovaný s podmienkou. To znamená, že sa očakávajú ďalšie dôkazy o prínosoch tohto lieku.
Európska agentúra pre lieky najmenej raz ročne posúdi nové informácie o lieku a tento súhrn charakteristických vlastností podľa potreby aktualizuje.
5.2 Farmakokinetické vlastnostiAbsorpcia
Po intravenóznom podaní dosiahli plazmatické koncentrácie pixantrónu maximálnu hodnotu koncentrácie na konci infúzie, a potom klesali polyexponenciálne. Farmakokinetika lieku Pixuvri závisela od dávky v dávkovom rozsahu 3 mg/m2 až 105 mg/m2 a nepozorovali sa podstatné rozdiely, keď sa liek podával v štúdiách skúmajúcich monoterapiu alebo kombinovanú liečbu. Priemerné expozície pri monoterapii:
Dávka lieku Pixuvri Počet pacientov AUC (0 – 24 h) (ng.h/ml)
(mg/m2)

33
|
3
|
982 ± 115
|
49
|
6
|
1727 ± 474
|
88
|
2
|
3811
|
Podľa analýzy farmakokinetických údajov populácie bola priemerná expozícia počas 28-dňového



cyklu pre cieľovú zaznamenanú dávku pixantrónu 50 mg/m2 6 320 ng.h.ml (90 % IS, 5 990 – 6 800
ng.h.ml) pre 3 dávky / 4-týždňový cyklus.
DistribúciaLiek Pixuvri má veľký distribučný objem 25,8 l a približne 50 % sa viaže na plazmatické proteíny.
BiotransformáciaHlavné produkty biotransformácie pixantrónu sú acetylované metabolity. Zmena pixantrónu
in vitrona acetylované metabolity buď prostredníctvom NAT1, alebo NAT2 však bola veľmi obmedzená. V ľudskom moči sa zlúčenina vylúčila prevažne nezmenená a zistili sa veľmi malé množstvá
acetylovaných metabolitov fázy I a fázy II. Preto sa nezdá, že metabolizmus je dôležitou cestou
eliminácie pixantrónu. Acetylované metabolity boli farmakologicky neaktívne a metabolicky stabilné.
ElimináciaPixantrón má stredný až vysoký celkový plazmatický klírens 72,7 l/h a nízku renálnu exkréciu, čo je menej ako 10 % podanej dávky do 0 – 24 hodín. Terminálny polčas bol v rozsahu 14,5 až 44,8 hod. spriemerom 23,3 ± 8,0 (n=14, CV=34 %) a mediánom 21,2 hod. Vzhľadom na obmedzený príspevok renálneho klírensu je plazmatický klírens prevažne nerenálny. Liek Pixuvri sa môže metabolizovať v pečeni a/alebo vylúčiť žlčou. Keďže sa zdá, že metabolizmus je obmedzený, vylúčenie nezmeneného pixantrónu žlčou môže byť hlavnou cestou eliminácie. Klírens v pečeni sa približuje prúdeniu plazmy v pečeni, čo naznačuje vysoký pomer extrakcie v pečeni, a tým tiež účinnú elimináciu materskej účinnej látky. Príjem pixantrónu pečeňou je možno sprostredkovaný aktívnymi transportérmi OCT1 a vylučovanie žlčou zasa P-gp a BCRP.
Pixantrón mal len slabú alebo žiadnu schopnosť inhibovať P-gp, BCRP a transportný mechanizmus
BSEP
in vitro.
Pixantrón inhiboval transport metformínu prostredníctvom OCT1
in vitro, ale nepredpokladá sa, že inhibuje OTC1
in vivo v klinicky významných koncentráciách.
Pixantrón bol slabý inhibítor transportérov príjmu OATP1B1 a OATP1B3
in vitro.
Linearita/nelinearitaPreukázalo sa, že farmakokinetika pixantrónu je lineárna v širokom rozsahu dávok, od 3 mg/m2 do 105
mg/m2.
Vzťah(vzťahy) farmakokinetiky/farmakodynamikyPozoroval sa vzťah medzi plazmatickou expozíciou pixantrónu a počtom neutrofilov.
5.3 Predklinické údaje o bezpečnostiPo jednom intravenóznom podaní lieku Pixuvri v dávke 29 mg/kg a 38 mg/kg sa u myší pozorovala okamžitá smrť (114 mg/m2, LD10). Pozorovalo sa zníženie počtu bielych a červených krviniek
a zmeny v kostnej dreni, slezine, obličkách a semenníkoch. Podobné zistenia boli hlásené u potkanov a psov v dávke 116 mg/m2. U psov sa bezprostredne po liečbe vyskytla tachykardia a zmeny
v elektrokardiografoch (EKG).
V štúdiách skúmajúcich opakované podanie dávky u myší, potkanov a psov patrili k hlavným zisteniam myelotoxicita, nefrotoxicita (okrem psov) a poškodenie semenníkov.
Liek Pixuvri podávaný psom v dávke 0,5 až 0,9 mg/kg počas šiestich cyklov nezapríčinil mortalitu ani závažné klinické príznaky vrátane zmien v EKG alebo telesnej hmotnosti. Samce boli citlivejší na liečbu, pokiaľ ide o zníženie počtu bielych krviniek a krvných doštičiek (reverzibilné)
a vyčerpanie lymfoidov (slezina a týmus), ako aj značnú toxicitu pre reprodukčné orgány, čo sa predpokladá v prípade cytotoxického lieku. Okrem prechodného zvýšenia expozície u samíc po treťom cykle sa nepozorovali značné rozdiely vo farmakokinetických parametroch. Samce však mali trochu vyššiu expozíciu ako samice.
U psov liečba neovplyvnila srdce, keďže sa nepozorovali žiadne zmeny EKG v rôznych časových bodoch liečby a nezistili sa ani histopatologické a makropatologické srdcové zmeny. Funkcia obličiek a histológia neboli ovplyvnené ani v 4-týždňovej a 26-týždňovej štúdii.
Hodnotil sa kardiotoxický potenciál lieku Pixuvri v porovnaní s rovnako účinnými dávkami doxorubicínu a mitoxantrónu pri liečbe dovtedy neliečených myší a myší premedikovaných doxorubicínom. Pixantrón dimaleát v dávke do 27 mg/kg podávaný dvakrát týždenne počas
4 týždňov nemal žiadne kardiotoxické účinky, zatiaľ čo mitoxantrón bol podľa očakávaní kardiotoxický vo všetkých testovaných dávkach (0,6, 1,6 a 1,5 mg/kg). Liek Pixuvri vyvolal slabú nefropatiu. Minimálna kardiotoxicita lieku Pixuvri sa dokázala aj pri opakovaných liečebných
cykloch pri rovnakých dávkach.
Štúdie genotoxicity potvrdili možnosť klastogénneho účinku na cicavčie bunky in vitro a in vivo. Liek Pixuvri bol podľa Amesovho testu mutagénny, zvýšil počet chromozómových aberácií
v ľudských lymfocytoch a zvýšil výskyt mikrojadier in vivo.
Liek Pixuvri zapríčinil toxicitu matiek a plodov u potkanov a králikov dokonca v takej nízkej dávke, ako je 1,8 mg/kg podávanej na 9. až 11. deň gravidity, a vyššie dávky viedli k abortom a celkovej rezorpcii embrya. Embryotoxicita bola charakterizovaná zníženou priemernou hmotnosťou plodu, malformáciami plodu a neúplnou alebo oneskorenou osifikáciou plodu. Neuskutočnili sa žiadne dlhodobé štúdie na zvieratách na stanovenie karcinogénneho potenciálu lieku Pixuvri. Neuskutočnila sa žiadna štúdia lokálnej tolerancie.
Preukázalo sa, že liek Pixuvri má in vitro fototoxické účinky na bunky 3T3.
Myelotoxicita lieku Pixuvri a mitoxantrónu podávaných v dávke LD10 (pixantrón dimaleát
38 mg/kg a mitoxantrón 6,1 mg/kg) v štúdii skúmajúcej jednotky tvoriace kolónie u myší bola podobná.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Chlorid sodný, monohydrát laktózy,
hydroxid sodný (na úpravu pH),
kyselina chlorovodíková (na úpravu pH).
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Neotvorená injekčnáliekovka
5 roky
R
ekonštituovaný a zriedený roztok
Preukázalo sa, že chemická a fyzikálna stabilita pri používaní v polyetylénových (PE) štandardných infúznych vakoch pri expozícii dennému svetlu je 24 hodín pri izbovej teplote (15 °C až 25 °C).
Z mikrobiologického hľadiska sa má produkt použiť okamžite. Ak sa nepoužije okamžite, za obdobie a podmienky uchovávania pred použitím nesie zodpovednosť používateľ , pričom za normálnych okolností nemá byť dlhšie ako 24 hodín pri teplote 2 °C až 8 °C, pokiaľ sa rekonštitúcia a riedenie neuskutočnili za kontrolovaných a schválených aseptických podmienok.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C).
Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom. Podmienky na uchovávanie po rekonštitúcii a zriedení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Injekčná liekovka zo skla typu I so sivou butylovou gumenou zátkou s hliníkovou plombou
a červeným plastovým uzáverom obsahujúca 50 mg pixantrón dimaleátu, čo zodpovedá 29 mg pixantrónu.
Veľkosť balenia po 1 injekčnej liekovke.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Rekonštitúcia a riedenie
Pred rekonštitúciou vizuálne skontrolujte lyofilizovaný prášok, či nemá nejaké nezvyčajné nedostatky, napr. štiepenie, rozpustené časti alebo sklovitý vzhľad. Každú 29 mg injekčnú liekovku rekonštituujte za aseptických podmienok s 5 ml injekčného roztoku chloridu sodného 9 mg/ml
(0,9 %). Lyofilizovaný prášok sa má úplne rozpustiť do 60 sekúnd pomocou miešania. Vznikne
tmavomodrý roztok s koncentráciou pixantrónu 5,8 mg/ml.
Za aseptických podmienok natiahnite potrebný objem pre požadovanú dávku (na základe
koncentrácie 5,8 mg/ml) a preneste do 250 ml infúzneho vaku obsahujúceho injekčný roztok chloridu sodného 9 mg/ml (0,9 %). Výsledná koncentrácia pixantrónu v infúznom vaku má byť nižšia ako 580 mikrogramov/ml na základe vstupného rekonštituovaného lieku. Kompatibilita
s inými rozpúšťadlami sa nestanovila. Po prenesení dôkladne zamiešajte obsah infúzneho vaku. Zmes má byť číry tmavomodrý roztok.
Počas podávania zriedeného roztoku lieku Pixuvri sa majú používať polyétersulfónové zabudované filtre s veľkosťou pórov 0,2 µm.
Liek Pixuvri je cytotoxický. Zabráňte kontaktu lieku s očami a pokožkou. Pri manipulácii s liekom
Pixuvri a počas dekontaminácie použite rukavice, masky a ochranné okuliare.
Špeciálne opatrenia na likvidáciu
Liek Pixuvri je len na jednorazové použitie. Nepoužitý liek alebo odpad vzniknutý z lieku vrátane materiálu použitého na rekonštitúciu, riedenie a podávanie treba zlikvidovať v súlade s miestnymi požiadavkami pre cytotoxické látky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
CTI Life Sciences Limited Highlands House Basingstoke Road Spencers Wood, Reading Berkshire RG7 1NT
Veľká Británia
8. REGISTRAČNÉ ČÍSLOEU/1/12/764/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie : 10/05/2012
Predĺženia registrácie : 10/04/2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu/