
zoteliómu pleury a nemalobunkového karcinómu pľúc sa netýka detí a dospievajúcich.
Pacienti s poškodením obličiek (štandardný Cockcroftov a Gaultov vzorec alebo glomerulárna
filtrácia meraná metódou klírensu Tc99m-DPTA v sére)
Pemetrexed sa primárne vylučuje v nezmenenej forme obličkami. V klinických štúdiách nebola u
pacientov s klírensom kreatinínu ≥ 45 ml/min potrebná žiadna úprava dávky mimo úprav odporúčaných pre všetkých pacientov. Nie sú dostatočné dáta o použití pemetrexedu u pacientov s klírensom kreatinínu pod 45 ml/min, a preto sa použitie pemetrexedu u týchto pacientov neodporúča (pozri časť 4.4).
Pacienti s poškodením pečene
Nebol zistený žiadny vzťah medzi AST (SGOT), ALT (SGPT) alebo celkovým bilirubínom a
farmakokinetikou pemetrexedu. Napriek tomu pacienti s pečeňovým poškodením s bilirubínom
> 1,5- krát ako horná hranica normy a/alebo aminotransferázami > 3,0-krát ako horná hranica normálnych hodnôt (hepatálne metastázy neprítomné) alebo > 5,0-krát ako je horná hranica normálnych hodnôt (hepatálne metastázy prítomné) neboli doteraz špeciálne študovaní.
Spôsob podávania
Pemetrexed Baxter je na intravenózne použitie. Pemetrexed Baxter sa má podávať intravenóznou
infúziou počas 10 minút, v prvý deň každého 21-denného cyklu.
Opatrenia pred zaobchádzaním s liekom Pemetrexed Baxter alebo pri podaní lieku Pemetrexed Baxter a pokyny na rekonštitúciu a nariedenie lieku Pemetrexed Baxter pred podaním sú uvedené v časti 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Dojčenie (pozri časť 4.6).
Súbežná vakcinácia proti žltej zimnici (pozri časť 4.5).
4.4 Osobitné upozornenia a opatrenia pri používaní
Pemetrexed môže utlmiť funkciu kostnej drene, čoho výsledkom je neutropénia, trombocytopénia a anémia (alebo pancytopénia) (pozri časť 4.8). Potlačenie tvorby kostnej drene predstavuje obvykle toxicitu, ktorá limituje veľkosť použitej dávky. Pacienti musia byť sledovaní z hľadiska útlmu kostnej drene počas liečby a pemetrexed nesmie byť podaný pacientom, pokiaľ sa absolútny počet neutrofilov (ANC) nevráti na hodnotu ≥ 1 500 buniek/mm3 a počet doštičiek na ≥ 100 000 buniek/mm3. Zníženie dávky v nasledujúcom cykle závisí od hodnôt absolútneho počtu neutrofilov v čase najhlbšieho poklesu, počtu doštičiek a maximálnej nehematologickej toxicity vyskytujúcej sa v predchádzajúcom cykle (pozri časť 4.2).
Bolo zaznamenaných menej redukcií a hematologickej toxicity stupňa 3/4 a nehematologickej toxicity ako je neutropénia, febrilná neutropénia a infekcia s neutropéniou stupňa 3/4, keď boli pred liečbou podávané kyselina listová a vitamín B12. Preto musia byť všetci pacienti liečení pemetrexedom poučení, aby užívali profylakticky kyselinu listovú a vitamín B12 za účelom zníženia toxicity
súvisiacej s liečbou (pozri časť 4.2).
Kožné reakcie boli zaznamenané u pacientov, ktorí nedostávali pred liečbou kortikosteroidy.
Podávanie dexametazónu (alebo ekvivalentného kortikosteroidu) pred liečbou pemetrexedom môže znížiť výskyt a závažnosť kožných reakcií (pozri časť 4.2).
Nebol študovaný dostatočný počet pacientov s klírensom kreatinínu pod 45 ml/min. Preto sa použitie pemetrexedu u pacientov s klírensom kreatinínu < 45 ml/min neodporúča (pozri časť 4.2).
Pacienti s miernou až stredne závažnou renálnou insuficienciou (klírens kreatinínu 45 – 79 ml/min) sa musia vyvarovať užívania nesteroidových antiflogistík (NSA), ako je ibuprofén a kyselina acetylsalicylová (> 1,3 g denne), 2 dni pred, v deň a 2 dni po podaní pemetrexedu (pozri časť 4.5). Pacienti s miernou až stredne závažnou renálnou insuficienciou, vhodní na liečbu pemetrexedom, majú prerušiť užívanie NSA s dlhšími polčasmi vylučovania najmenej 5 dní pred, v deň a
najmenej 2 dni po podaní pemetrexedu (pozri časť 4.5).
V súvislosti s pemetrexedom samotným alebo v kombinácii s inými chemoterapeutikami boli hlásené závažné renálne príhody, vrátane akútneho renálneho zlyhania. Mnoho pacientov, u ktorých sa tieto príhody objavili, malo rizikové faktory pre rozvoj renálnych príhod, vrátane dehydratácie alebo preexistujúcej hypertenzie alebo diabetes. Pri samostatnom používaní pemetrexedu alebo jeho používaní s inými chemoterapeutickými liekmi bol po uvedení na trh hlásený aj nefrogenický diabetes insipidus a tubulárna nekróza obličiek. Väčšina z týchto príhod ustúpila po prerušení liečby pemetrexedom.
U pacientov je potrebné pravidelne kontrolovať symptómy akútnej tubulárnej nekrózy, zníženej
funkcie obličiek a prejavy a symptómy nefrogenického diabetu insipidus (napr. hypernatriémia).
Vplyv prítomnosti tekutín v treťom priestore, ako je pleurálny výpotok alebo ascites, na pemetrexed nie je presne stanovený. Klinické skúšanie 2. fázy s pemetrexedom na 31 pacientoch s ohraničeným tumorom a stabilným výskytom tekutiny v treťom priestore nepreukázalo žiadny rozdiel v plazmatických koncentráciách a klírense pemetrexedu normalizovaných podľa dávky oproti pacientom bez prítomnosti tekutín v treťom priestore. Preto je vhodné pred začatím liečby pemetrexedom zvážiť drenáž tekutiny z tretieho priestoru, avšak táto nemusí byť nutná.
Ako dôsledok gastrointestinálnej toxicity pemetrexedu podávaného v kombinácii s cisplatinou sa pozorovala závažná dehydratácia. Preto pacienti musia dostávať adekvátnu antiemetickú terapiu a primeranú hydratáciu pred a/alebo po podaní liečby.
Menej často boli v priebehu klinických štúdií s pemetrexedom hlásené závažné kardiovaskulárne príhody vrátane infarktu myokardu a cerebrovaskulárne príhody, hlavne pri podaní v kombinácii s ďalším cytostatikom. Väčšina pacientov, u ktorých sa pozorovali tieto príhody, mala preexistujúce kardiovaskulárne rizikové faktory (pozri časť 4.8).
U pacientov s rakovinou je častý pokles imunity. Preto sa neodporúča súbežné užívanie živých oslabených vakcín (pozri časť 4.3 a 4.5).
Pemetrexed môže mať geneticky škodlivé účinky. Pohlavne zrelým mužom sa neodporúča splodiť dieťa počas liečby a do 3 mesiacov od ukončenia liečby. Odporúča sa používanie antikoncepčných metód alebo abstinencia. Vzhľadom na možnosť ireverzibilnej infertility spôsobenej liečbou pemetrexedom sa mužom odporúča, aby vyhľadali konzultáciu o možnosti trvalého uchovania spermií pred začiatkom liečby.
Ženy v plodnom veku musia počas liečby a 6 mesiacov po ukončení liečby pemetrexedom používať účinnú antikoncepčnú metódu (pozri časť 4.6).
Prípady radiačnej pneumonitídy boli zaznamenané u pacientov liečených ožarovaním buď pred, počas alebo po ich liečbe pemetrexedom. U týchto pacientov je potrebná zvláštna pozornosť a opatrnosť pri užívaní iných rádiosenzibilizujúcich látok.
U pacientov, ktorí podstúpili rádioterapiu pred týždňami až rokmi, boli zaznamenané prípady radiačného poškodenia typu „recall fenomén“.
Pomocné látky
P
emetrexed Baxter 100 mg prášok na koncentrát na infúzny roztok
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej injekčnej liekovke, t. j. v podstate zanedbateľné množstvo sodíka.
Pemetrexed Baxter 500 mg prášok na koncentrát na infúzny roztok
Tento liek obsahuje 54 mg sodíka v jednej injekčnej liekovke, čo zodpovedá 2,7 % WHO
odporúčaného maximálneho denného príjmu 2 g sodíka pre dospelú osobu.
4.5 Liekové a iné interakcie
Pemetrexed sa vylučuje v nezmenenej forme hlavne obličkami, a to tubulárnou sekréciou a v menšom množstve glomerulárnou filtráciou. Súbežné podávanie nefrotoxických látok (napr. aminoglykozidy, kľučkové diuretiká, zlúčeniny platiny, cyklosporín) môže viesť k oneskorenému klírensu pemetrexedu. Táto kombinácia sa musí používať s opatrnosťou. Ak je to nevyhnutné, klírens kreatinínu musí byť prísne monitorovaný.
Súbežné podávanie látok, ktoré sa vylučujú taktiež tubulárnou sekréciou (napr. probenecid, penicilín) môže viesť k oneskoreniu klírensu pemetrexedu. V prípade kombinovaného podania týchto látok a pemetrexedu je nutné postupovať s opatrnosťou. V prípade potreby musí byť klírens kreatinínu starostlivo monitorovaný.
U pacientov s normálnymi renálnymi funkciami (klírens kreatinínu > 80 ml/min) môžu vysoké dávky nesteroidových antiflogistík (NSA, ako je ibuprofén > 1 600 mg/deň) a vyššia dávka kyseliny acetylsalicylovej (> 1,3 g denne) znížiť elimináciu a následne zvýšiť výskyt nežiaducich reakcií pemetrexedu. Preto sa pri súbežnom podávaní vyšších dávok NSA alebo vyššej dávky kyseliny acetylsalicylovej s pemetrexedom u pacientov s normálnymi renálnymi funkciami (klírens kreatinínu
> 80 ml/min) musí postupovať s opatrnosťou.
Pacienti s miernou až stredne závažnou renálnou insuficienciou (klírens kreatinínu 45 – 79 ml/min) sa
musia vyvarovať súbežného podávania pemetrexedu s NSA (napr. ibuprofén) alebo vyššej dávky
kyseliny acetylsalicylovej 2 dni pred, v deň a 2 dni po podaní pemetrexedu (pozri časť 4.4).
Vzhľadom na nedostatok dát ohľadom potenciálnej interakcie s NSA s dlhšími polčasmi, ako sú piroxikam alebo rofekoxib, je potrebné prerušiť ich podávanie u pacientov s miernou až stredne závažnou renálnou insuficienciou najmenej 5 dní pred, v deň a najmenej 2 dni po podaní pemetrexedu (pozri časť 4.4). Ak je potrebné súbežne podávať NSA, u týchto pacientov je potrebné dôkladne monitorovať toxicitu, najmä myelosupresiu a gastrointestinálnu toxicitu.
Pemetrexed prechádza obmedzeným pečeňovým metabolizmom. Výsledky z in vitro štúdií s ľudskými pečeňovými mikrozómami ukázali, že sa nedá predpokladať, že pemetrexed spôsobuje klinicky významnú inhibíciu metabolického klírensu látok metabolizovaných CYP3A, CYP2D6, CYP2C9, a CYP1A2.
Interakcie bežné u všetkých cytotoxických liekov
Vzhľadom na zvýšené riziko trombózy u pacientov s rakovinou je použitie antikoagulačnej liečby časté. Vysoká intraindividuálna variabilita stavu koagulácie počas choroby a možnosť interakcie medzi perorálnymi antikoagulanciami a protinádorovou chemoterapiou vyžaduje zvýšenú frekvenciu monitorovania INR (International Normalised Ratio), pokiaľ sa rozhodneme pacienta liečiť perorálnymi antikoagulanciami.
Kontraindikované súbežné podávanie: Vakcína proti žltej zimnici: riziko fatálnej generalizovanej
postvakcinačnej reakcie (pozri časť 4.3).
Neodporučené súbežné podávanie: Živé oslabené vakcíny (okrem žltej zimnice, v tomto prípade je súbežné podávanie kontraindikované): riziko systémovej reakcie s možným fatálnym koncom. Riziko je zvýšené u jedincov, ktorí už majú pokles imunity spôsobený základným ochorením. Použite inaktivovanú vakcínu, pokiaľ je k dispozícii (poliomyelitída) (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Ženy v plodnom veku / Antikoncepcia u mužov a žien
Pemetrexed môže mať geneticky škodlivé účinky. Ženy v plodnom veku musia v priebehu liečby
a 6 mesiacov po ukončení liečby pemetrexedom používať účinnú antikoncepciu.
Pohlavne zrelým mužom sa odporúča používanie účinných antikoncepčných metód a neodporúča sa splodiť dieťa počas liečby a do 3 mesiacov od ukončenia liečby.
Gravidita
Neexistujú údaje o použití pemetrexedu u tehotných žien, avšak je podozrenie, že pemetrexed, tak ako
iné antimetabolity, pravdepodobne spôsobuje závažné vrodené chyby, keď je použitý počas gravidity. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Pemetrexed sa nesmie používať v gravidite, pokiaľ to nie je nevyhnutné a po starostlivom zvážení potrieb liečby u matky a rizika pre plod (pozri časť 4.4).
Dojčenie
Nie je známe, či sa pemetrexed vylučuje do ľudského materského mlieka a nežiaduce reakcie na
dojčené dieťa sa nedajú vylúčiť. Dojčenie musí byť počas liečby pemetrexedom prerušené (pozri
časť 4.3).
Fertilita
Vzhľadom na možnosť ireverzibilnej infertility spôsobenej liečbou pemetrexedom sa mužom odporúča, aby vyhľadali konzultáciu o možnosti trvalého uchovania spermií pred začiatkom liečby.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Bolo však zistené, že pemetrexed môže spôsobovať únavu. Preto musia byť pacienti upozornení, aby neviedli vozidlá a neobsluhovali stroje, ak sa táto udalosť vyskytne.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Najčastejšie hlásenými nežiaducimi účinkami v súvislosti s pemetrexedom, použitým či už v monoterapii alebo v kombinácii, boli útlm kostnej drene prejavujúci sa ako anémia, neutropénia,
leukopénia, trombocytopénia; a gastrointestinálna toxicita prejavujúca sa ako anorexia, nevoľnosť, vracanie, hnačka, zápcha, faryngitída, mukozitída a stomatitída. Ďalšie nežiaduce účinky zahŕňajú
renálnu toxicitu, zvýšenie koncentrácie aminotransferáz, alopéciu, únavu, dehydratáciu, vyrážku, infekciu/sepsu a neuropatiu. Medzi zriedkavé nežiaduce účinky patria Stevensov-Johnsonov syndróm a toxická epidermálna nekrolýza.
Tabuľkovýprehľadnežiaducichreakcií
V tabuľke 4 sú uvedené nežiaduce účinky bez ohľadu na príčinnú súvislosť s pemetrexedom používaným buď v monoterapii alebo v kombinácii s cisplatinou z pilotných registračných štúdií (JMCH, JMEI, JMBD, JMEN a PARAMOUNT) a z obdobia po uvedení na trh.
NÚ sú uvedené podľa triedy orgánových systémov MedDRA. Na klasifikáciu frekvencie sa použila táto konvencia: veľmi časté (≥ 1/10); časté (≥ 1/100 až <1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000); neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
T
abuľka 4. Frekvencie nežiaducich účinkov všetkých stupňov bez ohľadu na príčinné súvislosti z pilotných registračných štúdií: JMEI (Pemetrexed verzus docetaxel), JMDB (Pemetrexed a cisplatina verzus Gemzar a cisplatina, JMCH (Pemetrexed s cisplatinou verzus cisplatina), JMEN a PARAMOUNT (Pemetrexed) s najlepšou podpornou starostlivosťou verzus placebo s najlepšou podpornou starostlivosťou) a z obdobia po uvedení na trh.
T
rieda orgánových systémov
(
M
edDRA)
|
Veľmi časté
|
Časté
|
M
enej časté
|
Z
riedkavé
|
Veľmi
zriedkavé
|
Neznáme
|
Infekcie a nákazy
|
infekciaa, faryngitída
|
sepsab
|
|
|
dermo- hypodermatití- da
|
|
Poruchy krvi a lymfatického systému
|
neutropénia, leukopénia, znížený hemoglobín,
|
febrilná neutropénia, znížený počet krvných doštičiek
|
pancytopénia
|
Autoimunit- ná hemolytická anémia
|
|
|
Poruchy imunitného systému
|
|
hypersenzitivita
|
|
anafylaktic- ký šok
|
|
|
Poruchy metabolizmu a výživy
|
|
dehydratácia
|
|
|
|
|
Poruchy nervového systému
|
|
periférna motorická neuropatia,
periférna senzorická neuropatia, závraty, porucha chuti
|
mozgovo-cievna príhoda, ischemická
príhoda, intrakraniálna hemorágia
|
|
|
|
Poruchy oka
|
|
konjunktivitída, suché oko, zvýšená
lakrimácia, keratokonjun- ktivitída, opuch viečka, chroba očného povrchu
|
|
|
|
|
Poruchy srdca a srdcovej činnostic
|
|
zlyhanie srdca, arytmia
|
infarkt myokardu, ochorenie koronárnych ciev, angína,
supraventri-
kulárna arytmia
|
|
|
|
Poruchy ciev
|
|
|
periférna ischémiac
|
|
|
|
Poruchy dýchacej sústavy,
hrudníka a
mediastína
|
|
|
pľúcna embólia, intersticiálnabd pneumonitída
|
|
|
|
Poruchy gastrointes- tinálneho traktu
|
stomatitída, anorexia, vracanie, hnačka, nevoľnosť
|
dyspepsia, zápcha,
bolesť brucha
|
gastrointes- tinálna hemorágia, intestinálna perforácia,
kolitídae, rektálna
hemorágia, ezofagitída
|
|
|
|
T
rieda orgánových systémov (MedDRA)
|
Veľmi časté
|
Časté
|
M
enej časté
|
Z
riedkavé
|
Veľmi
zriedkavé
|
Neznáme
|
Poruchy pečene a žlčových ciest
|
|
zvýšená alanín- aminotransferáza, zvýšená aspartát-
aminotransfe-
ráza
|
|
hepatitída
|
|
|
Poruchy kože a podkožného tkaniva
|
vyrážka, exfoliácia kože
|
multiformný erytém, urtikária, hyperpigmen- tácia, pruritus, alopécia
|
|
erytém
|
toxická epidermálna nekrolýzab, Stevensov- Johnsonov syndrómb, pemfigoid, bulózna dermatitída, získaná epidermoly- tická bulóza, erytémový edémf pseudoceluli- tída, dermatitída, ekzém, prurigo
|
|
Poruchy obličiek a močových
ciest
|
znížený klírens kreatinínu, zvýšený kreatinín v
krvii
|
zlyhanie obličiek, znížená glomerulárna filtrácia
|
|
|
|
nefrogénny diabetes insipidus, renálna
tubulárna
nekróza
|
Celkové poruchy a reakcie v
mieste podania
|
únava,
|
bolesť na hrudi, horúčka,
bolesť,
edém,
zápal sliznice
|
|
|
|
|
Laboratórne a funkčné vyšetrenia
|
|
zvýšená gamaglutamyl transferáza
|
|
|
|
|
Úrazy, otravy a komplikácie liečebného postupu
|
|
|
radiačná pneumonitída, radiačná ezofagitída
|
radiačný
„recall“
fenomén
|
|
|
a s a bez neutropénie
b v niektorých prípadoch fatálny
c niekedy viedli k nekróze končatín
d s respiračnou nedostatočnosťou
e pozorované len v kombinácii s cisplatinou
f najmä dolných končatín
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 Predávkovanie
K popísaným symptómom z predávkovania patrí neutropénia, anémia, trombocytopénia, mukozitída, senzorická polyneuropatia a vyrážka. K predpokladaným komplikáciám z predávkovania patrí útlm kostnej drene manifestujúci sa neutropéniou, trombocytopéniou a anémiou. Taktiež sa môže vyskytnúť infekcia s horúčkou alebo bez nej, hnačka, a/alebo mukozitída. V prípade podozrenia na
predávkovanie, musia mať pacienti sledovaný krvný obraz a musia dostávať podpornú liečbu podľa potreby. V liečbe predávkovania pemetrexedom sa musí vziať do úvahy podávanie
kalciumfolinátu / kyseliny folinovej.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Cytostatiká, analógy kyseliny listovej, ATC kód: L01BA04
Pemetrexed je antifolátové cytostatikum, cielené na viaceré enzymatické systémy. Pôsobí narušením rozhodujúcich metabolických procesov závislých na folátoch, ktoré sú nevyhnutné pre replikáciu buniek.
Štúdie in vitro ukázali, že pemetrexed sa správa ako antifolát pôsobiaci na viaceré enzymatické systémy tým, že inhibuje tymidylát syntetázu (TS), dihydrofolát reduktázu (DHFR) a glycínamid ribonukleotid formyltransferázu (GARFT), ktoré sú kľúčovými enzýmami závislými na foláte pre de novo biosyntézu tymidínu a purínových nukletidov. Pemetrexed je transportovaný do buniek redukovaným folátovým nosičom aj membránovým folátovým väzbovým proteínovým transportným systémom.V bunke je pemetrexed rýchlo a efektívne zmenený na polyglutamátové formy enzýmom folylpolyglutamát syntetázou. Polyglutamátové formy sa zdržujú v bunkách a sú ešte účinnejšie inhibítory TS a GARFT. Polyglutamácia je proces závislý na čase a koncentrácii, ku ktorému dochádza v nádorových bunkách a v menšej miere v normálnych tkanivách. Polyglutamátové metabolity majú zvýšený intracelulárny polčas, čoho výsledkom je prolongovaný účinok lieku v malígnych bunkách.
Európska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií pre pemetrexed s ohľadom na všetky vekové podskupiny detí a dospievajúcich vo všetkých schválených indikáciách (pozri časť 4.2).
Klinická účinnosť
Mezotelióm
EMPHACIS, multicentrická, randomizovaná, jednoducho zaslepená štúdia fázy 3 s pemetrexedom plus cisplatina verzus cisplatina u pacientov dovtedy neliečených chemoterapiou s malígnym mezoteliómom pleury ukázala, že pacienti liečení pemetrexedom a cisplatinou mali
klinické 2,8 mesačné zlepšenie mediánu prežívania v porovnaní s pacientmi liečenými cisplatinou.
Počas štúdie bola pridaná dlhodobá suplementácia nízkymi dávkami kyseliny listovej a vitamínu B12 za účelom zníženia toxicity. Primárna analýza štúdie bola vykonaná na populácii pacientov randomizovaných do liečebnej skupiny, ktorá bola liečená hodnoteným liekom (randomizovaní a liečení). Bola vykonaná analýza podskupín pacientov, ktorí dostávali suplementáciu kyselinou
listovou a vitamínom B12 počas celého priebehu liečby počas štúdie (úplne suplementovaní). Výsledky týchto analýz účinnosti sú uvedené v tabuľke:
T
abuľka 5: Účinnosť pemetrexedu v kombinácii s cisplatinou oproti cisplatine pri malígnom mezotelióme pleury
|
R
andomizovaní a liečení
pacienti
|
P
l
ne suplementovaní pacienti
|
Parameter účinnosti
|
P
emetrexed/
cisplatina
(
N = 226)
|
C
is
platina
(
N = 222)
|
P
emetrexed/
cisplatina
(
N = 168)
|
C
is
platina
(
N = 163)
|
Medián celkového prežívania(mesiace)
(95 % CI)
|
12,1
(10,0 – 14,4)
|
9,3
(7,8 – 10,7)
|
13,3
(11,4 – 14,9)
|
10,0
(8,4 – 11,9)
|
Log rank hodnota pa
|
0,020
|
0,051
|
Medián času do progresie tumoru
(mesiace) (95 % CI)
|
5,7
(4,9 – 6,5)
|
3,9
(2,8 – 4,4)
|
6,1
(5,3 – 7,0)
|
3,9
(2,8 – 4,5)
|
Log rank hodnota pa
|
0,001
|
0,008
|
Čas do zlyhania liečby (mesiace)
(95 % CI)
|
4,5
(3,9 – 4,9)
|
2,7
(2,1 – 2,9)
|
4,7
(4,3 – 5,6)
|
2,7
(2,2 – 3,1)
|
Log rank hodnota pa
|
0,001
|
0,001
|
Pomer celkovej odpovedeb
(95 % CI)
|
41,3 %
(34,8 – 48,1)
|
16,7 %
(12,0 – 22,2)
|
45,5 %
(37,8 – 53,4)
|
19,6 %
(13,8 – 26,6)
|
Fisherova presná hodnota pa
|
< 0,001
|
< 0,001
|
Skratky: CI = interval spoľahlivosti
a hodnota p odkazuje na porovnanie medzi liečebnými ramenami.
b Rameno pemetrexed/cisplatina, randomizovaní a liečení (N = 225) a plne suplementovaní (N = 167)
Štatisticky signifikantné zlepšenie klinicky závažných symptómov (bolesť a dušnosť) spojených s malígnym mezoteliómom pleury v ramene pemetrexed/cisplatina (212 pacientov) oproti ramenu s cisplatinou (218 pacientov) bolo preukázané použitím škály symptómov karcinómu pľúc (Lung Cancer Symptom Scale). Taktiež boli pozorované štatisticky významné rozdiely v pľúcnych funkčných testoch. Rozdiel medzi liečebnými ramenami bol dosiahnutý zlepšením pľúcnej funkcie v ramene pemetrexed/cisplatina a zhoršením pľúcnej funkcie v čase v kontrolnom ramene.
Existujú obmedzené údaje u pacientov s malígnym mezoteliómom pleury liečených pemetrexedom v monoterapii. Pemetrexed v dávke 500 mg/m2 bol študovaný v monoterapii u 64 chemoterapiou neliečených pacientov s malígnym mezoteliómom pleury. Celková odpoveď na liečbu bola 14,1 %.
NSCLC (nemalobunkový karcinóm pľúc), liečba v druhej líniiV multicentrickej, randomizovanej, otvorenej štúdii fázy 3 s pemetrexedom a docetaxelom u pacientov s lokálne pokročilým a metastatickým NSCLC po primárnej chemoterapii bol preukázaný medián prežívania 8,3 mesiacov u pacientov liečených pemetrexedom (populácia so zámerom byť liečená n
= 283) a 7,9 mesiacov u pacientov liečených docetaxelom (populácia so zámerom byť liečená n
= 288). Predchádzajúca chemoterapia nezahŕňala pemetrexed. Analýza vplyvu histológie NSCLC na
liečebný efekt z hľadiska celkového prežitia vyšla v prospech pemetrexedu oproti docetaxelu vo všetkých okrem prevažne skvamóznych histológií (n = 399, 9,3 verzus 8,0 mesiacov, dosiahnuté HR
= 0,78; 95% CI = 0,61-1,00, p = 0,047) a v prospech docetaxelu pre skvamóznu bunkovú histológiu
karcinómu (n = 172, 6,2 verzus 7,4 mesiacov, dosiahnuté HR = 1,56; 95% CI = 1,08-2,26, p = 0,018). V rámci histologických podskupín sa nepozorovali žiadne klinicky významné rozdiely týkajúce sa bezpečnostného profilu pemetrexedu.
Obmedzené klinické údaje zo samostatnej, randomizovanej, kontrolovanej štúdie
fázy 3 predpokladajú, že údaje o účinnosti (celkové prežitie, prežívanie bez progresie) pre pemetrexed sú rovnaké medzi pacientmi predtým liečenými docetaxelom (n = 41) a pacientmi, ktorí predtým nedostávali liečbu docetaxelom (n = 540).
T
abuľka 6: Účinnosť pemetrexedu a docetaxelu u NSCLC - ITT populácia
|
P
emetrexed
|
D
ocetaxel
|
Č
as prežívania (mesiace)
§ Medián (m)
§ 95 % CI pre medián
§ HR
§ 95 % CI pre HR
§ hodnota p pre nonferioritu (HR)
|
(n = 283) (n = 288)
8,3 7,9
(7,0 – 9,4) (6,3 – 9,2)
0,99 (0,82 – 1,20)
0,226
|
Č
as prežívania bez progresie (mesiace)
§ Medián
§ HR (95 % CI)
|
(n = 283) (n = 288)
2,9 2,9
0,97 (0,82 – 1,16)
|
Č
as do zlyhania liečby (TTTF – mesiace)
§ Medián
§ HR (95 % CI)
|
(n = 283) (n = 288)
2,3 2,1
0,84 (0,71 – 0,997)
|
O
dpoveď (n: kvalifikovaný pre odpoveď)
§ Odpoveď na liečbu (%) (95 % CI)
§ Stabilizácia ochorenia (%)
|
(n = 264)
9,1 (5,9 – 13,2)
45,8
|
(n = 274)
8,8 (5,7 – 12,8)
46,4
|
Skratky: CI = interval spoľahlivosti; HR = pomer rizika; ITT = so zámerom liečiť; n = veľkosť celej
populácie.
NSCLC, liečba v prvej líniiMulticentrická, randomizovaná, otvorená štúdia fázy 3 s pemetrexedom a cisplatinou verzus gemcitabínom a cisplatinou u pacientov bez predchádzajúcej liečby chemoterapiou s lokálne pokročilým alebo metastatickým (stupeň IIIb alebo IV) NSCLC ukázala, že pemetrexed spolu s cisplatinou (ITT [Intent-To-Treat – so zámerom liečiť] populácia n = 862) splnila primárny cieľ a preukázala rovnakú klinickú účinnosť ako gemcitabín s cisplatinou (ITT n = 863) v celkovom prežívaní (adjustovaný pomer rizík 0,94; 95 % CI = 0,84-1,05). Všetci pacienti zahrnutí do štúdie mali výkonnostný stav podľa ECOG 0 alebo 1.
Analýza primárnej účinnosti bola založená na ITT populácii. Analýzy citlivosti hlavných cieľových parametrov účinnosti boli hodnotené na populácii kvalifikovanej protokolom (PQ). Analýzy účinnosti pre PQ populáciu boli zhodné s analýzami pre ITT populáciu a podporujú noninferioritu AC verzus GC.
Prežívanie bez progresie (PFS) a celková odpoveď na liečbu boli podobné medzi liečebnými ramenami: medián PFS bol 4,8 mesiacov pre pemetrexed s cisplatinou verzus 5,1 mesiacov pre gemcitabín s cisplatinou (adjustovaný pomer rizík 1,04; 95% CI = 0,94-1,15) a celková odpoveď na liečbu bola 30,6% (95% CI = 27,3- 33,9) pre pemetrexed s cisplatinou verzus 28,2% (95% CI
= 25,0- 31,4) pre gemcitabín s cisplatinou. PFS údaje sa čiastočne potvrdili nezávislým preskúmaním
(na preskúmanie bolo náhodne vybraných 400/1725 pacientov).
Analýza vplyvu histológie NSCLC na celkové prežitie ukázala klinicky významné rozdiely v
prežívaní podľa histológie, pozri tabuľku nižšie.
T
abuľka 7: Účinnosť pemetrexedu + cisplatina vs. gemcitabín + cisplatina v prvej línii nemalobunkového karcinómu pľúc – ITT populácia a histologické podskupiny.
I
T
T populácia a histologické
podskupiny
|
Medián celkového prežitia v mesiacoch (95% CI)
|
A
djustovaný pomer rizík
(H
R)
(
95% CI)
|
p-hodnota superiority
|
P
emetrexed + cisplatina
|
G
e
m
citabín +
cisplatina
|
ITT populácia
(N = 1725)
|
10,3
(9,8 – 11,2)
|
N =862
|
10,3
(9,6 – 10,9)
|
N = 863
|
0,94a
(0,84 – 1,05)
|
0,259
|
Adenokarcinóm
(N =847)
|
12,6
(10,7 – 13,6)
|
N = 436
|
10,9
(10,2 – 11,9)
|
N = 411
|
0,84
(0,71–0,99)
|
0,033
|
Veľkobunkový
(N = 153)
|
10,4
(8,6 – 14,1)
|
N = 76
|
6,7
(5,5 – 9,0)
|
N = 77
|
0,67
(0,48–0,96)
|
0,027
|
Iné (N = 252)
|
8,6
(6,8 – 10,2)
|
N = 106
|
9,2
(8,1 – 10,6)
|
N = 146
|
1,08
(0,81–1,45)
|
0,586
|
Zo skvamóznych buniek (N = 473)
|
9,4
(8,4 – 10,2)
|
N = 244
|
10,8
(9,5 – 12,1)
|
N = 229
|
1,23 (1,00–1,51)
|
0,050
|
Skratky: CI = interval spoľahlivosti; ITT = so zámerom liečiť; n = veľkosť celej populácie.
a Štatisticky signifikantná pre noninferioritu, s celkovým intervalom spoľahlivosti pre HR výrazne
pod 1,17645 hranicou noninferiority (p< 0,001).
Kaplanove Meierove krivky celkového prežitia podľa histológie
1,0
0,9
0,8
AdenokarcinómAC
1,0
0,9
0,8
Veľkobunkový karcinómAC
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0,0
GC GC
0,7
0,6

0,5
0,4
0,3
0,2
0,1
0,0
Čas prežitia (mesiace)
Čas prežitia (mesiace)
Nepozorovali sa žiadne klinicky významné rozdiely týkajúce sa bezpečnostného profilu pemetrexedu s
cisplatinou v rámci histologických podskupín.
Pacienti liečení pemetrexedom a cisplatinou potrebovali menej transfúzií (16,4 % verzus 28,9 %, p< 0,001), transfúzií červených krviniek (16,1 % verzus 27,3 %, p< 0,001) a transfúzií krvných doštičiek (1,8 % versus 4,5 %, p = 0,002). Pacienti potrebovali tiež podávanie nižších dávok erytropoetínu/darbopoetínu (10,4 % versus 18,1 %, p< 0,001), G-CSF/GM-CSF (3,1 % versus 6,1 %, p = 0,004) a liekov s obsahom železa (4,3 % versus 7,0 %, p = 0,021).
NSCLC, udržiavacia liečba:
JMEN
Multicentrická randomizovaná dvojitozaslepená placebom kontrolovaná štúdia fázy 3 (JMEN)
porovnávala účinnosť a bezpečnosť udržiavacej liečby pemetrexedom spolu s najlepšou možnou podpornou liečbou (BSC) (n = 441) a podávaním placeba spolu s BSC (n = 222) u pacientov s lokálne pokročilým (štádium IIIB) alebo metastázujúcim (štádium IV) NSCLC, u ktorých nedošlo ku progresii po 4 cykloch terapie prvej línie dvojkombináciou obsahujúcou cisplatinu alebo karboplatinu v kombinácii s gemcitabínom, paklitaxelom alebo docetaxelom. Kombinovaná liečba obsahujúca v prvej
línii dvojkombináciu s pemetrexedom nebola zahrnutá. Všetci pacienti, ktorí sa zúčastnili tejto štúdie mali ECOG výkonnostný stav 0 alebo 1. Udržiavacia liečba sa pacientom podávala do progresie choroby. Účinnosť a bezpečnosť sa merali od začiatku randomizácie po dokončení (indukčnej) terapie prvej línie. Stredná hodnota počtu cyklov podaných pacientom bola 5 cyklov udržiavacej liečby pemetrexedom a 3,5 cyklu podávania placeba. Celkovo 213 pacientov (48,3 %) dokončilo ≥ 6 cyklov
a 103 pacientov (23,4 %) dokončilo ≥ 10 cyklov liečby pemetrexedom.
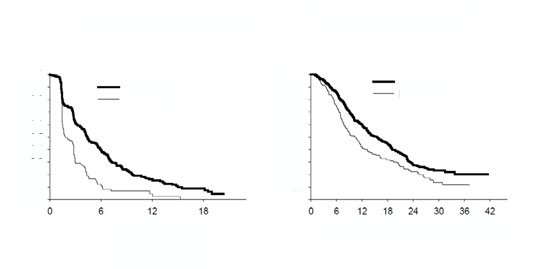
Štúdia dosiahla svoj primárny cieľ a preukázala štatisticky významné zlepšenie PFS v skupine
s pemetrexedom oproti skupine s placebom (n = 581, nezávisle hodnotená populácia,
medián 4,0 mesiacov, resp. 2,0 mesiacov) (pomer rizík = 0,60, 95 % CI = 0,49-0,73, p < 0,00001). Nezávislé hodnotenie pacientských skenov potvrdilo závery hodnotenia PFS zo strany skúšajúcich.
Stredná hodnota celkovej doby prežitia (OS) pre celú populáciu (n = 663) bola v skupine
s pemetrexedom 13,4 mesiacov a v skupine s placebom 10,6 mesiacov, pomer rizík = 0,79 (95 %, CI = 0,65 - 0,95, p = 0,01192).
V súlade s inými štúdiami s pemetrexedom sa v štúdii JMEN pozoroval rozdiel účinnosti s ohľadom
na histológiu NSCLC. U pacientov s NSCLC iného histologického typu ako prevažne skvamózneho (n
= 430, nezávisle hodnotená populácia) bola stredná hodnota celkovej doby prežívania bez progresie
(PFS) pri pemetrexede 4,4 mesiace a v skupine s placebom 1,8 mesiaca, pomer rizík = 0,47 (95 % CI
= 0,37-0,60, p = 0,00001). Stredná hodnota celkovej doby prežitia (OS) u pacientov s NSCLC iného histologického typu ako prevažne skvamózneho (n = 481) bola v skupine
s pemetrexedom 15,5 mesiacov a v skupine s placebom 10,3 mesiacov (pomer rizík = 0,70 (95 %
CI 0,56-0,88, p = 0,002). Stredná hodnota (OS) vrátane indukčnej fázy bola u pacientov s NSCLC
iného histologického typu ako prevažne skvamózneho v skupine s pemetrexedom 18,6 mesiacov a v skupine s placebom 13,6 mesiacov, pomer rizík = 0,71 (95 % CI = 0,56 - 0,88; p = 0,002).
U pacientov s karcinómom skvamózneho histologického typu nenaznačujú výsledky PFS ani OS
výhodu liečby pemetrexedom oproti placebu.
Medzi histologickými podskupinami sa v bezpečnostnom profile pemetrexedu nepozorovali žiadne klinicky signifikantné rozdiely.
JMEN: Kaplanova Meierova krivka doby prežívania bez progresie (PFS) a celkovej doby prežitia u pacientov s NSCLC iného histologického typu ako prevažne skvamózneho užívajúcich pemetrexed alebo placebo:
Doba prežívania bez progresie
Celková doba prežitia
1,0
0,9
0,8

0,7
0,6
0,5
0,4
0,3
0,2
0,1
0,0
Pemetrexed
Placebo
1,0
0,9
0,8
0,7
0,6
0,5
0,4

0,3
0,2
0,1
0,0
Pemetrexed
Placebo
Doba PFS (mesiace)
Doba prežívania (mesiace)
PARAMOUNT
Mutlicentrická randomizovaná dvojito zaslepená, placebom kontrolovaná štúdia
fázy 3 (PARAMOUNT) porovnávala účinnosť a bezpečnosť pokračovacej udržiavacej liečby
pemetrexedom s BSC (n = 359) oproti liečbe placebom s BSC (n = 180) u pacientov s lokálne
pokročilým (v štádiu IIIB) alebo metastatickým (v štádiu IV) NSCLC iného histologického typu, ako
prevažne zo skvamóznych buniek, u ktorých nedošlo k progresii ochorenia po 4 cykloch prvej línie liečby dvojkombináciou pemetrexedu s cisplatinou. Z celkového počtu 939 pacientov liečených pemetrexedom v kombinácii s cisplatinou bolo 539 pacientov randomizovaných na udržiavaciu liečbu pemetrexedom alebo placebom. Z randomizovaných pacientov odpovedalo na liečbu 44,9 % úplne/čiastočne a u 51,9 % došlo ku stabilizácii ochorenia po liečbe dvojkombináciou pemetrexedu s cisplatinou. Pacienti, ktorí boli randomizovaní na udržiavaciu liečbu, museli mať výkonnostný stav ECOG 0 alebo 1. Medián doby trvania od začiatku liečby pemetrexedom spolu s cisplatinou do začiatku udržiavacej liečby bol 2,96 mesiacov rovnako v skupine s pemetrexedom aj v skupine s placebom. Randomizovaní pacienti dostávali udržiavaciu liečbu, kým trvala progresia ochorenia. Účinnosť a bezpečnosť sa merali od randomizácie po ukončenie prvej línie (indukčnej) liečby. Stredné hodnoty počtu podaných cyklov boli 4 cykly udržiavacej liečby pemetrexedom a 4 cykly placeba. Celkovo ukončilo ≥6 cyklov udržiavacej liečby pemetrexedom 169 pacientov (47,1 %), čo predstavovalo minimálne 10 úplných cyklov s pemetrexedom.
Štúdia dosiahla svoj primárny cieľ a preukázala štatisticky významné zlepšenie PFS v skupine s pemetrexedom oproti skupine s placebom (n = 472, nezávisle hodnotená populácia, medián
3,9 mesiacov, resp. 2,6 mesiaca) (pomer rizík = 0,64, 95 % CI = 0,51-0,81, p < 0,0002). Nezávislé hodnotenie pacientskych skenov potvrdilo závery hodnotenia PFS zo strany skúšajúcich.
U randomizovaných pacientov, podľa meraní od začiatku indukčnej liečby prvej línie pemetrexedom s
cisplatinou, bol podľa hodnotení skúšajúcich medián PFS 6,9 mesiaca v skupine s pemetrexedom a 5,6 mesiaca v skupine s placebom (pomer rizík = 0,59 95 % CI = 0,47-0,74).
Liečba pemetrexedom, následne po indukčnej liečbe s pemetrexedom a cisplatinou (4 cykly), bola štatisticky lepšia než liečba placebom pre OS (medián 13,9 mesiacov oproti 11,0 mesiacom, pomer rizík = 0,78; 98 % CI = 0,64 – 0,96; p = 0,0195). V čase tejto konečnej analýzy prežitia bolo nažive alebo sa stratilo z pozorovania 28,7 % pacientov v ramene s pemetrexedom oproti 21,7 % v ramene s placebom. Relatívna liečebná efektivita pemetrexedu bola vnútorne konzistentná medzi podskupinami (vrátane štádia ochorenia, odpovede na indukčnú liečbu, ECOG PS, fajčiarskeho stavu, pohlavia, histológie a veku) a podobná tej, ktorá bola pozorovaná v neupravených analýzach OS a PFS. 1-ročné a 2-ročné prežívanie u pacientov užívajúcich pemetrexed bolo 58 % a 32 % oproti 45 % a 21 % u pacientov s placebom. Medián OS od začiatku prvolíniovej indukčnej liečby s pemetrexedom a cisplatinou bol 16,9 mesiacov u pacientov v ramene s pemetrexedom oproti 14,0 mesiacov v ramene s placebom (pomer rizík = 0,78; 95 % CI = 0,64 – 0,96). Percento pacientov, ktorí po ukončení štúdie pokračovali v liečbe bolo 64,3 % pre pemetrexed a 71,7 % pre placebo.
PARAMOUNT: Kaplanova Meierova krivka PFS a OS u pacientov s NSCLC iného histologického typu ako prevažne skvamóznych buniek, pokračujúcich v udržiavacej liečbe pemetrexedom alebo placebom (merané od randomizácie) Prežívanie bez progresie
Celkové prežívanie
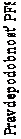
1,0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0,0
Pemetrexed
Placebo
1,0
0,9
0,8
0,7
0,6
0,5

0,4
0,3
0,2
0,1
0,0
Pemetrexed
Placebo
Doba PFS (mesiace) Doba OS (mesiace)
Bezpečnostné profily udržiavacej liečby pemetrexedom z dvoch klinických štúdií JMEN a
PARAMOUNT boli podobné.
5.2 Farmakokinetické vlastnosti
Farmakokinetické vlastnosti pemetrexedu po podaní lieku v monoterapii boli hodnotené
u 426 pacientov s rozličnými malígnymi solídnymi tumormi v dávkach od 0,2 do 838 mg/m2 podaných
v infúzii počas 10 minút. Distribučný objem pemetrexedu v ustálenom stave je 9 l/m2. Štúdie in vitro ukazujú, že približne 81 % pemetrexedu sa viaže na plazmatické proteíny. Táto väzba nebola výrazne ovplyvnená rôznymi stupňami renálneho poškodenia. Pemetrexed sa podrobuje v obmedzenej miere
pečeňovému metabolizmu. Pemetrexed je primárne eliminovaný močom, pričom 70 % až 90 % dávky
sa vylúči močom v nezmenenej forme v priebehu prvých 24 hodín od podania. Štúdie in vitro
naznačujú, že pemetrexed sa aktívne vylučuje pomocou OAT3 (organického aniónového transportéra 3). Celkový systémový klírens pemetrexedu je 91,8 ml/min a eliminačný polčas plazmy
je 3,5 hodín, u pacientov s normálnou obličkovou funkciou (klírens kreatinínu 90 ml/min). Variabilita
v klírense medzi pacientmi je mierna, a to 19,3 %. Celková systémová expozícia pemetrexedu (AUC) a maximálna plazmatická koncentrácia sa proporcionálne zvyšujú s dávkou. Farmakokinetika pemetrexedu je rovnaká aj po viacerých liečebných cykloch.
Farmakokinetické vlastnosti pemetrexedu nie sú ovplyvnené súčasným podávaním cisplatiny. Suplementácia perorálnou kyselinou listovou a intramuskulárnym vitamínom B12 neovplyvňujú farmakokinetiku pemetrexedu.
5.3 Predklinické údaje o bezpečnosti
Podanie pemetrexedu gravidným myšiam viedlo k zníženiu schopnosti vývoja plodu, zníženiu hmotnosti plodu, nekompletnej osifikácii niektorých kostných štruktúr, k rázštepu podnebia.
Podanie pemetrexedu samcom myší viedlo k reprodukčnej toxicite charakterizovanej redukciou výskytu fertility a testikulárnou atrofiou. V 9-mesačnej štúdii s použitím intravenóznej bolusovej injekcie vykonanej na bígloch bol pozorovaný testikulárny nález (degenerácia/nekróza semenotvorného epitelu). To naznačuje, že pemetrexed môže poškodiť mužskú fertilitu. Ženská fertilita nebola skúmaná.
Pemetrexed nebol mutagénny v in vitro chromozomálnom aberačnom teste u ovariálnych buniek čínskych škrečkov, ani v Amesovom teste. V mikronukleárnom teste in vivo u myší bolo zistené, že pemetrexed je klastogénny.
Štúdie hodnotiace karcinogénny potenciál pemetrexedu neboli vykonané.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol
Kyselina chlorovodíková (na úpravu pH) Hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Pemetrexed je fyzikálne inkompatibilný s rozpúšťadlami obsahujúcimi vápnik, vrátane laktátového Ringerovho roztoku a Ringerovho roztoku. Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Neotvorenáinjekčnáliekovka
P
emetrexed Baxter 100 mg prášok na koncentrát na infúzny roztok
18 mesiacov
Pemetrexed Baxter 500 mg prášok na koncentrát na infúzny roztok
2 roky
Rekonštituované a infúzne roztoky
Chemická a fyzikálna stabilita rekonštituovaných a infúznych roztokov pemetrexedu bola preukázaná
počas 24 hodín pri uchovávaní v chlade (2 °C – 8 °C). Z mikrobiologického hľadiska sa liek musí použiť ihneď. Ak sa nepoužije ihneď, za čas uchovávania a podmienky pred použitím je zodpovedný užívateľ, liek by v tomto prípade nemal byť uchovávaný dlhšie ako 24 hodín pri teplote od 2 °C
do 8 °C.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne špeciálne podmienky na uchovávanie.
Podmienky na uchovávanie lieku po rekonštitúcii, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Pemetrexed Baxter 100 mg prášok na koncentrát na infúzny roztok
10 ml sklenená injekčná liekovka typu I s chlórbutylovou gumenou zátkou s obsahom 100 mg pemetrexedu. 1 injekčná liekovka v balení.
Pemetrexed Baxter 500 mg prášok na koncentrát na infúzny roztok
50 ml sklenená injekčná liekovka typu I s chlórbutylovou gumenou zátkou s obsahom 500 mg pemetrexedu. 1 injekčná liekovka v balení.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
1. Použite aseptickú techniku počas rekonštitúcie a pri následnom riedení pemetrexedu na podanie intravenóznej infúzie.
2. Vypočítajte dávku a počet potrebných injekčných liekoviek s liekom Pemetrexed Baxter. Každá injekčná liekovka obsahuje väčšie množstvo pemetrexedu na uľahčenie prenosu označenej dávky.
3. Pemetrexed Baxter 100 mg prášok na koncentrát na infúzny roztok
Rekonštituujte 100 mg injekčnú liekovku pridaním 4,2 ml 0,9 % injekčného roztoku chloridu
sodného (9 mg/ml) bez konzervačných látok, čím vznikne roztok obsahujúci 25 mg/ml pemetrexedu.
Pemetrexed Baxter 500 mg prášok na koncentrát na infúzny roztok
Rekonštituujte 500 mg injekčnú liekovku pridaním 20 ml 0,9 % injekčného roztoku chloridu
sodného (9 mg/ml) bez konzervačných látok, čím vznikne roztok obsahujúci 25 mg/ml pemetrexedu.
Pohybujte jemným krúživým pohybom každou injekčnou liekovkou, až kým sa prášok úplne rozpustí. Výsledný roztok je číry a jeho farba kolíše od bezfarebnej po žltú alebo žltozelenú bez narušenia jeho kvality. pH pripraveného roztoku je medzi 6,6 a 7,8. Potrebné je ďalšie riedenie.
4. Príslušný objem rekonštituovaného roztoku pemetrexedu sa musí ďalej nariediť na 100 ml
s 0,9 % injekčným roztokom chloridu sodného (9 mg/l) bez použitia konzervačných prísad a podať ako intravenózna infúzia počas 10 minút.
5. Infúzne roztoky s pemetrexedom pripravené podľa vyššie uvedeného návodu sú kompatibilné s
polyolefínovými infúznymi setmi a infúznymi vakmi.
6. Lieky na parenterálnu aplikáciu sa musia pred aplikáciou vizuálne kontrolovať na prítomnosť drobných častíc a zmenu farby. V prípade prítomnosti drobných častíc neaplikujte.
7. Roztok pemetrexedu je určený len na jedno použitie. Všetky nepoužité lieky alebo odpad vzniknutý z liekov musia byť zlikvidované v súlade s národnými požiadavkami.
Bezpečnostnéopatreniapri príprave a podávaní liekuTak ako u iných potenciálne toxických protinádorových liekov, sa musí s infúznymi roztokmi pemetrexedu zaobchádzať starostlivo. Pri ich príprave sa odporúča použitie rukavíc. Ak sa roztok dostane do kontaktu s kožou, umyte kožu ihneď a dôkladne mydlom a vodou. Ak sa roztok pemetrexedu dostane do kontaktu so sliznicami, prepláchnite sliznice dôkladne vodou. Pemetrexed nie je vezikancium. V prípade úniku pemetrexedu mimo žilu neexistuje špecifické antidotum. Bolo popísaných pár prípadov úniku pemetrexedu mimo žilu, ktoré hodnotiaci lekár nepovažoval za závažné. Únik lieku mimo žilu musí byť liečený miestnymi štandardnými postupmi ako u iných nevezikancií.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBaxter Holding B.V.
Kobaltweg 49, 3542 CE Utrecht, Holandsko
8. REGISTRAČNÉ ČÍSLOEU/1/22/1705/001
EU/1/22/1705/002
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry
(EMEA)
http://www.ema.europa.eu.
PR
Í
L
OH
A II
A
. VÝROBCA ZODPOVEDNÝ ZA UVOĽNENIE ŠARŽE
B
. PODMIENKY ALEBO OBMEDZENIA TÝKAJÚCE SA VÝDAJA A POUŽITIA
C
. ĎALŠIE PODMIENKY A POŽIADAVKY REGISTRÁCIE
D
. PODMIENKY ALEBO OBMEDZENIA TÝKAJÚCE SA BEZPEČNÉHO A ÚČINNÉHO POUŽÍVANIA LIEKU
A
. VÝROBCA ZODPOVEDNÝ ZA UVOĽNENIE ŠARŽE
N
ázov a adresa výrobcu zodpovedného za uvoľnenie šarže
Baxter Oncology GmbH
Kantstrasse 2
33790 Halle/Westfalen
Nemecko
B. PODMIENKY ALEBO OBMEDZENIA TÝKAJÚCE SA VÝDAJA A POUŽITIA
Výdaj lieku viazaný na lekársky predpis s obmedzením predpisovania (pozri Prílohu I: Súhrn
charakteristických vlastností lieku, časť 4.2).
C. ĎALŠIE PODMIENKY A POŽIADAVKY REGISTRÁCIE
• Periodicky aktualizované správy o bezpečnosti (Periodic safety update reports, PSUR)
Požiadavky na predloženie PSUR tohto lieku sú stanovené v zozname referenčných dátumov Únie (zoznam EURD) v súlade s článkom 107c ods. 7 smernice 2001/83/ES a všetkých následných aktualizácií uverejnených na európskom internetovom portáli pre lieky.
D. PODMIENKY ALEBO OBMEDZENIA TÝKAJÚCE SA BEZPEČNÉHO A ÚČINNÉHO
POUŽÍVANIA LIEKU
• Plán riadenia rizík (RMP)
Držiteľ rozhodnutia o registrácii vykoná požadované činnosti a zásahy v rámci dohľadu nad liekmi, ktoré sú podrobne opísané v odsúhlasenom RMP predloženom v module 1.8.2 registračnej dokumentácie a vo všetkých ďalších odsúhlasených aktualizáciách RMP.
Aktualizovaný RMP je potrebné predložiť:
• na žiadosť Európskej agentúry pre lieky,
• vždy v prípade zmeny systému riadenia rizík, predovšetkým v dôsledku získania nových informácií, ktoré môžu viesť k výraznej zmene pomeru prínosu a rizika, alebo v dôsledku dosiahnutia dôležitého medzníka (v rámci dohľadu nad liekmi alebo minimalizácie rizika).
PR
ÍLOHA III
O
ZNAČEN
I
E OBALU A PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA
A
. OZNAČENIE OBALU









 ÚDA
JE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
ŠKATUĽA
1. NÁZOV LIEKU
ÚDA
JE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
ŠKATUĽA
1. NÁZOV LIEKU
Pemetrexed Baxter 100 mg prášok na koncentrát na infúzny roztok
pemetrexed
2. LIEČIVO (LIEČIVÁ)Každá injekčná liekovka obsahuje 100 mg pemetrexedu (ako disodná soľ pemetrexedu).
Po rekonštitúcii obsahuje každá injekčná liekovka 25 mg/ml pemetrexedu.
3. ZOZNAM POMOCNÝCH LÁTOKManitol, kyselina chlorovodíková, hydroxid sodný.
4. LIEKOVÁ FORMA A OBSAHPrášok na koncentrát na infúzny roztok.
1 injekčná liekovka
5. SPÔSOB A CESTA (CESTY) PODÁVANIANa intravenózne použitie po rekonštitúcii a zriedení.
Len na jednorazové použitie.
Pred použitím si prečítajte písomnú informáciu pre používateľa.
6. ŠPECIÁLNE UPOZORNENIE, ŽE LIEK SA MUSÍ UCHOVÁVAŤ MIMO DOHĽADUA DOSAHU DETÍUchovávajte mimo dohľadu a dosahu detí.
7. INÉ ŠPECIÁLNE UPOZORNENIE (UPOZORNENIA), AK JE TO POTREBNÉCytotoxické
8. DÁTUM EXSPIRÁCIEEXP
9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIE








 10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉ
11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCII
10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉ
11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCII
Baxter Holding B.V.
Kobaltweg 49, 3542 CE Utrecht
Holandsko
12. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/22/1705/001
13. ČÍSLO VÝROBNEJ ŠARŽELot
14. ZATRIEDENIE LIEKU PODĽA SPÔSOBU VÝDAJA15. POKYNY NA POUŽITIE16. INFORMÁCIE V BRAILLOVOM PÍSMEZdôvodnenie neuvádzať informáciu v Braillovom písme sa akceptuje.
17. ŠPECIFICKÝ IDENTIFIKÁTOR – DVOJROZMERNÝ ČIAROVÝ KÓDDvojrozmerný čiarový kód so špecifickým identifikátorom.
18. ŠPECIFICKÝ IDENTIFIKÁTOR – ÚDAJE ČITATEĽNÉ ĽUDSKÝM OKOMPC
SN NN






 MINIMÁLNE ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
ŠTÍTOK NA INJEKČNEJ LIEKOVKE
MINIMÁLNE ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
ŠTÍTOK NA INJEKČNEJ LIEKOVKE 100 mg balenie
1. NÁZOV LIEKU A CESTA (CESTY) PODÁVANIA'
Pemetrexed Baxter 100 mg prášok na koncentrát
pemetrexed
Intravenózne použitie po rekonštitúcii a zriedení
2. SPÔSOB PODÁVANIA3. DÁTUM EXSPIRÁCIEEXP
4. ČÍSLO VÝROBNEJ ŠARŽELot
5. OBSAH V HMOTNOSTNÝCH, OBJEMOVÝCH ALEBO V KUSOVÝCH JEDNOTKÁCH100 mg
6. INÉCytotoxické









 ÚDA
JE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
ŠKATUĽA
1. NÁZOV LIEKU
ÚDA
JE, KTORÉ MAJÚ BYŤ UVEDENÉ NA VONKAJŠOM OBALE
ŠKATUĽA
1. NÁZOV LIEKU
Pemetrexed Baxter 500 mg prášok na koncentrát na infúzny roztok
pemetrexed
2. LIEČIVOKaždá injekčná liekovka obsahuje 500 mg pemetrexedu (ako disodnú soľ pemetrexedu).
Po rekonštitúcii obsahuje každá injekčná liekovka 25 mg/ml pemetrexedu.
3. ZOZNAM POMOCNÝCH LÁTOKManitol, kyselina chlorovodíková, hydroxid sodný.
4. LIEKOVÁ FORMA A OBSAHPrášok na koncentrát na infúzny roztok.
1 injekčná liekovka
5. SPÔSOB A CESTA (CESTY) PODÁVANIANa intravenózne použitie po rekonštitúcii a zriedení.
Len na jednorazové použitie.
Pred použitím si prečítajte písomnú informáciu pre používateľa.
6. ŠPECIÁLNE UPOZORNENIE, ŽE LIEK SA MUSÍ UCHOVÁVAŤ MIMO DOHĽADUA DOSAHU DETÍUchovávajte mimo dohľadu a dosahu detí.
7. INÉ ŠPECIÁLNE UPOZORNENIA, AK JE TO POTREBNÉCytotoxické
8. DÁTUM EXSPIRÁCIEEXP
9. ŠPECIÁLNE PODMIENKY NA UCHOVÁVANIE








 10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉ
11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCII
10. ŠPECIÁLNE UPOZORNENIA NA LIKVIDÁCIU NEPOUŽITÝCH LIEKOV ALEBO ODPADOV Z NICH VZNIKNUTÝCH, AK JE TO VHODNÉ
11. NÁZOV A ADRESA DRŽITEĽA ROZHODNUTIA O REGISTRÁCII
Baxter Holding B.V.
Kobaltweg 49, 3542 CE Utrecht
Holandsko
12. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/22/1705/002
13. ČÍSLO VÝROBNEJ ŠARŽELot
14. ZATRIEDENIE LIEKU PODĽA SPÔSOBU VÝDAJA15. POKYNY NA POUŽITIE16. INFORMÁCIE V BRAILLOVOM PÍSMEZdôvodnenie neuvádzať informáciu v Braillovom písme sa akceptuje.
17. ŠPECIFICKÝ IDENTIFIKÁTOR – DVOJROZMERNÝ ČIAROVÝ KÓDDvojrozmerný čiarový kód so špecifickým identifikátorom.
18. ŠPECIFICKÝ IDENTIFIKÁTOR – ÚDAJE ČITATEĽNÉ ĽUDSKÝM OKOMPC
SN NN






 MINIMÁLNE ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
ŠTÍTOK NA INJEKČNEJ LIEKOVKE
MINIMÁLNE ÚDAJE, KTORÉ MAJÚ BYŤ UVEDENÉ NA MALOM VNÚTORNOM OBALE
ŠTÍTOK NA INJEKČNEJ LIEKOVKE 500 mg balenie
1. NÁZOV LIEKU A CESTA (CESTY) PODÁVANIAPemetrexed Baxter 500 mg prášok na koncentrát
pemetrexed
Intravenózne použitie po rekonštitúcii a zriedení
2. SPÔSOB PODÁVANIA3. DÁTUM EXSPIRÁCIEEXP
4. ČÍSLO VÝROBNEJ ŠARŽELot
5. OBSAH V HMOTNOSTNÝCH, OBJEMOVÝCH ALEBO V KUSOVÝCH JEDNOTKÁCH500 mg
6. INÉCytotoxické
B
. PÍSOMNÁ INFORMÁCIA PRE POUŽÍVATEĽA
P
ís
o
m
ná informácia pre používateľa
P
emetrexed Baxter 100 mg prášok na koncentrát na infúzny roztok Pemetrexed Baxter 500 mg prášok na koncentrát na infúzny roztok pemetrexed
Pozorne si prečítajte celú písomnú informáciu predtým, ako začnete užívať tento liek.
- Túto písomnú informáciu si uschovajte. Možno bude potrebné, aby ste si ju znovu prečítali.
- Ak máte akékoľvek ďalšie otázky, obráťte sa na svojho lekára alebo lekárnika.
- Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika.
To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii
pre používateľa. Pozri časť 4.
V tejto písomnej informácii sa dozviete
1. Čo je Pemetrexed Baxter a na čo sa používa
2. Čo potrebujete vedieť predtým, ako použijete liek Pemetrexed Baxter
3. Ako používať liek Pemetrexed Baxter
4. Možné vedľajšie účinky
5. Ako uchovávať liek Pemetrexed Baxter
6. Obsah balenia a ďalšie informácie
1. Čo je Pemetrexed Baxter a na čo sa používa
Pemetrexed Baxter je liek určený na liečbu zhubných nádorov.
Pemetrexed Baxter sa podáva v kombinácii s cisplatinou, ďalším protirakovinovým liekom, na liečbu malígneho mezoteliómu pleury, typu rakoviny, ktorý postihuje výstelku pľúc, pacientom, ktorí
predtým nedostávali chemoterapiu.
Pemetrexed Baxter sa tiež podáva v kombinácii s cisplatinou na počiatočnú liečbu pacientov s pokročilým štádiom rakoviny pľúc.
Pemetrexed Baxter vám môžu predpísať aj ak máte rakovinu pľúc v pokročilom štádiu a vaše ochorenie reagovalo na liečbu alebo ostalo po počiatočnej chemoterapii prevažne nezmenené.
Pemetrexed Baxter je tiež určený na liečbu pacientov s pokročilým štádiom rakoviny pľúc, u ktorých dôjde ku zhoršeniu ochorenia po tom, čo bola použitá iná úvodná chemoterapia.
2. Čo potrebujete vedieť predtým, ako použijete liek Pemetrexed Baxter
Neužívajte liek Pemetrexed Baxter
- ak ste alergický na pemetrexed alebo na ktorúkoľvek z ďalších zložiek tohto lieku (uvedených v časti 6).
- ak dojčíte, musíte počas liečby liekom Pemetrexed Baxter dojčenie prerušiť.
- ak ste nedávno dostali, alebo v najbližšej dobe máte dostať vakcínu proti žltej zimnici.
Upozornenia a opatrenia
Obráťtesanasvojholekáraalebonemocničnéholekárnikapredtým,akozačneteužívaťliek Pemetrexed Baxter.
Ak máte alebo ste mali problémy s obličkami, oznámte to svojmu lekárovi alebo nemocničnému
lekárnikovi, pretože by nemuselo byť vhodné, aby ste dostávali liek Pemetrexed Baxter.
Pred každou infúziou vám bude odobratá krv na vyšetrenie, či máte v poriadku funkciu obličiek a pečene a na kontrolu, či máte dostatočný počet krviniek, aby ste mohli dostať liek Pemetrexed Baxter. Váš lekár sa môže rozhodnúť zmeniť dávku alebo oddialiť liečbu v závislosti na vašom celkovom
zdravotnom stave a v prípade, že máte príliš nízky počet krviniek. Pokiaľ užívate súčasne cisplatinu, váš lekár sa presvedčí, že ste dostatočne hydratovaný/á a pred liečbou cisplatinou a po nej dostanete vhodné lieky, ktoré zabránia vracaniu.
Keď ste podstúpili alebo idete podstúpiť rádioterapiu, prosím, oznámte to vášmu lekárovi, pretože sa môže u vás objaviť včasná alebo neskorá reakcia na ožarovanie pri lieku Pemetrexed Baxter.
Keď ste boli v poslednej dobe očkovaný/á, prosím, oznámte to vášmu lekárovi, pretože to môže
pravdepodobne spôsobiť nepriaznivé účinky pri lieku Pemetrexed Baxter. Oznámte, prosím, svojmu lekárovi ak máte alebo ste mali choré srdce.
Ak u vás došlo k nahromadeniu tekutiny v okolí pľúc, môže sa lekár rozhodnúť pred podaním lieku
Pemetrexed Baxter túto tekutinu odstrániť.
Deti a dospievajúci:
Tento liek nemajú užívať deti ani dospievajúci, pretože nie sú žiadne skúsenosti s týmto liekom u detí
a dospievajúcich mladších ako 18 rokov.
Iné lieky a Pemetrexed Baxter
Oznámte prosím vášmu lekárovi, keď užívate nejaké lieky proti bolesti alebo zápalu (opuchu), ako sú tzv. nesteroidné protizápalové lieky (NSA), vrátane liekov, ktoré sú voľne predajné bez lekárskeho predpisu (ako napríklad ibuprofén). Existuje mnoho druhov NSA s rôznou dobou účinnosti. Na základe plánovaného dátumu infúzie lieku Pemetrexed Baxter a/alebo stavu funkcie vašich obličiek vám lekár odporučí, ktoré lieky môžete používať a kedy ich môžete používať. Pokiaľ si nie ste istý, spýtajte sa svojho lekára alebo lekárnika, či niektorý z vašich liekov nie je NSA.
Ak užívate alebo ste v poslednom čase užívali ešte iné lieky, vrátane liekov, ktorých výdaj nie je
viazaný na lekársky predpis, oznámte to, prosím, svojmu lekárovi alebo lekárnikovi.
Tehotenstvo
Ak ste tehotná, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte sa so svojím
lekárom. Použitiu lieku Pemetrexed Baxter sa treba v tehotenstve vyvarovať. Váš lekár s vami preberie možné riziká používania lieku Pemetrexed Baxter v tehotenstve. V priebehu liečby liekom Pemetrexed Baxter a 6 mesiacov po užití poslednej dávky musia ženy používať účinnú antikoncepciu.
Dojčenie
Ak dojčíte, oznámte to svojmu lekárovi.
Počas liečby liekom Pemetrexed Baxter sa musí dojčenie prerušiť.
Plodnosť
Muži by nemali splodiť deti počas liečby a do 3 mesiacov po liečbe liekom Pemetrexed Baxter, a preto
by mali počas liečby liekom Pemetrexed Baxter a 3 mesiace po jej skončení používať účinnú antikoncepciu. Ak v priebehu liečby alebo v priebehu 3 mesiacov po ukončení liečby chcete splodiť dieťa, poraďte sa so svojím lekárom alebo lekárnikom. Pemetrexed Baxter môže ovplyvniť vašu schopnosť splodiť deti. Poraďte sa so svojím ošetrujúcim lekárom o možnosti uchovania spermií pred začatím liečby.
Vedenie vozidla a obsluha strojov
Pemetrexed Baxter môže vyvolať únavu. Pri vedení vozidla a obsluhe strojov buďte opatrný(á).
Pemetrexed Baxter obsahuje sodík
Pemetrexed Baxter 100 mg prášok na koncentrát na infúzny roztok
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej injekčnej liekovke, t. j. v podstate zanedbateľné množstvo sodíka.
P
emetrexed Baxter 500 mg prášok na koncentrát na infúzny roztok
Tento liek obsahuje 54 mg sodíka (hlavnej zložky kuchynskej soli) v jednej injekčnej liekovke.
To zodpovedá 2,7 % odporúčaného maximálneho denného príjmu sodíka pre dospelú osobu.
3. Ako používať liek Pemetrexed Baxter
Dávka lieku Pemetrexed Baxter je 500 miligramov na každý štvorcový meter vášho telesného povrchu. Vaša výška a hmotnosť sa merajú za účelom výpočtu vášho telesného povrchu. Lekár použije údaj o vašom telesnom povrchu na výpočet vašej správnej dávky. Táto dávka môže byť
upravená, prípadne liečba môže byť oddialená v závislosti na počte vašich krviniek a vašom celkovom zdravotnom stave. Nemocničný lekárnik, zdravotná sestra alebo lekár zmieša liek Pemetrexed Baxter
v prášku predtým, ako vám bude podaná s 0,9 % injekčným roztokom chloridu sodného (9 mg/ml).
Liek Pemetrexed Baxter dostanete vždy v infúzii do jednej z vašich žíl. Táto infúzia bude trvať
približne 10 minút.
Ak dostanete liek Pemetrexed Baxter v kombinácii s cisplatinou:
Lekár alebo nemocničný lekárnik vypočíta potrebnú dávku na základe vašej výšky a hmotnosti. Cisplatina sa podáva takisto do žily a podáva sa približne 30 minút po ukončení infúzie lieku Pemetrexed Baxter. Infúzia cisplatiny bude trvať približne 2 hodiny.
Infúziu musíte obvykle dostávať raz za 3 týždne.
Ďalšie lieky:
Kortikosteroidy: váš lekár vám predpíše steroidné tablety (v dávke zodpovedajúcej 4 mg dexametazónu dvakrát denne), ktoré budete užívať v deň pred liečbou liekom Pemetrexed Baxter, v deň jej podania a nasledujúci deň po jej podaní. Tento liek budete dostávať na zníženie frekvencie a závažnosti kožných reakcií, ktoré sa môžu objaviť počas protinádorovej liečby.
Dopĺňanie vitamínov: váš lekár vám predpíše perorálnu kyselinu listovú (vitamín) alebo multivitamín s obsahom kyseliny listovej (350 až 1 000 mikrogramov), ktoré budete musieť užívať raz denne počas liečby liekom Pemetrexed Baxter. Počas siedmich dní pred prvou dávkou lieku Pemetrexed Baxter si musíte vziať najmenej 5 dávok kyseliny listovej. Musíte pokračovať v užívaní kyseliny listovej
ešte 21 dní po poslednej dávke lieku Pemetrexed Baxter. Dostanete taktiež injekciu vitamínu
B12 (1 000 mikrogramov) a to v týždni pred podaním lieku Pemetrexed Baxter a ďalej približne každých 9 týždňov (čo zodpovedá 3 kúram liečby liekom Pemetrexed Baxter). Vitamín B12 a kyselinu listovú dostanete na zníženie možných toxických účinkov protinádorovej liečby.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára alebo
lekárnika.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého. Akonáhle zaznamenáte akýkoľvek z nižšie uvedených nežiaducich účinkov, musíte ihneď kontaktovať
svojho lekára:
§ horúčka alebo infekcia (v danom poradí, často alebo veľmi často): keď máte teplotu 38 ºC alebo
vyššiu, potenie alebo iné známky infekcie (pretože môžete mať menej bielych krviniek ako normálne, čo je veľmi časté). Infekcia (sepsa) môže byť závažná a môže spôsobiť smrť
§ keď začnete pociťovať bolesť na hrudníku (často) alebo máte rýchlu srdcovú frekvenciu (menej
často).
§ keď máte bolesti, začervenanie, opuch alebo afty v ústach (veľmi často).
§ alergická reakcia: keď sa vyvinie kožná vyrážka (veľmi často), pocity pálenia alebo svrbenia (často), prípadne horúčka (často). Kožné reakcie môžu byť zriedkavo závažné až smrteľné. Obráťte sa na svojho lekára, ak sa u vás objavia rozsiahle vyrážky, svrbenie alebo pľuzgiere (Stevensov-Johnsonov syndróm alebo toxická epidermálna nekrolýza)
§ keď pozorujete únavu, pociťujete nevoľnosť, ľahko sa zadýchate alebo ste bledý(á) (pretože
môžete mať menej krvného farbiva hemoglobínu ako je normálne, čo je veľmi časté).
§ keď pozorujete krvácanie z ďasien, nosa alebo úst, prípadne akékoľvek krvácanie, ktoré sa ťažko zastavuje, červenkastý alebo ružovkastý moč, neočakávanú tvorbu modrín (pretože
môžete mať nižší počet krvných doštičiek ako je normálne, čo je časté)
§ Keď spozorujete náhlu dýchavičnosť, intenzívnu bolesť v hrudi, alebo pri kašli vykašliavate krv
(menej časté) (môže to svedčiť o prítomnosti krvnej zrazeniny v pľúcnych cievach) Ďalšie vedľajšie účinky lieku Pemetrexed Baxter môžu zahŕňať:
Veľmi časté (môžu postihovať viac ako 1 z 10 osôb)
Infekcia
Faryngitída (bolesť hrdla)
Nízky počet neutrofilových granulocytov (druh bielych krviniek) Nízky počet bielych krviniek
Nízka hladina hemoglobínu (anémia)
Bolesť, začervenanie, opuch alebo afty v ústach
Strata chuti do jedla
Vracanie
Hnačka
Nutkanie na vracanie/nevoľnosť
Kožná vyrážka
Odlupujúcu sa koža
Nálezy pri vyšetrení krvi mimo normu, poukazujúce na zníženú funkčnosť obličiek
Únava (vyčerpanosť)
Časté (môžu postihovať menej ako 1 z 10 osôb)
Infekcia krvi
Zvýšená telesná teplota s nízkym počtom neutrofilných granulocytov (druh bielych krviniek)
Nízky počet krvných doštičiek
Alergická reakcia
Strata telesných tekutín
Zmena vnímania chuti
Poškodenie motorických nervov, ktoré môže spôsobiť svalovú slabosť a atrofiu (zakrpatenie) najmä v
ramenách a nohách
Poškodenie senzorických nervov, ktoré môže spôsobiť stratu citlivosti, pálivú bolesť a nestabilnú
chôdzu
Závraty
Zápal alebo opuch spojovky (membrány, ktorá lemuje očné viečka a pokrýva očné bielka)
Suché oko
Slziace oči
Suchosť spojovky (membrány, ktorá lemuje očné viečka a pokrýva očné bielka) a rohovky (priesvitnej
blany, ktorá prekrýva dúhovku a zrenicu)
Opuch očných viečok
Poruchy oka vrátane suchých očí, slzenia, podráždenia a/alebo bolesti očí
Zlyhanie srdca (stav, ktorý ovplyvňuje čerpaciu silu vašich srdcových svalov)
Nepravidelný rytmus srdca
Tráviace ťažkosti
Zápcha
Bolesť brucha
Pečeň: zvýšenie hladiny chemických látok v krvi prechádzajúcej pečeňou
Zvýšená pigmentácia kože (zmena farby kože) Svrbenie
Vyrážka na koži, kde každá pripomína volské oko
Vypadávanie vlasov
Žihľavka
Náhle zlyhanie obličiek Znížená činnosť obličiek Zvýšená telesná teplota Bolesť
Nadbytočná tekutina v tkanive, spôsobujúca opuch
Bolesť na hrudi
Zápal a tvorba vredov na slizniciach lemujúcich tráviaci trakt
Menej časté (môžu postihovať menej ako 1 zo 100 osôb) Znížený počet červených, bielych krviniek a krvných doštičiek Mozgová porážka
Typ mŕtvice, keď je upchatá tepna do mozgu
Vnútrolebečné krvácanie
Angína (bolesť na hrudi spôsobená zníženým prítokom krvi do srdca)
Infarkt
Zúženie alebo upchatie koronárnych tepien
Zrýchlený tlkot srdca
Nedostatočné prekrvenie končatín
Nepriechodnosť jednej z pľúcnych artérií
Zápal a zjazvenie sliznice pľúc s dýchacími problémami
Vytekanie jasne červenej krvi z konečníka Krvácanie v gastrointestinálnom trakte Roztrhnuté črevo
Zápal výstelky pažeráka
Zápal výstelky hrubého čreva, ktorý môže byť sprevádzaný črevným alebo rektálnym krvácaním
(pozorované iba v kombinácii s cisplatinou)
Zápal, opuch, erytém a erózia sliznicového povrchu pažeráka spôsobená ožarovaním
Zápal pľúc spôsobený ožarovaním
Zriedkavé (môžu postihovať menej ako 1 z 1 000 osôb)
Zničenie červených krviniek
Anafylaktický šok (závažná alergická reakcia)
Zápalové ochorenie pečene
Sčervenanie kože
Kožná vyrážka, ktorá sa vyvíja v celej predtým ožiarenej oblasti
Veľmi zriedkavé (môžu postihovať menej ako 1 z 10 000 osôb)
Infekcie kože a mäkkých tkanív
Stevensov-Johnsonov syndróm (druh závažnej reakcie na kožu a sliznicu, ktorá môže ohrozovať život)
Toxická epidermálna nekrolýza (druh závažnej kožnej reakcie, ktorá môže ohrozovať život) Autoimunitné ochorenie, ktoré má za následok vyrážky a pľuzgiere na nohách, pažiach a bruchu Zápal kože charakterizovaný prítomnosťou búl, ktoré sú naplnené tekutinou
Krehkosť kože, pľuzgiere a erózie a zjazvenie kože
Sčervenenie, bolesť a opuch hlavne dolných končatín
Zápal kože a tuku pod kožou (pseudocelulitída) Zápal kože (dermatitída)
Pokožka zapálená, svrbivá, červená, popraskaná a drsná
Intenzívne svrbivé miesta
Neznáme (častosť sa nedá odhadnúť z dostupných údajov)
Forma diabetu spôsobená patológiou obličiek
Porucha obličiek zahŕňajúca smrť tubulárnych epitelových buniek, ktoré tvoria obličkové kanáliky
Môže sa u vás vyskytnúť akýkoľvek z uvedených prejavov a/alebo stavov. Ak spozorujete niektorý z
týchto vedľajších účinkov, musíte to oznámiť svojmu lekárovi ihneď ako to bude možné. Ak ste znepokojený akýmkoľvek vedľajšim účinkom porozprávajte sa so svojím lekárom.
Hlásenie vedľajších účinkov
Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie
účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené v
prílohe V. Hlásením
vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať liek Pemetrexed BaxterTento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na štítku injekčnej liekovky a škatuli po EXP. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Tento liek nevyžaduje žiadne špeciálne podmienky na uchovávanie.
Rekonštituované a infúzne roztoky: Liek sa má použiť ihneď. Keď je pripravený podľa návodu, chemická a fyzikálna stabilita rekonštituovaného a infúzneho roztoku pemetrexedu bola preukázaná počas 24 hodín pri uchovávaní v chlade (2 °C – 8 °C).
Tento liek je určený iba na jednorazové použitie, akýkoľvek nepoužitý roztok musí byť zlikvidovaný v
súlade s národnými požiadavkami.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo Pemetrexed Baxter obsahujeLiečivo je pemetrexed.
Ďalšie zložky sú manitol, kyselina chlorovodíková a hydroxid sodný (pozri časť 2 „Pemetrexed Baxter obsahuje sodík“).
Pemetrexed Baxter 100 mg: každá injekčná liekovka obsahuje 100 miligramov pemetrexedu (ako
disodnú soľ pemetrexedu)
Pemetrexed Baxter 500 mg: každá injekčná liekovka obsahuje 500 miligramov pemetrexedu (ako
disodnú soľ pemetrexedu)
Po rekonštitúcii roztok obsahuje 25 mg/ml pemetrexedu. Pred podaním je potrebné ďalšie nariedenie
zdravotníckym pracovníkom.
Ako vyzerá Pemetrexed Baxter a obsah baleniaPemetrexed Baxter je prášok na infúzny koncentrát v 10 ml alebo 50 ml sklenenej injekčnej liekovke
s gumenou zátkou. Je to biely až svetložltý alebo zeleno-žltý lyofilizovaný prášok.
Je dostupný v baleniach obsahujúcich 1 injekčnú liekovku.
D
ržiteľ rozhodnutia o registrácii
Baxter Holding B.V.
Kobaltweg 49, 3542 CEUtrecht
Holandsko
Výrobca
Baxter Oncology GmbH Kantstraße 2
33790 Halle/Westfalen
Nemecko
Ak potrebujete akúkoľvek informáciu o to
rozhodnutia o registrácii:
België/Belgique/Belgien Baxter Belgium SPRL/BVBA Tél/Tel: +32 (0)2 386 80 00 braine_reception@baxter.com
|
mto lieku, kontaktujte miestneho zástupcu držiteľa
Lietuva
UAB „Baxter Lithuania“ Tel: +37052527100
|
България
Baxter Holding B.V.
Teл.: +31 (0)30 2488 911
|
L
uxembourg/Luxemburg Baxter Belgium SPRL/BVBA Tél/Tel: +32 (0)2 386 80 00 braine_reception@baxter.com
|
Č
eská republika
BAXTER CZECH spol. s r.o. Tel: +420 225 774 111
|
Magyarország Baxter Hungary Kft. Tel: +36 1 202 1980
|
D
anmark
Baxter A/S
Tlf: +45 4816 6400
|
Malta
Baxter Holding B.V.
Tel: +44 (0)1635 206345
|
D
eutschland
Baxter Deutschland GmbH Tel: +49 (0)89 31701-0
info_de@baxter.com
|
N
ederland
Baxter B.V.
Tel: +31 (0)30 2488 911
utrecht_reception@baxter.com
|
E
esti
OÜ Baxter Estonia
Tel: +372 651 5120
|
N
orge
Baxter AS
Tlf: +47 22 58 48 00
|
Ε
λλάδα
Baxter (Hellas) Ε.Π.Ε.,
Τηλ: +30 210 28 80 000
|
Ö
sterreich
Baxter Healthcare GmbH Tel: +43 1 71120 0 austria_office_healthcare@baxter.com
|
E
s
paña
Baxter S.L.
Tel: +34 91 678 93 00
|
Polska
Baxter Polska Sp. z o.o. Tel: +48 22 488 37 77
|
France
Baxter SAS
Tél: +33 1 34 61 50 50
|
Portugal
Baxter Médico Farmacêutica, Lda. Tel: +351 21 925 25 00
|
H
rvatska
Baxter Healthcare d.o.o. Tel: +385 1 6610314
|
R
omânia
BAXTER HEALTHCARE SRL Tel: +40 372 302 053
37
|
|
|
Ireland
Baxter Holding B.V.
Tel: +44 (0)1635 206345
Slovenija
Baxter d.o.o.
Tel: +386 1 420 16 80
Ísland
Baxter Medical AB Sími: +46 8 632 64 00
Slovenská republika
Baxter Slovakia s.r.o. Tel: +421 2 32 10 11 50
It
alia
Baxter S.p.A.
Tel: +390632491233
Suomi/Finland
Baxter Oy
Puh/Tel: +358 (09) 862 111
Κύ
πρ
ος
P.T. Hadjigeorgiou Co Ltd
Τηλ: +357 25 37 24 25
Sverige
Baxter Medical AB
Tel: +46 (0)8 632 64 00
L
atvija
Baxter Latvia SIA Tel: +371 677 84784
United Kingdom (Northern Ireland)
Baxter Holding B.V.
Tel: +44 (0)1635 206345
T
áto písomná informácia bola naposledy aktualizovaná v MM/RRRR.
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/
 N
asledujúca
i
nformácia
j
e
určená
lenprezdravotníckych pracovníkov:
Pokyny na použitie, zaobchádzanie s liekom a likvidáciu.
N
asledujúca
i
nformácia
j
e
určená
lenprezdravotníckych pracovníkov:
Pokyny na použitie, zaobchádzanie s liekom a likvidáciu.
1. Použite aseptickú techniku počas rekonštitúcie a následnom riedení pemetrexedu na podanie
intravenóznej infúzie.
2. Vypočítajte dávku a počet potrebných injekčných liekoviek s liekom Pemetrexed Baxter. Každá injekčná liekovka obsahuje väčšie množstvo pemetrexedu na uľahčenie prenosu označenej dávky.
3. Pemetrexed Baxter 100 mg:
Zmiešajte 100 mg injekčnej liekovky so 4,2 ml 0,9 % injekčného roztoku chloridu sodného
(9 mg/ml) bez použitia konzervačných prísad, čím vznikne roztok obsahujúci 25 mg/ml pemetrexedu.
Pemetrexed Baxter 500 mg:
Zmiešajte 500 mg injekčnej liekovky s 20 ml 0,9 % injekčného roztoku chloridu sodného
(9 mg/ml) bez použitia konzervačných prísad, čím vznikne roztok obsahujúci 25 mg/ml pemetrexedu.
Pohybujte jemným krúživým pohybom každou injekčnou liekovkou až kým sa prášok úplne rozpustí. Výsledný roztok je číry a jeho farba kolíše od bezfarebnej po žltú alebo žltozelenú bez narušenia jeho kvality. pH rekonštituovaného roztoku je medzi 6,6 a 7,8.
Potrebné je ďalšie riedenie.4. Príslušný objem rekonštituovaného roztoku pemetrexedu sa musí ďalej nariediť na 100 ml
s 0,9 % injekčným roztokom chloridu sodného (9 mg/l) bez použitia konzervačných prísad a podať ako intravenózna infúzia počas 10 minút.
5. Infúzne roztoky s pemetrexedom pripravené podľa vyššie uvedeného návodu sú kompatibilné s polyolefínovými infúznymi setmi a infúznymi vakmi. Pemetrexed je inkompatibilný s rozpúšťadlami obsahujúcimi vápnik, vrátane Ringerovho injekčného roztoku s laktátom a Ringerovho injekčného roztoku.
6. Lieky na parenterálnu aplikáciu sa musia pred aplikáciou vizuálne kontrolovať na prítomnosť drobných častíc a zmenu farby. V prípade prítomnosti drobných častíc neaplikujte.
7. Roztok pemetrexedu je určený len na jedno použitie. Všetky nepoužité lieky alebo odpad vzniknutý z liekov majú byť zlikvidované v súlade s národnými požiadavkami.
Bezpečnostné opatrenia pri príprave a podávaní lieku: Tak ako u iných potenciálne toxických protinádorových liekov, sa musí s infúznymi roztokmi pemetrexedu zaobchádzať starostlivo. Pri ich príprave sa odporúča použitie rukavíc. Ak sa roztok dostane do kontaktu s kožou, umyte kožu ihneď a dôkladne mydlom a vodou. Ak sa roztok pemetrexedu dostane do kontaktu so sliznicami, prepláchnite sliznice dôkladne vodou. Pemetrexed nie je vezikancium. V prípade úniku pemetrexedu mimo žilu neexistuje špecifické antidotum. Bolo popísaných pár prípadov úniku pemetrexedu mimo žilu, ktoré hodnotiaci lekár nepovažoval za závažné. Únik lieku mimo žilu musí byť liečený miestnymi štandardnými postupmi ako u iných nevezikancií.