
vitro.
Bezpečnosť a účinnosť pegfilgrastimu sa neskúmali u pacientov s myelodysplastickým syndrómom, chronickou myeloidnou leukémiou a u pacientov so sekundárnou AML, preto sa nemá používať
u týchto pacientov. Osobitnú pozornosť treba venovať rozlíšeniu blastického zvratu pri chronickej myeloidnej leukémie od AML.
Bezpečnosť a účinnosť pegfilgrastimu podávaného u pacientov s AML de novo vo veku < 55 rokov s cytogenetikou t(15; 17) sa neskúmali.
Bezpečnosť a účinnosť pegfilgrastimu sa neskúmali u pacientov užívajúcich vysoké dávky chemoterapie. Tento liek sa nemá použiť na zvýšenie dávok cytotoxickej chemoterapie nad stanovené dávkovacie režimy.
Pľúcne nežiaduce reakcie
Po podaní G-CSF boli hlásené pľúcne nežiaduce reakcie, osobitne intersticiálna pneumónia. Zvýšené
riziko je u pacientov, ktorí majú v nedávnej anamnéze pulmonálne infiltráty alebo pneumóniu (pozri
časť 4.8).
Výskyt pulmonálnych prejavov, ako sú kašeľ, horúčka a dyspnoe, v spojení s rádiologickými dôkazmi pulmonálnych infiltrátov a zhoršenie pulmonálnych funkcií spolu so zvýšeným počtom neutrofilov môže predstavovať začiatočné príznaky syndrómu respiračnej tiesne dospelých (acute respiratory distress syndrome, ARDS). Za takýchto okolností sa má podávanie pegfilgrastimu podľa uváženia lekára prerušiť a má sa začať vhodná liečba (pozri časť 4.8).
Glomerulonefritída
U pacientov užívajúcich filgrastim a pegfilgrastim bola hlásená glomerulonefritída. Vo všeobecnosti
sa po znížení dávky alebo po vysadení filgrastimu a pegfilgrastimu prípady glomerulonefritídy upravili. Odporúča sa sledovať rozbor moču.
Syndróm kapilárneho presakovania
Po podaní faktora stimulujúceho kolónie granulocytov sa zaznamenal syndróm kapilárneho
presakovania, ktorý je charakterizovaný hypotenziou, hypoalbuminémiou, edémom
a hemokoncentráciou. Pacienti, u ktorých sa vyvinú príznaky syndrómu kapilárneho presakovania, sa majú starostlivo sledovať a majú dostať štandardnú symptomatickú liečbu, ktorá môže zahŕňať potrebu intenzívnej starostlivosti (pozri časť 4.8).
Splenomegália a ruptúra sleziny
Po podaní pegfilgrastimu boli hlásené zvyčajne asymptomatické prípady splenomegálie a prípady
ruptúry sleziny, vrátane niekoľkých smrteľných prípadov (pozri časť 4.8). Z toho dôvodu je potrebné starostlivo sledovať veľkosť sleziny (napr. fyzikálnym vyšetrením, ultrazvukom). Diagnóza ruptúry sleziny má byť vzatá do úvahy u pacientov s bolesťami v oblasti brušnej dutiny vľavo hore alebo
s bolesťami hornej časti ramena.
Trombocytopénia a anémia
Liečba samotným pegfilgrastimom nezabraňuje trombocytopénii a anémii, pretože myelosupresívna
chemoterapia je udržiavaná na plných dávkach podľa predpísaného režimu. Odporúča sa pravidelné sledovanie počtu krvných doštičiek a hematokritu. Špeciálna opatrnosť je potrebná pri podávaní jednej chemoterapie alebo kombinácie chemoterapií, o ktorých je známe, že spôsobujú závažnú trombocytopéniu.
Kosáčikovitá anémia
Krízy kosáčikovitej anémie sú spájané s podávaním pegfilgrastimu pacientom s bunkami
s kosáčikovitým charakterom alebo s kosáčikovitou anémiou (pozri časť 4.8). Preto majú lekári pri predpisovaní pegfilgrastimu pacientom s bunkami s kosáčikovitým charakterom alebo s kosáčikovitou anémiou postupovať opatrne, monitorovať príslušné klinické parametre a laboratórne funkcie a venovať pozornosť možnej spojitosti medzi týmto liekom a zväčšením sleziny a vznikom
vazooklúznej krízy.
Leukocytóza
Menej ako 1 % pacientov liečených pegfilgrastimom vykazovalo počet bielych krviniek (WBC) 100 x
109/l alebo vyšší. Neboli hlásené nežiaduce reakcie priamo pripísateľné tomuto stupňu leukocytózy. Takéto zvýšenie počtu WBC je prechodné, zvyčajne sa objavuje 24 až 48 hodín po podaní a je v súlade s farmakodynamickými účinkami tohto lieku. V súlade s klinickými účinkami a potenciálu pre
leukocytózu sa má WBC kontrolovať počas liečby v pravidelných intervaloch. Ak počet leukocytov
prevýši 50 x 109/l po očakávanom minime, tento liek sa má okamžite vysadiť.
Precitlivenosť
U pacientov liečených pegfilgrastimom sa zaznamenala pri úvodnej alebo následnej liečbe
precitlivenosť, vrátane anafylaktických reakcií. U pacientov s klinicky významnou precitlivenosťou vysaďte pegfilgrastim natrvalo. Nepodávajte pegfilgrastim pacientom s precitlivenosťou na pegfilgrastim alebo filgrastim v anamnéze. Ak sa vyskytne závažná alergická reakcia, je potrebné podať vhodnú liečbu a po dobu niekoľkých dní starostlivo sledovať pacienta.
Stevensov-Johnsonov syndróm
Stevensov-Johnsonov syndróm (SJS), ktorý môže byť život ohrozujúci alebo môže byť fatálný, bol zriedka hlásený v spojitosti s liečbou pegfilgrastimom. Ak sa u pacienta objaví SJS pri používaní pegfilgrastimu, liečba pegfilgrastimom sa u tohto pacienta už nikdy nesmie opätovne začať.
Imunogenicita
Rovnako ako u všetkých terapeutických proteínov je tu potenciál pre imunogenicitu. Výskyt tvorby
protilátok proti pegfilgrastimu je zvyčajne nízky. Väzba protilátok je v takej miere, ako sa očakáva u
všetkých biologických liekov; avšak momentálne nie je spojená s neutralizačnou aktivitou.
Aortitída
Po podaní filgrastimu alebo pegfilgrastimu bola u zdravých pacientov a u pacientov s onkologickým
ochorením hlásená aortitída. Medzi príznaky patrí horúčka, abdominálna bolesť, nevoľnosť, bolesť chrbta a zvýšená hladina zápalových markerov (napr. C-reaktívny proteín a počet WBC). Vo väčšine prípadov bola aortitída diagnostikovaná pomocou CT a vo všeobecnosti ustúpila po vysadení filgrastimu alebo pegfilgrastimu. Pozri tiež časť 4.8.
Mobilizácia PBPC
Bezpečnosť a účinnosť Pelgrazu na mobilizáciu krvných kmeňových buniek u pacientov alebo
zdravých darcov neboli príslušne hodnotené.
Ďalšie osobitné opatrenia
Zvýšenie hematopoetickej aktivity kostnej drene ako odpoveď na liečbu rastovým faktorom sa spája
s prechodným pozitívnymi kostnými zmenami na snímkach. Túto skutočnosť je potrebné zvážiť pri
interpretácii výsledkov kostných snímok.
Pomocné látky so známym účinkom
Tento liek obsahuje 50 mg sorbitolu v jednej jednotke objemu, čo sa rovná 30 mg v jednej 6 mg
dávke.
Pelgraz obsahuje menej ako 1 mmol (23 mg) sodíka v jednej 6 mg dávke, t. j. v podstate zanedbateľné
množstvo sodíka.
Všetci pacienti
Kryt ihly naplnenej injekčnej striekačky obsahuje sušený prírodný kaučuk (derivát latexu), ktorý môže
vyvolať alergické reakcie.
4.5 Liekové a iné interakcie
Vzhľadom na potenciálnu senzitivitu rýchlo sa deliacich myeloidných buniek na cytotoxickú chemoterapiu, pegfilgrastim má byť podávaný minimálne 24 hodín po podaní cytotoxickej chemoterapie. V klinických skúšaniach bol pegfilgrastim bezpečne podávaný 14 dní pred chemoterapiou. Súčasné použitie Pelgrazu s niektorým chemoterapeutikom nebolo u pacientov hodnotené. U zvierat viedlo súčasné podanie pegfilgrastimu a 5-fluorouracilu (5-FU) alebo iných antimetabolitov k potenciácii myelosupresie.
Možné interakcie s inými hematopoetickými rastovými faktormi a cytokínmi neboli v klinických skúšaniach špeciálne hodnotené.
Možnosť interakcií s lítiom, ktoré taktiež podporuje uvoľňovanie neutrofilov, nebola špeciálne
skúmaná. Nie sú k dispozícii dôkazy, že by takéto interakcie boli škodlivé.
Bezpečnosť a účinnosť Pelgrazu neboli hodnotené u pacientov užívajúcich chemoterapiu spojenú s oneskorenou myelosupresiou, napr. derivátmi nitrózomočoviny.
Špecifické interakčné alebo metabolické štúdie sa neuskutočnili, klinické skúšania však neindikovali interakcie pegfilgrastimu s inými liekmi.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití pegfilgrastimu u gravidných
žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Pegfilgrastim sa
neodporúča používať počas gravidity a u žien vo fertilnom veku nepoužívajúcich antikoncepciu.
Dojčenie
Nie sú dostatočné informácie o vylučovaní pegfilgrastimu/metabolitov do ľudského mlieka, riziko u
novorodencov/dojčiat nemôže byť vylúčené. Rozhodnutie, či ukončiť dojčenie alebo či ukončiť/prerušiť liečbu pegfilgrastimom sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Pegfilgrastim neovplyvnil reprodukčnú schopnosť ani fertilitu samcov alebo samíc pri kumulatívnych
týždenných dávkach približne 6 až 9-krát vyšších, ako je odporúčaná dávka u ľudí (na základe plochy
povrchu tela) (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pegfilgrastim nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať
stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Najčastejšie hlásenými nežiaducimi reakciami boli bolesť v kostiach (veľmi častá [≥ 1/10])
a muskuloskeletálna bolesť (častá [≥ 1/100 to < 1/10]). Bolesť v kostiach bola väčšinou miernej až strednej intenzity, prechodnej povahy a u väčšiny pacientov bola kontrolovateľná štandardnými analgetikami.
Reakcie hypersenzitívneho typu, vrátane kožnej vyrážky, žihľavky, angioedému, dýchavičnosti,
erytému, sčervenania a hypotenzie sa vyskytli pri počiatočnej alebo následnej liečbe s pegfilgrastimom
(menej časté [≥ 1/1 000 až < 1/100]). Závažné alergické reakcie, vrátane anafylaxie sa vyskytovali u
pacientov liečených pegfilgrastimom (menej časté) (pozri časť 4.4).
Syndróm kapilárneho presakovania, ktorý môže ohroziť život, ak sa oneskorí liečba, sa zaznamenal ako menej častý (≥ 1/1 000 až < 1/100) po podaní faktorov stimulujúcich kolónie granulocytov
u pacientov s rakovinou, ktorí podstupujú chemoterapiu; pozri časť 4.4 a časť nižšie “Opis vybraných nežiaducich reakcií”.
Splenomegália, zvyčajne asymptomatická, je menej častá.
Ruptúra sleziny, vrátane fatálnych prípadov, je po podaní pegfilgrastimu hlásená menej často (pozri časť 4.4).
Zaznamenali sa menej časté pľúcne nežiaduce reakcie, vrátane intersticiálnej pneumónie, pľúcneho edému, pľúcnych infiltrátov a pľúcnej fibrózy. Menej často tieto prípady prerástli do respiračného zlyhania alebo ARDS, ktoré môžu byť smrteľné (pozri časť 4.4).
U pacientov s bunkami s kosáčikovitým charakterom alebo s kosáčikovitou anémiou sa zaznamenali izolované prípady kríz kosáčikovitej anémie (menej často u pacientov s kosáčikovitou anémiou) (pozri časť 4.4).
Súhrn nežiaducich reakcií zoradených do tabuľky
Údaje uvedené v tabuľke nižšie opisujú nežiaduce reakcie hlásené z klinických skúšaní a spontánnych
hlásení. V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda
o
rgánových systémov podľa MedDRA
Veľmi časté
(≥ 1/10)
Časté (≥ 1/100 až < 1/10)
Nežiaduce reakcie
Menej časté (≥ 1/1 000 až < 1/100)
Z
r
iedkavé (≥ 1/10 000 až
< 1/1 000)
Veľm
i
zriedkavé
(< 1/10 000)
Poruchy krvi
a lymfatického systému
Poruchy imunitného systému Poruchy metabolizmu a výživy
Poruchy nervového systému
bolesť hlavy1
trombocytopénia1, leukocytóza1
krízy kosáčikovitej anémie2, splenomegália2, ruptúra sleziny2 hypersenzitívne reakcie, anafylaxia zvýšenie hladín kyseliny močovej
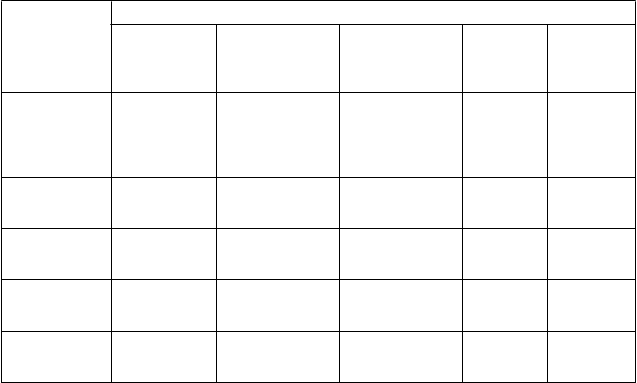 Poruchy ciev
Poruchy ciev syndróm kapilárneho presakovania1
aortitída
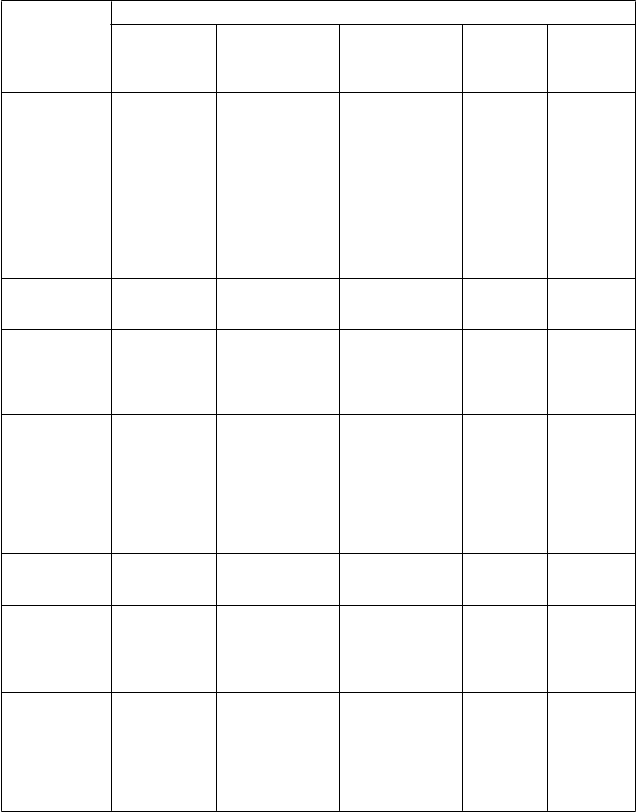
Trieda orgánových systémov podľa MedDRA
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestiná lneho traktu Poruchy kože
a podkožného tkaniva
Veľmi časté
(≥ 1/10)
nauzea1
Časté (≥ 1/100 až < 1/10)
Nežiaduce reakcie
Menej časté (≥ 1/1 000 až < 1/100)
syndróm respiračnej tiesne dospelých2, pľúcne nežiaduce reakcie (intersticiálna pneumónia, pľúcny edém, pľúcne infiltráty
a pľúcna fibróza)
hemoptýza
Sweetov syndróm (akútna febrilná dermatóza)1,2, kožná vaskulitída1,2
Zriedkavé (≥ 1/10 000 až
< 1/1 000) pulmonálna hemorágia
StevensovJ ohnsonov syndróm
Veľmi
zriedkavé
(< 1/10 000)
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
Poruchy obličiek a močových ciest Celkové poruchy a reakcie v
m
ieste podania
Laboratórne a funkčné vyšetrenia
bolesť
v kostiach
muskuloskeletáln
a bolesť (myalgia, artralgia, bolesť v končatinách, bolesť chrbta, muskuloskeletáln
a bolesť, bolesť
krku)
bolesť v mieste vpichu1,
bolesť na hrudi, ktorá nesúvisí so srdcom
glomerulonefritíd a2
reakcie v mieste vpichu2
zvýšenie hladiny laktátdehydrogená zy a alkalickej fosfatázy1, prechodné zvýšenie LFT pre ALT alebo AST1
1 Pozri časť nižšie “Opis vybraných nežiaducich reakcií”.
2 Táto nežiaduca reakcia sa zistila po uvedení lieku na trh, nepozorovala sa však v randomizovaných, kontrolovaných, klinických skúšaniach u dospelých. Kategória frekvencie bola odhadovaná
zo štatistického výpočtu na základe 1 576 pacientov liečených pegfilgrastimom v deviatich randomizovaných klinických skúšaniach.
Opis vybraných nežiaducich reakcií
Zaznamenali sa menej časté prípady Sweetovho syndrómu, hoci v niektorých prípadoch môže k ich
vzniku prispievať aj základné hematologické nádorové ochorenie.
U pacientov liečených pegfilgrastimom sa menej často zaznamenali prípady kožnej vaskulitídy.
Mechanizmus vaskulitídy u pacientov liečených pegfilgrastimom nie je známy.
Pri počiatočnej alebo následnej liečbe pegfilgrastimom sa objavili reakcie v mieste vpichu, vrátane erytému v mieste vpichu (menej časté), ako aj bolesť v mieste vpichu (časté).
Zaznamenali sa časté prípady leukocytózy (WBC > 100 x 109/l) (pozri časť 4.4).
Vratný, mierny až stredný nárast hladiny kyseliny močovej a alkalickej fosfatázy bez pridružených klinických účinkov sa vyskytoval menej často; vratný, mierny až stredný nárast hladiny laktátdehydrogenázy bez pridružených klinických účinkov sa objavil menej často u pacientov používajúcich pegfilgrastim po cytotoxickej chemoterapii.
Nevoľnosť a bolesť hlavy boli zaznamenané veľmi často u pacientov užívajúcich chemoterapiu.
U pacientov sa po podaní pegfilgrastimu následne po cytotoxickej chemoterapii pozorovalo menej často zvýšenie funkčných pečeňových testov na alanínaminotransferázu (ALT) alebo aspartátaminotransferázu (AST). Tieto zvýšenia boli prechodné a vrátili sa na pôvodné hodnoty.
Zaznamenali sa časté prípady trombocytopénie.
Po uvedení faktora stimulujúceho kolónie granulocytov na trh sa zaznamenali prípady syndrómu kapilárneho presakovania. Zvyčajne sa vyskytovali u pacientov s pokročilým nádorovým ochorením, sepsou, u pacientov liečených kombinovanou chemoterapiou alebo podstupujúcich aferézu (pozri časť
4.4).
Pediatrická populáciaSkúsenosti u detí sú obmedzené. V porovnaní so staršími deťmi vo veku 6 – 11 rokov (80 %) a 12 –
21 rokov (67 %) a dospelými, sa u mladších detí vo veku 0 – 5 rokov (92 %) pozoroval vyšší výskyt závažných nežiaducich reakcií. Najčastejšie hlásená nežiaduca reakcia bola bolesť kostí (pozri časti
5.1 a 5.2).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieJednorazové dávky 300 mikrogramov/kg boli subkutánne podávané obmedzenému počtu zdravých dobrovoľníkov a pacientov s nemalobunkovým karcinómom pľúc bez závažných nežiaducich reakcií. Nežiaduce účinky boli podobné účinkom, ktoré sa pozorovali u jedincov, ktorým sa podávali nižšie dávky pegfilgrastimu.
5
. FARMAKOLOGICKÉ VLASTNOSTI
5
.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: imunostimulanciá, faktory stimulujúce kolónie; ATC kód: L03AA13
Pelgraz je biologicky podobný liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej liekovej agentúry na adrese
http://www.ema.europa.eu.
Ľudský faktor stimulujúci kolónie granulocytov (G-CSF) je glykoproteín, ktorý reguluje produkciu a uvoľňovanie neutrofilov z kostnej drene. Pegfilgrastim je kovalentný konjugát rekombinantného ľudského G-CSF (r-metHuG-CSF) a jednej 20 kd molekuly PEG. Pegfilgrastim je vzhľadom na znížený renálny klírens trvácnejšou formou filgrastimu.
Mechanizmus účinku pegfilgrastimu a filgrastimu sa ukázal byť identický a vedie k značnému zvýšeniu počtu periférnych krvných neutrofilov do 24 hodín, s miernym nárastom hladiny monocytov a/alebo lymfocytov. Podobne ako v prípade filgrastimu, neutrofily produkované ako odpoveď na pegfilgrastim vykazujú normálne alebo silnejšie funkcie ako bolo demonštrované v testoch chemotaktických a fagocytárnych funkcií. Ako aj ostatné hematopoetické rastové faktory,
in vitro vykazuje G-CSF stimulujúce vlastnosti na ľudské endoteliálne bunky. G-CSF môže
in vitro podporovať rast myeloidných buniek, vrátane malígnych. Podobné efekty možno
in vitro pozorovať na niektorých nemyeloidných bunkách.
V dvoch randomizovaných, dvojito zaslepených, pivotných štúdiách s pacientmi užívajúcimi myelosupresívnu chemoterapiu doxorubicínu a docetaxelu, znížilo podávanie pegfilgrastimu jeden
krát počas cyklu trvanie neutropénie a výskyt febrilnej neutropénie podobne, ako to bolo pozorované v prípade denného podávania filgrastimu (stredná hodnota 11 denných podaní). V prípade neprítomnosti podpory rastového faktora viedlo toto obmedzenie k stredne dlho trvajúcej (5 až 7 dní) neutropénii stupňa 4 a 30 – 40 % výskytu febrilnej neutropénie. V jednej štúdii (n = 157), kde bola podávaná stála dávka 6 mg pegfilgrastimu, sa v skupine s pegfilgrastimom stredná dĺžka trvania neutropénie stupňa 4 pohybovala na úrovni 1,8 dňa v porovnaní s 1,6 dňa v skupine s filgrastimom (rozdiel 0,23 dňa, 95 % interval spoľahlivosti −0,15, 0,63). Počas celej štúdie bol nárast febrilnej neutropénie 13 % u
pacientov liečených pegfilgrastimom v porovnaní s 20 % u pacientov liečených filgrastimom (rozdiel
7 %, 95 % interval spoľahlivosti −19 %, 5 %). V druhej štúdii (n = 310), kde bola podávaná dávka upravená podľa hmotnosti (100 mikrogramov/kg), v skupine s pegfilgrastimom bola stredná dĺžka trvania neutropénie stupňa 4 1,7 dňa v porovnaní s 1,8 dňa v skupine s filgrastimom (rozdiel 0,03 dňa,
95 % interval spoľahlivosti −0,36, 0,30). Celkový nárast febrilnej neutropénie bol 9 % u pacientov liečených pegfilgrastimom v porovnaní s 18 % u pacientov liečených filgrastimom (rozdiel 9 %, 95 % interval spoľahlivosti −16,8 %, −1,1 %).
V placebom kontrolovanej, dvojito zaslepenej štúdii u pacientok s rakovinou prsníka bol hodnotený účinok pegfilgrastimu na ovplyvnenie incidencie febrilnej neutropénie po podávaní chemoterapeutického režimu s 10 – 20 % rizikom vzniku febrilnej neutropénie (docetaxel 100 mg/m2 každé 3 týždne počas 4 cyklov). 928 pacientok bolo randomizovaných do skupiny dostávajúcej jednorazovú dávku pegfilgrastimu alebo placeba približne 24 hodín (deň 2) po chemoterapii v každom cykle. Incidencia febrilnej neutropénie bola nižšia u pacientok randomizovaných do skupiny dostávajúcej pegfilgrastim v porovnaní s placebom (1 % verzus 17 %, p < 0,001). Výskyt hospitalizácie a intravenózne podanie antiinfektív v súvislosti s klinickou diagnózou febrilnej neutropénie bol nižší v skupine pacientok s pegfilgrastimom v porovnaní s placebom (1 % verzus
14 %, p < 0,001; a 2 % verzus 10 %, p < 0,001).
V malej (n = 83) Fáza II randomizovanej dvojito zaslepenej štúdii u pacientov dostávajúcich chemoterapiu na
de novo AML, sa porovnával pegfilgrastim (jednorazová dávka 6 mg) s filgrastimom, podávaných počas indukčnej chemoterapie. Stredný čas na regeneráciu z ťažkej neutropénie bol stanovený na 22 dní u oboch liečebných skupín. Dlhodobé skúšky sa nevykonali (pozri časť 4.4).
V multicentrickej, randomizovanej, otvorenej štúdii fázy II (n = 37) s pediatrickými pacientmi so sarkómom, ktorí dostávali 100 mikrogramov/kg pegfilgrastimu po prvom cykle chemoterapie

vinkristínom, doxorubicínom a cyklofosfamidom (VAdriaC/IE), sa pozorovalo dlhšie trvanie závažnej neutropénie (neutrofily < 0,5 x 109) u mladších detí vo veku 0-5 rokov (8,9 dní) v porovnaní
so staršími deťmi vo veku 6 – 11 rokov (6 dní) a 12 – 21 rokov (3,7 dní) a dospelými. Okrem toho bol pozorovaný vyšší výskyt febrilnej neutropénie u mladších detí vo veku 0 – 5 rokov (75 %)

v porovnaní so staršími deťmi vo veku 6 – 11 rokov (70 %) a 12 – 21 rokov (33 %) a dospelými (pozri
časti 4.8 a 5.2).
 5.2 Farmakokinetické vlastnosti
5.2 Farmakokinetické vlastnosti

Po jednej subkutánnej dávke pegfilgrastimu sa maximálna sérová koncentrácia pegfilgrastimu dosiahne 16 až 120 hodín po podaní a sérové koncentrácie pegfilgrastimu pretrvávajú počas obdobia neutropénie po myelosupresívnej chemoterapii. Vzhľadom na dávku je eliminácia pegfilgrastimu nelineárna; sérový klírens pegfilgrastimu klesá s narastajúcou dávkou. Zdá sa, že pegfilgrastim je zväčša eliminovaný neutrofilmi sprostredkovaným klírensom, ktorý je pri vyšších dávkach saturovaný. Sérová koncentrácia pegfilgrastimu prudko klesá následkom obnovy neutrofilov, čo je v súlade s mechanizmom spätnej regulácie klírensu (pozri obrázok 1).
 Obrázok 1. Profil stredných hodnôt sérovej koncentrácie pegfilgrastimu a absolútneho počtu neutrofilov (APN) po jednorazovom injekčnom podaní (6 mg) pacientom užívajúcim chemoterapiu
Obrázok 1. Profil stredných hodnôt sérovej koncentrácie pegfilgrastimu a absolútneho počtu neutrofilov (APN) po jednorazovom injekčnom podaní (6 mg) pacientom užívajúcim chemoterapiu'
Vzhľadom na neutrofilmi sprostredkovaný mechanizmus klírensu sa vplyv poruchy funkcie obličiek a
pečene na farmakokinetiku pegfilgrastimu nepredpokladá. V otvorenej štúdii (n = 31) s použitím rovnakej dávky pegfilgrastimu nemal rôzny stupeň poruchy funkcie obličiek, vrátane konečného štádia ochorenia obličiek (ESRD), žiaden vplyv na farmakokinetiku pegfilgrastimu.
Starší pacientiObmedzené údaje indikujú, že farmakokinetika pegfilgrastimu u starších pacientov (> 65 rokov) je

podobná ako u dospelých.
Pediatrická populáciaFarmakokinetika pegfilgrastimu sa skúmala u 37 pediatrických pacientov so sarkómom, ktorí dostávali
100 mikrogramov/kg pegfilgrastimu po skončení VAdriaC/IE chemoterapie. Najmladšia veková skupina (0 –5 rokov) mala vyššiu priemernú expozíciu pegfilgrastimu (AUC) (±SD)
(47,9 ±22,5 mikrogramov.h/ml) ako staršie deti vo veku 6 – 11 rokov (22,0 ±13,1 mikrogramov.h/ml) a 12 – 21 rokov (29,3 ±23,2 mikrogramov.h/ml) (pozri časť 5.1). S výnimkou najmladšej vekovej skupiny (0 – 5 rokov) sa zdalo, že priemerná hodnota AUC u pediatrických jedincov je podobná ako
u dospelých pacientov s vysoko rizikovým štádiom II–IV karcinómu prsníka, ktorí užívali
100 mikrogramov/kg pegfilgrastimu po skončení chemoterapie s doxorubicínom/docetaxelom (pozri
časti 4.8 a 5.1).
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe štandardných štúdií toxicity po opakovanom podávaní odhalili predpokladané farmakologické účinky vrátane zvýšenia počtu leukocytov, myeloidnej hyperplázie v kostnej dreni, extramedulárnej hematopoézy a zväčšenia sleziny.
U mláďat potkanov, ktorým bol v období gravidity subkutánne podaný pegfilgrastim, neboli pozorované nežiaduce účinky, u zajacov však bola dokázaná embryonálna/fetálna toxicita (strata embrya), spôsobená pegfilgrastimom pri kumulatívnych dávkach približne 4-krát vyšších ako je odporúčaná dávka u ľudí. Embryonálna/fetálna toxicita (strata embrya) sa nepozorovala, keď boli gravidné potkany vystavené dávke, ktorá je odporúčaná u ľudí. V štúdiách s potkanmi bolo dokázané, že pegfilgrastim môže prenikať placentou. Štúdie u potkanov naznačili, že subkutánne podaný pegfilgrastim neovplyvňuje reprodukčnú výkonnosť, fertilitu, estrálny cyklus, dni medzi párením
a pohlavným stykom a vnútromaternicové prežívanie. Význam týchto nálezov pre ľudí nie je známy.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
octan sodný* sorbitol (E420) polysorbát 20 voda na injekciu
*Octan sodný vzniká titráciou ľadovej kyseliny octovej hydroxidom sodným.
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi, najmä nie s roztokmi chloridu sodného.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C).
Pelgraz možno vystaviť izbovej teplote (do 25 °C ± 2 °C) počas jedného obdobia maximálne do
72 hodín. Pelgraz ponechaný pri izbovej teplote dlhšie ako 72 hodín musí byť zlikvidovaný.
Neuchovávajte v mrazničke. Náhodné vystavenie lieku teplotám mrazu počas jedného obdobia na menej ako 24 hodín nenarušuje stabilitu Pelgrazu.
Vnútorný obal uchovávajte vo vonkajšej škatuli na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
Pelgraz 6 mg injekčný roztok naplnený v injekčnej striekačke
Naplnená injekčná striekačka (sklo typu I) s trvalo nasadenou ihlou z nehrdzavejúcej ocele a
bezpečnostným chráničom ihly.
Kryt ihly naplnenej injekčnej striekačky obsahuje sušený prírodný kaučuk (pozri časť 4.4).
Každá naplnená injekčná striekačka obsahuje 0,6 ml injekčného roztoku. Balenie obsahuje jednu
naplnenú injekčnú striekačku s jedným alkoholovým tampónom v blistrovom balení.
Pelgraz 6 mg injekčný roztok v naplnenom injektore
Naplnený injektor obsahuje naplnenú injekčnú striekačku (sklo typu I) s trvalo nasadenou injekčnou
ihlou z nehrdzavejúcej ocele. Naplnená injekčná striekačka je zvonka vybavená zariadením na samopodávanie (naplnený injektor).
Kryt ihly naplnenej injekčnej striekačky obsahuje sušený prírodný kaučuk (pozri časť 4.4).
Každá naplnená injekčná striekačka injektora obsahuje 0,6 ml injekčného roztoku. Balenie obsahuje jeden naplnený injektor s jedným alkoholovým tampónom v blistrovom balení.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pelgraz 6 mg injekčný roztok naplnený v injekčnej striekačke
Pred použitím Pelgrazu je nutné vizuálne skontrolovať, či roztok neobsahuje viditeľné častice. Podať
sa môžu iba číre a bezfarebné roztoky.
Nadmerné pretrepávanie môže viesť k agregácii pegfilgrastimu a tak spôsobiť inaktiváciu jeho
biologických vlastností.
Pred aplikáciou injekcie nechajte naplnenú injekčnú striekačku dosiahnuť izbovú teplotu.
Použitie naplnenej striekačky s bezpečnostným chráničom ihly
Bezpečnostný chránič ihly zakryje ihlu po injekčnom podaní, aby nedošlo k bodnému poraneniu. Nemá to vplyv na normálnu funkciu striekačky. Pomaly a rovnomerne stláčajte piest, kým neaplikujete celú dávku a piest nebude možné zatlačiť ďalej. Udržujte piest pod tlakom a vytiahnite ihlu z tela pacienta. Bezpečnostný chránič ihly sa aktivuje po uvoľnení piestu.
Pelgraz 6 mg injekčný roztok v naplnenom injektore
Pred použitím Pelgrazu je nutné vizuálne skontrolovať, či roztok neobsahuje viditeľné častice. Podať
sa môžu iba číre a bezfarebné roztoky.
Nadmerné pretrepávanie môže viesť k agregácii pegfilgrastimu a tak spôsobiť inaktiváciu jeho
biologických vlastností.
Pred aplikáciou injekcie nechajte naplnený injektor dosiahnuť izbovú teplotu. Likvidácia
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7
. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Accord Healthcare S.L.U.
World Trade Center, Moll de Barcelona, s/n, Edifici Est 6ª planta,
08039 Barcelona, Španielsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/18/1313/001
EU/1/18/1313/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 21. septembra 2018
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.