
i časť 4.8).
Vyskytli sa fatálne prípady perforácie. Pazopanib sa má používať opatrne u pacientov s rizikom vzniku GI perforácie alebo fistuly.
Hojenie rán
Neuskutočnili sa žiadne formálne štúdie o účinku pazopanibu na hojenie rán. Keďže inhibítory
cievneho endotelového rastového faktora (vascular endothelial growth factor, VEGF) môžu narušiť hojenie rán, liečba pazopanibom sa má prerušiť aspoň 7 dní pred plánovaným chirurgickým zákrokom.
Rozhodnutie o opätovnom začatí liečby pazopanibom po chirurgickom zákroku má vychádzať z klinického posúdenia adekvátneho hojenia rany. Liečba pazopanibom sa má ukončiť u pacientov s
dehiscenciou rany.
Hypotyreóza
V klinických štúdiách s pazopanibom sa vyskytli prípady hypotyreózy (pozri časť 4.8). Odporúča sa
predliečebné laboratórne vyšetrenie funkcie štítnej žľazy a pacienti s hypotyreózou sa pred začatím liečby pazopanibom majú liečiť v súlade so štandardnou medicínskou praxou. Všetci pacienti majú
byť počas liečby pazopanibom pozorne sledovaní kvôli prejavom a príznakom dysfunkcie štítnej
žľazy. Laboratórne sledovanie funkcie štítnej žľazy sa má vykonávať v pravidelných intervaloch
a funkcia štítnej žľazy sa má liečiť v súlade so štandardnou medicínskou praxou.
Proteinúria
V klinických štúdiách s pazopanibom bola hlásená proteinúria. Odporúča sa vykonať vyšetrenie moču
pred liečbou a v pravidelných intervaloch počas liečby a pacientov treba sledovať kvôli zhoršujúcej sa proteinúrii. Liečba pazopanibom sa má ukončiť, ak u pacienta vznikne nefrotický syndróm.
Syndróm z rozpadu nádoru(tumourlysissyndrome,TLS)
Výskyt TLS, vrátane fatálneho TLS bol spojený s užívaním pazopanibu (pozri časť 4.8). Pacienti so
zvýšeným rizikom TLS sú pacienti s rýchlo rastúcimi nádormi, vysokým nádorovým zaťažením, renálnou dysfunkciou alebo dehydratáciou. Pred začatím liečby pazopanibom sa majú zvážiť
preventívne opatrenia, ako je liečba vysokých hladín kyseliny močovej a intravenózna hydratácia.
Rizikových pacientov treba starostlivo sledovať a liečiť podľa klinickej potreby.
Pneumotorax
V klinických štúdiách s pazopanibom sledovaným pri pokročilom sarkóme mäkkých tkanív sa vyskytli
prípady pneumotoraxu (pozri časť 4.8). Pacientov liečených pazopanibom treba dôkladne sledovať kvôli prejavom a príznakom pneumotoraxu.
Pediatrická populácia
Keďže spôsob účinku pazopanibu môže závažným spôsobom ovplyvniť rast a dozrievanie orgánov
počas skorého postnatálneho vývoja hlodavcov (pozri časť 5.3), pazopanib sa nemá podávať pediatrickým pacientom mladším ako 2 roky.
Infekcie
Hlásené boli prípady závažných infekcií (s neutropéniou alebo bez nej), v niektorých prípadoch so
smrteľným koncom.
Kombinácia sinýmisystémovýmiprotinádorovýmiterapiami
Klinické štúdie pazopanibu v kombinácii s množstvom iných protinádorových terapií (vrátane napr.
pemetrexedu, lapatinibu alebo pembrolizumabu) boli v skorej fáze ukončené kvôli obavám zo zvýšenej toxicity a/alebo úmrtnosti a pri týchto kombinovaných režimoch liečby nebola stanovená bezpečná a účinná dávka.
Gravidita
Predklinické štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Ak sa pazopanib
používa počas gravidity alebo ak pacientka otehotnie počas liečby pazopanibom, pacientku treba oboznámiť s možným rizikom pre plod. Ženám vo fertilnom veku sa má odporučiť, aby sa počas
liečby pazopanibom vyhli otehotneniu (pozri časť 4.6).
Interakcie
Je potrebné vyhnúť sa súbežnej liečbe silnými inhibítormi CYP3A4, P-glykoproteínu (P-gp) alebo
proteínu zodpovedného za rezistenciu pri rakovine prsníka (breast cancer resistance protein, BCRP)
vzhľadom na riziko zvýšenej expozície pazopanibu (pozri časť 4.5). Má sa zvážiť výber alternatívnych, súbežne podávaných liekov s nulovým alebo minimálnym potenciálom inhibície CYP3A4, P-gp alebo BCRP.
Je potrebné vyhnúť sa súbežnej liečbe induktormi CYP3A4 vzhľadom na riziko zníženej expozície pazopanibu (pozri časť 4.5).
Počas súbežnej liečby ketokonazolom boli pozorované prípady hyperglykémie.
Pri súbežnom podávaní pazopanibu so substrátmi uridín-difosfát-glukuronozyltransferázy 1A1 (UGT1A1) (napr. s irinotekánom) je potrebná opatrnosť, keďže pazopanib je inhibítor UGT1A1 (pozri časť 4.5).
Počas liečby pazopanibom sa nemá piť grapefruitová šťava (pozri časť 4.5). Pomocnélátky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej filmom obalenej tablete, t.j. v podstate
zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Účinky iných liekovnapazopanib
In vitro štúdie naznačili, že oxidačný metabolizmus pazopanibu v mikrozómoch ľudskej pečene je
sprostredkovaný hlavne CYP3A4, pričom v menšej miere sa na ňom podieľajú CYP1A2 a CYP2C8. Inhibítory a induktory CYP3A4 preto môžu pozmeniť metabolizmus pazopanibu.
Inhi bít ory CY P3A4, P -gp, BCRP
Pazopanib je substrát CYP3A4, P-gp a BCRP.
Súbežné podávanie pazopanibu (400 mg jedenkrát denne) so silným inhibítorom CYP3A4 a P-gp, ketokonazolom (400 mg jedenkrát denne), počas 5 po sebe nasledujúcich dní, viedlo k 66 % a 45 % zvýšeniu priemernej hodnoty AUC(0-24) a Cmax pazopanibu, v uvedenom poradí, v porovnaní so samostatným podávaním pazopanibu (400 mg jedenkrát denne počas 7 dní). Porovnanie farmakokinetických parametrov pazopanibu, a to Cmax (rozmedzie priemerných hodnôt 27,5 až 58,1 μg/ml) a AUC(0-24) (rozmedzie priemerných hodnôt 48,7 až 1 040 μg*h/ml) po samostatnom podaní
800 mg pazopanibu a po podaní 400 mg pazopanibu a 400 mg ketokonazolu (priemerná hodnota Cmax
59,2 μg/ml, priemerná hodnota AUC(0-24)1 300 μg*h/ml) naznačilo, že v prítomnosti silného inhibítora
CYP3A4 a P-gp bude zníženie dávky pazopanibu na 400 mg jedenkrát denne u väčšiny pacientov
viesť k systémovej expozícii podobnej tej, ktorá je pozorovaná po samostatnom podávaní 800 mg pazopanibu jedenkrát denne. U niektorých pacientov sa však môže dosiahnuť vyššia systémová expozícia pazopanibu ako tá, ktorá bola pozorovaná po samostatnom podávaní 800 mg pazopanibu.
Súbežné podávanie pazopanibu s inými silnými inhibítormi enzýmov z rodiny CYP3A4 (napr. s itrakonazolom, klaritromycínom, atazanavirom, indinavirom, nefazodónom, nelfinavirom, ritonavirom, sakvinavirom, telitromycínom, vorikonazolom) môže zvýšiť koncentrácie pazopanibu. Grapefruitová šťava obsahuje inhibítor CYP3A4 a taktiež môže zvyšovať plazmatické koncentrácie pazopanibu.
Podanie 1 500 mg lapatinibu (substrátu a slabého inhibítora CYP3A4 a P-gp a silného inhibítora BCRP) s 800 mg pazopanibu viedlo k približne 50 % až 60 % zvýšeniu priemerných hodnôt AUC(0-24) a Cmax pazopanibu v porovnaní so samostatným podaním 800 mg pazopanibu. Inhibícia P-gp a/alebo BCRP lapatinibom pravdepodobne prispela k zvýšenej expozícii pazopanibu.
Súbežné podanie pazopanibu s inhibítorom CYP3A4, P-gp a BCRP, akým je lapatinib, vedie k zvýšeniu plazmatických koncentrácií pazopanibu. Súbežné podanie silných inhibítorov P-gp alebo BCRP môže pozmeniť aj expozíciu pazopanibu a jeho distribúciu, vrátane distribúcie do centrálneho nervového systému (CNS).
Je potrebné vyhnúť sa súbežnému podávaniu pazopanibu so silným inhibítorom CYP3A4 (pozri časť
4.4). Ak nie je dostupná žiadna medicínsky prijateľná alternatíva silného inhibítora CYP3A4, počas súbežného podávania sa má dávka pazopanibu znížiť na 400 mg denne. V takýchto prípadoch treba
venovať dôkladnú pozornosť nežiaducim reakciám na liek a v prípade výskytu nežiaducich udalostí
s možnou súvislosťou s liekom sa môže uvažovať o ďalšom znížení dávky.
Je potrebné vyhnúť sa kombinácii so silnými inhibítormi P-gp alebo BCRP alebo sa odporúča výber alternatívneho, súbežné podávaného lieku s nulovým alebo minimálnym potenciálom inhibície P-gp alebo BCRP.
Induktory CYP3A4, P-gp, BCRP
Induktory CYP3A4, ako napríklad rifampín, môžu znižovať plazmatické koncentrácie pazopanibu. Súbežné podanie pazopanibu so silnými induktormi P-gp alebo BCRP môže pozmeniť expozíciu
pazopanibu a jeho distribúciu, vrátane distribúcie do CNS. Odporúča sa výber alternatívneho, súbežne
podávaného lieku s nulovým alebo minimálnym potenciálom indukcie enzýmov alebo transportných proteínov.
Účinky pazopanibu nainélieky
In vitro štúdie s mikrozómami ľudskej pečene preukázali, že pazopanib inhibuje enzýmy CYP 1A2,
3A4, 2B6, 2C8, 2C9, 2C19 a 2E1. Potenciálna indukcia ľudského CYP3A4 sa preukázala v in vitro
teste ľudského PXR. Štúdie klinickej farmakológie, s použitím pazopanibu v dávke 800 mg jedenkrát denne, preukázali, že pazopanib nemá u onkologických pacientov klinicky významný vplyv na farmakokinetiku kofeínu (skúšobný substrát CYP1A2), warfarínu (skúšobný substrát CYP2C9) alebo omeprazolu (skúšobný substrát CYP2C19). Podanie pazopanibu viedlo k približne 30 % zvýšeniu priemerných hodnôt AUC a Cmax midazolamu (skúšobný substrát CYP3A4) a k 33 % až 64 % zvýšeniu pomeru koncentrácií dextrometrofánu k dextrofánu v moči po perorálnom podaní dextrometorfánu (skúšobný substrát CYP2D6). Súbežné podanie pazopanibu v dávke 800 mg
jedenkrát denne a paklitaxelu v dávke 80 mg/m2 (substrát CYP3A4 a CYP2C8) raz týždenne viedlo k priemerne 26 % zvýšeniu AUC a 31 % zvýšeniu Cmax paklitaxelu.
Na základe in vitro hodnôt IC50 a in vivo hodnôt plazmatickej Cmax môžu metabolity pazopanibu, GSK1268992 a GSK1268997, prispievať k čistému inhibičnému účinku pazopanibu voči BCRP. Okrem toho nemožno vylúčiť inhibíciu BCRP a P-gp pazopanibom v gastrointestinálnom trakte. Pri súbežnom podávaní pazopanibu s inými perorálnymi substrátmi BCRP a P-gp je potrebná opatrnosť.
V in vitro podmienkach pazopanib inhiboval ľudský transportný polypeptid organických aniónov (organic anion transporting polypeptide, OATP1B1). Nie je možné vylúčiť, že pazopanib ovplyvní farmakokinetiku substrátov OATP1B1 (napr. statínov, pozri ďalej „Účinok súbežného použitia pazopanibu a simvastatínu“).
V in vitro podmienkach je pazopanib inhibítor enzýmu uridín-difosfát-glukuronozyltransferázy 1A1 (UGT1A1). Aktívny metabolit irinotekánu, SN-38, je substrát OATP1B1 a UGT1A1. Súbežné podávanie pazopanibu v dávke 400 mg jedenkrát denne s cetuximabom v dávke 250 mg/m2 a irinotekánom v dávke 150 mg/m2 viedlo približne k 20 % zvýšeniu systémovej expozície SN-38. Pazopanib môže mať väčší vplyv na dispozíciu SN-38 u osôb s polymorfizmom UGT1A1*28 v porovnaní s osobami s alelou divokého typu. Na základe genotypu UGT1A1 sa však nedal vždy predpovedať vplyv pazopanibu na dispozíciu SN-38. Pri súbežnom podávaní pazopanibu a substrátov UGT1A1 je potrebná obozretnosť.
Účinok súbežného použitia pazopanibu a simvastatínu
Súbežné použitie pazopanibu a simvastatínu zvyšuje výskyt vzostupov hodnôt ALT. Výsledky meta-
analýzy súhrnných údajov z klinických štúdií s pazopanibom ukazujú, že hodnota ALT > 3-násobok
ULN bola hlásená u 126/895 (14 %) pacientov, ktorí nepoužívali statíny, v porovnaní s 11/41 (27 %) pacientmi, ktorí súbežne používali simvastatín (p = 0,038). Ak u pacienta súbežne liečeného simvastatínom dôjde k zvýšeniu hodnôt ALT, treba dodržiavať odporúčania pre dávkovanie pazopanibu a prerušiť podávanie simvastatínu (pozri časť 4.4). Navyše je pri súbežnom použití pazopanibu a iných statínov potrebná obozretnosť, keďže v súčasnosti nie sú k dispozícii dostatočné údaje na zhodnotenie ich vplyvu na hladiny ALT. Nie je možné vylúčiť, že pazopanib ovplyvní farmakokinetiku iných statínov (napr. atorvastatínu, fluvastatínu, pravastatínu, rosuvastatínu).
Účinok jedla napazopanib
Podanie pazopanibu s jedlom s vysokým alebo nízkym obsahom tuku viedlo k približne 2-násobnému
zvýšeniu hodnôt AUC a Cmax. Pazopanib sa má preto podávať aspoň 1 hodinu pred alebo 2 hodiny po
jedle.
Lieky, ktoré zvyšujúhodnotupHvžalúdku
Súbežné podanie pazopanibu s ezomeprazolom znižuje biologickú dostupnosť pazopanibu približne o
40 % (AUC a Cmax) a je potrebné vyhnúť sa súbežnému podaniu pazopanibu s liekmi, ktoré zvyšujú hodnotu pH v žalúdku. Ak je súbežné použitie inhibítora protónovej pumpy (PPI) medicínsky
nevyhnutné, odporúča sa užívať dávku pazopanibu bez jedla jedenkrát denne večer súbežne s PPI. Ak
je súbežné podanie antagonistu H2-receptora medicínsky nevyhnutné, pazopanib sa má užívať bez jedla aspoň 2 hodiny pred podaním dávky antagonistu H2-receptora alebo aspoň 10 hodín po jeho podaní. Pazopanib sa má podať aspoň 1 hodinu pred podaním krátkodobo pôsobiacich antacíd alebo 2 hodiny po ich podaní. Odporúčania týkajúce sa súbežného podávania PPI a antagonistov H2- receptorov vychádzajú z fyziologických hľadísk.
4.6 Fertilita, gravidita a laktácia
Gravidita/Antikoncepciaumužovažien
Nie sú k dispozícii dostatočné údaje o použití pazopanibu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko pre ľudí.
Pazopanib sa nemá používať počas gravidity, pokiaľ klinický stav ženy nevyžaduje liečbu pazopanibom. Ak sa pazopanib používa počas gravidity alebo ak pacientka otehotnie počas liečby pazopanibom, pacientku treba oboznámiť s možným rizikom pre plod.
Ženám vo fertilnom veku sa má odporučiť, aby počas liečby a počas najmenej 2 týždňov po poslednej dávke pazopanibu, používali účinnú antikoncepciu a aby sa počas liečby pazopanibom vyhli otehotneniu.
Pacienti mužského pohlavia (vrátane tých, ktorí podstúpili vazektómiu) musia počas užívania pazopanibu a najmenej 2 týždne po poslednej dávke pazopanibu pri pohlavnom styku používať kondómy, aby sa predišlo možnej expozícii lieku u gravidných partneriek a partneriek vo fertilnom veku.
Dojčenie
Bezpečnosť používania pazopanibu počas dojčenia nebola stanovená. Nie je známe, či sa pazopanib
alebo jeho metabolity vylučujú do materského mlieka. Nie sú žiadne údaje o vylučovaní pazopanibu
do mlieka u zvierat. Riziko u dojčiat nemôže byť vylúčené. Dojčenie sa má počas liečby pazopanibom ukončiť.
Fertilita
Štúdie na zvieratách preukázali, že samčia a samičia fertilita môže byť ovplyvnená liečbou
pazopanibom (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pazopanib Gedeon Richter nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Na základe farmakologického účinku pazopanibu nie je možné predvídať škodlivý účinok na takéto činnosti. Pri posudzovaní schopnosti pacienta vykonávať činnosti, ktoré vyžadujú úsudok, motorické alebo kognitívne schopnosti, treba mať na pamäti klinický stav pacienta a profil nežiaducich udalostí pazopanibu. Pacienti nesmú viesť vozidlá alebo obsluhovať stroje, ak pociťujú závraty, únavu alebo slabosť.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Súhrnné údaje z pivotného skúšania RCC (VEG105192, n = 290), z predĺženej štúdie (VEG107769, n
= 71), z podporného skúšania fázy II (VEG102616, n = 225) a z randomizovanej, otvorenej štúdie fázy
III s paralelným usporiadaním skupín skúmajúcej noninferioritu (VEG108844, n = 577) boli hodnotené pri celkovom posúdení bezpečnosti a znášanlivosti pazopanibu (celkový n = 1 149) u jedincov s RCC (pozri časť 5.1).
Súhrnné údaje z pivotného skúšania STS (VEG110727, n = 369) a z podporného skúšania fázy II (VEG20002, n = 142) boli hodnotené pri celkovom posúdení bezpečnosti a znášanlivosti pazopanibu (celková populácia pacientov pre hodnotenie bezpečnosti n = 382) u jedincov so STS (pozri časť 5.1).
Najvýznamnejšie závažné nežiaduce reakcie zistené v skúšaniach RCC alebo STS boli tranzitórny ischemický atak, ischemická cievna mozgová príhoda, ischémia myokardu, infarkt myokardu a mozgový infarkt, srdcová dysfunkcia, gastrointestinálna perforácia a fistula, predĺženie QT intervalu, torsade de pointes a pľúcne, gastrointestinálne a cerebrálne krvácanie, pričom všetky tieto nežiaduce reakcie boli hlásené u < 1 % liečených pacientov. Ďalšie významné závažné nežiaduce reakcie zistené v skúšaniach STS zahŕňali venózne tromboembolické príhody, dysfunkciu ľavej komory a pneumotorax.
pľúcne krvácanie/hemoptýzu, poruchu funkcie pečene, perforáciu čreva a ischemickú cievnu mozgovú príhodu.
Najčastejšie nežiaduce reakcie (vyskytujúce sa aspoň u 10 % pacientov) akéhokoľvek stupňa závažnosti v skúšaniach RCC a STS zahŕňali: hnačku, zmenu farby vlasov, hypopigmentáciu kože, exfoliatívnu vyrážku, hypertenziu, nauzeu, bolesť hlavy, únavu, anorexiu, vracanie, dysgeúziu, stomatitídu, zníženie telesnej hmotnosti, bolesť, zvýšené hladiny alanínaminotransferázy a zvýšené hladiny aspartátaminotransferázy.
Nežiaduce reakcie na liek, všetkých stupňov závažnosti, ktoré boli hlásené u jedincov s RCC a u jedincov so STS alebo počas obdobia po uvedení lieku na trh sú nižšie uvedené podľa triedy orgánových systémov MedDRA, frekvencie a stupňa závažnosti. Na klasifikáciu frekvencie sa použila nasledujúca konvencia: veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až
<1/100); zriedkavé (≥1/10 000 až <1/1 000); veľmi zriedkavé (<1/10 000); neznáme (z dostupných údajov).
Kategórie boli priradené na základe absolútnych frekvencií podľa údajov z klinických skúšaní. Hodnotené boli aj údaje o bezpečnosti a znášanlivosti získané v období po uvedení lieku na trh zo všetkých klinických skúšaní s pazopanibom a zo spontánnych hlásení. V rámci každej triedy orgánových systémov sú nežiaduce reakcie s rovnakou frekvenciou uvedené v poradí klesajúcej závažnosti.
Zoznam nežiaducich reakcií uvedený vtabuľkeTabuľka 2 Nežiaduce reakcie súvisiace s liečbou hlásené v štúdiách RCC (n = 1 149) alebopočas obdobia po uvedení lieku na trh
Trieda orgánových systémov
| Frekvencia
(všetky
stupne
závažnosti)
| Nežiaduce reakcie
| Všetky stupne
závažnosti
n (%)
| 3. stupeň závažnosti
n (%)
| 4. stupeň závažnosti
n (%)
|
Infekcie a nákazy
| Časté
| Infekcie (s neutropéniou
alebo bez nej)†
| neznáme
| neznáme
| neznáme
|
Menej časté
| Infekcia ďasien
| 1 (<1%)
| 0
| 0
|
Infekčná peritonitída
| 1 (<1%)
| 0
| 0
|
Benígne a malígne nádory, vrátane nešpecifiko- vaných novotvarov (cysty a polypy)
| Menej časté
| Bolesť v mieste nádoru
| 1 (<1%)
| 1 (<1%)
| 0
|
Poruchy krvi a lymfatického systému
| Časté
| Trombocytopénia
| 80 (7%)
| 10 (<1%)
| 5 (<1%)
|
Neutropénia
| 79 (7%)
| 20 (2%)
| 4 (<1%)
|
Leukopénia
| 63 (5%)
| 5 (<1%)
| 0
|
Menej časté
| Polycytémia
| 6 (0,03%)
| 1
| 0
|
Zriedkavé
| Trombotická
mikroangiopatia (vrátane trombotickej trombocytopenickej purpury a hemolyticko- uremického syndrómu)†
| neznáme
| neznáme
| neznáme
|
T
rieda orgánových systémov
F
r
ekvencia (všetky stupne závažnosti)
N
ežiaduce reakcie Všetky stupne závažnosti n (%)
3. stupeň závažnosti n (%)
4. stupeň závažnosti n (%)
P
oruchy endokrinného systému
Časté Hypotyreóza 83 (7%) 1 (<1%) 0
Veľmi časté Znížená chuť do jedlae 317 (28%) 14 (1%) 0
|
Dehydratácia
|
16 (1%)
|
5 (<1%)
|
0
|
Menej časté
|
Hypomagneziémia
|
10 (<1%)
|
0
|
0
|
Neznáme
|
Syndróm z rozpadu
|
neznáme
|
neznáme
|
neznáme
|
|
nádoru*
|
|
|
|
Časté
|
Insomnia
|
30 (3%)
|
0
|
0
|
Veľmi časté
|
Dysgeúziac
|
254 (22%)
|
1 (<1%)
|
0
|
|
Bolesť hlavy
|
122 (11%)
|
11 (<1%)
|
0
|
Časté
|
Závraty
|
55 (5%)
|
3 (<1%)
|
1 (<1%)
|
|
Letargia
|
30 (3%)
|
3 (<1%)
|
0
|
|
Parestézia
|
20 (2%)
|
2 (<1%)
|
0
|
|
Periférna senzorická
|
17 (1%)
|
0
|
0
|
|
neuropatia
|
|
|
|
Menej časté
|
Hypestézia
|
8 (<1%)
|
0
|
0
|
|
Tranzitórny ischemický
|
7 (<1%)
|
4 (<1%)
|
0
|
|
atak
|
|
|
|
|
Somnolencia
|
3 (<1%)
|
1 (<1%)
|
0
|
|
Cievna mozgová príhoda
|
2 (<1%)
|
1 (<1%)
|
1 (<1%)
|
|
Ischemická cievna
|
2 (<1%)
|
0
|
1 (<1%)
|
|
mozgová príhoda
|
|
|
|
Zriedkavé
|
Syndróm reverzibilnej
|
neznáme
|
neznáme
|
neznáme
|
|
posteriórnej
|
|
|
|
|
encefalopatie/syndróm
|
|
|
|
|
reverzibilnej posteriórnej
|
|
|
|
|
leukoencefalopatie†
|
|
|
|
Časté
|
Rozmazané videnie
|
19 (2%)
|
1 (<1%)
|
0
|
Menej časté
|
Odlúpenie sietnice†
|
1 (<1%)
|
1 (<1%)
|
0
|
|
|
P
oruchy metabolizmu a výživy
Časté Hypofosfatémia 21 (2%) 7 (<1%) 0
P
sychické
poruchy
 P
oruchy nervového systému
P
oruchy nervového systému
P
oruchy oka
|
Menej časté
|
Natrhnutie sietnice† Zmena farby mihalníc Bradykardia
|
1 (<1%)
4 (<1%)
6 (<1%)
|
1 (<1%)
0
0
|
0
0
0
|
P
oruchy srdca a
|
|
Infarkt myokardu
|
5 (<1%)
|
1 (<1%)
|
4 (<1%)
|
srdcovej činnosti
|
|
Srdcová dysfunkciaf
|
4 (<1%)
|
1 (<1%)
|
0
|
|
|
Ischémia myokardu
|
3 (<1%)
|
1 (<1%)
|
0
|
|
Veľmi časté
|
Hypertenzia
|
473 (41%)
|
115 (10%)
|
1 (<1%)
|
|
Časté
|
Návaly tepla
|
16 (1%)
|
0
|
0
|
|
|
Venózna
|
13 (1%)
|
6 (<1%)
|
7 (<1%)
|
P
oruchy ciev
|
|
tromboembolická
|
|
|
|
|
|
príhodag
|
|
|
|
|
|
Sčervenanie
|
12 (1%)
|
0
|
0
|
|
Menej časté
|
Hypertenzná kríza
|
6 (<1%)
|
0
|
2 (<1%)
|
 T
rieda
orgánových systémov
P
oruchy
dýchacej sústavy, hrudníka a mediastína
P
oruchy
gastrointestinál- neho traktu
P
oruchy pečene
T
rieda
orgánových systémov
P
oruchy
dýchacej sústavy, hrudníka a mediastína
P
oruchy
gastrointestinál- neho traktu
P
oruchy pečene
F
r
ekvencia
|
N
ežiaduce reakcie
|
V
šetky
|
3. stupeň
|
4. stupeň
|
(
všetky
|
|
stupne
|
z
ávažnosti
|
z
ávažnosti
|
stupne
|
|
z
ávažnosti
|
n (%)
|
n (%)
|
z
ávažnosti)
|
|
n (%)
|
|
|
|
Krvácanie
|
1 (<1%)
|
0
|
0
|
Zriedkavé
|
Aneuryzmy a arteriálne
|
neznáme
|
neznáme
|
neznáme
|
|
disekcie†
|
|
|
|
Časté
|
Epistaxa
|
50 (4%)
|
1 (<1%)
|
0
|
|
Dysfónia
|
48 (4%)
|
0
|
0
|
|
Dyspnoe
|
42 (4%)
|
8 (<1%)
|
1 (<1%)
|
|
Hemoptýza
|
15 (1%)
|
1 (<1%)
|
0
|
Menej časté
|
Rinorea
|
8 (<1%)
|
0
|
0
|
|
Pľúcne krvácanie
|
2 (<1%)
|
0
|
0
|
|
Pneumotorax
|
1 (<1%)
|
0
|
0
|
Zriedkavé
|
Intersticiálna choroba
|
neznáme
|
neznáme
|
neznáme
|
|
pľúc/pneumonitída†
|
|
|
|
Veľmi časté
|
Hnačka
|
614 (53%)
|
65 (6%)
|
2 (<1%)
|
|
Nauzea
|
386 (34%)
|
14 (1%)
|
0
|
|
Vracanie
|
225 (20%)
|
18 (2%)
|
1 (<1%)
|
|
Bolesť bruchaa
|
139 (12%)
|
15 (1%)
|
0
|
Časté
|
Stomatitída
|
96 (8%)
|
4 (<1%)
|
0
|
|
Dyspepsia
|
83 (7%)
|
2 (<1%)
|
0
|
|
Flatulencia
|
43 (4%)
|
0
|
0
|
|
Abdominálna distenzia
|
36 (3%)
|
2 (<1%)
|
0
|
|
Vriedky v ústnej dutine
|
28 (2%)
|
3 (<1%)
|
0
|
|
Suchosť v ústach
|
27 (2%)
|
0
|
0
|
Menej časté
|
Pankreatitída
|
8 (<1%)
|
4 (<1%)
|
0
|
|
Rektálne krvácanie
|
8 (<1%)
|
2 (<1%)
|
0
|
|
Hematochézia
|
6 (<1%)
|
0
|
0
|
|
Gastrointestinálne
|
4 (<1%)
|
2 (<1%)
|
0
|
|
krvácanie
|
|
|
|
|
Meléna
|
4 (<1%)
|
1(<1%)
|
0
|
|
Častá stolica
|
3 (<1%)
|
0
|
0
|
|
Krvácanie z anusu
|
2 (<1%)
|
0
|
0
|
|
Perforácia hrubého čreva
|
2 (<1%)
|
1 (<1%)
|
0
|
|
Krvácanie v ústnej dutine
|
2 (<1%)
|
0
|
0
|
|
Krvácanie v hornej časti
|
2 (<1%)
|
1 (<1%)
|
0
|
|
gastrointestinálneho
|
|
|
|
|
traktu
|
|
|
|
|
Enterokutánna fistula
|
1 (<1%)
|
0
|
0
|
|
Hemateméza
|
1 (<1%)
|
0
|
0
|
|
Hemoroidálne krvácanie
|
1 (<1%)
|
0
|
0
|
|
Perforácia ilea
|
1 (<1%)
|
0
|
1 (<1%)
|
|
Ezofágové krvácanie
|
1 (<1%)
|
0
|
0
|
|
Retroperitoneálne
|
1 (<1%)
|
0
|
0
|
|
krvácanie
|
|
|
|
Časté
|
Hyperbilirubinémia
|
38 (3%)
|
2 (<1%)
|
1 (<1%)
|
|
Porucha funkcie pečene
|
29 (3%)
|
13 (1%)
|
2 (<1%)
|
|
Hepatotoxicita
|
18 (2%)
|
11(<1%)
|
2 (<1%)
|
Menej časté
|
Žltačka
|
3 (<1%)
|
1 (<1%)
|
0
|
|
|
a žlčových ciest
 T
rieda
T
rieda
F
r
ekvencia
|
N
ežiaduce reakcie
|
V
šetky
|
3. stupeň
|
4. stupeň
|
(
všetky
|
|
stupne
|
z
ávažnosti
|
z
ávažnosti
|
stupne
|
|
z
ávažnosti
|
n (%)
|
n (%)
|
z
ávažnosti)
|
|
n (%)
|
|
|
|
Poškodenie pečene
|
2 (<1%)
|
2 (<1%)
|
0
|
|
vyvolané liekom
|
|
|
|
|
Zlyhanie pečene
|
1 (<1%)
|
0
|
1 (<1%)
|
Veľmi časté
|
Zmena farby vlasov
|
404 (35%)
|
1 (<1%)
|
0
|
|
Syndróm palmárno-
|
206 (18%)
|
39 (3%)
|
0
|
|
plantárnej
|
|
|
|
|
erytrodyzestézie
|
|
|
|
|
Alopécia
|
130 (11%)
|
0
|
0
|
|
Vyrážka
|
129 (11%)
|
7 (<1%)
|
0
|
Časté
|
Hypopigmentácia kože
|
52 (5%)
|
0
|
0
|
|
Suchosť kože
|
50 (4%)
|
0
|
0
|
|
Pruritus
|
29 (3%)
|
0
|
0
|
|
Erytém
|
25 (2%)
|
0
|
0
|
|
Depigmentácia kože
|
20 (2%)
|
0
|
0
|
|
Hyperhidróza
|
17 (1%)
|
0
|
0
|
Menej časté
|
Porucha nechtov
|
11 (<1%)
|
0
|
0
|
|
Odlupovanie kože
|
10 (<1%)
|
0
|
0
|
|
Reakcia z fotosenzitivity
|
7 (<1%)
|
0
|
0
|
|
Erytematózna vyrážka
|
6 (<1%)
|
0
|
0
|
|
Porucha kože
|
5 (<1%)
|
0
|
0
|
|
Makulárna vyrážka
|
4 (<1%)
|
0
|
0
|
|
Pruritická vyrážka
|
3 (<1%)
|
0
|
0
|
|
Vezikulárna vyrážka
|
3 (<1%)
|
0
|
0
|
|
Generalizovaný pruritus
|
2 (<1%)
|
1 (<1%)
|
0
|
|
Generalizovaná vyrážka
|
2 (<1%)
|
0
|
0
|
|
Papulózna vyrážka
|
2 (<1%)
|
0
|
0
|
|
Plantárny erytém
|
1 (<1%)
|
0
|
0
|
|
Kožný vred†
|
neznáme
|
neznáme
|
neznáme
|
Časté
|
Artralgia
|
48 (4%)
|
8 (<1%)
|
0
|
|
Myalgia
|
35 (3%)
|
2 (<1%)
|
0
|
|
Svalové spazmy
|
25 (2%)
|
0
|
0
|
Menej časté
|
Bolesť kostrovej
|
9 (<1%)
|
1 (<1%)
|
0
|
|
a svalovej sústavy
|
|
|
|
Veľmi časté
|
Proteinúria
|
135 (12%)
|
32 (3%)
|
0
|
Menej časté
|
Krvácanie v močových
|
1 (<1%)
|
0
|
0
|
|
cestách
|
|
|
|
Menej časté
|
Menorágia
|
3 (<1%)
|
0
|
0
|
|
Vaginálne krvácanie
|
3 (<1%)
|
0
|
0
|
|
Metrorágia
|
1 (<1%)
|
0
|
0
|
Veľmi časté
|
Únava
|
415 (36%)
|
65 (6%)
|
1 (<1%)
|
Časté
|
Zápal slizníc
|
86 (7%)
|
5 (<1%)
|
0
|
|
Asténia
|
82 (7%)
|
20 (2%)
|
1 (<1%)
|
|
Edémb
|
72 (6%)
|
1 (<1%)
|
0
|
|
Bolesť na hrudníku
|
18 (2%)
|
2 (<1%)
|
0
|
Menej časté
|
Triaška
|
4 (<1%)
|
0
|
0
|
|
|
orgánových systémov
P
oruchy kože a
podkožného
t
kaniva
P
oruchy
kostrovej a
svalovej sústavy a spojivového tkaniva
P
oruchy obličiek
a močových ciest
P
oruchy
reprodukčného systému a prsníkov
C
elkové poruchy
a reakcie v mieste podania
T
rieda orgánových systémov
|
F
r
ekvencia
(
všetky stupne závažnosti)
|
N
ežiaduce reakcie
|
V
šetky
stupne závažnosti n (%)
|
3. stupeň
z
ávažnosti
n (%)
|
4. stupeň
z
ávažnosti
n (%)
|
|
|
Porucha slizníc
|
1 (<1%)
|
0
|
0
|
|
Veľmi časté
Časté
|
Zvýšená hladina
alanínaminotransferázy
Zvýšená hladina aspartátaminotransferázy
Zníženie telesnej hmotnosti Zvýšená hladina bilirubínu v krvi
Zvýšená hladina kreatinínu v krvi Zvýšená hladina lipázy Znížený počet bielych
|
246 (21%)
211 (18%)
96 (8%)
61 (5%)
55 (5%)
51 (4%)
51 (4%)
|
84 (7%)
51 (4%)
7 (<1%)
6 (<1%)
3 (<1%)
21 (2%)
3 (<1%)
|
14 (1%)
10 (<1%)
0
1 (<1%)
0
7 (<1%)
0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
krviniekd
|
|
|
|
|
|
Zvýšená hladina
hormónu stimulujúceho štítnu žľazu v krvi
|
36 (3%)
|
0
|
0
|
|
|
Zvýšená hladina amylázy
|
35 (3%)
|
7 (<1%)
|
0
|
|
|
Zvýšená hladina
gamaglutamyltransferázy
|
31 (3%)
|
9 (<1%)
|
4 (<1%)
|
L
aboratórne a
f
u
nkčné
|
|
Zvýšený krvný tlak
|
15 (1%)
|
2 (<1%)
|
0
|
vyšetrenia
|
|
Zvýšená hladina
močoviny v krvi
|
12 (1%)
|
1 (<1%)
|
0
|
|
|
Abnormálne hodnoty
funkčných vyšetrení pečene
|
12 (1%)
|
6 (<1%)
|
1 (<1%)
|
|
Menej časté
|
Zvýšená hladina
pečeňových enzýmov
|
11 (<1%)
|
4 (<1%)
|
3 (<1%)
|
|
|
Znížená hladina glukózy
v krvi
|
7 (<1%)
|
0
|
1 (<1%)
|
|
|
Predĺženie QT intervalu
na elektrokardiograme
|
7 (<1%)
|
2 (<1%)
|
0
|
|
|
Zvýšená hladina
transamináz
|
7 (<1%)
|
1 (<1%)
|
0
|
|
|
Abnormálne hodnoty
funkčných vyšetrení štítnej žľazy
|
3 (<1%)
|
0
|
0
|
|
|
Zvýšený diastolický
krvný tlak
|
2 (<1%)
|
0
|
0
|
|
|
Zvýšený systolický
krvný tlak
|
1 (<1%)
|
0
|
0
|
† Nežiaduce reakcie súvisiace s liečbou hlásené počas obdobia po uvedení lieku na trh (spontánne hlásenia
prípadov a závažné nežiaduce reakcie zo všetkých klinických skúšaní s pazopanibom).
* Nežiaduce reakcie súvisiace s liečbou hlásené iba počas obdobia po uvedení lieku na trh. Frekvenciu nemožno odhadnúť z dostupných údajov.
Boli skombinované nasledujúce termíny:
a Bolesť brucha, bolesť v hornej časti brucha a bolesť v dolnej časti brucha
b Edém, periférny edém, edém oka, lokalizovaný edém a edém tváre
c Dysgeúzia, ageúzia a hypogeúzia
d Znížený počet bielych krviniek, znížený počet neutrofilov a znížený počet leukocytov
e Znížená chuť do jedla a anorexia
f Srdcová dysfunkcia, dysfunkcia ľavej komory, srdcové zlyhanie a reštriktívna kardiomyopatia
g Venózna tromboembolická príhoda, hlboká žilová trombóza, pľúcna embólia a trombóza
Neutropénia, trombocytopénia a syndróm palmárno-plantárnej erytrodyzestézie boli častejšie pozorované u pacientov východoázijského pôvodu.
Tabuľka 3 Nežiaduce reakcie súvisiace s liečbou hlásené v skúšaniach STS (n = 382) alebo počas obdobia po uvedení lieku na trhFrekvencia
(všetky stupne
závažnosti)
| Nežiaduce reakcie
| Všetky stupne
závažnosti
n (%)
| 3. stupeň závažnosti
n (%)
| 4. stupeň závažnosti
n (%)
| Časté
| Infekcia ďasien
| 4 (1%)
| 0
| 0
| Veľmi časté
| Bolesť v mieste nádoru
| 121 (32%)
| 32 (8%)
| 0
| Veľmi časté
| Leukopénia
| 106 (44%)
| 3 (1%)
| 0
|
| Trombocytopénia
| 86 (36%
| 7 (3%)
| 2 (<1%)
|
| Neutropénia
| 79 (33%)
| 10 (4%)
| 0
| Menej časté
| Trombotická
| 1 (<1%)
| 1 (<1%)
| 0
|
| mikroangiopatia (vrátane
|
|
|
|
| trombotickej
|
|
|
|
| trombocytopenickej
|
|
|
|
| purpury a hemolyticko-
|
|
|
|
| uremického syndrómu)
|
|
|
| Časté
| Hypotyreóza
| 18 (5%)
| 0
| 0
|
|
|
Trieda orgánových systémovInfekcie a nákazyBenígne a malígnenádory, vrátane nešpecifikovaných novotvarov (cysty a polypy)Poruchy krvi alymfatického systémuf
 P
oruchy
endokrinného systému
P
oruchy metabolizmu a
výživy
P
oruchy
endokrinného systému
P
oruchy metabolizmu a
výživy
Veľmi časté Znížená chuť do jedla 108 (28%) 12 (3%) 0
Hypoalbuminémiaf 81 (34%) 2 (<1%) 0
Časté Dehydratácia 4 (1%) 2 (1%) 0
Menej časté Hypomagneziémia 1 (<1%) 0 0
Neznáme Syndróm z rozpadu
nádoru*
neznáme neznáme neznáme
P
sychické poruchy Časté Insomnia 5 (1%) 1 (<1%) 0
Veľmi časté Dysgeúziac 79 (21%) 0 0
Bolesť hlavy 54 (14%) 2 (<1%) 0
P
oruchy nervového
Časté Periférna senzorická
neuropatia
30 (8%) 1 (<1%) 0
systému
Závraty 15 (4%) 0 0
Menej časté Somnolencia 3 (<1%) 0 0
Parestézia 1 (<1%) 0 0
Mozgový infarkt 1 (<1%) 0 1 (<1%)
P
oruchy oka Časté Rozmazané videnie 15 (4%) 0 0
F
r
e
kvencia
|
N
ežiaduce reakcie
|
V
šetky
|
3. stupeň
|
4. stupeň
|
(
všetky
|
|
stupne
|
z
ávažnosti
|
z
ávažnosti
|
stupne
|
|
z
ávažnosti
|
n (%)
|
n (%)
|
z
ávažnosti)
|
|
n (%)
|
|
|
Časté
|
Srdcová dysfunciag
|
21 (5%)
|
3 (<1%)
|
1 (<1%)
|
|
Dysfunkcia ľavej
|
13 (3%)
|
3 (<1%)
|
0
|
|
komory
|
|
|
|
|
Bradykardia
|
4 (1%)
|
0
|
0
|
Menej časté
|
Infarkt myokardu
|
1 (<1%)
|
0
|
0
|
Veľmi časté
|
Hypertenzia
|
152 (40%)
|
26 (7%)
|
0
|
Časté
|
Venózna
|
13 (3%)
|
4 (1%)
|
5 (1%)
|
|
tromboembolická
|
|
|
|
|
príhodad
|
|
|
|
|
Návaly tepla
|
12 (3%)
|
0
|
0
|
|
Sčervenanie
|
4 (1%)
|
0
|
0
|
Menej časté
|
Krvácanie
|
2 (<1%)
|
1 (<1%)
|
0
|
Zriedkavé
|
Aneuryzmy a arteriálne
|
neznáme
|
neznáme
|
neznáme
|
|
disekcie
|
|
|
|
Časté
|
Epistaxa
|
22 (6%)
|
0
|
0
|
|
Dysfónia
|
20 (5%)
|
0
|
0
|
|
Dyspnoe
|
14 (4%)
|
3 (<1%)
|
0
|
|
Kašeľ
|
12 (3%)
|
0
|
0
|
|
Pneumotorax
|
7 (2%)
|
2 (<1%)
|
1 (<1%)
|
|
Štikútka
|
4 (1%)
|
0
|
0
|
|
Pľúcne krvácanie
|
4 (1%)
|
1 (<1%)
|
0
|
Menej časté
|
Orofaryngálna bolesť
|
3 (<1%)
|
0
|
0
|
|
Krvácanie z priedušiek
|
2 (<1%)
|
0
|
0
|
|
Rinorea
|
1 (<1%)
|
0
|
0
|
|
Hemoptýza
|
1 (<1%)
|
0
|
0
|
Zriedkavé
|
Intersticiálna choroba
|
neznáme
|
neznáme
|
neznáme
|
|
pľúc/pneumonitída†
|
|
|
|
Veľmi časté
|
Hnačka
|
174 (46%)
|
17 (4%)
|
0
|
|
Nauzea
|
167 (44%)
|
8 (2%)
|
0
|
|
Vracanie
|
96 (25%)
|
7 (2%)
|
0
|
|
Bolesť bruchaa
|
55 (14%)
|
4 (1%)
|
0
|
|
Stomatitída
|
41 (11%)
|
1 (<1%)
|
0
|
Časté
|
Abdominálna distenzia
|
16 (4%)
|
2 (1%)
|
0
|
|
Suchosť v ústach
|
14 (4%)
|
0
|
0
|
|
Dyspepsia
|
12 (3%)
|
0
|
0
|
|
Krvácanie v ústnej
|
5 (1%)
|
0
|
0
|
|
dutine
|
|
|
|
|
Flatulencia
|
5 (1%)
|
0
|
0
|
|
Krvácanie z anusu
|
4 (1%)
|
0
|
0
|
Menej časté
|
Gastrointestinálne
|
2 (<1%)
|
0
|
0
|
|
krvácanie
|
|
|
|
|
Rektálne krvácanie
|
2 (<1%)
|
0
|
0
|
|
Enterokutánna fistula
|
1 (<1%)
|
1 (<1%)
|
0
|
|
Krvácanie do žalúdka
|
1 (<1%)
|
0
|
0
|
|
Meléna
|
2 (<1%)
|
0
|
0
|
|
Ezofágové krvácanie
|
1 (<1%)
|
0
|
1 (<1%)
|
|
Peritonitída
|
1 (<1%)
|
0
|
0
|
|
|
T
rieda orgánových
systémov
P
oruchy srdca a
srdcovej činnosti
P
oruchy ciev
P
oruchy dýchacej
sústavy, hrudníka a mediastína
P
oruchy
gastrointestinál- neho traktu
T
rieda orgánových
systémov
P
oruchy pečene a
ž
l
čových ciest
P
oruchy kože a
podkožného
t
kaniva
P
oruchy kostrovej
a svalovej sústavy a spojivového
t
kaniva
P
oruchy obličiek a močových ciest
F
r
e
kvencia
|
N
ežiaduce reakcie
|
V
šetky
|
3. stupeň
|
4. stupeň
|
(
všetky
|
|
stupne
|
z
ávažnosti
|
z
ávažnosti
|
stupne
|
|
z
ávažnosti
|
n (%)
|
n (%)
|
z
ávažnosti)
|
|
n (%)
|
|
|
|
Retroperitoneálne
|
1 (<1%)
|
0
|
0
|
|
krvácanie'
|
|
|
|
|
Krvácanie v hornej časti
|
1 (<1%)
|
1 (<1%)
|
0
|
|
gastrointestinálneho
|
|
|
|
|
traktu
|
|
|
|
|
Perforácia ilea
|
1 (<1%)
|
0
|
1 (<1%)
|
Menej časté
|
Porucha funkcie pečene
|
2 (<1%)
|
0
|
1 (<1%)
|
Neznáme
|
Zlyhanie pečene*
|
neznáme
|
neznáme
|
neznáme
|
Veľmi časté
|
Zmena farby vlasov
|
93 (24%)
|
0
|
0
|
|
Hypopigmentácia kože
|
80 (21%)
|
0
|
0
|
|
Exfoliatívna vyrážka
|
52 (14%)
|
2 (<1%)
|
0
|
Časté
|
Alopécia
|
30 (8%)
|
0
|
0
|
|
Porucha kožec
|
26 (7%)
|
4 (1%)
|
0
|
|
Suchosť kože
|
21 (5%)
|
0
|
0
|
|
Hyperhidróza
|
18 (5%)
|
0
|
0
|
|
Porucha nechtov
|
13 (3%)
|
0
|
0
|
|
Pruritus
|
11 (3%)
|
0
|
0
|
|
Erytém
|
4 (1%)
|
0
|
0
|
Menej časté
|
Vriedky na koži
|
3 (<1%)
|
1 (<1%)
|
0
|
|
Vyrážka
|
1 (<1%)
|
0
|
0
|
|
Papulózna vyrážka
|
1 (<1%)
|
0
|
0
|
|
Reakcia z fotosenzitivity
|
1 (<1%)
|
0
|
0
|
|
Syndróm palmárno-
|
2 (<1%)
|
0
|
0
|
|
plantárnej
|
|
|
|
|
erytrodyzestézie
|
|
|
|
Časté
|
Bolesť kostrovej
|
35 (9%)
|
2 (<1%)
|
0
|
|
a svalovej sústavy
|
|
|
|
|
Myalgia
|
28 (7%)
|
2 (<1%)
|
0
|
|
Svalové kŕče
|
8 (2%)
|
0
|
0
|
Menej časté
|
Artralgia
|
2 (<1%)
|
0
|
0
|
Menej časté
|
Proteinúria
|
2 (<1%)
|
0
|
0
|
Menej časté
|
Vaginálne krvácanie
|
3 (<1%)
|
0
|
0
|
|
Menorágia
|
1 (<1%)
|
0
|
0
|
|
|
P
oruchy reprodukčného systému a prsníkov
C
elkové poruchy a reakcie v mieste podania
Veľmi časté Únava 178 (47%) 34 (9%) 1 (<1%)
Časté Edémb 18 (5%) 1 (<1%) 0
Bolesť na hrudníku 12 (3%) 4 (1%) 0
Triaška 10 (3%) 0 0
Menej časté Zápal slizníce 1 (<1%) 0 0
Asténia 1 (<1% 0 0
 L
aboratórne a funkčné vyšetrenia
L
aboratórne a funkčné vyšetreniah
Veľmi časté Zníženie telesnej
hmotnosti
Časté Abnormálne výsledky vyšetrenia ucha, nosa a hrdlae
86 (23%) 5 (1%) 0
29 (8%) 4 (1%) 0
T
rieda orgánových systémov
|
F
r
e
kvencia
(
všetky stupne závažnosti)
|
N
ežiaduce reakcie
|
V
šetky
stupne závažnosti n (%)
|
3. stupeň
z
ávažnosti
n (%)
|
4. stupeň
z
ávažnosti
n (%)
|
|
|
Zvýšená hladina
alanínaminotransferázy
|
8 (2%)
|
4 (1%)
|
2 (<1%)
|
|
|
Abnormálna hladina
cholesterolu v krvi
|
6 (2%)
|
0
|
0
|
|
|
Zvýšená hladina
aspartátaminotransferázy
|
5 (1%)
|
2 (<1%)
|
2 (<1%)
|
|
|
Zvýšená hladina
gamaglutamyltransferázy
|
4 (1%)
|
0
|
3 (<1%)
|
|
Menej časté
|
Zvýšená hladina
bilirubínu v krvi
|
2 (<1%)
|
0
|
0
|
|
|
Zvýšená hladina
aspartátaminotransferázy
|
2 (<1%)
|
0
|
2 (<1%)
|
|
|
Zvýšená hladina
alanínaminotransferázy
|
1 (<1%)
|
0
|
1 (<1%)
|
|
|
Znížený počet krvných
doštičiek
|
1 (<1%)
|
0
|
1 (<1%)
|
|
|
Predĺženie QT intervalu
na elektrokardiograme
|
2 (<1%)
|
1 (<1%)
|
0
|
† Nežiaduce reakcie súvisiace s liečbou hlásené počas obdobia po uvedení lieku na trh (spontánne hlásenia
prípadov a závažné nežiaduce reakcie zo všetkých klinických skúšaní s pazopanibom).
* Nežiaduce reakcie súvisiace s liečbou hlásené iba počas obdobia po uvedení lieku na trh. Frekvenciu nemožno odhadnúť z dostupných údajov.
Boli skombinované nasledujúce termíny:
a Bolesť brucha, bolesť v hornej časti brucha a gastrointestinálna bolesť
b Edém, periférny edém a edém očných viečok
c Vo väčšine týchto prípadov išlo o syndróm palmárno-plantárnej erytrodyzestézie
d Venózne tromboembolické príhody - zahŕňajú hlbokú žilovú trombózu, pľúcnu embóliu a trombózu
e Väčšina týchto prípadov popisuje mukozitídu
f Frekvencia výskytu je založená na tabuľkách s laboratórnymi hodnotami zo skúšania VEG110727 (N = 240). Tieto boli skúšajúcimi lekármi hlásené ako nežiaduce udalosti menej často ako sa udáva v tabuľkách s
laboratórnymi hodnotami.
g Prípady srdcovej dysfunkcie - zahŕňajú dysfunkciu ľavej komory, srdcové zlyhanie a reštriktívnu
kardiomyopatiu
h Frekvencia výskytu je založená na nežiaducich udalostiach hlásených skúšajúcimi lekármi. Odchýlky laboratórnych hodnôt boli skúšajúcimi lekármi hlásené ako nežiaduce udalosti menej často ako sa udáva v tabuľkách s laboratórnymi hodnotami.
Neutropénia, trombocytopénia a syndróm palmárno-plantárnej erytrodyzestézie boli častejšie pozorované u pacientov východoázijského pôvodu.
Pediatrická populáciaBezpečnostný profil u pediatrických pacientov bol podobný profilu hlásenému pri pazopanibe u
dospelých v schválených indikáciách na základe údajov od 44 pediatrických pacientov zo štúdie fázy I ADVL0815 a 57 pediatrických pacientov zo štúdie fázy II PZP034X2203 (pozri časť 5.1).
Hláseniepodozrenínanežiaducereakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieV klinických štúdiách bol pazopanib hodnotený v dávkach až 2 000 mg. U 1 z 3 pacientov, ktorým bolo podávaných 2 000 mg denne, sa pozorovala únava 3. stupňa (toxicita obmedzujúca veľkosť dávky) a u 1 z 3 pacientov, ktorým bolo podávaných 1 000 mg denne, sa pozorovala hypertenzia 3. stupňa.
Nie je známe žiadne špecifické antidotum pri predávkovaní pazopanibom a liečba predávkovania má pozostávať zo všeobecných podporných opatrení.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Cytostatiká, inhibítory proteínkinázy, iné inhibítory proteínkinázy.
ATC kód: L01EX03
Mechanizmus účinkuPazopanib je perorálne podávaný, silne účinný, mnohocieľový tyrozínkinázový inhibítor (TKI)
receptorov 1, 2 a 3 pre vaskulárny endotelový rastový faktor (vascular endothelial growth factor receptors, VEGFR), receptorov α a β trombocytového rastového faktora (platelet-derived growth
factor, PDGFR) a receptora faktora kmeňových buniek (c-KIT) s hodnotami IC50 10, 30, 47, 71, 84 a
74 nmol/l, v uvedenom poradí. V predklinických experimentoch pazopanib v závislosti od dávky inhiboval v bunkách ligandom indukovanú autofosforyláciu receptora 2 pre VEGFR, receptora c-Kit a receptorov PDGFR. V podmienkach
in vivo pazopanib inhiboval VEGF-indukovanú fosforyláciu
receptora 2 pre VEGFR v myších pľúcach, angiogenézu pri rôznych zvieracích modeloch a rast viacerých ľudských nádorových xenoštepov u myší.
FarmakogenomikaVo farmakogenetickej meta-analýze údajov z 31 klinických skúšaní s pazopanibom, podávaným buď v
monoterapii alebo v kombinácii s inými liekmi, sa zvýšenie ALT > 5 x ULN (NCI CTC 3. stupeň)
vyskytlo u 19 % nositeľov alely HLA-B*57:01 a u 10 % pacientov bez tejto alely. V uvedenom súbore údajov bolo 133 z 2235 (6 %) pacientov nositeľmi alely HLA-B*57:01 (pozri časť 4.4).
Klinické štúdie Karc i nóm z obl i čkovýc h buni ek (RCC) Bezpečnosť a účinnosť pazopanibu pri RCC sa hodnotila v randomizovanej, dvojito zaslepenej,
placebom kontrolovanej, multicentrickej štúdii. Pacientom (N = 435) s lokálne pokročilým a/alebo metastatickým RCC bola náhodne pridelená liečba pazopanibom v dávke 800 mg jedenkrát denne
alebo bolo podávané placebo. Primárny cieľ štúdie bol vyhodnotiť a porovnať dve liečebné skupiny s
ohľadom na prežívanie bez progresie ochorenia (progression-free survival, PFS) a hlavným sekundárnym cieľovým ukazovateľom bolo celkové prežívanie (overall survival, OS). Ďalšími parametrami bolo hodnotenie výskytu celkovej odpovede na liečbu a trvanie odpovede na liečbu.
Z celkového počtu 435 pacientov v tejto štúdii bolo 233 pacientov bez predchádzajúcej liečby a 202 podstupovalo druhú líniu liečby po absolvovaní jednej predchádzajúcej liečby založenej na IL-2 alebo INFα. Výkonnostný stav (ECOG) bol v skupine s pazopanibom a v skupine s placebom podobný (ECOG 0: 42 % oproti 41 %, ECOG 1: 58 % oproti 59 %). Väčšina pacientov mala buď priaznivé (39
%) alebo intermediárne (54 %) prognostické faktory podľa MSKCC (Memorial Sloan Kettering
Cancer Centre)/Motzerových kritérií. Všetci pacienti mali histologicky potvrdený svetlobunkový karcinóm alebo prevažne svetlobunkový karcinóm. Približne polovica všetkých pacientov mala ochorením postihnuté 3 alebo viacej orgánov a väčšina pacientov mala pred začatím liečby metastázy ochorenia lokalizované v pľúcach (74 %) a/alebo v lymfatických uzlinách (54 %).
V oboch liečebných skupinách bolo podobné percento pacientov bez predchádzajúcej liečby a pacientov po predchádzajúcej liečbe cytokínmi (53 % a 47 % v skupine s pazopanibom, 54 % a 46 % v skupine s placebom). V podskupine po predchádzajúcej liečbe cytokínmi väčšina pacientov (75 %) podstúpila liečbu založenú na interferóne.
V oboch liečebných skupinách bolo podobné percento pacientov, ktorí v predchádzajúcom období podstúpili nefrektómiu (89 % v skupine s pazopanibom a 88 % v skupine s placebom) a/alebo rádioterapiu (22 % v skupine s pazopanibom a 15 % v skupine s placebom).
Primárna analýza primárneho cieľového ukazovateľa PFS je založená na hodnotení ochorenia prostredníctvom nezávislej rádiologickej analýzy v celej sledovanej populácii (pacienti bez predchádzajúcej liečby a pacienti po predchádzajúcej liečbe cytokínmi).
Tabuľka 4 Výsledky celkovej účinnosti pri RCC podľa nezávislého hodnotenia(VEG105192)Cieľové ukazovatele/Sledovaná populácia
|
Pazopanib
|
Placebo
|
HR (95% IS)
|
P-hodnota
(jednostranná)
|
PFS
Celková* ITT populácia
Medián (mesiace)
|
N=290
9,2
|
N=145
4,2
|
0,46 (0,34; 0,62)
|
<0,0000001
|
Miera odpovede na
liečbu
% (95% IS, interval
spoľahlivosti)
|
N =290
30 (25,1; 35,6)
|
N =145
3 (0,5; 6,4)
|
–
|
<0,001
|
HR=pomer rizík (hazard ratio); ITT=populácia všetkých randomizovaných pacientov (intention to treat); PFS=prežívanie bez progresie ochorenia (progression-free survival).
* - pacienti bez predchádzajúcej liečby a pacienti po predchádzajúcej liečbe cytokínmi.
|
Graf 1 Kaplanova-Meierova krivka prežívania bez progresie ochorenia podľanezávislej analýzy celej sledovanej populácie (pacienti bez predchádzajúcej liečby a pacienti po predchádzajúcej liečbe cytokínmi) (VEG105192)

os x; Mesiace, os y; Podiel pacientov bez progresie ochorenia, Pazopanib —―— (N = 290), Medián 9,2
mesiaca; Placebo -------- (N = 145), Medián 4,2 mesiaca; Pomer rizík = 0,46; 95% IS (0,34; 0,62), P <
0,0000001
Graf 2 Kaplanova-Meierova krivka prežívania bez progresie ochorenia podľa nezávislej analýzy pacientov bez predchádzajúcej liečby (VEG105192) os x; Mesiace, os y; Podiel pacientov bez progresie ochorenia, Pazopanib —―— (N = 155), Medián 11,1
mesiaca; Placebo ------- (N = 78), Medián 2,8 mesiaca; Pomer rizík = 0,40; 95% IS (0,27; 0,60), P < 0,0000001
Graf 3 Kaplanova-Meierova krivka prežívania bez progresie ochorenia podľa nezávislej analýzy pacientov po predchádzajúcej liečbe cytokínmi (VEG105192)
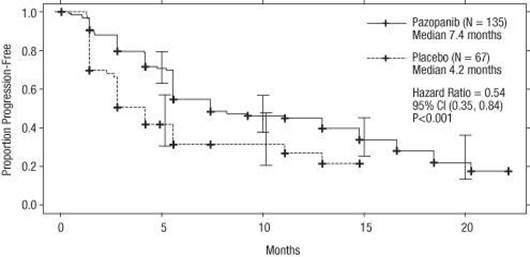
os x; Mesiace, os y; Podiel pacientov bez progresie ochorenia, Pazopanib —―— (N = 135), Medián 7,4
mesiaca; Placebo -------- (N = 67), Medián 4,2 mesiaca; Pomer rizík = 0,54; 95 % IS (0,35; 0,84), P < 0,001
U pacientov, ktorí odpovedali na liečbu, bol podľa nezávislej analýzy medián času do odpovede na liečbu 11,9 týždňa a medián trvania odpovede na liečbu bol 58,7 týždňa (VEG105192).
V konečnej analýze prežívania špecifikovanej protokolom bol medián celkového prežívania (OS) 22,9 mesiaca pri pacientoch náhodne zaradených do skupiny s pazopanibom a 20,5 mesiaca pri pacientoch náhodne zaradených do skupiny s placebom [HR = 0,91 (95% IS: 0,71; 1,16; p = 0,224)]. Výsledky
OS podliehajú možnému skresleniu, keďže 54 % pacientov zo skupiny s placebom bolo v predĺžení tejto štúdie po progresii ochorenia liečených aj pazopanibom. Šesťdesiatim šiestim percentám
pacientov zo skupiny s placebom bola po skončení štúdie podávaná liečba, v porovnaní s 30 %
pacientov zo skupiny s pazopanibom.
Medzi liečebnými skupinami sa nezistili žiadne štatistické rozdiely pri hodnotení celkovej kvality života s použitím dotazníkov EORTC QLQ-C30 a EuroQoL EQ-5D.
V štúdii fázy II s 225 pacientmi s lokálne recidivujúcim alebo metastatickým svetlobunkovým karcinómom obličky sa podľa nezávislej analýzy vyskytla objektívna odpoveď na liečbu u 35 % pacientov a medián trvania odpovede na liečbu bol 68 týždňov. Medián PFS bol 11,9 mesiaca.
Bezpečnosť, účinnosť a kvalita života pri liečbe pazopanibom vs. sunitinibom sa hodnotili v randomizovanej, otvorenej štúdii fázy III s paralelným usporiadaním skupín skúmajúcej noninferioritu (VEG108844).
V štúdii VEG108844 bola pacientom (N = 1 110) s lokálne pokročilým a/alebo metastatickým RCC, ktorí v predchádzajúcom období nepodstúpili systémovú liečbu, náhodne pridelená buď liečba pazopanibom v dávke 800 mg nepretržite jedenkrát denne alebo liečba sunitinibom v dávke 50 mg jedenkrát denne v 6-týždňových cykloch s podávaním liečby počas 4 týždňov, po ktorých nasledovali
2 týždne bez liečby.
Primárnym cieľom tejto štúdie bolo vyhodnotiť a porovnať PFS u pacientov liečených pazopanibom oproti pacientom liečeným sunitinibom. Demografické charakteristiky boli medzi liečebnými skupinami podobné. Charakteristiky ochorenia pri prvotnej diagnóze a pri skríningu boli medzi liečebnými skupinami vyvážené, pričom väčšina pacientov mala histologicky potvrdený svetlobunkový karcinóm a ochorenie v štádiu IV.
Štúdia VEG108844 dosiahla svoj primárny cieľový ukazovateľ, ktorým bolo PFS a preukázala, že pazopanib je noninferiórny oproti sunitinibu, keďže horná hranica 95 % IS pre pomer rizík bola nižšia ako protokolom špecifikovaná hraničná hodnota noninferiority 1,25. Výsledky celkovej účinnosti sú zhrnuté v tabuľke 5.
T
abuľka 5 Výsledky celkovej účinnosti (VEG108844)
C
i
eľový ukazovateľ
|
P
azopanib
N=
557
|
Sunitinib
N=
553
|
HR
(
95% IS)
|
PFS
Celkové
Medián (mesiace) (95% IS)
Celkové prežívanie Medián (mesiace) (95% IS)
|
8,4 (8,3; 10,9)
28,3 (26,0; 35,5)
|
9,5 (8,3; 11,0)
29,1 (25,4; 33,1)
|
1,047 (0,898; 1,220)
0,915a
(0,786; 1,065)
|
HR=pomer rizík; PFS=prežívanie bez progresie ochorenia; a P hodnota=0,245 (2-stranná)
|
G
raf 4 Kaplanova-Meierova krivka prežívania bez progresie ochorenia podľa
nezávislej analýzy celej populácie pacientov (VEG108844)
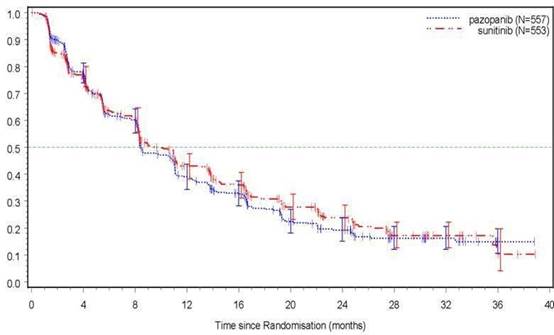
Os x: Čas od randomizácie (mesiace)
Analýzy PFS v podskupinách sa vykonali pre 20 demografických a prognostických faktorov. 95% intervaly spoľahlivosti pre všetky podskupiny zahŕňali pomer rizík v hodnote 1. V troch najmenších z týchto 20 podskupín prekročil bodový odhad pomeru rizík 1,25; t.j. u jedincov, ktorí v predchádzajúcom období nepodstúpili nefrektómiu (n = 186, HR = 1,403; 95% IS (0,955; 2,061)), s východiskovou hodnotou LDH > 1,5 x ULN (n = 68, HR = 1,72; 95% IS (0,943; 3,139)) a s vysokým rizikom podľa MSKCC (n = 119, HR = 1,472; 95% IS (0,937; 2,313)).
Sark óm mäkký ch t kaní v (STS) Účinnosť a bezpečnosť pazopanibu pri STS sa hodnotila v pivotnom, randomizovanom, dvojito zaslepenom, placebom kontrolovanom, multicentrickom skúšaní fázy III (VEG110727). Celkovo 369
pacientom s pokročilým STS bola náhodne pridelená liečba pazopanibom v dávke 800 mg jedenkrát
denne alebo bolo podávané placebo. Dôležité je, že štúdie sa mohli zúčastniť iba pacienti s vybranými histologickými podtypmi STS, a preto sa účinnosť a bezpečnosť pazopanibu môže považovať za
stanovenú iba pri týchto podtypoch STS a liečba pazopanibom sa má obmedziť na takéto podtypy
STS.
Nasledujúce typy tumorov boli vhodné pre štúdiu:
Fibroblastické tumory (fibrosarkóm u dospelých, myxofibrosarkóm, sklerotizujúci epiteloidný fibrosarkóm, malígne solitárne fibrózne tumory), takzvané fibrohistiocytárne tumory (pleomorfný
malígny fibrózny histiocytóm [MFH], obrovskobunkový MFH, inflamatórny MFH), leiomyosarkóm,
malígne glomusové tumory, tumory kostrových svalov (pleomorfný a alveolárny rabdomyosarkóm), tumory cievnej sústavy (epiteloidný hemangioendotelióm, angiosarkóm), neurčito diferencované tumory (synoviálny, epiteloidný, alveolárny tumor mäkkých tkanív, jasnobunkový, dezmoplastický tumor z malých okrúhlych buniek, extrarenálny rabdoidný tumor, malígny mezenchymóm, tumor z perivaskulárnych epiteloidných buniek (PEComa), intimálny sarkóm), malígne tumory z buniek obalov periférnych nervov, nešpecifikované (NOS) nediferencované sarkómy mäkkých tkanív a iné typy sarkómu (neuvedené ako nevhodné pre štúdiu).
Nasledujúce typy tumorov boli nevhodné pre štúdiu:
Adipocytický sarkóm (všetky podtypy), všetky rabdomyosarkómy, ktoré neboli alveolárne ani pleomorfné, chondrosarkóm, osteosarkóm, Ewingove tumory/primitívne neuroektodermálne tumory
(PNET), GIST, dermatofibrosarcoma protuberans, inflamatórny myofibroblastický sarkóm, malígny
mezotelióm a zmiešané mezodermálne tumory maternice.
Treba poznamenať, že pacienti s adipocytickým sarkómom boli z pivotnej štúdie fázy III vylúčení, keďže v predchádzajúcej štúdii fázy II (VEG20002) účinnosť (PFS v 12. týždni) pozorovaná pri pazopanibe podávanom pri adipocytickom sarkóme nedosiahla vopred stanovenú mieru umožňujúcu ďalšie klinické testovanie.
Ďalšie kľúčové kritériá vhodnosti pre zaradenie do štúdie VEG110727 boli: histologicky potvrdený malígny STS vysokého alebo intermediárneho stupňa a progresia ochorenia v priebehu 6 mesiacov od liečby metastatického ochorenia alebo recidíva ochorenia v priebehu 12 mesiacov od (neo)-
/adjuvantnej liečby.
Deväťdesiatosem percent (98 %) jedincov bolo predtým liečených doxorubicínom, 70 % bolo predtým liečených ifosfamidom a 65 % jedincov bolo pred zaradením do štúdie liečených minimálne troma alebo viacerými chemoterapeutikami.
Pacienti boli stratifikovaní podľa faktorov výkonnostného stavu podľa WHO (WHO PS - performance status) (0 alebo 1) pred začatím liečby a podľa počtu línií predchádzajúcej systémovej liečby pokročilého ochorenia (0 alebo 1 oproti 2+). V každej liečebnej skupine bolo mierne vyššie percento jedincov s 2+ líniami predchádzajúcej systémovej liečby pokročilého ochorenia (58 % v liečebnej skupine s placebom a 55 % v liečebnej skupine s pazopanibom) v porovnaní s 0 alebo 1 líniou predchádzajúcej systémovej liečby (42 % v liečebnej skupine s placebom a 45 % v liečebnej skupine s pazopanibom). Medián trvania sledovania jedincov (definovaného ako doba od dátumu randomizácie po posledný kontakt alebo úmrtie) bol podobný v oboch liečebných skupinách (9,36 mesiaca pri placebe [rozmedzie 0,69 až 23,0 mesiacov] a 10,04 mesiaca pri pazopanibe [rozmedzie 0,2 až 24,3 mesiaca].
Primárnym cieľom skúšania bolo prežívanie bez progresie ochorenia (PFS hodnotené nezávislou rádiologickou analýzou); sekundárne cieľové ukazovatele zahŕňali celkové prežívanie (OS), celkovú mieru odpovede na liečbu a trvanie odpovede na liečbu.
Tabuľka 6 Výsledky celkovej účinnosti pri STS podľa nezávislého hodnotenia (VEG110727)
C
ie
ľové ukazovatele /
Sledovaná populácia
|
P
azopanib
|
Placebo
|
H
R (95% IS)
|
P
-
h
odnota
(
dvojstranná)
|
PFS
Celková ITT populácia
Medián (týždne)
Leiomyosarkóm
Medián (týždne)
Podskupiny synoviálneho sarkómu
Medián (týždne)
Podskupiny „iných STS“
Medián (týždne)
|
N=246
20,0
N=109
20,1
N=25
17,9
N=112
20,1
|
N=123
7,0
N=49
8,1
N=13
4,1
N=61
4,3
|
0,35 (0,26; 0,48)
0,37 (0,23; 0,60)
0,43 (0,19; 0,98)
0,39 (0,25; 0,60)
|
<0,001
<0,001
0,005
<0,001
|
OS
Celková ITT populácia
Medián (mesiace)
Leiomyosarkóm* Medián (mesiace)
Podskupiny synoviálneho sarkómu*
Medián (mesiace)
Podskupiny „iných STS“* Medián (mesiace)
|
N=246
12,6
N=109
16,7
N=25
8,7
N=112
10,3
|
N=123
10,7
N=49
14,1
N=13
21,6
N=61
9,5
|
0,87 (0,67; 1,12)
0,84 (0,56; 1,26)
1,62 (0,79; 3,33)
0,84 (0,59; 1,21)
|
0,256
0,363
0,115
0,325
|
Miera odpovede na liečbu
(
CR+
P
R
)
% (95% IS)
Trvanie odpovede na
liečbu
Medián (týždne) (95% IS)
|
4 (2,3; 7,9)
38,9 (16,7; 40,0)
|
0 (0,0; 3,0)
|
|
|
HR = pomer rizík; ITT = populácia všetkých randomizovaných pacientov; PFS = prežívanie bez progresie
ochorenia; CR = úplná odpoveď (complete response); PR = čiastočná odpoveď (partial response). OS = celkové prežívanie
* Celkové prežívanie pre konkrétne histologické podskupiny STS (leiomyosarkóm, synoviálny sarkóm a „iné“
STS) sa má interpretovať obozretne vzhľadom na malý počet jedincov a široké intervaly spoľahlivosti
|
Podobné zlepšenie PFS vyplývajúce z hodnotení vykonaných skúšajúcimi lekármi sa pozorovalo v
skupine s pazopanibom v porovnaní so skupinou s placebom (v celkovej ITT populácii HR: 0,39; 95% IS, 0,30 až 0,52, p < 0,001).
Graf 5 Kaplanova-Meierova krivka prežívania bez progresie ochorenia priSTS podľa nezávislej analýzy celej populácie pacientov (VEG110727)

Predpokladaná funkcia prežívania (Estimated Survival Function), Čas od randomizácie (týždne) (Time since
Randomisation (Weeks), Rizikoví jedinci (Subjects At Risk), Poznámka: Pri každej liečebnej skupine je znázornené rozmedzie 95% intervalu spoľahlivosti (Note: 95% confidence interval bands are shown for each treatment)
V konečnej analýze OS vykonanej po objavení sa 76 % (280/369) udalostí sa medzi dvoma liečebnými skupinami nepozoroval významný rozdiel v OS (HR 0,87; 95% IS 0,67; 1,12; p = 0,256).
Pediatrická populáciaŠtúdia fázy I (ADVL0815) s pazopanibom sa uskutočnila u 44 pediatrických pacientov s rôznymi
rekurentnými alebo refraktérnymi solídnymi nádormi. Primárnym cieľom bolo preskúmať maximálnu tolerovanú dávku (MTD), bezpečnostný profil a farmakokinetické vlastnosti pazopanibu u detí.
Medián trvania expozície v tejto štúdii bol 3 mesiace (1 - 23 mesiacov).
Štúdia fázy II (PZP034X2203) s pazopanibom sa uskutočnila u 57 pediatrických pacientov s refraktérnymi solídnymi nádormi vrátane rabdomyosarkómu (N=12), nerabdomyosarkómového sarkómu mäkkých tkanív (N=11), Ewingovho sarkómu/pPNET (N=10), osteosarkómu (N=10), neuroblastómu (N=8) a hepatoblastómu (N=6). Štúdia bola jednorazová, nekontrolovaná, otvorená štúdia na stanovenie terapeutickej aktivity pazopanibu u detí a dospievajúcich vo veku od 1 do <18 rokov. Pazopanib sa podával denne ako tableta v dávke 450 mg/m2/dávka alebo ako perorálna suspenzia v dávke 225 mg/m2/dávka. Maximálna povolená denná dávka bola 800 mg pre tabletu a 400 mg pre perorálnu suspenziu. Medián trvania expozície bol 1,8 mesiaca (1 deň – 29 mesiacov).
Výsledky tejto štúdie nepreukázali žiadnu významnú protinádorovú aktivitu v príslušnej pediatrickej populácii. Pazopanib sa preto neodporúča na liečbu týchto nádorov u pediatrickej populácie (informácie o použití v pediatrickej populácii, pozri časť 4.2).
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s referenčným liekom obsahujúcim pazopanib vo všetkých podskupinách pediatrickej populácie pri liečbe karcinómu obličky a obličkovej panvičky (okrem nefroblastómu, nefroblastomatózy, jasnobunkového sarkómu, mezoblastického nefrómu, medulárneho karcinómu obličky a rabdoidného tumoru obličky) (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAbsorpcia
Po perorálnom podaní jednorazovej 800 mg dávky pazopanibu pacientom so solídnymi nádormi sa maximálna plazmatická koncentrácia (Cmax) v hodnote približne 19 ± 13 μg/ml dosiahla v priemere po
3,5 hodinách (rozmedzie 1,0 - 11,9 hodiny) a dosiahla sa hodnota AUC0-∞ približne 650 ± 500
μg.h/ml. Každodenné podávanie viedlo k 1,23- až 4-násobnému zvýšeniu AUC0-T.
Pri podávaní pazopanibu v dávkach nad 800 mg nedošlo ku konzistentnému zvýšeniu hodnoty AUC
alebo Cmax.
Systémová expozícia pazopanibu je zvýšená, keď sa podáva s jedlom. Podanie pazopanibu s jedlom s vysokým alebo nízkym obsahom tuku viedlo k približne 2-násobnému zvýšeniu hodnôt AUC a Cmax. Pazopanib sa má preto podávať aspoň dve hodiny po jedle alebo aspoň jednu hodinu pred jedlom (pozri časť 4.2).
Podanie rozdrvenej tablety s obsahom 400 mg pazopanibu zvýšilo hodnotu AUC(0-72) o 46 % a hodnotu Cmax približne 2-násobne a skrátilo tmax o približne 2 hodiny v porovnaní s podaním celej tablety. Tieto výsledky naznačujú, že biologická dostupnosť a rýchlosť absorpcie perorálne podaného pazopanibu sú zvýšené po podaní rozdrvenej tablety v porovnaní s podaním celej tablety (pozri časť
4.2).
Distribúcia
Väzba pazopanibu na ľudské plazmatické bielkoviny in vivo bola viac než 99 % bez závislosti od
koncentrácie v rozmedzí 10 - 100 μg/ml. In vitro štúdie svedčia o tom, že pazopanib je substrát P-gp a
BCRP.
Biotransformácia
Výsledky z in vitro štúdií preukázali, že metabolizmus pazopanibu je sprostredkovaný hlavne
CYP3A4, pričom v menšej miere sa na ňom podieľajú CYP1A2 a CYP2C8. Štyri hlavné metabolity pazopanibu predstavujú iba 6 % expozície v plazme. Jeden z týchto metabolitov inhibuje proliferáciu VEGF-stimulovaných ľudských endotelových buniek umbilikálnej žily s podobnou účinnosťou ako pazopanib, ďalšie metabolity sú 10- až 20-násobne menej účinné. Účinnosť pazopanibu preto závisí hlavne od expozície pôvodnej molekule pazopanibu.
Eliminácia
Pazopanib sa vylučuje pomaly s priemerným polčasom 30,9 hodiny po podaní odporúčanej 800 mg
dávky. Vylučuje sa hlavne stolicou, pričom vylučovanie obličkami predstavuje < 4 % podanej dávky.
Osobitné skupinypacientov
Porucha f unkc ie obl i či ek
Výsledky naznačujú, že močom sa vo forme pazopanibu a jeho metabolitov vylučuje menej než 4 %
perorálne podanej dávky pazopanibu. Výsledky z populačného farmakokinetického modelovania (údaje od jedincov s východiskovými hodnotami klírensu kreatinínu (CLCR) v rozmedzí od 30,8 ml/min do 150 ml/min) preukázali, že porucha funkcie obličiek pravdepodobne nemá klinicky významný vplyv na farmakokinetiku pazopanibu. U pacientov s klírensom kreatinínu nad 30 ml/min nie je potrebná žiadna úprava dávky. U pacientov s klírensom kreatinínu pod 30 ml/min sa odporúča opatrnosť, keďže v tejto skupine pacientov nie sú skúsenosti s podávaním pazopanibu (pozri časť 4.2).
Porucha f unkc ie peče ne Ľahká
Mediány hodnôt Cmax a AUC(0-24) pazopanibu v rovnovážnom stave u pacientov s miernymi abnormalitami parametrov pečene (definovanými buď ako referenčné hodnoty bilirubínu a zvýšenie
hodnôt ALT akéhokoľvek stupňa alebo ako zvýšenie hodnôt bilirubínu až na 1,5-násobok ULN bez ohľadu na hodnotu ALT) po podaní 800 mg jedenkrát denne sú podobné ako mediány hodnôt u
pacientov s normálnou funkciou pečene (pozri tabuľku 7). 800 mg pazopanibu jedenkrát denne je
odporúčaná dávka pre pacientov s miernymi abnormalitami sérových pečeňových testov (pozri časť
4.2).
Stredne ťažkáMaximálna tolerovaná dávka pazopanibu (MTD) u pacientov so stredne ťažkou poruchou funkcie pečene (definovanou ako zvýšenie hodnôt bilirubínu na > 1,5-násobok až 3-násobok ULN bez ohľadu na hodnotu ALT) bola 200 mg jedenkrát denne. Mediány hodnôt Cmax a AUC(0-24) v rovnovážnom stave dosiahnuté po podávaní 200 mg pazopanibu jedenkrát denne u pacientov so stredne ťažkou poruchou funkcie pečene predstavovali približne 44 % (Cmax) a 39 % (AUC(0-24)) zodpovedajúcich mediánov hodnôt dosiahnutých po podávaní 800 mg jedenkrát denne u pacientov s normálnou funkciou pečene (pozri tabuľku 7).
U jedincov so stredne ťažkou poruchou funkcie pečene sa na základe údajov o bezpečnosti a znášanlivosti má dávka pazopanibu znížiť na 200 mg jedenkrát denne (pozri časť 4.2).
ŤažkáMediány hodnôt Cmax a AUC(0-24) v rovnovážnom stave dosiahnuté po podávaní 200 mg pazopanibu jedenkrát denne u pacientov s ťažkou poruchou funkcie pečene predstavovali približne 18 % (Cmax) a
15 % (AUC(0-24)) zodpovedajúcich mediánov hodnôt dosiahnutých po podávaní 800 mg jedenkrát denne u pacientov s normálnou funkciou pečene. Na základe zníženej expozície a obmedzenej
pečeňovej rezervy sa pazopanib neodporúča pre pacientov s ťažkou poruchou funkcie pečene
(definovanou ako hodnota celkového bilirubínu > 3-násobok ULN bez ohľadu na hladinu ALT) (pozri časť 4.2).
Tabuľka 7 Mediány farmakokinetických parametrov pazopanibu v rovnovážnom stave stanovené u pacientov s poruchou funkcie pečene.Skupina
| Sledovaná dávka
| Cmax (µg/ml)
| AUC(0-24)
(µg x h/ml)
| Odporúčaná dávka
|
Normálna funkcia pečene
| 800 mg OD
| 52,0
(17,1 - 85,7)
| 888,2
(345,5 - 1482)
| 800 mg OD
|
Mierna porucha funkcie
pečene (PFP)
| 800 mg OD
| 33,5
(11,3 - 104,2)
| 774,2
(214,7 - 2034,4)
| 800 mg OD
|
Stredne ťažká PFP
| 200 mg OD
| 22,2
(4,2 - 32,9)
| 256, 8
(65,7 - 487,7)
| 200 mg OD
|
Ťažká PFP
| 200 mg OD
| 9,4
(2,4 - 24,3)
| 130,6
(46,9 - 473,2)
| Neodporúča sa
|
OD – jedenkrát denne
|
Pedi at ri ck á popul áci a Po podaní pazopanibu pediatrickým pacientom v dávke 225 mg/m2 (vo forme perorálnej suspenzie)
boli farmakokinetické parametre (Cmax, Tmax a AUC) podobné tým, ktoré boli predtým hlásené
u dospelých pacientov liečených 800 mg pazopanibu. Výsledky nepreukázali žiadny výrazný rozdiel v
klírense pazopanibu, normalizovaný podľa plochy povrchu tela, medzi deťmi a dospelými.
5.3 Predklinické údaje o bezpečnostiPredklinický bezpečnostný profil pazopanibu sa hodnotil na myšiach, potkanoch, králikoch a opiciach. V štúdiách opakovaného podávania vykonaných na hlodavcoch, účinky na rôzne tkanivá (kosti, zuby, nechtové lôžka, reprodukčné orgány, hematologické tkanivá, obličky a pankreas) zrejme súviseli s farmakologickým účinkom inhibície VEGFR a/alebo narušenia od VEGF-závislých signálnych dráh, pričom väčšina účinkov sa vyskytovala pri hladinách expozície v plazme nižších ako sú hladiny pozorované v klinickej praxi. Ďalšie zaznamenané účinky zahŕňajú úbytok telesnej hmotnosti, hnačku a/alebo morbiditu, ktoré boli buď dôsledkom lokálnych gastrointestinálnych účinkov zapríčinených vysokou lokálnou expozíciou lieku na slizniciach (pri opiciach) alebo farmakologických účinkov (pri hlodavcoch). Proliferatívne hepatálne lézie (eozinofilné ložiská a adenóm) sa pozorovali u samíc myší
pri expozíciách 2,5-násobne vyšších ako je expozícia u ľudí na základe AUC.
V štúdiách juvenilnej toxicity, v ktorých sa potkanom pred odstavením podávali dávky od 9. dňa po narodení až do 14. dňa po narodení, spôsobil pazopanib úmrtia a abnormálny rast/zrenie orgánov, konkrétne obličiek, pľúc, pečene a srdca, a to pri dávke predstavujúcej približne 0,1-násobok klinickej expozície u dospelých ľudí na základe AUC. Keď sa potkanom po odstavení podávali dávky od 21. dňa po narodení po 62. deň po narodení, toxikologické nálezy boli podobné ako u dospelých potkanov
pri porovnateľných expozíciách. Ľudskí pediatrickí pacienti sú vystavení zvýšenému riziku účinkov na kosti a zuby v porovnaní s dospelými, keďže tieto zmeny, vrátane inhibície rastu (skrátené končatiny),
krehkých kostí a remodelácie zubov, boli prítomné u juvenilných potkanov pri dávke ≥ 10 mg/kg/deň
(rovnajúcej sa približne 0,1- až 0,2-násobku klinickej expozície u dospelých ľudí na základe AUC) (pozri časť 4.4).
Účinky na reprodukčnýsystém,fertilituateratogénneúčinky
Pazopanib bol preukázateľne embryotoxický a teratogénny, keď sa podával potkanom a králikom pri
expozíciách viac než 300-násobne nižších ako je expozícia u ľudí (na základe AUC). Účinky zahŕňali zníženú samičiu fertilitu, zvýšené predimplantačné a postimplantačné straty, skorú resorpciu embrya/plodu, smrť embrya, zníženú telesnú hmotnosť plodu a kardiovaskulárnu malformáciu. U hlodavcov sa tiež zaznamenalo zníženie počtu žltých teliesok, zvýšenie počtu cýst a atrofia vaječníkov. V štúdii fertility potkaních samcov sa nezistil žiaden účinok na párenie alebo fertilitu, ale pri expozíciách rovnajúcich sa 0,3-násobku expozície u ľudí na základe AUC sa zaznamenala znížená hmotnosť semenníkov a nadsemenníkov spolu so zníženou tvorbou spermií, zníženou motilitou spermií a zníženou koncentráciou spermií v nadsemeníkoch a v semenníkoch.
Genotoxicita
Pazopanib nespôsobil genetické poškodenie, keď sa testoval v testoch genotoxicity (Amesov test, test
chromozómových aberácií v ľudských periférnych lymfocytoch a in vivo mikronukleárny test na potkanoch). Syntetický medziprodukt vznikajúci pri výrobe pazopanibu, ktorý je v malom množstve
obsiahnutý aj v konečnom liečive, nebol mutagénny v Amesovom teste, ale bol genotoxický v teste na
bunkách myšieho lymfómu a v in vivo mikronukleárnom teste na myšiach.
Karcinogenita
V dvojročných testoch karcinogenity s pazopanibom sa pozorovalo zvýšenie počtu pečeňových
adenómov u myší a duodenálnych adenokarcinómov u potkanov. Vzhľadom na patogenézu špecifickú pre hlodavcov a mechanizmus týchto nálezov sa neusudzuje, že by predstavovali zvýšené riziko karcinogenity pre pacientov užívajúcich pazopanib.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Pazopani b Gedeon Richter 200 mg fi l mom obal ené tabl ety:
Jadro tablety
mikrokryštalická celulóza (E460)
sodná soľ karboxymetylškrobu (typ A)
povidón (K30) (E1201)
stearát horečnatý (E470b)
Obal tabletyhypromelóza (E464) oxid titaničitý (E171) makrogol 400 (E1521)

červený oxid železitý (E172)
polysorbát 80 (E433)
Pazopanib Gedeon Richter 400 mg fi l mom obal ené tabl ety: Jadro tablety
mikrokryštalická celulóza (E460)
sodná soľ karboxymetylškrobu (typ A)
povidón (K30) (E1201)
stearát horečnatý (E470b)
Obal tablety
hypromelóza (E464)
oxid titaničitý (E171)
makrogol 400 (E1521)
polysorbát 80 (E433)
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti30 mesiacov
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaPazopanib Gedeon Richter 200 mg fi l mom obal ené tabl ety: 30, 90, multibalenie po 90 (3 balenia po 30) filmom obalených tabliet v bielych HDPE fľašiach s
polypropylénovým viečkom bezpečným pre deti.
30, 90, multibalenie po 90 (3 balenia po 30) filmom obalených tabliet v čírych/priehľadných hliníkových PVC/PE/PVDC blistroch.
30 x 1, 90 x 1, multibalenie po 90 x 1 (3 balenia po 30 x 1) filmom obalená tableta
v čírych/priehľadných hliníkových PVC/PE/PVDC perforovaných blistroch s jednotlivými dávkami.
Pazopanib Gedeon Richter 400 mg filmom obalené tablety:
|
|
30, 60 filmom obalených tabliet v HDPE fľašiach s polypropylénovým viečkom bezpečným pre deti.
|
30, 60, multibalenie po 60 (2 balenia po 30) filmom obalených tabliet v čírych/priehľadných
|
|
hliníkových PVC/PE/PVDC blistroch.
|
|
30 x 1, 60 x 1, multibalenie po 60 x 1 (2 balenia po 30 x 1) filmom obalená tableta
|
|
v čírych/priehľadných hliníkových PVC/PE/PVDC perforovaných blistroch s jednotlivými dávkami.
|
| | | | |
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIGedeon Richter Plc.
Gyömrői út 19-21
H-1103 Budapešť
Maďarsko
8. REGISTRAČNÉ ČÍSLO
Pazopanib Gedeon Richter 200 mg filmom obalené tablety: 44/0060/22-S
PazopanibGedeonRichter 400 mg filmom obalené tablety: 44/0061/22-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU
04/2022