
dnota Ca kor v sére pre dialýzou ≥ 8,3 mg/dl (2,08 mmol/l).
Ďalšie odporúčania týkajúce sa manažmentu nízkych hladín vápnika sú uvedené v tabuľke nižšie. Parsabiv sa môže používať ako súčasť terapeutických režimov, ktoré zahŕňajú príslušnú liečbu
viazačmi fosfátov a/alebo sterolmi vitamínu D (pozri časť 5.1).
Vynechané dávky
Ak sa vynechá pravidelne plánovaná hemodialyzačná liečba, vynechané dávky nepodajte. Parsabiv sa má podať pri ďalšej hemodialyzačnej liečbe v rovnakej dávke. Ak sú dávky vynechané po dobu viac ako 2 týždne, potom sa má Parsabiv podať v dávke 5 mg (alebo 2,5 mg, ak bola taká posledná dávka pacienta) a titrovať, aby sa dosiahla požadovaná hodnota PTH.
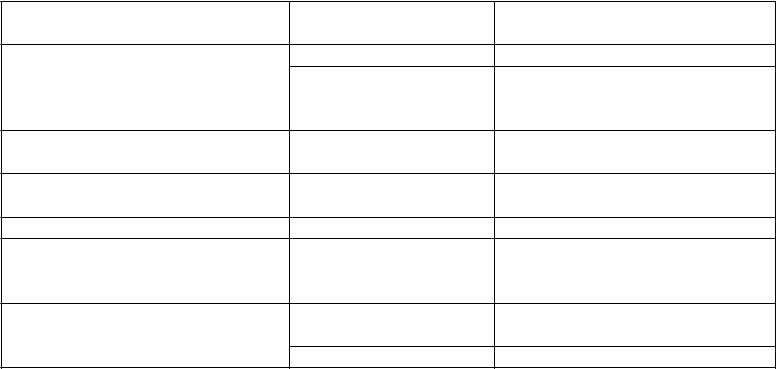
Úpravy dávky na základe hladín sérového vápnika
Sérový vápnik sa má merať počas 1 týždňa po zahájení liečby alebo úprave dávky Parsabivu. Po stanovení udržiavacej fázy pacienta sa má hladina korigovaného sérového vápnika merať každé 4 týždne. V štúdiách sa celkový sérový vápnik meral s použitím modulárnych analyzátorov Roche. Dolná hranica normálnych hodnôt pre korigovaný sérový vápnik bola 8,3 mg/dl (2,08 mmol/l). Iné laboratórne testy môžu mať pre dolnú hranicu normálnych hodnôt odlišné hraničné hodnoty.
V prípade, že sa vyskytnú klinicky významné poklesy hladín korigovaného sérového vápnika pod dolnú hranicu normálnych hodnôt a/alebo príznaky hypokalciémie, odporúča sa nasledujúci manažment:
 Hodnota korigovaného
sérového vápnika alebo klinické príznaky hypokalciémie*:
Hodnota korigovaného
sérového vápnika alebo klinické príznaky hypokalciémie*:
< 8,3 mg/dl (2,08 mmol/l) a
≥ 7,5 mg/dl (1,88 mmol/l)
Odporúčania· Ak je to klinicky indikované:
- začnite podávať doplnky vápnika, viazače fosfátov obsahujúce vápnik a/alebo steroly vitamínu D alebo zvýšte ich dávky.
- zvýšte koncentráciu vápnika v dialyzáte.
- zvážte zníženie dávky Parsabivu.
Hodnota korigovaného
sérového vápnika alebo klinické príznaky hypokalciémie*:
< 7,5 mg/dl (1,88 mmol/l) alebo príznaky hypokalciémie
Odporúčania
· Prerušte liečbu Parsabivom, kým hodnoty hladiny korigovaného sérového vápnika nie sú ≥ 8,3 mg/dl
(2,08 mmol/l) a kým neustúpia príznaky hypokalciémie (ak sú prítomné).
· Ak je to klinicky indikované:
- začnite podávať doplnky vápnika, viazače fosfátov obsahujúce vápnik a/alebo steroly vitamínu D alebo
zvýšte ich dávky.
- zvýšte koncentráciu vápnika v dialyzáte.
· Obnovte liečbu Parsabivom v dávke o 5 mg nižšej ako posledná podaná dávka. Ak posledná dávka podaná pacientovi bola 2,5 mg alebo 5 mg, obnovte podávanie s dávkou 2,5 mg potom, keď už hladiny korigovaného sérového vápnika sú ≥ 8,3 mg/dl (2,08 mmol/l) a príznaky hypokalciémie (ak sú prítomné) ustúpili.

* Celkový vápnik bol meraný modulárnym analyzátorom Roche. Pri hladinách albumínu < 4,0 g/dl Ca kor
(mg/dl) = celkový Ca (mg/dl) + (4 - albumín[g/dl])*0,8.
Prechod z cinakalcetu na ParsabivParsabiv sa nemá začať podávať pacientom v priebehu 7 dní po podaní poslednej dávky cinakalcetu a
kým hodnoty korigovaného sérového vápnika nie sú na dolnej hranici normálnych hodnôt alebo nad
ňou (pozri časť 5.1).
Pediatrická populáciaBezpečnosť a účinnosť etelkalcetidu u detí a dospievajúcich mladších ako 18 rokov neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Starší pacientiOdporúčané dávkovanie pre starších pacientov je rovnaké ako dávkovanie pre dospelých pacientov.
Spôsob podávaniaParsabiv sa nemá riediť.
Parenterálne lieky sa pred podávaním musia vizuálne skontrolovať, či neobsahujú častice alebo či nedošlo k zmene sfarbenia.
Parsabiv je podávaný do venózneho ramena dialyzačného okruhu na konci hemodialyzačnej liečby počas spätného preplachovania alebo intravenózne po spätnom preplachovaní. Keď sa podáva počas spätného preplachovania, najmenej 150 ml objemu spätného preplachovania sa má podať po injekcii. Keď je spätné preplachovanie dokončené a Parsabiv nebol podaný, môže sa podať intravenózne s nasledujúcou rýchlou aplikáciou fyziologického roztoku s objemom najmenej 10 ml.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Parsabiv sa nemá začať podávať, ak je korigovaný sérový vápnik nižší ako dolná hranica normálnych hodnôt (pozri časti 4.2 a 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
Hypokalciémia
Liečba Parsabivom sa nemá začať podávať pacientom, ak je korigovaný sérový vápnik nižší ako dolná
hranica normálnych hodnôt (pozri časť 4.3).
Medzi možné prejavy hypokalciémie patria parestézie, myalgie, svalové spazmy a záchvaty.
Keďže etelkalcetid znižuje sérový vápnik, pacientov treba poučiť, aby vyhľadali lekársku pomoc, ak sa u nich vyskytnú príznaky hypokalciémie, a majú sa sledovať, či sa u nich nevyskytne
hypokalciémia (pozri časť 4.2). Hladiny sérového vápnika sa majú merať pred začatím liečby, počas 1 týždňa od začatia liečby alebo úpravy dávky Parsabivu a každé 4 týždne počas liečby. Ak nastanú klinicky významné poklesy hladín korigovaného sérového vápnika, majú sa prijať opatrenia na zvýšenie hladín sérového vápnika (pozri časť 4.2).
Komorová arytmia a predĺženie intervalu QT sekundárne pri hypokalciémii
Pokles sérového vápnika môže predĺžiť interval QT, čo môže viesť ku komorovej arytmii (pozri časť
4.8). Hladiny sérového vápnika sa majú pozorne sledovať u pacientov s vrodeným syndrómom dlhého intervalu QT, s predchádzajúcim predĺžením intervalu QT v anamnéze, so syndrómom dlhého intervalu QT alebo náhlej srdcovej smrti v rodinnej anamnéze a s inými ochoreniami, ktoré počas liečby Parsabivom predisponujú na predĺženie intervalu QT a komorovú arytmiu.
Kŕče
Prah pre vznik záchvatových kŕčov možno znížiť významnou redukciou hladín sérového vápnika. Hladiny sérového vápnika sa počas liečby Parsabivom majú pozorne sledovať u pacientov so záchvatovým ochorením v anamnéze.
Zhoršenie srdcového zlyhania
Zhoršená funkcia myokardu, hypotenzia a kongestívne zlyhanie srdca (congestive heart failure, CHF)
môžu súvisieť s významným znížením hladín sérového vápnika. Hladiny sérového vápnika sa počas liečby Parsabivom majú sledovať u pacientov s kongestívnym zlyhaním srdca v anamnéze (pozri časť
4.2), ktoré môže súvisieť so znížením hladín sérového vápnika.
Súbežné podávanie s inými liekmi
Parsabiv podávajte s opatrnosťou pacientom užívajúcim iné lieky, o ktorých je známe, že znižujú
sérový vápnik. Pozorne sledujte sérový vápnik (pozri časť 4.5).
Pacientom liečeným Parsabivom sa nemá podávať cinakalcet. Súbežné podávanie môže viesť k závažnej hypokalciémii.
Adynamické ochorenie kostí
Adynamické ochorenie kostí sa môže rozvinúť vtedy, ak hladiny PTH sú dlhodobo nižšie ako
100 pg/ml. Ak sa hodnoty PTH znížia pod odporučený cieľový interval, dávka sterolov vitamínu D a/alebo Parsabivu sa má znížiť alebo sa má liečba prerušiť. Po prerušení sa liečba môže obnoviť s nižšou dávkou, aby sa PTH udržal v cieľovom intervale (pozri časť 4.2).
Imunogenicita
V klinických štúdiách bol u 7,1 % pacientov s SHPT liečených Parsabivom po dobu až 6 mesiacov
výsledok testu pozitívny na viažuce protilátky. Z nich 80,3 % malo protilátky existujúce už pred podaním lieku. S preexistujúcimi alebo vyvíjajúcimi sa protilátkami proti etelkalcetidu sa nespájal
žiadny dôkaz o zmenenom farmakokinetickom profile, zmenenej klinickej odpovedi alebo zmenenom profile bezpečnosti. Ak je podozrenie na tvorbu protilátok proti etelkalcetidu s klinicky významným účinkom, obráťte sa na držiteľa rozhodnutia o registrácii ohľadne vyšetrenia protilátok. Kontaktné údaje sú uvedené v časti 6 písomnej informácie pre používateľa.
Pomocná látka so známym účinkom
Parsabiv obsahuje menej ako 1 mmol sodíka v injekčnej liekovke, t.j. v podstate zanedbateľné
množstvo sodíka.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie. Riziko farmakokinetickej interakcie s etelkalcetidom nie je známe.
Etelkalcetid in vitro neinhibuje ani neindukuje enzýmy CYP450 a sám nebol substrátom pre metabolizmus sprostredkovaný enzýmami CYP450. Etelkalcetid in vitro nebol substrátom efluxných a vychytávacích transportných proteínov; a etelkalcetid nebol inhibítorom bežných transportných proteínov.
Súbežné podávanie iných liekov znižujúcich sérový vápnik a Parsabivu môže viesť k zvýšenému riziku hypokalciémie (pozri časť 4.4). Pacientom liečeným Parsabivom sa cinakalcet nemá podávať (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii údaje alebo je iba obmedzené množstvo údajov o používaní etelkalcetidu u
gravidných žien. Štúdie na zvieratách nepreukázali priame ani nepriame škodlivé účinky z hľadiska reprodukčnej toxicity (pozri časť 5.3). Ako preventívne opatrenie je vhodnejšie vyhnúť sa počas gravidity používaniu Parsabivu.
Dojčenie
Nie je známe, či je etelkalcetid prítomný v materskom mlieku. Dostupné údaje s potkanmi preukázali,
že etelkalcetid sa vylučuje do mlieka (pozri časť 5.3).
Riziko pre novorodencov/dojčatá nemožno vylúčiť. Rozhodnutie o tom, či ukončiť dojčenie alebo či ukončiť liečbu/zdržať sa liečby Parsabivom, sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre matku.
Fertilita
Nie sú dostupné žiadne údaje o vplyve etelkalcetidu na fertilitu u ľudí. Štúdie na zvieratách
nepreukázali priame ani nepriame škodlivé účinky na fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Parsabiv nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Niektoré potenciálne prejavy hypokalciémie však môžu ovplyvniť schopnosť viesť vozidlá
a obsluhovať stroje (pozri časť 4.4).
4.8 Nežiaduce účinky
Súhrn profilu bezpečnosti
Veľmi časté vedľajšie účinky v súvislosti s Parsabivom sú znížená hladina vápnika v krvi, svalové
kŕče, diarea, nauzea a vracanie. U väčšiny pacientov boli mierne až stredne závažné a prechodné. Prerušenie liečby v dôsledku nežiaducich účinkov bolo predovšetkým pre nízku hladinu vápnika v krvi, nauzeu a vracanie.
Súhrn nežiaducich reakcií zoradených do tabuľky
Nežiaduce reakcie sú uvedené nižšie s použitím nasledujúcej konvencie: veľmi časté (≥ 1/10); časté
(≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000).
Tabuľka 1 Výskyt nežiaducich reakcií z kontrolovaných klinických štúdií
Trieda orgánových systémov
(TOS) MedDRA
Trieda frekvencie Nežiaduce reakcie
Poruchy metabolizmu a výživy Veľmi časté Znížená hladina vápnika v krvi1, 4
Časté Hypokalciémia1, 5
Hyperkaliémia2
Hypofosfatémia
Poruchy nervového systému Časté Bolesť hlavy
Parestézia3
Poruchy srdca a srdcovej činnosti Časté Zhoršenie srdcového zlyhania1
Predĺženie intervalu QT1
Poruchy ciev Časté Hypotenzia
Poruchy gastrointestinálneho traktu Veľmi časté Nauzea Vracanie Diarea
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Veľmi časté Svalové spazmy
Časté Myalgia
1 Pozri časť Opis vybraných nežiaducich reakcií.
2 Hyperkaliémia zahŕňa uprednostňované termíny hyperkaliémia a zvýšená hladina draslíka v krvi.
3 Parestézia zahŕňa uprednostňované termíny parestézia a hypestézia.
4 Asymptomatické zníženie vápnika pod 7,5 mg/dl (1,88 mmol/l) alebo klinicky signifikantné asymptomatické zníženie sérového Ca kor v rozpätí 7,5 a < 8,3 mg/dl (1,88 a < 2,08 mmol/l) (ktoré vyžadovalo lekársku starostlivosť).
5 Symptomatické zníženie sérového Ca kor < 8,3 mg/dl (2,08 mmol/l).
Opis vybraných nežiaducich reakciíHypokalciémiaVäčšina udalostí asymptomatického zníženia hladiny vápnika v krvi a symptomatickej hypokalciémie bola mierna alebo stredne závažná. V štúdiách s kombinovanou liečbou kontrolovaných placebom sa vo vyššom podiele pacientov v skupine s Parsabivom dosiahla najmenej jedna hodnota Ca kor v sére <
7,0 mg/dl (1,75 mmol/l) v porovnaní s pacientmi v skupine s placebom (7,6 % Parsabiv; 3,1 % placebo), < 7,5 mg/dl (1,88 mmol/l) (27,1 % Parsabiv; 5,5 % placebo) a < 8,3 mg/dl (2,08 mmol/l) (78,6 % Parsabiv; 19,4 % placebo). V týchto štúdiách 1 % pacientov v skupine s Parsabivom a 0 % pacientov v skupine s placebom prerušilo liečbu v dôsledku nežiaducej udalosti nízkeho sérového vápnika. Ďalšie informácie o potenciálnych prejavoch hypokalciémie nájdete v časti 4.4
a o monitorovaní sérového vápnika v časti 4.2.
Predĺženie intervalu QTc sekundárne pri hypokalciémii
V štúdiách s kombinovanou liečbou kontrolovaných placebom mal vyšší percentuálny podiel pacientov v skupine s Parsabivom maximálny nárast intervalu QTcF > 60 ms oproti východiskovej hodnote v porovnaní so skupinou s placebom (1,2 % Parsabiv; 0 % placebo). Výskyt maximálneho QTcF u pacientov po začatí liečby pred dialýzou > 500 ms bol v skupine s Parsabivom 4,8 % a v skupine s placebom 1,9 %.
Zhoršenie zlyhania srdcaV štúdiách s kombinovanou liečbou kontrolovaných placebom bol výskyt potvrdených udalostí CHF vyžadujúcich hospitalizáciu 2,2 % v liečebnej skupine s Parsabivom v porovnaní s 1,2 % v skupine s placebom.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 PredávkovaniePredávkovanie etelkalcetidom môže viesť k hypokalciémii s klinickými príznakmi alebo bez nich
a môže vyžadovať liečbu. V prípade predávkovania sa má skontrolovať sérový vápnik, pacienti majú byť monitorovaní na symptómy hypokalciémie (pozri časť 4.4) a treba prijať príslušné opatrenia (pozri časť 4.2). Hoci sa Parsabiv odstraňuje dialýzou, hemodialýza ako liečba na predávkovanie sa neskúmala. Jednorazové dávky do 60 mg a viacnásobné dávky do 22,5 mg 3-krát týždenne na konci dialýzy u pacientov liečených hemodialýzou boli v klinických skúšaniach bezpečne podávané.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Homeostatiká vápnika, antiparatyreoidné liečivá. ATC kód: H05BX04
Mechanizmus účinkuReceptor citlivý na vápnik na povrchu hlavnej bunky prištítnej žľazy je hlavným regulátorom sekrécie
PTH. Etelkalcetid je syntetická peptidová kalcimimetická látka, ktorá znižuje sekréciu PTH prostredníctvom viazania a aktivácie receptora citlivého na vápnik. Zníženie hladiny PTH je spojené so súčasným znížením hladín vápnika a fosfátov v sére.
Farmakodynamické účinkyPo podaní jednej intravenóznej bolusovej dávky 5 mg etelkalcetidu sa hladiny PTH rýchlo znížili do
30 minút po podaní dávky, ostali maximálne znížené po dobu 1 hodiny a potom sa vrátili na východiskové hodnoty. Rozsah a trvanie zníženia hladín PTH sa zvyšovali so zvyšujúcou sa dávkou. Zníženie hladín PTH korelovalo s koncentráciami etelkalcetidu v plazme u hemodialyzovaných pacientov. Účinok zníženia hladín PTH sa udržal po celé 6-mesačné obdobie aplikácie lieku, keď bol etelkalcetid podávaný intravenóznym bolusom 3-krát týždenne.
Klinická účinnosť a bezpečnosť
Placebom kontrolované štúdie
Uskutočnili sa dve 6-mesačné, dvojito zaslepené, placebom kontrolované klinické štúdie s pacientmi s SHPT a s CKD, ktorí dostávali hemodialýzu 3-krát týždenne (n = 1 023). Pacientom bol podávaný Parsabiv alebo placebo v začiatočnej dávke 5 mg 3-krát týždenne na konci hemodialýzy a s cieľom dosiahnuť cieľovú hladinu PTH ≤ 300 pg/ml bol titrovaný každé 4 týždne až do 17. týždňa na maximálnu dávku 15 mg 3-krát týždenne. Medián priemernej týždennej dávky Parsabivu počas obdobia hodnotenia účinnosti (OHÚ) bol 20,4 mg (6,8 mg na jedno podanie). Pacienti s nižšími hladinami PTH pri skríningu zvyčajne vyžadovali nižšie dávky (medián priemernej týždennej dávky
15,0 mg pre pacientov s hladinami PTH pri skríningu < 600 pg/ml, 21,4 mg s hladinami PTH pri skríningu 600 až ≤ 1 000 pg/ml a 27,1 mg s hladinami PTH pri skríningu > 1 000 pg/ml). Pacienti boli udržiavaní na koncentrácii vápnika v dialyzáte ≥ 2,25 mEq/l.
Primárnym koncovým ukazovateľom v každej štúdii bol podiel pacientov s > 30 % znížením hladín PTH v porovnaní s východiskovými hodnotami počas OHÚ (OHÚ definované ako 20. až 27. týždeň vrátane). Sekundárnymi koncovými ukazovateľmi boli podiel pacientov s priemernou hladinou PTH
≤ 300 pg/ml počas OHÚ, a percentuálna zmena pri PTH, Ca kor a fosfátoch v sére a pri súčine vápnika a fosforu (Ca x P) počas OHÚ oproti východiskovej hodnote.
Demografické a základné charakteristiky v oboch skupinách v každej štúdii boli podobné. Priemerný vek pacientov v 2 štúdiách bol 58,2 (rozpätie 21 až 93) rokov. Priemerné (SE, štandardná odchýlka) východiskové koncentrácie PTH v 2 štúdiách boli 846,9 (21,8) pg/ml pre skupinu s Parsabivom a
835,9 (21,0) pg/ml pre skupinu s placebom, pričom približne 21 % účastníkov zaradených v oboch štúdiách malo východiskové hladiny PTH > 1 000 pg/ml. Priemerné trvanie hemodialýzy pred vstupom do štúdie bolo 5,4 roka a 68 % pacientov užívalo pri vstupe do štúdie steroly vitamínu D, pričom 83 % užívalo viazače fosfátu.
Obe štúdie preukázali, že Parsabiv znížil hladiny PTH a súčasne znížil aj hladiny vápnika, fosfátu a súčin Ca x P. Výsledky všetkých primárnych a sekundárnych koncových ukazovateľov boli štatisticky signifikantné a výsledky boli v oboch štúdiách zhodné, ako sa uvádza v tabuľke 2.
Tabuľka 2 Účinky Parsabivu na PTH, korigovaný sérový vápnik, fosfát a Ca x P v 6-mesačných placebom kontrolovaných štúdiách
Štúdia 1 Štúdia 2
PTH
Pacienti s > 30 % znížením PTH počas OHÚ,
Parsabiv
(N = 254)
Placebo
(N = 254)
Parsabiv
(N = 255)
Placebo
(N = 260)
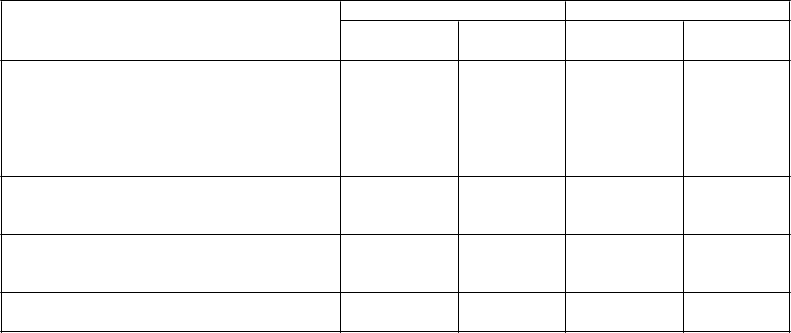
n (%) 188 (74,0)a 21 (8,3) 192 (75,3)a 25 (9,6)
Pacienti s ≤ 300 pg/ml PTH počas OHÚ, n (%) 126 (49,6)a 13 (5,1) 136 (53,3)a 12 (4,6)
Priemerná percentuálna zmena počas OHÚ, %
(SE) −55,11 (1,94)a 13,00 (2,81) −57,39 (1,91)a 13,72 (2,50)
Korigovaný sérový vápnikPriemerná percentuálna zmena počas OHÚ, %
(SE) −7,29 (0,53)a 1,18 (0,29) −6,69 (0,55)a 0,58 (0,29)
FosfátPriemerná percentuálna zmena počas OHÚ, %
(SE) −7,71 (2,16)b −1,31 (1,42) −9,63 (1,61)a −1,60 (1,42)
Ca x PPriemerná percentuálna zmena OHÚ, % (SE) −14,34 (2,06)a −0,19 (1,44) −15,84 (1,57)a −1,06 (1,42)
a p < 0,001 verzus placebo
b p = 0,003 verzus placebo
Parsabiv znížil hladiny PTH bez ohľadu na východiskový PTH, trvanie dialýzy a to, či pacienti užívali steroly vitamínu D, alebo nie. Bolo pravdepodobnejšie, že pacienti s nižšími hladinami PTH pri skríningu dosiahnu počas OHÚ PTH ≤ 300 pg/ml.
Parsabiv sa spájal so znížením markerov kostného metabolizmu (kostná špecifická alkalická fosfatáza a c-telopeptid kolagénu typu I) a fibroblastového rastového faktora 23 (výskumné koncové ukazovatele) na konci štúdie (27. týždeň) v porovnaní s placebom.
Aktívnym liekom kontrolovaná štúdia
6-mesačná, dvojito zaslepená, aktívnym liekom kontrolovaná štúdia porovnávala účinnosť a bezpečnosť Parsabivu s cinakalcetom u 683 pacientov s SHPT a s CKD na hemodialýze. Režim dávkovania Parsabivu bol podobný režimu dávkovania v štúdiách kontrolovaných placebom (začiatočná dávka 5 mg titrovaná každé 4 týždne s 2,5 mg až 5 mg prírastkami na maximálnu dávku
15 mg 3-krát týždenne). Začiatočná dávka cinakalcetu bola 30 mg denne, titrovaná každé 4 týždne s 30 mg prírastkami alebo 60 mg pri poslednej titrácii smerom nahor na maximálnu dávku 180 mg denne podľa súhrnu charakteristických vlastností pre cinakalcet. Medián priemernej týždennej dávky Parsabivu počas OHÚ bol 15,0 mg (5,0 mg na jedno podanie) a cinakalcetu 360,0 mg (51,4 mg na jedno podanie). Primárnym koncovým ukazovateľom bola noninferiorita pri podiele pacientov, ktorí dosiahli > 30 % zníženie priemernej hodnoty PTH počas OHÚ oproti východiskovej hodnote (20. až'
27. týždeň). Hlavné sekundárne koncové ukazovatele boli podiel pacientov, ktorí dosiahli > 50 % a
> 30 % zníženie priemerného PTH oproti východiskovej hodnote počas OHÚ, a priemerný počet dní s vracaním alebo nauzeou za týždeň v prvých 8 týždňoch, následne overované na superioritu. Priemerné (SE) východiskové koncentrácie PTH boli 1 092,12 (33,8) v skupine s Parsabivom a
1 138,71 (38,2) pg/ml v skupine s cinakalcetom. Demografické a iné základné charakteristiky boli podobné ako v placebom kontrolovaných štúdiách.
Parsabiv bol noninferiórny oproti cinakalcetu pri primárnom koncovom ukazovateli a bol superiórny oproti cinakalcetu pri sekundárnych koncových ukazovateľoch podiel pacientov dosahujúcich > 30 % zníženie priemerného PTH počas OHÚ v porovnaní s východiskovými hodnotami (68,2 % Parsabiv verzus 57,7 % cinakalcet; p = 0,004) a podiel pacientov dosahujúcich > 50 % zníženie priemerného PTH počas OHÚ v porovnaní s východiskovými hodnotami (52,4 % Parsabiv verzus 40,2 % cinakalcet; p = 0,001). V týchto dvoch skupinách nebol pri sekundárnom koncovom ukazovateli hodnotiacom priemerný počet dní s vracaním alebo nauzeou za týždeň v prvých 8 týždňoch pozorovaný žiadny štatisticky významný rozdiel.
„Switch“ štúdia
Výsledky zo štúdie, ktorá vyhodnocovala zmeny v hladinách korigovaného sérového vápnika pri prechode pacientov z cinakalcetu na Parsabiv, preukázali, že liečba Parsabivom v začiatočnej dávke
5 mg by sa po 7-dňovom prerušení podávania cinakalcetu mohla bezpečne začať za predpokladu, že korigovaný sérový vápnik je ≥ 8,3 mg/dl (2,08 mmol/l).
Otvorené predĺženie štúdie
K placebom kontrolovaným štúdiám a „switch“ štúdii uvedeným vyššie sa uskutočnila 52-týždňová predĺžená štúdia s jedným ramenom s cieľom charakterizovať dlhodobú bezpečnosť a účinnosť Parsabivu u 891 pacientov s SHPT a s CKD na hemodialýze. Všetci účastníci dostávali Parsabiv
v začiatočnej dávke 5 mg 3-krát týždenne. Dávka Parsabivu mohla byť titrovaná 5., 9., 17., 25., 33.,
41. a 49. týždeň na maximálnu dávku 15 mg, aby sa dosiahli cieľové hladiny PTH ≤ 300 pg/ml pri zachovaní sérových koncentrácií Ca kor.
Na konci 52. týždňa sa Parsabiv nespájal so žiadnymi novými zisteniami z hľadiska bezpečnosti a preukázal udržanie liečebného účinku, o čom svedčí zníženie hodnôt PTH pred dialýzou o > 30 %
v porovnaní s východiskovými hodnotami u 2/3 pacientov. Okrem toho Parsabiv znížil hodnoty PTH pred dialýzou na ≤ 300 pg/ml u viac ako 50 % pacientov a znížil priemerné hodnoty PTH, Ca kor, Ca kor x P a fosfátu v porovnaní s východiskovými hodnotami.
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Parsabivom v
jednej alebo viacerých podskupinách pediatrickej populácie v liečbe hyperparatyreózy (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Distribúcia
V populačnom farmakokinetickom modeli bol distribučný objem v rovnovážnom stave približne 796 l.
Etelkalcetid sa prevažne viaže na plazmatický albumín reverzibilnou kovalentnou väzbou. Nekovalentné viazanie etelkalcetidu na plazmatické proteíny je nízke, s podielom voľnej frakcie 0,53. Pomer koncentrácií [14C]-etelkalcetidu v krvi a plazme je približne 0,6.
Biotransformácia
Etelkalcetid sa nemetabolizuje prostredníctvom enzýmov CYP450. Etelkalcetid sa biotransformuje v
krvi prostredníctvom reverzibilnej výmeny disulfidov s endogénnymi tiolmi, aby prevažne vytvoril konjugát so sérovým albumínom. Plazmatická expozícia produktov biotransformácie bola približne 5- násobne vyššia ako plazmatická expozícia etelkalcetidu a ich časový priebeh koncentrácie je podobný ako pri etelkalcetide. Hlavný produkt biotransformácie (viazaný na albumín) bol in vitro minimálne aktívny.
Eliminácia
Intravenózne podávanie 3-krát týždenne na konci hemodialýzy viedlo k účinnému polčasu 3 až 5 dní.
Etelkalcetid sa rýchlo vylučuje u pacientov s normálnou funkciou obličiek, zatiaľ čo u pacientov s CKD vyžadujúcich hemodialýzu sa vylučoval prevažne hemodialýzou. Etelkalcetid bol účinne odstránený s hodnotou hemodialyzačného klírensu 7,66 l/hodinu. Po jednorazovej rádioaktívne značenej dávke etelkalcetidu u pacientov s CKD so sekundárnou HPT liečených hemodialýzou sa približne 60 % podaného [14C]-etelkalcetidu objavilo v dialyzáte a približne 7 % sa vylúčilo močom a stolicou, čo sú úhrnné hodnoty za 175 dní odberového obdobia. Interindividuálna variabilita systémového klírensu v populácii pacientov je približne 70 %.
Linearita/nelinearita
Farmakokinetika etelkalcetidu je lineárna a nemení sa časom po jednorazovej (5 až 60 mg) a
viacnásobných intravenóznych dávkach (2,5 až 20 mg) u pacientov s CKD so sekundárnou HPT liečených hemodialýzou. Po intravenóznom podávaní dávky 3-krát týždenne na konci každej 3- až 4- hodinovej hemodialýzy u pacientov s CKD dosiahli plazmatické hladiny etelkalcetidu takmer rovnovážny stav 4 týždne po podávaní dávok s pozorovaným 2- až 3-násobným pomerom akumulácie.
Porucha funkcie obličiek
U pacientov s miernou až závažnou poruchou funkcie obličiek sa neuskutočnili žiadne špecifické
farmakokinetické štúdie s etelkalcetidom. Farmakokinetika etelkalcetidu bola popísaná u pacientov s
CKD liečených hemodialýzou. Etelkalcetid je určený pre pacientov s CKD liečených hemodialýzou.
Porucha funkcie pečene
U pacientov s poruchou funkcie pečene sa neuskutočnila žiadna špecifická štúdia.
Telesná hmotnosť, pohlavie, vek, rasa
U skúmaných dospelých pacientov neboli pozorované žiadne farmakokinetické rozdiely súvisiace s
telesnou hmotnosťou, pohlavím, vekom alebo rasou.
5.3 Predklinické údaje o bezpečnosti
Očakávaný farmakologický účinok znížených hodnôt PTH a vápnika v krvi bol pozorovaný v štúdiách na zvieratách vystavených klinickým koncentráciám. Pri vystavení klinickým koncentráciám bolo pozorované zníženie sérového vápnika spojené s trasením, kŕčmi a zisteniami súvisiacimi so stresom. Všetky účinky boli po ukončení liečby reverzibilné.
Etelkalcetid bol pre niektoré kmene baktérií mutagénny (Amesov test), nebol však genotoxický v in vitro a in vivo testoch genotoxicity cicavcov, a preto sa považuje za negenotoxický pre ľudí.
V štúdiách zameraných na karcinogenicitu myší a potkanov sa nevyskytli žiadne tumory súvisiace s etelkalcetidom do vystavenia 0,4-násobku klinických koncentrácií.
Po podaní etelkalcetidu potkanom pri hladinách expozície až 1,8-násobne vyšších ako hladiny klinickej expozície dosiahnutej u pacientov, ktorí dostávajú etelkalcetid v dávke 15 mg trikrát týždenne, sa nezistil žiadny účinok na fertilitu samčekov ani samičiek.
Po vystavení do 1,8- až 4,3-násobku hladín klinickej expozície počas organogenézy sa nezistili žiadne účinky na embryonálno-fetálny vývoj potkanov a králikov. V štúdii zameranej na prenatálny a postnatálny vývoj potkanov sa zistil minimálny nárast perinatálnej mortality mláďat, oneskorenie pôrodu a prechodné spomalenie postnatálneho rastu súvisiace s toxicitami u matky, ako je hypokalciémia, trasenie a zníženie telesnej hmotnosti a príjmu potravy pri 1,8-násobku hladín
klinickej expozície.
Štúdie s potkanmi preukázali, že [14C]-etelkalcetid sa vylučuje do mlieka v koncentráciách podobných plazmatickým.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
chlorid sodný kyselina jantarová voda na injekciu
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky.
Po vybratí z chladničky:
· Ak je Parsabiv uchovávaný v pôvodnom obale, je stabilný maximálne 7 kumulatívnych dní.
Z hľadiska teploty nie sú potrebné žiadne zvláštne požiadavky na uchovávanie.
· Po vybratí z pôvodného obalu je Parsabiv stabilný maximálne 4 hodiny, ak je chránený pred priamym slnečným svetlom.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C).
Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
Parsabiv 2,5 mg injekčný roztok
Jednorazová injekčná liekovka (sklo typu I) so zátkou (elastomerickou potiahnutou fluoropolymérom)
a hliníkovým tesnením s vyklápacím krytom proti prachu. Každá injekčná liekovka obsahuje 0,5 ml injekčného roztoku.
Parsabiv 5 mg injekčný roztok
Jednorazová injekčná liekovka (sklo typu I) so zátkou (elastomerickou potiahnutou fluoropolymérom)
a hliníkovým tesnením s vyklápacím krytom proti prachu. Každá injekčná liekovka obsahuje 1 ml injekčného roztoku.
Parsabiv 10 mg injekčný roztok
Jednorazová injekčná liekovka (sklo typu I) so zátkou (elastomerickou potiahnutou fluoropolymérom)
a hliníkovým tesnením s vyklápacím krytom proti prachu. Každá injekčná liekovka obsahuje 2 ml injekčného roztoku.
Veľkosť balenia 1, 6, 12 a 42 injekčných liekoviek. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Iba na jednorazové použitie.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Amgen Europe B.V. Minervum 7061
NL-4817 ZK Breda
Holandsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
Parsabiv 2,5 mg injekčný roztok EU/1/16/1142/001 - 1 injekčná liekovka EU/1/16/1142/002 - 6 injekčných liekoviek EU/1/16/1142/003 - 12 injekčných liekoviek EU/1/16/1142/004 - 42 injekčných liekoviek Parsabiv 5 mg injekčný roztok EU/1/16/1142/005 - 1 injekčná liekovka EU/1/16/1142/006 - 6 injekčných liekoviek EU/1/16/1142/007 - 12 injekčných liekoviek EU/1/16/1142/008 - 42 injekčných liekoviek Parsabiv 10 mg injekčný roztok EU/1/16/1142/009 - 1 injekčná liekovka EU/1/16/1142/010 - 6 injekčných liekoviek EU/1/16/1142/011 - 12 injekčných liekoviek EU/1/16/1142/012 - 42 injekčných liekoviek
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU