
za potrebnú žiadna úprava dávky.
Pediatrická populácia
Bezpečnosť a účinnosť tohto lieku u detí a dospievajúcich mladších ako 18 rokov nebola stanovená. K
dispozícii nie sú žiadne údaje.
Spôsob podávania
Len na podanie od oka.
Opatrenia pred podaním lieku
Pacienti musia byť poučení, aby si pred použitím umyli ruky.
OXERVATE sa musí podávať iba pomocou priloženého aplikačného systému (nástavca na injekčnú liekovku a pipiet), podľa pokynov uvedených v časti 6.6.
Na každé podanie sa musí použiť samostatná pipeta.
Ak sa používa viac ako jeden topický oftalmologický liek, očná instilácia sa musí podávať s rozdielom aspoň 15 minút, aby sa zabránilo rozriedeniu druhého lieku. Ak sa používa očná masť, gél alebo iná viskózna očná instilácia, musia sa podávať 15 minút po podaní lieku OXERVATE (pozri aj časť 4.5).
V prípade súbežného používania s kontaktnými šošovkami pozri časť 4.4.
Pokyny na prípravu a zaobchádzanie s liekom pred podaním sú uvedené v časti 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Riziko keratolýzy alebo hroziacej perforácie rohovky
Pred začiatkom liečby liekom OXERVATE je dôležité stanoviť riziko keratolýzy alebo hroziacej
perforácie a potrebu podstúpenia akútnej operácie alebo iného zákroku, keďže cenegermín sa nesmie používať u pacientov vyžadujúcich okamžitú operáciu.
Očné reakcie
OXERVATE môže pacientovi spôsobiť mierny až stredne silný očný diskomfort, ako napríklad bolesť
oka. Pacient musí byť poučený, aby sa v prípade obáv alebo závažnejších reakcií oka obrátil na lekára.
Použitie kortikosteroidov alebo očnej instilácie obsahujúcej konzervačné látky
Počas liečby neurotrofickej keratitídy je potrebné vyhnúť sa použitiu látok pôsobiacich lokálne
v očiach, o ktorých je známe, že inhibujú hojenie epitelu. K týmto látkam patria aj kortikosteroidy alebo očné instilácie s konzervačnými látkami, ako napríklad benzalkóniumchlorid, polyquaternium-1, benzododecíniumbromid, cetrimid a iné kvartérne amóniové zlúčeniny, pretože by mohli narúšať hojenie rohovky (pozri časť 4.5).
Očné infekcie
Infekcia oka sa musí liečiť pred použitím lieku OXERVATE. Ak sa vyskytne infekcia oka, podávanie
lieku OXERVATE sa má pozastaviť až do vyliečenia infekcie (pozri časť 4.2).
Rakovina oka
Cenegermín môže teoreticky ovplyvniť rakovinu oka, keďže ide o rastový faktor. U pacientov
s rakovinou oka sa musí OXERVATE používať s opatrnosťou. U týchto pacientov sa odporúča naďalej sledovať progresiu rakoviny v priebehu liečby a po liečbe týmto liekom.
Kontaktné šošovky
Pacienti musia byť poučení, aby si pred aplikáciou lieku OXERVATE vybrali kontaktné šošovky a po
nakvapkaní dávky počkali 15 minút pred ich opätovným vložením, pretože prítomnosť kontaktných šošoviek (terapeutických alebo korekčných) by teoreticky mohla obmedziť distribúciu cenegermínu do oblasti rohovkovej lézie.
4.5 Liekové a iné interakcie
Počas liečby liekom OXERVATE sa môžu použiť iné topické oftalmologické lieky, ak sa použijú
v časových intervaloch (s odstupom) 15 minút, s výnimkou liekov, o ktorých je známe, že inhibujú epiteliálne hojenie (napr. kortikosteroidy alebo očné kvapky s obsahom konzervačným látok ako benzalkóniumchlorid, polyquaternium-1, benzododecíniumbromid, cetrimid a iné kvartérne amóniové zlúčeniny) (pozri časti 4.2 a 4.4). Ak sa používa očná masť, gél, alebo iné viskózne očné instilácie, OXERVATE sa musí podať ako prvý.
Neuskutočnili sa žiadne interakčné štúdie s inými liekmi.
Keďže systémová absorpcia cenegermínu po použití lieku je zanedbateľná alebo nemerateľná, nepredpokladajú sa žiadne liekové interakcie.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú dostupné žiadne údaje o používaní cenegermínu u gravidných žien. Štúdie na zvieratách
s cenegermínom nepreukázali priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej toxicity pri subkutánnom podávaní (pozri časť 5.3).
Systémová expozícia cenegermínu je zanedbateľná, alebo sa nevyskytuje.
Ako preventívne opatrenie sa odporúča vyhnúť sa použitiu lieku OXERVATE počas tehotenstva. Dojčenie
Nie je známe, či sa cenegermín vylučuje do ľudského mlieka.
Riziko pre dojčené dieťa nemožno vylúčiť.
Rozhodnutie, či prestať dojčiť alebo vysadiť/nepoužiť liečbu týmto liekom, sa musí vykonať po zvážení prínosu dojčenia pre dieťa a prínosu terapie pre ženu.
Fertilita
Neexistujú žiadne údaje o vplyve cenegermínu na fertilitu u ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liečba má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje, pretože môže spôsobiť dočasne rozmazané videnie alebo iné poruchy videnia, u ktorých sa predpokladá, že budú trvať niekoľko minút po instilácii. Ak sa po aplikácii kvapiek objaví rozmazané videnie, pacient musí pred vedením motorového vozidla alebo obsluhou stroja počkať, kým sa mu zrak nevyjasní.
4
.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Najčastejšie hlásené nežiaduce reakcie počas klinických štúdií u pacientov s neurotrofickou
keratitídou, ktorí sú liečení liekom OXERVATE, zahŕňajú bolesť oka (11,1 %); zápal oka (8,3 %), ktorý môže zahŕňať zápal prednej komory a hyfému; zvýšené slzenie (5,6 %), s príznakmi ako napríklad očný výtok; bolesť viečok (5,6 %) a pocit cudzieho telesa v oku (5,6 %).
Najčastejšie hlásenou nežiaducou reakciou bola bolesť oka, po ktorej nasledovalo podráždenie oka a abnormálne pocity v oku, ak zoberieme do úvahy celú populáciu liečenú týmto liekom (t.j. populáciu zahrnutú v klinických skúšaniach aj v indikáciách iných ako neurotrofická keratitída).
Tabuľkový súhrn nežiaducich reakcií
V klinických štúdiách boli pozorované nižšie uvedené nežiaduce účinky u pacientov s neurotrofickou
keratitídou, ktorí sú liečení liekom OXERVATE 20 μg/ml.
Nežiaduce účinky sú uvedené nižšie podľa klasifikácie orgánových systémov MedDRA (SOC – triedy orgánových systémov a úrovne preferovaných termínov).
Sú zoradené podľa triedy orgánových systémov a rozdelené podľa nasledovnej konvencie: veľmi časté
(≥1/10), časté (≥1/100 až < 1/10), menej časté (≥1/1000 až < 1/100), zriedkavé (≥1/10 000 až <
1/1000), veľmi zriedkavé (< 1/10 000) alebo neznáme (nie je možné odhadnúť na základe dostupných údajov).
Trieda orgánových
systémov Frekvencia Nežiaduca reakcia
Infekcie a nákazy Menej časté Absces rohovky
Poruchy nervového
systému Časté Bolesť hlavy
Veľmi časté Bolesť oka
Zápal oka, bolesť viečok, pocit cudzieho telesa v oku,
Poruchy oka
Časté
zvýšené slzenie, blefaritída, hyperémia spojoviek, fotofóbia, podráždenie očí
Menej časté Neovaskularizácia rohovky
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNie je pravdepodobné, že sa vyskytne topické predávkovanie, alebo že bude spojené s toxicitou. Topické predávkovanie cenegermínom sa môže z oka(očí) vypláchnuť vlažnou vodou.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: {zatiaľ nepridelená}, ATC kód: {zatiaľ nepridelený}.
Mechanizmus účinku
OXERVATE obsahuje cenegermín, rekombinantnú formu ľudského nervového rastového faktora.
Nervový rastový faktor je endogénny proteín zapojený do diferenciácie a starostlivosti o neuróny, ktorý pôsobí prostredníctvom špecifických receptorov pre nervový rastový faktor s vysokou afinitou (t. j. TrkA) a nízkou afinitou (t. j. p75NTR). Receptory pre nervový rastový faktor sú exprimované
v prednom segmente oka (rohovke, spojovke, dúhovke, riasnatom telese a šošovke), slznou žľazou a zadným segmentom vnútroočného tkaniva. Liečba cenegermínom, podávaná vo forme očnej instilácie, je určená na umožnenie obnovy integrity rohovky.
Klinická účinnosť a bezpečnosť
Účinnosť a bezpečnosť lieku OXERVATE sa hodnotila v dvoch multicentrických, randomizovaných,
dvojito-zaslepených, vehikulom kontrolovaných klinických štúdiách (NGF0212 a NGF0214) u pacientov so stredne ťažkou (trvalý epiteliálny defekt) alebo ťažkou (rohovkový vred) neurotrofickou keratitídou refraktérnou na nechirurgickú liečbu. V oboch skúšaniach pacienti dostávali OXERVATE alebo vehikulum 6-krát denne do postihnutého oka(očí) po dobu 8 týždňov a podstúpili obdobie následného sledovania.
Do štúdie NGF0214 bolo zaradených 48 pacientov (priemerný vek 65±14 rokov, rozsah 33 –
94 rokov) liečených liekom OXERVATE 20 µg/ml alebo vehikulom (24 pacientov v každom ramene). Do štúdie NGF0212 bolo zaradených celkovo 174 pacientov (priemerný vek 61±16 rokov, rozsah 18 –
95 rokov), ktorí boli vystavení lieku OXERVATE a vehikulu bez pomocnej látky L-metionínu;
156 pacientov bolo nezávisle vyhodnotených na účinnosť s porovnaním dvoch rôznych dávok lieku s 20 a 10 µg/ml cenegermínu verzus vehikulom (52 pacientov v každom ramene).
Nasledujúca tabuľka uvádza súhrn výsledkov úplnéhouzdraveniarohovky u pretrvávajúceho poškodenia epitelu alebo vredu na rohovke (primárny koncový ukazovateľ, ktorý je definovaný ako najväčší priemer fluoresceínom zafarbenej rohovky <0,5 mm) po 4 a 8 týždňoch liečby pacientov, ktorí dostávali OXERVATE 20 µg/ml alebo vehikulum v týchto dvoch štúdiách.
Štúdia NGF0214 Štúdia NGF0212
Výsledky po 4 a 8 týždňoch liečby 4. týždeň 8. týždeň 4. týždeň 8. týždeň
Miera úplného zahojenia rohovky
OXERVATE 56,5 % 69,6 % 58,0 % 74,0 % vehikulum 37,5 % 29,2 % 19,6 % 43,1 % (hodnota p) (0,191) (0,006) (0,001) (0,002)
V oboch štúdiách bol po 8 týždňoch liečby meraný a zhrnutý v nasledujúcej tabuľke percentuálny
podiel pacientov, ktorí mali úplnévyjasnenierohovky (stupeň 0 na modifikovanej Oxfordskej škále), zmenu priemernej hodnoty metódou najmenších štvorcov v skóre najlepšiekorigovanejzrakovejostrostidodiaľky (ETDRS optotypy, angl. Early Treatment Diabetic Retinopathy Study letters) od východiskovej hodnoty a akékoľvek zlepšeniacitlivostirohovky, merané v milimetroch
Cochetovou-Bonnetovou esteziometriou (rozdiel porovnaný s východiskovou hodnotou >0).
Výsledky po 8 týždňoch liečby ŠtúdiaNGF0214 Štúdia NGF0212
OXERVATE 22,7 % 21,4 %
Kompletné vyjasnenie rohovky
Najlepšie korigovaná zraková ostrosť do diaľky
Citlivosť rohovky vnútri lézie
vehikulum 4,2 % 10,0 % (hodnota p) (0,062) (0,157)
OXERVATE 6,11 11,9 vehikulum 3,53 6,9 (hodnota p) (0,143) (0,213)
OXERVATE 72,2 % 76,3 % vehikulum 60,0 % 68,4 % (hodnota p) (0,458) (0,442)
Pacienti považovaní za úplne vyliečených na konci 8-týždňovej liečby liekom OXERVATE nemali tendenciu k recidívam počas 12-mesačného obdobia následného sledovania štúdie NGF0212. Konkrétne, viac než 80 % z 31 pacientov, ktorí boli vyliečení po úvodnej liečbe liekom OXERVATE
20 µg/ml, a ktorých reakcia bola dostupná, zostalo úplne vyliečených na konci 12-mesačného obdobia následného sledovania.
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s liekom v jednej
alebo vo viacerých podskupinách pediatrickej populácie s neurotrofickou keratitídou (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Cenegermín sa väčšinou odstráni z oka s produkciou sĺz a cez nosovoslzný kanál; menšia časť, ktorá
sa vstrebáva, sa vyskytuje väčšinou v spojovke a periorbitálnom tkanive a v menšej miere v rohovke po podaní do oka.
Farmakokinetické profilovanie pacientov zaradených do štúdie nezistilo žiadnu akumulačný účinok cenegermínu. Vo všeobecnosti je systémové vstrebávanie lieku OXERVATE zanedbateľné.
Distribúcia
Po podaní očnej instilácie je cenegermín distribuovaný najmä v prednej časti oka, hoci štúdia
s rádioaktívne označeným cenegermínom u potkanov ukázala, že sa dostane aj do sietnice a ostatných zadných častí oka pri dávkach výrazne vyšších ako tie, ktoré sú podávané očnou instiláciou u ľudí na liečbu neurotrofickej keratitídy. Keďže pri podávaní dávok do oka nedochádza k systémovej absorpcii nad prirodzené základné hodnoty, cenegermín nie je distribuovaný do telesných tkanív.
Biotransformácia
Po podaní do oka sa cenegermín vylučuje hlavne sekréciou sĺz a zvyšok sa väčšinou biotransformuje
proteázami v miestnom tkanive.
Eliminácia
Cenegermín podávaný očnou instiláciou sa vylučuje prevažne sekréciou sĺz.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti (centrálny nervový systém), toxicity po jednej dávke, toxicity po opakovanom podávaní, reprodukčnej toxicity, toxicity pre embryofetálny vývin a prenatálny a postnatálny vývin neodhalili žiadne riziko pre ľudí pri okulárnom (očná instilácia), intravenóznom a/alebo subkutánnom podaní.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
dihydrát trehalózy manitol
hydrogénfosforečnan sodný bezvodý dihydrogénfosforečnan sodný, dihydrát hydroxypropylmetylcelulóza polyetylénglykol 6000
L-metionín
voda na injekciu
kyselina chlorovodíková hydroxid sodný
dusík
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
Neotvorená liekovka
2 roky.
Otvorená liekovka
Po otvorení sa liek musí uchovávať pri teplote do 25 °C a použiť do 12 hodín pri 25 °C.
Z mikrobiologického hľadiska spôsob otvárania (t. j. pripojením nástavca na liekovku) vylučuje riziko mikrobiálnej kontaminácie.
6.4 Špeciálne upozornenia na uchovávanie
Liekovky OXERVATE
Lekáreň:
Škatuľa s liekovkami na týždeň sa musí uchovávať v mrazničke (-20 °C ± 5 °C).
Pacient:
Pacient dostane škatuľu s liekovkami na týždeň, obsahujúcu 7 liekoviek OXERVATE v izolovanom balení. Hneď po príchode domov (a najneskôr do 5 hodín, odkedy dostane liek v lekárni) musí pacient umiestniť škatuľu s liekovkami na týždeň do chladničky, pri teplote 2-8 °C. Je potrebné poznamenať, že zmrazený liek z lekárne môže potrebovať až 30 minút na rozmrazenie.
Z chladničky je potrebné vybrať samostatnú viacdávkovú liekovku OXERVATE na použitie
v priebehu jedného dňa. Každá otvorená liekovka môže byť uchovávaná v chladničke alebo pri teplote do 25 °C, ale musí sa použiť do 12 hodín.
Po tejto dobe sa musí obsah liekovky zlikvidovať bez ohľadu na to, či v liekovke zostali nejaké zvyšky lieku.'
6.5 Druh obalu a obsah balenia
1 ml roztoku OXERVATE v sterilných, viacdávkových sklenených liekovkách typu I, bez konzervačných látok, uzavretých gumovou zátkou a hliníkovým krytom s polypropylénovým vyklápacím viečkom, balených v kartónových škatuliach.
Veľkosť balenia: 7 viacdávkových liekoviek v 1 škatuli
Pacient dostane škatuľu na týždeň, ktorá obsahuje 7 liekoviek OXERVATE.
Tento liek sa má použiť iba so špecifickým nástavcom na liekovku a jednorazovými pomôckami
(pipetami), ktoré budú poskytnuté oddelene od škatule OXERVATE na týždeň.
Samostatne, spolu s kartou na zaznamenávanie dávok, bude poskytnutých 7 nástavcov na liekovku (t. j. 1 na deň), 42 pipiet (t. j. 6 na deň) a 42 dezinfekčných obrúskov (t. j. 6 na deň), čo postačuje na podávanie lieku počas jedného týždňa. Pre prípad potreby bude poskytnutý aj materiál navyše: nástavec (1), pipety (3) a obrúsky (3).
 6
.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
6
.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pacient dostane škatuľu na týždeň, obsahujúcu 7 viacdávkových liekoviek s OXERVATE, ktoré treba uchovávať v chladničke až do dňa použitia.
Pacient samostatne dostane aj nástavce na liekovky, pipety a dezinfekčné obrúsky.
Z chladničky je potrebné vybrať jednu viacdávkovú liekovku OXERVATE v rovnakom čase každé ráno, majúc na pamäti 12-hodinový dávkovací režim. Viacdávková liekovka obsahujúca liek sa musí pripraviť podľa nasledujúcich pokynov:
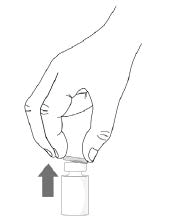
1) Čistými, čerstvo umytými rukami položte injekčnú liekovku na pevnú rovnú plochu a odstráňte plastové vyklápacie viečko.
2) Odlepte a stiahnite zadnú stranu blistrového balenia nástavca liekovky.
3) Bez toho, aby ste vybrali nástavec liekovky z blistrového balenia, pripojte nástavec liekovky na liekovku pevným vertikálnym zatlačením nástavca liekovky, kým nezapadne na miesto cez hrdlo liekovky a hrot nástavca liekovky neprepichne gumovú zátku liekovky. Po správnom pripojení sa nástavec už nesmie z liekovky odstraňovať.
4) Odstráňte a zlikvidujte blistrový obal nástavca na liekovku. Nedotýkajte sa povrchu nástavca.
 1 2 3-4
1 2 3-4
Pri odobratí každej dávky roztoku OXERVATE a jej podaní sa musia dodržať nižšie uvedené kroky:
5) Vezmite samostatný dezinfekčný obrúsok a jemne očistite povrch ventilu luer lock konektora na nástavci liekovky. Po vyčistení nechajte ventil schnúť približne jednu minútu.
6) Vezmite pipetu a vyberte ju z ochranného obalu.
7) V smere hodinových ručičiek naskrutkujte pipetu na luer lock konektor na nástavci liekovky.
8) Uistite sa, že piest pipety je stlačený úplne nadol.
9) Prevráťte injekčnú liekovku s pripojenou pipetou a jemne vytiahnite piest pipety von až na
doraz, čím sa natiahne roztok do pipety (uistite sa, že piest je vytiahnutý až po zarážku).
10) Skontrolujte pipetu a uistite sa, že obsahuje roztok. Vzduchové bubliny môžu spôsobiť upchatie a zabrániť správnemu naplneniu pipety (najmä pri prvom odobratí). Ak je pipeta prázdna, ponechajte liekovku s pripojenou pipetou v obrátenej polohe, zatlačte piest na doraz a znova ho vytiahnite.
11) Po správnom naplnení pipetu odskrutkujte z luer lock konektora na nástavci liekovky.

 5 6-7-8 9-10-11
5 6-7-8 9-10-11

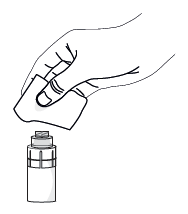
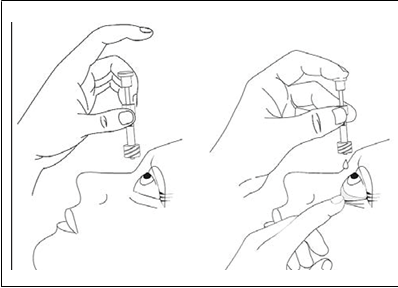
12) Chyťte pipetu prostredníkom a palcom tak, aby bola orientovaná nadol, zakloňte hlavu a pipetu umiestnite nad postihnuté oko. Stiahnite spodné viečko. Jemne stlačte piest pipety, kým nekvapne jedna kvapka do spojovkového fornixu.
13) Hneď po kvapnutí použitú pipetu a obrúsok zlikvidujte.
14) Ak dôjde k chybe a kvapka nebude podaná do oka, opakujte kroky opísané vyššie a použite pri tom novú pipetu a obrúsok.
15) Počas dňa možno liekovku vložiť späť do chladničky po každom použití alebo ju uchovávať pri teplote do 25 °C (s nástavcom liekovky stále pripojeným).
 12-13-14
12-13-14Pokyny na podávanie uvedené vyššie (kroky 5 až 15) je potrebné opakovať každé 2 hodiny (šesťkrát
denne), pričom sa vždy použije nový dezinfekčný obrúsok a nová pipeta.
Liekovka a všetok zvyšný roztok sa musia zlikvidovať na konci dňa ale najneskôr do 12 hodín od času, kedy sa k liekovke pripojí nástavec (bez ohľadu na to, či v liekovke zostane nejaký zvyšný roztok).
Aby sa zabezpečilo presné dávkovanie každé 2 hodiny, pacienta treba upozorniť, aby si nastavil budík ako pripomienku pre podanie dávky.
Pacient musí byť poučený, aby počas týždňa používal na zaznamenávanie dávok kartu poskytnutú spolu s pomôckami na aplikáciu, aby bolo možné skontrolovať, či bolo každý deň podaných šesť dávok. Na tejto karte musí pacient zaznamenávať dátum prvého použitia týždenného balenia, čas otvorenia liekovky (t. j. keď bol nástavec na liekovku pripojený k liekovke) a časy každodennej aplikácie očnej instilácie v priebehu týždňa.
Počas obdobia liečby bude každý týždeň vydané nové balenie lieku OXERVATE.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7
. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Dompé farmaceutici S.p.A. Via Santa Lucia, 6
20122 Miláno - Taliansko
Tel.: +39 02 583831
Fax: +39 02 58383215
E-mail:
info@dompe.com8. REGISTRAČNÉ ČÍSLO(A)EU/1/17/1197/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: {DD mesiac RRRR}
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu.