
lu
Androgén-deprivačná liečba môže predĺžiť QT interval.
U pacientov s anamnézou alebo rizikovými faktormi pre predĺženie QT intervalu a u pacientov
užívajúcich súbežne lieky, ktoré môžu predĺžiť QT interval (pozri časť 4.5), majú lekári pred začatím liečby liekom Orgovyx posúdiť pomer prínosu a rizika vrátane potenciálu pre Torsade de pointes.
Podrobná štúdia QT/QTc ukázala, že neexistuje žiadny inherentný účinok relugolixu na predĺženie
QTc intervalu (pozri časť 4.8).
Srdcovo-cievne ochorenie
Srdcovo-cievne ochorenie, ako je infarkt myokardu a cievna mozgová príhoda, bolo hlásené v
lekárskej literatúre u pacientov s androgén-deprivačnou liečbou. Preto treba brať do úvahy všetky
kardiovaskulárne rizikové faktory.
Zmeny hustoty kostí
Dlhodobá supresia testosterónu u mužov, ktorí podstúpili orchiektómiu alebo ktorí boli liečení
agonistom receptora GnRH alebo antagonistom GnRH, je spojená so zníženou hustotou kostí. Znížená hustota kostí u pacientov s ďalšími rizikovými faktormi môže viesť k osteoporóze a zvýšenému riziku
zlomenín kostí.
Porucha funkciepečene
Pacienti so známym ochorením pečene alebo podozrením na ochorenie pečene neboli zaradení do
dlhodobých klinických štúdií s relugolixom. Pozorovalo sa mierne, prechodné zvýšenie alanínaminotransferázy (ALT) a aspartátaminotransferázy (AST), ktoré však nebolo sprevádzané
zvýšením bilirubínu ani spojené s klinickými príznakmi (pozri časť 4.8). Počas liečby sa odporúča sledovanie funkcie pečene u pacientov so známym alebo suspektným ochorením pečene.
Farmakokinetika relugolixu u pacientov s ťažkou poruchou funkcie pečene nebola hodnotená (pozri
časť 5.2).
Ťažká poruchafunkcieobličiek
Expozícia relugolixu u pacientov s ťažkou poruchou funkcie obličiek sa môže zvýšiť až dvojnásobne
(pozri časť 5.2). Pretože nižšia dávka relugolixu nie je dostupná, u pacientov s ťažkou poruchou funkcie obličiek je pri podávaní 120 mg dávky relugolixu jedenkrát denne potrebná opatrnosť.
Množstvo relugolixu odstráneného hemodialýzou nie je známe.
Monitorovanie prostatickéhošpecifickéhoantigénu (PSA)
Účinok lieku Orgovyx sa má monitorovať podľa klinických parametrov a hladiny prostatického
špecifického antigénu (PSA) v sére.
Sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej filmom obalenej tablete, t.j. v
podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Možný účinok iných liekovna expozíciu relugolixu
P-gp inhibítory
Je potrebné sa vyhnúť súbežnému podávaniu lieku Orgovyx a perorálnych inhibítorov P-gp. Relugolix
je substrát P-gp (pozri časť 5.2). Pri súbežnom podaní 120 mg dávky relugolixu a následnom podaní
500 mg dávky erytromycínu štyrikrát denne počas 8 dní, P-gp a stredne silného inhibítora CYP3A, sa plocha pod plazmatickou koncentráciou časovej krivky (AUC) a maximálnou plazmatickou
koncentráciou (Cmax) relugolixu zvýšila 3,5-násobne a 2,9-násobne v dôsledku inhibície črevného P-gp
erytromycínom, čo viedlo k zvýšeniu perorálnej biologickej dostupnosti relugolixu. Súbežné
podávanie lieku Orgovyx s inými perorálnymi inhibítormi P-gp môže zároveň zvýšiť AUC a Cmax relugolixu, a teda môže zvýšiť riziko nežiaducich reakcií spojených s liekom Orgovyx. K liekom, ktoré sú perorálnymi inhibítormi P-gp, patria niektoré antiinfekčné látky (napr. azitromycín, erytromycín, klaritromycín, gentamicín, tetracyklín), antimykotiká (ketokonazol, itrakonazol), antihypertenzíva (napr. karvedilol, verapamil), antiarytmiká (napr. amiodarón, dronedarón,
propafenón, chinidín), antianginózne látky (napr. ranolazín), cyklosporín, inhibítory proteázy vírusu
ľudskej imunitnej nedostatočnosti (HIV) alebo vírusu hepatitídy C (HCV) (napr. ritonavir, telaprevir).
Ak sa nemožno vyhnúť súbežnému podávaniu s perorálnymi inhibítormi P-gp raz alebo dvakrát denne
(napr. azitromycín), najskôr by sa mal užiť liek Orgovyx, potom po 6 hodinách orálny inhibítor P-gp a pacienti by sa mali častejšie monitorovať, či sa u nich neprejavujú nežiaduce reakcie. Alternatívne
môže byť liečba liekom Orgovyx prerušená až na 2 týždne na krátkodobú liečbu inhibítorom P-gp
(napr. pri určitých makrolidových antibiotikách). Ak sa liečba liekom Orgovyx preruší na viac ako
7 dní, pokračujte v podávaní lieku Orgovyx so začiatočnou 360 mg dávkou v prvý deň, po ktorej
nasleduje 120 mg jedenkrát denne (pozri časť 4.2).
Kombinované P-gp a silné induktory CYP3A
Je potrebné sa vyhnúť súbežnému podávaniu lieku Orgovyx s kombinovanými P-gp a silnými
induktormi CYP3A. Po podaní 40 mg dávky relugolixu a následnom podaní 600 mg dávky
rifampicínu denne počas 13 dní, P-gp a silného induktora CYP3A, sa AUC relugolixu znížila o 55 % a Cmax o 23 % v dôsledku indukcie črevného P-gp (a CYP3A) rifampicínom, čo malo za následok pokles perorálnej biologickej dostupnosti relugolixu. Aj súbežné podávanie lieku Orgovyx s inými kombinovanými P-gp a silnými induktormi CYP3A môže znížiť AUC a Cmax relugolixu, a teda môže znížiť terapeutické účinky lieku Orgovyx. Lieky, ktoré sú kombinované P-gp a silné induktory CYP3A4, zahŕňajú inhibítor androgénneho receptora apalutamid, určité antikonvulzíva (napr. karbamazepín, fenytoín, fenobarbital), antiinfekčné látky (napr. rifampicín, rifabutín), ľubovník bodkovaný (Hypericum perforatum), inhibítory HIV alebo HCV proteázy (napr. ritonavir) a nenukleozidové inhibítory reverznej transkriptázy (napr. efavirenz).
Ak sa súbežnému podávaniu nedá vyhnúť, je potrené zvýšiť dávku lieku Orgovyx (pozri časť 4.2). Po vysadení kombinovaného P-gp a silného induktora CYP3A je potrebné pokračovať v odporúčanej dávke lieku Orgovyx raz denne.
Iné lieky
Pri súbežnom podávaní relugolixu s vorikonazolom (silný inhibítor CYP3A, prvý deň 400 mg dávka
dvakrát denne, potom 200 mg dávka dvakrát denne po dobu 8 dní), atorvastatínom (80 mg dávka raz denne po dobu 10 dní) alebo látkami znižujúcimi kyslosť sa nepozorovali žiadne klinicky významné rozdiely vo farmakokinetike relugolixu. Pri súbežnom podávaní s relugolixom sa nepozorovali žiadne klinicky významné rozdiely vo farmakokinetike pri jednorazovej dávke 5 mg midazolamu (citlivý substrát CYP3A) alebo jednorazovej dávke 10 mg rosuvastatínu (substrát proteínu rezistencie rakoviny prsníka [BCRP]). Na základe obmedzených údajov (n = 20) u mužov, ktorí v štúdii fázy 3
dostávali súbežne 120 mg dávku relugolixu a 80 až 160 mg dávky enzalutamidu (inhibítor signalizácie androgénneho receptora, ktorý je silným induktorom CYP3A a inhibítorom P-gp) až 266 dní, najnižšie
koncentrácie plazmatického relugolixu a sérového testosterónu sa z klinického hľadiska významne
nezmenili po pridaní enzalumitadu k monoterapii relugolixom. Preto sa počas kombinovanej liečby môže zachovať rovnaká dávka relugolixu.
Keďže liečba androgénovou depriváciou môže predĺžiť QT interval, súbežné užívanie lieku Orgovyx s liekmi, o ktorých je známe, že predlžujú QT interval, alebo liekmi schopnými vyvolať Torsade de pointes, ako je trieda IA (napr. chinidín, dizopyramid) alebo trieda III (napr. amiodarón, sotalol, dofetilid, ibutilid), antiarytmiká, metadón, moxifloxacín, antipsychotiká atď. treba starostlivo vyhodnotiť (pozri časť 4.4).
Potenciál relugolixu ovplyvniť expozíciuinými liekmi
Relugolix je slabým induktorom metabolizmu sprostredkovaného CYP3A. Pri súbežnom podaní
jednorazovej 5-mg dávky midazolamu, citlivého substrátu CYP3A, po podaní 120-mg dávok lieku
Orgovyx raz denne do rovnovážneho stavu sa AUC0-inf midazolamu znížila o 22 % a Cmax o 14 %, čo sa nepovažuje za klinicky významné. Klinicky významné účinky na iné substráty CYP3A4 sa
nepredpokladajú. Ak však dôjde k zníženiu terapeutických účinkov, lieky (napr. statíny) možno titrovať, aby sa dosiahli požadované terapeutické účinky.
Relugolix je inhibítorom BCRP in vitro. Pri súbežnom podávaní jednorazovej 10 mg dávky rosuvastatínu, substrátu BCRP a OATP1B1, po podávaní 120 mg dávok relugolixu raz denne do rovnovážneho stavu sa AUC0-inf rosuvastatínu znížila o 27 % a Cmax o 34 %. Zníženie expozície rosuvastatínu sa nepovažuje za klinicky významné. Rosuvastatín však možno titrovať, aby sa dosiahli požadované terapeutické účinky. Účinok relugolixu na iné substráty BCRP sa nehodnotil a význam pre iné substráty BCRP nie je známy.
Relugolix je inhibítor P-gp in vitro, čo naznačuje potenciál pre klinicky relevantnú inhibíciu P-gp 120 mg dávkou relugolixu. In vitro inhibičná sila je však nižšia ako účinnosť pozorovaná pri BCRP, a preto sa neočakáva klinicky významná interakcia so substrátmi P-gp. So substrátom P-gp sa neuskutočnili žiadne klinické interakčné štúdie.
Štúdie in vitro
Enzýmy cytochrómu P450 (CYP): Relugolix nie je inhibítorom CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 ani CYP3A4, ani nie je induktorom CYP1A2 alebo CYP2B6
v klinicky relevantných plazmatických koncentráciách.
Systémy transportérov: Relugolix nie je inhibítorom OATP1B1, OATP1B3, OAT1, OAT3, OCT2, MATE1, MATE2-K ani BSEP v klinicky relevantných plazmatických koncentráciách.
4.6 Fertilita, gravidita a laktácia
Tento liek nie je indikovaný ženám vo fertilnom veku. Nesmú ho používať ženy, ktoré sú alebo môžu byť tehotné ani dojčiace ženy (pozri časť 4.1).
Antikoncepcia
Nie je známe, či sa relugolix alebo jeho metabolity nachádzajú v sperme. Na základe zistení u zvierat
a mechanizmu účinku, ak má pacient pohlavný styk so ženou vo fertilnom veku, počas liečby a
2 týždne po poslednej dávke lieku Orgovyx sa musí používať účinná antikoncepcia.
Gravidita
K dispozícii je obmedzené množstvo údajov o používaní relugolixu u gravidných žien. Štúdie na
zvieratách preukázali, že expozícia relugolixu na začiatku tehotenstva môže zvýšiť riziko straty tehotenstva na začiatku tehotenstva (pozri časť 5.3). Na základe farmakologických účinkov nemožno vylúčiť nepriaznivý vplyv na graviditu.
Dojčenie
Výsledky z neklinických štúdií naznačujú, že relugolix sa vylučuje do mlieka dojčiacich potkanov
(pozri časť 5.3). Nie sú dostupné žiadne údaje týkajúce sa prítomnosti relugolixu alebo jeho metabolitov v ľudskom mlieku alebo jeho účinku na dojčené dieťa. Účinok na dojčenie
novorodencov/dojčiat nemôže byť vylúčený.
Fertilita
Na základe zistení u zvierat a mechanizmu účinku môže Orgovyx narušiť plodnosť u mužov s
reprodukčným potenciálom (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Orgovyx nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Únava a závrat sú veľmi časté (únava) a časté (závrat) nežiaduce reakcie, ktoré môžu ovplyvniť schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinkyZhrnutie bezpečnostného profiluNajčastejšie pozorované nežiaduce reakcie počas liečby relugolixom sú fyziologické účinky supresie
testosterónu vrátane návalov tepla (54 %), muskuloskeletálnej bolesti (30 %) a únavy (26 %). Medzi
ďalšie veľmi časté nežiaduce reakcie patrí hnačka a zápcha (každé po 12 %).
Tabuľkový zoznamnežiaducichreakciíNežiaduce reakcie uvedené v tabuľke 1 sú klasifikované podľa frekvencie a triedy orgánových
systémov. V rámci každej skupiny frekvencií sú nežiaduce reakcie na liek zoradené podľa klesajúcej závažnosti. Frekvencie sú definované ako veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté
(≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000) a neznáme
(z dostupných údajov). V rámci každej skupiny frekvencií sú nežiaduce reakcie usporiadané podľa klesajúcej závažnosti.
Poruchy krvi a lymfatického systému
| Časté
| Anémia
| Poruchy endokrinného systému
| Časté
| Gynekomastia
| Psychické poruchy
| Časté
| Nespavosť
| Depresia
| Poruchy nervového systému
| Časté
| Závraty
| Bolesť hlavy
| Poruchy srdca a srdcovej činnosti
| Zriedkavé
| Infarkt myokardu
| Neznáme
| Predĺžený QT interval (pozri časti 4.4 a 4.5)
| Poruchy ciev
| Veľmi časté
| Návaly horúčavy
| Časté
| Hypertenzia
| Poruchy gastrointestinálneho traktu
| Veľmi časté
| Hnačkaa
| Zápcha
| Časté
| Nevoľnosť
| Poruchy kože a podkožného tkaniva
| Časté
| Hyperhidróza
| Vyrážka
| Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
| Veľmi časté
| Muskuloskeletálna bolesťb
| Menej časté
| Osteoporóza/osteopénia
| Poruchy reprodukčného systému a prsníkov
| Časté
| Znížené libido
| Celkové poruchy a reakcie v mieste podania
| Veľmi časté
| Únavac
|
|
|
Tabuľka 1. Nežiaduce reakcie hlásené v štúdii HERO
L
aboratórne a funkčné vyšetrenia
|
Časté
|
Zvýšenie hmotnosti
|
Zvýšená hladina glukózyd
|
Zvýšené triglyceridyd
|
Zvýšený cholesterol v krvie
|
Menej časté
|
Zvýšená aspartátaminotransferáza
|
Zvýšená alanínaminotransferázad
|
a Zahŕňa hnačku a kolitídu
b Zahŕňa artralgiu, bolesť chrbta, bolesť končatín, muskuloskeletálnu bolesť, myalgiu, bolesť kostí, bolesť krku, artritídu, muskuloskeletálnu stuhnutosť, nekardiálnu bolesť na hrudníku, bolesť chrbtice a muskuloskeletálny
diskomfort
c Zahŕňa únavu a asténiu
d Zvýšenie stupňa 3/4 zistené monitorovaním klinických laboratórnych testov (pozri nižšie)
e Nebolo zaznamenané žiadne zvýšenie cholesterolu > stupeň 2
Opis vybranýchnežiaducichreakciíZmeny laboratórnych parametrovZmeny laboratórnych hodnôt pozorované počas až 1-ročnej liečby v štúdii fázy 3 (N = 622) boli v
rovnakom rozsahu pre Orgovyx a agonistu GnRH (leuprorelín) použitého ako aktívny komparátor. Koncentrácie ALT a/alebo AST > 3-násobok hornej hranice normy (ULN) boli hlásené u 1,4 % pacientov s normálnymi hodnotami pred liečbou po liečbe liekom Orgovyx. Zvýšenie ALT na stupeň 3/4 sa pozorovalo u 0,3 % pacientov a AST na stupeň 3/4 u 0 % pacientov liečených liekom Orgovyx. Žiadne udalosti neboli spojené so zvýšeným bilirubínom.
Koncentrácia hemoglobínu klesla o 10 g/l počas 1 roka liečby. Výrazný pokles hemoglobínu
(≤ 105 g/l) sa pozoroval u 4,8 % po liečbe liekom Orgovyx, s poklesom na stupeň 3/4 u 0,5 %. Hladina glukózy sa zvýšila na stupeň 3/4 u 2,9 % pozorovaných pacientov a triglyceridy sa zvýšili na stupeň 3/4 u 2,0 % pozorovaných pacientov.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePri predávkovaní liekom Orgovyx nie je známe žiadne špecifické antidotum. V prípade predávkovania sa má podávanie lieku Orgovyx ukončiť a majú sa prijať všeobecné podporné opatrenia, kým sa akákoľvek klinická toxicita nezníži alebo neustúpi, berúc do úvahy polčas 61,5 hodiny. Nežiaduce reakcie v prípade predávkovania ešte neboli pozorované. Predpokladá sa, že takéto reakcie budú pripomínať nežiaduce reakcie uvedené v časti 4.8. Nie je známe, či sa relugolix odstraňuje hemodialýzou.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Endokrinná liečba, iné antagonisty hormónov a príbuzné liečivá, ATC
kód: L02BX04
Mechanizmus účinkuRelugolix je nepeptidový antagonista receptora GnRH, ktorý sa kompetitívne viaže na receptory
GnRH v prednej hypofýze, čím zabraňuje naviazaniu natívnych GnRH a signalizuje sekréciu
luteinizačného hormónu (LH) a hormónu stimulujúceho folikuly (FSH). V dôsledku toho je znížená produkcia testosterónu zo semenníkov. U ľudí po začatí liečby liekom Orgovyx koncentrácie FSH a LH rýchlo klesajú a koncentrácie testosterónu sú stlačené pod fyziologické koncentrácie. Liečba nie je spojená s počiatočným zvýšením koncentrácií FSH a LH a následne testosterónu („potenciálne symptomatické vzplanutie“) pozorovaným po začatí liečby analógom GnRH. Po prerušení liečby sa koncentrácie hormónov hypofýzy a gonád vrátia na fyziologické koncentrácie.
Klinická účinnosťabezpečnosť
Bezpečnosť a účinnosť lieku Orgovyx bola hodnotená v randomizovanej, otvorenej štúdii HERO u
dospelých mužov s androgén-senzitívnym pokročilým karcinómom prostaty vyžadujúcim najmenej
1 rok androgén deprivačnej terapie, ktorí neboli kandidátmi na chirurgickú ani radiačnú terapiu
s liečebným zámerom. Vhodní pacienti mali buď dôkaz biochemického (PSA) alebo klinického
relapsu po lokálnej primárnej intervencii s liečebným zámerom a neboli kandidátmi na záchrannú operáciu, mali novo diagnostikované metastatické ochorenie citlivé na androgén alebo pokročilé lokalizované ochorenie, ktoré sa nedá vyliečiť primárnym zásahom prostredníctvom operácie alebo ožarovania. Vhodní pacienti museli mať výsledný stav podľa Východnej kooperatívnej onkologickej skupiny (Eastern Cooperative Oncology Group, ECOG) 0 alebo 1. Pacientom s progresiou ochorenia počas liečebného obdobia sa odporúčalo, aby zostali v štúdii, a ak to bolo indikované, mohli absolvovať rádioterapiu podľa predpisu skúšajúceho. Ak sa hladiny PSA zvýšili, pacientom bolo umožnené užívať enzalutamid po potvrdení progresie PSA alebo docetaxel počas štúdie.
Primárnym meradlom výsledku účinnosti bola miera lekárskej kastrácie definovaná ako dosiahnutie
a udržanie dennej supresie testosterónu v sére na kastračných hladinách (< 50 ng/dl) 29 dní až
48 týždňov liečby a navyše sa hodnotila noninferiorita relugolixu v porovnaní s leuprorelínom (pozri
tabuľku 2). Ďalšie kľúčové sekundárne koncové ukazovatele zahŕňali mieru kastrácie na 4. a 15. deň,
mieru kastrácie s testosterónom < 20 ng/dl na 15. deň a mieru odpovede PSA v 15. deň (pozri tabuľku 3).
Celkovo bolo randomizovaných 934 pacientov, ktorí dostávali Orgovyx alebo leuprorelín v pomere 2:1 počas 48 týždňov:
a) Orgovyx v nasycovacej dávke 360 mg v prvý deň, po ktorom nasledujú denné 120 mg
dávky perorálne.
b) Leuprorelín 22,5 mg injekcia (alebo 11,25 mg v Japonsku, Taiwane a Číne) subkutánne každé 3 mesiace. Leuprorelín acetát v dávke 11,25 mg každé 3 mesiace je dávkovací
režim, ktorý sa v Európskej únii pre túto indikáciu neodporúča.
Populácia (N = 930) v oboch liečebných skupinách mala priemerný vek 71 rokov (od 47 do 97 rokov). Etnická/rasová distribúcia bola nasledovná: 68 % bielej pleti, 21 % ázijského pôvodu, 4,9 % čiernej pleti a 5 % ostatní. Štádium ochorenia bolo rozdelené takto: 32 % metastázujúce (M1), 31 % lokálne pokročilé (T3/4 NX M0 alebo akékoľvek T N1 M0), 28 % lokalizované (T1 alebo T2 N0 M0) a 10 % neklasifikovateľné.
Primárne výsledky účinnosti lieku Orgovyx na leuprorelín na dosiahnutie a udržanie sérového testosterónu na kastračných hladinách (T < 50 ng/dl) sú uvedené v tabuľke 2 a na obrázku 1. Východiskové hladiny testosterónu a časový priebeh supresie testosterónu liekom Orgovyx a leuprorelínom počas 48-týždňového obdobia liečby sú znázornené na obrázku 2.
T
abuľka 2. Miera lekárskej kastrácie (koncentrácie testosterónu < 50 ng/dl) od 1. dňa 5. týždňa
(
29. deň) do 1. dňa 49. týždňa (337. deň) v štúdii HERO
|
O
rgovyx
360/120 mg
|
L
euprorelín
22,5 alebo 11,5 mg
a
|
Počet liečených
|
622b
|
308b
|
Miera odpovede (95 % CI)c
|
96,7 %
(94,9 %, 97,9 %)
|
88,8 %
(84,6 %, 91,8 %)
|
Rozdiel od leuprorelínu (95 % CI)
|
7,9 %
(4,1 %, 11,8 %)d
hodnota p < 0,0001
|
|
a Dávka 22,5 mg v Európe a Severnej Amerike, dávka 11,25 mg v Ázii. Miera kastrácie podskupiny pacientov, ktorí dostávali 22,5 mg leuprorelínu (n = 264) predstavovala 88,0 % (95 % CI: 83,4 %, 91,4 %).
b Dvaja pacienti v každej skupine nedostali skúšanú liečbu a neboli zahrnutí.
c Odhady podľa Kaplan-Meiera v rámci skupiny.
d Non-inferiorita bola testovaná s rezervou -10 %.'
Obrázok 1: Kumulatívny výskyt koncentrácií testosterónu < 50 ng/dl v štúdii HERO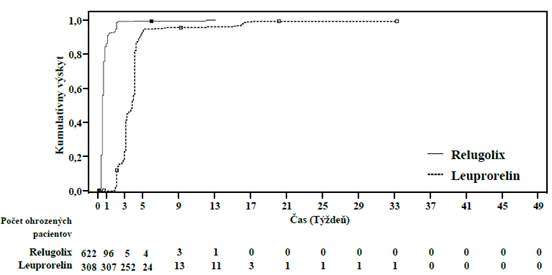 Obrázok 2: Koncentrácie testosterónu od východiskovej hodnoty do 49. týždňa (priemera 95 % CI) v štúdii HERO
Obrázok 2: Koncentrácie testosterónu od východiskovej hodnoty do 49. týždňa (priemera 95 % CI) v štúdii HERO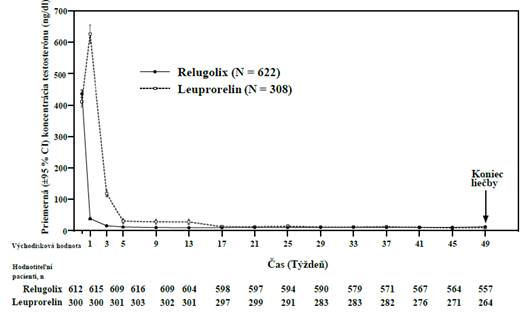
Súhrn výsledkov kľúčových sekundárnych koncových ukazovateľov je uvedený v tabuľke 3.
Tabuľka 3. Súhrn kľúčových sekundárnych koncových ukazovateľov
Sekundárny ukazovateľ
| Orgovyx
(N = 622)
| Leuprorelín
(N = 308)
|
Hodnota p
|
Kumulatívna pravdepodobnosť potlačenia testosterónu
na < 50 ng/dl pred podaním dávky v 4. deň
| 56,0
| 0,0
| < 0,0001
|
Kumulatívna pravdepodobnosť potlačenia testosterónu
na < 50 ng/dl pred podaním dávky v 15. deň
| 98,7
| 12,1
| < 0,0001
|
Podiel pacientov s odpoveďou PSA v 15. deň
s následným potvrdením v 29. deň
| 79,4
| 19,8
| < 0,0001
|
Kumulatívna pravdepodobnosť potlačenia testosterónu
na < 20 ng/dl pred podaním dávky na 15. deň
| 78,4
| 1,0
| < 0,0001
|
Skratky: PSA = prostatický špecifický antigén.
Pediatrická populáciaEurópska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom Orgovyx
vo všetkých podskupinách pediatrickej populácie pri liečbe pokročilého hormonálne senzitívneho karcinómu prostaty (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiPo perorálnom podaní jednorazovej nasycovacej 360 mg dávky bol priemer (± štandardná odchýlka
[± SD]) AUC0-24 relugolixu 985 (± 742) ng.hr/ml a Cmax relugolixu 215 (± 184) ng/ml. Po podaní
120 mg dávky raz denne boli priemerné hodnoty (± SD), Cmax, Cavg (priemerná plazmatická
koncentrácia počas 24-hodinového intervalu dávkovania) a Ctrough relugolixu v rovnovážnom stave na úrovniach Cmax 70 (± 65) ng/ml, Cavg 17,0 (± 7) ng/ml a Ctrough 10,7 (± 4) ng/ml.
Akumulácia expozície relugolixu pri podaní 120 mg dávky relugolixu raz denne je približne 2- násobná. Po podávaní relugolixu jedenkrát denne po nasycovacej 360 mg dávke v prvý deň podávania sa rovnovážny stav relugolixu dosiahne do 7. dňa.
AbsorpciaAbsorpcia relugolixu po perorálnom podaní je primárne sprostredkovaná črevným P-gp, pre ktorý je
relugolix substrátom. Po perorálnom podaní sa relugolix rýchlo absorbuje, pričom kvantifikovateľnú koncentráciu dosiahne 0,5 hodiny po podaní dávky, po ktorej nasleduje jeden alebo viacero nasledujúcich absorpčných vrcholov. Medián (rozsah) času do Cmax (tmax) relugolixu je 2,25 hodiny (0,5 až 5,0 hodín). Absolútna biologická dostupnosť relugolixu je 11,6 %.
Po podaní jednorazovej 120 mg dávky relugolixu po konzumácii vysoko kalorického jedla s vysokým obsahom tuku (približne 800 až 1 000 kalórií z toho 500 kalórií z tukov, 220 zo sacharidov a 124 z bielkovín) sa AUC0-∞ znížila o 19 % a Cmax o 21 %. Poklesy expozície relugolixu s jedlom sa nepovažujú za klinicky významné, a preto sa Orgovyx môže podávať bez ohľadu na jedlo (pozri
časť 4.2).
DistribúciaRelugolix sa na 68 až 71 % viaže na plazmatické bielkoviny, predovšetkým na albumín a v menšej
miere na α1-kyslý glykoproteín. Priemerný pomer krvi k plazme je 0,78. Na základe zdanlivého
distribučného objemu (Vz) sa relugolix široko distribuuje do tkanív. Odhadovaný distribučný objem v rovnovážnom stave (Vss) je 3 900 l.
B
i
otransformácia
Štúdie in vitro naznačujú, že primárne enzýmy CYP prispievajúce k celkovému oxidačnému
metabolizmu relugolixu v pečeni boli CYP3A4/5 (45 %) > CYP2C8 (37 %) > CYP2C19 (< 1 %) s
oxidačnými metabolitmi, metabolitom-A a metabolitom-B, tvorenými CYP3A4/5 a CYP2C8.
Eliminácia
Po vstrebaní sa približne 19 % relugolixu vylúči ako nezmenená účinná látka močom a približne 80 %
sa vylúči viacerými biotransformačnými cestami, vrátane CYP3A a CYP2C8 a mnohými ďalšími vedľajšími metabolickými cestami, s malým príspevkom biliárnej sekrécie nezmeneného lieku a/alebo
metabolitov. Približne 38 % podanej dávky sa vylúči vo forme metabolitov (iných ako metabolit-C)
stolicou a močom. Metabolit-C, ktorý je tvorený črevnou mikroflórou, je primárnym metabolitom
v stolici (51 %) a ďalej odráža neabsorbované liečivo.
Linearita/nelinearita
Relugolix je spojený s väčším než dávkovo úmerným zvýšením expozície pri dávkach nižších ako
približne 80 mg, čo je v súlade so saturáciou črevného P-gp závislou od dávky a zodpovedajúcim klesajúcim príspevkom črevného výtoku P-gp k perorálnej biologickej dostupnosti relugolixu pri zvyšovaní dávky. Po saturácii črevného P-gp je väčšia časť absorpcie relugolixu riadená pasívnou difúziou a expozícia relugolixu sa zvyšuje úmerne s dávkou v rozmedzí dávok 80 až 360 mg. Nasýtenie črevného P-gp vyššími dávkami relugolixu sa prejavuje zvýšením expozície relugolixu závislým od dávky spojeným serytromycínom, silným inhibítorom P-gp (a stredne silným inhibítorom CYP3A), kde zvýšenie expozície bolo menšie pre 120 mg dávku v porovnaní s nižšími dávkami relugolixu (20 alebo 40 mg) (pozri časť 4.5).
Osobitné populácie
Populačné analýzy PK (PopPK) a PopPK/PD naznačujú, že neexistujú žiadne klinicky významné
rozdiely v expozícii koncentrácií relugolixu alebo testosterónu na základe veku, rasy alebo etnickej príslušnosti, telesnej veľkosti (telesnej hmotnosti alebo indexu telesnej hmotnosti) alebo štádia rakoviny.
Porucha funkcie obličiek
Na základe štúdií zameraných na poruchy funkcie obličiek s užívaním 40 mg dávok relugolixu sa expozícia relugolixu (AUC0-t) u pacientov so stredne ťažkou poruchou funkcie obličiek zvýšila 1,5- násobne a u pacientov s ťažkou poruchou funkcie obličiek až 2-násobne, v porovnaní s jedincami
s normálnou funkciou obličiek. Zvýšenie u pacientov so stredne ťažkou poruchou funkcie obličiek sa nepovažuje za klinicky významné. Pokiaľ ide o pacientov s ťažkou poruchou funkcie obličiek, pri
podávaní 120 mg dávky relugolixu jedenkrát denne je potrebná opatrnosť (pozri časť 4.4).
Účinok poruchy funkcie obličiek v konečnom štádiu s hemodialýzou alebo bez nej na farmakokinetiku relugolixu sa nehodnotil. Množstvo relugolixu odstránené hemodialýzou nie je známe.
Porucha funkcie pečene
Po podaní jednorazovej 40 mg dávky relugolixu pacientom s miernou alebo stredne ťažkou poruchou
funkcie pečene sa celková expozícia relugolixu (AUC0-∞) znížila o 31 % alebo bola porovnateľná
v porovnaní s jedincami s normálne fungujúcou pečeňou. Priemerný polčas rozpadu relugolixu u pacientov s miernou alebo stredne ťažkou poruchou funkcie pečene a u zdravých kontrolných
jedincov bol porovnateľný.
U pacientov s miernou alebo stredne ťažkou poruchou funkcie pečene nie je potrebná úprava dávky Orgovyxu (pozri časť 4.2). Účinky ťažkej poruchy funkcie pečene na farmakokinetiku relugolixu sa nehodnotili.
5.3 Predklinické údaje o bezpečnosti
Neklinické údaje založené na konvenčných štúdiách farmakologickej bezpečnosti, toxicity pri opakovanom podávaní, genotoxicity alebo karcinogénneho potenciálu nepreukazujú žiadne zvláštne riziká pre ľudí, okrem tých, ktoré sú uvedené nižšie.
U samcov myší s knock-in ľudským GnRH-receptorom znížilo perorálne podanie relugolixu hmotnosť prostaty a semenných vačkov v dávkach ≥ 3 mg/kg dvakrát denne po dobu 28 dní. Účinky relugolixu boli reverzibilné, s výnimkou hmotnosti semenníkov, ktorá sa úplne nezotavila do 28 dní po vysadení lieku. Tieto účinky u samcov myší typu knock-in sú pravdepodobne spojené s farmakodynamikou relugolixu, avšak význam týchto zistení pre ľudí nie je známy. V 39-týždňovej štúdii toxicity po opakovanom podávaní u opíc sa nezistili žiadne významné účinky na samčie reprodukčné orgány pri perorálnych dávkach relugolixu až do 50 mg/kg/deň (približne 36-násobok expozície u ľudí pri odporúčanej dávke 120 mg denne na základe AUC). Relugolix (dávky ≥ 1 mg/kg) potláčal koncentrácie LH u kastrovaných samcov opíc cynomolgus. Supresívny účinok relugolixu na LH a pohlavné hormóny sa však nehodnotil v 39-týždňovej štúdii toxicity u intaktných opíc. Význam nedostatku účinku na reprodukčné orgány u intaktných opičích samcov pre ľudí teda nie je známy.
U gravidných králikov, ktorým sa počas obdobia organogenézy perorálne podával relugolix, boli pozorované spontánne potraty a celková strata schopnosti vrhať mláďatá pri hladinách expozície (AUC) nižších ako sú tie, ktoré sa dosiahli pri odporúčanej dávke 120 mg/deň pre človeka.
U potkanov sa nepozorovali žiadne účinky na embryofetálny vývoj, relugolix však významne
neinteraguje s receptormi GnRH u tohto druhu.
U dojčiacich potkanov, ktorým bola podaná jednorazová perorálna dávka 30 mg/kg rádioaktívne
označeného relugolixu 14. deň po pôrode, bol relugolix a/alebo jeho metabolity prítomný v mlieku
v koncentráciách až 10-násobne vyšších ako v plazme 2 hodiny po znížení dávky na nízke hladiny do
48 hodín po podaní dávky. Väčšina rádioaktivity odvodenej od relugolixu v mlieku pozostávala z nezmeneného relugolixu.
Štúdie hodnotenia environmentálnych rizík ukázali, že relugolix môže predstavovať riziko pre vodné
prostredie (pozri časť 6.6).
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
manitol (E421)
sodná soľ karboxymetylškrobu (E468)
hydroxypropylcelulóza (E463) stearát horečnatý (E572) hypromelóza (E464)
oxid titaničitý (E171)
červený oxid železitý (E172)
karnaubský vosk (E903)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh a obsah baleniaOrgovyx filmom obalené tablety sa dodávajú vo fľaši. Každá fľaša z polyetylénu s vysokou hustotou (HDPE) obsahuje 30 filmom obalených tabliet a vysúšadlo a je uzavretá indukčne uzavretým polypropylénovým (PP) viečkom chrániacim pred prístupom detí.
Veľkosti balenia po 30 a 90 (3 balenia po 30) filmom obalených tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuTento liek môže predstavovať riziko pre životné prostredie (pozri časť 5.3). Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAccord Healthcare S.L.U.
World Trade Center, Moll de Barcelona, s/n, Edifici Est 6ª planta,
08039 Barcelona,
Španielsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/22/1642/001
EU/1/22/1642/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 29. apríl 2022
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.