
opikapónu s inhibítormi
MAO (napr. fenelzín, tranylcypromín a moklobemid) inými, než určenými na liečbu Parkinsonovej choroby, kontraindikované.
Súbežné používanie opikapónu a inhibítorov MAO na liečbu Parkinsonovej choroby, napr. rasagilín
(až 1 mg/deň) a selegilín (až 10 mg/deň v perorálnych liekových formách alebo 1,25 mg/deň v liekových formách s bukálnou absorpciou) je prípustné (pozri časť 4.3).
Nie sú k dispozícii skúsenosti so súbežným používaním opikapónu s inhibítorom MAO safinamidom. Preto sa má k ich súbežnému používaniu pristupovať s primeranou opatrnosťou.
Lieky metabolizovanéCOMT
Opikapón môže ovplyvniť metabolizmus liekov obsahujúcich katecholovú skupinu, ktoré sa
metabolizujú prostredníctvom COMT, napr. rimiterol, izoprenalín, adrenalín, noradrenalín, dopamín, dopexamín alebo dobutamín, čo vedie k zosilneným účinkom týchto liekov. Pri používaní opikapónu
sa odporúča pozorné sledovanie pacientov, ktorí sa liečia týmito liekmi.
Tricyklické antidepresíva a inhibítory reabsorpcie noradrenalínu
K dispozícii sú len obmedzené skúsenosti s opikapónom používaným súbežne s tricyklickými
antidepresívami a inhibítormi reabsorpcie noradrenalínu (napr. venlafaxín, maprotilín a desipramín). Preto sa má k ich súbežnému používaniu pristupovať s primeranou opatrnosťou.
Repaglinid
Opikapón je slabým inhibítorom CYP2C8. Štúdia u zdravých osôb používajúcich dávku 25 mg,
a menej ako optimálnu liekovú formu ukázala pri súbežnom podávaní (t.j. pri podávaní v rovnaký čas)
s opikapónom priemerné zvýšenie miery expozície repaglinidu o 30%, nie však jej rozsahu, čo je najpravdepodobnejšie spôsobené inhibíciou CYP2C8. Preto treba obzvlášť zvážiť používanie liekov metabolizovaných CYP2C8 a je potrebné sa vyhnúť ich súbežnému podávaniu.
Substráty OATP1B1
Opikapón je slabým inhibítorom OATP1B1. Nie sú k dispozícii skúsenosti so súbežným používaním
opikapónu so substrátmi OATP1B1. Liekom transportovaným pomocou OATP1B1 sa má preto
venovať osobitná pozornosť a k ich súbežnému používaniu sa má pristupovať s primeranou opatrnosťou.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití opikapónu u gravidných žien.
Štúdie na zvieratách sú nedostatočné z hľadiska reprodukčnej toxicity (pozri časť 5.3). Ongentys sa neodporúča užívať počas gravidity a u žien vo fertilnom veku nepoužívajúcich antikoncepciu.
Dojčenie
Nie je známe, či sa opikapón alebo jeho metabolity vylučujú do ľudského mlieka. Riziko
u novorodencov/dojčiat nemôže byť vylúčené. Dojčenie má byť počas liečby Ongentysom ukončené.
Fertilita
Účinky opikapónu na fertilitu u ľudí sa neskúmali. Štúdie na zvieratách s opikapónom nepreukázali
priame alebo nepriame účinky z hľadiska fertility (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Opikapón v spojení s levodopou môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Opikapón môže v spojení s levodopou spôsobovať závrat, symptomatickú ortostatickú hypotenziu a ospalosť. Preto sa má pri vedení vozidiel a obsluhe strojov dodržiavať opatrnosť.
4.8 Nežiaduce účinky
Súhrn údajovobezpečnosti
Najčastejšie hlásenými nežiaducimi reakciami boli poruchy nervového systému. Dyskinéza bola
najčastejšie hlásenou nežiaducou reakciou vyskytujúcou sa počas liečby (17,7%).
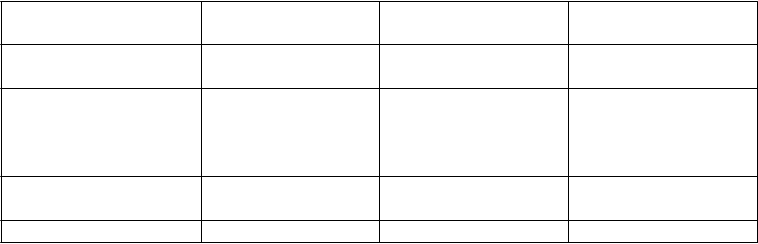
Tabuľkový zoznamnežiaducichreakcií
V tabuľke nižšie (tabuľka 1) sú všetky nežiaduce reakcie uvedené podľa tried orgánových systémov
a frekvencie.
Frekvencie sú definované nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000) veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
Tabuľka 1 - Frekvencie nežiaducich reakcií (MedDRA) v placebom kontrolovaných štúdiách
3. fázy
T
rieda orgánových systémov
P
oruchy metabolizmu
a výživy
V
eľmi časté Časté Menej časté
znížená chuť do jedla, hypertriglyceridémia
P
sychické poruchy abnormálne sny, halucinácie, zrakové halucinácie, nespavosť
úzkosť, depresia, zvukové halucinácie, nočné mory, poruchy spánku
P
oruchy nervového systému
dyskinéza závraty, bolesť hlavy, ospalosť
dysgeúzia, hyperkinéza, synkopa
 P
oruchy oka
P
oruchy oka suché oči
P
oruchy ucha a labyrintu Poruchy srdca a srdcovej činnosti
upchatie ucha palpitácie
P
oruchy ciev ortostatická hypotenzia hypertenzia, hypotenzia
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu
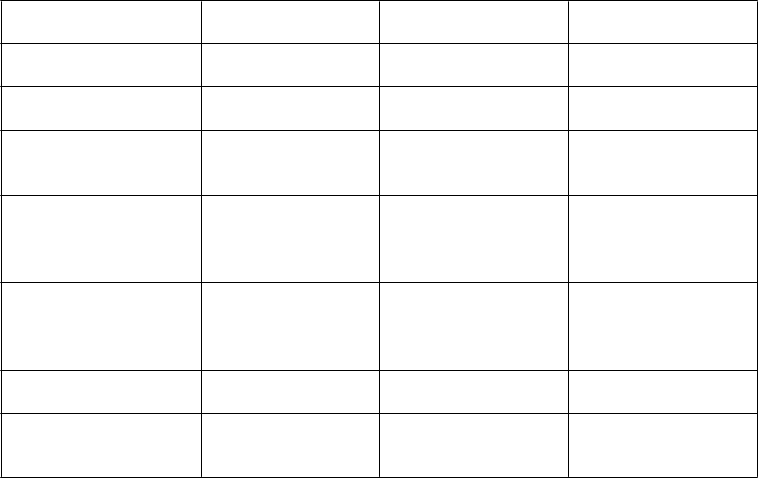
zápcha, sucho
v ústach, vracanie
dýchavičnosť
abdominálna distenzia, bolesť brucha, bolesť hornej časti brucha, dyspepsia
P
oruchy kostrovej
a svalovej sústavy
a spojivového tkaniva
P
oruchy obličiek
a močových ciest
svalové kŕče svalové zášklby, stuhnutosť svalov
a kostí, myalgia, bolesť končatín chromatúria, noktúria
L
aboratórne a funkčné
vyšetrenia
zvýšená hladina kreatinín fosfokinázy v krvi
znížená telesná hmotnosť
H
l
ásenie
podozrení
na
nežiaduce
r
eakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNie je známe žiadne špecifické antidotum. Má sa podať príslušná symptomatická a podporná liečba. Má sa zvážiť odstránenie opikapónu výplachom žalúdka a/alebo inaktivácia podaním aktívneho čierneho uhlia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antiparkinsoniká, iné dopaminergické liečivá, ATC kód: [zatiaľ nepridelený]
Mechanizmus účinkuOpikapón je periférny, selektívny a reverzibilný inhibítor katechol-
O-metyltransferázy (COMT)
s vysokou (sub-pikomolárnou) afinitou väzby, ktorá vedie k pomalej disociačnej konštante komplexu a dlho trvajúcemu účinku (> 24 hodín)
in vivo.
V prítomnosti inhibítora DOPA dekarboxylázy (DDCI) sa stáva COMT hlavným metabolizujúcim enzýmom levodopy a katalyzuje jej premenu na 3-
O-metyldopu (3-OMD) v mozgu a v periférnej nervovej sústave. U pacientov užívajúcich levodopu a periférne DDCI, ako je karbidopa alebo benserazid, zvyšuje opikapón plazmatické hladiny levodopy a tým zlepšuje klinickú odpoveď na levodopu.
Farmakodynamickéúčinky
Po podaní 50 mg opikapónu zdravým osobám preukázal opikapón výraznú (> 90%) a dlho trvajúcu
(> 24 hodín) inhibíciu COMT.
V ustálenom stave opikapón 50 mg po jednorazovom perorálnom podaní buď 100/25 mg levodopy/karbidopy alebo 100/25 mg levodopy/benserazidu 12 h po dávke opikapónu významne zvýšil mieru systémovej expozície levodopy o približne 2-násobok v porovnaní s placebom.
Klinická účinnosť abezpečnosťÚčinnosť a bezpečnosť opikapónu sa preukázala až počas 15 týždňov v dvoch dvojito zaslepených,
placebom a aktívne (len štúdia 1) kontrolovaných štúdií 3. fázy u 1 027 randomizovaných dospelých pacientov s Parkinsonovou chorobou liečených levodopou/DDCI (samostatne alebo v kombinácii
s inými antiparkinsonikami) a motorickými fluktuáciami na konci efektu dávky. Pri skríningu bol
priemerný vek podobný vo všetkých liečebných skupinách a to v rozsahu od 61,5 do 65,3 rokov. Pacienti mali stupne závažnosti ochorenia 1 až 3 (modifikované podľa stupnice Hoehna a Yahra) v stave „ON“ (dostatočná kontrola). Títo pacienti boli liečení 3 až 8 dennými dávkami levodopy/DDCI a mali priemerný čas „OFF“ (nedostatočná kontrola) najmenej 1,5 h. V oboch štúdiách bolo
783 pacientom podávaných 25 mg alebo 50 mg opikapónu alebo placebo. V štúdii 1 bolo
122 pacientov liečených opikapónom 5 mg a 122 pacientov bolo liečených a entakaponóm 200 mg (aktívny komparátor). Väčšina pacientov liečených v oboch pivotných štúdiách bolo liečených levodopou/DDCI s okamžitým uvoľňovaním. V kombinovaných štúdiách 3. fázy bolo 60 pacientov, ktorí používali prevažne levodopu s riadeným uvoľňovaním (t.j. > 50% ich liekov levodopy/DDCI), z ktorých 48 bolo liečených výlučne liekmi levodopy s riadeným uvoľňovaním. Aj keď neexistuje
dôkaz, že by bola účinnosť alebo bezpečnosť opikapónu ovplyvnená používaním levodopy s riadeným uvoľňovaním, skúsenosti s takýmito liekmi sú obmedzené.
Pre opikapón bola počas dvojito zaslepenej liečby preukázaná klinická účinnosť prevyšujúca placebo, a to ako pre primárnu premennú hodnotu účinnosti použitú v oboch štúdiách, t. j. skrátenie času
„OFF“ (tabuľka 2), pomer pacientov odpovedajúcich časom „OFF“ (t.j. pacientov, u ktorých došlo ku skráteniu času „OFF“ aspoň o 1 hodinu od východiskovej hodnoty po koniec štúdie) (tabuľka 3), ako aj pre väčšinu sekundárnych koncových bodov odvodených zo záznamov.
Zníženie priemeru najmenších štvorcov (
Least Squares, LS) absolútneho času „OFF“ od východiskovej hodnoty po koniec štúdie bolo v skupine s entakapónom -78,7 minút. Rozdiel v zmene priemeru LS času „OFF“ medzi entakapónom a placebom v štúdii 1 bol -30,5 minút. Rozdiel v zmene priemeru LS času „OFF“ medzi opikapónom 50 mg a entakapónom bol -24,8 minút a bola dokázaná porovnateľnosť opikapónu 50 mg s entakapónom (95 % interval spoľahlivosti: -61,4;11,8).
 Tabuľka 2 - Zmena absolútnych časov „OFF“ a „ON“ (minúty) od východiskového stavu do konca štúdie
Tabuľka 2 - Zmena absolútnych časov „OFF“ a „ON“ (minúty) od východiskového stavu do konca štúdie Liečba
Liečba N Priemer LS 95% IS Hodnota p
Štúdia1Zmena času “OFF”Placebo 121 -48,3 -- -- OPC 5 mg 122 -77,6 -- -- OPC 25 mg 119 -73,2 -- -- OPC 50 mg 115 -103,6 -- -- OPC 5 mg – placebo -- -29,3 -65,5; 6,8 0,0558
OPC 25 mg – placebo -- -25,0 -61,5; 11,6 0,0902
OPC 50 mg – placebo -- -55,3 -92,0; -18,6 0,0016
Zmena celkového času „ON“ bez obťažujúcich dyskinézaPlacebo 121 40,0 -- -- OPC 5 mg 122 75,6 -- -- OPC 25 mg 119 78,6 -- -- OPC 50 mg 115 100,8 -- --

 L
i
ečba
L
i
ečba N Priemer LS 95% IS Hodnota p
OPC 5 mg – placebo -- 35,6 -2,5; 73,7 0,0670
OPC 25 mg – placebo -- 38,6 0,2; 77,0 0,0489
OPC 50 mg – placebo -- 60,8 22,1; 99,6 0,0021
Štúdia2Zmena času “OFF”Placebo 136 -54,6 -- -- OPC 25 mg 125 -93,2 -- -- OPC 50 mg 150 -107,0 -- -- OPC 25 mg – placebo -- -38,5 -77,0; -0,1 0,0900
OPC 50 mg – placebo -- -52,4 -89,1; -15,7 0,0101
Zmena celkového času „ON“ bez obťažujúcich dyskinézaPlacebo 136 37,9 -- -- OPC 25 mg 125 79,7 -- -- OPC 50 mg 150 77,6 -- -- OPC 25 mg – placebo -- 41,8 0,7; 82,9 0,0839

OPC 50 mg – placebo -- 39,7 0,5; 78,8 0,0852
IS = interval spoľahlivosti, LS priemer = priemer najmenších štvorcov (
Least Squares), N = počet nechýbajúcich hodnôt, OPC = opikapón.
a. Čas „ON“ bez obťažujúcich dyskinéz = čas „ON“ s neobťažujúcimi dyskinézami + čas „ON“ bez dyskinéz
 Tabuľka 3 - Miery pacientov odpovedajúcich časmi „OFF“ na konci štúdie
Tabuľka 3 - Miery pacientov odpovedajúcich časmi „OFF“ na konci štúdie
T
yp odpovede Placebo
(
N=
121)
E
ntakapón
(
N=
122)
O
P
C 5 mg
(
N=
122)
O
P
C 25 mg
(
N=
119)
O
P
C 50 mg
(
N=
115)
 Štúdia
1
Skrátenie času
“OFF”
Štúdia
1
Skrátenie času
“OFF” Pacienti s odpoveďou, n (%)
Rozdiel oproti placebu55 (45,5) 66 (54,1) 64 (52,5) 66 (55,5) 75 (65,2)
Hodnota p -- 0,1845 0,2851 0,1176 0,0036
(95% IS) (-0,039; 0,209) (-0,056; 0,193) (-0,025; 0,229) (0,065; 0,316)
Skrátenie času
“OFF”
Pacienti s odpoveďou, n (%)
Roziel oproti placebu
65 (47,8) NA NA 74 (59,2) 89 (59,3)
Hodnota p -- -- -- 0,0506 0,0470

(95 % IS) (0,001; 0,242) (0,003; 0,232) IS = interval spoľahlivosti, N = celkový počet pacientov, n = počet pacientov s dostupnými informáciami, NA = neaplikovateľné, OPC = opikapón
Poznámka: Pacient s odpoveďou bol pacient, u ktorého došlo ku skráteniu absolútneho času „OFF“ aspoňo 1 hodinu (pacient odpovedajúci časom „OFF“).Výsledky otvoreného predĺženia štúdií trvajúceho 1 rok u 862 pacientov, ktorí pokračovali v liečbe dvojito zaslepených štúdií (otvorená štúdia 1 a otvorená štúdia 2), naznačujú udržanie účinku dosiahnutého počas dvojito zaslepeného obdobia štúdií. V otvorených štúdiách začali všetci pacienti dávkou 25 mg v prvom týždni (7 dní), nezávisle od ich predošlej liečby v dvojito zaslepenom období. Ak neboli motorické fluktuácie na konci efektu dávky dostatočne kontrolované a ak to dovolila znášanlivosť lieku, mohla sa dávka opikapónu zvýšiť na 50 mg. Ak sa pozorovali neprijateľné dopaminergické nežiaduce udalosti, upravila sa dávka levodopy. Ak to nebolo dostačujúce na zvládnutie nežiaducich udalostí, mohla sa dávka opikapónu titrovať smerom nadol. V prípade iných nežiaducich udalostí sa mohla dávka levodopy a/alebo opikapónu upraviť.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s opikapónom vo
všetkých podskupinách pediatrickej populácie s Parkinsonovou chorobou a motorickými fluktuáciami
(informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Opikapón má nízku mieru absorpcie (~ 20%). Farmakokinetické výsledky ukázali, že opikapón sa po
podaní viacnásobných až 50 mg dávok opikapónu jedenkrát denne rýchlo absorbuje s hodnotou t max
1,0 h až 2,5 h.
Distribúcia
In vitro štúdie s rozsahom koncentrácií opikapónu od 0,3 do 30 μg/ml ukázali, že väzba 14C-opikapónu
na ľudské plazmatické proteíny je vysoká (99,9%) a nezávislá od koncentrácie. Väzba 14C-opikapónu na plazmatické proteíny nebo ovplyvnená prítomnosťou warfarínu, diazepamu, digoxínu ani tolbutamidu a väzba 14C-warfarínu, 2-14-C-diazepamu, 3H-digoxínu a 14C-tolbutamidu nebola ovplyvnená prítomnosťou opikapónu ani hlavného ľudského metabolitu opikapón sulfátu.
Po perorálnom podaní bol zjavný objem distribúcie opikapónu pri dávke 50 mg 29 l s 36% variabilitou medzi jednotlivými osobami.
Biotransformácia
Sulfatácia opikapónu sa zdá byť hlavnou cestou metabolizmu u ľudí uvoľňujúc inaktívny metabolit
opikapón sulfát. Iné cesty metabolizmu zahŕňajú glukuronidáciu, metyláciu a redukciu.
Najhojnejšie vrcholové koncentrácie v plazme po jednorazovej dávke 100 mg 14C opikapónu predstavujú metabolity BIA 9-1103 (sulfát) a BIA 9-1104 (metylovaný metabolit) s 67,1% a 20,5% rádioaktívnej AUC, v uvedenom poradí. Iné metabolity sa vo väčšine plazmatických vzoriek odobraných počas klinickej štúdie hmotnostnej bilancie nenašli v merateľných koncentráciách.
Redukovaný metabolit opikapónu (zistený ako aktívny v predklinických štúdiách) je vedľajším metabolitom v ľudskej plazme a predstavuje menej než 10% celkovej systémovej expozície opikapónu.
V in vitro štúdiách s ľudskými pečeňovými mikrozómami sa pozorovala mierna inhibícia CYP1A2
a CYP2B6. Celé zníženie aktivity sa v podstate vyskytlo pri najvyšších koncentráciách opikapónu
10 μg/ml.
Opikapón inhiboval aktivitu CYP2C8 s odhadovanou hodnotou Ki 0,9 μg/ml. Štúdia u zdravých osôb ukázala priemerné zvýšenie v rýchlosti, nie však v rozsahu, o 30 % expozície repaglinidu, ktorý je substrátom CYP2C8 (pozri časť 4.5).
Opikapón znižoval aktivitu CYP2C9 prostredníctvom kompetitívneho / zmiešaného spôsobu inhibície. Avšak klinické interakčné štúdie uskutočnené s warfarínom nepreukázali žiadny účinok opikapónu na farmakodynamické vlastnosti warfarínu, ktorý je substrátom CYP2C9.
Eliminácia
U zdravých osôb bol po podaní viacnásobných až 50 mg dávok opikapónu jedenkrát denne polčas
eliminácie (t1/2 ) opikapónu 0,7 h až 3,2 h.
Po viacnásobnom podaní perorálnych dávok jedenkrát denne v rozsahu dávok 5 až 50 mg opikapónu mal opikapón sulfát dlhú terminálnu fázu s hodnotami polčasu eliminácie v rozsahu od 94 h do 122 h,
a ako následok tohto dlhého polčasu eliminácie mal opikapón sulfát vysokú mieru akumulácie v plazme s hodnotami až do 6,6.
Po perorálnom podaní je zjavný celkový telesný klírens opikapónu pri dávke 50 mg 22l/h, s 45%
variabilitou medzi jednotlivými osobami.
Po podaní jednorazovej perorálnej dávky 14C-opikapónu je hlavou cestou vylučovania opikapónu
a jeho metabolitov vylučovanie stolicou, predstavujúc 58,5% až 76,8% podanej rádioaktívnej látky (priemer 76,2%). Zvyšok rádioaktívnej látky sa vylúčil močom (priemer 12,8%) a vydýchnutým vzduchom (15,9%). V moči bol primárnym metabolitom opikapónu jeho glukuronidový metabolit, kým materská látka a iné metabolity boli vo všeobecnosti pod hranicou merateľnosti. Vo všeobecnosti sa dá vyvodiť, že obličky nie sú primárnou cestou vylučovania. Preto sa dá predpokladať, že opikapón a jeho metabolity sa vylučujú hlavne stolicou.
Linearita/nelinearita
Expozície opikapónu sa po podaní viacnásobných dávok 50 mg opikapónu jedenkrát denne zvyšovali
priamo úmerne s dávkou.
Transportéry
In vitro štúdie ukázali, že opikapón sa netransportuje prostredníctvom OATP1B1, ale prostredníctvom
OATP1B3, a efluxným transportom prostredníctvom P-gp a BCRP. BIA 9-1103, jeho hlavný metabolit, sa transportoval prostredníctvom OATP1B1 a OATP1B3 a efluxným transportom prostredníctvom BCRP, ale nie je substrátom pre efluxný transportér P-gp/MDR1.
S ohľadom na množstvá opikapónu a BIA 9-1103 bez plazmy zistené v klinických štúdiách sa nepredpokladajú žiadne interakcie s transportérmi OAT1, OAT3, OATP1B1, OATP1B3, OCT1, OCT2, BCRP, P-gp/MDR1, BSEP, MATE1 a MATE2-K. Nie je možné vylúčiť inhibíciu OATP1B1 a tento účinok sa neštudoval.
Staršie osoby (≥ 65 rokov)
Farmakokinetické vlastnosti opikapónu sa hodnotili u starších osôb (vo veku 65-78 rokov) po
7-dňovom podávaní viacnásobných 30 mg dávok. Pre staršiu populáciu sa pozoroval nárast v miere aj rozsahu systémovej expozície v porovnaní s mladšou populáciou. Inhibícia aktivity S-COMT bola
u starších osôb významne zvýšená. Rozsah tohto účinku sa nepovažuje za klinicky významný.
Telesná hmotnosť
Neexistuje vzťah medzi expozíciou opikapónu a telesnou hmotnosťou v rozmedzí 40-100 kg.
Porucha funkcie pečene
K dispozícii sú obmedzené klinické skúsenosti u pacientov so stredne ťažkou poruchou funkcie pečene
(Childova-Pughova trieda B). Farmakokinetické vlastnosti opikapónu boli hodnotené u zdravých osôb a pacientov so stredne ťažkou chronickou poruchou funkcie pečene po podaní jednorazovej 50 mg dávky. Biologická dostupnosť opikapónu bola výrazne vyššia u pacientov so stredne ťažkou chronickou poruchou funkcie pečene a nepozorovali sa žiadne bezpečnostné problémy. Keďže sa však opikapón používa ako doplnková liečba k liečbe levodopou, môže sa zvážiť úprava dávky na základe možnej zosilnenej dopaminergickej odpovede levodopy a s tým spojenej znášanlivosti. Nie sú dostupné klinické skúsenosti u pacientov s ťažkou poruchou funkcie pečene (Childova-Pughova
trieda C) (pozri čas 4.2). Poruchafunkcieobličiek
Farmakokinetické vlastnosti opikapónu neboli priamo hodnotené u osôb s chronickou poruchou funkcie obličiek. Avšak vyhodnotenie s 50 mg opikapónu sa vykonalo u osôb zaradených do štúdií
3. fázy s GFR/1,73 m2 < 60 ml/min (t.j. stredne znížená kapacita renálneho vylučovania) a použitím
súhrnných údajov pre BIA 9-1103 (hlavný metabolit opikapónu). Plazmatické hladiny BIA 9-1103 neboli ovplyvnené u pacientov s chronickou poruchou funkcie obličiek, takže nie je potrebné uvažovať o žiadnej úprave dávky.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
U potkanov nemal opikapón žiadny vplyv na samčiu ani samičiu plodnosť alebo prenatálny vývoj pri
22-násobných hladinách expozícií v porovnaní s expozíciami u ľudí. U gravidných králikov bola znášanlivosť opikapónu nižšia, s maximálnymi systémovými expozíciami na úrovni alebo pod terapeutickým rozsahom. Aj keď embryofetálny vývoj nebol u králikov negatívne ovplyvnený, štúdia sa nepovažuje za prediktívnu pre hodnotenie rizika u ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly
monohydrát laktózy
sodná soľ karboxymetylškrobu, typ A predželatínovaný kukuričný škrob magnéziumstearát
Obal kapsuly
želatína
hlinitý lak indigokarmínu (E132)
erytrozín (E127)
oxid titaničitý (E171)
Atrament na potlač
šelak, propylénglykol, amoniak, hlinitý lak indigokarmínu (E132)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
HDPE fľaše: 3 roky
Blistre: 2 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne teplotné podmienky na uchovávanie. Blistre: Uchovávajte v pôvodnom blistri na ochranu pred vlhkosťou.
HDPE fľaša: Fľašu udržiavajte dôkladne uzatvorenú na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah baleniaBiele fľaše z polyetylénu s vysokou hustotou (HDPE) s polypropylénovým (PP) detským bezpečnostným uzáverom obsahujúce 10 alebo 30 kapsúl.
OPA/Al/PVC//Al blistre obsahujúce 10 alebo 30 kapsúl. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBial - Portela & Cª, S.A.
À Av. da Siderurgia Nacional
4745-457 S. Mamede do Coronado
Portugalsko
Tel:+351 22 986 61 00
Fax: +351 22 986 61 90
e-mail:
info@bial.com8. REGISTRAČNÉ ČÍSLOEU/1/15/1066/001
EU/1/15/1066/008-010
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUOngentys 50 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá tvrdá kapsula obsahuje 50 mg opikapónu.
PomocnálátkasoznámymúčinkomKaždá tvrdá kapsula obsahuje 148,2 mg laktózy (ako monohydrát).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMATvrdá kapsula (kapsula)
Tmavomodré kapsuly veľkosti 1, s rozmerom približne 19 mm s vytlačeným označením „OPC 50“ na viečku a „Bial“ na tele kapsuly.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieOngentys je indikovaný ako doplnková liečba k inhibítorom levodopa/DOPA dekarboxylázy (DDCI) dospelým pacientom s Parkinsonovou chorobou a s motorickými fluktuáciami na konci efektu dávky, ktorí sa nemôžu stabilizovať pomocou týchto kombinácií.
4.2 Dávkovanie a spôsob podávaniaDávkovanieOdporúčaná dávka opikapónu je 50 mg.
Ongentys sa má užívať jedenkrát denne pred spaním, najmenej jednu hodinu pred alebo po kombináciách levodopy.
Úprava dávkovania pri antiparkinsonickej liečbeOpikapón zosilňuje účinok levodopy. V dôsledku toho je často potrebné upraviť dávku levodopy v priebehu prvých dní až týždňov po začatí liečby opikapónom (pozri časť 4.4).
Vynechaná dávkaAk sa vynechá jedna dávka, má sa užiť ďalšia plánovaná dávka. Pacient nemá užiť dodatočnú dávku, aby nahradil vynechanú dávku.
Osobitné skupiny pacientovStaršie osoby
U starších pacientov nie je potrebná žiadna úprava dávky (pozri časť 5.2).
U pacientov vo veku ≥ 85 rokov je potrebná opatrnosť, keďže u tejto vekovej skupiny sú k dispozícii iba obmedzené údaje.
Porucha funkcie obličiek
U pacientov s poruchou funkcie obličiek nie je potrebná žiadna úprava dávky, keďže opikapón sa nevylučuje obličkami (pozri časť 5.2).
Porucha funkcie pečene
U pacientov s miernou poruchou funkcie pečene nie je potrebná žiadna úprava dávky
(Childova-Pughova trieda A).
K dispozícii sú iba obmedzené klinické skúsenosti u pacientov so stredne ťažkou poruchou funkcie pečene (Childova-Pughova trieda B). U týchto pacientov je potrebná opatrnosť a môže byť potrebná úprava dávky (pozri časť 5.2).
Nie sú k dispozícii klinické skúsenosti u pacientov s ťažkou poruchou funkcie pečene (Childova-
Pughova trieda C), preto sa používanie Ongentysu u týchto pacientov neodporúča (pozri časť 5.2).
Pediatrická populácia
Použitie Ongentysu sa netýka pediatrickej populácie s Parkinsonovou chorobou a motorickými fluktuáciami.
Spôsob podávania
Perorálne použitie.
Kapsuly sa majú prehltnúť celé, s vodou.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Feochromocytóm, paraganglióm alebo iné nádory vylučujúce katecholamín.
Anamnéza zhubného neuroletpického syndrómu a/alebo netraumatickej rabdomyolýzy.
Súbežné používanie s inhibítormi monoaminooxidázy (MAO-A a MAO-B) (napr. fenelzín, tranylcypromín a moklobemid) inými, než určenými na liečbu Parkinsonovej choroby (pozri časť 4.5).
4.4 Osobitné upozornenia a opatrenia pri používaní
Úprava dávkovania pri antiparkinsonickej liečbe
Ongentys sa má podávať ako doplnková liečba k liečbe levodopou. Takže opatrenia platné pre liečbu
levodopou sa majú vziať do úvahy aj pre Ongentys. Opikapón zosilňuje účinok levodopy. Na zníženie dopaminergických nežiaducich reakcií súvisiacich s levodopou (napr. dyskinéza, halucinácie,
nevoľnosť, vracanie a ortostatická hypotenzia) je často potrebná úprava dennej dávky levodopy
predĺžením dávkovacích intervalov a/alebo znížením dávky levodopy, a to podľa klinického stavu pacienta počas prvých dní až prvých týždňov po začatí liečby Ongentysom (pozri časť 4.2).
Ak sa preruší liečba Ongentysom, je potrebné upraviť dávku ostatných antiparkinsonických liekov, a to hlavne levodopy, aby sa dosiahla dostatočná hladina na kontrolu príznakov.
Psychické poruchy
Pacienti a opatrovatelia sa majú oboznámiť zo skutočnosťou, že u pacientov liečených agonistami
dopamínu a/alebo inými dopaminergickými liekmi sa môžu vyskytnúť poruchy kontroly impulzov
vrátane patologického hráčstva, zvýšeného libida, hypersexuality, chorobného míňania alebo nakupovania, hltavého a chorobného jedenia. Pacienti majú byť pravidelne monitorovaní z dôvodu vývoja porúch kontroly impulzov a ak sa vyvinú takéto príznaky, odporúča sa prehodnotiť liečbu.
Iné
V štúdiách s nitrokatecholovými inhibítormi katechol-O-metyltransferázy (COMT) sa hlásili zvýšené
hladiny pečeňových enzýmov. U pacientov, u ktorých sa vyskytne progresívna anorexia, asténia a znížená telesná hmotnosť v priebehu relatívne krátkeho obdobia sa má zvážiť celkové lekárske
prehodnotenie vrátane funkcie pečene.
Intolerancia pomocných látok
Ongentys obsahuje laktózu. Pacienti s dedičnými problémami intolerancie galaktózy, laponskou
deficienciou laktózy alebo glukózo-galaktózovou malabsorpciou nesmú užívať Ongentys.
4.5 Liekové a iné interakcie
Inhibítory monoaminooxidázy (MAO)
Kombinácia opikapónu a inhibítorov MAO môže mať za následok inhibíciu väčšiny ciest
zodpovedných za metabolizmus katecholamínov. Preto je súbežné používanie opikapónu s inhibítormi
MAO (napr. fenelzín, tranylcypromín a moklobemid) inými, než určenými na liečbu Parkinsonovej choroby, kontraindikované.
Súbežné používanie opikapónu a inhibítorov MAO na liečbu Parkinsonovej choroby, napr. rasagilín
(až 1 mg/deň) a selegilín (až 10 mg/deň v perorálnych liekových formách alebo 1,25 mg/deň v liekových formách s bukálnou absorpciou) je prípustné (pozri časť 4.3).
Nie sú k dispozícii skúsenosti so súbežným používaním opikapónu s inhibítorom MAO safinamidom. Preto sa má k ich súbežnému používaniu pristupovať s primeranou opatrnosťou.
Lieky metabolizovanéCOMT
Opikapón môže ovplyvniť metabolizmus liekov obsahujúcich katecholovú skupinu, ktoré sa
metabolizujú prostredníctvom COMT, napr. rimiterol, izoprenalín, adrenalín, noradrenalín, dopamín, dopexamín alebo dobutamín, čo vedie k zosilneným účinkom týchto liekov. Pri používaní opikapónu
sa odporúča pozorné sledovanie pacientov, ktorí sa liečia týmito liekmi.
Tricyklické antidepresíva a inhibítory reabsorpcie noradrenalínu
K dispozícii sú len obmedzené skúsenosti s opikapónom používaným súbežne s tricyklickými
antidepresívami a inhibítormi reabsorpcie noradrenalínu (napr. venlafaxín, maprotilín a desipramín). Preto sa má k ich súbežnému používaniu pristupovať s primeranou opatrnosťou.
Repaglinid
Opikapón je slabým inhibítorom CYP2C8. Štúdia u zdravých osôb používajúcich dávku 25 mg,
a menej ako optimálnu liekovú formu ukázala pri súbežnom podávaní (t.j. pri podávaní v rovnaký čas)
s opikapónom priemerné zvýšenie miery expozície repaglinidu o 30%, nie však jej rozsahu, čo je najpravdepodobnejšie spôsobené inhibíciou CYP2C8. Preto treba obzvlášť zvážiť používanie liekov metabolizovaných CYP2C8 a je potrebné sa vyhnúť ich súbežnému podávaniu.
Substráty OATP1B1
Opikapón je slabým inhibítorom OATP1B1. Nie sú k dispozícii skúsenosti so súbežným používaním
opikapónu so substrátmi OATP1B1. Liekom transportovaným pomocou OATP1B1 sa má preto
venovať osobitná pozornosť a k ich súbežnému používaniu sa má pristupovať s primeranou opatrnosťou.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití opikapónu u gravidných žien.
Štúdie na zvieratách sú nedostatočné z hľadiska reprodukčnej toxicity (pozri časť 5.3). Ongentys sa neodporúča užívať počas gravidity a u žien vo fertilnom veku nepoužívajúcich antikoncepciu.
Dojčenie
Nie je známe, či sa opikapón alebo jeho metabolity vylučujú do ľudského mlieka. Riziko
u novorodencov/dojčiat nemôže byť vylúčené. Dojčenie má byť počas liečby Ongentysom ukončené.
Fertilita
Účinky opikapónu na fertilitu u ľudí sa neskúmali. Štúdie na zvieratách s opikapónom nepreukázali
priame alebo nepriame účinky z hľadiska fertility (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Opikapón v spojení s levodopou môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Opikapón môže v spojení s levodopou spôsobovať závrat, symptomatickú ortostatickú hypotenziu a ospalosť. Preto sa má pri vedení vozidiel a obsluhe strojov dodržiavať opatrnosť.
4.8 Nežiaduce účinky
Súhrn údajovobezpečnosti
Najčastejšie hlásenými nežiaducimi reakciami boli poruchy nervového systému. Dyskinéza bola
najčastejšie hlásenou nežiaducou reakciou vyskytujúcou sa počas liečby (17,7%).
Tabuľkový zoznamnežiaducichreakcií
V tabuľke nižšie (tabuľka 1) sú všetky nežiaduce reakcie uvedené podľa tried orgánových systémov
a frekvencie.
Frekvencie sú definované nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000) veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
Tabuľka 1 - Frekvencie nežiaducich reakcií (MedDRA) v placebom kontrolovaných štúdiách
3. fázy
T
rieda orgánových systémov
P
oruchy metabolizmu
a výživy
V
eľmi časté Časté Menej časté
znížená chuť do jedla, hypertriglyceridémia
P
sychické poruchy abnormálne sny, halucinácie, zrakové halucinácie, nespavosť
úzkosť, depresia, zvukové halucinácie, nočné mory, poruchy spánku
P
oruchy nervového systému
dyskinéza závraty, bolesť hlavy, ospalosť
dysgeúzia, hyperkinéza, synkopa
 P
oruchy oka
P
oruchy oka suché oči
P
oruchy ucha a labyrintu Poruchy srdca a srdcovej činnosti
upchatie ucha palpitácie
P
oruchy ciev ortostatická hypotenzia hypertenzia, hypotenzia
P
oruchy dýchacej sústavy, hrudníka a mediastína
P
oruchy gastrointestinálneho traktu

zápcha, sucho
v ústach, vracanie
dýchavičnosť
abdominálna distenzia, bolesť brucha, bolesť hornej časti brucha, dyspepsia
P
oruchy kostrovej
a svalovej sústavy
a spojivového tkaniva
P
oruchy obličiek
a močových ciest
svalové kŕče svalové zášklby, stuhnutosť svalov
a kostí, myalgia, bolesť končatín chromatúria, noktúria
L
aboratórne a funkčné
vyšetrenia
zvýšená hladina kreatinín fosfokinázy v krvi
znížená telesná hmotnosť
H
l
ásenie
podozrení
na
nežiaduce
r
eakcie
'

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNie je známe žiadne špecifické antidotum. Má sa podať príslušná symptomatická a podporná liečba. Má sa zvážiť odstránenie opikapónu výplachom žalúdka a/alebo inaktivácia podaním aktívneho čierneho uhlia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antiparkinsoniká, iné dopaminergické liečivá, ATC kód: [zatiaľ nepridelený]
Mechanizmus účinkuOpikapón je periférny, selektívny a reverzibilný inhibítor katechol-
O-metyltransferázy (COMT)
s vysokou (sub-pikomolárnou) afinitou väzby, ktorá vedie k pomalej disociačnej konštante komplexu a dlho trvajúcemu účinku (> 24 hodín)
in vivo.
V prítomnosti inhibítora DOPA dekarboxylázy (DDCI) sa stáva COMT hlavným metabolizujúcim enzýmom levodopy a katalyzuje jej premenu na 3-
O-metyldopu (3-OMD) v mozgu a v periférnej nervovej sústave. U pacientov užívajúcich levodopu a periférne DDCI, ako je karbidopa alebo benserazid, zvyšuje opikapón plazmatické hladiny levodopy a tým zlepšuje klinickú odpoveď na levodopu.
Farmakodynamickéúčinky
Po podaní 50 mg opikapónu zdravým osobám preukázal opikapón výraznú (> 90%) a dlho trvajúcu
(> 24 hodín) inhibíciu COMT.
V ustálenom stave opikapón 50 mg po jednorazovom perorálnom podaní buď 100/25 mg levodopy/karbidopy alebo 100/25 mg levodopy/benserazidu 12 h po dávke opikapónu významne zvýšil mieru systémovej expozície levodopy o približne 2-násobok v porovnaní s placebom.
Klinická účinnosť abezpečnosťÚčinnosť a bezpečnosť opikapónu sa preukázala až počas 15 týždňov v dvoch dvojito zaslepených,
placebom a aktívne (len štúdia 1) kontrolovaných štúdií 3. fázy u 1 027 randomizovaných dospelých pacientov s Parkinsonovou chorobou liečených levodopou/DDCI (samostatne alebo v kombinácii
s inými antiparkinsonikami) a motorickými fluktuáciami na konci efektu dávky. Pri skríningu bol
priemerný vek podobný vo všetkých liečebných skupinách a to v rozsahu od 61,5 do 65,3 rokov. Pacienti mali stupne závažnosti ochorenia 1 až 3 (modifikované podľa stupnice Hoehna a Yahra) v stave „ON“ (dostatočná kontrola). Títo pacienti boli liečení 3 až 8 dennými dávkami levodopy/DDCI a mali priemerný čas „OFF“ (nedostatočná kontrola) najmenej 1,5 h. V oboch štúdiách bolo
783 pacientom podávaných 25 mg alebo 50 mg opikapónu alebo placebo. V štúdii 1 bolo
122 pacientov liečených opikapónom 5 mg a 122 pacientov bolo liečených a entakaponóm 200 mg (aktívny komparátor). Väčšina pacientov liečených v oboch pivotných štúdiách bolo liečených levodopou/DDCI s okamžitým uvoľňovaním. V kombinovaných štúdiách 3. fázy bolo 60 pacientov, ktorí používali prevažne levodopu s riadeným uvoľňovaním (t.j. > 50% ich liekov levodopy/DDCI), z ktorých 48 bolo liečených výlučne liekmi levodopy s riadeným uvoľňovaním. Aj keď neexistuje
dôkaz, že by bola účinnosť alebo bezpečnosť opikapónu ovplyvnená používaním levodopy s riadeným uvoľňovaním, skúsenosti s takýmito liekmi sú obmedzené.
Pre opikapón bola počas dvojito zaslepenej liečby preukázaná klinická účinnosť prevyšujúca placebo, a to ako pre primárnu premennú hodnotu účinnosti použitú v oboch štúdiách, t. j. skrátenie času
„OFF“ (tabuľka 2), pomer pacientov odpovedajúcich časom „OFF“ (t.j. pacientov, u ktorých došlo ku skráteniu času „OFF“ aspoň o 1 hodinu od východiskovej hodnoty po koniec štúdie) (tabuľka 3), ako aj pre väčšinu sekundárnych koncových bodov odvodených zo záznamov.
Zníženie priemeru najmenších štvorcov (
Least Squares, LS) absolútneho času „OFF“ od východiskovej hodnoty po koniec štúdie bolo v skupine s entakapónom -78,7 minút. Rozdiel v zmene priemeru LS času „OFF“ medzi entakapónom a placebom v štúdii 1 bol -30,5 minút. Rozdiel v zmene priemeru LS času „OFF“ medzi opikapónom 50 mg a entakapónom bol -24,8 minút a bola dokázaná porovnateľnosť opikapónu 50 mg s entakapónom (95 % interval spoľahlivosti: -61,4;11,8).
 Tabuľka 2 - Zmena absolútnych časov „OFF“ a „ON“ (minúty) od východiskového stavu do konca štúdie
Tabuľka 2 - Zmena absolútnych časov „OFF“ a „ON“ (minúty) od východiskového stavu do konca štúdie Liečba
Liečba N Priemer LS 95% IS Hodnota p
Štúdia1Zmena času “OFF”Placebo 121 -48,3 -- -- OPC 5 mg 122 -77,6 -- -- OPC 25 mg 119 -73,2 -- -- OPC 50 mg 115 -103,6 -- -- OPC 5 mg – placebo -- -29,3 -65,5; 6,8 0,0558
OPC 25 mg – placebo -- -25,0 -61,5; 11,6 0,0902
OPC 50 mg – placebo -- -55,3 -92,0; -18,6 0,0016
Zmena celkového času „ON“ bez obťažujúcich dyskinézaPlacebo 121 40,0 -- -- OPC 5 mg 122 75,6 -- -- OPC 25 mg 119 78,6 -- -- OPC 50 mg 115 100,8 -- --

 L
i
ečba
L
i
ečba N Priemer LS 95% IS Hodnota p
OPC 5 mg – placebo -- 35,6 -2,5; 73,7 0,0670
OPC 25 mg – placebo -- 38,6 0,2; 77,0 0,0489
OPC 50 mg – placebo -- 60,8 22,1; 99,6 0,0021
Štúdia2Zmena času “OFF”Placebo 136 -54,6 -- -- OPC 25 mg 125 -93,2 -- -- OPC 50 mg 150 -107,0 -- -- OPC 25 mg – placebo -- -38,5 -77,0; -0,1 0,0900
OPC 50 mg – placebo -- -52,4 -89,1; -15,7 0,0101
Zmena celkového času „ON“ bez obťažujúcich dyskinézaPlacebo 136 37,9 -- -- OPC 25 mg 125 79,7 -- -- OPC 50 mg 150 77,6 -- -- OPC 25 mg – placebo -- 41,8 0,7; 82,9 0,0839

OPC 50 mg – placebo -- 39,7 0,5; 78,8 0,0852
IS = interval spoľahlivosti, LS priemer = priemer najmenších štvorcov (
Least Squares), N = počet nechýbajúcich hodnôt, OPC = opikapón.
a. Čas „ON“ bez obťažujúcich dyskinéz = čas „ON“ s neobťažujúcimi dyskinézami + čas „ON“ bez dyskinéz
 Tabuľka 3 - Miery pacientov odpovedajúcich časmi „OFF“ na konci štúdie
Tabuľka 3 - Miery pacientov odpovedajúcich časmi „OFF“ na konci štúdie
T
yp odpovede Placebo
(
N=
121)
E
ntakapón
(
N=
122)
O
P
C 5 mg
(
N=
122)
O
P
C 25 mg
(
N=
119)
O
P
C 50 mg
(
N=
115)
 Štúdia
1
Skrátenie času
“OFF”
Štúdia
1
Skrátenie času
“OFF” Pacienti s odpoveďou, n (%)
Rozdiel oproti placebu55 (45,5) 66 (54,1) 64 (52,5) 66 (55,5) 75 (65,2)
Hodnota p -- 0,1845 0,2851 0,1176 0,0036
(95% IS) (-0,039; 0,209) (-0,056; 0,193) (-0,025; 0,229) (0,065; 0,316)
Skrátenie času
“OFF”
Pacienti s odpoveďou, n (%)
Roziel oproti placebu
65 (47,8) NA NA 74 (59,2) 89 (59,3)
Hodnota p -- -- -- 0,0506 0,0470

(95 % IS) (0,001; 0,242) (0,003; 0,232) IS = interval spoľahlivosti, N = celkový počet pacientov, n = počet pacientov s dostupnými informáciami, NA = neaplikovateľné, OPC = opikapón
Poznámka: Pacient s odpoveďou bol pacient, u ktorého došlo ku skráteniu absolútneho času „OFF“ aspoňo 1 hodinu (pacient odpovedajúci časom „OFF“).Výsledky otvoreného predĺženia štúdií trvajúceho 1 rok u 862 pacientov, ktorí pokračovali v liečbe dvojito zaslepených štúdií (otvorená štúdia 1 a otvorená štúdia 2), naznačujú udržanie účinku dosiahnutého počas dvojito zaslepeného obdobia štúdií. V otvorených štúdiách začali všetci pacienti dávkou 25 mg v prvom týždni (7 dní), nezávisle od ich predošlej liečby v dvojito zaslepenom období. Ak neboli motorické fluktuácie na konci efektu dávky dostatočne kontrolované a ak to dovolila znášanlivosť lieku, mohla sa dávka opikapónu zvýšiť na 50 mg. Ak sa pozorovali neprijateľné dopaminergické nežiaduce udalosti, upravila sa dávka levodopy. Ak to nebolo dostačujúce na zvládnutie nežiaducich udalostí, mohla sa dávka opikapónu titrovať smerom nadol. V prípade iných nežiaducich udalostí sa mohla dávka levodopy a/alebo opikapónu upraviť.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s opikapónom vo
všetkých podskupinách pediatrickej populácie s Parkinsonovou chorobou a motorickými fluktuáciami
(informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Opikapón má nízku mieru absorpcie (~ 20%). Farmakokinetické výsledky ukázali, že opikapón sa po
podaní viacnásobných až 50 mg dávok opikapónu jedenkrát denne rýchlo absorbuje s hodnotou t max
1,0 h až 2,5 h.
Distribúcia
In vitro štúdie s rozsahom koncentrácií opikapónu od 0,3 do 30 μg/ml ukázali, že väzba 14C-opikapónu
na ľudské plazmatické proteíny je vysoká (99,9%) a nezávislá od koncentrácie. Väzba 14C-opikapónu na plazmatické proteíny nebo ovplyvnená prítomnosťou warfarínu, diazepamu, digoxínu ani tolbutamidu a väzba 14C-warfarínu, 2-14-C-diazepamu, 3H-digoxínu a 14C-tolbutamidu nebola ovplyvnená prítomnosťou opikapónu ani hlavného ľudského metabolitu opikapón sulfátu.
Po perorálnom podaní bol zjavný objem distribúcie opikapónu pri dávke 50 mg 29 l s 36% variabilitou medzi jednotlivými osobami.
Biotransformácia
Sulfatácia opikapónu sa zdá byť hlavnou cestou metabolizmu u ľudí uvoľňujúc inaktívny metabolit
opikapón sulfát. Iné cesty metabolizmu zahŕňajú glukuronidáciu, metyláciu a redukciu.
Najhojnejšie vrcholové koncentrácie v plazme po jednorazovej dávke 100 mg 14C opikapónu predstavujú metabolity BIA 9-1103 (sulfát) a BIA 9-1104 (metylovaný metabolit) s 67,1% a 20,5% rádioaktívnej AUC, v uvedenom poradí. Iné metabolity sa vo väčšine plazmatických vzoriek odobraných počas klinickej štúdie hmotnostnej bilancie nenašli v merateľných koncentráciách.
Redukovaný metabolit opikapónu (zistený ako aktívny v predklinických štúdiách) je vedľajším metabolitom v ľudskej plazme a predstavuje menej než 10% celkovej systémovej expozície opikapónu.
V in vitro štúdiách s ľudskými pečeňovými mikrozómami sa pozorovala mierna inhibícia CYP1A2
a CYP2B6. Celé zníženie aktivity sa v podstate vyskytlo pri najvyšších koncentráciách opikapónu
10 μg/ml.
Opikapón inhiboval aktivitu CYP2C8 s odhadovanou hodnotou Ki 0,9 μg/ml. Štúdia u zdravých osôb ukázala priemerné zvýšenie v rýchlosti, nie však v rozsahu, o 30 % expozície repaglinidu, ktorý je substrátom CYP2C8 (pozri časť 4.5).
Opikapón znižoval aktivitu CYP2C9 prostredníctvom kompetitívneho / zmiešaného spôsobu inhibície. Avšak klinické interakčné štúdie uskutočnené s warfarínom nepreukázali žiadny účinok opikapónu na farmakodynamické vlastnosti warfarínu, ktorý je substrátom CYP2C9.
Eliminácia
U zdravých osôb bol po podaní viacnásobných až 50 mg dávok opikapónu jedenkrát denne polčas
eliminácie (t1/2 ) opikapónu 0,7 h až 3,2 h.
Po viacnásobnom podaní perorálnych dávok jedenkrát denne v rozsahu dávok 5 až 50 mg opikapónu mal opikapón sulfát dlhú terminálnu fázu s hodnotami polčasu eliminácie v rozsahu od 94 h do 122 h,
a ako následok tohto dlhého polčasu eliminácie mal opikapón sulfát vysokú mieru akumulácie v plazme s hodnotami až do 6,6.
Po perorálnom podaní je zjavný celkový telesný klírens opikapónu pri dávke 50 mg 22l/h, s 45%
variabilitou medzi jednotlivými osobami.
Po podaní jednorazovej perorálnej dávky 14C-opikapónu je hlavou cestou vylučovania opikapónu
a jeho metabolitov vylučovanie stolicou, predstavujúc 58,5% až 76,8% podanej rádioaktívnej látky (priemer 76,2%). Zvyšok rádioaktívnej látky sa vylúčil močom (priemer 12,8%) a vydýchnutým vzduchom (15,9%). V moči bol primárnym metabolitom opikapónu jeho glukuronidový metabolit, kým materská látka a iné metabolity boli vo všeobecnosti pod hranicou merateľnosti. Vo všeobecnosti sa dá vyvodiť, že obličky nie sú primárnou cestou vylučovania. Preto sa dá predpokladať, že opikapón a jeho metabolity sa vylučujú hlavne stolicou.
Linearita/nelinearita
Expozície opikapónu sa po podaní viacnásobných dávok 50 mg opikapónu jedenkrát denne zvyšovali
priamo úmerne s dávkou.
Transportéry
In vitro štúdie ukázali, že opikapón sa netransportuje prostredníctvom OATP1B1, ale prostredníctvom
OATP1B3, a efluxným transportom prostredníctvom P-gp a BCRP. BIA 9-1103, jeho hlavný metabolit, sa transportoval prostredníctvom OATP1B1 a OATP1B3 a efluxným transportom prostredníctvom BCRP, ale nie je substrátom pre efluxný transportér P-gp/MDR1.
S ohľadom na množstvá opikapónu a BIA 9-1103 bez plazmy zistené v klinických štúdiách sa nepredpokladajú žiadne interakcie s transportérmi OAT1, OAT3, OATP1B1, OATP1B3, OCT1, OCT2, BCRP, P-gp/MDR1, BSEP, MATE1 a MATE2-K. Nie je možné vylúčiť inhibíciu OATP1B1 a tento účinok sa neštudoval.
Staršie osoby (≥ 65 rokov)
Farmakokinetické vlastnosti opikapónu sa hodnotili u starších osôb (vo veku 65-78 rokov) po
7-dňovom podávaní viacnásobných 30 mg dávok. Pre staršiu populáciu sa pozoroval nárast v miere aj rozsahu systémovej expozície v porovnaní s mladšou populáciou. Inhibícia aktivity S-COMT bola
u starších osôb významne zvýšená. Rozsah tohto účinku sa nepovažuje za klinicky významný.
Telesná hmotnosť
Neexistuje vzťah medzi expozíciou opikapónu a telesnou hmotnosťou v rozmedzí 40-100 kg.
Porucha funkcie pečene
K dispozícii sú obmedzené klinické skúsenosti u pacientov so stredne ťažkou poruchou funkcie pečene
(Childova-Pughova trieda B). Farmakokinetické vlastnosti opikapónu boli hodnotené u zdravých osôb a pacientov so stredne ťažkou chronickou poruchou funkcie pečene po podaní jednorazovej 50 mg dávky. Biologická dostupnosť opikapónu bola výrazne vyššia u pacientov so stredne ťažkou chronickou poruchou funkcie pečene a nepozorovali sa žiadne bezpečnostné problémy. Keďže sa však opikapón používa ako doplnková liečba k liečbe levodopou, môže sa zvážiť úprava dávky na základe možnej zosilnenej dopaminergickej odpovede levodopy a s tým spojenej znášanlivosti. Nie sú dostupné klinické skúsenosti u pacientov s ťažkou poruchou funkcie pečene (Childova-Pughova
trieda C) (pozri čas 4.2). Poruchafunkcieobličiek
Farmakokinetické vlastnosti opikapónu neboli priamo hodnotené u osôb s chronickou poruchou funkcie obličiek. Avšak vyhodnotenie s 50 mg opikapónu sa vykonalo u osôb zaradených do štúdií
3. fázy s GFR/1,73 m2 < 60 ml/min (t.j. stredne znížená kapacita renálneho vylučovania) a použitím
súhrnných údajov pre BIA 9-1103 (hlavný metabolit opikapónu). Plazmatické hladiny BIA 9-1103 neboli ovplyvnené u pacientov s chronickou poruchou funkcie obličiek, takže nie je potrebné uvažovať o žiadnej úprave dávky.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
U potkanov nemal opikapón žiadny vplyv na samčiu ani samičiu plodnosť alebo prenatálny vývoj pri
22-násobných hladinách expozícií v porovnaní s expozíciami u ľudí. U gravidných králikov bola znášanlivosť opikapónu nižšia, s maximálnymi systémovými expozíciami na úrovni alebo pod terapeutickým rozsahom. Aj keď embryofetálny vývoj nebol u králikov negatívne ovplyvnený, štúdia sa nepovažuje za prediktívnu pre hodnotenie rizika u ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly
monohydrát laktózy
sodná soľ karboxymetylškrobu, typ A predželatínovaný kukuričný škrob magnéziumstearát
Obal kapsuly
želatína
hlinitý lak indigokarmínu (E132)
erytrozín (E127)
oxid titaničitý (E171)
Atrament na potlač
šelak, oxid titaničitý (E171), propylénglykol, amoniak, simetikón
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
HDPE fľaše: 3 roky
Blistre: 2 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne teplotné podmienky na uchovávanie. Blistre: Uchovávajte v pôvodnom blistri na ochranu pred vlhkosťou.
HDPE fľaša: Fľašu udržiavajte dôkladne uzatvorenú na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah baleniaBiele fľaše z polyetylénu s vysokou hustotou (HDPE) s polypropylénovým (PP) detským bezpečnostným uzáverom obsahujúce 10, 30 alebo 90 kapsúl.
OPA/Al/PVC//Al blistre obsahujúce 10, 30 alebo 90 kapsúl. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBial - Portela & Cª, S.A.
À Av. da Siderurgia Nacional
4745-457 S. Mamede do Coronado
Portugalsko
Tel:+351 22 986 61 00
Fax: +351 22 986 61 90
e-mail:
info@bial.com8. REGISTRAČNÉ ČÍSLOEU/1/15/1066/002-007
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.