
Môže sa vyskytnúť urikemická nefropatia. Pri monitorovaní terapeutického účinku je potrebné pozorne sledovať krvný obraz v periférnej krvi a kostnú dreň pacienta.
Boli hlásené nežiaduce reakcie v podobe pankreatitídy. Pacienti majú byť informovaní o charakteristickom príznaku pankreatitídy, ktorá, ak nie je liečená, môže viesť k úmrtiu: pretrvávajúce bolesti brucha, ktoré môžu byť intenzívne a vystreľovať do oblasti chrbta. V prípade podozrenia na pankreatitídu je nutné ukončiť podávanie Oncasparu. V prípade potvrdenia pankreatitídy sa podávanie Oncasparu nesmie obnoviť. Preto majú byť po ukončení liečby pegaspargázou vykonávané vhodné vyšetrenia. Keďže nie je známa presná patogenéza, možno odporúčať len podporné opatrenia.
Je potrebné často vykonávať merania amylázy v sére, aby sa identifikovali včasné prejavy zápalu pankreasu.
V ojedinelých prípadoch bola hlásená hemoragická alebo nekrotizujúca pankreatitída vedúca k úmrtiu. Počas liečby Oncasparom sa má sledovať hladina glukózy v krvi a moči, pretože sa môže zvyšovať.
Počas liečby a najmenej 6 mesiacov po ukončení liečby Oncasparom sa musí používať účinná neperorálna antikoncepcia. Keďže nemožno vylúčiť nepriamu interakciu medzi perorálnou antikoncepciou a pegaspargázou, používanie perorálnej antikoncepcie sa nepovažuje za primeranú metódu antikoncepcie (pozri časti 4.5 a 4.6).
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na dávku, t.j. v podstate neobsahuje sodík.
4.5 Liekové a iné interakcie
Pokles hladiny proteínov v sére spôsobený pegaspargázou môže zvýšiť toxicitu iných liekov, ktoré sa viažu na proteíny.
Okrem toho môže pegaspargáza prostredníctvom inhibície syntézy proteínov a bunkového delenia narúšať mechanizmus účinku ďalších látok, ktoré k svojmu účinku potrebujú bunkové delenie, napr. metotrexátu.
Metotrexát a cytarabín môžu narúšať pôsobenie lieku rôznym spôsobom: predchádzajúce podanie týchto látok môže synergicky zvýšiť účinok Oncasparu. Ak sú tieto látky podané následne, účinok pegaspargázy môže byť antagonicky oslabený.
Pegaspargáza môže ovplyvniť metabolizmus enzýmov pri užívaní iných liekov, najmä v pečeni. Používanie Oncasparu môže viesť k výkyvom koagulačných faktorov. To môže zvýšiť sklon ku
krvácaniu a/alebo trombóze. Pri súčasnom podávaní antikoagulancií, ako sú kumarín, heparín,
dipyridamol, kyselina acetylsalicylová alebo nesteroidné protizápalové lieky, je preto potrebná opatrnosť.
Pri súčasnom podávaní glukokortikoidov (napr. prednizónu) a pegaspargázy môžu byť zmeny koagulačných parametrov (napr. pokles fibrinogénu a nedostatok antitrombínu III, ATIII) výraznejšie.
Bezprostredne predchádzajúca alebo súbežná liečba vinkristínom môže zvýšiť toxicitu pegaspargázy a riziko anafylaktických reakcií. Podávanie Oncasparu pred vinkristínom môže zvýšiť neurotoxicitu vinkristínu. Preto z dôvodu minimalizovania toxicity sa má vinkristín podávať najmenej 12 hodín pred podaním Oncasparu.
Nie je možné vylúčiť nepriamu interakciu medzi pegaspargázou a perorálnou antikoncepciou v dôsledku hepatotoxicity pegaspargázy, ktorá môže narúšať pečeňový klírens perorálnej antikoncepcie. Preto sa kombinácia Oncasparu s perorálnou antikoncepciou neodporúča. Ženy v plodnom veku majú používať inú metódu ako perorálnu antikoncepciu (pozri časti 4.4 a 4.6).
Súčasné očkovanie živými vakcínami zvyšuje riziko závažných infekcií, ktoré súvisia s imunosupresívnou aktivitou pegaspargázy a prítomnosťou základného ochorenia a kombinovanou chemoterapiou (pozri časť 4.4). Očkovanie živými vakcínami sa preto má podávať najskôr 3 mesiace po ukončení celej antileukemickej liečby.
4.6 Fertilita, gravidita a laktácia
Ženy v plodnom veku/Antikoncepcia u mužov a žien
Počas liečby a najmenej 6 mesiacov po ukončení liečby Oncasparom musia muži a ženy používať účinnú antikoncepciu. Keďže nemožno vylúčiť nepriamu interakciu medzi perorálnou antikoncepciou a pegaspargázou, perorálna antikoncepcia sa v takejto klinickej situácii nepovažuje za dostatočne bezpečnú. Ženy v plodnom veku majú používať inú metódu ako perorálnu antikoncepciu (pozri
časti 4.4 a 4.5).
Gravidita
K dispozícii sú obmedzené údaje o používaní L-asparaginázy u tehotných žien a údaje o používaní Oncasparu u tehotných žien nie sú k dispozícii. Neuskutočnili sa žiadne reprodukčné štúdie na zvieratách s pegaspargázou, ale štúdie na zvieratách s L-asparaginázou ukázali teratogenitu (pozri časť 5.3). Preto sa Oncaspar vzhľadom na svoje farmakologické vlastnosti má používať počas tehotenstva len vtedy, ak si klinický stav ženy vyžaduje liečbu pegaspargázou.
Dojčenie
Nie je známe, či sa pegaspargáza vylučuje do materského mlieka. Vzhľadom na jej farmakologické vlastnosti sa riziko pre dojčených novorodencov/dojčatá nedá vylúčiť. Ako bezpečnostné opatrenie sa má dojčenie počas liečby Oncasparom ukončiť a po jej ukončení sa nesmie znovu začať.
Fertilita
Neuskutočnili sa žiadne štúdie skúmajúce účinok pegaspargázy na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Oncaspar má veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje, pretože mení schopnosť
reakcie.
Pacientom sa má odporučiť, aby neviedli vozidlá ani neobsluhovali stroje, ak u nich dôjde k zmätenosti, somnolencii alebo iným nežiaducim reakciám, ktoré môžu zhoršiť ich schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Nežiaduce reakcie opísané v tejto časti sú získané spojením nežiaducich reakcií z údajov z klinických štúdií a skúseností pacientov s ALL po uvedení Oncasparu na trh. Analýzy bezpečnosti sa uskutočnili so zohľadnením nežiaducich reakcií na liek v rámci klinickej štúdie 1 [CCG-1962] a klinickej
štúdie 2 [AALL07P4] (pozri časť 5.1).
Tabuľkový zoznam nežiaducich reakcií
Nežiaduce reakcie a ich frekvencie sú uvedené v tabuľke 1.
Frekvencia vedľajších účinkov je definovaná podľa nasledujúcej konvencie: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Tabuľka 1: Nežiaduce reakcie hlásené pri liečbe Oncasparom
Štandardná trieda
orgánových systémov
MedDRA
Poruchy krvi
a lymfatického systému Poruchy endokrinného systému
Poruchy gastrointestinálneho traktu
Celkové poruchy a reakcie v mieste podania Poruchy pečene
a žlčových ciest
Poruchy imunitného systému
Nežiaduca reakcia
Časté: Febrilná neutropénia, anémia, koagulopatia
Neznáme: Zlyhanie kostnej drene
Veľmi časté: Hyperglykémia
Veľmi časté: Pankreatitída, hnačka, bolesť brucha, nevoľnosť
Časté: Vracanie, stomatitída
Zriedkavé: Nekrotizujúca pankreatída, hemoragická pankreatída
Neznáme: Pankreatická pseudocysta, parotitída* Neznáme: Pyrexia
Časté: Hepatotoxicita, stukovatenie pečene
Zriedkavé: Nekróza pečene, žltačka, cholestáza, zlyhanie pečene Veľmi časté: Precitlivenosť, žihľavka, anafylaktická reakcia Neznáme: Toxická epidermálna nekrolýza*
Infekcie a nákazy Časté: Infekcie, sepsa
Laboratórne a funkčné vyšetrenia
Veľmi časté: Zníženie telesnej hmotnosti
Časté: Zvýšená amyláza, zvýšená alanínaminotransferáza, zvýšený krvný bilirubín, znížený krvný albumín, znížený počet neutrofilov, znížený počet krvných doštičiek, predĺžený aktivovaný parciálny tromboplastínový čas, predĺžený protrombínový čas, hypofibrinogenémia Neznáme: Zvýšená krvná močovina, protilátky proti peraspargáze
Štandardná trieda orgánových systémov MedDRA
Poruchy metabolizmu a výživy
Poruchy kostrovej
a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest Poruchy nervového systému
Nežiaduca reakcia
Veľmi časté: Znížená chuť do jedla
Časté: Hypertriglyceridémia, hyperlipidémia, hypercholesterolémia
Neznáme: Diabetická ketoacidóza
Časté: Bolesť v končatinách
Neznáme: Akútne zlyhanie obličiek*
Časté: Záchvaty, periférna motorická neuropatia, synkopa Zriedkavé: Syndróm posteriórnej reverzibilnej leukoencefalopatie Neznáme: Ospalosť, tras*
Psychické poruchy Neznáme: Stav zmätenosti
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy kože a podkožného tkaniva
Časté: Hypoxia
Veľmi časté: Vyrážka
Poruchy ciev Časté: Trombóza**
Neznáme: Cerebrovaskulárna príhoda
*Nežiaduce účinky pozorované u iných asparagináz v skupine
**Legenda: trombóza CNS
Opis vybraných nežiaducich reakciíV súvislosti s liečbou asparaginázou sa zaznamenali nasledovné nežiaduce reakcie. Hoci tieto reakcie nie sú špecificky spojené s pegaspargázou, môžu sa prejaviť pri užívani Oncasparu:
Poruchy krvi a lymfatického systémuOncaspar môže spôsobiť miernu až stredne závažnú myelosupresiu a môžu byť postihnuté všetky tri línie krviniek.
Približne polovica všetkých závažných krvácaní a trombóz ovplyvňuje mozgové cievy a môže viesť
napr. k mozgovej príhode, záchvatu, bolesti hlavy alebo strate vedomia.
Poruchy nervového systémuOncaspar môže spôsobiť disfunkcie centrálneho nervového systému, ktoré sa prejavujú ako kŕče a menej často ako stav zmätenosti a somnolencia (mierne narušené vedomie).
V zriedkavých prípadoch sa môže vyskytnúť syndróm reverzibilnej posteriórnej leukoencefalopatie
(RPLS).
Vo veľmi zriedkavých prípadoch bol opísaný mierny tras prstov.
Poruchy gastrointestinálneho traktuPribližne u polovice pacientov sa vyskytli mierne až stredne závažné gastrointestinálne reakcie, ako napr. strata chuti do jedla, nevoľnosť, vracanie, žalúdočné kŕče, hnačka a úbytok telesnej hmotnosti. Často sa vyskytuje pankreatitída. Boli zaznamenané ojedinelé prípady tvorby pseudocýst (až do
štyroch mesiacov po poslednej liečbe).
V zriedkavých prípadoch sa vyskytuje hemoragická alebo nekrotizujúca pankreatitída. Pri liečbe L-asparaginázou bol popísaný jeden prípad pankreatitídy so súčasnou akútnou parotitídou. V ojedinelých prípadoch bola hlásená hemoragická alebo nekrotizujúca pankreatitída vedúca k úmrtiu. Počas a aj po ukončení liečby Oncasparom sa môže zvýšiť hladina amylázy v sére.
Poruchy obličiek a močových ciestPočas liečebných režimov obsahujúcich L-asparaginázu sa môže vo vzácnych prípadoch vyvinúť
akútne zlyhanie obličiek.
Poruchy kože a podkožného tkaniva
Na koži sa môžu prejaviť alergické reakcie. V súvislosti s L-asparaginázou bol popísaný jeden prípad toxickej epidermálnej nekrolýzy (Lyellov syndróm).
Poruchy endokrinného systémuČasto sa pozorujú zmeny endokrinnej funkcie pankreasu, ktoré sa prejavujú prevažne vo forme abnormálneho metabolizmu glukózy. Boli popísané prípady diabetickej ketoacidózy aj hyperosmolárnej hyperglykémie, ktoré spravidla reagujú na podanie inzulínu.
Poruchy metabolizmu a výživyPozorovala sa zmena hladiny tukov v sére a veľmi často dochádza k zmenám hodnôt tukov v sére, vo väčšine prípadov bez klinických príznakov.
Pravidelne sa vyskytuje zvýšenie hladiny močoviny v sére nezávislé od dávky, ktoré je takmer vždy prejavom prerenálnej metabolickej nerovnováhy.
Celkové poruchy a reakcie v mieste podaniaPo podaní injekcie sa môže vyskytnúť zvýšená teplota, ktorá zvyčajne spontánne ustúpi.
Poruchy imunitného systémuZistili sa špecifické protilátky proti pegaspargáze, ktoré boli menej často spojené s reakciami z precitlivenosti. Boli zaznamenané aj neutralizujúce protilátky znižujúce klinickú účinnosť.
Poruchy pečene a žlčových ciestČasté sú zmeny pečeňových ukazovateľov. Často sa tiež pozoruje zvýšenie transamináz a bilirubínu v sére, nezávislé od dávky.
Veľmi často sa pozoruje steatóza pečene. V zriedkavých prípadoch bola hlásená cholestáza, ikterus, nekróza pečeňových buniek a zlyhanie pečenie s letálnym koncom.
Porucha syntézy proteínov môže viesť k poklesu hladiny proteínov v sére. U väčšiny pacientov dochádza počas liečby k poklesu sérového albumínu nezávislého od dávky.
Typ nežiaducich reakcií Oncasparu je podobný vedľajším účinkom natívnej nepegylovanej
L-asparaginázy (napr. natívna
E. coli asparagináza).
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V4.9 PredávkovanieBolo hlásených niekoľko prípadov predávkovania Oncasparom v dôsledku náhodného podania. Po predávkovaní boli pozorované zvýšené pečeňové enzýmy, vyrážka a hyperbilirubinémia. Neexistuje žiadna špecifická farmakologická liečba predávkovania. V prípade predávkovania musia byť pacienti pozorne sledovaní pre prípad prejavov a príznakov nežiaducich reakcií a primerane liečení symptomatickou a podpornou liečbou.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antineoplastické a imunomodulačné látky, iné antineoplastické látky, ATC kód: L01XX24
Mechanizmus účinku
Mechanizmom účinku L-asparaginázy je enzymatické štiepenie aminokyseliny L-asparagínu na kyselinu asparágovú a amoniak. Deplécia L-asparagínu v krvnom sére vedie k inhibícii syntézy proteínov, syntézy DNA a syntézy RNA, najmä v leukemických blastoch, ktoré nie sú schopné syntetizovať L-asparagín a podliehajú apoptóze.
Naopak normálne bunky sú schopné syntetizovať L-asparagín a sú menej ovplyvnené jeho rýchlou depléciou počas liečby enzýmom L-asparaginázou. Pegylácia nemení enzymatické vlastnosti
L-asparaginázy, ale ovplyvňuje farmakokinetiku a imunogenicitu enzýmu.
Farmakodynamické účinky
Antileukemický účinok L-asparaginázy súvisí s trvalou depléciou L-asparaginázy. Farmakodynamika bola posudzovaná v štúdii 1 u 57 novo diagnostikovaných pediatrických pacientov s ALL so štandardným rizikom, ktorí dostali tri intramuskulárne dávky Oncasparu (2 500 U/m2), jednu v každej liečebnej fáze, t.j. vo fáze indukcie a dvoch fázach oneskorenej intenzifikácie. Farmakodynamická aktivita bola posudzovaná na základe sériových meraní asparagínu v sére (n = 57) a cerebrospinálnej tekutine (cerebrospinal fluid, CFS) (n = 50).
Klinická účinnosťa bezpečnosť
Účinnosť a bezpečnosť Oncasparu sa hodnotili na základe dvoch klinických štúdií, v ktorých bol injekčný/infúzny roztok Oncaspar použitý na liečbu prvej línie ALL: štúdie 1 u pacientov s ALL so štandardným rizikom a štúdie 2 u pacientov s ALL s vysokým rizikom.
Účinnosť Oncasparu pri ALL u pacientov s relapsujúcim alebo refraktérnym ochorením a anamnézou predchádzajúcej alergickej reakcie na natívnu E. coli L-asparaginázu bola založená na skupine 94 pacientov zo šiestich otvorených štúdií [ASP-001, ASP-201A, ASP-302, ASP-304, ASP-400 a
ASP-001C/003C].
Prvá línia (pacienti s ALL bez precitlivenosti na E. coli L-asparaginázu)
Bezpečnosť a účinnosť Oncasparu sa hodnotila v otvorenej, multicentrickej, randomizovanej, aktívne kontrolovanej štúdii (štúdia 1). V tejto štúdii bolo 118 pediatrických pacientov vo veku 1 až 9 rokov s
predtým neliečenou ALL so štandardným rizikom randomizovaných v pomere 1:1 do skupiny s Oncasparom alebo s natívnou E.coli L-asparaginázou ako súčasť kombinovanej terapie. Oncaspar bol podávaný intramuskulárne v dávke 2 500 jednotiek/m2 na 3. deň 4-týždňovej indukčnej fázy a na 3. deň každej z dvoch 8-týždňových fáz oneskorenej intenzifikácie (delayed intensification, DI). Natívna E. coli L-asparagináza bola podávaná intramuskulárne v dávke 6 000 jednotiek/m2 trikrát týždenne celkom v 9 dávkach počas indukčnej fázy a v celkom 6 dávkach počas každej fázy oneskorenej intenzifikácie.
Primárne určovanie účinnosti bolo založené na preukázaní podobnej deplécie asparagínu (rozsah a trvanie) v skupine s Oncasparom a v skupine s natívnou E.coli L-asparaginázou. Cieľom stanoveným
v protokole bolo dosiahnutie deplécie asparagínu na sérovú koncentráciu £1 mmol. Percento pacientov s týmto stupňom deplécie bolo v 2 skupinách štúdie podobné počas všetkých 3 liečebných fáz v časových bodoch stanovených v protokole.
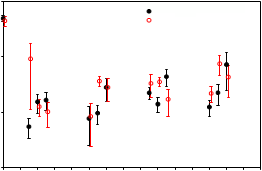
Vo všetkých fázach liečby sa sérové koncentrácie asparagínu znížili počas 4 dní od prvej dávky asparaginázy v liečebnej fáze a ostali nízke počas približne 3 týždňov v skupine s Oncasparom aj v skupine s natívnou E. coli L-asparaginázou. Na obrázku 1 sú znázornené sérové koncentrácie asparagínu počas indukčnej fázy. Schémy deplécie sérového asparagínu v 2 fázach oneskorenej intenzifikácie sú podobné ako schémy deplécie sérového asparagínu v indukčnej fáze.
Obrázok 1: Priemerná koncentrácia (± štandardná chyba) sérového asparagínu počas indukčnej fázy štúdie 1
100,0
Natívna
E. coli L-asparagináza

Oncaspar®
10,0

1,0
0,1
0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30
Dni po prvej dávke L-asparaginázyPoznámka: Oncaspar (2 500 jednotiek/m2 intramuskulárne) bol podávaný na 3. deň 4-týždňovej indukčnej fázy. Natívna
E. coli L-asparagináza (6 000 jednotiek/m2 intramuskulárne) bola podávaná 3-krát týždenne v 9 dávkach počas indukcie.
Koncentrácie asparagínu v cerebrospinálnej tekutine boli stanovené u 50 pacientov počas indukčnej fázy. Asparagín v cerebrospinálnej tekutine sa znížil z priemernej koncentrácie pred liečbou 3,1 µmol na 1,7 µmol na 4. ± 1 deň a 1,5 µmol na 25. ± 1 deň po podaní Oncasparu. Tieto zistenia boli podobné tým, ktoré boli pozorované v liečebnej skupine s natívnou
E. coli L-asparaginázou.
V tabuľke 2 sú uvedené miery prežitia bez udalosti (Event-Free Survival, EFS) v skupine s Oncasparom a v skupine s natívnou
E. coli L-asparaginázou. Štúdia 1 nebola navrhnutá na hodnotenie rozdielov v miere EFS.
Tabuľka 2: Miera prežitia bez udalosti v 3., 5. a 7. roku (štúdia 1)Oncaspar Natívna
E. coli L-asparagináza
Miera EFS v 3. roku % (95 % CI)
Miera EFS v 5. roku % (95 % CI)
Miera EFS v 7. roku % (95 % CI)
83 (73, 93)
78 (67, 88)
75 (63, 87)
79 (68, 90)
73 (61, 85)
66 (52, 80)

Najčastejšími nežiaducimi reakciami v štúdii 1 boli infekcie vrátane dvoch infekcií ohrozujúcich život
(1 pacient v každej skupine). Výskyt a typ nežiaducich reakcií 3. a 4. stupňa boli vo všeobecnosti medzi týmito dvoma liečebnými skupinami podobné. Dvaja pacienti v skupine s Oncasparom mali alergické reakcie počas oneskorenej intenzifikácie (DI) DI #1 (alergická reakcia 1. stupňa a žihľavka 3. stupňa).
Pilotná štúdia (štúdia 2) sa uskutočnila u novo diagnostikovaných pacientov vo veku od 1 do 30 rokov s B-prekurzorovou ALL s vysokým rizikom. Išlo o kontrolovanú, randomizovanú štúdiu porovnávajúcu Oncaspar s iným liekom s obsahom pegylovanej asparaginázy v kombinácii s chemoterapiou viacerými látkami v liečbe prvej línie. Kritériá leukocytov (White blood cell, WBC) boli: a) Vek 1 - 10 rokov: Leukocyty ≥ 50 000/μl; b) vek 10 - 30 rokov: Akýkoľvek počet leukocytov; c) predchádzajúca liečba steroidmi: Akýkoľvek počet leukocytov. Pacientom nebola povolená predchádzajúca cytotoxická chemoterapia s výnimkou steroidov a intratekálne podávaného cytarabínu. Do tejto štúdie bolo celkovo zaradených 166 pacientov; 54 pacientov bolo randomizovaných na
liečbu 2 500 U/m2 Oncasparu a 111 pacientov bolo randomizovaných na iný pegylovaný liek s obsahom asparaginázy. Oncaspar sa podával intravenózne v dávke 2 500 jednotiek/m2 počas fázy indukcie, konsolidácie, oneskorenej intenzifikácie a dočasnej udržiavacej fázy pacientom s ALL s
skupine s Oncasparom miera EFS 85,1 % [95 % CI 72 – 92 %] a miera celkového prežitia (overall survival, OS) 92,4 % [95 % CI 81 – 97 %]. Celkovo v skupine liečenej Oncasparom bola frekvencia precitlivenosti všetkých stupňov 9,8 %, anafylaktických reakcií 19,6 % a pankreatitídy 5,9 %. Frekvencia febrilnej neutropénie 3. alebo vyššieho stupňa bola 37,9 %.
Pacienti s ALL s precitlivenosťou na natívnu E. coli L-asparaginázu
Šesť otvorených štúdií hodnotilo Oncaspar u relapsujúcich/refraktérnych hematologických ochorení.
V týchto štúdiách užívalo Oncaspar celkovo 94 pacientov s diagnózou ALL a anamnézou predchádzajúcej alergickej reakcie na natívnu E. coli L-asparaginázu. Jednému pacientovi boli intravenózne podávané dávky 250 a 500 jednotiek/m2 Oncasparu. Ostatní pacienti boli
liečení dávkami 2 000 alebo 2 500 U/m2 podávanými intramuskulárne alebo intravenózne. Pacienti dostávali Oncaspar ako monoterapiu alebo v kombinácii s chemoterapiou viacerými látkami. Celkovo v 5 štúdiách analyzovaných na základe výsledkov u 65 pacientov s ALL užívajúcich Oncaspar a s
použitím najvyššej terapeutickej odpovede počas celej štúdie bola pozorovaná úplná remisia
u 30 pacientov (46 %), čiastočná remisia u 7 pacientov (11 %) a hematologické zlepšenie u 1 pacienta (2 %). V druhej štúdii s 29 precitlivenými pacientmi s ALL užívajúcimi Oncaspar bola u 11 pacientov hodnotená reakcia počas indukcie. Traja z týchto pacientov dosiahli úplnú remisiu (27 %), 1 pacient mal čiastočnú remisiu (9 %), 1 pacient mal hematologické zlepšenie (9 %) a u 2 pacientov bola zaznamenaná terapeutická účinnosť (18 %). Terapeutická účinnosť bola definovaná ako klinické zlepšenie, ktoré nespĺňalo kritériá pre ostatné priaznivé výsledky. Počas udržiavacej fázy sa
hodnotilo 19 pacientov, z ktorých 17 dosiahlo úplnú remisiu (89 %) a 1 pacient terapeutickú účinnosť
(5 %).
5.2 Farmakokinetické vlastnosti
Farmakokinetické posúdenia Oncasparu boli založené na enzymatickom teste, ktorý meral aktivitu asparaginázy.
U dospelých s leukémiou bola počiatočná enzymatická aktivita po intravenóznom podaní Oncasparu úmerná dávke. Polčas eliminácie z plazmy sa nachádzal v rozmedzí 1 a 6 dní a zdalo sa, že nie je ovplyvnený dávkou.
Rovnako bol nezávislý od veku, pohlavia, telesného povrchu, funkcie obličiek a pečene, diagnózy a závažnosti ochorenia. Terminálny polčas však bol u precitlivených pacientov kratší ako u pacientov bez precitlivenosti a môže byť znížený v dôsledku tvorby vysokých hladín protilátok proti pegaspargáze.
Distribučný objem bol v rozmedzí odhadovaného objemu plazmy. Po intravenóznej infúzii trvajúcej jednu hodinu bola aktivita apsaraginázy detekovaná po dobu najmenej 15 dní po prvej liečbe Oncasparom.
Pacientom s novo diagnostikovanou ALL bola podaná jediná intramuskulárna injekcia Oncasparu
(2 500 U/m² telesného povrchu) alebo natívnej asparaginázy z baktérií E. coli (25 000 U/m² telesného povrchu) alebo Erwinia (25 000 U/m² telesného povrchu). Eliminačný polčas Oncasparu v plazme bol štatisticky významne dlhší (5,7 dňa) ako eliminačné polčasy v plazme natívnych asparagináz z baktérií E. coli (1,3 dňa) a Erwinia (0,65 dňa). Okamžitá bunková smrť leukemických buniek in vivo meraná pomocou fluorescencie rodamínu bola u všetkých troch prípravkov s L-asparaginázou rovnaká.
Pacienti s ALL s niekoľkými relapsami boli liečení buď Oncasparom, alebo natívnou asparaginázou z baktérie E. coli v rámci indukčnej terapie. Oncaspar sa podával intramuskulárne v dávke 2 500 U/m² telesného povrchu v 1. a 15. deň indukcie. Priemerný polčas Oncasparu v plazme bol 8 dní u pacientov bez precitlivenosti (AUC 10,35 U/ml/deň) a 2,7 dňa u precitlivených pacientov (AUC 3,52 U/ml/deň).
Vzhľadom k tomu, že pegaspargáza je proteín s vysokou molekulovou hmotnosťou, nevylučuje sa obličkami a u pacientov s poškodením obličiek sa nepredpokladá žiadna zmena farmakokinetiky Oncasparu.
Keďže proteolytické enzýmy zodpovedné za metabolizmus Oncasparu sú rozmiestnené všade v tkanivách, presná úloha pečene nie je známa; predpokladá sa však, že akýkoľvek pokles funkcie pečene nebude pri používaní Oncasparu predstavovať klinicky významné problémy.
K dispozícii nie sú žiadne údaje u starších pacientov.
5.3 Predklinické údaje o bezpečnosti
Akútna toxicita
Len veľmi vysoké dávky pegaspargázy podané myšiam intraperitoneálne ako jedna dávka (25 000 –
100 000 U/kg telesnej hmotnosti) spôsobili úmrtie 14 % všetkých liečených myší. Pri rovnakom dávkovaní bola pozorovaná mierna hepatotoxicita. Nežiaduce reakcie zahŕňali úbytok telesnej hmotnosti, piloerekciu a zníženú aktivitu. Znížená hmotnosť sleziny môže byť známkou potenciálnych imunosupresívnych vlastností liečby.
Pegaspargáza bola dobre znášaná potkanmi a psami, keď bola podávaná intravenózne v jednej dávke až 500 U/kg.
Toxicita po opakovanom podávaní
4-týždňová štúdia s pegaspargázou u potkanov pri dávkach 400 U/kg/deň podávaných intraperitoneálne viedla k poklesu príjmu potravy a úbytku telesnej hmotnosti v porovnaní s kontrolnou skupinou.
3-mesačná štúdia s pegaspargázou u myší pri dávkach do 500 U/kg podávaných intraperitoneálne alebo intramuskulárne viedla k miernym hepatocelulárnym zmenám len u najvyššej intraperitoneálnej dávky.
U psov liečených pegaspargázou v dávke 1 200 U/kg týždenne po dobu 2 týždňov bol pozorovaný dočasne znížený nárast telesnej hmotnosti a mierne dočasné zníženie celkového počtu leukocytov. U jedného zo štyroch psov sa tiež vyskytla zvýšená aktivita glutamátpyruváttransaminázy v sére.
Imunogenicita
V 12-týždennej štúdii u myší, ktorým bola pegaspargáza podávaná týždenne v dávke 10,5 U/myš intramuskulárne alebo intraperitoneálne nebola detekovaná žiadna imunogénna reakcia.
Reprodukčná toxicita
Neuskutočnili sa žiadne štúdie reprodukčnej toxicity s pegaspargázou.
Štúdie embryotoxicity s L-asparaginázou poskytli dôkazy o teratogénnom potenciáli u potkanov liečených od 6. do 15. dňa gestácie, pričom hodnota bez pozorovaných účinkov (No Observed Effect Level, NOEL) pre teratogénne účinky bola 300 U/kg intravenózne. U králikov boli výsledkom
dávok 50 až 100 U/kg podaných intravenózne na 8. a 9. deň gestácie životaschopné plody s vrodenými malformáciami: hodnota NOEL nebola stanovená. Pri dávkach v terapeutickom rozsahu boli pozorované mnohopočetné malformácie a embryoletálne účinky. Skúmanie účinku na fertilitu, perinatálny a postnatálny vývoj nebolo vykonané.
Karcinogenita, mutagenita, fertilita
Dlhodobý výskum karcinogenity alebo štúdie účinku na fertilitu zvierat neboli s pegaspargázou vykonané.
Pegaspargáza nebola mutagénna v Amesovom teste používajúcom kmene Salmonella typhimurium.
6
. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Monohydrát dihydrogénfosforečnanu sodného
Heptahydrát fosforečnanu disodného
Chlorid sodný
Voda na injekcie
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
8 mesiacov.
Chemická a fyzikálna stabilita zriedeného roztoku počas používania bola preukázaná počas 48 hodín pri teplote 2° C – 8 °C. Z mikrobiologického hľadiska platí, že produkt by sa mal použiť okamžite. Ak sa nepoužije okamžite, za časy a podmienky skladovania pred použitím zodpovedá používateľ a za normálnych okolností nepôjde o obdobie dlhšie ako 24 hodín pri teplote 2° C – 8 °C, za predpokladu, že riedenie sa nevykonalo v kontrolovaných a overených aseptických podmienkach.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
6.5 Druh obalu a obsah balenia
5 ml roztoku v injekčnej liekovke (sklo typu I) so zátkou (gumenou) a tesnením (hliníkovým)
s odklápacím viečkom. Veľkosť balenia po 1 ks.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Tento liek môže spôsobiť podráždenie pri kontakte. Preto sa s roztokom musí zaobchádzať a podávať
ho mimoriadne opatrne. Musí sa zabrániť inhalácii pary a kontaktu s kožou a so sliznicami, najmä s očami. V prípade kontaktu okamžite vyplachujte veľkým množstvom vody po dobu
najmenej 15 minút.
Roztok možno pred podaním intravenóznej injekcie zriediť 5 % roztokom glukózy alebo injekčným roztokom chloridu sodného s koncentráciou 9 mg/ml (0,9 %) (pozri časť 4.2).
Roztok nepoužívajte, ak je zakalený alebo sa v ňom vytvorila zrazenina. Nepretrepávajte.
Oncaspar je určený na jedno použitie. Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Baxalta Innovations GmbH Industriestrasse 67
A – 1221 Viedeň
Rakúsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/15/1070/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 14. januára 2016
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o
bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUOncaspar 750 U/ml prášok na injekčný/infúzny roztok.
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá injekčná liekovka obsahuje 3 750 jednotiek (U)** pegaspargázy*.
Po rekonštitúcii obsahuje 1ml roztoku 750 jednotiek pegaspargázy (750 U/ml).
* Liečivo je kovalentný konjugát L-asparaginázy získanej z baktérie
Escherichia coli s monometoxypolyetylénglykolom
** Jedna jednotka je definovaná ako množstvo enzýmu, ktoré je potrebné na uvoľnenie 1 µmol amoniaku za minútu pri pH 7,3 a teplote 37 °C.
Účinnosť tohto lieku sa nemá porovnávať s účinnosťou iného pegylovaného alebo nepegylovaného proteínu rovnakej terapeutickej skupiny. Ďalšie informácie pozri časť 5.1.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMAPrášok na injekčný/infúzny roztok. Biely až sivobiely prášok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieOncaspar je indikovaný ako zložka antineoplastickej kombinovanej liečby akútnej lymfoblastovej leukémie (ALL) u pediatrických pacientov od narodenia do veku 18 rokov a u dospelých pacientov.
4.2 Dávkovanie a spôsob podávaniaOncaspar majú predpisovať a podávať lekári a zdravotnícki pracovníci, ktorí majú skúsenosti s používaním antineoplastických liekov. Má sa podávať len v nemocničnom prostredí, kde je k dispozícii vhodné resuscitačné vybavenie.
DávkovanieOncaspar sa zvyčajne používa ako súčasť protokolov kombinovanej chemoterapie s ďalšími antineoplastickými látkami (pozri tiež časť 4.5).
Pediatrickí pacienti a dospelí ≤ 21 rokovOdporúčaná dávka u pacientov s telesným povrchom ≥ 0,6 m2 a u pacientov vo veku
≤21 rokov je 2 500 U pegaspargázy (čo zodpovedá 3,3 ml Oncasparu)/m² telesného povrchu raz za 14 dní.
Deti s telesným povrchom < 0,6 m² majú dostávať 82,5 U pegaspargázy (čo zodpovedá 0,1 ml
Oncasparu)/kg telesnej hmotnosti raz za 14 dní.
Dospelí >21 rokov
Pokiaľ nie je predpísané inak, odporúčané dávkovanie u dospelých vo veku > 21 rokov je 2 000 U/m2
raz za 14 dní.
Liečbu možno pred ďalším podaním pegaspargázy monitorovať na základe minimálnej aktivity asparaginázy v sére. Ak hodnoty aktivity asparaginázy nedosahujú cieľové hladiny, môže sa zvážiť zmena liečby na iný prípravok s asparaginázou (pozri časť 4.4).
Osobitné populácie
Poškodenie obličiek
Vzhľadom k tomu, že pegaspargáza je proteín s vysokou molekulovou hmotnosťou, nevylučuje sa obličkami a u pacientov s poškodením obličiek nie je potrebná úprava dávky.
Poškodenie pečene
U pacientov s poškodením pečene nie je potrebná úprava dávky.
Starší pacienti
U pacientov starších ako 65 rokov je k dispozícii obmedzené množstvo údajov.
Spôsob podávania
Oncaspar sa môže podávať intramuskulárnou injekciou alebo intravenóznou infúziou.
Pri menších objemoch sa uprednostňuje intramuskulárna cesta podania. Keď sa Oncaspar podáva intramuskulárnou injekciou, množstvo lieku injekčne podané do jedného miesta nemá presiahnuť 2 ml u detí a dospievajúcich a 3 ml u dospelých. Ak sa podáva väčšie množstvo, dávka sa má rozdeliť a vpichnúť do viacerých miest.
Intravenózna infúzia Oncasparu sa zvyčajne podáva počas 1 až 2 hodín v 100 ml injekčného roztoku chloridu sodného s koncentráciou 9 mg/ml (0,9 %) alebo v 5 % roztoku glukózy.
Zriedený roztok možno podávať spolu s už tečúcou infúziou chloridu sodného s
koncentráciou 9 mg/ml (0,9 %) alebo v 5 % roztoku glukózy. Počas podávania Oncasparu nepodávajte cez tú istú intravenóznu infúziu iné lieky.
Pokyny na rekonštitúciu a riedenie tohto lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Závažné poškodenie pečene (bilirubín > 3-násobok hornej hranice normálnych hodnôt [upper limit of normal, ULN]; transaminázy > 10-násobok ULN).
Závažná trombóza pri predchádzajúcej liečbe L-asparaginázou v anamnéze. Pankreatitída v anamnéze (pozri časť 4.4).
Závažné hemoragické udalosti pri predchádzajúcej liečbe L-asparaginázou v anamnéze (pozri
časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
Môže sa vykonať meranie úrovne aktivity asparaginázy v sére alebo v plazme, aby sa vylúčilo rýchle znižovanie aktivity asparaginázy.
Nízke hladiny aktivity asparaginázy môžu byť spojené s výskytom protilátok proti asparagináze
v dôsledku potenciálneho neutralizujúceho pôsobenia týchto protilátok. V takýchto prípadoch treba zvážiť zmenu liečby na iný prípravok s asparaginázou.
Počas liečby sa môžu vyskytnúť reakcie z precitlivenosti na pegaspargázu vrátane anafylaxie ohrozujúcej život. Ako rutinné bezpečnostné opatrenie sa odporúča pacienta počas jednej hodiny po podaní monitorovať, pričom má byť k dispozícii resuscitačné vybavenie a iné potrebné metódy na liečbu anafylaxie (epinefrín, kyslík, intravenózne steroidy, atď.). U pacientov so závažnými alergickými reakciami sa má podávanie Oncasparu ukončiť (pozri časti 4.3 a 4.8). V závislosti od závažnosti príznakov sa ako protiopatrenie môžu podávať antihistamíny, kortikosteroidy a vazopresoriká.
U pacientov liečených pegaspargázou sa môžu vyskytnúť závažné trombotické udalosti vrátane trombózy sinus sagittalis. U pacientov so závažnými trombotickými udalosťami sa má podávanie Oncasparu ukončiť.
U pacientov liečených pegaspargázou sa môže vyskytnúť zvýšený protrombínový čas (prothrombin time, PT), zvýšený parciálny tromboplastínový čas (partial thromboplastin time, PTT) a hypofibrinogenémia. Na začiatku liečby a v pravidelných intervaloch počas liečby a po jej ukončení sa majú monitorovať koagulačné parametre, najmä vtedy, ak sa súčasne používajú ďalšie lieky
inhibujúce koaguláciu, ako napr. kyselina acetylsalicylová a nesteroidné protizápalové lieky (pozri
časť 4.5).
Je nevyhnutné pravidelne monitorovať koagulačný profil. Fibrinogén možno považovať za parameter prokoagulačného a antikoagulačného systému. Ak dôjde k výraznému poklesu fibrinogénu alebo nedostatku antitrombínu III (ATIII), zvážte cielenú substitúciu (napr. čerstvo zmrazenú plazmu).
Pegaspargáza môže vykazovať imunosupresívnu aktivitu. Preto je možné, že používanie tohto lieku podporuje u pacientov vznik infekcií.
Liečba kombinovaná s Oncasparom môže viesť k závažnej pečeňovej toxicite a toxicite centrálneho nervového systému.
Pri podávaní Oncasparu v kombinácii s inými hepatotoxickými látkami je potrebné postupovať opatrne, najmä pri už existujúcom poškodení pečene. V tomto prípade sa majú pacienti monitorovať pre prípad poškodenia pečene.
Ak sú prítomné príznaky hyperamonémie (napr. nevoľnosť, vracanie, letargia, podráždenosť), majú sa pozorne sledovať hladiny amoniaku.
Existuje možnosť zvýšeného rizika hepatotoxicity pri kombinácii L-asparaginázy s inhibítormi tyrozínkinázy pri liečbe Ph+ ALL, preto je pri rozhodovaní o použití Oncasparu v tejto populácii pacientov potrebné postupovať opatrne.
Pomerne často je zaznamenané zníženie počtu cirkulujúcich lymfoblastov a v prvých dňoch liečby je často pozorovaný normálny alebo príliš nízky počet leukocytov. To môže byť spojené s výrazným nárastom hladiny kyseliny močovej v sére. Môže sa vyskytnúť urikemická nefropatia. Pri monitorovaní terapeutického účinku je potrebné pozorne sledovať krvný obraz v periférnej krvi a kostnú dreň pacienta.
Boli hlásené nežiaduce reakcie v podobe pankreatitídy. Pacienti majú byť informovaní o charakteristickom príznaku pankreatitídy, ktorá, ak nie je liečená, môže viesť k úmrtiu: pretrvávajúce bolesti brucha, ktoré môžu byť intenzívne a vystreľovať do oblasti chrbta. V prípade podozrenia na pankreatitídu je nutné ukončiť podávanie Oncasparu. V prípade potvrdenia pankreatitídy sa podávanie Oncasparu nesmie obnoviť. Preto majú byť po ukončení liečby pegaspargázou vykonávané vhodné vyšetrenia. Keďže nie je známa presná patogenéza, možno odporúčať len podporné opatrenia.
Je potrebné často vykonávať merania amylázy v sére, aby sa identifikovali včasné prejavy zápalu pankreasu.
V ojedinelých prípadoch bola hlásená hemoragická alebo nekrotizujúca pankreatitída vedúca k úmrtiu. Počas liečby Oncasparom sa má sledovať hladina glukózy v krvi a moči, pretože sa môže zvyšovať.
Počas liečby a najmenej 6 mesiacov po ukončení liečby Oncasparom sa musí používať účinná neperorálna antikoncepcia. Keďže nemožno vylúčiť nepriamu interakciu medzi perorálnou antikoncepciou a pegaspargázou, používanie perorálnej antikoncepcie sa nepovažuje za primeranú metódu antikoncepcie (pozri časti 4.5 a 4.6).
Tento liek obsahuje menej ako 1mmol sodíka (23 mg) na dávku, t.j. v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Pokles hladiny proteínov v sére spôsobený pegaspargázou môže zvýšiť toxicitu iných liekov, ktoré sa viažu na proteíny.
Okrem toho môže pegaspargáza prostredníctvom inhibície syntézy proteínov a bunkového delenia narúšať mechanizmus účinku ďalších látok, ktoré k svojmu účinku potrebujú bunkové delenie, napr. metotrexátu.
Metotrexát a cytarabín môžu narúšať pôsobenie lieku rôznym spôsobom: predchádzajúce podanie týchto látok môže synergicky zvýšiť účinok Oncasparu. Ak sú tieto látky podané následne, účinok pegaspargázy môže byť antagonicky oslabený.
Pegaspargáza môže ovplyvniť metabolizmus enzýmov pri užívaní iných liekov, najmä v pečeni. Používanie Oncasparu môže viesť k výkyvom koagulačných faktorov. To môže zvýšiť sklon ku
krvácaniu a/alebo trombóze. Pri súbežnom podávaní antikoagulancií, ako sú kumarín, heparín,
dipyridamol, kyselina acetylsalicylová alebo nesteroidné protizápalové lieky, je preto potrebná opatrnosť.
Pri súčasnom podávaní glukokortikoidov (napr. prednizónu) a pegaspargázy môžu byť zmeny koagulačných parametrov (napr. pokles fibrinogénu a nedostatok antitrombínu III, ATIII) výraznejšie.
Bezprostredne predchádzajúca alebo súbežná liečba vinkristínom môže zvýšiť toxicitu pegaspargázy a riziko anafylaktických reakcií. Podávanie Oncasparu pred vinkristínom môže zvýšiť neurotoxicitu vinkristínu. Preto z dôvodu minimalizovania toxicity sa má vinkristín podávať najmenej 12 hodín pred podaním Oncasparu.
Nie je možné vylúčiť nepriamu interakciu medzi pegaspargázou a perorálnou antikoncepciou v dôsledku hepatotoxicity pegaspargázy, ktorá môže narúšať pečeňový klírens perorálnej antikoncepcie. Preto sa kombinácia Oncasparu s perorálnou antikoncepciou neodporúča. Ženy v plodnom veku majú používať inú metódu ako perorálnu antikoncepciu (pozri časti 4.4 a 4.6).
Súčasné očkovanie živými vakcínami zvyšuje riziko závažných infekcií, ktoré súvisia s imunosupresívnou aktivitou pegaspargázy a prítomnosťou základného ochorenia a kombinovanou chemoterapiou (pozri časť 4.4). Očkovanie živými vakcínami sa preto má podávať najskôr 3 mesiace po ukončení celej antileukemickej liečby.
4.6 Fertilita, gravidita a laktácia
Ženy v plodnom veku/Antikoncepcia u mužov a žien
Počas liečby a najmenej 6 mesiacov po ukončení liečby Oncasparom musia muži a ženy používať účinnú antikoncepciu. Keďže nemožno vylúčiť nepriamu interakciu medzi perorálnou antikoncepciou a pegaspargázou, perorálna antikoncepcia sa v takejto klinickej situácii nepovažuje za dostatočne bezpečnú. Ženy v plodnom veku majú používať inú metódu ako perorálnu antikoncepciu (pozri
časti 4.4 a 4.5).
Gravidita
K dispozícii sú obmedzené údaje o používaní L-asparaginázy u tehotných žien a údaje o používaní Oncasparu u tehotných žien nie sú k dispozícii. Neuskutočnili sa žiadne reprodukčné štúdie na zvieratách s pegaspargázou, ale štúdie na zvieratách s L-asparaginázou ukázali teratogenitu (pozri časť 5.3). Preto sa Oncaspar vzhľadom na svoje farmakologické vlastnosti má používať počas tehotenstva len vtedy, ak si klinický stav ženy vyžaduje liečbu pegaspargázou.
Dojčenie
Nie je známe, či sa pegaspargáza vylučuje do materského mlieka. Vzhľadom na jej farmakologické vlastnosti sa riziko pre dojčených novorodencov/dojčatá nedá vylúčiť. Ako bezpečnostné opatrenie sa má dojčenie počas liečby Oncasparom ukončiť a po jej ukončení sa nesmie znovu začať.
Fertilita
Neuskutočnili sa žiadne štúdie skúmajúce účinok pegaspargázy na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Oncaspar má veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje, pretože mení schopnosť
reakcie.
Pacientom sa má odporučiť, aby neviedli vozidlá ani neobsluhovali stroje, ak u nich dôjde k zmätenosti, somnolencii alebo iným nežiaducim reakciám, ktoré môžu zhoršiť ich schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Nežiaduce reakcie opísané v tejto časti sú získané spojením nežiaducich reakcií z údajov z klinických štúdií a skúseností pacientov s ALL po uvedení Oncasparu na trh. Analýzy bezpečnosti sa uskutočnili so zohľadnením nežiaducich reakcií na liek v rámci klinickej štúdie 1 [CCG-1962] a klinickej
štúdie 2 [AALL07P4] (pozri časť 5.1).
Tabuľkový zoznam nežiaducich reakcií
Nežiaduce reakcie a ich frekvencie sú uvedené v tabuľke 1.
Frekvencie sú definované podľa nasledujúcej konvencie: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Tabuľka 1: Nežiaduce reakcie hlásené pri liečbe Oncasparom
 Štandardná trieda
orgánových systémov
MedDRA
Štandardná trieda
orgánových systémov
MedDRA
Poruchy krvi
a lymfatického systému Poruchy endokrinného systému
Poruchy gastrointestinálneho traktu
Celkové poruchy a reakcie v mieste podania Poruchy pečene
a žlčových ciest
Nežiaduca reakciaČasté: Febrilná neutropénia, anémia, koagulopatia
Neznáme: Zlyhanie kostnej drene
Veľmi časté: Hyperglykémia
Veľmi časté: Pankreatitída, hnačka, bolesť brucha, nevoľnosť
Časté: Vracanie, stomatitída
Zriedkavé: Nekrotizujúca pankreatída, hemoragická pankreatída
Neznáme: Pankreatická pseudocysta, parotitída* Neznáme: Pyrexia
Časté: Hepatotoxicita, stukovatenie pečene
Zriedkavé: Nekróza pečene, žltačka, cholestáza, zlyhanie pečene
Štandardná trieda orgánových systémov MedDRA
Poruchy imunitného systému
Nežiaduca reakcia
Veľmi časté: Precitlivenosť, žihľavka, anafylaktická reakcia
Neznáme: Toxická epidermálna nekrolýza*
Infekcie a nákazy Časté: Infekcie, sepsa
Laboratórne a funkčné vyšetrenia
Poruchy metabolizmu a výživy
Poruchy kostrovej
a svalovej sústavy a spojivového tkaniva Poruchy obličiek a močových ciest Poruchy nervového systému
Veľmi časté: Zníženie telesnej hmotnosti
Časté: Zvýšená amyláza, zvýšená alanínaminotransferáza, zvýšený krvný bilirubín, znížený krvný albumín, znížený počet neutrofilov, znížený počet krvných doštičiek, predĺžený aktivovaný parciálny tromboplastínový čas, hypofibrinogenémia
Neznáme: Zvýšená krvná močovina, protilátky proti peraspargáze
Veľmi časté: Znížená chuť do jedla
Časté: Hypertriglyceridémia, hyperlipidémia, hypercholesterolémia
Neznáme: Diabetická ketoacidóza
Časté: Bolesť v končatinách
Neznáme: Akútne zlyhanie obličiek*
Časté: Záchvaty, periférna motorická neuropatia, synkopa Zriedkavé: Syndróm posteriórnej reverzibilnej leukoencefalopatie Neznáme: Ospalosť, tras*
Psychické poruchy Neznáme: Stav zmätenosti
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy kože a podkožného tkaniva
Časté: Hypoxia
Veľmi časté: Vyrážka
Poruchy ciev Časté: Trombóza**
Neznáme: Cerebrovaskulárna príhoda
*Nežiaduce účinky pozorované u iných asparagináz v skupine
**Legenda: trombóza CNS
Opis vybraných nežiaducich reakciíV súvislosti s liečbou asparaginázou sa zaznamenali nasledovné nežiaduce reakcie. Hoci tieto reakcie nie sú špecificky spojené s pegaspargázou, môžu sa prejaviť pri užívani Oncasparu:'
Poruchy krvi a lymfatického systémuOncaspar môže spôsobiť miernu až stredne závažnú myelosupresiu a môžu byť postihnuté všetky tri línie krviniek.
Približne polovica všetkých závažných krvácaní a trombóz ovplyvňuje mozgové cievy a môže viesť
napr. k mozgovej príhode, záchvatu, bolesti hlavy alebo strate vedomia.
Poruchy nervového systémuOncaspar môže spôsobiť disfunkcie centrálneho nervového systému, ktoré sa prejavujú ako kŕče a menej často ako stav zmätenosti a somnolencia (mierne narušené vedomie).
V zriedkavých prípadoch sa môže vyskytnúť syndróm reverzibilnej posteriórnej leukoencefalopatie
(reversible posterior leukoencephalopathy syndrome, RPLS).
Vo veľmi zriedkavých prípadoch bol opísaný mierny tras prstov.
Poruchy gastrointestinálneho traktuPribližne u polovice pacientov sa vyskytli mierne až stredne závažné gastrointestinálne reakcie, ako napr. strata chuti do jedla, nevoľnosť, vracanie, žalúdočné kŕče, hnačka a úbytok telesnej hmotnosti. Často sa vyskytuje akútna pankreatitída. Boli zaznamenané ojedinelé prípady tvorby pseudocýst (až do štyroch mesiacov po poslednej liečbe).
V zriedkavých prípadoch sa vyskytuje hemoragická alebo nekrotizujúca pankreatitída. Pri liečbe L-asparaginázou bol popísaný jeden prípad pankreatitídy so súčasnou akútnou parotitídou. V ojedinelých prípadoch bola hlásená hemoragická alebo nekrotizujúca pankreatitída vedúca k úmrtiu. Počas a aj po ukončení liečby Oncasparom sa môže zvýšiť hladina amylázy v sére.
Poruchy obličiek a močových ciestPočas liečebných režimov obsahujúcich L-asparaginázu sa môže vo vzácnych prípadoch vyvinúť
akútne zlyhanie obličiek.
Poruchy kože a podkožného tkanivaNa koži sa môžu prejaviť alergické reakcie. V súvislosti s L-asparaginázou bol popísaný jeden prípad toxickej epidermálnej nekrolýzy (Lyellov syndróm).
Poruchy endokrinného systémuČasto sa pozorujú zmeny endokrinnej funkcie pankreasu, ktoré sa prejavujú prevažne vo forme abnormálneho metabolizmu glukózy. Boli popísané prípady diabetickej ketoacidózy aj hyperosmolárnej hyperglykémie, ktoré spravidla reagujú na podanie inzulínu.
Poruchy metabolizmu a výživyPozorovala sa zmena hladiny tukov v sére a veľmi často dochádza k zmenám hodnôt tukov v sére, vo väčšine prípadov bez klinických príznakov.
Pravidelne sa vyskytuje zvýšenie hladiny močoviny v sére nezávislé od dávky, ktoré je takmer vždy prejavom prerenálnej metabolickej nerovnováhy.
Celkové poruchy a reakcie v mieste podaniaPo podaní injekcie sa môže vyskytnúť zvýšená teplota, ktorá zvyčajne spontánne ustúpi.
Poruchy imunitného systémuZistili sa špecifické protilátky proti pegaspargáze, ktoré boli menej často spojené s reakciami z precitlivenosti. Boli zaznamenané aj neutralizujúce protilátky znižujúce klinickú účinnosť.
Poruchy pečene a žlčových ciestČasté sú zmeny pečeňových ukazovateľov. Často sa tiež pozoruje zvýšenie transamináz a bilirubínu v sére, nezávislé od dávky.
Veľmi často sa pozoruje steatóza pečene. V zriedkavých prípadoch bola hlásená cholestáza, ikterus, nekróza pečeňových buniek a zlyhanie pečenie s letálnym koncom.
Porucha syntézy proteínov môže viesť k poklesu hladiny proteínov v sére. U väčšiny pacientov dochádza počas liečby k poklesu sérového albumínu nezávislého od dávky.
Typ nežiaducich reakcií Oncasparu je podobný vedľajším účinkom natívnej nepegylovanej
L-asparaginázy (napr. natívna
E. coli asparagináza).
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V4.9 PredávkovanieBolo hlásených niekoľko prípadov predávkovania Oncasparom v dôsledku náhodného podania. Po predávkovaní boli pozorované zvýšené pečeňové enzýmy, vyrážka a hyperbilirubinémia. Neexistuje žiadna špecifická farmakologická liečba predávkovania. V prípade predávkovania musia byť pacienti pozorne sledovaní pre prípad prejavov a príznakov nežiaducich reakcií a primerane liečení symptomatickou a podpornou liečbou.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Cytostatiká, iné cytostatiká, ATC kód: L01XX24
Mechanizmus účinku
Mechanizmom účinku L-asparaginázy je enzymatické štiepenie aminokyseliny L-asparagínu na kyselinu asparágovú a amoniak. Deplécia L-asparagínu v krvnom sére vedie k inhibícii syntézy proteínov, syntézy DNA a syntézy RNA, najmä v leukemických blastoch, ktoré nie sú schopné syntetizovať L-asparagín a podliehajú apoptóze.
Naopak normálne bunky sú schopné syntetizovať L-asparagín a sú menej ovplyvnené jeho rýchlou depléciou počas liečby enzýmom L-asparaginázou. Pegylácia nemení enzymatické vlastnosti
L-asparaginázy, ale ovplyvňuje farmakokinetiku a imunogenicitu enzýmu.
Farmakodynamické účinky
Antileukemický účinok L-asparaginázy súvisí s trvalou depléciou L-asparaginázy. Farmakodynamika bola posudzovaná v štúdii 1 u 57 novo diagnostikovaných pediatrických pacientov s ALL so štandardným rizikom, ktorí dostali tri intramuskulárne dávky Oncasparu (2 500 U/m2), jednu v každej liečebnej fáze, t.j. vo fáze indukcie a dvoch fázach oneskorenej intenzifikácie. Farmakodynamická aktivita bola posudzovaná na základe sériových meraní asparagínu v sére (n = 57) a cerebrospinálnej tekutine (cerebrospinal fluid, CFS) (n = 50).
Klinická účinnosťa bezpečnosť
Účinnosť a bezpečnosť Oncasparu sa hodnotili na základe dvoch klinických štúdií, v ktorých bol injekčný/infúzny roztok Oncaspar použitý na liečbu prvej línie ALL: štúdie 1 u pacientov s ALL so štandardným rizikom a štúdie 2 u pacientov s ALL s vysokým rizikom.
Účinnosť Oncasparu pri ALL u pacientov s relapsujúcim alebo refraktérnym ochorením a anamnézou predchádzajúcej alergickej reakcie na natívnu E. coli L-asparaginázu bola založená na skupine 94 pacientov zo šiestich otvorených štúdií [ASP-001, ASP-201A, ASP-302, ASP-304, ASP-400 a
ASP-001C/003C].
Prvá línia (pacienti s ALL bez precitlivenosti na E. coli L-asparaginázu)
Bezpečnosť a účinnosť Oncasparu sa hodnotila v otvorenej, multicentrickej, randomizovanej, aktívne kontrolovanej štúdii (štúdia 1). V tejto štúdii bolo 118 pediatrických pacientov vo veku 1 až 9 rokov s predtým neliečenou ALL so štandardným rizikom randomizovaných v pomere 1:1 do skupiny s Oncasparom alebo s natívnou E.coli L-asparaginázou ako súčasť kombinovanej terapie. Oncaspar bol podávaný intramuskulárne v dávke 2 500 jednotiek/m2 na 3. deň 4-týždňovej indukčnej fázy a na 3. deň každej z dvoch 8-týždňových fáz oneskorenej intenzifikácie (delayed intensification, DI). Natívna E. coli L-asparagináza bola podávaná intramuskulárne v dávke 6 000 jednotiek/m2 trikrát týždenne celkom v 9 dávkach počas indukčnej fázy a v celkom 6 dávkach počas každej fázy oneskorenej intenzifikácie.
Primárne určovanie účinnosti bolo založené na preukázaní podobnej deplécie asparagínu (rozsah a trvanie) v skupine s Oncasparom a v skupine s natívnou E.coli L-asparaginázou. Cieľom stanoveným
v protokole bolo dosiahnutie deplécie asparagínu na sérovú koncentráciu £1 mmol. Percento pacientov s týmto stupňom deplécie bolo v 2 skupinách štúdie podobné počas všetkých 3 liečebných fáz v časových bodoch stanovených v protokole.
Vo všetkých fázach liečby sa sérové koncentrácie asparagínu znížili počas 4 dní od prvej dávky asparaginázy v liečebnej fáze a ostali nízke počas približne 3 týždňov v skupine s Oncasparom aj v skupine s natívnou E. coli L-asparaginázou. Na obrázku 1 sú znázornené sérové koncentrácie asparagínu počas indukčnej fázy. Schémy deplécie sérového asparagínu v 2 fázach oneskorenej intenzifikácie sú podobné ako schémy deplécie sérového asparagínu v indukčnej fáze.
Obrázok 1: Priemerná koncentrácia (± štandardná chyba) sérového asparagínu počas indukčnej fázy štúdie 1
100,0
Natívna
E. coli L-asparagináza
Oncaspar®
10,0

1,0
0,1
0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30
Dni po prvej dávke L-asparaginázyPoznámka: Oncaspar (2 500 jednotiek/m2 intramuskulárne) bol podávaný na 3. deň 4-týždňovej indukčnej fázy. Natívna
E. coli L-asparagináza (6 000 jednotiek/m2 intramuskulárne)
bola podávaná 3-krát týždenne v 9 dávkach počas indukcie.
Koncentrácie asparagínu v cerebrospinálnej tekutine boli stanovené u 50 pacientov počas indukčnej fázy. Asparagín v cerebrospinálnej tekutine sa znížil z priemernej koncentrácie pred liečbou 3,1 µmol na 1,7 µmol na 4. ± 1 deň a 1,5 µmol na 25. ± 1 deň po podaní Oncasparu. Tieto zistenia boli podobné tým, ktoré boli pozorované v liečebnej skupine s natívnou
E. coli L-asparaginázou.
V tabuľke 2 sú uvedené miery prežitia bez udalosti (Event-Free Survival, EFS) v skupine s Oncasparom a v skupine s natívnou
E. coli L-asparaginázou. Štúdia 1 nebola navrhnutá na hodnotenie rozdielov v miere EFS.
Tabuľka 2: Miera prežitia bez udalosti v 3., 5. a 7. roku (štúdia 1)Oncaspar Natívna
E. coli L-asparagináza
Miera EFS v 3. roku % (95 % CI)
Miera EFS v 5. roku % (95 % CI)
Miera EFS v 7. roku % (95 % CI)
83 (73, 93)
78 (67, 88)
75 (63, 87)
79 (68, 90)
73 (61, 85)
66 (52, 80)

Najčastejšími nežiaducimi reakciami v štúdii 1 boli infekcie vrátane dvoch infekcií ohrozujúcich život
(1 pacient v každej skupine). Výskyt a typ nežiaducich reakcií 3. a 4. stupňa boli vo všeobecnosti medzi týmito dvoma liečebnými skupinami podobné. Dvaja pacienti v skupine s Oncasparom mali alergické reakcie počas oneskorenej intenzifikácie (DI) DI #1 (alergická reakcia 1. stupňa a žihľavka 3. stupňa).
Pilotná štúdia (štúdia 2) sa uskutočnila u novo diagnostikovaných pacientov vo veku od 1 do 30 rokov s B-prekurzorovou ALL s vysokým rizikom. Išlo o kontrolovanú, randomizovanú štúdiu porovnávajúcu Oncaspar s iným liekom s obsahom pegylovanej asparaginázy v kombinácii s chemoterapiou viacerými látkami v liečbe prvej línie. Kritériá leukocytov (White blood cell, WBC) boli: a) Vek 1 - 10 rokov: Leukocyty ≥ 50 000/μl; b) vek 10 - 30 rokov: Akýkoľvek počet leukocytov; c) predchádzajúca liečba steroidmi: Akýkoľvek počet leukocytov. Pacientom nebola povolená predchádzajúca cytotoxická chemoterapia s výnimkou steroidov a intratekálne podávaného cytarabínu. Do tejto štúdie bolo celkovo zaradených 166 pacientov; 54 pacientov bolo randomizovaných na
liečbu 2 500 U/m2 Oncasparu a 111 pacientov bolo randomizovaných na iný pegylovaný liek s obsahom asparaginázy. Oncaspar sa podával intravenózne v dávke 2 500 jednotiek/m2 počas fázy indukcie, konsolidácie, oneskorenej intenzifikácie a dočasnej udržiavacej fázy pacientom s ALL s
vysokým rizikom, liečeným rozšírenou Berlin-Frankfurt-Münster terapiou. V 3. roku bola v liečebnej skupine s Oncasparom miera EFS 85,1 % [95 % CI 72 – 92 %] a miera celkového prežitia (overall survival, OS) 92,4 % [95 % CI 81 – 97 %]. Celkovo v skupine liečenej Oncasparom bola frekvencia precitlivenosti všetkých stupňov 9,8 %, anafylaktických reakcií 19,6 % a pankreatitídy 5,9 %. Frekvencia febrilnej neutropénie 3. alebo vyššieho stupňa bola 37,9 %.
Pacienti s ALL s precitlivenosťou na natívnu E. coli L-asparaginázu
Šesť otvorených štúdií hodnotilo Oncaspar u relapsujúcich/refraktérnych hematologických ochorení. V týchto štúdiách užívalo Oncaspar celkovo 94 pacientov s diagnózou ALL a anamnézou
predchádzajúcej alergickej reakcie na natívnu E. coli L-asparaginázu. Jednému pacientovi boli intravenózne podávané dávky 250 a 500 jednotiek/m2 Oncasparu. Ostatní pacienti boli
liečení dávkami 2 000 alebo 2 500 U/m2 podávanými intramuskulárne alebo intravenózne. Pacienti dostávali Oncaspar ako monoterapiu alebo v kombinácii s chemoterapiou viacerými látkami. Celkovo v 5 štúdiách analyzovaných na základe výsledkov u 65 pacientov s ALL užívajúcich Oncaspar a s
použitím najvyššej terapeutickej odpovede počas celej štúdie bola pozorovaná úplná remisia
u 30 pacientov (46 %), čiastočná remisia u 7 pacientov (11 %) a hematologické zlepšenie u 1 pacienta (2 %). V druhej štúdii s 29 precitlivenými pacientmi s ALL užívajúcimi Oncaspar bola u 11 pacientov hodnotená reakcia počas indukcie. Traja z týchto pacientov dosiahli úplnú remisiu (27 %), 1 pacient mal čiastočnú remisiu (9 %), 1 pacient mal hematologické zlepšenie (9 %) a u 2 pacientov bola zaznamenaná terapeutická účinnosť (18 %). Terapeutická účinnosť bola definovaná ako klinické zlepšenie, ktoré nespĺňalo kritériá pre ostatné priaznivé výsledky. Počas udržiavacej fázy sa
hodnotilo 19 pacientov, z ktorých 17 dosiahlo úplnú remisiu (89 %) a 1 pacient terapeutickú účinnosť
(5 %).
5.2 Farmakokinetické vlastnosti
Farmakokinetické posúdenia Oncasparu boli založené na enzymatickom teste, ktorý meral aktivitu asparaginázy.
U dospelých s leukémiou bola počiatočná enzymatická aktivita po intravenóznom podaní Oncasparu úmerná dávke. Polčas eliminácie z plazmy sa nachádzal v rozmedzí 1 a 6 dní a zdalo sa, že nie je ovplyvnený dávkou.
Rovnako bol nezávislý od veku, pohlavia, telesného povrchu, funkcie obličiek a pečene, diagnózy a závažnosti ochorenia. Terminálny polčas však bol u precitlivených pacientov kratší ako u pacientov bez precitlivenosti a môže byť znížený v dôsledku tvorby vysokých hladín protilátok proti pegaspargáze.
Distribučný objem bol v rozmedzí odhadovaného objemu plazmy. Po intravenóznej infúzii trvajúcej jednu hodinu bola aktivita apsaraginázy detekovaná po dobu najmenej 15 dní po prvej liečbe Oncasparom.
Pacientom s novo diagnostikovanou ALL bola podaná jediná intramuskulárna injekcia Oncasparu
(2 500 U/m² telesného povrchu) alebo natívnej asparaginázy z baktérií E. coli (25 000 U/m² telesného povrchu) alebo Erwinia (25 000 U/m² telesného povrchu). Eliminačný polčas Oncasparu v plazme bol štatisticky významne dlhší (5,7 dňa) ako eliminačné polčasy v plazme natívnych asparagináz z baktérií E. coli (1,3 dňa) a Erwinia (0,65 dňa). Okamžitá bunková smrť leukemických buniek in vivo meraná pomocou fluorescencie rodamínu bola u všetkých troch prípravkov s L-asparaginázou rovnaká.
Pacienti s ALL s niekoľkými relapsami boli liečení buď Oncasparom, alebo natívnou asparaginázou z baktérie E. coli v rámci indukčnej terapie. Oncaspar sa podával intramuskulárne v dávke 2 500 U/m² telesného povrchu v 1. a 15. deň indukcie. Priemerný polčas Oncasparu v plazme bol 8 dní u pacientov bez precitlivenosti (AUC 10,35 U/ml/deň) a 2,7 dňa u precitlivených pacientov (AUC 3,52 U/ml/deň).
Vzhľadom k tomu, že pegaspargáza je proteín s vysokou molekulovou hmotnosťou, nevylučuje sa obličkami a u pacientov s poškodením obličiek sa nepredpokladá žiadna zmena farmakokinetiky Oncasparu.
Keďže proteolytické enzýmy zodpovedné za metabolizmus Oncasparu sú rozmiestnené všade v tkanivách, presná úloha pečene nie je známa; predpokladá sa však, že akýkoľvek pokles funkcie pečene nebude pri používaní Oncasparu predstavovať klinicky významné problémy.
K dispozícii nie sú žiadne údaje u starších pacientov.
5.3 Predklinické údaje o bezpečnosti
Neklinická porovnateľnosť farmakokinetiky/farmakodynamiky medzi dvoma farmaceutickými formami Oncasparu (injekčný/infúzny roztok a prášok na injekčný roztok) bola preukázaná u psov po jednej a opakovaných dávkach (500 U/kg) intravenóznou cestou. Nižšie uvedené štúdie sa vykonali
s injekčným/infúznym roztokom.
Akútna toxicita
Len veľmi vysoké dávky pegaspargázy podané myšiam intraperitoneálne ako jedna dávka (25 000 –
100 000 U/kg telesnej hmotnosti) spôsobili úmrtie 14 % všetkých liečených myší. Pri rovnakom dávkovaní bola pozorovaná mierna hepatotoxicita. Nežiaduce reakcie zahŕňali úbytok telesnej hmotnosti, piloerekciu a zníženú aktivitu. Znížená hmotnosť sleziny môže byť známkou potenciálnych imunosupresívnych vlastností liečby.
Pegaspargáza bola dobre znášaná potkanmi a psami, keď bola podávaná intravenózne v jednej dávke až 500 U/kg.
Toxicita po opakovanom podávaní
4-týždňová štúdia s pegaspargázou u potkanov pri dávkach 400 U/kg/deň podávaných intraperitoneálne viedla k poklesu príjmu potravy a úbytku telesnej hmotnosti v porovnaní s kontrolnou skupinou.
3-mesačná štúdia s pegaspargázou u myší pri dávkach do 500 U/kg podávaných intraperitoneálne alebo intramuskulárne viedla k miernym hepatocelulárnym zmenám len u najvyššej intraperitoneálnej dávky.
U psov liečených pegaspargázou v dávke 1 200 U/kg týždenne po dobu 2 týždňov bol pozorovaný dočasne znížený nárast telesnej hmotnosti a mierne dočasné zníženie celkového počtu leukocytov. U jedného zo štyroch psov sa tiež vyskytla zvýšená aktivita glutamátpyruváttransaminázy v sére.
Imunogenicita
V 12-týždennej štúdii u myší, ktorým bola pegaspargáza podávaná týždenne v dávke 10,5 U/myš intramuskulárne alebo intraperitoneálne nebola detekovaná žiadna imunogénna reakcia.
Reprodukčná toxicita
Neuskutočnili sa žiadne štúdie reprodukčnej toxicity s pegaspargázou.
Štúdie embryotoxicity s L-asparaginázou poskytli dôkazy o teratogénnom potenciáli u potkanov liečených od 6. do 15. dňa gestácie, pričom hodnota bez pozorovaných účinkov (No Observed Effect Level, NOEL) pre teratogénne účinky bola 300 U/kg intravenózne. U králikov boli výsledkom
dávok 50 až 100 U/kg podaných intravenózne na 8. a 9. deň gestácie životaschopné plody s vrodenými malformáciami: hodnota NOEL nebola stanovená. Pri dávkach v terapeutickom rozsahu boli pozorované mnohopočetné malformácie a embryoletálne účinky. Skúmanie účinku na fertilitu, perinatálny a postnatálny vývoj nebolo vykonané.
Karcinogenita, mutagenita, fertilita
Dlhodobý výskum karcinogenity alebo štúdie účinku na fertilitu zvierat neboli s pegaspargázou vykonané.
Pegaspargáza nebola mutagénna v Amesovom teste používajúcom kmene Salmonella typhimurium.
6
. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
heptahydrát fosforečnanu disodného monohydrát dihydrogénfosforečnanu sodného chlorid sodný
sacharóza
hydroxid sodný (na úpravu pH)
kyselina chlorovodíková (na úpravu pH)
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
2 roky.
Rekonštituovaný roztok
Chemická a fyzikálna stabilita počas používania bola preukázaná počas 24 hodín pri teplote nižšej ako
25 °C. Z mikrobiologického hľadiska platí, že ak metóda rekonštitúcie nevylučuje riziko mikrobiálnej kontaminácie, produkt sa má použiť okamžite. Ak sa nepoužije okamžite, za časy a podmienky skladovania počas používania zodpovedá používateľ.
Zriedený roztok
Chemická a fyzikálna stabilita počas používania bola preukázaná počas 48 hodín pri teplote 2° C –
8 °C. Z mikrobiologického hľadiska platí, že produkt sa má použiť okamžite. Ak sa nepoužije okamžite, za časy a podmienky skladovania pred použitím zodpovedá používateľ a za normálnych okolností nepôjde o obdobie dlhšie ako 24 hodín pri teplote 2° C – 8 °C, za predpokladu, že rekonštitúcia/riedenie sa nevykonali v kontrolovaných a overených aseptických podmienkach.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 25 °C.
Podmienky uchovávania rekonštituovaného a zriedeného lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Liekovka z flintového skla typu I s chlórobutylovou elastomérovou zátkou s 20 mm hliníkovým vyklápacím uzáverom s obsahom 3 750 U pegaspargázy.
Veľkosť balenia po 1 ks.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Tento liek môže spôsobiť podráždenie pri kontakte. Preto sa s práškom musí zaobchádzať a podávať
ho mimoriadne opatrne. Musí sa zabrániť inhalácii pary a kontaktu s kožou a so sliznicami, najmä s očami. Ak sa liek dostane do kontaktu s očami, pokožkou alebo sliznicou, okamžite vyplachujte veľkým množstvom vody po dobu najmenej 15 minút.
Oncaspar je po rekonštitúcii určený na intravenózne alebo intramuskulárne podanie. Prášok musí byť
pred podaním rekonštituovaný s 5,2 ml vody na injekciu (pozri časť 4.2).
Návod na použitie
1. Personál má byť zaškolený na zaobchádzanie s liekom a jeho premiestňovanie (gravidné pracovníčky nemajú pracovať s týmto liekom).
2. Musí sa použiť aseptická technika.
3. Majú sa dodržiavať postupy správneho zaobchádzania s antineoplastikami.
4. Pri manipulácii s Oncasparom sa odporúča použitie jednorazových rukavíc a ochranného odevu.
5. Všetky pomôcky na podávanie alebo čistenie vrátane rukavíc sa majú umiestniť do vriec s vysoko rizikovým odpadom na spálenie pri vysokej teplote.
Rekonštitúcia1. Do liekovky sa pomocou striekačky a ihly veľkosti 21 vstrekne 5,2 ml vody na injekciu.
2. Liekovkou treba jemne víriť, kým sa prášok nerekonštituuje.
3. Roztok má byť po rekonštitúcii číry, bezfarebný a nemá obsahovať žiadne viditeľné cudzie telesá. Rekonštituovaný roztok nepoužívajte, ak je zakalený alebo sa v ňom vytvorila zrazenina. Nepretrepávajte.
4. Roztok sa má použiť do 24 hodín po rekonštitúcii, ak sa skladuje pri teplote do 25 °C.
Podávanie1. Parenterálne lieky sa majú pred podaním skontrolovať, či neobsahujú nejaké častice. Použiť sa má len číry, bezfarebný roztok, ktorý neobsahuje viditeľné cudzie telesá.
2. Liek sa má podávať intravenózne alebo intramuskulárne. Roztok sa má podávať pomaly.
V prípade intramuskulárnej injekcie by objem nemal prekročiť 2 ml u detí a dospievajúcich a 3 ml u dospelých.
Na intravenózne podanie sa má rekonštituovaný roztok zriediť v 100 ml injekčného roztoku chloridu sodného s koncentráciou 9 mg/ml (0,9 %) alebo v 5 % roztoku glukózy.
Zriedený roztok sa môže podávať počas 1 alebo 2 hodín spolu s už tečúcou infúziou chloridu sodného s koncentráciou 9 mg/ml alebo 5 % roztoku glukózy. Počas podávania Oncasparu nepodávajte cez tú istú intravenóznu infúziu iné lieky (pozri časť 4.2).
Roztok sa má po zriedení okamžite použiť. Ak okamžité použitie nie je možné, zriedený roztok sa môže skladovať pri teplote 2° C – 8 °C najviac 48 hodín (pozri časť 6.3).
LikvidáciaOncaspar je určený na jedno použitie.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBaxalta Innovations GmbH Industriestrasse 67
A – 1221 Viedeň
Rakúsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/15/1070/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 14. januára 2016
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.