
a dávky.
Pediatrická populácia
Použitie lieku NUCEIVA sa netýka pediatrickej populácie.
Spôsob podávania
Intramuskulárne použitie.
Po rekonštitúciisamáliekNUCEIVApoužiťlennaliečbujednéhopacientapočasjednéhosedenia.
Opatrenie pred zaobchádzaním alebo podaním lieku
Pokyny týkajúce sa použitia lieku, opatrení pred zaobchádzaním s liekom alebo jeho podaním, zaobchádzania s injekčnými liekovkami a ich likvidácie, pozri časť 6.6.
Ak sa liek NUCEIVA injekčne podáva do vertikálnych vrások medzi obočiami viditeľných pri maximálnom mračení sa (tiež známych ako glabelárne línie), je potrebné postupovať opatrne
a zabezpečiť, aby sa liek nepodal injekčne do krvnej cievy (pozri časť 4.4).
Je potrebné vyhnúť sa fyzickej manipulácii (ako je trenie) v mieste podania injekcie v čase
bezprostredne po jej podaní.
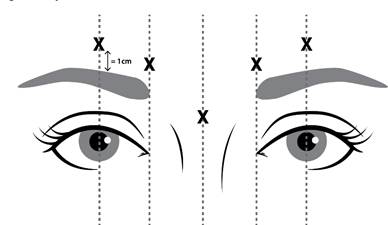
Pokyny týkajúce sa podávania do glabelárnych línií viditeľných pri maximálnom mračení sa Rekonštituovaný liek NUCEIVA (100 jednotiek/2,5 ml) sa podáva injekčne pomocou sterilnej injekčnej ihly s veľkosťou 30 G.
Na zníženie rizika ptózy očného viečka sa majú vykonať tieto opatrenia:
• majú sa podať dve injekcie do každého svalu corrugator supercilii (zvrašťovač obočia) (zospodu a zvrchu strednej časti) a jedna injekcia do svalu procerus (štíhly sval) s celkovou dávkou 20 jednotiek,
• má sa zabrániť podaniu injekcie v blízkosti svalu levator palpebrae superioris (zdvíhač horného viečka) najmä u pacientov s veľkými komplexmi sťahovača obočia (depressor supercilii),
• injekcie do laterálneho svalu corrugator sa majú podávať aspoň 1 cm nad nadočnicový oblúk.
O
b
r
á
z
o
k 1 Miesta podania injekcie
 4.3 Kontraindikácie
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Generalizované poruchy činnosti svalov (napr. myasténia gravis alebo Lambertov-Eatonov syndróm) Infekcia alebo zápal v navrhovaných miestach podania injekcie.
4.4 Osobitné upozornenia a opatrenia pri používaníVšeobecnéPred podaním lieku NUCEIVA je potrebné poznať anatómiu a anatomické prvky svalov
procerusa
corrugator supercilii a štruktúru okolitých ciev a nervov, ktoré sa nachádzajú v oblasti glabelárnych
línií. Je nutné zabrániť injekčnému podaniu do zraniteľných anatomických štruktúr, ako sú nervy a krvné cievy.
S podaním injekcie sa spájala lokalizovaná bolesť, zápal, parestézia, znížená citlivosť, bolestivosť, opuch/edém, erytém, lokalizovaná infekcia, krvácanie a/alebo modriny. Bolesť a/alebo úzkosť súvisiaca s injekčnou ihlou viedli k vazovagálnym reakciám vrátane prechodnej symptomatickej hypotenzie a synkopy.
Je potrebné postupovať opatrne, ak cieľový sval vykazuje nadmernú slabosť alebo atrofiu.
Ak sa liek NUCEIVA injekčne podáva do glabelárnych línií viditeľných pri maximálnom mračení sa, je potrebné postupovať opatrne a zabezpečiť, aby sa liek nepodal injekčne do krvnej cievy (pozri
časť 4.2).
Existuje riziko ptózy očného viečka po liečbe (pozri časť 4.2).
Je potrebné postupovať opatrne, ak sa po predchádzajúcom injekčnom podaní botulínového toxínu vyskytli komplikácie.
Poruchy zrážanlivosti krviJe potrebné postupovať opatrne, ak sa liek NUCEIVA používa u pacientov s poruchami zrážania krvi.
Po injekčnom podaní môže u týchto pacientov dôjsť k vzniku modrín.
Lokálne a vzdialené šírenie toxínového účinkuVeľmi zriedkavo sa pri podávaní botulínového toxínu hlásili nežiaduce reakcie pravdepodobne
súvisiace s rozšírením toxínu ďalej od miesta podania (pozri časť 4.8). Ťažkosti s prehĺtaním
a dýchaním sú závažné a môžu spôsobiť smrť. Injekciu lieku NUCEIVA sa neodporúča podávať
pacientom s dysfágiou a aspiráciou v anamnéze.
Pacienti alebo ich ošetrovatelia majú byť poučení, aby ihneď vyhľadali lekársku pomoc, ak sa u nich vyskytnú poruchy prehĺtania, reči alebo dýchania.
Existujúce neuromuskulárne poruchy
Pacienti s neznámymi neuromuskulárnymi poruchami môžu byť vystavení zvýšenému riziku klinicky
významných systémových účinkov, vrátane závažnej dysfágie a respiračnej poruchy, po podaní bežných dávok botulínového toxínu typu A. V niektorých z týchto prípadov trvala dysfágia niekoľko
mesiacov a vyžadovala zavedenie žalúdočnej vyživovacej sondy (pozri časť 4.3).
Je potrebné postupovať opatrne, ak sa botulínový toxín typu A používa na liečbu pacientov
s amyotrofickou laterálnou sklerózou alebo s periférnymi neuromuskulárnymi poruchami.
Reakcie z precitlivenosti
Po injekčnom podaní botulínového toxínu sa môže veľmi zriedkavo vyskytnúť anafylaktická reakcia.
Preto má byť k dispozícii epinefrín (adrenalín) alebo iné antianafylaktické opatrenia.
Tvorba protilátok
V priebehu liečby botulínovým toxínom sa môžu vytvoriť protilátky proti botulínovému toxínu typu
A. Niektoré z vytvorených protilátok majú neutralizačné účinky, čo môže viesť k zlyhaniu liečby
botulínovým toxínom typu A.
Je nevyhnutné, abysaliekNUCEIVApoužillennaliečbujednéhopacientapočasjednéhosedenia.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
Teoreticky môže byť účinok botulínového toxínu zosilnený aminoglykozidovými antibiotikami, spektinomycínom alebo inými liekmi, ktoré ovplyvňujú neuromuskulárny prenos (napr. neuromuskulárne blokátory).
Vplyv podania rôznych sérotypov botulínových neurotoxínov v rovnakom čase alebo v priebehu niekoľkých mesiacov nie je známy. Nadmerná neuromuskulárna slabosť sa môže zhoršiť po podaní ďalšieho botulínového toxínu pred odznením účinkov predtým podaného botulínového toxínu.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii primerané údaje o použití botulínového toxínu typu A u gravidných žien. Štúdie na
zvieratách sú nedostatočné, pokiaľ ide o reprodukčnú toxicitu (pozri časť 5.3). Liek NUCEIVA sa
neodporúča používať počas gravidity a u žien vo fertilnom veku, ktoré nepoužívajú antikoncepciu.
Dojčenie
Nie sú k dispozícii žiadne informácie o tom, či sa liek NUCEIVA vylučuje do materského mlieka.
Liek NUCEIVA sa nemá používať počas dojčenia.
Fertilita
Vplyv lieku NUCEIVA na plodnosť u ľudí nie je známy. V prípade iného botulínového toxínu typu A
sa však preukázalo, že znižuje plodnosť samcov a samíc zvierat.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
NUCEIVA má malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Existuje potenciálne riziko vzniku asténie, svalovej slabosti, závratu a poruchy videnia, ktoré môžu ovplyvniť schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Po liečbe liekom NUCEIVA sa môžu vyskytnúť závažné nežiaduce účinky vrátane ptózy očného
viečka, imunitnej odpovede, vzdialeného rozšírenia toxínu, vzniku alebo zhoršenia neuromuskulárnej
poruchy a reakcií z precitlivenosti. Medzi nežiaduce účinky najčastejšie hlásené v priebehu liečby patrí bolesť hlavy, ktorá sa vyskytuje u 9,0 % pacientov, a ptóza očného viečka vyskytujúca sa u 1,0 % pacientov.
Tabuľkový prehľad nežiaducichreakcií
Tabuľka 1 Nežiaduce reakcie súvisiace s podaním lieku NUCEIVA sú klasifikované podľa triedy
orgánových systémov a frekvencia výskytu je definovaná nasledovne: veľmi časté (≥ 1/10), časté
(≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi
zriedkavé (< 1/10 000).
Trieda orgánových
systémov Preferovaný výraz Frekvencia
Infekcie a nákazy infekcia horných dýchacích ciest zriedkavé
Psychické poruchy depresia zriedkavé
Poruchy nervovej sústavy bolesť hlavy časté
závraty, migréna, porucha
svalového tonusu, porucha reči
menej časté
dyzestézia, bolesť hlavy,
hypoestézia, parestézia, poruchy zmyslového vnímania
zriedkavé
Poruchy oka ptóza očného viečka časté
astenopia, blefarospazmus,
ptóza obočia, edém očného viečka, opuch očí, rozmazané
videnie
diplopia, suché oko, porucha senzorickej inervácie očných viečok
menej časté
zriedkavé
Poruchy ucha a labyrintu vertigo zriedkavé
Poruchy ciev návaly horúčavy zriedkavé
Poruchy dýchacej sústavy,
hrudníka a mediastína
epistaxa zriedkavé
Poruchy gastrointestinálneho
traktu
hnačka zriedkavé
Poruchy kože a
podkožného tkaniva
svrbenie (pruritus) menej časté
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
Celkové poruchy
a reakcie v mieste podania
kožná cysta, erytém,
fotosenzitívna reakcia, hromadenie kožného tkaniva,
napnutie kože
svalové zášklby, muskuloskeletárnabolesť, myalgia, bolesť krku
modriny v mieste podania injekcie, ochorenie podobné chrípke, bolesť v mieste podania injekcie, opuch v mieste podania injekcie
erytémv mieste podania injekcie, parestézia v mieste podania injekcie, svrbenie (pruritus)
v mieste podania injekcie, bolesť,
citlivosť
zriedkavé
zriedkavé
časté
zriedkavé
Laboratórne a funkčné
vyšetrenia
meranie vnútroočného tlaku zriedkavé
Úrazy, otravy
a komplikácie liečebného
postupu
kontúzia menej časté
opuch po liečebnom postupe, bolesť hlavy v priebehu liečebného postupu
zriedkavé
P
oznámka: Zriedkavé nežiaduce reakcie sa vyskytli len u 1 z 1 659 pacientov liečených liekom
NUCEIVA. Menej časté nežiaduce reakcie sa vyskytli u 2 až 7 pacientov.
Opis vybraných nežiaducich reakcií
Nežiaduce reakcie súvisiace s podávaním injekcie
Nežiaduce účinky súvisiace s podávaním injekcie, ktoré boli hlásené po podaní lieku NUCEIVA, sa
z hľadiska jednotlivých frekvencií vyskytujú menej často, z hľadiska všetkých frekvencií sa vyskytujú
často. Patrí sem modrina v mieste podania injekcie, bolesť a opuch v mieste podania injekcie. Zriedkavo sa vyskytujúce reakcie v mieste podania injekcie, ktoré boli hlásené, zahŕňajú erytém, parestéziu, pruritus, bolesť a citlivosť.
Nežiaduce účinky liečiv z triedy botulínového toxínu typu A
Svalová atrofia
Svalová atrofia sa očakáva po opakovanej liečbe botulínovým toxínom ako sekundárny účinok chabej
paralýzy liečených svalov.
Rozšírenie toxínuPri používaní botulínového toxínu boli veľmi zriedkavo hlásené nežiaduce reakcie pravdepodobne súvisiace s rozšírením toxínu ďalej od miesta podania (napr. svalová slabosť, ťažkosti s dýchaním,
dysfágia alebo zápcha) (pozri časť 4.4).
Reakcie z precitlivenostiPo injekčnom podaní botulínového toxínu sa môže veľmi zriedkavo vyskytnúť anafylaktická reakcia. Preto má byť k dispozícii epinefrín (adrenalín) alebo iné antianafylaktické opatrenia.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieSymptómy predávkovaniaPrejavy predávkovania nemusia byť zjavné ihneď po injekčnom podaní lieku. V prípade náhodného
injekčného podania lieku alebo jeho perorálneho užitia má byť pacient niekoľko dní pod lekárskym dohľadom z dôvodu sledovania prejavov a príznakov celkovej slabosti alebo svalovej paralýzy.
U pacientov s príznakmi otravy botulínovým toxínom typu A (celková slabosť, ptóza, diplopia, poruchy prehĺtania a reči alebo paréza dýchacích svalov) sa má zvážiť hospitalizácia.
Príliš časté alebo nadmerné podávanie lieku môže zvýšiť riziko tvorby protilátok. Tvorba protilátok môže viesť k zlyhaniu liečby.
Predávkovanie liekom NUCEIVA závisí od dávky, miesta podania injekcie a základných vlastností tkaniva. Neboli pozorované žiadne prípady systémovej toxicity vyplývajúce z neúmyselného injekčného podania botulínového toxínu typu A. Nadmerné dávky môžu spôsobiť lokálnu alebo vzdialenú generalizovanú a závažnú neuromuskulárnu paralýzu. Neboli hlásené žiadne prípady perorálneho užitia botulínového toxínu typu A.
Postup v prípade predávkovaniaV prípade predávkovania má byť pacient pod lekárskym dohľadom z dôvodu sledovania príznakov
nadmernej svalovej slabosti alebo svalovej paralýzy. Ak je to potrebné, má sa začať so
symptomatickou liečbou.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Myorelaxanciá, iné periférne pôsobiace myorelaxanciá
ATC kód: M03AX01.
Mechanizmus účinkuBotulínovýtoxín typu A (neurotoxín baktérie
Clostridium botulinum) blokuje periférne uvoľňovanie
acetylcholínu na presynaptických cholinergných nervových zakončeniach štiepením proteínu SNAP-
25, ktorý je nevyhnutný na úspešné viazanie a uvoľňovanie acetylcholínu z vezikúl nachádzajúcich sa v nervových zakončeniach, čo vedie k denervácii svalu a k chabej paralýze.
Po podaní injekcie nasleduje začiatočné rýchle vysoko-afinitné naviazanie toxínu na špecifické receptory na povrchu buniek. Potom nasleduje prenos toxínu cez plazmatickú membránu receptormi sprostredkovanou endocytózou. Nakoniec sa toxín uvoľňuje do cytosólu, pričom dochádza
k progresívnej inhibícii uvoľňovania acetylcholínu. Klinické prejavy sa objavia do 2 – 3 dní s maximálnym účinkom pozorovaným do 4 týždňov po podaní injekcie.
K regenerácii po intramuskulárnej injekcii dochádza zvyčajne do 12 týždňov po podaní injekcie, keď sa nervové zakončenia obnovia a opäť spoja s platničkami v nervových zakončeniach.
Klinická účinnosť abezpečnosť
Glabelárne línie
Do európskej/kanadskej klinickej štúdie bolo zahrnutých 540 pacientov s miernymi až hlbokými glabelárnymi líniami viditeľnými pri maximálnom mračení sa, na ktorých mali ich glabelárne línie významný psychologický vplyv (na náladu, úzkosť alebo symptómy depresie).
Podľa meraní vyšetrujúceho lekára vykonaných v rámci posúdenia hĺbky glabelárnej línie pri maximálnom mračení sa, injekcie lieku NUCEIVA výrazne redukovali hĺbku glabelárnych línií pri maximálnom mračení sa o jeden alebo viac stupňov až počas 139 dní.
Tabuľka 2 – Primárny ukazovateľ účinnosti – Hodnoty podľa škály glabelárnych línií 0 (žiadne) alebo 1 (jemné) v 30. deň pri maximálnej kontrakcii posúdené vyšetrujúcim lekárom, PP populácia
Respondenti –
primárny
ukazovateľ účinnosti
Placebo BOTOX NUCEIVA
BOTOX oproti placebu
Úplný rozdiel
NUCEIVA
oproti placebu
NUCEIVA oproti BOTOXU
Počet 2/48 202/244 205/235
Percentuálny
podiel 4,2 % 82,8 % 87,2 % 78,6 % 83,1 % 4,4 %
(% CI) (0,0; 9,8) (78,1;
87,5)
(83,0; 91,5) (66,5;
85,5)
(70,3; 89,4) (– 1,9; 10,8)


P-hodnota < 0,001 < 0,001
Škála glabelárnych línií (glabellar line scale, GLS); 0 = žiadne línie, 1 = jemné línie, 2 = mierne línie,
3 = hlboké línie
Dva dni po podaní injekcie bolo 12,2 % (6/49) pacientov liečených placebom, 57,0 % (139/244) pacientov liečených liekom BOTOX a 54,2 % (130/240) pacientov liečených liekom NUCEIVA posudzovaných vyšetrujúcimi lekármi ako respondenti na liečbu (žiadne alebo jemne hlboké línie pri maximálnom mračení sa).
T
abuľka 3 – Výskumný ukazovateľ účinnosti – Hodnoty podľa škály glabelárnych línií 0 (žiadne) alebo 1 (jemné) v 30. deň pri maximálnej kontrakcii u pacientov liečených liekom NUCEIVA, posúdené vyšetrujúcim lekárom –– porovnanie s východiskovými hodnotami podľa GLS pri maximálnej kontrakcii, ITT populácia
NUCEIVA (N = 245)
Východiskové hodnoty podľa GLS pri
maximálnej kontrakcii
2 (mierne)
GLS = 0 pri maximálnej kontrakcii v 30. deň
GLS = 1 pri maximálnej kontrakcii v 30. deň
Počet 35/62 25/62
Percentuálny podiel 56,5 % 40,3 %
3 (hlboké)
Počet 41/179 108/179
Percentuálny podiel 22,9 % 60,3 %
Škála glabelárnych línií (glabellar line scale, GLS); 0 = žiadne línie, 1 = jemné línie, 2 = mierne línie,
3 = hlboké línie. Číselné údaje sú založené na počte pacientov so špecifikovanou východiskovou hĺbkou pri maximálnej kontrakcii, ktorí mali východiskové a GLS hodnoty v 30. deň pri maximálnej
kontrakcii posúdené vyšetrujúcim lekárom.
Tabuľka 4 – Výskumný ukazovateľ účinnosti – Hodnoty podľa škály glabelárnych línií 0 (žiadne) alebo 1 (jemné) v 30. deň pri maximálnej kontrakcii u pacientov liečení liekom NUCEIVA, posúdené vyšetrujúcim lekárom –– porovnanie s východiskovými kategóriami GLS v pokoji, ITT populácia
NUCEIVA (N = 245)
Východisková kategória GLS v pokoji
≤ 1 (t. j., žiadne alebo jemné)
GLS = 0 pri maximálnej kontrakcii v 30. deň'
GLS = 1 pri maximálnej kontrakcii v 30. deň






Počet 61/103 40/103
Percentuálny podiel 59,2 % 38,8 %
> 1 (t. j., mierne alebo hlboké)
Počet 15/138 93/138
Percentuálny podiel 10,9 % 67,4 %
Škála glabelárnych línií (glabellar line scale, GLS); 0 = žiadne línie, 1 = jemné línie, 2 = mierne línie,
3 = hlboké línie. Číselné údaje sú založené na počte pacientov so špecifikovanou východiskovou hĺbkou v pokoji, ktorí tiež mali východiskové a GLS hodnoty v 30. deň pri maximálnej kontrakcii
posúdené vyšetrujúcim lekárom.
Injekcie lieku NUCEIVA redukovali hĺbku glabelárnych línií v pokoji – výskumný ukazovateľ.
T
abuľka 5 – Výskumný ukazovateľ účinnosti – Hodnoty podľa škály glabelárnych línií zlepšené
o >/= 2 stupeň v 30. deň v pokoji posúdené vyšetrujúcim lekárom, PP populácia
Respondenti – výskumný ukazovateľ účinnosti
Placebo BOTOX NUCEIVA
BOTOX oproti placebu
Úplný rozdiel
NUCEIVA oproti placebu
NUCEIVA oproti BOTOXU
Počet 0/27 36/149 32/133
Percentuálny
podiel 0 % 24,2 % 24,1 % 24,2 % 24,1 % – 0,1 %
(% CI) (0,0; 12,8) (17,5; 31,8) (17,1; 32,2) (11,4;
32,3)
(11,3; 32,4) (– 10,1; 9,9)


P-hodnota 0,003 0,003 0,984
U pacientov starších ako 65 rokov sú klinické údaje o lieku NUCEIVA obmedzené.
Trvanie odpovede v štúdii fázy 3 bolo 139 dní na základe zlepšenia hodnotenia podľa GLS o 1 stupeň.
Celkovo 922 pacientov sa zúčastnilo na 2 jednoročných otvorených nekontrolovaných štúdiách
a v priebehu týchto štúdií dostal priemerný pacient 3 liečby.
Psychologický vplyv glabelárnych línií bol potvrdený pri vstupe do štúdie a hoci nemohol byť preukázaný priaznivý účinok na psychickú pohodu, pri porovnaní s placebom svedčili výsledky hlásené pacientmi o značnom účinku. Navyše, účinky lieku NUCEIVA na psychickú pohodu a výsledky hlásené pacientmi boli porovnateľné s liekom BOTOX, čo bolo aktívna kontrolná látka použitá v hlavnej štúdii.
5.2 Farmakokinetické vlastnostiPo podaní intramuskulárnej injekcie v odporúčanej dávke sa nezistila prítomnosť lieku NUCEIVA
v periférnej krvi.
Štúdie týkajúce sa absorpcie, distribúcie, biotransformácie a eliminácie liečiva neboli vykonané kvôli povahe tohto lieku.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe obvyklých štúdií akútnej toxicity a toxicity po opakovanom
podávaní neodhalili žiadne osobitné riziko pre ľudí.
Reprodukčná toxicitaPotenciálny vplyv lieku NUCEIVA na plodnosť sa u zvierat neskúmal. U gravidných potkanov denné
intramuskulárne injekcie s obsahom 0,5; 1 alebo 4 jednotiek/kg počas obdobia organogenézy (od 6. do
16. dňa gravidity) nevyvolali významné toxikologické účinky na gravidné samice ani na embryofetálny vývoj plodu. Účinky na peri-/postnatálny vývoj sa nehodnotili.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokľudský albumín chlorid sodný
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
Neotvorená injekčná liekovka
30 mesiacov
Rekonštituovaný roztok
Chemická a fyzikálna stabilita pri používaní sa preukázala počas 72 hodín pri teplote 2 °C až 8 °C.
Z mikrobiologického hľadiska sa má liek použiť okamžite. Ak sa nepoužije okamžite, za čas
a podmienky uchovávania pripraveného roztoku pred použitím zodpovedá používateľ a zvyčajne nemá
prekročiť 24 hodín pri teplote 2 °C až 8 °C, ak sa rekonštitúcia/riedenie lieku nevykonala/nevykonalo v kontrolovaných a validovaných aseptických podmienkach.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (pri teplote 2 °C – 8 °C).
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Injekčná liekovka (sklo typu I) so zátkou (z chlórbutylovej gumy) a s (hliníkovým) uzáverom.
Veľkosť balenia: po 1 kuse.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Rekonštitúcia sa má vykonávať v súlade so zásadami aseptickej metódy. Liek NUCEIVA sa rekonštituuje injekčným roztokom chloridu sodného s koncentráciou 9 mg/ml(0,9 %). Podľa nižšie uvedenej tabuľky riedenia sa množstvo injekčného roztoku chloridu sodného s koncentráciou 9 mg/ml (0,9 %) natiahne do injekčnej striekačky, aby sa získal rekonštituovaný roztok s koncentráciou
4 jednotky/0,1 ml.
Množstvo rozpúšťadla [9 mg/ml (0,9 %) injekčného
roztoku chloridu sodného] pridaného do injekčnej

liekovky obsahujúcej 100 jednotiek.
Výsledná dávka (jednotky na 0,1 ml)
2,5 ml 4 jednotky
Stredná časť gumovej zátky sa musí očistiť alkoholom.
Roztok sa pripraví tak, že sa rozpúšťadlo pomaly vstrekuje do injekčnej liekovky ihlou cez gumovú zátku a jemným otáčaním liekovky sa zabráni tvorbe bublín. Ak vákuum nenatiahne rozpúšťadlo do injekčnej liekovky, injekčná liekovka sa musí zlikvidovať. Po rekonštitúcii sa má roztok pred použitím vizuálne skontrolovať. Použiť sa môže len číry bezfarebný roztok bez prítomnosti častíc.
Rekonštituovaný liek NUCEIVA (100 jednotiek/2,5 ml) sa podáva injekčne pomocou sterilnej injekčnej ihly s veľkosťou 30 G. Do každého z piatich miest podania (pozri obrázok 1) sa podajú štyri jednotky (4 jednotky/0,1 ml). Dve injekcie do každého svalu corrugator supercilii (zvrašťovač obočia) (zospodu a zvrchu strednej časti) a jedna injekcia do svalu procerus (štíhly sval) s celkovou dávkou
20 jednotiek.
Je nevyhnutné, abysaliekNUCEIVApoužillennaliečbujednéhopacientapočasjednéhosedenia.
Postup,ktorýsamusídodržaťscieľombezpečnezlikvidovaťinjekčnéliekovky,injekčné
striekačky apoužitýmateriál:
Ihneď po použití a pred likvidáciou sa musí nepoužitý rekonštituovaný roztok lieku NUCEIVA
v injekčnej liekovke a/alebo injekčnej striekačke inaktivovať 2 ml zriedeného roztoku chlórnanu sodného s koncentráciou 0,5 % alebo 1 % (Javelov roztok) a má sa zlikvidovať v súlade s miestnymi požiadavkami.
Použité injekčné liekovky, injekčné striekačky a materiál sa nesmú vyprázdniť a musia sa zlikvidovať vo vhodných nádobách ako zdravotnícky biologicky nebezpečný odpad v súlade s miestnymi požiadavkami.
Odporúčania v prípade nehody pri zaobchádzaní s botulínovým toxínom:
V prípade nehody pri zaobchádzaní s liekom, v stave vákuovo vysušeného lieku alebo
v rekonštituovanom stave sa musia ihneď zaviesť príslušné opatrenia uvedené nižšie.
• Toxín je veľmi citlivý na teplo a určité chemické látky.
• Akýkoľvek rozliaty liek sa musí utrieť: absorpčným materiálom nasiaknutým v roztoku chlórnanu sodného (Javelov roztok) v prípade vákuovo vysušeného lieku, alebo suchým absorpčným materiálom v prípade rekonštituovaného lieku.
• Kontaminované plochy sa musia očistiť absorpčným materiálom nasiaknutým v roztoku chlórnanu sodného (Javelov roztok) a následne osušiť.
• Ak sa injekčná liekovka rozbije, opatrne pozbierajte kusy skla a utrite liek, ako sa uvádza
vyššie, aby ste zabránili porezaniu kože.
• Ak sa liek dostane do styku s kožou, umyte miesto roztokom chlórnanu sodného a dôkladne
opláchnite veľkým množstvom vody.
• Ak liek zasiahne oči, dôkladne ich opláchnite veľkým množstvom vody alebo roztokom na výplach očí.
Ak sa poraní osoba podávajúca injekciu (porezanie, pichnutie), postupujte podľa vyššie uvedených
pokynov a vykonajte príslušné zdravotné opatrenia.
Tieto pokyny na použitie lieku, zaobchádzanie s ním a na jeho likvidáciu sa musia prísne dodržiavať.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
EvolusPharmaLtd
70 Sir John Rogerson’sQuay
Dublin 2
Írsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
EU/1/19/1364/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.