
je na podanie celej dávky potrebná viac ako jedna injekcia, každá injekcia sa musí podať do iného miesta.
Somatrogon sa má podávať jedenkrát týždenne, rovnaký deň každý týždeň, kedykoľvek počas dňa.
Ngenla 24 mg injekčný roztok v naplnenom pere
Naplneným perom sa podávajú dávky od 0,2 mg do 12 mg somatrogonu s prírastkami po 0,2 mg
(0,01 ml).
Ngenla 60 mg injekčný roztok v naplnenom pere
Naplneným perom sa podávajú dávky od 0,5 mg do 30 mg somatrogonu s prírastkami po 0,5 mg
(0,01 ml).
Pokyny týkajúce sa lieku pred podaním, pozri v časti 6.6 a na konci písomnej informácie pre používateľa.
4.3 Kontraindikácie
Precitlivenosť na somatrogon (pozri časť 4.4) alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Na základe skúseností s dennou liečbou rastovým hormónom sa somatrogon nesmie používať v prípade potvrdenej aktivity nádoru. Intrakraniálne nádory musia byť inaktívne a protinádorová liečba skončená pred začatím liečby rastovým hormónom (RH – rastový hormón). Liečba sa má prerušiť pri preukázanom raste nádoru (pozri časť 4.4).
Somatrogon sa nesmie používať na podporu rastu u detí s uzavretými epifyzálnymi rastovými štrbinami.
Pacienti s vážnym akútnym ochorením, komplikáciami po otvorenej operácii srdca, operácii brucha, viacnásobnej úrazovej traume, akútnom respiračnom zlyhaní a podobnými stavmi nemajú byť liečení somatrogonom (pre pacientov podstupujúcich substitučnú liečbu, pozri časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
Sledovateľnosť
Aby sa zlepšila (do)sledovateľnosť biologického lieku, má sa zrozumiteľne zaznamenať názov a číslo
šarže podaného lieku.
Precitlivenosť
Pri denne podávanom rastovom hormóne boli hlásené závažné systémové hypersenzitívne reakcie
(napr. anafylaxia, angioedém). Ak sa objaví závažná hypersenzitívna reakcia, používanie somatrogonu sa musí okamžite ukončiť; pacienti sa musia bezodkladne liečiť v súlade so štandardnou starostlivosťou a sledovať, kým prejavy a príznaky nevymiznú (pozri časť 4.3).
Hypoadrenalizmus
Na základe zverejnených údajov, pacienti liečení denne podávaným rastovým hormónom, ktorí majú
alebo u nich existuje riziko vzniku deficiencie hypofyzárneho hormónu(ov), môžu byť vystavení riziku znížených sérových hladín kortizolu a/alebo nemaskovaného centrálneho (sekundárneho) hypoadrenalizmu. Okrem toho, u pacientov liečených substitučnou glukokortikoidovou terapiou
v dôsledku skoršie diagnostikovaného hypoadrenalizmu môže byť po začatí liečby somatrogonom potrebné zvýšenie udržiavacích dávok alebo dávok potrebných v stresových situáciách (pozri časť
4.5). U pacientov je potrebné sledovať zníženie sérových hladín kortizolu a/alebo potrebu zvýšenia dávky glukokortikoidov u tých so známym hypoadrenalizmom (pozri časť 4.5).
Funkcia štítnejžľazy
Rastový hormón zvyšuje extratyroidálnu konverziu T4 na T3 a môže odhaliť začínajúcu hypotyreózu.
Pacienti s už prítomnou hypotyreózou sa majú adekvátnym spôsobom liečiť pred začiatkom liečby somatrogonom, ako je indikované na základe klinického vyšetrenia. Keďže hypotyreóza interferuje
s odpoveďou na liečbu rastovým hormónom, pacientom sa musí pravidelne vyšetrovať funkcia štítnej
žľazy a keď je to indikované, musia sa liečiť substitučnou liečbou tyroidným hormónom (pozri časti
4.5 a 4.8).
Praderov-Willihosyndróm
Somatrogon sa neštudoval u pacientov s Praderovým-Williho syndrómom. Somatrogon nie je
indikovaný na dlhodobú liečbu pediatrických pacientov s poruchou rastu spôsobenou geneticky potvrdeným Praderovým-Williho syndrómom, pokiaľ sa u nich nediagnostikovala aj GHD. Boli hlásené prípady náhleho úmrtia po začatí liečby rastovým hormónom u pediatrických pacientov
s Praderovým-Williho syndrómom, ktorí mali jeden alebo viac nasledovných rizikových faktorov:
závažná obezita, anamnéza obštrukcie horných dýchacích ciest alebo spánkového apnoe, alebo neidentifikovaná respiračná infekcia.
Metabolizmus glukózy
Liečba rastovým hormónom môže znižovať citlivosť na inzulín a indukovať hyperglykémiu.
U pacientov liečených somatrogonom, ktorí majú glukózovú intoleranciu alebo ďalšie rizikové faktory diabetu, sa musí zvážiť ďalšie sledovanie. U pacientov liečených somatrogonom, ktorí majú diabetes mellitus, môže byť potrebná úprava dávky hypoglykemizujúcich liekov (pozri časť 4.5).
Neoplazma
U pacientov s malígnym ochorením v anamnéze sa musí venovať osobitná pozornosť prejavom
a príznakom relapsu. Pacienti s už prítomnými nádormi alebo so sekundárne po intrakraniálnej lézii vzniknutou deficienciou rastového hormónu, sa musia rutinne vyšetrovať, či nedošlo k progresii alebo relapsu základného ochorenia. U pacientov, ktorí v detstve prekonali rakovinu, bolo hlásené zvýšené riziko vzniku druhej neoplazmy, ak boli po prvej neoplazme liečení somatropínom. U pacientov liečených ožarovaním hlavy kvôli ich prvej neoplazme, boli intrakraniálne tumory, najmä meningeómy, zo sekundárnych nádorov najčastejšie.
Benígna intrakraniálnahypertenzia
U malého počtu pacientov liečených rastovým hormónom bola hlásená intrakraniálna hypertenzia (IH)
s edémom papily, ataxiou, poruchami zraku, bolesťou hlavy, nevoľnosťou a/alebo vracaním.
Na začiatku liečby a podľa toho, ako to bude vyžadovať klinický stav, sa odporúča fundoskopia.
U pacientov s klinickým alebo fundoskopickým potvrdením IH sa liečba somatrogonom musí dočasne prerušiť. V súčasnosti nie je dostatok poznatkov na odporúčanie pokračovať v liečbe rastovým hormónom u pacientov s vyliečenou IH. Ak sa liečba somatrogonom znovu začne, je potrebné sledovať príznaky a prejavy IH.
Akútne kritickéochorenie
U kriticky chorých dospelých pacientov, ktorí mali komplikácie po otvorenej operácii srdca, operácii
brucha, viacnásobnej traume alebo akútnom respiračnom zlyhaní, sa pozorovala vyššia mortalita
u pacientov liečených 5,3 mg alebo 8 mg somatropínu denne (t. j. 37,1 – 56 mg/týždeň) v porovnaní
s pacientmi, ktorí dostávali placebo, 42 % vs. 19 %. Na základe týchto informácií, títo pacienti nemajú byť liečení somatrogonom. Keďže o bezpečnosti substitučnej liečby rastovým hormónom u akútne kriticky chorých pacientov nie sú dostupné žiadne údaje, musí sa za týchto okolností zvážiť prínos pokračovania liečby somatrogonom oproti potenciálnemu riziku. U všetkých pacientov, u ktorých dôjde ku vzniku iného alebo podobného kritického ochorenia, sa musí zvážiť možný prínos liečby somatrogonom oproti potenciálnemu riziku.
Pankreatitída
Hoci je to u pacientov liečených rastovým hormónom zriedkavé, pankreatitída sa má zvážiť
u pacientov, u ktorých sa počas liečby somatrogonom vyvinie silná bolesť brucha.
Skolióza
Keďže somatrogon zvyšuje rýchlosť rastu, počas liečby sa majú sledovať prejavy vzniku alebo
progresie skoliózy.
Epifýzové poruchy
Epifýzové poruchy, vrátane epifyzeolýzy hlavy femuru, sa môžu vyskytnúť častejšie u pacientov
s endokrinnými poruchami alebo u pacientov, ktorí rýchlo rastú. Každý pediatrický pacient, ktorý počas liečby začne krívať alebo sa sťažovať na bolesť bedra alebo kolena, sa musí dôkladne vyšetriť.
Perorálna estrogénováliečba
Perorálny estrogén ovplyvňuje odpoveď IGF-I na rastový hormón. Ak pacientka užívajúca
somatrogon začne alebo ukončí liečbu obsahujúcu perorálny estrogén, musí sa sledovať hodnota IGF-I, aby sa stanovilo, či sa má upraviť dávka rastového hormónu tak, aby sa sérové hladiny IGF-I udržiavali v rámci požadovaného rozsahu (pozri časť 4.2). U pacientok na perorálnej liečbe obsahujúcej estrogén môže byť na dosiahnutie liečebného cieľa potrebná vyššia dávka somatrogonu (pozri časť 4.5).
Pomocné látky
Obsah sodíka
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t. j. v podstate zanedbateľné množstvo sodíka.
Metakrezol
Myozitída je veľmi zriedkavá nežiaduca udalosť, ktorá môže súvisieť s konzervačnou látkou metakrezol. V prípade myalgie alebo disproporčnej bolesti v mieste podania injekcie sa musí zvážiť myozitída, a ak sa potvrdí, musia sa používať iné lieky obsahujúce rastový hormón bez metakrezolu.
4.5 Liekové a iné interakcie
U pediatrických pacientov sa neuskutočnili žiadne interakčné štúdie. Glukokortikoidy
Súbežná liečba glukokortikoidmi môže inhibovať rast podporujúce účinky somatrogonu. Pacienti
s deficienciou adrenokortikotropného hormónu (ACTH - adrenocorticotropic hormone) majú mať starostlivo upravenú svoju substitučnú liečbu glukokortikoidmi, aby sa zabránilo akémukoľvek inhibičnému účinku na rast. Preto sa má u pacientov liečených glukokortikoidmi starostlivo sledovať ich rast na posúdenie potenciálneho vplyvu glukokortikoidovej liečby na rast.
Rastový hormón znižuje konverziu kortizónu na kortizol a môže odhaliť predtým neobjavený
centrálny hypoadrenalizmus alebo znížiť účinnosť nízkych dávok substitučnej liečby glukokortikoidmi
(pozri časť 4.4).
Inzulínahypoglykemizujúcelieky
U pacientov s diabetes mellitus, ktorí vyžadujú medikamentóznu liečbu, môže byť nutná úprava dávky
inzulínu a/alebo perorálnych/injekčne podávaných hypoglykemizujúcich liekov, keď sa u nich začne liečba somatrogonom (pozri časť 4.4).
Tyroidné lieky
Liečba denne podávaným rastovým hormónom môže odhaliť predtým nediagnostikovanú alebo
subklinickú centrálnu hypotyreózu. Môže byť potrebné začať so substitučnou liečbou tyroxínom alebo môže byť potrebné ju upraviť (pozri časť 4.4).
Perorálna estrogénováliečba
Ak pacientky užívajú perorálnu liečbu obsahujúcu estrogén, na dosiahnutie liečebného cieľa môže byť
potrebná vyššia dávka somatrogonu (pozri časť 4.4).
Lieky metabolizovanécytochrómomP450
So somatrogonom sa neuskutočnili liekové interakčné štúdie. Ukázalo sa, že somatrogon in vitro
indukuje expresiu CYP3A4 mRNA. Klinický význam tohto javu nie je známy. Štúdie s inými agonistami receptora ľudského rastového hormónu (hGH - human growth hormone) uskutočnené u detí a dospelých s nedostatočnou sekréciou rastového hormónu a u zdravých starších mužov
naznačujú, že ich podávanie môže zvyšovať klírens látok, o ktorých je známe, že sú metabolizované
prostredníctvom izoenzýmov cytochrómu P450, najmä CYP3A. Môže sa zvyšovať klírens látok metabolizovaných prostredníctvom CYP3A4 (napr. pohlavných steroidov, kortikosteroidov, antikonvulzív a cyklosporínu), a to by mohlo viesť k nižšej expozícii týchto látok.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne údaje o používaní somatrogonu u gravidných žien. Štúdie na zvieratách
nepreukázali priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej toxicity (pozri časť 5.3).
Používanie Ngenly sa neodporúča počas gravidity a u žien vo fertilnom veku, ktoré nepoužívajú antikoncepciu.
Dojčenie
Nie je známe, či sa somatrogon/metabolity vylučuje/vylučujú do materského mlieka. Nedá sa vylúčiť
riziko pre novorodencov/dojčatá. Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu somatrogonom, sa musí urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Riziko infertility u žien alebo mužov s reprodukčným potenciálom sa neštudovalo. V štúdii
na potkanoch nebola fertilita samčekov a samičiek ovplyvnená (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Ngenla nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Často hlásenými nežiaducimi reakciami po liečbe somatrogonom sú reakcie v mieste podania injekcie
(ISR - injection site reaction) (25,1 %), bolesť hlavy (10,7 %) a horúčka (10,2 %).
Tabuľkový zoznamnežiaducichreakcií
Bezpečnostné údaje sú odvodené z multicentrickej bezpečnostnej a dávku zisťujúcej štúdie fázy 2
a z pivotnej multicentrickej štúdie non-inferiority fázy 3 u pediatrických pacientov s GHD (pozri časť 5.1). Tieto údaje odrážajú expozíciu 265 pacientov liečených somatrogonom podávaným jedenkrát týždenne (0,66 mg/kg/týždeň).
Tabuľka 1 uvádza nežiaduce reakcie somatrogonu v rámci tried orgánových systémov (SOC - system organ class). Nežiaduce reakcie uvedené v tabuľke nižšie sú uvádzané podľa SOC a kategórií frekvencie, ktoré sú definované použitím nasledujúcej konvencie: veľmi časté (≥ 1/10), časté
(≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000) alebo neznáme (z dostupných údajov). V každej skupine podľa frekvencie sú nežiaduce reakcie zoradené podľa klesajúcej závažnosti.
Tabuľka 1. Nežiaduce reakcie
Trieda orgánových systé- mov
|
Veľmi časté
|
Časté
|
Menej časté
|
Zried- kavé
|
Veľmi zried-
kavé
|
Nezn
á- me
|
Poruchy krvi
a lymfatického systému
|
|
anémia
eozinofília
|
|
|
|
|
Poruchy endokrinného
systému
|
|
hypotyreóza
|
adrenálna
insuficiencia
|
|
|
|
Poruchy nervového
systému
|
bolesť hlavy
|
|
|
|
|
|
Poruchy oka
|
|
alergická
konjunktivití- da
|
|
|
|
|
Poruchy kože
a podkožného tkaniva
|
|
|
generalizovaná vyrážka
|
|
|
|
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
|
|
artralgia bolesť
v končatine
|
|
|
|
|
Celkové poruchy a reakcie
v mieste podania
|
reakcie
v mieste podania injekciea horúčka
|
|
|
|
|
|
a Reakcie v mieste podania injekcie zahŕňajú nasledovné: bolesť v mieste podania injekcie, erytém, pruritus, opuch, stvrdnutie, modrina, krvácanie, teplo, hypertrofia, zápal, deformácia, urtikária.
OpisvybranýchnežiaducichreakciíReakcia v mieste podania injekcieV klinickej štúdii fázy 3 sa počas štúdie vyžadovalo aktívne hlásenie ISR. Vo väčšine prípadov lokálne ISR mali tendenciu byť prechodné, vyskytovali sa najmä v prvých 6 mesiacoch liečby a boli mierne závažné. V priemere ISR nastupovali v deň podania injekcie a priemerne trvali < 1 deň. Spomedzi týchto reakcií sa bolesť v mieste podania injekcie, erytém, pruritus, opuch, stvrdnutie, modrina, hypertrofia, zápal a teplo hlásili u 43,1 % pacientov liečených somatrogonom v porovnaní
s 25,2 % pacientov, ktorým sa podávali injekcie somatropínu denne.
V dlhodobom otvorenom predĺžení (OLE -
open label extension) klinickej štúdie fázy 3 mali lokálne ISR podobnú povahu a závažnosť, a hlásili sa v skorej fáze u účastníkov, ktorí prešli z liečby somatropínom na liečbu somatrogonom. ISR sa hlásili u 18,3 % pacientov, ktorí boli pôvodne liečení somatrogonom v hlavnej štúdii a pokračovali v liečbe v OLE časti štúdie, a podobne sa hlásili
u 37 % pacientov, ktorí boli pôvodne liečení somatropínom a v OLE časti štúdie prešli na liečbu
somatrogonom.
ImunogenicitaV pivotnej štúdii bezpečnosti a účinnosti bolo spomedzi 109 účastníkov liečených somatrogonom
84 (77,1 %) pozitívne testovaných na protilátky proti lieku (ADA -
anti-drug antibodies).
Pri vytváraní protilátok sa nepozoroval žiaden vplyv na klinické účinky a ani na bezpečnosť.
Iné nežiaduce liekové reakcie pre somatropín možno považovať za skupinový účinok, sú to:• Benígne a malígne neoplazmy: (pozri časť 4.4).
• Poruchy metabolizmu a výživy: diabetes mellitus 2. typu (pozri časť 4.4).
• Poruchy nervového systému: benígna intrakraniálna hypertenzia (pozri časť 4.4), parestézia.
• Poruchy kostrovej a svalovej sústavy a spojivového tkaniva: myalgia.
• Poruchy reprodukčného systému a prsníkov: gynekomastia.
• Poruchy kože a podkožného tkaniva: kožná vyrážka, urtikária a pruritus.
• Celkové poruchy a reakcie v mieste podania: periférny edém, edém tváre.
• Poruchy gastrointestinálneho traktu: pankreatitída (pozri časť 4.4).
MetakrezolTento liek obsahuje metakrezol, ktorý sa môže podieľať na bolestivosti injekcií (pozri časť 4.4).
Hlásenie podozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 PredávkovanieJednotlivé dávky somatrogonu vyššie ako 0,66 mg/kg/týždeň sa neštudovali.
Na základe skúseností s denne podávaným rastovým hormónom by krátkodobé predávkovanie mohlo najprv viesť k hypoglykémii a následne k hyperglykémii. Dlhodobé predávkovanie by mohlo viesť
k prejavom a príznakom gigantizmu a/alebo akromegálie v súvislosti s účinkami nadbytku rastového hormónu.
Liečba predávkovania somatrogonom musí pozostávať zo všeobecných podporných opatrení.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: hormóny hypofýzy a hypotalamu a analógy, somatropín a agonisty somatropínu, ATC kód: H01AC08.
Mechanizmus účinkuSomatrogon je glykoproteín, ktorý pozostáva z aminokyselinovej sekvencie ľudského rastového
hormónu (hGH –
human growth hormone) s jednou kópiou C-koncového peptidu (CTP -
C-terminal peptide) z beta reťazca ľudského choriového gonadotropínu (hCG -
human chorionic gonadotropin) na N-konci a dvoch kópií CTP (v tandeme) na C-konci. Vďaka glykozylácii a CTP doménam má somatrogon taký polčas rozpadu, ktorý umožňuje týždenné dávkovanie.
Somatrogon sa viaže na RH receptor a iniciuje kaskádu prenosu signálu, ktorá kulminuje zmenami
v raste a metabolizme. Konzistentne s RH signalizáciou vedie väzba somatrogonu k aktivácii STAT5b signálnej dráhy a zvyšovaniu sérovej koncentrácie IGF-I. Zistilo sa, že zvyšovanie IGF-I je závislé od dávky somatrogonu, čo čiastočne sprostredkúva klinický účinok. Následkom toho RH a IGF-I stimulujú metabolické zmeny, lineárny rast a zrýchlenie rastu u pediatrických pacientov
s nedostatočnou sekréciou rastového hormónu (GHD).
Farmakodynamické účinkyV klinických štúdiách somatrogon zvyšuje IGF-I. Farmakodynamické vyhodnocovania sa
uskutočňovali približne 96 hodín po podaní dávky, aby sa vyhodnotilo priemerné skóre štandardnej odchýlky (SDS) IGF-I v priebehu obdobia dávkovania, pričom sa prezentovali hodnoty IGF-I normalizované u liečených účastníkov po jednom mesiaci liečby.
Metabolizmus vody a minerálovSomatrogon indukuje zadržiavanie fosforu.
Klinická účinnosťabezpečnosťBezpečnosť a účinnosť somatrogonu na liečbu detí a dospievajúcich s GHD od 3 rokov sa
vyhodnocovali v dvoch multicentrických, randomizovaných, otvorených kontrolovaných klinických štúdiách. Obe štúdie zahŕňali 12-mesačné hlavné obdobie, v ktorom sa porovnával týždenne podávaný somatrogon so somatropínom podávaním jedenkrát denne, po ktorom nasledovalo jednoramenné otvorené predĺženie štúdie (OLE -
open label extension), v ktorom sa všetkým pacientom podával somatrogon jedenkrát týždenne. Primárnym cieľom ohľadom účinnosti pre obe štúdie bola rýchlosť rastu (HV -
height velocity) za rok po 12 mesiacoch liečby. V oboch štúdiách sa vyhodnocovali aj ďalšie ciele odrážajúce dobiehanie rastu, ako sú zmena SDS pre telesnú výšku oproti východiskovej hodnote a SDS pre telesnú výšku.
Pivotná multicentrická štúdia non-inferiority fázy 3 vyhodnocovala bezpečnosťa účinnosť dávky somatrogonu 0,66 mg/kg/týždeň v porovnaní s 0,034 mg/kg/deň somatropínu u 224 prepubertálnych pediatrických pacientov s GHD. Priemerný vek v liečebných skupinách bol 7,7 roka (minimálne 3,01, maximálne 11,96), 40,2 % pacientov malo > 3 roky až ≤ 7 rokov, 59,8 % malo > 7 rokov. 71,9 % pacientov bolo chlapcov a 28,1 % dievčat. V tejto štúdii bolo 74,6 % pacientov belochov,
20,1 % aziatov a 0,9 % černochov. Východiskové charakteristiky ochorenia boli medzi oboma liečebnými skupinami vyvážené. Približne 68 % pacientov malo vrcholové plazmatické hladiny
RH ≤ 7 ng/ml a priemerná výška bola pod -2 SDS.
Na základe rastovej rýchlosti hodnotenej v 12. mesiaci bol somatrogon jedenkrát týždenne
non-inferiórny k somatropínu podávanému jedenkrát denne (pozri tabuľku 2). Užívanie somatrogonu jedenkrát týždenne viedlo tiež k zvýšeniu SDS hodnôt IGF-I z priemerných -1,95 vo východiskovom stave do priemerných 0,65 v 12. mesiaci.
Parameter liečby
| Liečebná skupina
|
Rozdiel LSM (95 % IS)
| Somatrogon
(N = 109)
| Somatropín
(N = 115)
| Odhad LSM
| Odhad LSM
| Rýchlosť rastu (cm/rok)
| 10,10
| 9,78
| 0,33 (-0,24; 0,89)
| Skóre štandardnej odchýlky výšky
| -1,94
| -1,99
| 0,05 (-0,06; 0,16)
| Zmena v skóre štandardnej odchýlky výšky oproti východiskovej hodnote
| 0,92
| 0,87
| 0,05 (-0,06; 0,16)
|
|
|
Tabuľka 2. Účinnosť somatrogonu v porovnaní so somatropínom u pediatrických pacientov s GHD v 12. mesiaciSkratky: IS = interval spoľahlivosti; GHD = deficiencia rastového hormónu; LSM = priemer najmenších
štvorcov; N = počet randomizovaných a liečených pacientov.
V otvorenom predĺžení pivotnej štúdie fázy 3 dostávalo 91 pacientov 0,66 mg/kg/týždeň somatrogonu najmenej 2 roky a poskytovali sa údaje o výške. Po 2 rokoch sa pozoroval progresívny prírastok
v SDS telesnej výšky oproti východiskovej hodnote [kumulatívna zmena v SDS telesnej výšky,
priemer (SD) = 1,38 (0,78), medián = 1,19 (rozsah: 0,2; 4,9)].
V multicentrickej štúdii bezpečnosti a zisťovania dávky fázy 2 dostávalo 31 pacientov
0,66 mg/kg/týždeň somatrogonu po dobu 7,7 roka. Pri poslednom vyhodnocovaní bola SDS
pre telesnú výšku [priemer (SD)] -0,39 (0,95) a kumulatívna zmena SDS pre rýchlosť rastu
[priemer (SD)] oproti východiskovej hodnote 3,37 (1,27).
Záťaž liečbouV randomizovanej, otvorenej, skríženej štúdii fázy 3 u 87 pediatrických pacientov s GHD bol dopad podávania somatrogonu jedenkrát týždenne (0,66 mg/kg/týždeň) na záťaž liečbou porovnávaný
s denne podávaným somatropínom. Somatrogon podávaný jedenkrát týždenne demonštroval signifikantné zlepšenie (redukciu) záťaže liečbou pre pacienta, zlepšoval (redukoval) záťaž liečbou u opatrovateľa, zvyšoval pohodlie pacienta, zvyšoval ochotu spolupracovať a pacienti ho viac preferovali.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s Ngenlou
vo všetkých podskupinách pediatrickej populácie pre dlhodobú liečbu pediatrických pacientov
s poruchou rastu spôsobenou nedostatočnou sekréciou rastového hormónu (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Farmakokinetika (FK) somatrogonu sa vyhodnocovala použitím populačného FK prístupu pre somatrogon u 42 pediatrických pacientov s GHD (vekový rozsah 3 – 15,5 roka).
Absorpcia
Po subkutánnej injekcii sa sérové koncentrácie pomaly zvyšujú, vrchol dosahujú po 6 až 18 hodinách
po podaní dávky.
U pediatrických pacientov s GHD sa expozícia somatrogonu zvyšuje úmerne dávke pre dávky
0,25 mg/kg/týždeň, 0,48 mg/kg/týždeň a 0,66 mg/kg/týždeň. Pri podávaní somatrogonu jedenkrát týždenne nedochádza k žiadnej akumulácii. U pediatrických pacientov s GHD populačná FK odhadla ustálenú vrcholovú koncentráciu po 0,66 mg/kg/týždeň na 636 ng/ml. Pacienti, ktorí boli pozitívne testovaní na ADA, mali približne o 45% vyššie priemerné koncentrácie v ustálenom stave.
Distribúcia
U pediatrických pacientov s GHD populačná FK odhadla zdanlivý centrálny objem distribúcie
na 0,728 l/kg a zdanlivý periférny objem distribúcie na 0,165 l/kg.
Biotransformácia
Metabolický osud somatrogonu je klasický proteínový katabolizmus s následnou recykláciou
aminokyselín a ich návratom do systémového obehu.
Eliminácia
U pediatrických pacientov s GHD populačná FK odhadla zdanlivý klírens na 0,0317 l/h/kg. Pacienti,
ktorí boli pozitívne testovaní na ADA, mali približne 25,8 % zníženie zdanlivého klírensu. Na základe populačnej FK s efektívnym polčasom rozpadu odhadnutým na 28,2 hodiny, je somatrogon prítomný
v obehu približne 6 dní po poslednej dávke.
Osobitné skupinypacientov
Vek, rasa, pohlavie, telesná hmotnosť
Na základe populačných FK analýz nemajú vek, pohlavie, rasa a etnická príslušnosť klinicky významný účinok na farmakokinetiku somatrogonu u pediatrických pacientov s GHD. Expozícia somatrogonu klesá so zvyšujúcou sa telesnou hmotnosťou. Dávka somatrogonu 0,66 mg/kg/týždeň však poskytuje adekvátnu systémovú expozíciu na bezpečné dosiahnutie účinnosti v rámci hmotnostného rozsahu vyhodnocovaného v klinických štúdiách.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti a toxicity po opakovanom podávaní neodhalili žiadne osobitné riziko pre ľudí.
Štúdie reprodukčnej a vývojovej toxity sa uskutočnili u potkanov, ktorým sa somatrogon podával subkutánne v dávkach do 30 mg/kg (hladina expozície približne 14-násobne vyššia ako maximálna odporúčaná dávka pre ľudí na základe AUC).
Somatrogon indukoval predĺženie estrálneho cyklu, kopulačného intervalu a zvyšoval počet žltých teliesok u samičiek potkanov, ale nemal žiadny vplyv na párenie, fertilitu alebo skorý embryonálny vývoj.
Nepozorovali sa žiadne účinky somatrogonu na embryofetálny vývoj.
V prenatálnej a postnatálnej vývojovej štúdii somatrogon vyvolával zvýšenie priemernej telesnej hmotnosti (oboch pohlaví) prvej generácie (F1), ako aj zvýšenie priemerného kopulačného intervalu u F1 samičiek pri najvyššej dávke (30 mg/kg), čo korešpondovalo s dlhším estrálnym cyklom; nespájalo sa to však so žiadnymi účinkami na párenie.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
citrónan trisodný, dihydrát kyselina citrónová, monohydrát L-histidín
chlorid sodný metakrezol
poloxamér 188
voda na injekcie
6.2 Inkompatibility
Nevykonali sa žiadne štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
Pred prvýmpoužitím
3 roky pri 2 °C až 8 °C.
Pred prvým použitím uchovávajte Ngenlu v chladničke. Neotvorené naplnené pero sa môže dočasne uchovávať najviac 4 hodiny pri teplotách až do 32 °C.
Po prvompoužití
28 dní.
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Ngenlu uchovávajte s nasadeným vrchnákom pera na ochranu pred svetlom.
Ngenla sa môže uchovávať pri izbovej teplote (až do 32 °C) najviac 4 hodiny pri každom podaní injekcie, najviac však 5-krát. Po každom použití vráťte Ngenlu znova do chladničky. Nevystavujte Ngenlu teplotám vyšším ako 32 °C, ani ju nenechávajte pri izbovej teplote dlhšie ako 4 hodiny pri
každom použití. Pero Ngenla sa musí zlikvidovať, keď sa použilo 5-krát, keď bolo vystavené teplotám vyšším ako 32 °C alebo keď sa vybralo z chladničky na dlhšie ako 4 hodiny pri každom použití.
Chemická a fyzikálna stabilita pri používaní sa demonštrovala počas 28 dní od dátumu prvého použitia naplneného pera, keď sa naplnené pero medzi jednotlivými použitiami uchovávalo pri 2 °C až 8 °C.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke. Ngenlu uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky na uchovávanie po prvom použití lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Ngenla 24 mg injekčnýroztokvnaplnenompere
Toto viacdávkové jednorazové naplnené pero, ktoré obsahuje náplň (číre sklo typu I) trvalo
nepriepustne umiestnenú v plastovom pere, obsahuje 1,2 ml somatrogonu. Náplň je na spodnej strane uzavretá gumenou zátkou (gumené uzávery typu I) v tvare piestu a na hornej strane gumenou zátkou (gumené uzávery typu I) v tvare disku a je utesnená hliníkovým viečkom. Vrchnák pera, injekčné tlačidlo a označenie pera sú svetlofialovej farby.
Veľkosť balenia je 1 naplnené pero.
Ngenla 60mg injekčnýroztokvnaplnenompere
Toto viacdávkové jednorazové naplnené pero, ktoré obsahuje náplň (číre sklo typu I) trvalo
nepriepustne umiestnenú v plastovom pere, obsahuje 1,2 ml somatrogonu. Náplň je na spodnej strane uzavretá gumenou zátkou (gumené uzávery typu I) v tvare piestu a na hornej strane gumenou zátkou (gumené uzávery typu I) v tvare disku a je utesnená hliníkovým viečkom. Vrchnák pera, injekčné tlačidlo a označenie pera sú modrej farby.
Veľkosť balenia je 1 naplnené pero.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Roztok musí byť číry a bezfarebný až mierne svetložltý a nesmie obsahovať častice. Liek injekčne nepodávajte, ak je zakalený, tmavožltý alebo obsahuje častice. Perom netraste, trasenie môže liek poškodiť.
Každé naplnené pero Ngenla je určené na používanie jedným pacientom. Naplnené pero Ngenla si pacienti nikdy nesmú požičiavať, aj keby vymenili ihlu.
Naplnené pero sa môže používať najviac 28 dní po prvom použití a pred dátumom exspirácie. Liek neuchovávajte v mrazničke. Nevystavujte teplu (nad 32 °C). Nepoužívajte Ngenlu, ak bola
zmrazená alebo vystavená teplu, zlikvidujte ju.
Príprava dávky
Pero sa môže používať ihneď, ako sa vyberie z chladničky. Aby bolo podanie injekcie príjemnejšie,
naplnené pero obsahujúce sterilný roztok somatrogonu, sa môže nechať dosiahnuť izbovú teplotu až
do 32 °C po dobu do 30 minút. Roztok v pere sa musí skontrolovať na prítomnosť vločiek, častíc
a zmenu farby. Perom sa nesmie triasť. Ak sa spozorujú vločky, častice alebo zmena farby, pero sa nesmie použiť.
PodávanieMiesto určené na podanie injekcie sa má pripraviť podľa inštrukcií v návode na použitie. Pri každom
podaní sa odporúča zmeniť miesto podania injekcie. Počas používania po každej injekcii vždy nasaďte na naplnené pero vrchnák. Po každom použití vždy vráťte Ngenlu späť do chladničky. Pred každým použitím sa vždy musí nasadiť nová ihla. Ihly sa nesmú používať opakovane. Ihla sa musí po každom podaní injekcie odstrániť a pero sa musí uchovávať bez nasadenej ihly. Tým sa môže predísť zablokovaniu ihiel, kontaminácii, infekcii, úniku roztoku a nepresnému dávkovaniu.
V prípade zablokovania ihiel (tzn. keď sa na špičke ihly neobjavuje kvapalina) musia pacienti postupovať podľa pokynov uvedených v návode na použitie, ktorý je súčasťou písomnej informácie pre používateľa.
Na podanie lieku sú potrebné sterilné ihly, ktoré ale nie sú súčasťou balenia. Ngenla sa môže podávať ihlou od 4 mm do 8 mm a 31 alebo 32 G.
Pokyny na prípravu a podanie lieku sú uvedené v písomnej informácii pre používateľa a v návode na použitie.
LikvidáciaVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami. Ak je naplnené pero prázdne, bolo vystavené teplotám vyšším ako 32 °C, bolo vybrané z chladničky na viac ako 4 hodiny pri každom použití, použilo sa 5-krát alebo ak uplynulo viac ako
28 dní od jeho prvého použitia, musí sa zlikvidovať, aj keď obsahuje nepoužitý liek. Po správnom podaní všetkých dávok môže v pere zostať malé množstvo sterilného roztoku somatrogonu. Pacientov treba poučiť, aby nepoužívali zvyšný roztok, ale aby pero správne zlikvidovali.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIPfizer Europe MA EEIG Boulevard de la Plaine 17
1050 Bruxelles
Belgicko
8. REGISTRAČNÉ ČÍSLAEU/1/21/1617/001
EU/1/21/1617/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 14. februára 2022
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Návod na použitieNgenla 60 mg PeroInjekcia len na subkutánne použitie (pod kožu)
Tento návod si uschovajte. Tieto pokyny opisujú jednotlivé kroky ako pripraviť a podať injekciu Ngenly.Dôležité informácie o vašom pere Ngenla· Ngenla na podávanie injekcie je viacdávkové naplnené pero, ktoré obsahuje 60 mg lieku.
· Ngenlu si injekciou môže podať pacient, môže mu ju podať opatrovateľ, lekár, zdravotná sestra alebo lekárnik.
Nepokúšajte sa sami si podať injekciu Ngenly predtým, ako vám ukážu správny spôsob podávania injekcií a predtým, ako si prečítate a porozumiete návodu na
použitie. Ak sa váš lekár, zdravotná sestra alebo lekárnik rozhodne, že ste si vy alebo váš opatrovateľ schopný podávať injekcie Ngenly doma, musíte absolvovať školenie ako správne pripraviť a injekčne podávať Ngenlu. Je dôležité, aby ste si tento návod prečítali, porozumeli
mu a dodržiavali ho, aby ste si Ngenlu injekčne podávali správnym spôsobom. Je dôležité porozprávať sa so svojím lekárom, zdravotnou sestrou alebo lekárnikom, aby ste si boli istý,'
že rozumiete pokynom na dávkovanie Ngenly.
· Aby ste si lepšie zapamätali, kedy si podať injekciu Ngenly, môžete si vopred vyznačiť príslušné dni v kalendári. Ak sa vy alebo váš opatrovateľ chcete opýtať na čokoľvek ohľadom správneho injekčného podávania Ngenly, zavolajte svojmu lekárovi, zdravotnej sestre alebo lekárnikovi.
· Každé otočenie (kliknutie) dávkovacieho prstenca zvyšuje dávku o 0,5 mg lieku. Jednou injekciou môžete podať 0,5 mg až 30 mg. Ak je vaša dávka vyššia ako 30 mg, budete si musieť podať viac ako 1 injekciu.
· Po správnom podaní všetkých dávok môže v pere zostať malé množstvo lieku. Je to normálne.
Pacienti sa nesmú pokúšať použiť zvyšný roztok, ale musia pero správnym spôsobom zlikvidovať.
·
Nepožičiavajte svoje pero iným ľuďom, a to ani po výmene ihly. Mohli by ste iných ľudí nakaziť závažnou infekciou alebo by ste sa mohli od iných ľudí nakaziť závažnou infekciou.
· Na každé podanie injekcie použite vždy novú sterilnú ihlu. Zníži to riziko kontaminácie, infekcie, unikania lieku a zablokovania ihly, čo vedie k nesprávnej dávke.
· Svojím perom
netraste. Trasením sa môže poškodiť liek.
·
Neodporúča sa, aby pero používali nevidiaci alebo slabozrakí ľudia bez pomoci osoby správne vyškolenej o používaní lieku.
P
o
m
ô
cky, ktoré budete potrebovať pri každom podávaní injekcie
Zahrnuté v balení:
· 1 pero Ngenla 60 mg.
Nezahrnuté v balení:· 1 nová sterilná ihla na každé podanie injekcie.
· alkoholové tampóny.
· vatové tampóny alebo gáza.
· náplasť.
· nádoba vhodná na likvidáciu ostrých predmetov na ihly a perá.
Pero Ngenla 60 mg:Ihly, ktoré sa majú použiťIhly na pero sa
nedodávajú s vaším perom Ngenla. Na pero môžete použiť ihly od 4 mm do 8 mm.
· Ihly na použitie s vaším perom Ngenla:
o 31 G alebo 32 G
· O tom, ktorá ihla je pre vás správna, sa porozprávajte so svojím lekárom, zdravotnou sestrou alebo lekárnikom.
Sterilná ihla (príklad), nedodáva sa:
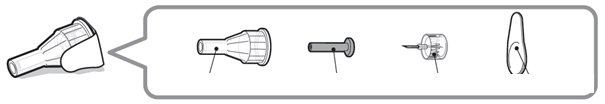
Sterilná ihla
Vonkajší kryt ihly
Vnútorný kryt ihly Ihla
Ochranný papier
Upozornenie: Nikdy nepoužívajte ohnutú alebo poškodenú ihlu. S ihlami na pero vždy zaobchádzajte
opatrne, aby ste sa uistili, že sa nepichnete (alebo že nepichnete niekoho iného). Nenasadzujte novú ihlu na pero, kým nie ste pripravený na podanie injekcie.
Príprava na podanie injekcie
1
. krok Príprava
· Umyte a utrite si ruky.
· Pero môžete použiť ihneď po vybraní z chladničky. Aby bolo podanie injekcie príjemnejšie, nechajte pero pri izbovej teplote po dobu až 30 minút.
(Pozri časť 5 „Ako uchovávať Ngenlu“ v písomnej informácii pre používateľa naplneného pera Ngenla 60 mg).
· Skontrolujte názov, silu a označenie pera, aby ste sa uistili, že je to liek, ktorý vám lekár predpísal.
· Skontrolujte dátum exspirácie na označení na pere. Pero
nepoužívajte, ak uplynul dátum exspirácie.
· Pero
nepoužívajte, ak:
o bolo zmrazené alebo vystavené teplu (viac ako 32 °C), alebo uplynulo viac ako 28 dní od jeho prvého použitia.
(Pozri časť 5 „Ako uchovávať Ngenlu“ v písomnej informácii pre používateľa naplneného pera Ngenla 60 mg).
o spadlo
o vyzerá zlomené alebo poškodené
· Kým nie ste pripravený na podanie injekcie,
neodstraňujte z pera vrchnák pera.
2. krok Výber a očistenie miesta podania injekcie · Ngenla sa môže podávať do brucha, stehien, zadku alebo hornej časti ramien.
· Vyberte si najlepšie miesto na podanie injekcie podľa odporúčaní lekára, zdravotnej sestry alebo lekárnika.
· Ak je na podanie vašej celej dávky potrebná viac ako 1 injekcia, každá injekcia sa musí podať na iné miesto.
· Injekciu
nepodávajte do kostnatých oblastí, do oblastí, ktoré sú s modrinami, začervenané, boľavé alebo stuhnuté a do oblastí, kde sú jazvy alebo kožné ochorenia.
· Miesto podania injekcie očistite alkoholovým tampónom.
· Miesto podania injekcie nechajte vyschnúť.
· Po očistení sa miesta podania injekcie
nedotýkajte.
3
. krok Kontrola lieku
· Zložte vrchnák pera a ponechajte si ho na opätovné nasadenie po podaní injekcie.
· Skontrolujte liek vnútri držiaka zásobníka.
· Uistite sa, že liek je číry a bezfarebný až jemne svetložltý. Ak je liek zakalený alebo tmavožltý,
nepodávajte ho.
· Uistite sa, že liek neobsahuje vločky alebo častice. Ak liek obsahuje vločky alebo častice,
nepodávajte ho.
Poznámka: Je normálne, keď v lieku zbadáte jednu alebo viacero bublín.
4. krok Nasadenie ihly · Vyberte novú ihlu a odtrhnite ochranný papier.
· Zarovnajte ihlu so svojím perom, pričom ich držte rovno.
· Jemne zatlačte a potom naskrutkujte ihlu na pero.
Nedoťahujte príliš silno.
Poznámka: Dávajte pozor, aby ste ihlu nenasadzovali pod uhlom. Môže to spôsobiť presakovanie pera.
Upozornenie: Ihly sú ostré na oboch koncoch. Zaobchádzajte s nimi opatrne, aby ste sa uistili,
že sa nepichnete (alebo že nepichnete niekoho iného).
5
. krok Zloženie vonkajšieho krytu ihly
· Zložte vonkajší kryt ihly.
· Vonkajší kryt ihly si určite uschovajte. Budete ho potrebovať neskôr na odstránenie ihly.
Poznámka: Po odstránení vonkajšieho krytu máte vidieť vnútorný kryt ihly. Ak ho nevidíte, pokúste sa nasadiť ihlu znova.
6. krok Zloženie vnútorného krytu ihly· Opatrne zložte vnútorný kryt ihly, aby bolo ihlu vidieť.
· Vnútorný kryt ihly zahoďte do nádoby na ostré predmety. Už ho nebudete potrebovať.
 („Áno: Prejdite na nastavenie nového pera“ má šípku smerujúcu k „Nastavenie nového pera
(priming)“ a „Nie“ má šípku smerujúcu k „Nastavenie predpísanej dávky“)
Nastavenie nového pera (priming) – len pri prvom použití nového pera
Pred prvým použitím musíte každé nové pero nastaviť (priming)
(„Áno: Prejdite na nastavenie nového pera“ má šípku smerujúcu k „Nastavenie nového pera
(priming)“ a „Nie“ má šípku smerujúcu k „Nastavenie predpísanej dávky“)
Nastavenie nového pera (priming) – len pri prvom použití nového pera
Pred prvým použitím musíte každé nové pero nastaviť (priming)
· Nastavenie nového pera sa uskutočňuje pred prvým použitím každého nového pera.
· Účelom nastavovania nového pera je odstránenie vzduchových bublín a uistenie sa, že dostanete správnu dávku.
Dôležité: Ak ste už svoje pero nastavili, preskočte kroky A až C.
Krok A: Nastavenie prstenca na hodnotu 1,0· Otočte dávkovací prstenec na hodnotu
1,0.
Poznámka: Ak dávkovací prstenec otočíte príliš ďaleko, môžete ho otočiť späť.
Krok B: Poklepanie po držiaku zásobníka
· Držte pero tak, aby ihla smerovala nahor, aby mohli vystúpiť vzduchové bubliny.
· Jemne
poklepte po držiaku zásobníka, aby všetky vzduchové bubliny vyplávali nahor.
Dôležité: Postupujte podľa kroku B, aj keď nevidíte vzduchové bubliny.
Krok C: Zatlačenie tlačidla a kontrola kvapaliny·
Zatlačte injekčné tlačidlo až na doraz a až kým sa v dávkovom okienku nezobrazí
„0“.
·
Skontrolujte tekutinu na špičke ihly. Ak sa objaví tekutina, vaše pero je nastavené.
· Pred podaním injekcie sa vždy uistite, že sa objavila kvapka tekutiny. Ak sa tekutina neobjavila, zopakujte kroky A až C.
o Ak sa tekutina neobjaví potom, ako ste kroky A až C zopakovali päťkrát (5), nasaďte novú ihlu a ešte to skúste jedenkrát (1).
Ak sa kvapka tekutiny stále neobjaví, pero
nepoužívajte. Obráťte sa na svojho lekára, zdravotnú sestru alebo lekárnika a použite nové pero.
Nastavenie predpísanej dávky
7
. krok Nastavenie vašej dávky

· Otáčajte dávkovací prstenec, aby ste nastavili svoju dávku.
o Otáčaním dávkovacieho prstenca jedným alebo druhým smerom sa dávka môže zvyšovať alebo znižovať.
o Dávkovací prstenec sa zakaždým otočí o 0,5 mg.
o Vaše pero obsahuje 60 mg lieku, ale na jedno podanie injekcie môžete nastaviť
maximálnu dávku do 30 mg.
o Dávkovacie okienko zobrazuje dávku v mg. Pozri
príklady A a B.
·
Vždy skontrolujte dávkovacie okienko, aby ste sa uistili, že máte nastavenú správnu dávku.Dôležité: Nestláčajte injekčné tlačidlo počas nastavovania dávky.
Čo mám robiť, keď si nemôžem nastaviť dávku, ktorú potrebujem?· Ak je vaša dávka väčšia ako 30 mg, budete potrebovať viac ako 1 injekciu.
· Jednou injekciou môžete podať 0,5 mg až 30 mg.
o Ak potrebujete pomoc pri správnom rozdelení svojej dávky, obráťte sa na svojho lekára, zdravotnú sestru alebo lekárnika.
o Na každé podanie injekcie použite novú ihlu
(pozri krok 4: Nasadenie ihly).
o Ak si potrebujete na svoju celú dávku podať 2 injekcie, nezabudnite si určite podať aj
druhú injekciu.
Čo mám robiť, ak mi už v mojom pere nezostalo dosť lieku?· Ak vaše pero obsahuje menej ako 30 mg lieku, dávkovacím prstencom sa nebude dať otáčať a v dávkovacom okienku sa zobrazí zvyšné množstvo lieku.
· Ak vo vašom pere neostalo dosť lieku na vašu celú dávku, môžete buď:
o injekčne podať množstvo, ktoré zostalo vo vašom pere, potom pripraviť nové pero a doplniť svoju celú dávku.
Nezabudnite odčítať dávku, ktorú ste si už podali. Keď je napríklad dávka 21,5 mg
a vy môžete dávkový prstenec nastaviť len na 17 mg, novým perom si musíte podať ďalších 4,5 mg.
o alebo môžete dostať nové pero a injekčne si podať celú dávku.
Injekčné podanie vašej dávky
8
. krok Zapichnutie ihly
· Pero držte tak, aby ste mohli vidieť čísla v dávkovacom okienku.
· Zapichnite ihlu priamo do kože.
9. krok Injekčné podanie lieku
· Ihlu držte v koži stále v rovnakej polohe.
·
Zatlačte injekčné tlačidlo až na doraz a až kým sa v dávkovacom okienku nezobrazí
„0“.
10
. krok Počítajte do 10

·
Stále držte zatlačené injekčné tlačidlo a počítajte do 10. Počítaním do 10 umožníte, aby sa podala celá dávka lieku.
· Po napočítaní do 10 pustite injekčné tlačidlo a pomaly vyberte pero z miesta podania injekcie tak, že ihlu
rovno vytiahnete.
Poznámka: Na špičke ihly môžete vidieť kvapku lieku. Je to normálne a nemá to vplyv na dávku, ktorú ste práve dostali.
11. krok Nasadenie vonkajšieho krytu ihly· Opatrne nasaďte vonkajší kryt ihly späť na ihlu.
· Tlačte na vonkajší kryt ihly, kým sa nezaistí.
Upozornenie: Nikdy sa nepokúšajte nasadiť vnútorý kryt ihly späť na ihlu. Mohli by ste sa ihlou pichnúť.
12
. krok Odstránenie ihly
· Odskrutkujte prekrytú ihlu z pera.
· Jemne ťahajte, kým sa prekrytá ihla neuvoľní.
Poznámka: Ak je ihla stále nasadená, opätovne nasaďte vonkajší kryt ihly a skúste to znova. Uistite sa, že keď ihlu odskrutkovávate, stále na ňu tlačíte.
· Vaše použité ihly na pero zlikvidujte v nádobe na ostré predmety podľa pokynov vášho lekára, zdravotnej sestry alebo lekárnika a v súlade s miestnymi zdravotníckymi a bezpečnostnými
predpismi. Nádobu na ostré predmety uchovávajte mimo dosahu detí. Ihly
nepoužívajte opakovane.
13. krok Opätovné nasadenie vrchnáka pera· Opätovne nasaďte vrchnák pera späť na vaše pero.
·
Nenasadzujte vrchnák na pero, ak je na ňom nasadená ihla.
· Ak vo vašom pere ostal nejaký liek, medzi použitiami ho uchovávajte v chladničke.
(Pozri časť 5 „Ako uchovávať Ngenlu“ v písomnej informácii pre používateľa naplneného peraNgenla 60 mg).
14
. krok Po podaní injekcie
· Jemne zatlačte na miesto podania injekcie s čistým vatovým tampónom alebo gázou a držte niekoľko sekúnd.
· Miesto podania injekcie netrite. Môže slabo krvácať. Je to normálne.
· Ak je to potrebné, miesto podania injekcie môžete prekryť malou náplasťou.
· Ak je vaše pero prázdne alebo ak uplynulo viac ako 28 dní od jeho prvého použitia, zahoďte ho, aj keď obsahuje nepoužitý liek. Svoje pero zahoďte do nádoby na ostré predmety.
· Aby ste si lepšie zapamätali, kedy sa má pero zlikvidovať, môžete si napísať dátum prvého použitia na označenie pera a nižšie:
Dátum prvého použitia //