
.
4.4 Osobitné upozornenia a opatrenia pri používaní
Vápnikvséreavmoči
U pacientov s normálnou hladinou vápnika v krvi bolo po podaní injekcie teriparatidu pozorované mierne a prechodné zvýšenie sérovej koncentrácie vápnika. Koncentrácie vápnika v sére dosahujú
maximum medzi 4 a 6 hodinami po podaní každej dávky teriparatidu, k východiskovým hodnotám sa
vrátia o 16 až 24 hodín. Preto, ak je potrebné odobrať pacientovi krv na stanovenie vápnika v sére, je nutné tento odber vykonať aspoň 16 hodín po užití poslednej dávky teriparatidu. Rutinné sledovanie hladiny vápnika v priebehu liečby sa nevyžaduje.
Teriparatid môže viesť k miernemu zvýšeniu vylučovania vápnika v moči, ale v klinických skúšaniach sa výskyt hyperkalciúrie nelíšil od výskytu u pacientov liečených placebom.
Urolitiáza
Teriparatid sa neskúmal u pacientov s aktívnou urolitiázou. U pacientov s aktívnou alebo nedávno manifestovanou urolitiázou môže teriparatid viesť ku zhoršeniu stavu, a má byť teda podávaný
s opatrnosťou.
Ortostatickáhypotenzia
V krátkodobých klinických štúdiách s teriparatidom sa pozorovali izolované epizódy prechodnej ortostatickej hypotenzie. K tejto príhode typicky došlo v priebehu 4 hodín po podaní a príznaky spontánne odzneli v priebehu niekoľkých minút až niekoľkých hodín. Ak sa táto prechodná ortostatická hypotenzia objavila, vyskytla sa v priebehu prvých niekoľkých dávok, tak ustúpila po uložení pacientov do vodorovnej polohy a neviedla k prerušeniu liečby.
Poškodenieobličiek
Pacienti so stredne závažným poškodením obličiek majú byť sledovaní so zvýšenou opatrnosťou.
Mladšia dospelápopulácia
Skúsenosti s mladšou dospelou populáciou, vrátane predmenopauzálnych žien, sú obmedzené (pozri časť 5.1). Liečba sa má začať len v prípade, ak jej prínos zreteľne prevýši riziká v tejto populácii.
Ženy v reprodukčnom veku majú používať účinné metódy antikoncepcie počas užívania teriparatidu. Ak žena otehotnie, teriparatid sa má vysadiť.
Dĺžkaliečby
Štúdie na potkanoch poukázali na zvýšený výskyt osteosarkómu pri dlhodobom podávaní teriparatidu (pozri časť 5.3). Kým nebudú dostupné ďalšie klinické údaje, nemá byť prekročená odporučená dĺžka liečby teriparatidom 24 mesiacov.
Dokumentácia
Pacient si má zaznamenať v kalendári číslo šarže (Lot) každého zásobníka a dátum jeho prvej injekcie.
Pomocnálátka
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednotke dávkovania, t.j. v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
V štúdii s 15 zdravými dobrovoľníkmi, ktorí denne užívali digoxín až do dosiahnutia rovnovážneho stavu, neovplyvnilo podanie jednorazovej dávky teriparatidu účinok digoxínu na srdce. Avšak
zo sporadických hlásení vyplýva, že pacienti s hyperkalciémiou môžu mať sklon k digitalisovej toxicite. Pretože teriparatid prechodne zvyšuje koncentráciu vápnika v sére, má teda byť u pacientov užívajúcich digitalis podávaný s opatrnosťou.
Teriparatid sa skúmal vo farmakodynamických interakčných štúdiách s hydrochlorotiazidom. Nezaznamenali sa žiadne klinicky významné interakcie.
Súčasné podávanie raloxifenu alebo hormonálnej substitučnej terapie spolu s teriparatidom nemalo vplyv na hladinu vápnika v sére alebo v moči alebo na výskyt klinických nežiaducich udalostí.
4.6 Fertilita, gravidita a laktácia
Ženyvreprodukčnomveku/Antikoncepciaužien
Ženy v reprodukčnom veku majú používať účinné metódy antikoncepcie počas užívania teriparatidu. Ak žena otehotnie, Movymia sa má vysadiť.
Gravidita
Movymia je kontraindikovaná pri používaní počas gravidity (pozri časť 4.3).
Dojčenie
Movymia je kontraindikovaná pri používaní počas dojčenia. Nie je známe, či sa teriparatid vylučuje do materského mlieka.
Fertilita
Štúdie na zajacoch preukázali reprodukčnú toxicitu (pozri časť 5.3). Neuskutočnili sa štúdie o vplyve teriparatidu na vývoj ľudského plodu. Potencionálne riziko pre ľudí nie je známe.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Teriparatid nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. U niektorých pacientov bola pozorovaná prechodná ortostatická hypotenzia alebo závrat. Títo pacienti sa majú do ústupu príznakov zdržať vedenia vozidiel alebo obsluhovania strojov.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Medzi najčastejšie hlásené nežiaduce reakcie u pacientov liečených teriparatidom patria nevoľnosť, bolesť v končatinách, bolesť hlavy a závrat.
Tabuľkovýprehľadnežiaducichreakcií
Aspoň jedna nežiaduca udalosť bola hlásená v skúšaniach s teriparatidom u 82,8 % pacientov užívajúcich teriparatid a u 84,5 % pacientov užívajúcich placebo.
Nežiaduce reakcie, ktoré súviseli s používaním teriparatidu pri osteoporóze v klinických skúšaniach a v priebehu uvedenia lieku na trh, sú zahrnuté nižšie v tabuľke.
Nežiaduce reakcie boli klasifikované podľa nasledovnej konvencie: veľmi časté (≥ 1/10), časté
(≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100) a zriedkavé (≥ 1/10 000 až <1/1 000).
Trieda
orgánových systémov
Poruchy krvi
a lymfatického systému
Poruchy imunitného systému
V
eľmi časté Časté Menej časté Zriedkavé
Anémia
Anafylaxia
Poruchy metabolizmu a výživy
Psychické poruchy Poruchy nervového
systému
Poruchy ucha a labyrintu
Hypercholesterol- émia
Depresia
Závrat, bolesť hlavy, ischias, synkopa Vertigo
Hyperkalciémia vyššia ako
2,76 mmol/l, hyperurikémia
Hyperkalciémia vyššia ako
3,25 mmol/l
 Poruchy srdca a srdcovej činnosti
Poruchy srdca a srdcovej činnosti
Palpitácie Tachykardia
Trieda orgánových systémov
V
eľmi časté Časté Menej časté Zriedkavé
Poruchy ciev Hypotenzia
Poruchy dýchacej
sústavy, hrudníka a mediastína
Dyspnoe Emfyzém
Poruchy gastrointestinál- neho traktu
Poruchy kože a podkožného tkaniva
Nauzea, vracanie, hiátová hernia, gastroezofageálna refluxná choroba Zvýšené potenie
Hemoroidy
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
P
oruchy obličiek a močových ciest
Bolesť končatín Svalové kŕče Myalgia, artralgia, kŕč chrbtového svalstva/bolesť*
Inkontinencia moču, polyúria, nutkanie na močenie, nefrolitiáza
Zlyhanie/poškode- nie obličiek
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Únava, bolesť na hrudníku, asténia, mierne a prechodné reakcie v mieste podania injekcie, vrátane bolesti, opuchu, erytému, modrín, pruritu a slabého krvácania v
mieste podania injekcie
Erytém v mieste podania injekcie, reakcia v mieste podania injekcie
Zvýšenie hmotnosti, srdcový šelest, zvýšenie hladiny alkalickej fosfatázy
Možné alergické udalosti ihneď
po injekcii: akútna
dýchavičnosť, orofaciálny edém, generalizovaná urtikária, bolesť
na hrudníku, edém
(najmä periférny)
* Závažné prípady kŕčov chrbtového svalstva alebo bolesti boli hlásené v priebehu niekoľkých minút po injekcii.
PopisvybranýchnežiaducichreakciíV klinických skúšaniach boli hlásené nasledovné reakcie s ≥ 1 %-ným rozdielom vo frekvencii v porovnaní s placebom: vertigo, nauzea, bolesť v končatinách, závrat, depresia, dýchavičnosť.
Teriparatid zvyšuje koncentrácie kyseliny močovej v sére. Zvýšenie koncentrácií kyseliny močovej
v sére nad hornú hranicu normy sa v rámci klinických skúšaní vyskytlo u 2,8 % pacientov užívajúcich teriparatid v porovnaní s 0,7 % pacientmi užívajúcimi placebo. Hyperurikémia však nespôsobila
zvýšený výskyt dny, bolesti kĺbov alebo urolitiázy.
Protilátky vykazujúce skríženú reaktivitu s teriparatidom boli vo veľkom klinickom skúšaní preukázané u 2,8 % žien užívajúcich teriparatid. Vo všeobecnosti protilátky boli prvýkrát preukázané po 12 mesiacoch liečby a po vysadení liečby dochádzalo k ich poklesu. V tejto súvislosti neboli preukázané žiadne reakcie z precitlivenosti, alergické reakcie, zmeny koncentrácie vápnika v sére alebo vplyv na vývoj minerálovej denzity kostí (Bone Mineral Density, BMD).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
PríloheV.4.9 PredávkovaniePrejavyasymptómyTeriparatid bol podávaný v jednotlivých dávkach až do množstva 100 mikrogramov a v opakovaných dávkach až do množstva 60 mikrogramov/deň po dobu 6 týždňov.
Príznaky, ktoré možno očakávať pri predávkovaní, zahŕňajú oneskorenú hyperkalciémiu a riziko
ortostatickej hypotenzie. Ďalej sa môžu vyskytnúť nauzea, vracanie, závrat a bolesť hlavy.
PoznatkyopredávkovanízospontánnychhlásenípouvedeníliekunatrhV spontánnych hláseniach po uvedení lieku na trh boli popísané prípady omylov v dávkovaní, kedy bol celý obsah (až 800 mikrogramov) teriparatidového pera podaný ako jedna dávka. Hlásené prechodné udalosti zahŕňali nevoľnosť, slabosť/letargiu a hypotenziu. V niektorých prípadoch nevznikli následkom predávkovania žiadne nežiaduce udalosti. V súvislosti s predávkovaním neboli hlásené žiadne úmrtia.
LiečbapredávkovaniaŽiadne špecifické antidotum pre teriparatid neexistuje. Pri podozrení na predávkovanie má byť teriparatid dočasne vysadený, má byť sledovaná koncentrácia vápnika v sére a majú sa zaviesť príslušné podporné opatrenia, ako napr. hydratácia.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: homeostáza vápnika, hormóny prištítnych teliesok a analógy, ATC kód: H05AA02
Movymia je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke

Európskej agentúry pre lieky
http://www.ema.europa.eu/ .MechanizmusúčinkuEndogénny parathormón (PTH) obsahujúci 84 aminokyselín je hlavným regulátorom metabolizmu vápnika a fosforu v kosti a v obličkách. Teriparatid (rhPTH(1-34)) je aktívny fragment (1-34)
endogénneho ľudského parathormónu. Fyziologické účinky PTH zahŕňajú stimuláciu kostnej novotvorby priamym pôsobením na bunky tvoriace kostnú hmotu (osteoblasty), a tým nepriame
zvýšenie črevnej absorpcie vápnika, zvýšenie tubulárnej reabsorpcie vápnika a vylučovanie fosfátov obličkami.
FarmakodynamickéúčinkyTeriparatid je látka podporujúca tvorbu kostí určená na liečbu osteoporózy. Účinky teriparatidu
na skelet závisia od charakteru systémovej expozície. Podávanie teriparatidu jedenkrát denne zvyšuje apozíciu novej kosti na povrchoch trabekulárnej a kortikálnej kosti preferenčnou stimuláciou aktivity osteoblastov, ktorá prevláda nad aktivitou osteoklastov.
Klinická
účinnosť
Rizikové faktory
Je potrebné vziať do úvahy nezávislé rizikové faktory, napríklad nízku BMD, vek, výskyt zlomeniny v minulosti, rodinnú anamnézu zlomeniny krčka stehnovej kosti, vysoký kostný obrat a nízky index
telesnej hmotnosti pri identifikácii žien a mužov so zvýšeným rizikom osteoporotických zlomenín,
u ktorých môže byť liečba prínosom.
U predmenopauzálnych žien s osteoporózou indukovanou glukokortikoidmi je potrebné vziať
do úvahy vysoké riziko zlomenín, ak majú bežnú zlomeninu alebo kombináciu rizikových faktorov, ktoré ich zaraďujú do skupiny s vysokým rizikom zlomenín (napr. nízka kostná denzita [napr.
T skóre ≤ −2], pretrvávajúca liečba vysokými dávkami glukokortikoidov [napr. ≥ 7,5 mg/deň počas minimálne 6 mesiacov], vysoká aktivita základného ochorenia, nízke hladiny pohlavných steroidných hormónov).
Postmenopauzálna osteoporóza
Do hlavnej klinickej štúdie bolo zaradených 1 637 postmenopauzálnych žien (priemerný vek 69,5 roka). Pri vstupe do štúdie malo deväťdesiat percent pacientov jednu alebo viac zlomenín stavcov a v priemere vertebrálna BMD bola 0,82 g/cm2 (čo zodpovedá T skóre = - 2,6). Všetky pacientky
denne dostávali 1 000 mg vápnika a aspoň 400 IU vitamínu D. Výsledky liečby teriparatidom trvajúcej až 24 mesiacov (priemerná doba: 19 mesiacov) preukázali štatisticky významné zníženie rizika
zlomenín (Tabuľka 1). Aby sa zabránilo jednej alebo viacerým zlomeninám stavcov je potrebné liečiť
11 žien po dobu priemerne 19 mesiacov.
Tabuľka 1
Výskyt zlomenín u postmenopauzálnych žien
Placebo
(n = 544) (%)
Teriparatid
(n = 541) (%)
Relatívne riziko (95%
CI) oproti placebu
Nová zlomenina stavcov (≥ 1) a Mnohopočetné zlomeniny stavcov (≥ 2) a Nevertebrálne osteoporotické zlomeniny c
Závažné nevertebrálne osteoporotické zlomeniny c (krčka stehnovej kosti, vretennej, ramennej kosti, rebier a panvy)
14,3 5,0 b 0,35 (0,22; 0,55)
4,9 1,1 b 0,23 (0,09; 0,60)
5,5% 2,6% d 0,47 (0,25; 0,87)
3,9% 1,5% d 0,38 (0,17; 0,86)
Skratky: n = počet pacientov náhodne pridelených do každej liečenej skupiny: CI = interval spoľahlivosti
a Výskyt zlomenín stavcov bol hodnotený u 448 pacientov dostávajúcich placebo a 444 pacientov dostávajúcich teriparatid, ktorí mali vstupné a kontrolné snímky chrbtice.
b p ≤ 0,001 v porovnaní s placebom.
c Signifikantné zníženie výskytu zlomeniny krčka stehnovej kosti nebolo preukázané.
d p ≤ 0,025 v porovnaní s placebom.
Po 19 mesiacoch liečby (priemerná doba) sa v porovnaní s placebom zvýšila minerálna denzita kostí
(BMD) v bedrovej chrbtici o 9 % a v celkovom krčku stehnovej kosti o 4 % (p < 0,001).
Sledovanie po ukončení liečby: Po ukončení liečby teriparatidom bolo 1 262 postmenopauzálnych žien z hlavného klinického skúšania zaradených do nasledujúcej štúdie, ktorá prebiehala po ukončení liečby. Primárnym cieľom tejto fázy štúdie bolo zhromaždiť údaje o bezpečnosti teriparatidu.
V priebehu tejto observačnej fázy boli povolené iné liečby osteoporózy a bolo vykonané ďalšie zhodnotenie výskytu zlomenín stavcov.
V priebehu priemerného obdobia 18 mesiacov po vysadení teriparatidu bol počet pacientov s aspoň jednou novou zlomeninou stavca o 41 % nižší v porovnaní s placebom (p = 0,004).
V otvorenej štúdii sa liečilo teriparatidom 503 postmenopauzálnych žien so závažnou osteoporózou a zlomeninou v predošlých 3 rokoch (83 % z nich už predtým dostávalo liečbu na osteoporózu) počas až
24 mesiacov. Po 24 mesiacoch liečby bol priemerný nárast BMD (minerálnej denzity kostí)
v porovnaní s východiskovými hodnotami 10,5 % v bedrovej chrbtici, 2,6 % v celom bedrovom kĺbe a
3,9% v krčku stehnovej kosti. Priemerný nárast BMD medzi 18 a 24 mesiacmi bol 1,4 % v bedrovej chrbtici, 1,2 % v celom bedrovom kĺbe a 1,6 % v krčku stehnovej kosti.
Do 24-mesačnej randomizovanej, dvojito zaslepenej, komparátorom kontrolovanej štúdie fázy, 4 bolo zahrnutých 1 360 postmenopauzálnych žien s rozvinutou osteoporózou. 680 pacientok bolo randomizovaných na teriparatid a 680 pacientok bolo randomizovaných na 35 mg/týždeň rizendronátu, perorálne. Na začiatku mali ženy vek v priemere 72,1 rokov a medián 2 bežných vertebrálnych zlomenín; 57,9 % pacientok užívalo pôvodnú bisfosfonátovú liečbu a počas štúdie 18,8 % užívalo súbežne glukokortikoidy. 1 013 (74,5 %) pacientok ukončilo 24-mesačné pokračovanie štúdie. Priemerná kumulatívna dávka (medián) glukokortikoidov bola 474,3 (66,2) mg v teriparatidovej skupine a 898,0 (100,0) mg v rizendronátovej skupine. Priemerný príjem vitamínu D (medián)
v teriparatidovej skupine bol 1433 IU/deň (1400 IU/deň) a v rizendronátovej skupine 1 191 IU/deň
(900 IU/deň). Výskyt nových vertebrálnych zlomenín u pacientok, ktorým vyhotovili vstupné aj následné rádiogramy chrbtice, bol 28/516 (5,4 %) u pacientok liečených teriparatidom a 64/533
(12,0 %) u pacientok liečených rizendronátom, relatívne riziko (95% CI) = 0,44 (0,29-0,68),
p < 0,0001. Kumulatívny výskyt združených klinických zlomenín (klinické vertebrálne a
nevertebrálne zlomeniny) bol 4,8 % u pacientok liečených teriparatidom a 9,8 % u pacientok liečených rizedronátom, pomer rizika (95% CI) = 0,48 (0,32-0,74), p = 0,0009.
Osteoporóza u mužov
Do klinického skúšania u mužov bolo zaradených 437 pacientov (priemerný vek 58,7 roka)
s hypogonadálnou osteoporózou (definovanou ako nízka hladina voľného testosterónu stanovená ráno alebo zvýšený FSH alebo LH) alebo idiopatickou osteoporózou. Vstupná minerálna denzita kostí
chrbtice a krčka stehnovej kosti vyjadrená ako priemerné T skóre boli -2,2 a -2,1 v uvedenom poradí.
Na začiatku malo 35 % pacientov zlomeninu stavcov a 59 % malo nevertebrálnu zlomeninu.
Všetci pacienti denne dostávali 1 000 mg vápnika a aspoň 400 IU vitamínu D. Po 3 mesiacoch došlo k významnému zvýšeniu BMD v bedrovej časti chrbtice. Po 12 mesiacoch sa BMD bedrovej časti chrbtice zvýšila v porovnaní s placebom o 5 %, celkového krčka stehnovej kosti o 1 %. Nebol však preukázaný významný účinok na výskyt zlomenín.
Osteoporóza indukovaná glukokortikoidmi
Účinnosť teriparatidu u mužov a žien (n = 428), ktorí dostávajú pretrvávajúcu systémovú liečbu glukokortikoidmi (ekvivalentnú 5 mg alebo viac prednizónu počas minimálne 3 mesiacov) bola preukázaná v 18-mesačnej primárnej fáze randomizovanej, dvojito zaslepenej, 36-mesačnej komparátorom kontrolovanej štúdii (alendronát 10 mg/deň). Dvadsaťosem percent pacientov malo na začiatku jednu alebo viac rádiograficky potvrdených vertebrálnych zlomenín. Všetci pacienti dostávali 1 000 mg vápnika denne a 800 IU vitamínu D denne.
Táto štúdia zahŕňala postmenopauzálne ženy (n = 277), predmenopauzálne ženy (n = 67) a mužov
(n = 83). Na začiatku mali postmenopauzálne ženy vekový priemer 61 rokov, stredné BMD T skóre v bedrovej časti chrbtice -2,7, medián dávky glukokortikoidu zodpovedajúci dávke prednizónu
7,5 mg/deň a 34 % pacientov malo jednu alebo viac rádiograficky potvrdených vertebrálnych
zlomenín; predmenopauzálne ženy mali vekový priemer 37 rokov, stredné BMD T skóre v bedrovej časti chrbtice -2,5, medián dávky glukokortikoidu zodpovedajúci dávke prednizónu 10 mg/deň a 9 % pacientov malo jednu alebo viac rádiograficky potvrdených vertebrálnych zlomenín; a muži mali vekový priemer 57 rokov, stredné BMD T skóre v bedrovej časti chrbtice -2,2, medián dávky
glukokortikoidu zodpovedajúci dávke prednizónu 10 mg/deň a 24 % pacientov malo jednu alebo viac rádiograficky potvrdených vertebrálnych zlomenín.
Šesťdesiatdeväť percent pacientov dokončilo 18-mesačnú primárnu fázu štúdie. V koncovom hodnotení po 18 mesiacoch, teriparatid signifikantne zvýšil BMD v bedrovej časti chrbtice (7,2 %)
v porovnaní s alendronátom (3,4 %) (p < 0,001). Teriparatid zvýšil BMD v oblasti celého bedrového kĺbu (3,6 %) v porovnaní s alendronátom (2,2 %) (p < 0,01), takisto ako krčka stehnovej kosti (3,7 %) v porovnaní s alendronátom (2,1 %) (p < 0,05). U pacientov liečených teriparatidom vzrástla hodnota
BMD v období medzi 18 a 24 mesiacmi liečby o ďalších 1,7 % v bedrovej chrbtici, 0,9 % v celom bedrovom kĺbe a 0,4 % v krčku stehennej kosti.
Analýza röntgenových snímok chrbtice po 36 mesiacoch liečby od 169 pacientov liečených alendronátom a 173 pacientov liečených teriparatidom preukázala, že u 13 pacientov v skupine liečenej alendronátom (7,7 %) sa vyskytla nová vertebrálna zlomenina v porovnaní s 3 pacientmi v skupine užívajúcich teriparatid (1,7 %) (p = 0,01). Okrem toho u 15 z 214 pacientov v skupine liečenej alendronátom (7,0 %) sa vyskytla nevertebrálna zlomenina v porovnaní so 16 pacientmi z 214 pacientov v skupine užívajúcich teriparatid (7,5 %) (p = 0,84).
U predmenopauzálnych žien bolo zvýšenie BMD z východiskovej hodnoty na hodnotu koncového ukazovateľa po 18 mesiacoch signifikantne vyššie v skupine s teriparatidom v porovnaní
s alendronátovou skupinou v bedrovej časti chrbtice (4,2 % oproti −1,9 %; p < 0,001) a v oblasti celého bedrového kĺbu (3,8 % oproti 0,9 %; p = 0,005). Žiadny signifikantný účinok na výskyt zlomeniny sa však nepreukázal.
5.2 Farmakokinetické vlastnosti
Distribúcia
Distribučný objem je približne 1,7 l/kg. Po subkutánnom podaní je polčas teriparatidu približne 1
hodina, čo odráža čas potrebný na vstrebanie z miesta vpichu injekcie.
Biotransformácia
Neboli vykonané žiadne štúdie metabolizmu alebo exkrécie s teriparatidom, zdá sa však, že periférny metabolizmus parathormónu prebieha prevažne v pečeni a obličkách.
Eliminácia
Teriparatid sa vylučuje hepatálnym a extrahepatálnym klírensom (približne 62 l/hod u žien a 94 l/hod u mužov).
Staršíľudia
Vo farmakokinetike teriparatidu neboli zaznamenané žiadne rozdiely s ohľadom na vek (rozpätie od 31 do 85 rokov). Úprava dávky podľa veku sa nevyžaduje.
5.3 Predklinické údaje o bezpečnosti
Teriparatid nebol genotoxický v žiadnej zo štandardne vykonanej série testov. Pri podávaní potkanom, myšiam alebo králikom neboli preukázané žiadne teratogénne účinky. Nepozorovali sa žiadne významné účinky u gravidných potkanov alebo myší, ktoré dostávali teriparatid v denných dávkach
30 až 1 000 mikrogramov/kg. Objavila sa však fetálna resorpcia a znížená veľkosť vrhu u gravidných králikov, ktoré dostávali teriparatid v denných dávkach 3 až 100 mikrogramov/kg. Embryotoxicita pozorovaná u králikov môže súvisieť s oveľa väčšou citlivosťou králikov na účinky PTH
na ionizovaný vápnik v krvi v porovnaní s hlodavcami.
U potkanov, liečených takmer celoživotne dennou injekciou teriparatidu, bolo preukázané dávkovo závislé zvýšenie kostnej novotvorby a zvýšený výskyt osteosarkómu, veľmi pravdepodobne epigenetickým mechanizmom. Podávanie teriparatidu potkanom nezvýšilo incidenciu žiadneho iného typu nádorového ochorenia. Klinický význam týchto nálezov je vďaka odlišnej fyziológii kosti
u potkanov a u ľudí pravdepodobne zanedbateľný. Žiadne kostné tumory neboli zaznamenané u opíc
po ovarektómii liečených počas 18 mesiacov alebo počas ďalších 3 rokov po ukončení liečby. Navyše v klinických skúšaniach alebo štúdiách nasledujúcich po ukončení liečby nebol žiadny osteosarkóm preukázaný.
Štúdie na zvieratách preukázali, že významne znížený prietok krvi pečeňou znižuje expozíciu PTH
hlavnému štiepnemu systému (Kupfferove bunky) a následne klírens PTH (1 – 84).
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
ľadová kyselina octová manitol
metakrezol
trihydrát octanu sodného
kyselina chlorovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky.
Chemická stabilita v priebehu užívania lieku bola preukázaná počas 28 dní pri 2 °C – 8 °C.
Z mikrobiologického pohľadu sa po otvorení môže liek uchovávať pri 2 °C – 8 °C maximálne 28 dní v rámci jeho času použiteľnosti.
Za inú dobu použitia a podmienky uchovávania je zodpovedný používateľ.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke pri teplote (2 °C – 8 °C). Po nasadení zásobníka do pera sa musí pero skombinované so zásobníkom hneď po použití vrátiť do chladničky.
Neuchovávajte v mrazničke. Zásobník uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Pero neuchovávajte s nasadenou ihlou. Po použití neodstraňujte zásobník z pera. Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
3 ml zásobník (silikónové sklo typ I) s piestom, zátkou (brómbutyl) a tesniacim diskom (hliníkové
a gumené tesniace vložky) balený do plastickej tácky uzavretej viečkom z fólie a balenej do škatuľky.
Každý zásobník obsahuje 2,4 ml roztoku, čo zodpovedá 28 dávkam s obsahom 20 mikrogramov
(na 80 mikrolitrov). Veľkosti balenia:
Movymia 20 mikrogramov/80 mikrolitrov injekčný roztok:
1 alebo 3 zásobníky.
Movymia balenie so zásobníkom a perom:
1 škatuľka zásobníka Movymia (obsahujúca 1 zásobník) a 1 škatuľka s Movymia Pen (obsahujúca 1
pero).
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomMovymia je dodávaná v zásobníku. Zásobníky Movymie sa musia používať iba opakovane použiteľným perom Movymia Pen, viacdávkovým systémom podávania lieku a nesmú sa podávať akýmkoľvek iným perom. S týmto liekom sa nedodávajú žiadne ihly.
Každý zásobník a pero má používať len jeden pacient. Pero sa môže používať s kompatibilnými ihlami. Tieto sú vymenované v návode na použitie pribalenom k peru. Na každú aplikáciu injekcie je
potrebné použiť novú, sterilnú ihlu pre pero.
Pred vložením zásobníka do Movymia Pen sa vždy musí skontrolovať čas použiteľnosti na štítku zásobníka. Aby ste zabránili chybám pri podávaní, uistite sa, že dátum, kedy začínate používať nový zásobník je minimálne 28 dní pred jeho dátumom exspirácie.
Predtým, ako sa použije systém s perom prvýkrát, pacient si musí prečítať a porozumieť návodu, ako používať pero, ktorý je pribalený k peru.
Po každej aplikácii musí byť pero vrátené do chladničky. Po prvom použití sa zásobník nesmie odstrániť z pera počas 28 dní používania.
Movymia sa nesmie prenášať do injekčnej striekačky. Prázdne zásobníky sa nesmú znovu plniť.
Movymia sa nemá použiť, ak je roztok zakalený, sfarbený alebo obsahuje viditeľné častice. Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIISTADA Arzneimittel AG Stadastrasse 2-18
61118 Bad Vilbel
Nemecko
8. REGISTRAČNÉ ČÍSLO
EU/1/16/1161/001 [1 zásobník]
EU/1/16/1161/002 [3 zásobníky]
EU/1/16/1161/003 [balenie so zásobníkom a perom]
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 11. január 2017
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.
Návod na použitie
Movymia Pen
Vždy sa pri používaní Movymia Pen riaďte pokynmi nižšie a na zadnej strane. Časti Movymia Pen
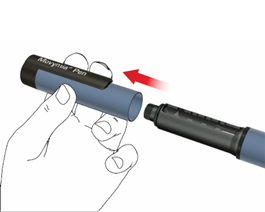
Príprava pera – prvé použitie/výmena zásobníkov
'
|
|
Vždy, keď do vášho pera Movymia Pen vkladáte nový zásobník Movymie, riaďte sa návodom. Neopakujte to pred každodennou injekciou, pretože nebudete mať dosť lieku Movymia na 28 dní. Prečítajte si písomnú informáciu k zásobníku Movymie poskytnutú oddelene.
B: Odstráňte držiak zásobníka otočením (bajonetová spojka).
: V prípade výmeny zásobníka vyberte prázdny zásob ásobníka drážkovanou kovovou čiapočkou zásobníka
ri každom novom zásobníku si poznačte dátum podan e spotrebovaných 28 denných dávok zo zásobníka.
|
|

C ník. Vložte nový zásobník Movymie do držiaka
z dopredu.
D: Opatrne zatlačte závitovú tyč priamo tak ďaleko,
v štartovacej polohe, ako je to pri úplne prvom použ pera.
|
|
P ia prvej injekcie. To vám pomôže vedieť, kedy
j
ako sa dá. Toto nie je potrebné, ak je tyč už
ití. Závitová tyč sa nedá úplne zatlačiť do plášťa
E: Nasaďte držiak zásobníka do plášť
|
|
a tak, že ho otočíte o 90 stupňov, kým sa nezastaví.
F: Nasaďte novú ihlu pera nasledovne:
• Stiahnite odstrániteľnú fóliu.
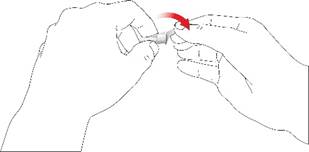
• Skrutkujte ihlu pera v smere hodinových ručičiek na držiak zásobníka. Uistite sa, že ihla pera je nasadená správne a pevne sedí na držiaku zásobníka.
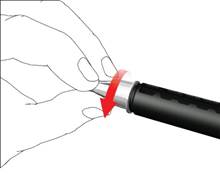
• Snímte vonkajší kryt ihly a odložte si ho.
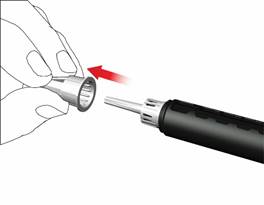
• Snímte a odhoďte vnútorný kryt ihly.
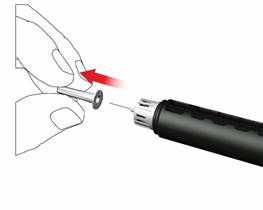
Pri nasadzovaní ihly môže uniknúť niekoľko kvapiek, toto je normálne.
G: Natiahnutie
Po vložení nového zásobníka a vždy pred podaním prvej injekcie z každého zásobníka musíte pero natiahnuť a vyskúšať.
• Otáčajte gombíkom v smere hodinových ručičiek, až kým uvidíte v okienku displeja symbol kvapky. Uistite sa, že dva indikačné prúžky sú zarovno. Počas volenia dávky vydáva pero počuteľný cvakavý zvuk a badateľný odpor.
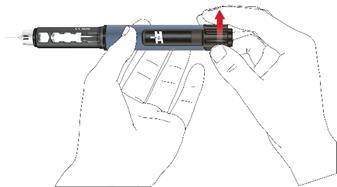
• Pero držte
ihlou smerom hore.
• Zatlačte tlačidlo úplne dovnútra. Držte ho, pokým sa indikátor dávky vráti do počiatočnej polohy. Z hrotu ihly musí odkvapnúť niekoľko kvapiek lieku.
Ak sa neobjavia žiadne kvapky, opakujte krok G, kým neuvidíte nejaké kvapky. Krok G neopakujte viac ako štyrikrát, avšak riaďte sa pokynmi nižšie v časti Riešenie problémov na zadnej strane.
 Podávanie pomocou Movymia Pen
Podávanie pomocou Movymia PenStarostlivo si umyte ruky mydlom, aby ste predišli infekcii. Uistite sa, že máte pripravené:
• vaše Movymia Pen s vloženým zásobníkom
• kompatibilnú ihlu pera
• neprepichnuteľnú nádobu na ostré predmety na odstránenie použitých ihiel.
Nepoužite pero, ak je
náplň zásobníka zakalená, má inú farbu alebo obsahuje viditeľné častice.Prečítajte si písomnú informáciu pre používateľa pre zásobník Movymia, poskytnutú osobitne.
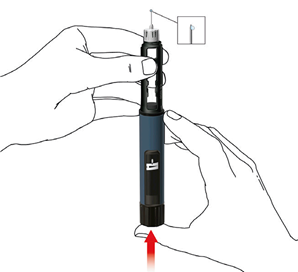
1. Nasadenie ihly pera
Pre každú injekciu použite novú ihlu. Nepoužite ihlu pera, ak je obal poškodený, alebo ak ste ho neotvorili sám/sama.
Poznámka: Nie je potrebné meniť ihlu, ak ju použijete ihneď po príprave pera. V tomto prípade postupujte podľa kroku „2. Nastavenie dávky a podanie injekcie”.
• Stiahnite odstrániteľnú fóliu.
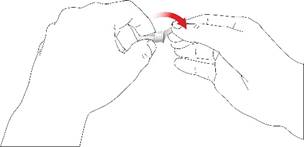
• Skrutkujte ihlu pera v smere hodinových ručičiek na držiak náplne. Uistite sa, že ihla pera je nasadená správne a pevne sedí na držiaku náplne.
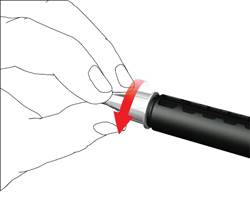
• Snímte vonkajší kryt ihly a odložte si ho.
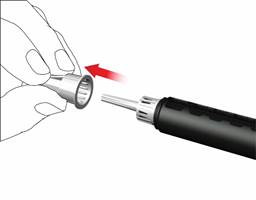
• Snímte a odhoďte vnútorný kryt ihly.

Pri nasadzovaní ihly môže uniknúť niekoľko kvapiek, toto je normálne.
2. Nastavenie dávky a podanie injekcieUpozornenie: Presvedčte sa, že používate správny roztok lieku. Skontrolujte štítok na zásobníku pred jeho zasunutím do držiaka zásobníka.
• Pre nastavenie fixnej dennej dávky 80 mikrolitrov otáčajte gombík v smere hodinových ručičiek, kým sa nezastaví a nedá sa ďalej otáčať. Uistite sa, že displej ukazuje znak šípky a dva indikačné prúžky sú zarovno. Počas volenia dávky vydáva pero počuteľný cvakavý zvuk a badateľný odpor. Nepokúšajte sa nasilu ďalej otáčať dávkovací gombík.
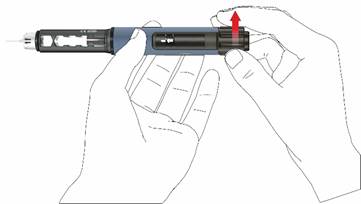 Poznámka:
Poznámka: Ak zásobník obsahuje menej ako 80 mikrolitrov, dávkovací gombík sa nedá v smere hodinových ručičiek otočiť až k symbolu šípky. V tomto prípade odstráňte ihlu pera, vymeňte zásobník a pokračujte s naťahovaním podľa krokov prípravy pera.
• Vyberte si vhodné miesto pre podanie injekcie a pripravte si kožu tak, ako vám odporučil lekár. Jemne držte záhyb kože medzi palcom a ukazovákom. Zasuňte ihlu priamo a jemne do kože tak, ako je to na obrázku.
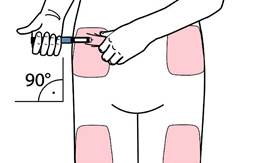
Upozornenie: Chráňte ihlu pera pred ohnutím alebo zlomením. Po zapichnutí ihly do kože pero nenakláňajte. Nakláňanie pera môže viesť k zohnutiu alebo k zlomeniu ihly. Zlomená ihla môže zostať zaseknutá v koži. Ak sa ihla zlomí a zasekne v koži, bezodkladne to povedzte svojmu lekárovi.
• Tlačte tlačidlo, pokým sa indikátor dávky nevráti do počiatočnej polohy. Podržte ihlu v záhybe kože počas ďalších 6 sekúnd.
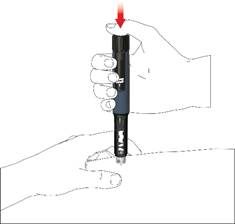
• Pomaly vytiahnite pero. Skontrolujte, či je displej v počiatočnej polohe, aby ste sa uistili, že ste si podali plnú dávku.
 3. Odstránenie ihly pera
3. Odstránenie ihly pera• Pozorne nasaďte vonkajší kryt ihly na ihlu pera.

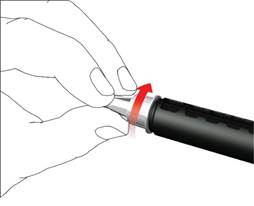
• Skrutkujte kryt ihly proti smeru hodinových ručičiek, aby ste odstránili ihlu pera. Zlikvidujte ju správne, napríklad odhoďte ju do neprepichnuteľnej nádoby na ostré predmety.
 4. Opätovné nasadenie krytu pera
4. Opätovné nasadenie krytu pera• Neodstraňujte zásoník z Movymia Pen, kým nie je prázdny.
• Po každom použití opätovne nasaďte kryt pera.

• Ihneď po použití uložte pero Movymia Pen s vloženým zásobníkom späť do chladničky medzi
2 a 8 °C.
Poznámka pre zdravotníckych pracovníkovMiestne, zdravotnícke alebo úradné zásady môžu upraviť návod týkajúci sa zaobchádzania s ihlami
a ich odstraňovaním.
Dodatočné informácieOpakovateľne použiteľné pero na podávanie fixných dávok je určené na jednoduchú aplikáciu lieku Movymia na liečbu osteoporózy. Každý zásobník Movymie obsahuje 28 fixných dávok po 80 mikrolitrov lieku Movymia.
Používajte svoje pero Movymia Pen iba tak, ako vám predpísal váš lekár, podľa tohto návodu na použitie a písomnej informácie k lieku Movymia.
Pero Movymia Pen môžu na podávanie injekcie sebe samým používať iba pacienti starší ako 18 rokov, zdravotnícki pracovníci alebo tretie osoby, ako napr. dospelí príbuzní.
Pero Movymia Pen nesmú používať nevidomí alebo zrakovo postihnutí pacienti bez pomoci
vyškolených zdravých osôb. V prípade poruchy zraku alebo schopnosti manipulácie sa obráťte na svojho lekára.
Ak máte k používaniu pera Movymia Pen akékoľvek otázky, obráťte sa kedykoľvek na náš
zákaznícky servis.
telefónne číslo: XXXXXXXXXXX
e-mail: XXXXXXXXXXX
Kompatibilné ihly pera
• Ypsomed mylife Clickfine kalibru od 29 do 31 (priemer 0,25 – 0,33 mm) a 12, 10, 8 alebo 6 mm dlhé
• BD Micro-Fine Ultra ihly kalibru od 29 do 31 (priemer 0,25 – 0,33 mm) a 12,7; 8 alebo 5 mm dlhé
Ihly pera od iných výrobcov možno použiť podľa ich uvedených detailov o kompatibilite.
Ihly pera sa musia použiť iba raz a zásobník Movymie musí používať iba jedna osoba.
Uchovávanie a starostlivosť o Movymia Pen
• So svojím perom zaobchádzajte opatrne. Neodhadzujte svoje pero a chráňte ho pred nárazmi na tvrdé povrchy. Chráňte ho pred vodou, prachom a vlhkosťou.
• Na vyčistenie pera Movymia Pen postačuje vlhká handrička. Nepoužívajte alkohol, iné rozpúšťadlá
alebo čistiace prostriedky. Nikdy neponárajte Movymia Pen do vody, lebo by ho to mohlo poškodiť.
• Nepoužívajte Movymia Pen, ak je poškodené, alebo ak máte pochybnosti o jeho správnom fungovaní.
• Prepravujte a uchovávajte Movymia Pen s vloženým zásobníkom pri teplotách špecifikovaných v písomnej informácii k lieku Movymia poskytnutej oddelene.
• Movymia Pen, zásobníky a ihly pera uchovávajte mimo dosahu detí.
• Neuchovávajte Movymia Pen s nasadenou ihlou, pretože by to mohlo spôsobiť vytváranie bublín v náplni.
Likvidácia Movymia Pen a použitého príslušenstva
Movymia Pen má životnosť dva roky. Pred likvidáciou pera Movymia Pen vždy odstráňte ihlu pera
a zásobník. Ihly a použité zásobníky sa musia likvidovať oddelene a bezpečne. Movymia Pen možno zlikvidovať podľa miestnych pravidiel.
Upozornenie
Dodržujte inštrukcie uvedené v tomto návode na použitie. Ak nie sú dodržiavané tieto inštrukcie, hrozí
riziko nesprávnej liečby, nepresného dávkovania, prenosu ochorení alebo infekcie. Ak máte akékoľvek zdravotné ťažkosti, bezodkladne vyhľadajte lekársku pomoc.
Záruka
Záruka pokrýva výrobné a materiálové chyby vášho Movymia Pen počas dvoch rokov používania od jeho získania. Je obmedzená na výmenu pera. Záruka sa nevzťahuje na poškodenia spôsobené:
• používaním iných zásobníkov než zásobníkov Movymie
• nesprávnym alebo neopatrným používaním, zaobchádzaním alebo čistením
• používaním v rozpore s návodom na použitie
• používaním pera so zdravotníckymi pomôckami, príslušenstvom alebo spotrebným materiálom iným, než odporúča XXXXXXXXXXX.
• pádom, nárazom, použitím sily, stykom s kvapalinami
• inými prípadmi expozície a nosenia, ktoré nie sú v súlade s návodom na použitie.
Riešenie problémov
Ak máte akékoľvek otázky k použitiu Movymia Pen, riaďte sa inštrukciami v tabuľke nižšie:
Otázka Odpoveď
1. V zásobníku sú viditeľné malé vzduchové bubliny.
Malá vzduchová bublina neovplyvní dávku ani neuškodí.
2. Nemožno nasadiť ihlu. Použite inú ihlu. Ak sa nedá nasadiť iná ihla, kontaktujte Zákaznícky servis.
3. Ihla je zlomená/skrivená/prehnutá. Použite inú ihlu.
4. Počas voľby dávky nevydáva pero zvukový signál.
5. Z ihly nevychádza žiadny liek počas prípravy pera podľa bodu „G: Natiahnutie”.
6. Dávkovací gombík sa nedá otočiť v smere hodinových ručičiek až k symbolu šípky.
7. Displej sa po podaní injekcie nevracia do štartovacej polohy.
Nepoužite toto pero; kontaktujte Zákaznícky servis.
Vymeňte ihlu a opakujte natiahnutie, ako je popísané v bodoch „F” a „G” časti prípravy pera.
Ak stále nevychádza žiadny liek, nepoužívajte toto pero; kontaktujte Zákaznícky servis.
Zvyšné množstvo lieku Movymia v zásobníku je menšie než 80 mikrolitrov. Vymeňte náplň
a ihlu pera a vykonajte natiahnutie v zmysle
prípravy pera.
Neopakujte podávanie injekcie v ten istý deň. Na nasledujúci deň použite novú ihlu. Nastavte dávku a dokončite podanie injekcie, ako je popísané v časti „2. Nastavenie dávky
a podanie injekcie”.
Ak sa po podaní injekcie displej stále nevrátil do štartovacej pozície, nepoužívajte toto pero;
kontaktujte Zákaznícky servis.
8. Je badateľný výtok z pera. Nepoužívajte toto pero; kontaktujte Zákaznícky servis.
9. Dávkovací gombík sa nedopatrením otočil
v smere hodinových ručičiek po podaní injekcie. Ako mám vrátiť dávkovací gombík do
štartovacej polohy?
Nestláčajte tlačidlo. Prestavte pero jednoduchým otočením dávkovacieho gombíka späť proti smeru hodinových ručičiek do štartovacej polohy.

Distribútor:
XXXXXXXXXXX
Výrobca: Ypsomed AG Brunnmattstrasse 6
3401 Burgdorf, Švajčiarsko