
1 Titrácia dávky
T
ýždeň (dni)
|
D
ávkovanie
|
týždeň 1 (deň 1-7)
|
polovica 10 mg filmom obalenej tablety (5 mg) denne počas 7 dní
|
týždeň 2 (deň 8-14)
|
jedna 10 mg filmom obalená tableta (10 mg) denne počas 7 dní
|
týždeň 3 (deň 15-21)
|
jedna a pol 10 mg filmom obalenej tablety (15 mg) denne počas 7 dní
|
od týždňa 4 a ďalej
|
dve 10 mg filmom obalené tablety (20 mg) denne
|
Udrž i avaci a dávka
Odporúčaná udržiavacia dávka je 20 mg denne.
Starší ľudiaNa základe klinických štúdií je dávka odporúčaná pre pacientov nad 65 rokov 20 mg denne (dve 10 mg
tablety jedenkrát denne), ako bolo popísané vyššie.
Porucha funkcie obličiekU pacientov s miernou poruchou funkcie obličiek (klírens kreatinínu 50-80 ml/min) sa nevyžaduje úprava dávky. U pacientov so stredne závažnou poruchou obličiek (klírens kreatinínu 30-49 ml/min) má
byť denná dávka 10 mg denne. Ak je dávka dobre tolerovaná minimálne 7 dní liečby, môže byť zvýšená až do 20 mg/deň podľa štandardnej titračnej schémy. U pacientov so závažnou poruchou funkcie
obličiek (klírens kreatinínu 5-29 ml/min) má byť denná dávka 10 mg denne.
Porucha funkcie pečeneU pacientov s miernou až stredne závažnou poruchou funkcie pečene (Child-Pugh A a Child-Pugh B) nie je potrebná úprava dávky. U pacientov so závažnou poruchou funkcie pečene nie sú dostupné údaje o užívaní memantínu. Podanie Memantine Grindeks sa neodporúča pacientom so závažnou poruchou funkcie pečene.
Pediatrická populáciaMemantine sa neodporúča používať u detí mladších ako 18 rokov kvôli nedostatočným údajom o bezpečnosti a účinnosti.
SpôsobpodávaniaNa perorálne použitie. Memantine Grindeks sa má užívať jedenkrát denne a má sa užívať vždy v rovnakú dennú dobu. Filmom obalené tablety sa môžu užívať s jedlom alebo bez jedla.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníU pacientov s epilepsiou, so záchvatmi kŕčov v minulosti alebo s predispozičnými faktormi na epilepsiu
sa odporúča opatrnosť.
Súbežnému užívaniu N-metyl-D-aspartát (NMDA)-antagonistov ako je amantadín, ketamín alebo dextrometorfán s memantínom sa odporúča vyhýbať. Tieto látky účinkujú na ten istý receptorový systém ako memantín, preto pri ich súbežnom užívaní môžu byť častejšie alebo výraznejšie nežiaduce reakcie (týkajúce sa najmä centrálneho nervového systému /CNS/) (pozri tiež časť 4.5).
Niektoré faktory, ktoré môžu zvýšiť pH moču (
pozri časť 5.2 „Eliminácia“)
, vyžadujú starostlivé sledovanie pacienta. Tieto faktory zahŕňajú drastické zmeny diéty, napr. z mäsitej na vegetariánsku, alebo masívny príjem alkalizujúcich žalúdočných pufrov. Močové pH sa môže zvýšiť tiež pri stavoch renálnej tubulárnej acidózy (RTA) alebo pri ťažkých infekciách močového traktu bakteriálnymi kmeňmi
Proteus. Vo väčšine klinických štúdií boli vylúčení pacienti s nedávnym infarktom myokardu, dekompenzovaným kongestívnym srdcovým zlyhaním (NYHA III-IV) alebo nekontrolovanou hypertenziou. Dôsledkom toho je fakt, že k dispozícii je len obmedzené množstvo údajov a pacienti s týmito ochoreniami majú byť starostlivo sledovaní.
Tablety obsahujú monohydrát laktózy. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, celkovým deficitom laktázy alebo glukózo-galaktózovou malabsorpciou nemajú užívať tento liek.
4.5 Liekové a iné interakcie
V dôsledku farmakologických efektov a mechanizmu účinku memantínu sa môžu objaviť nasledovné
interakcie:
- Mechanizmus účinku naznačuje, že účinky L-dopy, dopamínergických agonistov a anticholínergík
môžu byť pri súbežnom užívaní NMDA-antagonistov, ako je memantín, zosilnené. Účinky
barbiturátov alebo neuroleptík môžu byť naopak znížené. Súbežné podávanie memantínu a myorelaxancií, dantrolénu alebo baklofénu, môže modifikovať ich účinky a vyžadovať úpravu
dávok.
- Musí sa vyhnúť súbežnému užitiu memantínu a amantadínu, a to pre riziko farmakotoxickej
psychózy. Obe látky sú chemicky príbuzné NMDA-antagonisty. To isté môže platiť pre ketamín a
dextrometorfán (pozri tiež časť 4.4). Existuje tiež jedna publikovaná kazuistika o možnom riziku
kombinácie memantínu a fenytoínu.
- Iné liečivá, ako sú cimetidín, ranitidín, prokaínamid, chinidín, chinín a nikotín, ktoré používajú ten
istý obličkový katiónový transportný systém ako amantadín, môžu tiež interagovať s memantínom
a viesť tak k potenciálnemu riziku zvýšených plazmatických hladín.
- Ak sa memantín používa súbežne s hydrochlórtiazidom (HCT) alebo akoukoľvek kombináciou
HCT, je tu možnosť zníženia sérovej hladiny HCT.
- V postmarketingovom sledovaní boli zaznamenané ojedinelé prípady zvýšenia hodnôt
medzinárodného normalizovaného pomeru (INR, international normalized ratio) u pacientov
užívajúcich súbežne warfarín. Aj keď priama súvislosť nebola potvrdená, u pacientov, ktorí sú súbežne liečení perorálnymi antikoagulanciami, sa doporučuje dôkladné sledovanie protrombínového času alebo INR.
Vo farmakokinetíckých (FK) štúdiách s jednorazovou dávkou u mladých zdravých dobrovoľníkov nebola pozorovaná žiadna významná interakcia liečiv memantínu s glyburidom/metformínom alebo s donepezilom.
V klinickej štúdii u mladých zdravých jedincov nebol pozorovaný žiaden významný účinok memantínu na farmakokinetiku galantamínu.
Memantín in vitro neinhibuje CYP 1A2, 2A6, 2C9, 2D6, 2E1, 3A, flavín obsahujúcu monoxygenázu, epoxid hydrolázu alebo sulfatión.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne klinické údaje o gravidných ženách vystavených účinku memantínu. Štúdie na zvieratách naznačujú potenciál pre znížený vnútromaternicový rast pri expozičných hladinách identických alebo mierne vyšších ako u ľudí (pozri časť 5.3). Nie je známe potenciálne riziko pre ľudí. Memantín má byť užívaný počas gravidity iba v nevyhnutných prípadoch.
Dojčenie
Nie je známe, či sa memantín vylučuje do ľudského materského mlieka. Ak sa však vezme do úvahy
lipofilita tejto látky, je to pravdepodobné. Ženy užívajúce memantín nemajú dojčiť.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Alzheimerova choroba stredného až ťažkého stupňa zvyčajne spôsobuje zhoršenie schopnosti viesť vozidlá a zhoršuje schopnosť obsluhovať stroje. Navyše Memantine Grindeks má menší až stredný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Preto je potrebné upozorniť ambulantných pacientov, aby týmto činnostam venovali osobitnú pozornosť.
4.8 Nežiaduce účinky
V klinických štúdiách v ľahkej až ťažkej demencii, ktoré zahŕňali 1784 pacientov liečených memantínom a 1595 pacientov, ktorí užívali placebo, sa celkový výskyt nežiaducich účinkov pri liečbe memantínom nelíšil od výskytu pri placebe a nežiaduce účinky boli obvykle miernej až strednej závažnosti. Najčastejšie sa vyskytujúce nežiaduce účinky s vyšším výskytom v skupine s memantínom voči placebovej skupine boli závraty (6,3% voči 5,6%), bolesti hlavy (5,2% voči 3,9%), zápcha (4,6% voči 2,6%), ospalosť (3,4% voči 2,2%) a hypertenzia (4,1% voči 2,8%).
Nežiaduce účinky sú prezentované podľa MedDRA klasifikácie orgánových systémov a nasledovnej frekvencie: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000), neznáme (nedajú sa určiť z dostupných údajov).
V rámci každej skupiny frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Tabuľka 2 Nežiaduce účinky z klinických štúdií a postmarketingových skúseností
Trieda orgánových systémov Frekvencia Nežiaduci účinok
Infekcie a nákazy Menej časté Plesňové infekcie Poruchy imunitného systému Časté Precitlivenosť na liek Psychické poruchy Časté Ospalosť
Menej časté Zmätenosť, Halucinácie1
Neznáme Psychotické reakcie2
Poruchy nervového systému Časté Závraty, Porucha rovnováhy
Menej časté Poruchy chôdze
Veľmi zriedkavé Záchvaty Poruchy srdca a srdcovej činnosti Menej časté Zlyhanie srdca Poruchy ciev Časté Hypertenzia
Menej časté Žilová trombóza/tromboembólia
Poruchy dýchacej sústavy, hrudníka a mediastína
Časté Dyspnoe
Poruchy gastrointestinálneho traktu Časté Zápcha Menej časté Vracanie Neznáme Pankreatitída2
Poruchy pečene a žlčových ciest Časté Zvýšené hodnoty testov pečeňových funkcií
Neznáme Hepatitída
Celkové poruchy a reakcie v mieste
podania
Časté Bolesti hlavy
Menej časté Únava
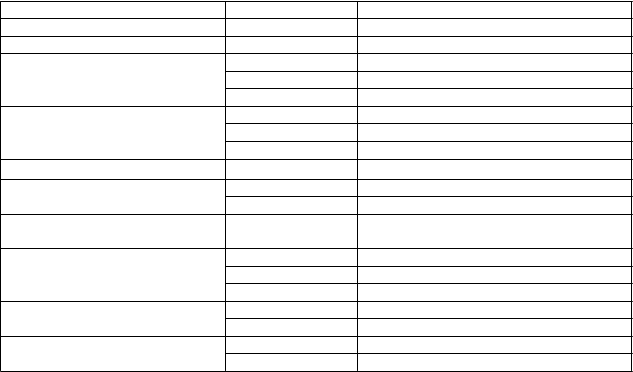
1 Halucinácie boli pozorované hlavne u pacientov s ťažkým stupňom Alzheimerovej choroby.
2 Ojedinelé prípady zaznamenané z postmarketingového sledovania.
Alzheimerova choroba býva sprevádzaná depresiou, samovražednými myšlienkami a samovraždou. Po uvedení lieku na trh boli tieto udalosti hlásené u pacientov liečených memantínom.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili všetky akékoľvek podozrenia na nežiadúce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 Predávkovanie
Skúsenosti s predávkovaním memantínom sú obmedzené.
Symptómy
Pomerne závažné predávkovanie (od 200 mg, respektíve 105 mg / deň počas 3 dní) bolo spojené buď s príznakmi ako sú únava, slabosť a/alebo s hnačkou alebo so žiadnými príznakmi. V prípadoch
predávkovania nižšími dávkami ako je 140 mg alebo neznámou dávkou sa u pacientov prejaili príznaky
ovplavnenia z CNS (ako napr. zmätenosť, ospalosť, ospalosť, závraty, nepokoj, agresivita, halucinácie a poruchy chôdze) a/alebo ťažkosti gastrointestinálneho pôvodu (zvracanie a hnačka).
V najextrémnejšom prípade predávkovania pacient prežil perorálne užitú dávku v celkovom množstve
2000 mg memantínu s účinkami na CNS (kóma počas 10 dní a neskôr diplopia a agitácia). Pacient dostal symptomatickú liečbu a plazmaferézu a zotavil sa bez trvalých zdravotných následkov.
V inom prípade značného predávkovania pacient tiež prežil a zotavil sa po perorálnom podaní 400 mg
memantínu. U pacienta sa vyskytli príznaky ovplyvnenia CNS, ako sú nepokoj, psychóza, vizuálne halucinácie, prokonvulzívnosť, somnolencia, stupor a bezvedomie.
Liečba
Liečba má byť symptomatická. Nie je k dispozícii žiadne špecifické antidotum. Na odstránenie účinnej látky sa majú použiť štandardné klinické postupy, ako je výplach žalúdka, aktívne uhlie (prerušenie
potenciálnej enterohepatálnej recirkulácie), acidifikácia moču, nútená diuréza.
V prípade prejavov a symptómov nadmernej stimulácie CNS sa má starostlivo zvážiť symptomatická klinická liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: iné liečivá proti demencii, ATC kód: N06DX01.
Vzrastá množstvo dôkazov o tom, že porušená funkcia glutamátergickej neurotransmisie, najmä na NMDA-receptoroch, sa podieľa na vzniku príznakov aj na progresii ochorenia u neurodegeneratívnej demencie.
Memantín je na napätí závislý, nekompetitívny antagonista NMDA receptorov strednej afinity. Zmierňuje účinky patologicky zvýšených tonických hladín glutamátu, ktoré môžu viesť k neuronálnej dysfunkcii.
Klinické štúdie
Pivotná monoterapeutická štúdia v populácii pacientov trpiacich Alzheimerovou chorobou stredného až
ťažkého stupňa (celkové skóre MMSE (mini mental state examination) na začiatku liečby 3 – 14) zahŕňala 252 ambulantne liečených pacientov. Štúdia preukázala priaznivý účinok liečby memantínom v porovnaní s placebom po 6-tich mesiacov (analýza pozorovaných prípadov - významnosť rozdielov pre CIBIC-plus (cases analysis for the clinician´s interview based impression of change): p=0,025; pre ADCS-ADLsev (Alzheimer´s disease cooperative study – activities of daily living): p=0,003; pre SIB (severe impairment battery): p=0,002).
Pivotná štúdia s memantínom v monoterapii v liečbe Alzheimerovej choroby mierneho až stredného stupňa (celkové skóre MMSE na začiatku liečby 10 – 22) zahŕňala 403 pacientov. U pacientov liečených memantínom bol pozorovaný štatisticky signifikantne lepší účinok v porovnaní s pacientami, ktorým bolo podávané placebo, v primárnych ukazovateľoch v 24. týždni prevodom hodnôt z posledného dokumentovaného vyšetrenia (analýza LOCF (last observation carried forward)): ADAS-cog (p=0,003) (Alzheimer´s disease assessment scale) a CIBIC-plus (p=0,004). V ďalšej monoterapeutickej štúdii v'
analýze nebola dosiahnutá štatistická významnosť v primárnom ukazovateli účinnosti v 24. týždni.
Meta-analýza pacientov s Alzheimerovou chorobou stredného až ťažkého stupňa (celkové skóre MMSE
≤ 20) zo šiestich, placebom kontrolovaných, 6-mesačných klinických štúdií vo fáze III. (vrátane monoterapeutických štúdií a štúdií s pacientmi na ustálenej dávke inihibítorov acetylcholínesterázy) preukázala štatisticky signifikantný účinok v prospech liečby memantínom v kognitívnej, globálnej a funkčnej oblasti. Pri identifikovaní pacientov so súčasným zhoršením vo všetkých troch oblastiach výsledky ukázali štatisticky signifikantný účinok memantínu v prevencii zhoršenia. Až u dvojnásobného počtu pacientov na placebe v porovnaní s pacientmi na memantíne sa preukázalo zhoršenie vo všetkých troch oblastiach (21% voči 11%, p<0,0001).
5.2 Farmakokinetické vlastnosti
Absorpcia
Memantín má absolútnu biodostupnosť približne 100%. Tmax je medzi 3 a 8 hodinami. Nie sú dôkazy o tom, že by jedlo ovplyvňovalo absorpciu memantínu.
Distribúcia
Denné dávky 20 mg vedú k rovnovážnym plazmatickým koncentráciám memantínu v rozmedzí od 70
do 150 mg/ml (0,5-1 μmol) s veľkými interindividuálnymi variáciami. Keď sa podávali denné dávky 5 až 30 mg, priemerný pomer cerebrospinálny likvor (CSF)/sérum bol vypočítaný na hodnotu 0,52. Objem distribúcie je okolo 10 l/kg. Približne 45% memantínu sa viaže na plazmatické proteíny.
Biotransformácia
U ľudí je asi 80% cirkulujúceho memantínového materiálu prítomného v podobe materskej látky.
Hlavnými metabolitmi u ľudí sú N-3,5-dimetyl-gludantán, izomerická zmes 4- a 6-hydroxy-memantínu a 1-nitrózo-3,5-dimetyl-adamantán. Žiaden z týchto metabolitov nevykazuje NMDA-antagonistickú aktivitu. Pri testoch In vitro sa nezistil metabolizmus, katalyzovaný niektorým z cytochrómov P-450.
V štúdii s použitím perorálne podávaného 14C-memantínu vymizlo priemerne 84% dávky v priebehu 20
dní, pričom viac ako 99% sa vylúčilo obličkami.
Eliminácia
Memantín sa vylučuje monoexponenciálnym spôsobom s konečným t1/2 od 60 do 100 hodín. U
dobrovoľníkov s normálnymi funkciami obličiek dosahuje celkový klírens (Cltot) množstvo do 170
ml/min/1,73 m2 a časť celkového obličkového klírensu sa dosahuje tubulárnou sekréciou.
Obličkový transport zahŕňa tiež tubulárnu reabsorpciu, pravdepodobne sprostredkovanú katiónovými transportnými proteínmi. Rýchlosť obličkovej eliminácie memantínu môže byť za alkalických podmienok moču znížená, faktor zníženia sa pohybuje od 7 do 9 (pozri časť 4.4). Alkalizácia moču môže byť výsledkom drastických zmien diéty, napr. prechod z mäsitej na vegetariánsku stravu, alebo masívneho príjmu alkalizujúcich žalúdočných pufrov.
Linearita/nelinearita
Štúdie na dobrovoľníkoch demonštrovali lineárnu farmakokinetiku v dávkovom rozpätí 10 až 40 mg.
Farmakokinetický/farmakodynamickývzťah
Pri dávke memantínu 20 mg denne hladiny memantínu v CSF zodpovedajú hodnote ki (ki=inhibičná konštanta) memantínu, ktorá je 0,5 μmol v ľudskom frontálnom kortexe.
5.3 Predklinické údaje o bezpečnosti
V krátkodobých štúdiách u potkanov indukoval memantín, podobne ako iné NMDA-antagonisty, neuronálnu vakuolizáciu a nekrózu (Olneyho lézie) len po dávkach, vedúcich k veľmi vysokým sérovým koncentráciám. Ataxia a iné predklinické prejavy predchádzali vakuolizácii a nekróze. Keďže takéto účinky neboli pozorované v dlhodobých štúdiách u hlodavcov ani u nehlodavcov, klinický význam týchto zistení zostáva nejasný.
V štúdiách toxicity po opakovanej dávke u hlodavcov a psov, ale nie u opíc, sa premenlivo pozorovali očné zmeny. Špecifické oftalmoskopické vyšetrenia v klinických štúdiách s memantínom však žiadne takéto zmeny neodhalili.
U hlodavcov sa pozorovala fosfolipidóza v pľúcnych makrofágoch v dôsledku nahromadenia memantínu v lyzozómoch. Tento účinok je známy aj u iných účinných látok s kationovými amfifilickými vlastnosťami. Je možný vzťah medzi touto akumuláciou a vakuolizáciou pozorovanou v pľúcach. Tento účinok bol pozorovaný u hlodavcov len pri vysokých dávkach. Klinický význam týchto zistení je nejasný.
Pri štandardných vyšetreniach sa po testovaní memantínu nezistila žiadna genotoxicita. V celoživotných štúdiách na myšiach a potkanoch sa nedokázala žiadna karcinogenita. Memantín nebol u potkanov a králikov teratogénny, dokonca ani pri dávkach toxických pre matku a nezaznamenali sa žiadne nežiaduce účinky memantínu na fertilitu. U potkanov sa zistilo zníženie rastu plodu pri expozičných hladinách, ktoré boli identické alebo mierne vyššie ako expozičné hladiny u ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety
- Monohydrát laktózy
- Mikrokryštalická celulóza
- Mastenec
- Koloidný oxid kremičitý bezvodý
- Stearát horečnatý
Obal tablety
Zlúčenina Opadry II White 33G28707 ktorá obsahuje:
- Hypromelóza (E 464)
- Oxid titaničitý (E 171)
- Monohydrát laktózy
- Makrogol 3000
- Triacetín
Karnaubský vosk
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
PVC/PVDC/Alu blistre obsahujú buď 7 alebo 10 tabliet v blistri.
Veľkosti balenia: 10, 14, 20, 28, 30, 40, 50, 56, 60, 90, 98, 100 alebo 112 tabliet sú balené do kartónovej škatule.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
AS Grindeks
Krustpils Iela 53
1057 Riga
Lotyšsko
8. REGISTRAČNÉ ČÍSLO
06/0088/21-S
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU
03/2021