
m sledovaní boli zaznamenané ojedinelé prípady zvýšenia hodnôt medzinárodného normalizovaného pomeru (INR) u pacientov užívajúcich súčasne warfarín. Aj keď priama súvislosť nebola potvrdená, u pacientov, ktorí sú súčasne liečení perorálnymi antikoagulanciami, sa doporučuje dôkladné sledovanie protrombínového času (INR).
Pri jednorázovej dávke vo farmakokinetíckých ( FK) štúdiách u mladých zdravých dobrovoľníkov nebola pozorovaná žiadna významná interakcia liečiv memantínu s glyburidom/metformínom alebo s donepezilom.
V klinickej štúdii u mladých zdravých jedincov nebol pozorovaný žiaden významný účinok memantínu na farmakokinetiku galantamínu.
Memantín in vitro neinhibuje CYP 1A2, 2A6, 2C9, 2D6, 2E1, 3A, flavín obsahujúcu monoxygenázu, epoxid hydrolázu alebo sulfatión.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne klinické údaje o gravidných ženách vystavených účinku memantínu. Štúdie na zvieratách naznačujú potenciál pre znížený vnútromaternicový rast pri expozičných hladinách
identických alebo mierne vyšších ako u ľudí (pozri časť 5.3). Nie je známe potenciálne riziko pre ľudí.
Memantín má byť užívaný počas gravidity iba v nevyhnutných prípadoch.
Laktácia
Nie je známe, či sa memantín u žien vylučuje do materského mlieka, ale ak vezmeme do úvahy lipofilitu tejto látky, je to pravdepodobné. Ženy, ktoré užívajú memantín, nemajú dojčiť.
Fertilita
V predklinických štúdiách samčej a samičej fertility neboli zaznamenané žiadne nežiaduce účinky memantínu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Alzheimerova choroba stredného až ťažkého stupňa samotná obvykle spôsobuje zhoršenie schopnosti
viesť vozidlá a obsluhovať stroje. Navyše memantín má menší až stredný vplyv na schopnosť viesť vozidlá a obsluhovať stroje, takže ambulantných pacientov je potrebné upozorniť, aby si dávali špeciálny pozor.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
V klinických štúdiách v miernej až ťažkej demencii, ktoré zahŕňali 1784 pacientov liečených memantínom a 1595 pacientov, ktorí užívali placebo, sa celkový výskyt nežiaducich účinkov pri liečbe
memantínom nelíšil od výskytu pri placebe a nežiaduce účinky boli obvykle miernej až strednej
závažnosti. Najčastejšie sa vyskytujúce nežiaduce účinky s vyšším výskytom v skupine s memantínom voči placebovej skupine boli závraty (6,3 % voči 5,6 %), bolesti hlavy (5,2 % voči 3,9 %), zápcha (4,6
% voči 2,6 %), ospalosť (3,4 % voči 2,2 %) a hypertenzia (4,1 % voči 2,8 %).
Tabuľkovýprehľadnežiaducichúčinkov
Nasledujúce nežiaduce účinky v doleuvedenej tabuľke boli zozbierané z klinických štúdií
s memantínom a z obdobia od jeho uvedenia na trh. V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Nežiaduce účinky sú zoradené podľa tried orgánových systémov pri použití nasledovnej konvencie:
veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1000 až < 1/100), zriedkavé (≥
1/10000 až < 1/1000), veľmi zriedkavé (< 1/10000), neznáme (nedajú sa určiť z dostupných údajov).
Trieda orgánových systémov Frekvencia Nežiaduci účinok Infekcie a nákazy Menej časté Plesňové infekcie Poruchy imunitného systému Časté Precitlivenosť na liek
Psychické poruchy Časté
Menej časté
Menej časté
Neznáme
Poruchy nervového systému Časté
Časté
Menej časté
Veľmi zriedkavé
Ospalosť Zmätenosť, Halucinácie 1
Psychotické reakcie2
Závraty
Porucha rovnováhy
Poruchy chôdze
Záchvaty
Poruchy srdca a srdcovej činnosti Menej časté Zlyhanie srdca
Poruchy ciev Časté

Menej časté
Hypertenzia Žilová trombóza/tromboembólia
Poruchy dýchacej sústavy, hrudníka a mediastína
Časté Dyspnoe
Poruchy gastrointestinálneho traktu Časté
Menej časté
Neznáme
Poruchy pečene a žlčových ciest Časté
Neznáme
Zápcha Vracanie Pankreatitída2
Zvýšené hodnoty testov pečeňových funkcií Hepatitída
Celkové poruchy a reakcie v mieste podania
Časté
Menej časté
Bolesti hlavy
Únava
1 Halucinácie boli pozorované hlavne u pacientov s ťažkým stupňom Alzheimerovej choroby.
2 Ojedinelé prípady zaznamenané z postmarketingového sledovania. Popisvybranýchnežiaducichreakcií
Alzheimerova choroba býva sprevádzaná depresiou, samovražednými predstavami a suicídiom. V postmarketingovom sledovaní boli tieto udalosti hlásené u pacientov liečených memantínom.
H
l
ásenie
podozrení
na
nežiaduce
r
eakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
Z klinických štúdií a post-marketingovej praxe sú dostupné len obmedzené skúsenosti s predávkovaním.
Symptómy: Pomerne široký interval predávkovania (od 200 mg do 105 mg/deň počas 3 dní, jednotlivo) je spojený buď s príznakmi ako sú únava, slabosť a/alebo hnačka, alebo so žiadnymi príznakmi. V prípadoch predávkovania nižšími dávkami ako 140 mg dávkou alebo neznámou dávkou sa u pacienta prejavili príznaky ovplyvnenia centrálneho nervového systému (zmätenosť, ospanlivosť, somnolencia, závraty, nepokoj, agresivita, halucinácie a poruchy chôdze) a/alebo ťažkosti gastrointestinálneho pôvodu (zvracanie a hnačka).
Vo veľmi extrémnom prípade predávkovania, pacient prežil perorálne užitú dávku v celkovom množstve 2000 mg memantínu s účinkami na centrálny nervový systém (kóma počas 10 dní, a neskôr diplopia a nepokoj). Pacientovi bola podaná symptomatická liečba a plazmaferéza. Pacient sa zotavil bez trvalých následkov na zdraví.
V inom prípade značného predávkovania pacient taktiež prežil a zotavil sa. Po užití 400 mg perorálnej dávky sa u pacienta prejavili príznaky ovplyvnenia centrálneho nervového systému (ako je nepokoj, psychóza, zrakové halucinácie, stav pred vznikom kŕčov, ospalosť, stupor a bezvedomie).
Liečba: V prípade predávkovania má byť liečba symptomatická. Nie je dostupné žiadne špecifické antidotum pri intoxikácii alebo pri predávkovaní. Štandardné klinické postupy na odstránenie liečiva z tela, napr. výplach žalúdka, čierne uhlie (prerušenie možného entero- hepatálneho obehu), acidifikácia moču; nútená diuréza má byť používaná primerane .
V prípade náznakov a symptómov nadmernej celkovej stimulácie centrálneho nervového systému
(CNS), sa má starostlivo zvážiť symptomatická klinická liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Iné lieky proti demencii, ATC kód: N06DX01.
Vzrastá množstvo dôkazov o tom, že porušená funkcia glutamátergickej neurotransmisie, najmä na NMDA-receptoroch, sa podieľa na vzniku príznakov aj na progresii ochorenia u neurodegeneratívnej demencie.
Memantín je na napätí závislý, nekompetitívny antagonista NMDA receptorov strednej afinity. Zmierňuje účinky patologicky zvýšených tonických hladín glutamátu, ktoré môžu viesť k neuronálnej dysfunkcii.
Klinické štúdie:
Pivotná monoterapeutická štúdia v populácii pacientov trpiacich Alzheimerovou chorobou stredného až ťažkého stupňa (celkové skóre MMSE na začiatku liečby 3 – 14) zahŕňala 252 ambulantne
liečených pacientov. Štúdia preukázala priaznivý účinok liečby memantínom v porovnaní s placebom
po 6-tich mesiacov (analýza pozorovaných prípadov - významnosť rozdielov pre CIBIC-plus:
p=0,025; pre ADCS-ADLsev: p=0,003; pre SIB: p=0,002).
Pivotná štúdia s memantínom v monoterapii v liečbe Alzheimerovej choroby mierneho až stredného stupňa (celkové skóre MMSE na začiatku liečby 10 – 22) zahŕňala 403 pacientov. U pacientov liečených memantínom bol pozorovaný štatisticky signifikantne lepší účinok v porovnaní s pacientmi, ktorým bolo podávané placebo, v primárnych ukazovateľoch v 24. týždni prevodom hodnôt
z posledného dokumentovaného vyšetrenia (analýza LOCF): ADAS-cog (p=0,003) a CIBIC-plus
(p=0,004). V ďalšej monoterapeutickej štúdii v liečbe Alzheimerovej choroby mierneho až stredného stupňa bolo randomizovaných celkovo 470 pacientov (celkové skóre MMSE na začiatku liečby
11-23). V prospektívne definovanej primárnej analýze nebola dosiahnutá štatistická významnosť
v primárnom ukazovateli účinnosti v 24. týždni.
Meta-analýza pacientov s Alzheimerovou chorobou stredného až ťažkého stupňa (celkové skóre MMSE < 20) zo šiestich, placebom kontrolovaných, 6-mesačných klinických štúdií vo fáze III. (vrátane monoterapeutických štúdií a štúdií s pacientmi na ustálenej dávke inihibítorov acetylcholínesterázy) preukázala štatisticky signifikantný účinok v prospech liečby memantínom
v kognitívnej, globálnej a funkčnej oblasti. Pri identifikovaní pacientov so súčasným zhoršením vo všetkých troch oblastiach výsledky ukázali štatisticky signifikantný účinok memantínu v prevencii
zhoršenia. Až u dvojnásobného počtu pacientov na placebe v porovnaní s pacientmi na memantíne sa
preukázalo zhoršenie vo všetkých troch oblastiach (21 % voči 11 %, p < 0,0001).
5.2 Farmakokinetické vlastnosti
Absorpcia:
Memantín má absolútnu biodostupnosť približne 100%. T max je medzi 3 a 8 hodín. Nie sú dôkazy o tom, že by potrava ovplyvňovala absorpciu memantínu.
Distribúcia:
Denné dávky 20 mg vedú k rovnovážnym plazmatickým koncentráciám memantínu v rozmedzí od 70
do 150 ng/ml (0,5-1 µmol) s veľkými interindividuálnymi variáciami. Keď sa podávali denné dávky 5 až 30 mg, priemerný pomer cerebrospinálny likvor (CSF)/sérum bol vypočítaný na 0,52. Objem distribúcie je okolo 10 l/kg. Približne 45% memantínu sa viaže na plazmatické proteíny.
Biotransformácia:
U ľudí je asi 80% cirkulujúceho memantínového materiálu prítomného v podobe materskej látky. Hlavnými metabolitmi u ľudí sú N-3,5-dimetyl-gludantán, izomerická zmes 4- a
6-hydroxy-memantínu a 1-nitrózo-3,5-dimetyl-adamantán. Žiaden z týchto metabolitov nevykazuje
NMDA-antagonistickú aktivitu. In vitro sa nezistil metabolizmus, katalyzovaný niektorým z cytochrómov P-450.
V štúdii s použitím perorálne podávaného 14C-memantínu vymizlo priemerne 84% dávky v priebehu
20 dní, pričom viac ako 99% sa vylúčilo obličkami.
Eliminácia:
Memantín sa vylučuje monoexponenciálnym spôsobom s konečným t1/2 od 60 do 100 hodín.
U dobrovoľníkov s normálnymi funkciami obličiek dosahuje celkový klírens (Cltot ) množstvo do
170 ml/min/1,73 m2 a časť celkového obličkového klírensu sa dosahuje tubulárnou sekréciou.
Obličkový transport zahŕňa tiež tubulárnu reabsorpciu, pravdepodobne sprostredkovanú katiónovými transportnými proteínmi. Rýchlosť obličkovej eliminácie memantínu môže byť za alkalických podmienok moču znížená, faktor zníženia sa pohybuje od 7 do 9 (pozri časť 4.4). Alkalizácia moču môže byť výsledkom drastických zmien diéty, napr. z mäsovej na vegetariánsku, alebo masívneho príjmu alkalizujúcich žalúdočných pufrov.
Linearita:
Štúdie na dobrovoľníkoch demonštrovali lineárnu farmakokinetiku v dávkovom rozpätí 10 až 40 mg.
Farmakokinetický/farmakodynamický
vzťah: Pri dávke memantínu 20 mg denne hladiny memantínu v CSF zodpovedajú hodnote ki (ki =inhibičná konštanta) memantínu, ktorá je 0,5 µmol v ľudskom frontálnom kortexe.
5.3 Predklinické údaje o bezpečnosti
V krátkodobých štúdiách u potkanov indukoval memantín, podobne ako iní NMDA-antagonisti, neuronálnu vakuolizáciu a nekrózu (Olneyho lézie) len po dávkach, vedúcich k veľmi vysokým sérovým koncentráciám. Ataxia a iné predklinické príznaky predchádzali vakuolizácii a nekróze. Keďže takéto účinky neboli pozorované v dlhodobých štúdiách u hlodavcov ani u nehlodavcov, klinický význam týchto zistení zostáva nejasný.
V štúdiách toxicity po opakovanej dávke u hlodavcov a psov, ale nie u opíc, sa premenlivo pozorovali očné zmeny. Špecifické oftalmoskopické vyšetrenia v klinických štúdiách s memantínom však žiadne takéto zmeny neodhalili.
U hlodavcov sa pozorovala fosfolipidóza v pľúcnych makrofágoch v dôsledku nahromadenia memantínu v lyzozómoch. Tento účinok je známy aj u iných účinných látok s kationovými amfifilickými vlastnosťami. Je možný vzťah medzi touto akumuláciou a vakuolizáciou pozorovanou v pľúcach. Tento účinok bol pozorovaný u hlodavcov len pri vysokých dávkach. Klinický význam týchto zistení je nejasný.
Pri štandardných vyšetreniach sa po testovaní memantínu nezistila žiadna genotoxicita.
V celoživotných štúdiách na myšiach a potkanoch sa nedokázala žiadna karcinogenita. Memantín nebol u potkanov a králikov teratogénny, dokonca ani pri dávkach toxických pre matku,
a nezaznamenali sa žiadne nežiaduce účinky memantínu na fertilitu. U potkanov sa zistilo zníženie rastu plodu pri expozičných hladinách, ktoré boli identické alebo mierne vyššie ako expozičné hladiny u ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadrotablety monohydrát laktόzy mikrokryštalická celulóza
oxid kremičitý, koloidný bezvodý krospovidon
magnéziumstearát
Obaltablety hypromelóza polysorbát 80 makrogol 400
oxid titaničitý (E171)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaBlistrové balenia obsahujúce 7, 10, 14 alebo 20 tabliet v jednom blistrovém stripe
(PVC/PE/PVDC/hliníkový blister). Veľkosti balenia: 14, 28, 30, 42, 50, 56, 98, 100 a 112 tabliet. Memantine Accord 10 mg tablety sú dostupné aj v dierkovanom blistri s jednotkovou dávkou
s kalendárnym označením vo veľkostiach balenia 14x1, 28x1, 56x1 alebo 98x1 tabliet.
Na trh ne nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAccord Healthcare Limited
Sage house, 319 Pinner road
North Harrow, Middlesex, HA1 4HF Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/13/880/001
EU/1/13/880/002
EU/1/13/880/003
EU/1/13/880/004
EU/1/13/880/005
EU/1/13/880/006
EU/1/13/880/007
EU/1/13/880/008
EU/1/13/880/014
EU/1/13/880/016
EU/1/13/880/017
EU/1/13/880/018
EU/1/13/880/019
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 04-12-2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Memantine Accord 20 mg filmom obalené tablety.
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá filmom obalená tableta obsahuje 20 mg memantínchloridu, čo zodpovedá 16,62 mg memantínu. Pomocnálátkasoznámymúčinkom: každá filmom obalená tableta obsahuje 295,18 mg monohydrátu laktόzy.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Filmom obalené tablety.
Bledočervené až šedo-červené, podlhovasté filmom obalené tablety s deliacou ryhou a s vyrazeným označením „MT“ rozdeleným deliacou ryhou na jednej strane a vyrazeným označením „20“ rozdeleným
ryhou na druhej strane.
Tableta sa môže rozdeliť na rovnaké dávky.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba pacientov s Alzheimerovou chorobou stredného až ťažkého stupňa.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Liečbu má začať a sledovať lekár, skúsený v diagnostike a liečbe Alzheimerovej demencie. Terapia sa
má začať len vtedy, ak je opatrovník schopný pravidelne kontrolovať, ako pacient užíva lieky. Diagnóza má byť stanovená podľa súčasných diagnostických odporúčaní. Tolerancia a dávkovanie
memantínu majú byť pravidelne prehodnocované, pokiaľ možno do troch mesiacov po začatí liečby.
Ďalej má byť klinický prínos memantínu a tolerancia liečby vyhodnocovaná v pravidelných intervaloch podľa aktuálnych terapeutických postupov. V udržiavacej liečbe sa môže pokračovať, pokiaľ je pre pacienta prínosom a zároveň liečbu memantínom toleruje. Prerušenie liečby memantínom sa má zvážiť v prípade, keď nebude prítomný preukázateľný terapeutický prínos alebo pacient nebude tolerovať liečbu.
Dospelí
Titrácia dávky
Maximálna denná dávka je 20 mg denne. Aby sa znížilo riziko nežiaducich účinkov, udržiavacia dávka sa dosahuje vzostupnou titráciou o 5 mg týždenne počas prvých 3 týždňov liečby nasledovne.
Pre vzostupnú titráciu sú dostupné iné sily tabliet.
Týždeň č. 1 (deň 1-7):
Pacient má užívať jednu 5 mg filmom obalenú tabletu denne počas 7 dní.
Týždeň č. 2 (deň 8-14):
Pacient má užívať jednu 10 mg filmom obalenú tabletu denne počas 7 dní. Týždeň č. 3 (deň 15-21):
Pacient má užívať jednu 15 mg filmom obalenú tabletu denne počas 7 dní.
Od týždňa č. 4 ďalej:
Pacient má užívať jednu 20 mg filmom obalenú tabletu denne.
Udržiavacia dávka
Odporúčaná udržiavacia dávka je 20 mg denne.
Starší pacienti
a základe klinických štúdií je dávka odporúčaná pre pacientov nad 65 rokov 20 mg denne, ako bolo popísané vyššie.
Poškodenie obličiek
U pacientov s mierne poškodenou funkciou obličiek (klírens kreatinínu 50-80 ml/min) sa nevyžaduje úprava dávky. U pacientov so stredne ťažkým obličkovým poškodením (klírens kreatinínu
30-49 ml/min) má byť denná dávka 10 mg denne. Ak dávka je dobre tolerovaná minimálne 7 dní liečby, môže byť zvýšená až do 20 mg/deň podľa štandardnej titračnej schémy. U pacientov s ťažko poškodenou funkciou obličiek (klírens kreatinínu 5-29 ml/min) má byť denná dávka 10 mg denne.
Poškodenie pečene
U pacientov s mierne až stredne ťažkou poškodenou funkciou pečene (Child-Pugh A a Child-Pugh B) nie je potrebná úprava dávky. U pacientov s vážne poškodenou funkciou pečene nie sú dostupné údaje o užívaní memantínu. Podanie lieku Memantine Accord sa neodporúča pacientom s ťažko poškodenou funkciou pečene.
Pediatrická populácia
Memantine Accord sa neodporúča používať u detí mladších ako18 rokov kvôli nedostatočným údajom o bezpečnosti a účinnosti.
Spôsob podávania
Liek Memantine Accord sa má podávať jedenkrát denne a má sa užívať vždy v rovnakú dennú dobu.
Filmom obalené tablety sa môžu užívať s jedlom alebo bez jedla.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
U pacientov s epilepsiou, so záchvatmi kŕčov v minulosti alebo s predispozičnými faktormi na epilepsiu sa odporúča opatrnosť.
Súčasnému užívaniu N-metyl-D-aspartát (NMDA)-antagonistov ako je amantadín, ketamín alebo dextrometorfán s memantínom sa má vyhýbať. Tieto látky účinkujú na ten istý receptorový systém ako memantín, preto pri ich súčasnom užívaní by mohli byť častejšie alebo výraznejšie nežiaduce reakcie (najmä týkajúce sa centrálneho nervového systému /CNS/) (pozri tiež časť 4.5).
Niektoré faktory, ktoré môžu zvýšiť pH moču (pozri časť 5.2 „Eliminácia“), vyžadujú starostlivé sledovanie pacienta. Tieto faktory zahŕňajú drastické zmeny diéty, napr. z mäsovej na vegetariánsku, alebo masívny príjem alkalizujúcich žalúdočných pufrov. Močové pH sa môže zvýšiť tiež pri stavoch renálnej tubulárnej acidózy (RTA) alebo pri ťažkých infekciách močového traktu bakteriálnymi kmeňmi Proteus.
Vo väčšine klinických štúdií boli vylúčení pacienti s nedávnym infarktom myokardu, dekompenzovaným kongestívnym srdcovým zlyhaním (NYHA III-IV) alebo nekontrolovanou hypertenziou. Dôsledkom toho je fakt, že k dispozícii je len obmedzené množstvo údajov a pacienti
s týmito ochoreniami majú byť starostlivo sledovaní.
Pomocnélátky
Memantine Accord obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, Lappovej deficiencie laktázy alebo malabsorpcie glukózo-galaktózy nemajú užívať tento liek.
4.5 Liekové a iné interakcie
V dôsledku farmakologických efektov a mechanizmu účinku memantínu sa môžu objaviť nasledovné interakcie:
• Mechanizmus účinku naznačuje, že účinky L-dopy, dopamínergických agonistov
a anticholínergík môžu byť pri súčasnom užívaní NMDA-antagonistov, ako je memantín, zosilnené. Účinky barbiturátov alebo neuroleptík môžu byť naopak znížené. Súčasné podávanie memantínu a myorelaxancií, dantrolénu alebo baklofénu, môže modifikovať ich účinky
a vyžadovať úpravu dávok.
• Musí sa vyhnúť súčasnému užitiu memantínu a amantadínu, a to pre riziko farmakotoxickej psychózy. Obe látky sú chemicky príbuzné NMDA-antagonistom. To isté môže platiť pre ketamín a dextrometorfán (pozri tiež časť 4.4). Existuje len jedna publikovaná kazuistika
o možnom riziku kombinácie memantínu a fenytoínu.
• Iné liečivá, ako sú cimetidín, ranitidín, prokaínamid, chinidín, chinín a nikotín, ktoré používajú ten istý obličkový katiónový transportný systém ako amantadín, môžu tiež interagovať
s memantínom a viesť tak k potenciálnemu riziku zvýšených plazmatických hladín.
• Ak sa memantín používa súčasne s hydrochlórotiazidom (HCT) alebo akoukoľvek kombináciou
HCT, je tu možnosť zníženia sérovej hladiny HCT.
• Pri postmarketingovom sledovaní boli zaznamenané ojedinelé prípady zvýšenia hodnôt medzinárodného normalizovaného pomeru (INR) u pacientov užívajúcich súčasne warfarín. Aj keď priama súvislosť nebola potvrdená, u pacientov, ktorí sú súčasne liečení perorálnymi antikoagulanciami, sa doporučuje dôkladné sledovanie protrombínového času (INR).
Pri jednorazovej dávke vo farmakokinetíckych ( FK) štúdiách u mladých zdravých dobrovoľníkov nebola pozorovaná žiadna významná interakcia účinných látok memantínu s glyburidom/metformínom alebo s donepezilom.
V klinickej štúdii u mladých zdravých jedincov nebol pozorovaný žiaden významný účinok memantínu na farmakokinetiku galantamínu.
Memantín in vitro neinhibuje CYP 1A2, 2A6, 2C9, 2D6, 2E1, 3A, flavín obsahujúcu monoxygenázu, epoxid hydrolázu alebo sulfatión.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne klinické údaje o gravidných ženách vystavených účinku memantínu. Štúdie na zvieratách naznačujú potenciál pre znížený vnútromaternicový rast pri expozičných hladinách
identických alebo mierne vyšších ako u ľudí (pozri časť 5.3). Nie je známe potenciálne riziko pre ľudí.
Memantín má byť užívaný počas gravidity iba v nevyhnutných prípadoch.
Laktácia
Nie je známe, či sa memantín u žien vylučuje do materského mlieka, ale ak vezmeme do úvahy lipofilitu tejto látky, je to pravdepodobné. Ženy, ktoré užívajú memantín, nemajú dojčiť.
Fertilita
V predklinických štúdiách samčej a samičej fertility neboli zaznamenané žiadne nežiaduce účinky memantínu..
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Alzheimerova choroba stredného až ťažkého stupňa samotná obvykle spôsobuje zhoršenie schopnosti viesť vozidlá a obsluhovať stroje. Navyše memantín má menší až stredný vplyv na schopnosť viesť vozidlá a obsluhovať stroje, takže ambulantných pacientov je potrebné upozorniť, aby si dávali špeciálny pozor.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
V klinických štúdiách v miernej až ťažkej demencii, ktoré zahŕňali 1784 pacientov liečených memantínom a 1595 pacientov, ktorí užívali placebo, sa celkový výskyt nežiaducich účinkov pri liečbe
memantínom nelíšil od výskytu pri placebe a nežiaduce účinky boli obvykle miernej až strednej závažnosti. Najčastejšie sa vyskytujúce nežiaduce účinky s vyšším výskytom v skupine s memantínom
voči placebovej skupine boli závraty (6,3 % voči 5,6 %), bolesti hlavy (5,2 % voči 3,9 %), zápcha (4,6
% voči 2,6 %), ospalosť (3,4 % voči 2,2 %) a hypertenzia (4,1 % voči 2,8 %).
Tabuľkovýprehľadnežiaducichúčinkov
Nasledujúce nežiaduce účinky v doleuvedenej tabuľke boli zozbierané z klinických štúdií
s memantínom a z obdobia od jeho uvedenia na trh. V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Nežiaduce účinky sú zoradené podľa tried orgánových systémov pri použití nasledovnej konvencie:
veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1000 až < 1/100), zriedkavé (≥
1/10000 až < 1/1000), veľmi zriedkavé (< 1/10000), neznáme (nedajú sa určiť z dostupných údajov).
Trieda orgánových systémov Frekvencia Nežiaduci účinok Infekcie a nákazy Menej časté Plesňové infekcie Poruchy imunitného systému Časté Precitlivenosť na liek
Psychické poruchy Časté
Menej časté Menej časté Neznáme
Poruchy nervového systému Časté
Časté
Menej časté
Veľmi zriedkavé
Ospalosť Zmätenosť, Halucinácie 1
Psychotické reakcie2
Závraty
Porucha rovnováhy
Poruchy chôdze
Záchvaty
Poruchy srdca a srdcovej činnosti Menej časté Zlyhanie srdca
Poruchy ciev Časté

Menej časté
Hypertenzia Žilová trombóza/tromboembólia
Poruchy dýchacej sústavy, hrudníka a mediastína
Časté Dyspnoe
Poruchy gastrointestinálneho traktu Časté
Menej časté
Neznáme
Poruchy pečene a žlčových ciest Časté
Neznáme
Zápcha Vracanie Pankreatitída2
Zvýšené hodnoty testov pečeňových funkcií Hepatitída
Celkové poruchy a reakcie v mieste podania
Časté
Menej časté
Bolesti hlavy
Únava
1 Halucinácie boli pozorované hlavne u pacientov s ťažkým stupňom Alzheimerovej choroby.
2 Ojedinelé prípady zaznamenané z postmarketingového sledovania.
Popis
vy
braných
nežiaducich
reakcií
Alzheimerova choroba býva sprevádzaná depresiou, samovražednými predstavami a suicídiom. V postmarketingovom sledovaní boli tieto udalosti hlásené u pacientov liečených memantínom.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
Z klinických štúdií a post-marketingovej praxe sú dostupné len obmedzené skúsenosti s predávkovaním.
Symptómy: Pomerne široký interval predávkovania (od 200 mg do 105 mg/deň počas 3 dní, jednotlivo) je spojený buď s príznakmi ako sú únava, slabosť a/alebo hnačka, alebo so žiadnymi príznakmi. V prípadoch predávkovania nižšími dávkami ako 140 mg dávkou alebo neznámou dávkou sa u pacienta prejavili príznaky ovplyvnenia centrálneho nervového systému (zmätenosť, ospanlivosť, somnolencia, závraty, nepokoj, agresivita, halucinácie a poruchy chôdze) a/alebo ťažkosti gastrointestinálneho pôvodu (zvracanie a hnačka).
Vo veľmi extrémnom prípade predávkovania, pacient prežil perorálne užitú dávku v celkovom množstve 2000 mg memantínu s účinkami na centrálny nervový systém (kóma počas 10 dní, a neskôr diplopia a nepokoj). Pacientovi bola podaná symptomatická liečba a plazmaferéza. Pacient sa zotavil bez trvalých následkov na zdraví.
V inom prípade značného predávkovania pacient taktiež prežil a zotavil sa. Po užití 400 mg perorálnej dávky sa u pacienta prejavili príznaky ovplyvnenia centrálneho nervového systému (ako je nepokoj, psychóza, zrakové halucinácie, stav pred vznikom kŕčov, ospalosť, stupor a bezvedomie).
Liečba: V prípade predávkovania má byť liečba symptomatická. Nie je dostupné žiadne špecifické antidotum pri intoxikácii alebo pri predávkovaní. Štandardné klinické postupy na odstránenie účinnej látky z tela, napr. výplach žalúdka, čierne uhlie (prerušenie možného entero- hepatálneho obehu), acidifikácia moču; nútená diuréza má byť používaná primerane .
V prípade náznakov a symptómov nadmernej celkovej stimulácie centrálneho nervového systému
(CNS), sa má starostlivo zvážiť symptomatická klinická liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Iné lieky proti demencii, ATC kód: N06DX01.
Vzrastá množstvo dôkazov o tom, že porušená funkcia glutamátergickej neurotransmisie, najmä na NMDA-receptoroch, sa podieľa na vzniku príznakov aj na progresii ochorenia u neurodegeneratívnej demencie.
Memantín je na napätí závislý, nekompetitívny antagonista NMDA receptorov strednej afinity. Zmierňuje účinky patologicky zvýšených tonických hladín glutamátu, ktoré môžu viesť k neuronálnej dysfunkcii.
Klinické štúdie:
Pivotná monoterapeutická štúdia v populácii pacientov trpiacich Alzheimerovou chorobou stredného až ťažkého stupňa (celkové skóre MMSE na začiatku liečby 3 – 14) zahŕňala 252 ambulantne liečených pacientov. Štúdia preukázala priaznivý účinok liečby memantínom v porovnaní s placebom
po 6-tich mesiacov (analýza pozorovaných prípadov - významnosť rozdielov pre CIBIC-plus:
p=0,025; pre ADCS-ADLsev: p=0,003; pre SIB: p=0,002).
Pivotná štúdia s memantínom v monoterapii v liečbe Alzheimerovej choroby mierneho až stredného stupňa (celkové skóre MMSE na začiatku liečby 10 – 22) zahŕňala 403 pacientov. U pacientov liečených memantínom bol pozorovaný štatisticky signifikantne lepší účinok v porovnaní s pacientmi, ktorým bolo podávané placebo, v primárnych ukazovateľoch v 24. týždni prevodom hodnôt
z posledného dokumentovaného vyšetrenia(analýza LOCF): Alzheimer´s disease assessment scale
(ADAS-cog) (p=0,003) a CIBIC-plus (p=0,004). V ďalšej monoterapeutickej štúdii v liečbe Alzheimerovej choroby mierneho až stredného stupňa bolo randomizovaných celkovo 470 pacientov (celkové skóre MMSE na začiatku liečby 11-23). V prospektívne definovanej primárnej analýze nebola dosiahnutá štatistická významnosť v primárnom ukazovateli účinnosti v 24. týždni.
Meta-analýza pacientov s Alzheimerovou chorobou stredného až ťažkého stupňa (celkové skóre MMSE < 20) zo šiestich, placebom kontrolovaných, 6-mesačných klinických štúdií vo fáze III. (vrátane monoterapeutických štúdií a štúdií s pacientmi na ustálenej dávke inihibítorov acetylcholínesterázy) preukázala štatisticky signifikantný účinok v prospech liečby memantínom
v kognitívnej, globálnej a funkčnej oblasti. Pri identifikovaní pacientov so súčasným zhoršením vo všetkých troch oblastiach výsledky ukázali štatisticky signifikantný účinok memantínu v prevencii
zhoršenia. Až u dvojnásobného počtu pacientov na placebe v porovnaní s pacientmi na memantíne sa
preukázalo zhoršenie vo všetkých troch oblastiach (21 % voči 11 %, p < 0,0001).
5.2 Farmakokinetické vlastnosti
Absorpcia: Memantín má absolútnu biodostupnosť približne 100%. T max je medzi 3 a 8 hodín. Nie sú dôkazy o tom, že by potrava ovplyvňovala absorpciu memantínu.
Distribúcia: Denné dávky 20 mg vedú k rovnovážnym plazmatickým koncentráciám memantínu v rozmedzí od 70 do 150 ng/ml (0,5-1 µmol) s veľkými interindividuálnymi variáciami. Keď sa podávali denné dávky 5 až 30 mg, priemerný pomer cerebrospinálny likvor (CSF)/sérum bol vypočítaný na 0,52. Objem distribúcie je okolo 10 l/kg. Približne 45% memantínu sa viaže na plazmatické proteíny.
Biotransformácia: U ľudí je asi 80% cirkulujúceho memantínového materiálu prítomného v podobe materskej látky. Hlavnými metabolitmi u ľudí sú N-3,5-dimetyl-gludantán, izomerická zmes 4- a
6-hydroxy-memantínu a 1-nitrózo-3,5-dimetyl-adamantán. Žiaden z týchto metabolitov nevykazuje
NMDA-antagonistickú aktivitu. In vitro sa nezistil metabolizmus, katalyzovaný niektorým z cytochrómov P-450.
V štúdii s použitím perorálne podávaného 14C-memantínu vymizlo priemerne 84% dávky v priebehu
20 dní, pričom viac ako 99% sa vylúčilo obličkami.
Eliminácia: Memantín sa vylučuje monoexponenciálnym spôsobom s konečným t1/2 od 60 do 100 hodín. U dobrovoľníkov s normálnymi funkciami obličiek dosahuje celkový klírens (Cltot ) množstvo do 170 ml/min/1,73 m2 a časť celkového obličkového klírensu sa dosahuje tubulárnou sekréciou.
Obličkový transport zahŕňa tiež tubulárnu reabsorpciu, pravdepodobne sprostredkovanú katiónovými transportnými proteínmi. Rýchlosť obličkovej eliminácie memantínu môže byť za alkalických podmienok moču znížená, faktor zníženia sa pohybuje od 7 do 9 (pozri časť 4.4). Alkalizácia moču môže byť výsledkom drastických zmien diéty, napr. z mäsovej na vegetariánsku, alebo masívneho príjmu alkalizujúcich žalúdočných pufrov.
Linearita:
Štúdie na dobrovoľníkoch demonštrovali lineárnu farmakokinetiku v dávkovom rozpätí 10 až 40 mg.
Farmakokinetický/farmakodynamickývzťah:
Pri dávke memantínu 20 mg denne hladiny memantínu v CSF zodpovedajú hodnote ki (ki =inhibičná
konštanta) memantínu, ktorá je 0,5 µmol v ľudskom frontálnom kortexe.
5.3 Predklinické údaje o bezpečnosti
V krátkodobých štúdiách u potkanov indukoval memantín, podobne ako iní NMDA-antagonisti, neuronálnu vakuolizáciu a nekrózu (Olneyho lézie) len po dávkach, vedúcich k veľmi vysokým sérovým koncentráciám. Ataxia a iné predklinické príznaky predchádzali vakuolizácii a nekróze. Keďže takéto účinky neboli pozorované v dlhodobých štúdiách u hlodavcov ani u nehlodavcov, klinický význam týchto zistení zostáva nejasný.
V štúdiách toxicity po opakovanej dávke u hlodavcov a psov, ale nie u opíc, sa premenlivo pozorovali očné zmeny. Špecifické oftalmoskopické vyšetrenia v klinických štúdiách s memantínom však žiadne takéto zmeny neodhalili.
U hlodavcov sa pozorovala fosfolipidóza v pľúcnych makrofágoch v dôsledku nahromadenia memantínu v lyzozómoch. Tento účinok je známy aj u iných účinných látok s kationovými amfifilickými vlastnosťami. Je možný vzťah medzi touto akumuláciou a vakuolizáciou pozorovanou v pľúcach. Tento účinok bol pozorovaný u hlodavcov len pri vysokých dávkach. Klinický význam týchto zistení je nejasný.
Pri štandardných vyšetreniach sa po testovaní memantínu nezistila žiadna genotoxicita.
V celoživotných štúdiách na myšiach a potkanoch sa nedokázala žiadna karcinogenita. Memantín nebol u potkanov a králikov teratogénny, dokonca ani pri dávkach toxických pre matku,
a nezaznamenali sa žiadne nežiaduce účinky memantínu na fertilitu. U potkanov sa zistilo zníženie rastu plodu pri expozičných hladinách, ktoré boli identické alebo mierne vyššie ako expozičné hladiny
u ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety monohydrát laktόzy mikrokryštalická celulóza
oxid kremičitý, koloidný bezvodý krospovidon
magnéziumstearát
Obal tablety hypromelóza polysorbát 80 makrogol 400
oxid titaničitý (E 171)
žltý a červený oxid železitý (E 172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaBlistrové balenia obsahujúce 7, 10,14 nebo 20 tabliet v jednom blistrovém stripe
(PVC/PE/PVDC/hliníkový blister). Veľkosti balenia: 14, 28, 42, 56 a 98 tabliet.
Memantine Accord 20 mg tablety sú dostupné aj v dierkovanom blistri s jednotkovou dávkou s kalendárnym označením vo veľkostiach balenia 14x1, 28x1, 56x1 alebo 98x1 tabliet.
Na trh ne nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAccord Healthcare Limited
Sage house, 319 Pinner road
North Harrow, Middlesex, HA1 4HF Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/13/880/009
EU/1/13/880/010
EU/1/13/880/011
EU/1/13/880/012
EU/1/13/880/015
EU/1/13/880/020
EU/1/13/880/021
EU/1/13/880/022
EU/1/13/880/023
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie 04-12-2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Memantine Accord 5 mg filmom obalené tablety. Memantine Accord 10 mg filmom obalené tablety. Memantine Accord 15 mg filmom obalené tablety. Memantine Accord 20 mg filmom obalené tablety.
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá filmom obalená tableta obsahuje 5 mg memantínchloridu, čo zodpovedá 4,15 mg memantínu. Pomocnálátkasoznámymúčinkom: každá filmom obalená tableta obsahuje 73,80 mg monohydrátu laktόzy.
Každá filmom obalená tableta obsahuje 10 mg memantínchloridu, čo zodpovedá 8,31 mg memantínu. Pomocnálátkasoznámymúčinkom: každá filmom obalená tableta obsahuje 183,13 mg monohydrátu laktόzy.
Každá filmom obalená tableta obsahuje 15 mg memantínchloridu, čo zodpovedá 12,46 mg memantínu. Pomocnálátkasoznámymúčinkom: každá filmom obalená tableta obsahuje 221,39 mg monohydrátu laktόzy.
Každá filmom obalená tableta obsahuje 20 mg memantínchloridu, čo zodpovedá 16,62 mg memantínu. Pomocnálátkasoznámymúčinkom: každá filmom obalená tableta obsahuje 295,18 mg monohydrátu laktόzy.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Filmom obalené tablety.
5 mg filmom obalené tablety sú biele, podlhovasté filmom obalené tablety s vyrazeným označením
„MT“ na jednej strane a vyrazeným označením „5“ na druhej strane.
10 mg filmom obalené tablety sú biele, podlhovasté filmom obalené tablety s deliacou ryhou a s vyrazeným označením „MT“ rozdeleným deliacou ryhou na jednej strane a vyrazeným označením
„10“ rozdeleným deliacou ryhou na druhej strane. Tableta sa môže rozdeliť na rovnaké dávky.
15 mg filmom obalené tablety sú oranžové až šedo-oranžové, podlhovasté filmom obalené tablety s vyrazeným „MT“ na jednej strane a s vyrazeným označením „15“ na druhej strane.
20 mg filmom obalené tablety sú bledočervené až šedo-červené, podlhovasté filmom obalené tablety s deliacou ryhou a s vyrazeným označením „MT“ rozdeleným deliacou ryhou na jednej strane a s vyrazeným označením „20“ rozdeleným deliacou ryhou na druhej strane.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba pacientov s Alzheimerovou chorobou stredného až ťažkého stupňa.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Liečbu má začať a sledovať lekár, skúsený v diagnostike a liečbe Alzheimerovej demencie. Terapia sa má začať len vtedy, ak je opatrovník schopný pravidelne kontrolovať, ako pacient užíva lieky. Diagnóza má byť stanovená podľa súčasných diagnostických odporúčaní. Tolerancia a dávkovanie memantínu majú byť pravidelne prehodnocované, pokiaľ možno do troch mesiacov po začatí liečby. Ďalej má byť klinický prínos memantínu a tolerancia liečby vyhodnocovaná v pravidelných intervaloch podľa aktuálnych terapeutických postupov. V udržiavacej liečbe sa môže pokračovať, pokiaľ je pre pacienta prínosom a zároveň liečbu memantínom toleruje. Prerušenie liečby'
memantínom sa má zvážiť v prípade, keď nebude prítomný preukázateľný terapeutický prínos alebo pacient nebude tolerovať liečbu.
Dospelí
Titrácia dávky
Odporúčaná počiatočná dávka je 5 mg denne, ktorá sa postupne počas prvých 4 týždňov liečby zvyšuje nasledovne tak, aby sa dosiahla udržiavacia dávka:
Týždeň 1 (deň 1-7):
Pacient má užívať jednu 5 mg filmom obalenú tabletu denne (bielu) po dobu 7 dní.
Týždeň 2 (deň 8-14):
Pacient má užívať jednu 10 mg filmom obalenú tabletu denne (bielu s deliacou ryhou) po dobu 7 dní.
Týždeň 3 (deň 15-21):
Pacient má užívať jednu 15 mg filmom obalenú tabletu denne (oranžovú až šedo-oranžovú s deliacou ryhou) po dobu 7 dní.
Týždeň 4 (deň 22-28):
Pacient má užívať jednu 20 mg filmom obalenú tabletu denne (bledočervenú až šedo-červenú s deliaciou ryhou) po dobu 7 dní.
Udržiavacia dávka
Odporúčaná udržiavacia dávka je 20 mg denne.
Starší pacienti Na základe klinických štúdií je dávka odporúčaná pre pacientov nad 65 rokov 20 mg denne (20 mg tablety jedenkrát denne), ako bolo popísané vyššie.
Poškodenie obličiek U pacientov s mierne poškodenou funkciou obličiek (klírens kreatinínu 50-
80 ml/min) sa nevyžaduje úprava dávky. U pacientov so stredne ťažkým obličkovým poškodením
(klírens kreatinínu 30-49 ml/min) má byť denná dávka 10 mg denne. Ak dávka je dobre tolerovaná minimálne 7 dní liečby, môže byť zvýšená až do 20 mg/deň podľa štandardnej titračnej schémy.
U pacientov s ťažko poškodenou funkciou obličiek (klírens kreatinínu 5-29 ml/min) má byť denná
dávka 10 mg denne.
Poškodenie pečene U pacientov s mierne až stredne ťažkou poškodenou funkciou pečene (Child-Pugh A a Child-Pugh B) nie je potrebná úprava dávky. U pacientov s ťažko poškodenou funkciou pečene nie sú dostupné údaje o užívaní memantínu. Podanie Memantine Accord sa neodporúča pacientom
s ťažko poškodenou funkciou pečene.
Pediatrická populácia
Memantine Accord sa neodporúča používať u detí mladších ako18 rokov kvôli nedostatočným údajom o bezpečnosti a účinnosti.
Spôsobpodávania
Liek Memantine Accord sa má podávať jedenkrát denne a má sa užívať vždy v rovnakú dennú dobu. Filmom obalené tablety sa môžu užívať s jedlom alebo bez jedla.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
U pacientov s epilepsiou, so záchvatmi kŕčov v minulosti alebo s predispozičnými faktormi na epilepsiu sa odporúča opatrnosť.
Súčasnému užívaniu N-metyl-D-aspartát (NMDA)-antagonistov ako je amantadín, ketamín alebo dextrometorfán s memantínom sa má vyhýbať. Tieto látky účinkujú na ten istý receptorový systém ako memantín, preto pri ich súčasnom užívaní by mohli byť častejšie alebo výraznejšie nežiaduce reakcie (najmä týkajúce sa oblasti centrálneho nervového systému /CNS/) (pozri tiež časť 4.5).
Niektoré faktory, ktoré môžu zvýšiť pH moču (pozri časť 5.2 „Eliminácia“), vyžadujú starostlivé sledovanie pacienta. Tieto faktory zahŕňajú drastické zmeny diéty, napr. z mäsovej na vegetariánsku, alebo masívny príjem alkalizujúcich žalúdočných pufrov. Močové pH sa môže zvýšiť tiež pri stavoch renálnej tubulárnej acidózy (RTA) alebo pri ťažkých infekciách močového traktu bakteriálnymi kmeňmi Proteus.
Vo väčšine klinických štúdií boli vylúčení pacienti s nedávnym infarktom myokardu, dekompenzovaným kongestívnym srdcovým zlyhaním (NYHA III-IV) alebo nekontrolovanou hypertenziou. Dôsledkom toho je fakt, že k dispozícii je len obmedzené množstvo údajov a pacienti s týmito ochoreniami majú byť starostlivo sledovaní.
Pomocnélátky Memantine Accord obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, Lappovej deficiencie laktázy alebo malabsorpcie glukózo-galaktózy nemajú užívať tento liek.
4.5 Liekové a iné interakcie
V dôsledku farmakologických efektov a mechanizmu účinku memantínu sa môžu objaviť nasledovné interakcie:
• Mechanizmus účinku naznačuje, že účinky L-dopy, dopamínergických agonistov
a anticholínergík môžu byť pri súčasnom užívaní NMDA-antagonistov, ako je memantín, zosilnené. Účinky barbiturátov alebo neuroleptík môžu byť naopak znížené. Súčasné podávanie memantínu a myorelaxancií, dantrolénu alebo baklofénu, môže modifikovať ich účinky
a vyžadovať úpravu dávok.
• Musí sa vyhnúť súčasnému užitiu memantínu a amantadínu, a to pre riziko farmakotoxickej psychózy. Obe látky sú chemicky príbuzné NMDA-antagonistom. To isté môže platiť pre ketamín a dextrometorfán (pozri tiež časť 4.4). Existuje len jedna publikovaná kazuistika
o možnom riziku kombinácie memantínu a fenytoínu.
• Iné liečivá, ako sú cimetidín, ranitidín, prokaínamid, chinidín, chinín a nikotín, ktoré používajú ten istý obličkový katiónový transportný systém ako amantadín, môžu tiež interagovať
s memantínom a viesť tak k potenciálnemu riziku zvýšených plazmatických hladín.
• Ak sa memantín používa súčasne s hydrochlórotiazidom (HCT) alebo akoukoľvek kombináciou
HCT, je tu možnosť zníženia sérovej hladiny HCT.
• Pri postmarketingovom sledovaní boli zaznamenané ojedinelé prípady zvýšenia hodnôt medzinárodného normalizovaného pomeru (INR) u pacientov užívajúcich súčasne warfarín. Aj keď priama súvislosť nebola potvrdená, u pacientov, ktorí sú súčasne liečení perorálnymi antikoagulanciami, sa doporučuje dôkladné sledovanie protrombínového času (INR).
Pri jednorazovej dávke vo farmakokinetíckych ( FK) štúdiách u mladých zdravých dobrovoľníkov nebola pozorovaná žiadna významná interakcia liečiv memantínu s glyburidom/metformínom alebo s donepezilom.
V klinickej štúdii u mladých zdravých jedincov nebol pozorovaný žiaden významný účinok memantínu na farmakokinetiku galantamínu.
Memantín in vitro neinhibuje CYP 1A2, 2A6, 2C9, 2D6, 2E1, 3A, flavín obsahujúcu monoxygenázu,
epoxid hydrolázu alebo sulfatión.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne klinické údaje o gravidných ženách vystavených účinku memantínu. Štúdie na zvieratách naznačujú potenciál pre znížený vnútromaternicový rast pri expozičných hladinách identických alebo mierne vyšších ako u ľudí (pozri časť 5.3). Nie je známe potenciálne riziko pre ľudí. Memantín má byť užívaný počas gravidity iba v nevyhnutných prípadoch.
Laktácia
Nie je známe, či sa memantín u žien vylučuje do materského mlieka, ale ak vezmeme do úvahy lipofilitu tejto látky, je to pravdepodobné. Ženy, ktoré užívajú memantín, nemajú dojčiť.
Fertilita
V predklinických štúdiách samčej a samičej fertility neboli zaznamenané žiadne nežiaduce účinky memantínu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Alzheimerova choroba stredného až ťažkého stupňa samotná obvykle spôsobuje zhoršenie schopnosti viesť vozidlá a obsluhovať stroje. Navyše memantín má menší až stredný vplyv na schopnosť viesť vozidlá a obsluhovať stroje, takže ambulantných pacientov je potrebné upozorniť, aby si dávali špeciálny pozor.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
V klinických štúdiách v miernej až ťažkej demencii, ktoré zahŕňali 1784 pacientov liečených memantínom a 1595 pacientov, ktorí užívali placebo, sa celkový výskyt nežiaducich účinkov pri liečbe
memantínom nelíšil od výskytu pri placebe a nežiaduce účinky boli obvykle miernej až strednej
závažnosti. Najčastejšie sa vyskytujúce nežiaduce účinky s vyšším výskytom v skupine s memantínom voči placebovej skupine boli závraty (6,3 % voči 5,6 %), bolesti hlavy (5,2 % voči 3,9 %), zápcha (4,6
% voči 2,6 %), ospalosť (3,4 % voči 2,2 %) a hypertenzia (4,1 % voči 2,8 %).
Tabuľkovýprehľadnežiaducichúčinkov
Nasledujúce nežiaduce účinky v doleuvedenej tabuľke boli zozbierané z klinických štúdií
s memantínom a z obdobia od jeho uvedenia na trh. V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Nežiaduce účinky sú zoradené podľa orgánových systémov pri použití nasledovnej konvencie: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1000 až < 1/100), zriedkavé (≥ 1/10000 až <
1/1000), veľmi zriedkavé (< 1/10000), neznáme (nedajú sa určiť z dostupných údajov).
Trieda orgánových systémov Frekvencia Nežiaduci účinok Infekcie a nákazy Menej časté Plesňové infekcie Poruchy imunitného systému Časté Precitlivenosť na liek
Psychické poruchy Časté
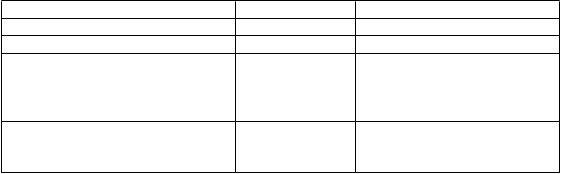
Menej časté Menej časté Neznáme
Poruchy nervového systému Časté
Časté
Menej časté
Ospalosť Zmätenosť, Halucinácie 1
Psychotické reakcie2
Závraty
Porucha rovnováhy
Poruchy chôdze
Veľmi zriedkavé Záchvaty
Poruchy srdca a srdcovej činnosti Menej časté Zlyhanie srdca
Poruchy ciev Časté
Menej časté
Hypertenzia Žilová trombóza/tromboembólia
Poruchy dýchacej sústavy, hrudníka a mediastína
Časté Dyspnoe
Poruchy gastrointestinálneho traktu Časté

Menej časté
Neznáme
Poruchy pečene a žlčových ciest Časté
Neznáme
Zápcha Vracanie Pankreatitída2
Zvýšené hodnoty testov pečeňových funkcií Hepatitída
Celkové poruchy a reakcie v mieste podania
Časté
Menej časté
Bolesti hlavy
Únava
1 Halucinácie boli pozorované hlavne u pacientov s ťažkým stupňom Alzheimerovej choroby.
2 Ojedinelé prípady zaznamenané z postmarketingového sledovania. Popisvybranýchnežiaducichreakcií
Alzheimerova choroba býva sprevádzaná depresiou, samovražednými predstavami a suicídiom. V postmarketingovom sledovaní boli tieto udalosti hlásené u pacientov liečených memantínom.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 Predávkovanie
Z klinických štúdií a post-marketingovej praxe sú dostupné len obmedzené skúsenosti s predávkovaním.
Symptómy: Pomerne široký interval predávkovania (od 200 mg do 105 mg/deň počas 3 dní, jednotlivo) je spojený buď s príznakmi ako sú únava, slabosť a/alebo hnačka, alebo so žiadnymi príznakmi. V prípadoch predávkovania nižšími dávkami ako 140 mg dávkou alebo neznámou dávkou sa u pacienta prejavili príznaky ovplyvnenia centrálneho nervového systému (zmätenosť, ospanlivosť, somnolencia, závraty, nepokoj, agresivita, halucinácie a poruchy chôdze) a/alebo ťažkosti gastrointestinálneho pôvodu (zvracanie a hnačka).
Vo veľmi extrémnom prípade predávkovania, pacient prežil perorálne užitú dávku v celkovom množstve 2000 mg memantínu s účinkami na centrálny nervový systém (kóma počas 10 dní, a neskôr diplopia a nepokoj). Pacientovi bola podaná symptomatická liečba a plazmaferéza. Pacient sa zotavil bez trvalých následkov na zdraví.
V inom prípade značného predávkovania pacient taktiež prežil a zotavil sa. Po užití 400 mg perorálnej dávky sa u pacienta prejavili príznaky ovplyvnenia centrálneho nervového systému (ako je nepokoj, psychóza, zrakové halucinácie, stav pred vznikom kŕčov, ospalosť, stupor a bezvedomie).
Liečba: V prípade predávkovania má byť liečba symptomatická. Nie je dostupné žiadne špecifické antidotum pri intoxikácii alebo pri predávkovaní. Štandardné klinické postupy na odstránenie liečiva z tela, napr. výplach žalúdka, čierne uhlie (prerušenie možného entero- hepatálneho obehu), acidifikácia moču; nútená diuréza má byť používaná primerane .
V prípade náznakov a symptómov nadmernej celkovej stimulácie centrálneho nervového systému
(CNS), sa má starostlivo zvážiť symptomatická klinická liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Iné lieky proti demencii, ATC kód: N06DX01.
Vzrastá množstvo dôkazov o tom, že porušená funkcia glutamátergickej neurotransmisie, najmä na NMDA-receptoroch, sa podieľa na vzniku príznakov aj na progresii ochorenia u neurodegeneratívnej demencie.
Memantín je na napätí závislý, nekompetitívny antagonista NMDA receptorov strednej afinity. Zmierňuje účinky patologicky zvýšených tonických hladín glutamátu, ktoré môžu viesť k neuronálnej dysfunkcii.
Klinické štúdie:
Pivotná monoterapeutická štúdia v populácii pacientov trpiacich Alzheimerovou chorobou stredného až ťažkého stupňa (celkové skóre MMSE na začiatku liečby 3 – 14) zahŕňala 252 ambulantne
liečených pacientov. Štúdia preukázala priaznivý účinok liečby memantínom v porovnaní s placebom
po 6-tich mesiacov (analýza pozorovaných prípadov - významnosť rozdielov pre CIBIC-plus:
p=0,025; pre ADCS-ADLsev: p=0,003; pre SIB: p=0,002).
Pivotná štúdia s memantínom v monoterapii v liečbe Alzheimerovej choroby mierneho až stredného stupňa (celkové skóre MMSE na začiatku liečby 10 – 22) zahŕňala 403 pacientov. U pacientov liečených memantínom bol pozorovaný štatisticky signifikantne lepší účinok v porovnaní s pacientmi, ktorým bolo podávané placebo, v primárnych ukazovateľoch v 24. týždni prevodom hodnôt
z posledného dokumentovaného vyšetrenia(analýza LOCF): Alzheimer´s disease assessment scale (ADAS-cog) (p=0,003) a CIBIC-plus (p=0,004). V ďalšej monoterapeutickej štúdii v liečbe Alzheimerovej choroby mierneho až stredného stupňa bolo randomizovaných celkovo 470 pacientov (celkové skóre MMSE na začiatku liečby 11-23). V prospektívne definovanej primárnej analýze nebola dosiahnutá štatistická významnosť primárnom ukazovateli účinnosti v 24. týždni.
Meta-analýza pacientov s Alzheimerovou chorobou stredného až ťažkého stupňa (celkové skóre MMSE < 20) zo šiestich, placebom kontrolovaných, 6-mesačných klinických štúdií vo fáze III. (vrátane monoterapeutických štúdií a štúdií s pacientmi na ustálenej dávke inihibítorov acetylcholínesterázy) preukázala štatisticky signifikantný účinok v prospech liečby memantínom
v kognitívnej, globálnej a funkčnej oblasti. Pri identifikovaní pacientov so súčasným zhoršením vo všetkých troch oblastiach výsledky ukázali štatisticky signifikantný účinok memantínu v prevencii zhoršenia. Až u dvojnásobného počtu pacientov na placebe v porovnaní s pacientmi na memantíne sa preukázalo zhoršenie vo všetkých troch oblastiach (21 % voči 11 %, p < 0,0001).
5.2 Farmakokinetické vlastnosti
Absorpcia: Memantín má absolútnu biodostupnosť približne 100%. T max je medzi 3 a 8 hodín. Nie sú dôkazy o tom, že by potrava ovplyvňovala absorpciu memantínu.
Distribúcia: Denné dávky 20 mg vedú k rovnovážnym plazmatickým koncentráciám memantínu v rozmedzí od 70 do 150 ng/ml (0,5-1 µmol) s veľkými interindividuálnymi variáciami. Keď sa podávali denné dávky 5 až 30 mg, priemerný pomer cerebrospinálny likvor (CSF)/sérum bol vypočítaný na 0,52. Objem distribúcie je okolo 10 l/kg. Približne 45% memantínu sa viaže na plazmatické proteíny.
Biotransformácia: U ľudí je asi 80% cirkulujúceho memantínového materiálu prítomného v podobe materskej látky. Hlavnými metabolitmi u ľudí sú N-3,5-dimetyl-gludantán, izomerická zmes 4- a
6-hydroxy-memantínu a 1-nitrózo-3,5-dimetyl-adamantán. Žiaden z týchto metabolitov nevykazuje
NMDA-antagonistickú aktivitu. In vitro sa nezistil metabolizmus, katalyzovaný niektorým z cytochrómov P-450.
V štúdii s použitím perorálne podávaného 14C-memantínu vymizlo priemerne 84% dávky v priebehu
20 dní, pričom viac ako 99% sa vylúčilo obličkami.
Eliminácia: Memantín sa vylučuje monoexponenciálnym spôsobom s konečným t1/2 od 60 do 100 hodín. U dobrovoľníkov s normálnymi funkciami obličiek dosahuje celkový klírens (Cltot ) množstvo do 170 ml/min/1,73 m2 a časť celkového obličkového klírensu sa dosahuje tubulárnou sekréciou.
Obličkový transport zahŕňa tiež tubulárnu reabsorpciu, pravdepodobne sprostredkovanú katiónovými transportnými proteínmi. Rýchlosť obličkovej eliminácie memantínu môže byť za alkalických podmienok moču znížená, faktor zníženia sa pohybuje od 7 do 9 (pozri časť 4.4). Alkalizácia moču môže byť výsledkom drastických zmien diéty, napr. z mäsovej na vegetariánsku, alebo masívneho príjmu alkalizujúcich žalúdočných pufrov.
Linearita:
Štúdie na dobrovoľníkoch demonštrovali lineárnu farmakokinetiku v dávkovom rozpätí 10 až 40 mg.
Farmakokinetický/farmakodynamickývzťah: Pri dávke memantínu 20 mg denne hladiny memantínu v CSF zodpovedajú hodnote ki (ki =inhibičná konštanta) memantínu, ktorá je 0,5 µmol v ľudskom frontálnom kortexe.
5.3 Predklinické údaje o bezpečnosti
V krátkodobých štúdiách u potkanov indukoval memantín, podobne ako iní NMDA-antagonisti, neuronálnu vakuolizáciu a nekrózu (Olneyho lézie) len po dávkach, vedúcich k veľmi vysokým sérovým koncentráciám. Ataxia a iné predklinické príznaky predchádzali vakuolizácii a nekróze. Keďže takéto účinky neboli pozorované v dlhodobých štúdiách u hlodavcov ani u nehlodavcov, klinický význam týchto zistení zostáva nejasný.
V štúdiách toxicity po opakovanej dávke u hlodavcov a psov, ale nie u opíc, sa premenlivo pozorovali očné zmeny. Špecifické oftalmoskopické vyšetrenia v klinických štúdiách s memantínom však žiadne takéto zmeny neodhalili.
U hlodavcov sa pozorovala fosfolipidóza v pľúcnych makrofágoch v dôsledku nahromadenia memantínu v lyzozómoch. Tento účinok je známy aj u iných účinných látok s kationovými amfifilickými vlastnosťami. Je možný vzťah medzi touto akumuláciou a vakuolizáciou pozorovanou v pľúcach. Tento účinok bol pozorovaný u hlodavcov len pri vysokých dávkach. Klinický význam týchto zistení je nejasný.
Pri štandardných vyšetreniach sa po testovaní memantínu nezistila žiadna genotoxicita.
V celoživotných štúdiách na myšiach a potkanoch sa nedokázala žiadna karcinogenita. Memantín nebol u potkanov a králikov teratogénny, dokonca ani pri dávkach toxických pre matku,
a nezaznamenali sa žiadne nežiaduce účinky memantínu na fertilitu. U potkanov sa zistilo zníženie
rastu plodu pri expozičných hladinách, ktoré boli identické alebo mierne vyššie ako expozičné hladiny u ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety pri 5/10/15/20 mg filmom obalených tabletách
monohydrát laktόzy mikrokryštalická celulóza
oxid kremičitý, koloidný bezvodý krospovidon
magnéziumstearát
Obal tablety pri 5/10/15/20 mg filmom obalených tabletáchhypromelóza polysorbát 80 makrogol 400
oxid titaničitý (E171)
Doplnkové pre 15 mg a 20 mg filmom obalené tabletyžtý a červený oxid železitý (E 172)
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti3 roky.
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaBlistrové balenia obsahujúce 28 tabliet so 7 tabletami s 5 mg, 7 tabletami s 10 mg, 7 tabletami s 15 mg a 7 tabletami s 20 mg (PVC/PE/PVDC/hliníkový blister).
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAccord Healthcare Limited
Sage house, 319 Pinner road
North Harrow, Middlesex, HA1 4HF, Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/13/880/13
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie 04-12-2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry
http://www.ema.europa.eu.