podľa nasledovných dvoch základných pravidiel:
1. užívanie tabliet sa nemá nikdy prerušiť na dlhšie ako 7 dní
2. na dosiahnutie zodpovedajúcej supresie osi hypotalamus-hypofýza-ováriá sa vyžaduje nepretržité sedemdňové užívanie tabliet.
V súlade s tým sa v bežnej praxi môžu poskytnúť nasledovné odporúčania:
·
1. týždeňUžívateľka musí užiť poslednú vynechanú tabletu hneď ako si spomenie, aj keby to znamenalo užitie dvoch tabliet súčasne. Potom pokračuje v užívaní tabliet vo zvyčajnom čase. Navyše je potrebné používať v nasledujúcich siedmich dňoch bariérovú metódu, napr. prezervatív. Ak došlo v predchádzajúcich siedmich dňoch k pohlavnému styku, musí sa zvážiť možnosť gravidity. Čím viac tabliet sa vynechalo a čím viac sa vynechanie užitia blíži k pravidelnému intervalu bez užívania tabliet, tým vyššie je riziko gravidity.
·
2. týždeň Používateľka musí užiť poslednú vynechanú tabletu hneď ako si spomenie, aj keby to znamenalo užitie dvoch tabliet súčasne. Potom pokračuje v užívaní tabliet vo zvyčajnom čase. Ak žena užívala tablety počas siedmich dní pred prvou vynechanou tabletou správne, ďalšie antikoncepčné opatrenia nie sú potrebné. Ak nie, alebo ak vynechala viac ako jednu tabletu, má žena v nasledujúcich 7 dňoch použiť bariérovú metódu napr. kondóm.
·
3. týždeň Vzhľadom na nastávajúci interval bez užívania tabliet je bezprostredné riziko zníženia spoľahlivosti antikoncepcie. Aj tak však možno upravením schémy užívania predísť zníženiu antikoncepčnej ochrany. V prípade dodržiavania jedného z nasledovných možných postupov, nie je potrebné používať ďalšie antikoncepčné opatrenia za predpokladu, že počas siedmich dní pred vynechaním prvej tablety užila všetky tablety správne. Ak to tak nie je, má žena zvoliť prvú z nasledujúcich dvoch možností a použiť navyše bariérovú metódu počas nasledujúcich siedmych dní.
1. Používateľka musí užiť poslednú vynechanú tabletu hneď ako si spomenie, aj keby to znamenalo užitie dvoch tabliet súčasne. Potom pokračuje v užívaní tabliet vo zvyčajnom čase. Užívanie tabliet z nasledujúceho blistra potom musí začať okamžite po využívaní predchádzajúceho, t.j. medzi baleniami nie je žiadna prestávka. Krvácanie z vysadenia sa pravdepodobne nedostaví pred doužívaním tabliet z druhého balenia, ale počas užívania tabliet môže nastať špinenie alebo medzimenštruačné krvácanie.
2. Žene sa môže tiež odporučiť, aby prerušila užívanie tabliet zo súčasne používaného balenia. Potom sa má dodržať interval najviac siedmich dní bez užívania tabliet vrátane dní, kedy sa tablety vynechali a následne pokračuje v užívaní tabliet z ďalšieho balenia.
Ak žena zabudne užiť tablety a následne sa nedostaví krvácanie z vysadenia v prvom normálnom intervale bez užívania tabliet, musí sa zvážiť možnosť gravidity.
Postup v prípade gastrointestinálnych ťažkostíV prípade závažných gastrointestinálnych ťažkostí (napr. vracanie, hnačka) nemusí byť vstrebávanie úplné a majú sa prijať ďalšie antikoncepčné opatrenia.
Ak počas 3-4 hodín po užití tablety dôjde k vracaniu, nová (nahradená tableta) sa má užiť čo najskôr, ako je to možné. Ak je to možné, nová tableta sa má užiť do 12 hodín od obvyklej doby užívania tabliet.
Ak uplynulo viac ako 12 hodín možno aplikovať postup ako je uvedený v časti 4.2, odsek „Postup pri vynechaní tabliet“. Ak žena nechce narušiť zvyčajnú schému užívania tabliet, musí užiť tabletu (y) z ďalšieho blistra.
Ako posunúť alebo oddialiť krvácanie z vysadenia Na oddialenie menštruácie, má žena pokračovať v užívaní tabliet z ďalšieho balenia Marynarky bez prestávky. Odďaľovať menštruáciu možno až do využívania druhého balenia. Počas tohto času sa u ženy môže objaviť medzimenštruačné krvácanie alebo špinenie. Po zvyčajnom sedemdňovom intervale bez užívania tabliet sa potom obnoví pravidelné užívanie Marynarky.
Ak si žena praje presunúť menštruáciu na iný deň v týždni, než na aký je zvyknutá v doterajšej schéme užívania, možno jej odporučiť, aby skrátila interval bez užívania tabliet o toľko dní, o koľko si praje. Čím kratší bude interval, tým väčšie je riziko, že nedôjde ku krvácaniu z vysadenia a že počas užívania nasledujúceho balenia sa vyskytne medzimenštruačné krvácanie a špinenie (podobne ako pri oddialení menštruácie).
4.3 KontraindikácieKombinovaná hormonálna antikoncepcia (combined hormonal contraceptives - CHC) sa nemá užívať v nasledujúcich podmienkach.
· Prítomnosť alebo riziko vzniku venóznej tromboembólie (VTE)
o Venózna tromboembólia - prítomná VTE (liečená antikoagulanciami) alebo v anamnéze (napr. trombóza hlbokých žíl [deep venous thrombosis - DVT] alebo pľúcna embólia [pulmonary embolism - PE]).
o Známa dedičná alebo získaná predispozícia na vznik venóznej tromboembólie, ako napríklad rezistencia voči APC (vrátane faktora V Leiden), deficiencia antitrombínu‑III, deficiencia proteínu C, deficiencia proteínu S.
o Závažný chirurgický zákrok s dlhodobou imobilizáciou (pozri časť 4.4).
o Vysoké riziko vzniku venóznej tromboembólie z dôvodu prítomnosti viacerých rizikových faktorov (pozri časť 4.4).
· Prítomnosť alebo riziko vzniku arteriálnej tromboembólie (ATE)
o Arteriálna tromboembólia - prítomná arteriálna tromboembólia, arteriálna tromboembólia v anamnéze (napríklad infarkt myokardu) alebo stav, ktorý je jej skorým príznakom (napríklad
angina pectoris).
o Cievne mozgové ochorenie - prítomná cievna mozgová príhoda, cievna mozgová príhoda v anamnéze alebo stav, ktorý je jej skorým príznakom (napríklad prechodný ischemický záchvat, TIA).
o Známa dedičná alebo získaná predispozícia na vznik arteriálnej tromboembólie, ako napríklad hyperhomocysteinémia a antifosfolipidové protilátky (antikardiolipínové protilátky, lupusové antikoagulancium).
o Migréna s ložiskovými neurologickými symptómami v anamnéze.
o Vysoké riziko vzniku arteriálnej tromboembólie z dôvodu viacerých rizikových faktorov (pozri časť 4.4) alebo prítomnosti jedného závažného rizikového faktora, ako napríklad:
· diabetes mellitus s cievnymi symptómami,
· závažná hypertenzia,
· závažná dyslipoproteinémia.
· existujúca alebo v minulosti sa vyskytujúca pankreatitída spojená so závažnou hypertriglyceridémiou
· diagnostikované malignity závislé od pohlavných steroidov alebo podozrenie na ne (napr. pohlavných orgánov alebo prsníka).
· existujúce alebo v minulosti sa vyskytujúce závažné ochorenie pečene, až do návratu pečeňových funkcií na referenčné hodnoty,
· existujúce nádory pečene (benígne alebo malígne) alebo ich výskyt v anamnéze,
· vaginálne krvácanie s nediagnostikovanou príčinou,
· precitlivenosť na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníUpozorneniaAk je prítomný ktorýkoľvek zo stavov alebo rizikových faktorov uvedených nižšie, vhodnosť užívania Marynarky sa má s danou ženou prekonzultovať.
Ženu treba upozorniť, že ak dôjde k zhoršeniu alebo prvému prejavu ktoréhokoľvek z týchto stavov alebo rizikových faktorov, má sa obrátiť na svojho lekára, ktorý určí či sa má ukončiť užívanie Marynarky.
V prípade podozrenia alebo potvrdenia vzniku VTE alebo ATE, užívanie kombinovanej hormonálnej antikoncepcie CHC má byť prerušené. V prípade začatia antikoagulačnej liečby, sa má iniciovať adekvátna alternatívna antikoncepcia kvôli teratogenite antikoagulačnej liečby (kumaríny).
Riziko vzniku venóznej tromboembólie (VTE)Používanie ktorejkoľvek kombinovanej hormonálnej antikoncepcie (CHC) zvyšuje riziko vzniku venóznej tromboembólie (VTE) v porovnaní s jej nepoužívaním.
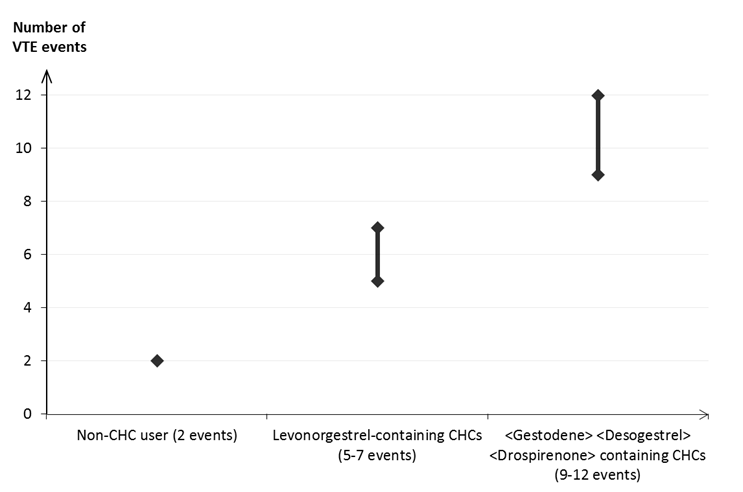
Lieky, ktoré obsahujú levonorgestrel, norgestimát alebo noretisterón, sú spojené s najnižším rizikom vzniku VTE. Ostatné lieky, ako je Marynarka, môžu toto riziko zvyšovať dvojnásobne. Rozhodnutie používať ktorýkoľvek iný liek, ako ten s najnižším rizikom výskytu VTE, sa má urobiť len po konzultácii s danou ženou, aby sa zaručilo, že rozumie riziku výskytu VTE pri užívaní Marynarky, ako jej aktuálne rizikové faktory ovplyvňujú toto riziko, a že riziko vzniku VTE je najvyššie v prvom roku používania CHC. Sú taktiež aj určité dôkazy o tom, že sa toto riziko zvyšuje pri opätovnom začatí používania CHC po prerušení používania trvajúcom 4 týždne alebo dlhšie.U približne 2 z 10 000 žien, ktoré používajú CHC a nie sú gravidné, vznikne VTE v priebehu jedného roka. Avšak u jednotlivých žien môže byť toto riziko oveľa vyššie v závislosti od prítomných rizikových faktorov (pozri nižšie).
Odhaduje sa
1, že VTE sa vyskytne v priebehu jedného roka u približne 9 až 12 žien z 10 000 žien, ktoré používajú CHC obsahujúcu gestodén, v porovnaní s približne 6
2 ženami, ktoré používajú CHC obsahujúcu levonorgestrel.
V oboch prípadoch je počet výskytov VTE za rok nižší než počet očakávaný u žien počas gravidity alebo v období po pôrode.
VTE sa môže v 1 až 2 % prípadov skončiť smrťou.
Počet prípadov VTE na 10 000 žien v priebehu jedného roka CHC obsahujúce gestodén (9‑12 prípadov)
|
|
CHC obsahujúce levonorgestrel
(5‑7 prípadov)
|
|
Nepoužívanie CHC (2 prípady)
|
|
U používateliek CHC bol mimoriadne zriedkavo hlásený výskyt trombózy v iných cievach, napr. v pečeňových, mezenterických, obličkových alebo sietnicových žilách a tepnách.
_______________________
1 Tieto incidencie boli odhadnuté zo všetkých dát z epidemiologických štúdií, použitím relatívnych rizík pre rôzne lieky v porovnaní s CHC obsahujúcimi levonorgestrel
2 Stredný bod rozpätia 5-7 (prípadov) na 10 000 ženských rokov (ŽR), založený na relatívnom riziku kombinovanej hormonálnej antikoncepcie (CHC) obsahujúcej levonorgestrel oproti 2,3 až 3,6 u nepoužívateliek.
Rizikové faktory vzniku VTERiziko vzniku venóznych tromboembolických komplikácií u používateliek CHC sa môže značne zvýšiť v prípade ženy s ďalšími rizikovými faktormi, najmä ak má viacero rizikových faktorov (pozri tabuľku).
Marynarka je kontraindikovaná, ak má žena viacero rizikových faktorov, ktoré ju vystavujú vysokému riziku vzniku venóznej trombózy (pozri časť 4.3). Ak má žena viac ako jeden rizikový faktor, zvýšenie rizika môže byť väčšie než súčet jednotlivých faktorov - v takomto prípade sa má zvážiť jej celkové riziko výskytu VTE. Ak sa pomer prínosov a rizík považuje za negatívny, CHC sa nemá predpisovať (pozri časť 4.3).
Tabuľka: Rizikové faktory vzniku VTERizikový faktor
| Komentár
|
Obezita (index telesnej hmotnosti nad 30 kg/m²)
| Riziko sa výrazne zvyšuje so zvyšovaním BMI.
Obzvlášť dôležité je to zvážiť, ak sú prítomné aj ďalšie rizikové faktory.
|
Dlhodobá imobilizácia, závažný chirurgický zákrok, akýkoľvek chirurgický zákrok na nohách alebo panve, neurochirurgický zákrok alebo závažný úraz.
Poznámka: dočasná imobilizácia vrátane cestovania leteckou dopravou trvajúcou >4 hodiny môže byť tiež rizikovým faktorom pre vznik VTE, najmä u žien s ďalšími rizikovými faktormi.
| V týchto prípadoch sa odporúča prerušiť používanie náplasti/tablety/krúžku (v prípade plánovaného chirurgického zákroku najmenej štyri týždne pred zákrokom) a pokračovať v ňom najskôr dva týždne po úplnom obnovení pohyblivosti. Má sa používať iný spôsob antikoncepcie, aby sa zabránilo neželanej gravidite.
Ak sa užívanie Marynarky nepreruší včas, má sa zvážiť antitrombotická liečba.
|
Pozitívna rodinná anamnéza (akýkoľvek výskyt venóznej tromboembólie u súrodenca alebo rodiča, najmä v relatívne mladom veku, napr. do 50 rokov).
| Ak existuje podozrenie na dedičnú predispozíciu, žena sa má pred rozhodnutím o používaní ktorejkoľvek CHC poradiť s odborným lekárom.
|
Iné zdravotné stavy spojené s VTE
| Rakovina, systémový lupus erythematosus, hemolyticko-uremický syndróm, chronické zápalové ochorenie čriev (Crohnova choroba alebo ulcerózna kolitída) a kosáčikovitá anémia
|
Zvyšujúci sa vek
| Najmä nad 35 rokov
|
Neexistuje žiadna zhoda ohľadom možnej úlohy kŕčových žíl a povrchovej tromboflebitídy pri vzniku alebo progresii venóznej trombózy.
Musí sa zvážiť zvýšené riziko vzniku tromboembólie počas gravidity a najmä počas 6‑týždňového obdobia šestonedelia (informácie o „gravidite a laktácii“, pozri časť 4.6).
Príznaky VTE (trombóza hlbokých žíl a pľúcna embólia)Žena má byť poučená, aby v prípade príznakov vyhľadala okamžitú lekársku pomoc a informovala zdravotníckeho pracovníka, že používa CHC.
Príznaky trombózy hlbokých žíl (DVT) môžu zahŕňať:
– jednostranný opuch nohy a/alebo chodidla alebo pozdĺž žily v nohe,
– bolesť alebo citlivosť v nohe, ktorú možno pociťovať iba v stoji alebo pri chôdzi,
– zvýšené teplo v postihnutej nohe, sčervenanie alebo zmena sfarbenia pokožky na nohe.
Príznaky pľúcnej embólie (PE) môžu zahŕňať:
– náhly nástup nevysvetliteľnej dýchavičnosti alebo rýchleho dýchania,
– náhly kašeľ, ktorý môže súvisieť s hemoptýzou,
– ostrú bolesť v hrudníku,
– závažný pocit točenia hlavy alebo závrat,
– rýchly alebo nepravidelný srdcový rytmus.
Niektoré z týchto príznakov (napríklad „dýchavičnosť“, „kašeľ“) sú nešpecifické a môžu byť nesprávne interpretované ako častejšie alebo menej závažné udalosti (napríklad infekcie dýchacích ciest).
Medzi ďalšie prejavy vaskulárnej oklúzie môžu patriť: náhla bolesť, opuch a mierne zmodranie niektorej končatiny.
Ak dôjde k oklúzii v oku, medzi symptómy môžu patriť bezbolestné rozmazané videnie, ktoré môže postupne prechádzať až do straty zraku. Niekedy môže dôjsť k strate zraku takmer okamžite.
Riziko vzniku arteriálnej tromboembólie (ATE)Epidemiologické štúdie spájajú používanie CHC so zvýšeným rizikom vzniku arteriálnej tromboembólie (infarkt myokardu) alebo cievnej mozgovej udalosti (napr. prechodný ischemický záchvat, cievna mozgová príhoda). Arteriálne tromboembolické udalosti sa môžu končiť smrťou.
Rizikové faktory vzniku ATERiziko vzniku arteriálnych tromboembolických komplikácií alebo cerebrovaskulárnej udalosti u používateliek CHC sa zvyšuje u žien s rizikovými faktormi (pozri tabuľku). Marynarka je kontraindikovaná, ak má žena jeden závažný alebo viacero rizikových faktorov vzniku ATE, ktoré ju vystavujú vysokému riziku vzniku arteriálnej trombózy (pozri časť 4.3). Ak má žena viac než jeden rizikový faktor, zvýšenie rizika môže byť väčšie než súčet jednotlivých faktorov - v takomto prípade sa má zvážiť jej celkové riziko. Ak sa pomer prínosov a rizík považuje za negatívny, CHC sa nemá predpisovať (pozri časť 4.3).
Tabuľka: Rizikové faktory vzniku ATERizikový faktor
| Komentár
|
Zvyšujúci sa vek
| Najmä nad 35 rokov
|
Fajčenie
| Ženám sa má odporučiť, aby nefajčili, ak chcú používať CHC. Ženám vo veku nad 35 rokov, ktoré pokračujú vo fajčení, sa má dôrazne odporučiť, aby používali iný spôsob antikoncepcie.
|
Hypertenzia
|
|
Obezita (index telesnej hmotnosti nad 30 kg/m²).
| Riziko sa výrazne zvyšuje so zvyšovaním BMI.
To je dôležité najmä u žien s ďalšími rizikovými faktormi.
|
Pozitívna rodinná anamnéza (akýkoľvek výskyt arteriálnej tromboembólie u súrodenca alebo rodiča, najmä v relatívne mladom veku, napr. do 50 rokov).
| Ak existuje podozrenie na dedičnú predispozíciu, žena sa má pred rozhodnutím o používaní ktorejkoľvek CHC poradiť s odborným lekárom.
|
Migréna
| Zvýšenie frekvencie alebo závažnosti migrény v priebehu používania CHC (čo môžu byť skoré príznaky cievnej mozgovej príhody) môže byť dôvodom na okamžité prerušenie používania lieku.
|
Ďalšie zdravotné stavy spojené s nežiaducimi vaskulárnymi udalosťami.
| Diabetes mellitus, hyperhomocysteinémia, ochorenie srdcových chlopní a atriálna fibrilácia, dyslipoproteinémia a systémový lupus erythematosus.
|
Príznaky ATEV prípade príznakov sa má žene odporučiť, aby bezodkladne vyhľadala lekársku pomoc a informovala zdravotníckeho pracovníka, že používa CHC.
Príznaky cievnej mozgovej príhody môžu zahŕňať:
– náhla strata citlivosti alebo slabosť tváre, ruky alebo nohy, najmä na jednej strane tela,
– náhle problémy s chôdzou, závrat, strata rovnováhy alebo koordinácie,
– náhla zmätenosť, problémy s rečou alebo jej porozumením,
– náhle problémy so zrakom u jedného alebo oboch očí,
– náhla, závažná alebo dlhodobá bolesť hlavy bez známej príčiny,
– strata vedomia alebo mdloba so záchvatom alebo bez neho.
Dočasné príznaky naznačujú, že udalosťou je prechodný ischemický záchvat (TIA).
Príznaky infarktu myokardu (MI) môžu zahŕňať:
– bolesť, nepohodlie, tlak, ťažoba, pocit stláčania alebo plnosti v hrudníku, ruke alebo pod hrudnou kosťou,
– dyskomfort vyžarujúci do chrbta, čeľuste, hrdla, ruky, žalúdka,
– pocit plnosti, tráviacich problémov alebo dusenia sa,
– potenie, nevoľnosť, vracanie alebo závrat,
– extrémna slabosť, úzkosť alebo dýchavičnosť,
– rýchly alebo nepravidelný srdcový rytmus.
NádoryRakovina krčka materniceV niektorých epidemiologických štúdiách u dlhodobých užívateliek COC bolo hlásené zvýšené riziko rakoviny krčka maternice, stále však nie je jasné, do akej miery môže byť toto zistenie ovplyvnené dôsledkom sexuálneho správania a ďalších faktorov, ako je ľudský papilloma vírus (HPV).
Rakovina prsníkaMetaanalýza 54 epidemiologických štúdií uvádza, že sa mierne zvýšilo relatívne riziko (RR=1,24) diagnostikovania výskytu rakoviny prsníka u žien počas užívania COC. Zvýšené riziko postupne klesá v priebehu 10 rokov po ukončení užívania COC. Pretože výskyt rakoviny prsníka je u žien do 40 rokov zriedkavý, zvýšený počet prípadov diagnostikovanej rakoviny prsníka u žien, ktoré užívajú alebo užívali COC je v pomere k celkovému riziku rakoviny prsníka malý. Kauzalitu tieto štúdie nedokazujú. Pozorované zvýšenie rizika môže byť zapríčinené skoršou diagnózou rakoviny prsníka u používateliek COC, biologickými účinkami COC alebo ich kombináciou. Rakovina prsníka diagnostikovaná u žien, ktoré niekedy COC užívali býva klinicky menej rozvinutá ako u žien, ktoré COC neužívali nikdy.
Rakovina pečeneV zriedkavých prípadoch sa u žien užívajúcich COC hlásili benígne a malígne nádory pečene. V ojedinelých prípadoch viedli tieto nádory k život ohrozujúcemu intraabdominálnemu krvácaniu. V prípade výskytu silných bolestí v nadbruší, zväčšenia pečene alebo prejavov intraabdominálneho krvácania u žien užívajúcich COC sa v diferenciálnej diagnóze musí uvažovať o nádore pečene.
Ostatné stavyU žien s hypertriglyceridémiou alebo ktoré majú toto ochorenie v rodinnej anamnéze sa v priebehu užívania COC môže zvýšiť riziko vzniku pankreatitídy.
Aj keď sa u mnohých žien užívajúcich COC zaznamenalo mierne zvýšenie krvného tlaku, klinicky významný vzostup je zriedkavý. Ak sa však v priebehu užívania COC rozvinie klinicky závažná hypertenzia je opodstatnené, ak lekár COC vysadí a lieči hypertenziu. Ak lekár uzná za vhodné, užívanie COC je možné obnoviť po dosiahnutí normotenzných hodnôt krvného tlaku antihypertenznou liečbou.
V súvislosti s graviditou a užívaním COC sa vyskytli alebo zhoršili nasledovné stavy, ale potvrdenie súvislosti s COC nie je preukázané: žltačka a/alebo svrbenie súvisiace s cholestázou, žlčové kamene, porfýria, systémový lupus erythematosus, hemolyticko-uremický syndróm, Sydenhamova chorea,
herpes gestationis, strata sluchu spôsobená otosklerózou.
U žien s hereditárnym angioedémom môže podávanie exogénnych estrogénov vyvolať alebo zhoršiť jeho symptómy.
COC môžu mať vplyv na periférnu inzulínovú rezistenciu a glukózovú toleranciu. Preto musia byť diabetičky starostlivo sledované, najmä na začiatku užívania COC.
Počas užívania COC bolo hlásené zhoršenie endogénnej depresie, epilepsie (pozri časť 4.5 interakcie), Crohnovej choroby a ulceróznej kolitídy.
Môže sa objaviť chloazma, najmä u žien, ktoré majú v anamnéze
chloasma gravidarum.
Ženy so sklonom ku chloazme sa majú počas užívania COC vyhýbať expozícii slnečnému alebo ultrafialovému žiareniu.
Rastlinné prípravky obsahujúce ľubovník bodkovaný (Hypericum perforatum) sa nemajú podávať počas užívania Marynarky kvôli riziku zníženia plazmatických koncentrácií a zníženia klinických účinkov Marynarky (viz bod 4.5).
Marynarka obsahuje laktózu. Pacientky so zriedkavými dedičnými problémami galaktózovej intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
Lekárske vyšetrenie/konzultáciaPred začatím užívania alebo opätovným nasadením Marynarky má sa vyšetriť kompletná zdravotná anamnéza (vrátane rodinnej anamnézy) a musí sa vylúčiť gravidita. Má sa zmerať krvný tlak a vykonať zdravotná prehliadka na základe kontraindikácií (pozri časť 4.3) a upozornení (pozri časť 4.4). Je dôležité ženu upozorniť na informácie o venóznej a arteriálnej trombóze vrátane rizika užívania Marynarky v porovnaní s inými CHC, o príznakoch VTE a ATE, o známych rizikových faktoroch a o tom, čo robiť v prípade podozrenia na trombózu.
Žena má byť poučená, aby si pozorne prečítala písomnú informáciu pre používateľku a dodržiavala odporúčania uvedené v nej. Frekvencia a druh vyšetrení sa majú robiť na základe stanovených postupov a majú sa prispôsobiť individuálnym potrebám ženy.
Ženy majú byť upozornené, že hormonálna antikoncepcia nechráni pred infekciami vírusom HIV (AIDS) ani inými ochoreniami prenášanými pohlavným stykom.
Znížená účinnosťÚčinnosť perorálnej antikoncepcie sa môže znížiť napr. ak sa vynechá užitie tablety, v prípade gastrointestinálnych ťažkostí (pozri časť 4.2) alebo ak sa súbežne užívajú ďalšie lieky (pozri časť 4.5).
Znížená kontrola cykluPri užívaní ktoréhokoľvek COC sa môže objaviť nepravidelné krvácanie (špinenie alebo medzimenštruačné krvácanie), predovšetkým počas prvých mesiacov užívania. Z tohto dôvodu má posúdenie nepravidelného krvácania zmysel až po adaptačnom intervale približne troch cyklov.
Ak nepravidelné krvácanie pokračuje alebo sa objaví po období pravidelných cyklov, musí sa zvážiť možnosť nehormonálnej príčiny a indikované sú zodpovedajúce diagnostické kroky na vylúčenie malignity alebo gravidity. Môžu zahŕňať aj kyretáž.
U niektorých žien nemusí dôjsť počas intervalu bez užívania tabliet ku krvácaniu z vysadenia. Ak sa COC užíva podľa pokynov opísaných v časti 4.2, je nepravdepodobné, že je žena gravidná. Ak sa však COC neužívalo pred prvým vynechaným krvácaním podľa týchto pokynov alebo ak nedošlo ku krvácaniu z vysadenia dvakrát, musí sa pred ďalším užívaním COC vylúčiť gravidita.
4.5 Liekové a iné interakciePoznámka: Na identifikovanie potenciálnych interakcií, sa musia zohľadniť odborné informácie o súbežne užívaných liekoch.
Vplyv iných liekov na MarynarkuInterakcie sa môžu vyskytnúť s liečivami, ktoré indukujú mikrozomálne enzýmy, čo môže viesť k zvýšenému klírensu pohlavných hormónov a spôsobiť medzimenštruačné krvácanie a/alebo zlyhanie antikoncepčnej ochrany.
Manažment Indukcia enzýmov sa môže pozorovať už po niekoľkých dňoch liečby. Maximálna indukcia enzýmov je zvyčajne dosiahnutá do niekoľkých týždňov. Počas 4 týždňov od ukončenia liečby liekom môže enzýmová indukcia pretrvávať.
Krátkodobá liečbaŽeny užívajúce liečivá indukujúce enzýmy musia dočasne okrem COC používať naviac bariérovú alebo inú metódu antikoncepčnej ochrany. Bariérová metóda sa musí používať počas celého obdobia súbežnej liečby a počas 28 dní od jej ukončenia. Ak súbežné podávanie lieku trvá aj po využívaní tabliet z blistrového balenia COC, užívanie z ďalšieho balenia COC sa má začať bez zvyčajného intervalu bez užívania tabliet.
Dlhodobá liečbaŽenám dlhodobo užívajúcim liečivá indukujúce enzýmy sa odporúča iná, spoľahlivá nehormonálna metóda antikoncepcie.
Látky zvyšujúce klírens COC (znižujúce účinnosť COC indukciou enzýmov) napríklad: barbituráty, bosentan, karbamazepín, fenytoín, primidón, rifampicín a lieky na HIV infekciu ritonavir, nevirapin a efavirenz, a možno tiež felbamát, griseofulvín, oxkarbazepín, topiramát a prípravky obsahujúce ľubovník bodkovaný (
Hypericum perforatum).
V literatúre boli popísané nasledujúce interakcie:Látky s premenlivým vplyvom na klírens kombinovanej perorálnej antikoncepciePri súbežnom užívaní spoločne s COC mnoho kombinácií inhibítorov HIV proteázy a nenukleozidových inhibítorov reverznej transkriptázy vrátane kombinácie s HCV inhibítormi, môže zvýšiť či znížiť koncentráciu estrogénu alebo gestagénov. Účinok týchto zmien môže byť v niektorých prípadoch klinicky významný.
Preto sa majú preštudovať informácie o prípravku k súbežnej liečbe HIV/HCV, aby sa identifikovali možné interakcie a akékoľvek súvisiace odporúčania. V prípade pochybností má žena liečená inhibítormi proteáz alebo inhibítormi nenukleozidovej reverznej transkriptázy používať dodatočnú bariérovú metódu antikoncepčnej ochrany.'
Účinok Marynarky na iné liekyPerorálna antikoncepcia môže ovplyvňovať metabolizmus niektorých iných liečiv. Podľa toho sa môžu plazmatické a tkanivové koncentrácie zvýšiť (napr. cyklosporín) alebo znížiť (napr. lamotrigín).
Laboratórne vyšetreniaUžívanie kontraceptívnych steroidov môže ovplyvniť výsledky niektorých laboratórnych testov, vrátane biochemických parametrov pečeňových, tyreoidálnych, adrenálnych a renálnych funkcií, plazmatických koncentrácií (väzbových) proteínov napr. globulínu viažuceho kortikosteroidy a lipidových/lipoproteínových frakcií, parametrov metabolizmu sacharidov a parametrov koagulácie a fibrinolýzy. Zmeny však zvyčajne zostávajú v rozmedzí referenčných laboratórnych hodnôt
4.6 Fertilita, gravidita a laktáciaGraviditaMarynarka nie je indikovaná počas gravidity (pozri časť 4.3). Ak v priebehu užívania Marynarky dôjde ku gravidite, liek sa musí okamžite vysadiť. Rozsiahle epidemiologické štúdie neodhalili zvýšené riziko vrodených chýb u detí narodených ženám, ktoré užívali kombinované perorálne kontraceptíva pred otehotnením, ani teratogénny vplyv COC, neúmyselne užívaných v ranej gravidite.
Pri opätovnom začatí používania Marynarky treba vziať do úvahy zvýšené riziko VTE v období po pôrode (pozri časti 4.2. a 4.4).
DojčenieCOC môžu ovplyvniť laktáciu, môžu znižovať množstvo a meniť zloženie materského mlieka.
Počas užívania sa malé množstvo kontraceptívnych steroidov a/alebo ich metabolitov môže vylučovať do materského mlieka a bolo hlásené niekoľko nežiaducich reakcií na dieťa, vrátane žltačky a zväčšenia prsníkov. Toto množstvo môže mať vplyv na dieťa. Z tohto dôvodu sa užívanie COC všeobecne neodporúča, až kým matka neprestane úplne dieťa dojčiť.
4.7. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeMarynarka nemá žiadny alebo len zanedbateľný vplyv na schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8. Nežiaduce účinkyPopis vybraných nežiaducich reakciíU žien užívajúcich CHC sa pozorovalo zvýšené riziko vzniku arteriálnych a venóznych trombotických a tromboembolických udalostí vrátane infarktu myokardu, cievnej mozgovej príhody, prechodných ischemických záchvatov, venóznej trombózy a pľúcnej embólie, ktoré sú podrobnejšie uvedené
v časti 4.4.
Najčastejšie hlásené nežiaduce účinky (>1/10) sú nepravidelné krvácanie, nevoľnosť, zvýšená telesná hmotnosť, citlivosť prsníkov a bolesť hlavy. Vyskytujú sa obvykle na začiatku liečby a sú prechodné.
Trieda orgánových systémov
| Časté (≥1/100
až < 1/10)
| Menej časté
(≥1/1 000
až < 1/100)
| Zriedkavé
(≥1/10 000
až < 1/1 000)
| Veľmi zriedkavé
(<1/10 000)
|
Poruchy nervového systému
| bolesť hlavy, nervozita
|
|
| chorea
|
Poruchy oka
| intolerancia kontaktných šošoviek,
poruchy zraku
|
|
|
|
Poruchy ucha a labyryntu
|
|
| otoskleróza
|
|
Poruchy gastrointestinálneho traktu
| nauzea
| vracanie
| cholelitiáza
| pankreatída
|
Poruchy kože a podkožného tkaniva
| akné
|
| chloazma
|
|
Poruchy metabolizmu a výživy
|
| hyperlipidémia
|
|
|
Poruchy ciev
| migréna
| hypertenzia
| venózna a arteriálna tromboembólia
|
|
Celkové poruchy a reakcie v mieste podania
| zvýšená telesná hmotnosť,
retencia tekutín
|
|
|
|
Poruchy imunitného systému
|
|
| Lupus erythematosus
|
|
Poruchy reprodukčného systému a prsníkov
| nepravidelné krvácanie,
amenorrhoea,
hypomenorrhoea,
citlivosť prsníkov
|
| zmeny vaginálneho sekrétu
|
|
Psychické poruchy
| zmeny libida,
depresia,
podráždenosť
|
|
|
|
Nasledujúce závažné nežiaduce účinky, ktoré boli hlásené u žien užívajúcich COC, pozri časť 4.3 a 4.4.
· Venózna tromboembólia, tj. hlbokých žíl dolných končatín alebo panvová venózna trombóza a pľúcna embólia.
· Arteriálne tromboembolické poruchy.
· Nádory pečene.
· Poruchy kože a podkožia: chloasma.
U používateliek kombinovanej perorálnej antikoncepcie je veľmi mierne zvýšená frekvencia diagnózy rakoviny prsníka. Pretože výskyt rakoviny prsníka je u žien do 40 rokov zriedkavý, zvýšený počet diagnostikovanej rakoviny prsníka je v pomere k celkovému riziku rakoviny prsníka malý. Kauzalita s COC nie je známa. Ďalšie informácie pozri v častiach 4.3 a 4.4.
InterakcieInterakcie COC s inými liečivami (induktory enzýmov) môžu spôsobiť medzimenštruačné krvácanie a/alebo zlyhanie antikoncepčnej ochrany (pozri časť 4.5).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9. PredávkovanieNie sú žiadne hlásenia o vážnych škodlivých účinkoch predávkovania. Vyskytnúť sa môžu tieto príznaky: nevoľnosť, vracanie, a u mladých dievčat slabé vaginálne krvácanie. Antidotá neexistujú a ďalšia liečba má byť symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1. Farmakodynamické vlastnostiFarmakoterapeutická skupina: hormonálne kontraceptíva na systémové použitie; gestagény a estrogény, fixná kombinácia
ATC kód: G03AA10
Celkový Pearl index (tehotenstvo v dôsledku zlyhania metódy + tehotenstvo z dôvodu zlyhania pacienta) pre etinylestradiol/gestodén 20/75 μg je 0,31 (horný limit 95% CI 0,59). Pearl index pre zlyhanie metódy je 0,16 (horný limit 95% CI 0,36).
Antikoncepčný účinok COC je založený na spolupôsobení rôznych faktorov, z nich inhibícia ovulácie a zmeny endometria sa považujú za najdôležitejšie.
5.2. Farmakokinetické vlastnostiGestodénAbsorpcia Perorálne podaný gestodén sa rýchlo a úplne absorbuje.
Po jednorazovom podaní sa maximálna koncentrácia v sére 4 ng/ml dosiahne približne do 1 hodiny. Biologická dostupnosť je približne 99 %.
DistribúciaGestodén sa viaže na sérový albumín a na globulín viažuci pohlavné hormóny (SHBG). Iba 1-2% z celkovej sérovej koncentrácie látky sú prítomné vo forme voľného steroidu, 50-70% sa špecificky viaže na SHBG. Zvýšenie hladiny SHBG indukované etinylestradiolom ovplyvňuje podiel gestodénu, viazaného na sérové proteíny a výsledkom je potom zvýšenie SHBG viazanej frakcie a pokles albumínom viazanej frakcie. Zdanlivý distribučný objem gestodénu je 0,7 l/kg.
BiotransformáciaGestodén sa úplne metabolizuje známou cestou steroidného metabolizmu. Rýchlosť metabolického klírensu zo séra je 0,8 ml/min/kg. So súčasne podaným etinylestradiolom sa nezistili žiadne priame interakcie.
ElimináciaSérová hladina gestodénu klesá v dvoch fázach. Konečná vylučovacia fáza je charakterizovaná polčasom asi 12-15 hodín. Gestodén sa nevylučuje v nezmenenej forme. Metabolity sa vylučujú močom a žlčou v pomere asi 6:4. Polčas vylučovania metabolitov je približne 1 deň.
Farmakokinetický/farmakodynamický vzťahFarmakokinetika gestodénu je ovplyvnená hladinou SHBG v sére, ktorá je súbežne podaným etinylestradiolom dvojnásobne zvýšená. Pri každodennom užívaní stúpne sérová hladina gestodénu asi štyrikrát, pričom rovnovážny stav sa dosiahne v druhej polovici liečebného cyklu.
EtinylestradiolAbsorpciaPerorálne podaný etinylestradiol sa absorbuje rýchlo a úplne. Vrchol sérovej koncentrácie - asi 80 pg/ml - sa dosiahne počas 1-2 hodín.
Absolútna biologická dostupnosť vyplývajúca z pre-systémovej konjugácii a first-pass efektu je približne
60 %.
DistribúciaV priebehu kojenia 0,02% dennej materské dávky prechádza do materského mlieka.
Etinylestradiol sa vysoko, ale nešpecificky viaže na sérový albumín (približne 98,5 %) a indukuje zvýšenie sérovej koncentrácie SHBG. Zdanlivý distribučný objem je asi 5 l/kg.
BiotransformáciaEtinylestradiol podlieha presystémovej konjugácii v sliznici tenkého čreva a v pečeni. Etinylestradiol sa primárne metabolizuje aromatickou hydroxyláciou, ale vzniká široké spektrum hydroxylovaných a metylovaných metabolitov, ktoré sú prítomné vo voľnej forme, ako aj vo forme glukuronátov a sulfátov. Rýchlosť metabolického klírensu je asi 5 ml/min/kg.
ElimináciaSérová hladina etinylestradiolu klesá v dvoch dispozičných fázach, terminálna fáza je charakterizovaná polčasom 24 hodín. Nezmenený etinylestradiol sa nevylučuje, ale jeho metabolity sa vylučujú močom a žlčou v pomere 4:6. Polčas vylučovania metabolitov je asi 1 deň.
Farmakokinetický/farmakodynamický vzťahUstálený stav sa dosiahne po 3-4 dňoch a sérové hladiny etinylestradiolu sú 30-40 % vyššie ako
v jednorázovej dávke.
5.3. Predklinické údaje o bezpečnostiEtinylestradiol a gestodén nie sú genotoxické. Štúdie karcinogenity so samostatným etinylestradiolem alebo v kombinácii s najrôznejšími gestagénmi nepreukazujú žiadne konkrétne karcinogénne riziko pre ženy pri užívání podľa indikácii pre antikoncepciu.
Treba však mať na pamäti, že pohlavné steroidy môžu podporovať rast niektorých hormón-dependentných tkanív a nádorov.
Štúdie reprodukčnej toxicity na fertilitu, vývoj plodu alebo reprodukčnú schopnosť so samostatným etinylestradiolom alebo v kombináciách s gestagénmy nepreukázali nežiadúce účinky pre ľudí ak sú používané podľa doporučení.
6. FARMACEUTICKÉ INFORMÁCIE6.1. Zoznam pomocných látokmonohydrát laktózy,
mikrokryštalická celulóza,
povidón K-30,
stearan horečnatý,
draselná soľ polakrilínu.
6.2. InkompatibilityNeaplikovateľné.
6.3. Čas použiteľnosti2 roky
6.4. Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 30 ºC v pôvodnom obale na ochranu pred svetlom.
6.5. Druh obalu a obsah baleniaPriehľadný až ľahko nepriehľadný PVC/PVDC/Al blister.
Veľkosti balenia:1x21 obalených tabliet
3x21obalených tabliet
6x21obalených tabliet
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6. Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIILaboratorios León Farma, S.A., Pol. Ind. Navatejera; C/La Vallina s/n; 24008-León, Španielsko
8. REGISTRAČNÉ ČÍSLO17/0025/17-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
Dátum posledného predĺženia:
10. DÁTUM REVÍZIE TEXTU10/2017