
vnou
látkou je číry bezfarebný roztok bez viditeľných častíc.
Injekcia lieku po značení rádioaktívnou látkou sa môže podať intradermálne, subkutánne, do nádorou alebo
do okolia nádoru.
Pri melanóme sa liek podáva intradermálne v jednej injekcii alebo dávka sa môže rozdeliť do viacerých
injekcií.
Pri karcinóme prsníka je podanie intradermálne, subareolárne (dávka sa podáva v jednej injekcii alebo môže byť rozdelená do viacerých injekcií) alebo do okolia nádoru (dávka rozdelená do viacerých injekcií).
Pri karcinóme skvamóznych buniek v ústnej dutine sa liek podáva do okolia nádoru (dávka rozdelená do viacerých injekcií).
Každá 50-mikrogramová injekčná liekovka obsahuje dodatočné množstvo zaručujúce, že možno podať 50 mikrogramov tilmanoceptu. Vyžadujesa však pripraviť injekčnú liekovku podľa pokynov a v dávke pre jedného pacienta použiť alikvótnu časť 50 mikrogramov.
Objem jednej injekcie nemá prekročiť 0,5 ml alebo nemá byť menší ako 0,1 ml. Celkový objem injekcie nemá byť väčší ako 1,0 ml a nemá byť menší ako 0,1 ml. Zriedenie lieku v objeme väčšom ako 1,0 ml by mohlo ovplyvniť distribúciu Lymphoseekuin vivo.
Pokyny na prípravu a kontrolu rádiochemickej čistoty rádiofarmaka, pozri časť 12.
Informácie o príprave pacienta, pozri časť 4.4.
4.3. Kontraindikácie
Precitlivenosť na liečivo, na ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo na ktorúkoľvek
zo zložiek rádiofarmaka značeného rádioaktívnou látkou.
4.4. Osobitné upozornenia a opatrenia pri používaní
Potenciálnaprecitlivenosťaleboanafylaktickéreakcie
Vždy sa musí vziať na vedomie možnosť precitlivenosti vrátane závažných život ohrozujúcich a smrteľných
anafylaktických/anafylaktoidných reakcií.
Ak sa vyskytne precitlivenosť alebo anafylaktické reakcie, podávanie lieku sa musí ihneď ukončiť
a v prípade potreby sa musí začať s intravenóznou liečbou. Z dôvodu zabezpečenia okamžitej reakcie na núdzový stav musia byť k dispozícii potrebné lieky a zariadenie, napríklad endotracheálna trubica a respirátor.
Individuálne odôvodnenie pomeru prínosu a rizika
Expozícia žiareniu u každého pacienta byť musí odôvodnená pravdepodobným prínosom. Podávaná rádioaktivita má byť v každom prípade čo najnižšia, ale dostatočná na získanie potrebných diagnostických informácií.
Poruchafunkcieobličiekapečene
Vzhľadom na možné zvýšenie expozície žiareniu je potrebné dôkladné posúdenie pomeru prínosu a rizika
u týchto pacientov. Odhadnutá dávka žiarenia u pacienta nemá prekročiť hodnotu 0,69 mSv ani v prípade, že dávka 74 MBq (2,0 mCi) sa nevylúčila (pozri časť 4.2).
Príprava pacienta
Pacient má byť pred začiatkom vyšetrenia náležite hydratovaný a časté močenie počas prvých hodín
po vyšetrení zníži u pacienta expozíciu žiareniu.
Osobitné upozornenia
Tento liek obsahuje menej ako 1 mmólu sodíka (23 mg) v dávke, t. j. v podstate sodík neobsahuje.
Opatrenia vzhľadom na riziko pre životné prostredie, pozri časť 6.6.
4.5. Liekové a iné interakcie
Pridanie veľmi veľkého objemu stopovacích látok alebo iných injektantov, ktoré časovo alebo anatomicky naväzujú na Lymphoseek, by mohlo ovplyvniť distribúciu Lymphoseekuin vivo. Ďalšie stopovacie látky sa nemajú injikovať do 30 minút po podaní Lymphoseeku.
Neuskutočnili sa žiadne ďalšie interakčné štúdie.
4.6. Fertilita, gravidita a laktácia
Ženyvofertilnomveku
Keď majú byť žene vo fertilnom veku podané rádiofarmaká, je dôležité zistiť, či nie je gravidná. Každá žena, ktorá nedostala menštruáciu, sa má považovať za gravidnú, kým sa nepreukáže opak. Ak sú pochybnosti
o možnej gravidite ženy (ak žena nedostala menštruáciu, ak je menštruácia veľmi nepravidelná atď.),
pacientke treba ponúknuť iné metódy, pri ktorých sa nepoužíva ionizačné žiarenie (ak sú takéto metódy
k dispozícii).
G
r
avidita
Kdispozícii nie sú údaje o použití Lymphoseeku u gravidných žien. Neuskutočnili sa žiadne štúdie reprodukčnej toxicity u zvierat a nie je známe, či Lymphoseek môže zapríčiniť poškodenie plodu, keď sa podá gravidnej žene.
Rádionuklidové postupy vykonávané ugravidných žien zahŕňajú tiež dávku žiarenia pre plod. Počas gravidity preto treba vykonávať len nevyhnutné vyšetrenia, keď pravdepodobný prínos vysoko prevýši riziko pre
matku a plod.
LaktáciaNie je známe, či sa technécium 99mTc tilmanocept vylučuje do materskéhomlieka u ľudí.
Pred podaním rádiofarmák matke, ktorá dojčí, treba zvážiť možnosť neskoršieho podania rádionuklidu, kým matka neprestane dojčiť, ako aj najvhodnejší výber rádiofarmák, pričom treba vziať na vedomie vylučovanie rádioaktivity do materského mlieka. Ak sa podanie lieku považuje za nevyhnutné, dojčenie sa musí prerušiť na 24 hodín po podaní injekcie a získané mlieko sa má zlikvidovať.
FertilitaS Lymphoseekom sa neuskutočnili štúdie fertility na zvieratách.
4.7. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeLymphoseek nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8. Nežiaduce účinkyV klinických skúšaniach zahŕňajúcich 553 pacientov najčastejšie nežiaduce reakcie boli:
◦ podráždenie na mieste vpichu (0,7 %; 4 pacienti z 553),
◦ bolesť na mieste vpichu (0,2 %; 1 pacient z 553).
Ďalšie nežiaduce reakcie boli menej časté, mali miernu intenzitu a krátke trvanie.

V nasledujúcej tabuľke sa uvádzajú frekvencie nežiaducich reakcií: Veľmi časté (≥ 1/10)
Časté (≥ 1/100 až < 1/10)
Menej časté (≥ 1/1 000 až < 1/100) Zriedkavé (≥ 1/10 000 až < 1/1 000) Veľmi zriedkavé (≥ 1/10 000)
Neznáma frekvencia (z dostupných údajov)
V klinických štúdiách sa hodnotil výskyt ďalej uvedených nežiaducich reakcií u 553 subjektov vo veku
18 rokov a starších, ktorí dostali Lymphoseek. Tieto reakcie časovo nadväzovali na podanie Lymphoseeku a mohli byť zapríčinené inými liekmi podanými pacientom, alebo chirurgickými postupmi.
Poruchy metabolizmu a výživy Menej časté: hyperkalciémia
Poruchy nervového systému Menej časté: afázia, závraty, bolesť hlavy, parestézia
Poruchy oka Menej časté: rozmazané videnie Poruchy srdca a srdcovej činnosti Menej časté: sínusová tachykardia Poruchy ciev Menej časté: návaly tepla
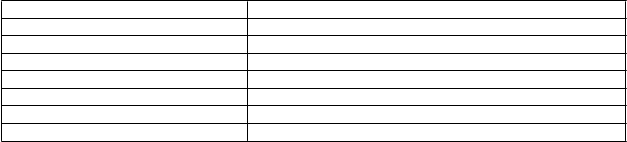
Poruchy gastrointestinálneho traktu Menej časté: nauzea
Poruchy kože a podkožného tkaniva Menej časté: podráždenie kože
Poruchy kostrovej a svalovej sústavy a Menej časté: bolesť v končatine, muskuloskeletálna bolesť,
spojivového tkaniva bolesť krku, bolesť v čelusti
Poruchy obličiek a močových ciest Menej časté: nutkanie na močenie, polakiúria
Poruchy reprodukčného systému a

prsníkov
Celkové poruchy a reakcie v mieste podania
Úrazy, otravy a komplikácie
liečebného postupu
Menej časté: bolesť v prsníkoch
Menej časté: podráždenie na mieste vpichu, bolesť na mieste vpichu, pocit horúčavy
Menej časté: bolesť na mieste rezu, seróm, otvorenie rany
Expozícia ionizačnému žiareniu súvisí s indukciou rakoviny a možným vznikom dedičných porúch. Keďže
účinná dávka pre dospelého (70 kg) je 0,69 mSv, keď je podaná maximálna odporúčaná rádioaktivita
74 MBq, predpokladá sa, že nežiaduce udalosti sa vyskytnú s nízkou pravdepodobnosťou.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9. PredávkovanieCelkové množstvo v injekcii nemá prekročiť 50 mikrogramov tilmanoceptu s celkovou maximálnou rádioaktivitou 74 MBq na dávku.Chronické alebo akútne predávkovanie nie je pravdepodobné vzhľadom na celkové množstvo v injekcii.
Pri dávkovej hladine, ktorá bola 3,7-násobne vyššia ako odporúčaná dávka Lymphoseeku u ľudí alebo 390- násobne vyššia ako predpokladaná humánna expozícia tilmanoceptu u zvierat, sa nepozorovali žiadne klinické následky.
V prípade predávkovania žiarením pri podaní tilmanoceptu sa má znížiť absorbovaná dávka u pacienta, ak je to možné, zvýšeným vylučovaním rádionuklidu z tela častým močením alebo vynútenou diurézou a častým vyprázdňovaním močového mechúra.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1. Farmakodynamické vlastnostiFarmakoterapeutická skupina: diagnostické rádiofarmakum, detekcia nádorov, ATC kód: V09IA09.
MechanizmusúčinkuLymphoseek je rádiofarmakum zacielené na receptory, ktoré je vytvorené tak, aby rýchlo prechádzalo cez lymfatické cievy. Je zamerané na biologický cieľ a akumuluje a zachytáva sa v primárnych drenážnych lymfatických uzlinách (sentinelových lymfatických uzlinách), ktoré sú kľúčové pre predikciu. Liečivo tilmanocept sa špecificky viaže na receptorové proteíny viažúce manózu (CD206), ktoré sa nachádzajú
na povrchu makrofágov a dendritových buniek. Makrofágy sú prítomné v lymfatických uzlinách vo vysokej koncentrácii.
Tilmanocept je makromolekula pozostávajúca z viacerých jednotiek kyseliny dietyléntriamínpentaoctovej
(DTPA) a manózy, pričom každá je synteticky pripojená na dextránovú kostru s molekulovou hmotnosťou
10 kDa. Manóza pôsobí ako substrát pre receptor a DTPA slúži ako chelačné činidlo na značenie technéciom
99mTc.Stredný priemer tilmanoceptu je 7 nm a táto malá molekulárna veľkosť umožňuje lepší prechod do lymfatických kanálov, čo vedie k rýchlemu a konzistentnému klírensu na mieste vpichu.
Po rekonštitúcii a značení sa Lymphoseek injektuje do tesnej blízkosti nádoru a používa sa pri zobrazovaní na detekciu gama žiarenia pred operáciou spolu so stacionárnou gama kamerou (scintigrafia), jednofotónovou emisnou počítačovou tomografiou (SPECT) alebo SPECT/počítačovou tomografiou
SPECT/CT a/alebo intraoperačne spolu s detekčnou gama sondou na lokalizáciu sentinelových lymfatických
uzlín v lymfatickej dráhe drénujúcej nádor.
V štúdiách in vitro sa preukázala špecifická a tesná väzba technécium 99mTc tilmanoceptu na ľudské receptory CD206 s afinitou k primárnemu väzbovému miestu s Kd = 2,76 x x 10-11 M. V klinických štúdiách fázy 1 sa približne 0,5 až 1,8 % dávky akumulovalo v drenážnych lymfatických uzlinách prostredníctvom špecifickej väzby po 30 minútach. Väzba technécium Tc 99m tilmanoceptu nie je závislá od typu alebo závažnosti nádoru.
Klinickáúčinnosť
V klinických štúdiách fázy 3 bol technécium 99mTc tilmanocept detegovateľný v sentinelových
lymfatických uzlinách do 10 minút. Podľa analýzy vonkajšieho zobrazovania s gama žiarením sa preukázalo, že technécium 99mTc tilmanocept sa zadržiava v rovnakých drenážnych lymfatických uzlinách až 30 hodín. U 100 % pacientov s melanómom, u 100 % pacientov s karcinómom skvamóznych buniek na hlave a krku
a u 82 % pacientiek s karcinómom prsníka sa pred operáciou uskutočnila lymfoscintigrafia. Celková miera
zhody medzi lokalizáciou lymfatických uzlín (na základe detekcie rádioaktivity) lymfoscintigrafiou pred operáciou a intraoperačným vyšetrením lymfatických uzlín bola 97,8 % pre všetkých pacientov.
V klinických štúdiách fázy 3 zahŕňajúcich pacientky s karcinómom prsníka mapovaným technécium Tc 99m tilmanoceptom aj farbivom živá modrá, technécium 99mTc tilmanocept bol podľa meta-analýzy pevných účinkov lokalizovaný u 99,91 % pacientiek s priemerne 2,08 lokalizovanými sentinelovými lymfatickými uzlinami na pacientku. Tieto miery boli významne vyššie (p<0,0001) v porovnaní s meta-analýzou náhodných účinkov vzhľadom na miery lokalizácie z publikovanej literatúry pre koloidné činidlá na mapovanie lymfatického systému používané v európskej klinickej praxi. Podľa meta-analýzy pevných účinkov zahŕňajúcej dve štúdie fázy 3 sa technécium Tc 99m tilmanocept lokalizovaný v 99,99 % vyoperovaných lymfatických uzlín zafarbil na modro farbivom živá modrá (zhoda). Alebo farbivo živá modrá lokalizované v 66,96 % vyoperovaných lymfatických uzlín bolo detegované technécium 99mTc tilmanoceptom (reverzná zhoda).
V klinických štúdiách fázy 3 zahŕňajúcich pacientov s melanómom mapovaným technécium 99mTc tilmanoceptom aj farbivom živá modrá, technécium 99mTc tilmanocept bol podľa meta-analýzy pevných účinkov lokalizovaný u 99,89 % pacientov s priemerne 2,30 lokalizovanými sentinelovými lymfatickými uzlinami na pacienta. Tieto miery boli významne vyššie (p<0,0001) v porovnaní s meta-analýzou náhodných účinkov vzhľadom na miery lokalizácie z publikovanej literatúry pre koloidné činidlá na mapovanie lymfatického systému používané v európskej klinickej praxi. Podľa meta-analýzy pevných účinkov zahŕňajúcej dve štúdie fázy 3 sa technécium 99mTc tilmanocept lokalizovaný v 99,99 % vyoperovaných lymfatických uzlín zafarbil na modro farbivom živá modrá (zhoda). Alebo farbivo živá modrá lokalizované
v 63,50% vyoperovaných lymfatických uzlín bolo detegované technécium 99mTc tilmanoceptom (reverzná
zhoda).
V jednej klinickej štúdii fázy 3 zahŕňajúcej pacientov s intraorálnym alebo kožným karcinómom skvamóznych buniek boli pomocou technécium 99mTctilmanoceptu lokalizované sentinelové lymfatické uzliny u 97,59 % pacientov, ktorí podstúpili hodnotenie lymfatických uzlín. Vo vzťahu k patologickému stavu súboru lymfatických uzlín po úplnom vyoperovaní lymfatických uzlín bol technécium 99mTc tilmanocept správne lokalizovaný v sentinelových lymfatických uzlinách, ktoré boli prediktívne pre prechovávanie metastatického nádoru u 38 pacientov z 39 pre falošne negatívnu mieru 2,56 %. Celková presnosť technécium 99mTc tilmanoceptu pri identifikácii skutočne pozitívnych a skutočne negatívnych pacientov vo vzťahu k patológii v lokalizovaných lymfatických uzlinách bola 98,80 %.
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Lymphoseekom v jednej alebo vo viacerých podskupinách pediatrickej populácie pre vizualizáciu lymfatickej drenáže solídnych malígnych nádorov na diagnostické účely (informácie o použití v pediatrickej populácii, pozri časť 4.2 ).
5.2. Farmakokinetické vlastnosti
Uskutočnili sa dve klinické skúšania fázy 1 zahŕňajúce pacientky s karcinómom prsníka a jedna štúdia fázy
1 zahŕňajúca pacientov s melanómom. Cieľom týchto štúdií bolo rádiofarmakokinetické hodnotenie
Lymphoseeku.
Distribúcia
V jednej štúdii fázy 1 zahŕňajúcej pacientky s karcinómom prsníka sa zistil rýchly klírens (konštanty rýchlosti eliminácie v rozsahu 0,222/h až 0,278/h) testovaného Lymphoseeku na mieste vpichu vo všetkých troch dávkach (4, 20 a 100 mikrogramov). Absorpcia technécium 99mTc tilmanoceptu v primárnej sentinelovej uzline sa zvýšila v závislosti od dávky (p=0,009): Injekcia Lymphoseeku v dávke 4, 20 a 100 mikrogramov viedla k hladinám technécium 99mTc tilmanoceptu v primárnej sentinelovej uzline (LSN) 0,09
± 0,20 pmólu, 6,53 ± 2,52 pmólu a 10,58 ± 8,43 pmólu. Percentuálna hodnota injikovanej dávky, ktorá sa dostala do primárnej sentinelovej uzliny (% IDSN) bola 0,05 % ± 0,10 % v skupine, ktorá dostala dávku Lymphoseeku 4 mikrogramy, 0,52 % ± 0,38 % v skupine, ktorá dostala dávku Lymphoseeku 20 mikrogramov a 0,21 % ± 0,17 % v skupine, ktorá dostala dávku Lymphoseeku100 mikrogramov. Plazmatická percentuálna hodnota ID na gram pre dve dávkové hladiny dosiahla maximum po 4 hodinách; priemerná hodnota pre dávku 4 mikrogramy bola 0,0090 %/g ± 0,0048 %/g a pre dávku 100 mikrogramov bola 0,0039 %/g ± 0,0046 %/g. Pri dávke 20 mikrogramov sa dosiahla maximálna hodnota po 2,5 hodinách s priemerným % ID/g 0,0023 %/g ± 0,0005 %/g.
V druhej štúdii fázy 1 zahŕňajúcej pacientky s karcinómom prsníka, v ktorej pacientky dostali injekciu Lymphoseeku v dávke 20 mikrogramov, konštanta priemernej rýchlosti eliminácie technécium 99mTc tilmanoceptu bola 0,299/h a polčas lieku na mieste vpichu bol 2,6 h. Percentuálna hodnota IDSN bola 1,68 %
± 1,22 % v skupine, ktorá dostala injekciu 3 hodiny pred operáciou a 1,81 % ± 2,19 % v skupine, ktorá dostala injekciu Lymphoseeku 16 hodín pred operáciou.
V štúdii fázy 1 zahŕňajúcej pacientov s melanómom sa Lymphoseek vo všetkých troch testovaných dávkach (20, 100 a 200 mikrogramov) eliminoval z miesta vpichu, pričom konštanty rýchlosti eliminácie boli v rozsahu 0,227/h až 0,396/h, čo viedlo k polčasu lieku na mieste vpichu 1,75 až 3,05 h. Absorpcia technécium
99mTctilmanoceptu v primárnej sentinelovej uzline sa zvýšila v závislosti od dávky: Podanie injekcie Lymphoseeku v dávke 20, 100 a 200 mikrogramov viedlo k hodnotám LSN 5,01 ± 8,02 pmólu, 17,5 ± 13,7 pmólu a 58,2 ± 41,2 pmólu technécium 99mTc tilmanoceptu. Percentuálna hodnota IDSN absorbovaného v primárnej lymfatickej uzline bola 0,50 % pre dávku 20 mikrogramov, 0,35 % pre dávku 100 mikrogramov a
0,58 % pre dávku 200 mikrogramov Lymphoseeku. Plazmatická percentuálna hodnota ID na gram pre dve dávkové hladiny dosiahla maximum po 15 minútach; priemerná hodnota pre dávku 20 mikrogramov bola
0,0104 %/g ± 0,0135 %/g a pre dávku 200 mikrogramov bola 0,0065 %/g ± 0,0082 %/g. Pri dávke
100 mikrogramov sa dosiahla maximálna hodnota po 1 a 2 hodinách s priemernou percentuálnou hodnotou ID/g 0,0018%/g ± 0,001%/g v každom časovom bode.
Eliminácia
Technécium 99mTc tilmanocept sa vylučuje najmä obličkami. Metabolizmus technécium 99mTc tilmanoceptu sa experimentálne neskúmal. Tilmanocept sa môže metabolizovať v pečeni na jednotlivé molekuly, najmä na dextrán (ktorý sa vylučuje obličkami a/alebo je ďalej metabolizovaný na glukózu), manózu (endogénny cukor) a kyselinu dietyléntriamínpentaoctovú (ktorá sa vylučuje obličkami). Tak ako
v prípade všetkých všeobecných metabolitov, najmä tých, u ktorých hrá merateľnú úlohu vylučovania pečeň,
technécium 99mTc tilmanocept sa v určitej miere pravdepodobne bude vylučovať aj žlčou.
Percentuálna hodnota ID pre pečeň, obličky a močový mechúr vypočítaná zo snímok celého tela u pacientiek s karcinómom prsníka po 1, 2,5, a 12 hodinách po podaní bola nižšia ako 2,6 % v každom časovom bode (všetky dávkové hladiny spolu). Percentuálna hodnota ID pre pečeň, obličky a močový mechúr vypočítaná
zo snímok celého tela v prípade pacientov s melanómom po 1 a 12 hodinách po podaní bola v rozsahu 1,1 %
až 3,1 % po 1 hodine a všetky hodnoty klesli do 12 hodín na menej ako 1 %.
5.3. Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity
po opakovanom podávaní a genotoxicity neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1. Zoznam pomocných látok
Dihydrát trehalózy, glycín (E640),
askorbát sodný (E301),
dihydrát chloridu cínatého (E512), hydroxid sodný (E524),
zriedená kyselina chlorovodíková (E507),
6.2. Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6 a 12.
6.3. Čas použiteľnosti
18 mesiacov.
Pooznačení rádioaktívnou látkou
6 hodín. Uchovávajte pri teplote neprevyšujúcej 25 °C. Uchovávajte s použitím príslušného tienenia proti žiareniu.
Z mikrobiologického hľadiska sa má liek použiť ihneď. Ak sa liek nepoužije ihneď, čas a podmienky uchovávania pred použitím sú na zodpovednosti používateľa.
6.4. Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 25 °C.
Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom. Podmienky na uchovávanie lieku po označení rádioaktívnou látkou, pozri časť 6.3.
Uchovávanie rádiofarmák má byť v súlade s vnútroštátnymi nariadeniami o rádioaktívnych látkach.
6.5. Druh obalu a obsah balenia
8ml injekčná liekovka zo skla typu I so zátkou z butylovej gumy uzavretá odlupovacím tesnením. Každá injekčná liekovka obsahuje 50 mikrogramov tilmanoceptu.
Veľkosť balenia: 1 a 5 injekčných liekoviek.
6.6. Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všeobecnéupozornenie
Rádiofarmaká môžu preberať, používať a podávať len schválené osoby v stanovených klinických
podmienkach. Ich prevzatie, uchovávanie, používanie, prenos a likvidácia podliehajú nariadeniam a/alebo
príslušným povoleniam príslušnej oficiálnej organizácie.
Rádiofarmaká sa majú pripravovať spôsobom, ktorý zodpovedá požiadavkám na bezpečnosť radiácie
a kvality lieku. Musia byť dodržané príslušné aseptické opatrenia.
Obsah injekčnej liekovky je určený len na použitie pri príprave lieku Lymphoseek a jeho označení rádioaktívnou látkou a nie na priame podanie pacientovi bez postupu prípravy pacienta. Každá 50- mikrogramová injekčná liekovka obsahuje dodatočnémnožstvo zaručujúce, že možno podať 50 mikrogramov tilmanoceptu. Vyžadujesa však pripraviť injekčnú liekovku podľa pokynov a v dávke pre jedného pacienta použiť alikvótnu časť 50 mikrogramov; zvyšná látka po rekonštitúcii a použití sa má zlikvidovať, pozri časť
12.
Pokyny na rekonštitúciu a označenie lieku rádioaktívnou látkou pred podaním, pozri časť 12. Liek označený rádioaktívnou látkou je číry bezfarebný roztok bez viditeľných častíc.
Ak počas prípravy tohto lieku spozorujete, že celistvosť tejto injekčnej liekovky je porušená, liek sa nesmie použiť.
Postup podávania lieku sa má uskutočniť tak, aby sa minimalizovalo riziko kontaminácie lieku a ožiarenie
pracovníkov. Je povinné primerané tienenie.
Obsah súpravy pred prípravou podľa pokynov nie je rádioaktívny. Po pridaní pertechnetátu sodného (99mTc)
podľa Európskeho liekopisu sa však musí zachovať primerané tienenie finálneho prípravku.
Pri podávaní rádiofarmák vzniká riziko vonkajšieho ožiarenia ďalších osôb alebo kontaminácie zapríčinenej vyliatím moču, zvratkov atď. Preto sa musia dodržiavať opatrenia na ochranu pred žiarením v súlade
s vnútroštátnymi nariadeniami.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Norgine B.V. Hogehilweg 7
1101CA Amsterdam
Holandsko
8. REGISTRAČNÉ ČÍSLO
EU/1/14/955/002
EU/1/14/955/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
19. novembra 2014
10. DÁTUM REVÍZIE TEXTU
11. DOZIMETRIA
Technécium (99mTc) sa vyrába pomocou (99Mo/99mTc) generátora a pri emitovaní gama žiarenia s priemernou energiou 140 keV a polčasom 6,02 hodiny sa rozpadá na technécium (99mTc), ktoré sa vzhľadom na dlhý polčas 2,13 x 105 rokov môže pokladať za kvázistabilné.
Odhadnutá dávka žiarenia pre niektoré orgány je založená na referenčných hodnotách MIRD a S-hodnotách
MIRD a bola vypočítaná z biologických údajov o absorpcii v orgánoch a vylúčení z krvi.
Dávky žiarenia v orgánoch a tkanivách priemerného pacienta (70 kg) na MBq Lymphoseeku značeného rádioaktívnou látkou sú uvedené v tabuľke 1 a tabuľke 2.
Tabuľka 1. Odhadnutá dávka absorbovaná z Lymphoseeku u pacientiek s karcinómom prsníkaaOdhadnutá dávka absorbovaného žiarenia pre karcinóm prsníka, mGy/MBqCieľový orgán Dospelí mozog 0,0002 prsník (miesto vpichu) 0,0897 stena žlčníka 0,0019 stena dolnej časti hrubého čreva 0,0007 tenké črevo 0,0005 žalúdok 0,0010 stena hornej časti hrubého čreva 0,0007 oblička 0,0101 pečeň 0,0018 pľúca 0,0020 sval 0,0005 vaječníky 0,0101 červená dreň 0,0007 kosť 0,0010 slezina 0,0015 semenníky 0,0027 týmus 0,0063 štítna žľaza 0,0048 močový mechúr 0,0032 celé telo (krv)b 0,0011
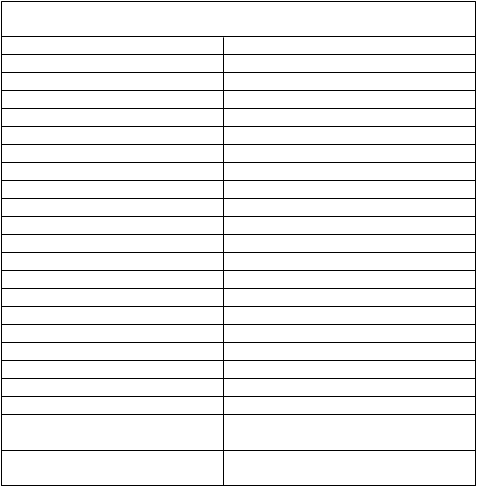 Účinná dávka (E)(muži, mSv/MBq)
Účinná dávka (E)(muži, mSv/MBq) 0,01600
Účinná dávka (E)(ženy, mSv/MBq) 0,01785
a Vypočítané z údajov od 18 pacientiek s karcinómom prsníka, ktoré dostali štyri injekcie
Lymphoseeku v dávke 4, 20 a 100 mikrogramov do okolia nádoru.
b Krv predstavuje expozíciu celého tela oddelene od nezávislých meraní iných orgánov a tkanív.
Tabuľka 2. Odhadnutá dávka absorbovaná z Lymphoseeku u pacientov s melanómoma Odhadnutá dávka absorbovaného žiarenia pre melanóm, mGy/MBq Cieľový orgán Dospelí s melanómom
Odhadnutá dávka absorbovaného žiarenia pre melanóm, mGy/MBq Cieľový orgán Dospelí s melanómom mozog 0,0050
prsník (miesto vpichu) 0,0427 stena žlčníka 0,0038 stena dolnej časti hrubého čreva 0,0031 tenké črevo 0,0032 žalúdok 0,0030 stena hornej časti hrubého čreva 0,0031 oblička 0,0150
pečeň 0,0050 pľúca 0,0032 sval 0,0024 vaječníky 0,0162 červená dreň 0,0027 kosť 0,0047 slezina 0,0032 semenníky 0,0056 týmus 0,0031 štítna žľaza 0,0025 močový mechúr 0,0076 celé telo (krv)b 0,0030
 Účinná dávka (E)(muži, mSv/MBq)
Účinná dávka (E)(muži, mSv/MBq) 0,01094
Účinná dávka (E)(ženy, mSv/MBq) 0,01357
a Vypočítané z údajov od 18 pacientov s melanómom, ktorí dostali štyri intradermálne injekcie
Lymphoseeku v dávke 20, 100 a 200 mikrogramov.'
b Krv predstavuje expozíciu celého tela oddelene od nezávislých meraní iných orgánov a tkanív.
12. POKYNY NA PRÍPRAVU RÁDIOFARMÁKRadiačnábezpečnosť–manipulácia s liekomPri manipulácii s Lymphoseekom používajte nepremokavé rukavice, účinné tienenie žiarenia a príslušné bezpečnostné opatrenia, aby ste zabránili zbytočnej expozícii žiareniu u pacienta, pracovníkov, personálu kliniky a ďalších osôb.
Rádiofarmaká majú používať zdravotnícki pracovníci, ktorí sú kvalifikovaní na základe konkrétneho
školenia a skúseností s bezpečným používaním a manipuláciou rádionuklidov, alebo sa majú používať
pod dohľadom zdravotníckych pracovníkov, ktorých skúsenosti a školenie boli schválené príslušnou vládnou
agentúrou, ktorá má oprávnenie povoľovať používanie rádionuklidov.
Pokyny na značenie tilmanoceptu, prášok 50 mikrogramov v injekčnej liekovke, rádioaktívnou látkoutechnécium 99mTcvšeobecnéaspektyZložky injekčnej liekovky v súprave sú sterilné, nepyrogénne a sú určené výlučne na použitie pri príprave
Lymphoseeku. Nepodávajte nepripravené zložky injekčnej liekovky v súprave priamo pacientovi.
Počas prípravy a podávania dodržiavajte aseptické postupy.
Počas prípravy a podávania dodržiavajte príslušné opatrenia radiačnej bezpečnosti. Pri použití Lymphoseeku
značeného rádioaktívnou látkou používajte tienenie žiarenia, aby ste zabránili expozícii žiareniu.
Použite len eluát z generátora pre technécium 99mTc, ktorý bol predtým eluovaný 8 hodín. Na dosiahnutie
najvyššej rádiochemickej čistoty rekonštituujte práve eluovaný eluát z generátora pre technécium 99mTc.
Reakcie označovania technéciom 99mTc závisia od zachovania iónu cínu v redukovanom
stave.Na rekonštitúciu tejto súpravy sa nemá použiť injekcia pertechnetátu sodného (99mTc) obsahujúca oxidanty. Injekčné liekovky sú utesnené pod dusíkom; vzduch alebo kyslík je pre obsah injekčnej liekovky škodlivý a injekčná liekovka sa preto nemá odvzdušňovať.
Lymphoseek, injekčný roztok značený rádioaktívnou látkou, sa má použiť do 6 hodín po rekonštitúcii.Dávka nesmie v čase podania obsahovať nižšiu úroveň rádioaktivity 99mTc, ako je stanovená úroveň, pre operáciu uskutočnenú v ten istý deň (18,5 MBq) alebo pre operáciu uskutočnenú na nasledujúci deň (74 MBq).
U
r
čenie
i
n
j
ekčných objemov
Lymphoseek sa môže pacientovi podať ako jedna injekcia alebo ako viac injekcií. Pred prípravou určte metódu plánovanej injekcie a počet injekcií, ktoré sa použijú pre daného pacienta. Pre každú injekciu pripravte samostatnú injekčnú striekačku. Na základe plánovaného počtu injekčných striekačiek
a plánovaného celkového injekčného objemu na pacienta určte (z tabuľky 3 uvedenej ďalej) objem rekonštituovanej injekčnej liekovky s Lymphoseekom značeným rádioaktívnou látkou.
Každá injekčná liekovka obsahujúca Lymphoseek, rekonštituovaná a značená rádioaktívnou látkou, má obsahovať 50 mikrogramov lieku s dodatočným množstvom, keď je liek pripravený podľa pokynov a podávaný tak, ako sa uvádza v tabuľke 3. Dodatočné množstvo je 12,5 mikrogramu, ktoréumožňuje dosiahnuť rádiochemickú čistotu testovania a zaručuje, že možno podať 50 mikrogramov tilmanoceptu. Jednému pacientovi sa nemá podať celý obsah injekčnej liekovky. Liek značený rádioaktívnou látkou sa má použiť do 6 hodín po príprave. Nepoužitý liek zlikvidujte.
Tabuľka 3: Injekcie Lymphoseeku podľa objemu injekcie
P
o
t
rebný počet
i
njekcií
C
elkový objem, ktorý sa
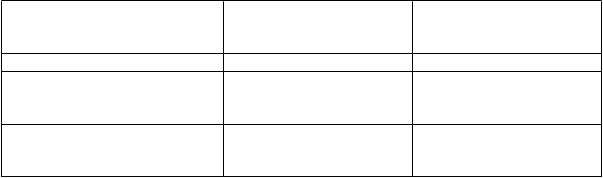 m
á injikovať
C
elkový rekonštitučný objem v injekčnej liekovke obsahujúcej Lymphoseek
m
á injikovať
C
elkový rekonštitučný objem v injekčnej liekovke obsahujúcej Lymphoseek
injekcia 1 x 0,1 ml 0,1 ml 0,125 ml injekcie 5 x 0,1 ml alebo
injekcie 2 x 0,25 ml alebo
injekcia 1 x 0,5 ml injekcie 5 x 0,2 ml alebo injekcie 4 x 0,25 ml alebo injekcie 2 x 0,5 ml
0,5 ml 0,625 ml
1,0 ml 1,25 ml
Spôsob podávania
Príprava roztoku Lymphoseeku značeného rádioaktívnou látkou na injekciu zo súpravy sa vykonáva
pomocou tohtoaseptického postupu:
a. Pred značením rádioaktívnou látkou skontrolujte injekčnú liekovku obsahujúcu prášok tilmanoceptu, či nie je poškodená. Liek nepoužívajte, ak sa zdá, že celistvosť injekčnej liekovky je porušená.
b. Na značenie rádioaktívnou látkou použite roztok pertechnetátu sodného (99mTc) z generátora pre technécium 99mTc do 8 hodín po elúcii.
c. Injekčnú liekovku obsahujúcu prášok tilmanoceptu neodvzdušňujte pred značením alebo počas značovania rádioaktívnou látkou.
d. Pomocou sterilnej injekčnej striekačky asepticky odoberte približne 23,1 MBq alebo 92,5 MBq roztoku
pertechnetátu sodného (99mTc) buď v objeme asi 0,125 ml (pre objem rekonštituovanej injekčnej liekovky 0,125 ml) alebo v objeme asi 0,5 ml (pre objem rekonštituovanej injekčnej liekovky 0,625 ml alebo 1,25 ml). Otestujte injekčnú striekačku na rádioaktivitu technécia 99mTc v kalibrátore dávky.
e. Pred značením rádioaktívnou látkou zaznamenajte na určené miesto na štítku injekčnej liekovky
s rádioaktívnym liekom množstvo rádioaktivity, objem rekonštituovanej injekčnej liekovky, dátum a čas, čas exspirácie a číslo šarže a štítok nalepte na injekčnú liekovku s práškom tilmanoceptu. Injekčnú
liekovku umiestnite pod radiačný štít a septum vydezinfikujte alkoholom.
f. Do injekčnej liekovky s práškom tilmanoceptu pridajte za aseptických podmienok roztok pertechnetátu
sodného (99mTc) (z kroku d) uvedeného vyššie). Odoberte rovnaký objem plynu v hornej časti
bez vytiahnutia ihly. Neodvzdušňujte.
g. Vytiahnite ihlu, injekčnú liekovku jemne vírte, aby sa obsah premiešal a potom ju nechajte pri izbovej
teplote stáť najmenej 15 minút.
h. K lieku značenému rádioaktívnou látkou v injekčnej liekovke s práškom tilmanoceptu pridajte
za aseptických podmienok sterilný injekčný roztok chloridu sodného 9 mg/ml (0,9 %), ak je to potrebné,
aby ste doplnili objem rekonštituovanej injekčnej liekovky 0,125 ml, 0,625 ml alebo 1,25 ml pred naplnením dávky pre pacienta do injekčnej striekačky (striekačiek). Na normalizovanie tlaku odoberte rovnaký objem plynu v hornej časti.
i. Otestujte injekčnú liekovku značenú rádioaktívnou látkou na celkovú rádioaktivitu pomocou kalibrátora dávky. Na štítok štítu, ktorý je súčasťou súpravy, zaznamenajte koncentráciu rádioaktivity
technécia 99mTc, celkový objem, čas a dátum testovania, čas exspirácie a číšlo šarže. Štítok nalepte na štít.
j. Stanovte rádiochemickú čistotu lieku značeného rádioaktívnou látkou, ako sa uvádza ďalej.
k. Odoberte potrebný objem lieku značeného rádioaktívnou látkou do príslušného počtu injekčných striekačiek. Otestujte injekčnú striekačku (striekačky) v kalibrátore dávky. Na štítok injekčnej striekačky zaznamenajte množstvo rádioaktivity, dátum a čas testovania, objem a čas exspirácie (ktorý nemá prekročiť 6 hodín od času prípravy) a štítok nalepte na injekčnú striekačku (striekačky).
l. Liek značený rádioaktívnou látkou uchovávajte pod štítom. Uchovávajte pri teplote neprevyšujúcej 25 °C.
Spotrebujte do času exspirácie uvedenom na štítku.
Stanovenie rádiochemickejčistotyLymphoseeku značenéhorádioaktívnoulátkou Stanovte rádiochemickú čistotu Lymphoseeku značeného rádioaktívnou látkou instantnou tenkovrstvovou chromatografiou (ITLC) s použitím papiera Whatman č. 1, 3MM, 31ET Chr alebo Biodex 150-001, červené prúžky (celulózový chromatografický papier) pomocou nasledujúcej metódy:
a. Označte ceruzkou na chromatografickom papieri líniu začiatku, stredu a čela rozpúšťadla, ako je uvedené ďalej:
Čelo rozpúšťadla
Stred
Začiatok
1 cm odspodu
Whatman č. 1, 3MM,
Chromatografický prúžok 31ET
Biodex 150-001, červené
prúžky
b. Kvapnite malú kvapku (3 - 10 mikrolitrov) lieku značeného rádioaktívnou látkou do stredu na línii
začiatku na chromatografickom prúžku.
c. Umiestnite prúžok do chromatografickej komory obsahujúcej 1 ml acetónu ako vyvíjacieho rozpúšťadla.
Umožnite, aby rozpúšťadlo migrovalo k čelu rozpúšťadla (5 cm odspodu Whatmanových prúžkov
a 3,5 cm pre prúžok Biodex). Vyberte prúžok z komory, nechajte ho vyschnúť a v polovici prestrihnite.
Na každej polovici prúžku odmerajte rádioaktivitu príslušným prístrojom na meranie rádioaktivity
(kalibrátor dávky alebo multikanálový analyzátor).
d. Vypočítajte percento rádiochemickej čistoty (% RCP) takto:

% RCP =
Rádioaktivita v dolnej polovici
Rádioaktivita v dolnej polovici +
rádioaktivita v hornej polovici
x 100
e. Nepoužívajte Lymphoseek označený rádioaktívnou látkou, ak je rádiochemická čistota nižšia ako 90 %.
Získavanie snímok/mapovanie sentinelových lymfatických uzlín
Použitia u dospelých s karcinómom prsníka, melanómom a karcinómom skvamóznych buniek v ústnej dutine:
· V klinických štúdiách pacienti dostali Lymphoseek až 30 hodín pred operáciou. Na identifikáciu sentinelových lymfatických uzlín lokalizáciou technécia 99mTc bol použitý ručný gama čítač (ktorý predstavuje akákoľvek ručná sonda na detekciu gama žiarenia). V klinických štúdiách s Lymphoseekom
skúšajúci štúdie použili prahové pravidlo pre pozitívnu lokalizáciu technécia 99mTc, ktorá bola odhadnutá pomocou rádioaktivity pozadia plus tri štandardné odchýlky od priemernej úrovne rádioaktivity pozadia (t. j.
pravidlo tri sigma, čo predstavuje > 99,7 % pravdepodobného rozdielu oproti pozadiu) [pozri tabuľku 4]. Rádioaktivita pozadia bola zvyčajne stanovená z tkaniva, ktoré bolo
od miesta vpichu vzdialené najmenej 20 centimetrov.
Tabuľka 4: Príklad prahového pravidla tri sigmaRádiaoktivita pozadiaa Prahová hodnota tri sigma5 11,71
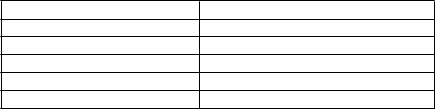
10 19,49
15 26,62
20 33,42
25 40,00
a Priemer troch 2-sekundových signálov alebo jedného 10-sekundového signálu
· Všetky činidlá na mapovanie lymfatického systému využívajú na distribúciu prvky lymfatického systému. Zobrazovanie a detekcia sentinelových lymfatických uzlín pomocou Lymphoseeku závisia od zacielenia na špecifické molekuly a naviazania na retikuloendoteliálne bunky v lymfatických uzlinách. Deformácia architektúry a zmena funkcie základného lymfatického systému predchádzajúcou rozsiahlou operáciou, ožarovaním alebo metastatickým ochorením môže viesť k zníženej lokalizácii lieku Lymphoseek v lymfatických uzlinách. Miera lokalizácie (percento všetkých pacientov najmenej s jednou horúcou uzlinou) a stupeň lokalizácie (priemerný počet horúcich uzlín na pacienta) pri použití lieku Lymphoseek na základe klinických štúdií nezávisí od metódy podania injekcie rádiofarmaka. Použitie Lymphoseeku je určené na doplnenie palpačného a vizuálneho vyšetrenia a iných postupov dôležitých na lokalizáciu lymfatických uzlín. Intraoperačné mapovanie lymfatického systému detekciou gama žiarenia sa môže začať už 15 minút po podaní injekcie a do 30 hodín (pri operácii na nasledujúci deň) po podaní Lymphoseeku.
· Po podaní injekcie Lymphoseeku sa môže uskutočniť vonkajšie zobrazovanie detekciou gama žiarenia.
Odporúčaný čas predoperačného zobrazovania je 15 minút po podaní injekcie, ale môže sa začať už po
10 minútach. Účinné predoperačné zobrazovacie postupy zahŕňajú planárnu scintigrafiu s použitím gama kamery, SPECT a SPECT/CT. Hoci tieto postupy dopĺňajú intraoperačné vyšetrenie gama sondou, takto získané snímky sa nemajú považovať za náhradu hĺbkového a dôkladného intraoperačného vyšetrenia ručnou gama sondou na detekciu žiarenia.
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.