Nepoužívajte, ak je blister porušený alebo otvorený. Nezaveďte po dátume exspirácie, ktorý je uvedený na vonkajšom obale a blistri za nápisom EXP.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Kyleena sa dodáva spolu s pripomienkovou kartou pre pacientku, ktorá je vložená vo vonkajšej škatuľke.
Po zavedení pripomienkovú kartu pre pacientku vyplňte a odovzdajte ju používateľke.
Príprava na zavedenie- Vyšetrite pacientku, aby ste určili veľkosť a polohu maternice s cieľom zistiť akékoľvek prejavy akútnych infekcií pohlavných orgánov alebo iné kontraindikácie na zavedenie Kyleeny. Ak nie je možné vylúčiť graviditu, je nutné vykonať tehotenský test.
- Na vizualizáciu cervixu zaveďte pošvové zrkadlo a potom dôkladne dezinfikujte cervix a pošvu vhodným antiseptickým roztokom.
- V prípade potreby využite pomoc zdravotnej sestry.
- Predný pysk cervixu zachyťte do peánu alebo iných klieští na stabilizáciu maternice. Ak je fixovaná retroverzia maternice môže byť vhodnejšie zachytiť zadný pysk cervixu. Môže sa použiť jemný ťah na kliešte, aby sa vyrovnal cervikálny kanál. Kliešte majú zostať v tejto polohe a má sa udržiavať jemný vyvažujúci ťah počas celého priebehu zavedenia.
- Cez cervikálny kanál zaveďte uterinnú sondu do dutiny maternice až po fundus na zmeranie hĺbky a potvrdenie smeru dutiny maternice a na vylúčenie akýchkoľvek známok intrauterinných abnormalít (napr. septa, submukóznych myómov) alebo predtým zavedenej intrauterinnej antikoncepcie, ktorá sa neodstránila. Ak sa objavia ťažkosti, zvážte dilatáciu kanála. Ak sa vyžaduje dilatácia kanála krčka maternice, zvážte použite analgézie a/alebo paracervikálneho bloku.
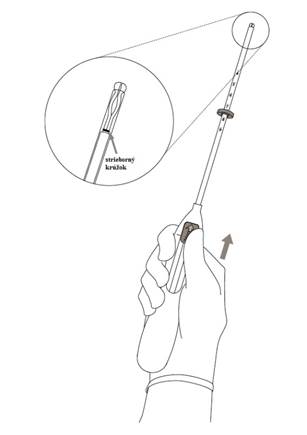
Zavedenie 2. Zatlačte posúvač dopredu v smere šípky do najvzdialenejšej polohy, aby ste umiestnili Kyleenu do zavádzacej trubičky (Obrázok 2).
| 
|
UPOZORNENIE! Nezatláčajte posúvač smerom nadol, pretože to môže predčasne uvoľniť Kyleenu. Ak sa Kyleena uvoľní, nebude možné ju zaviesť.
|
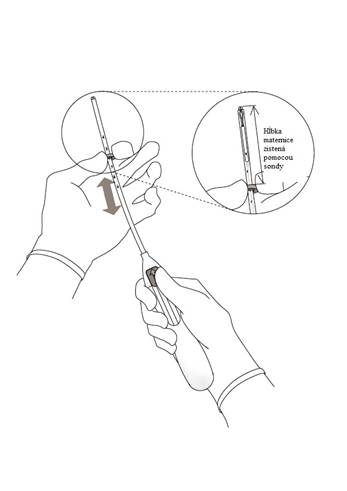
3. Držte posúvač v najvzdialenejšej polohe, nastavte horný koniec indikátora, aby zodpovedal hĺbke maternice zistenej pomocou sondy (Obrázok 3).
| 
|
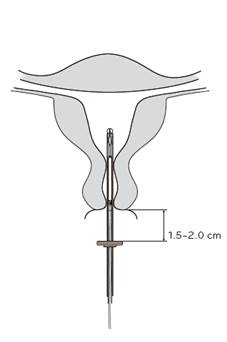
4. Počas držania posúvača v najvzdialenejšej polohe, zasuňte zavádzač cez kanál krčka maternice do maternice, až kým indikátor nie je vo vzdialenosti asi 1,5‑2 cm od krčka maternice (Obrázok 4).
| 
|
UPOZORNENIE! Zavádzač nezasúvajte nasilu! V prípade potreby dilatujte kanál krčka maternice.
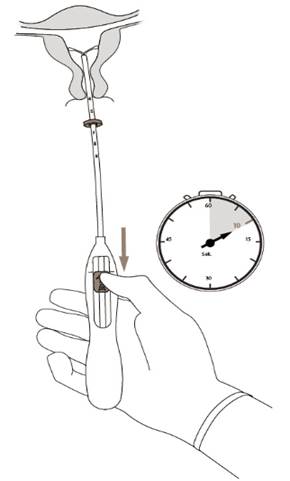
5. Počas držania zavádzača v stabilnej polohe stiahnite posúvač po značku, aby sa otvorili horizontálne ramienka Kyleeny (Obrázok 5). Počkajte 5-10 sekúnd, aby sa horizontálne ramienka úplne otvorili.
| 
|
6. Jemne zasuňte zavádzač smerom k fundu maternice, kým sa indikátor nedotkne krčka maternice. Kyleena sa teraz dotýka dna maternice (Obrázok 6).
| 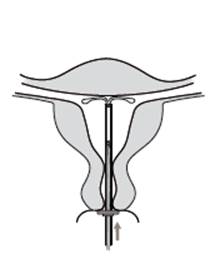
|
7. Držiac zavádzač v tejto polohe, uvoľnite Kyleenu zatiahnutím posúvača úplne nadol (Obrázok 7). Pokým držíte posúvač zatiahnutý úplne nadol, zavádzač jemne vytiahnite von. Vlákna odstrihnite a ponechajte asi 2-3 cm viditeľné mimo krčka maternice.
| 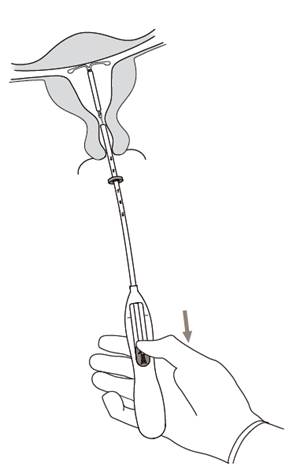
|
UPOZORNENIE! Ak máte podozrenie, že inzert nie je v správnej polohe, skontrolujte polohu (napr. pomocou ultrazvuku). Ak inzert nie je úplne umiestnený v dutine maternice, odstráňte ho. Odstránený systém sa nesmie opätovne zaviesť.
|
Odstránenie / výmenaOdstránenie / výmenu si pozrite v časti 4.2
Zavedenie a odstránenie / výmena.
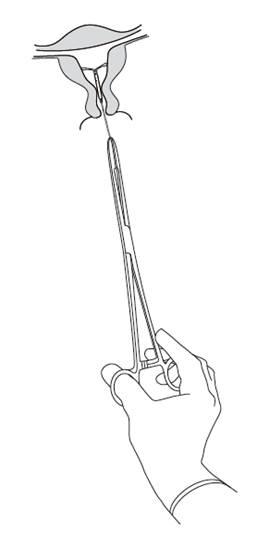
Kyleena sa odstraňuje ťahom za vlákna kliešťami (Obrázok 8).
Novú Kyleenu môžete zaviesť okamžite po odstránení.
Po odstránení Kyleeny treba skontrolovať, či je systém neporušený.
| 
|
4.3 Kontraindikácie· Gravidita (pozri časť 4.6);
· Akútne alebo opakujúce sa zápalové ochorenie panvy alebo stavy súvisiace so zvýšeným rizikom vzniku infekcií panvy;
· Akútna cervicitída alebo vaginitída;
· Popôrodná endometritída alebo infikovaný potrat v priebehu posledných troch mesiacov;
· Cervikálna intraepiteliálna neoplázia, pokiaľ sa nevylieči;
· Zhubný nádor maternice alebo krčku maternice;
· Nádory citlivé na gestagén, napr. rakovina prsníka;
· Diagnosticky neobjasnené abnormálne vaginálne krvácanie;
· Vrodené alebo získane anomálie maternice vrátane myómov, ktoré môžu prekážať pri zavedení a/alebo udržaní intrauterinného inzertu (napr. ak deformujú dutinu maternice);
· Akútne ochorenie pečene alebo nádor pečene;
· Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníPri nasledovných stavoch alebo ak sa tieto stavy objavia po prvýkrát, sa má Kyleena použiť s opatrnosťou po konzultácii so špecialistom alebo sa má zvážiť odstránenie inzertu:
· migréna, fokálna migréna s asymetrickou stratou zraku alebo iné symptómy indikujúce prechodnú cerebrálnu ischémiu,
· nezvyčajne silné bolesti hlavy
· žltačka
· výrazné zvýšenie krvného tlaku
· závažné arteriálne ochorenie, ako je cievna mozgová príhoda alebo infarkt myokardu
Nízka dávka levonorgestrelu môže ovplyvniť znášanlivosť glukózy a u diabetických pacientok, ktoré používajú Kyleenu, sa má sledovať koncentrácia glukózy v krvi. Vo všeobecnosti sa však nevyžaduje zmeniť terapeutický režim u diabetických pacientok, ktoré používajú IUS s obsahom levonorgestrelu.
Lekárske vyšetrenie / konzultáciaPred zavedením musí byť pacientka informovaná o prínosoch a rizikách Kyleeny, zahŕňajúcich prejavy a príznaky perforácie a riziko ektopickej gravidity, pozri nižšie. Má sa vykonať lekárske vyšetrenie vrátane vyšetrenia panvy a prsníkov. V prípade potreby, podľa uváženia zdravotníckeho pracovníka, sa má vykonať ster z krčka maternice. Má sa vylúčiť gravidita a choroby prenosné pohlavným stykom. Pred zavedením sa musia úspešne vyliečiť infekcie pohlavných orgánov. Má sa určiť poloha maternice a veľkosť dutiny maternice. Mimoriadne dôležité je správne umiestnenie Kyleeny na dne maternice, aby sa maximalizovala účinnosť a znížilo sa riziko vypudenia. Pokyny na zavedenie sa majú dôsledne dodržiavať.
Dôraz sa má klásť na nácvik správnej techniky zavedenia.
Zavedenie a odstránenie sa môže spájať s určitou bolesťou a krvácaním. Postup môže vyvolať vazovagálnu reakciu (napr. mdloby alebo u epileptičiek záchvat).
Pacientka sa má opätovne vyšetriť 4 až 6 týždňov po zavedení, aby sa skontrolovali vlákna a na ubezpečenie, že inzert je na správnom mieste. Kontrolné vyšetrenia sa potom odporúčajú raz ročne, alebo častejšie, ak je vyšetrenie klinicky indikované.
Kyleena nie je vhodná na použitie ako postkoitálna antikoncepcia.
Použitie Kyleeny na liečbu silného menštruačného krvácania alebo na ochranu pred hyperpláziou endometria, počas substitučnej liečby estrogénmi sa nestanovilo. Preto sa neodporúča jej použitie pri týchto stavoch.
Mimomaternicová graviditaV klinických skúšaniach bol celkový výskyt mimomaternicovej gravidity pri používaní Kyleeny približne 0,20 na 100 ženských rokov. Približne polovica gravidít, ktoré nastanú počas používania Kyleeny sú pravdepodobne mimomaternicové gravidity.
Ženy, ktoré zvažujú používanie Kyleeny majú byť poučené ohľadom prejavov, symptómov a rizík mimomaternicovej gravidity. U žien, ktoré otehotnejú pri používaní Kyleeny, je potrebné zvážiť a zhodnotiť možnosť výskytu mimomaternicovej gravidity.
Ženy s anamnézou mimomaternicovej gravidity, chirurgického zákroku na vajcovodoch, alebo po infekcii panvových orgánov majú zvýšené riziko mimomaternicovej gravidity. Možnosť výskytu mimomaternicovej gravidity je potrebné zvážiť v prípade bolestí v hypogastriu, hlavne v súvislosti s vynechaním menštruácie, alebo ak žena s amenoreou začne krvácať.
Keďže mimomaternicová gravidita môže mať dopad na fertilitu, je potrebné na individuálnom podklade starostlivo zvážiť prínosy a riziká používania Kyleeny.
Vplyv na menštruačné krvácanieU väčšiny používateliek Kyleeny sa očakáva vplyv na charakter menštruačného krvácania. Tieto zmeny sú výsledkom priameho účinku levonorgestrelu na endometrium a nemusia súvisieť s činnosťou vaječníkov.
Počas prvých mesiacov používania je bežné nepravidelné krvácanie a špinenie. Následne má silná supresia endometria za následok skrátenie dĺžky a zníženie intenzity menštruačného krvácania počas používania Kyleeny. Slabé krvácanie vedie často až do oligomenorey alebo amenorey.
V klinických skúšaniach sa postupne vyvinulo zriedkavé krvácanie a/alebo amenorea. Do konca piateho roku u 26,4 % a 22,6 % používateliek vyvinulo zriedkavé krvácanie a/alebo amenorea Ak sa menštruácia nedostaví počas šiestich týždňov od začiatku predchádzajúcej menštruácie, má sa zvážiť, či nedošlo k otehotneniu. Opakovaný tehotenský test nie je nevyhnutný u pacientok s pretrvávajúcou amenoreou, ak o gravidite nesvedčia ďalšie prejavy.
Ak sa krvácanie zosilní a/alebo sa postupom času stane nepravidelnejšie, majú sa vykonať náležité diagnostické opatrenia, keďže nepravidelné krvácanie môže byť symptómom endometriálnych polypov, hyperplázie alebo rakoviny a silné krvácanie môže byť prejavom nepozorovaného vypudenia IUS.
Infekcia panvyInfekcie panvy sa hlásili počas používania ktoréhokoľvek IUS alebo IUD (intrauterinného telieska). I keď Kyleena a zavádzač ako také, sú sterilné, z dôvodu bakteriálnej kontaminácie počas zavedenia sa môžu stať nosičom baktérií do horného pohlavného traktu. V klinických skúšaniach sa zápalové ochorenie panvy (pelvic in flammatory disease - PID) pozorovalo častejšie na začiatku používania Kyleeny, čo je v súlade s publikovanými údajmi pre medené IUD, pri ktorých sa najvyššia miera PID vyskytuje počas prvých 3 týždňov po zavedení a následne klesá.
Pred rozhodnutím sa pre Kyleenu je treba u pacientok dôkladne zhodnotiť rizikové faktory súvisiace s infekciou panvy (napr. viacerí sexuálni partneri, infekcie prenosné pohlavným stykom, PID v predchádzajúcej anamnéze). Infekcie panvy, ako je PID môžu mať závažné následky a môžu narušiť fertilitu a zvýšiť riziko ektopickej gravidity.
Rovnako ako u iných gynekologických alebo chirurgických zákrokov, môže sa po zavedení IUD objaviť (hoci mimoriadne zriedkavo) závažná infekcia alebo sepsa (vrátane sepsy, spôsobenej streptokokmi skupiny A).
Ak sa u ženy opätovne objavuje endometritída alebo zápalové ochorenie panvy alebo ak je akútna infekcia závažná alebo neodpovedá na liečbu, Kyleena sa musí odstrániť.
Indikujú sa bakteriologické vyšetrenia a odporúča sa sledovanie, dokonca aj pri miernych symptómoch naznačujúcich infekcie.
Vypudenie inzertuV klinických skúšaniach s Kyleenou bol výskyt vypudenia inzertu nízky a v rovnakom rozsahu ako výskyt, ktorý sa hlásil pri iných IUD a IUS. Symptómy čiastočného alebo úplného vypudenia Kyleeny môžu zahŕňať krvácanie alebo bolesť. K čiastočnému alebo úplnému vypudeniu inzertu však môže dôjsť aj bez vedomia ženy, čo vedie k poklesu alebo k strate antikoncepčnej ochrany. Keďže Kyleena zvyčajne postupom času znižuje výskyt menštruačného krvácania, môže zvýšenie menštruačného krvácania nasvedčovať vypudeniu.
Čiastočne vypudená Kyleena sa má odstrániť. Súčasne sa môže zaviesť nový inzert, pod podmienkou, že sa vylúčila gravidita.
Žena má byť poučená ako kontrolovať vlákna Kyleeny a aby kontaktovala svojho lekára, ak vlákna nemôže nahmatať.
PerforáciaAj keď nemusí byť ihneď spozorovaná, môže nastať perforácia alebo penetrácia tela alebo krčka maternice intrauterinnou antikoncepciou, najčastejšie počas zavedenia, čím sa môže znížiť účinnosť Kyleeny. V prípade obtiažneho zavedenia a/alebo nezvyčajnej bolesti či krvácania počas alebo po zavedení sa musia okamžite vykonať náležité kroky, ako je lekárske vyšetrenie a ultrazvuk, aby sa vylúčila perforácia. Takýto inzert sa musí odstrániť a môže byť potrebný chirurgický zákrok.
Vo veľkej prospektívnej porovnávacej neintervenčnej kohortovej štúdii, ktorá sa uskutočnila na používateľkách iných IUD (N=61,448 žien), bola incidencia perforácií na 1000 zavedení pre celú študovanú kohortu 1,3 (95% interval spoľahlivosti, 1,1-1,6), na 1 000 zavedení pre kohortu iných IUS s obsahom levonorgestrelu 1,4 (95% interval spoľahlivosti, 1,1-1,8) a na 1 000 zavedení pre kohortu medených IUD 1,1 (95% interval spoľahlivosti, 0,7-1,6).
Štúdia preukázala, že dojčenie v čase zavedenia, a zavedenie do 36 týždňov od pôrodu sa spája so zvýšeným rizikom perforácie (pozri Tabuľku 1). Tieto rizikové faktory boli nezávislé od typu použitého IUD.
Tabuľka 1: Incidencia perforácií na 1 000 zavedení pre celú kohortu, rozčlenená podľa dojčenia a obdobia uplynulého od pôrodu v čase zavedenia (ženy po pôrode)
| Dojčenie prebiehajúce
v čase zavedenia
| Dojčenie ukončené
v čase zavedenia
|
Zavedenie ≤ 36 týždňov od pôrodu
| 5,6
95% IS: 3,9-7,9,
n=6047 zavedení)
| 1,7
95% IS: 0,8-3,1,
n=5927 zavedení)
|
Zavedenie > 36 týždňov od pôrodu
| 1,6
(95% IS: 0,0-9,1,
n=608 zavedení)
| 0,7
(95% IS: 0,5-1,1,
n=41910 zavedení)
|
Riziko vzniku perforácie môže byť vyššie u žien s fixovanou retroverziou maternice.
Kontrolné vyšetrenie po zavedení sa má vykonať v súlade s odporúčaniami uvedenými v časti „Lekárske vyšetrenie / konzultácia“, ktoré sa v prípade klinickej indikácie u žien s rizikovými faktormi pre perforáciu môžu upraviť.
Stratené vláknaAk počas kontrolných vyšetrení nie sú na krčku maternice viditeľné vlákna, ktoré slúžia na odstránenie inzertu, musí sa vylúčiť nespozorované vypudenie a gravidita. Vlákna mohli byť vtiahnuté do maternice alebo cervikálneho kanála a môžu sa znovu objaviť počas ďalšej menštruácie. Ak sa vylúčila gravidita, zvyčajne sa vlákna nájdu pri jemnej sondáži cervikálneho kanála pomocou vhodného nástroja. Ak sa vlákna nenájdu, je potrebné zvážiť možnú expulziu alebo perforáciu. Na zistenie správnej polohy inzertu možno použiť ultrazvukovú diagnostiku. Ak vyšetrenie ultrazvukom nie je dostupné, alebo úspešné, možno na lokalizáciu Kyleeny použiť röntgen.
Ovariálne cysty / zväčšené ovariálne folikulyKeďže antikoncepčný účinok Kyleeny je založený prevažne na lokálnych účinkoch v rámci maternice, vo všeobecnosti nenastáva žiadna zmena funkcie ovárií vrátane pravidelného vývoja folikulov, uvoľňovania oocytov a folikulárnej atrézie u žien vo fertilnom veku. Atrézia folikulov je niekedy oneskorená a folikulogenéza môže pokračovať. Tieto zväčšené folikuly sa nedajú klinicky odlíšiť od ovariálnych cýst. Ovariálne cysty (vrátane hemoragických ovariálnych cýst a prasknutých ovariálnych cýst) sa ako nežiaduce udalosti hlásili v priebehu klinických skúšaní aspoň raz u približne 22,2 % žien používajúcich Kyleenu. Väčšina týchto cýst je asymptomatická, niekedy však môžu byť sprevádzané bolesťou panvy alebo dyspareuniou.
Vo väčšine prípadov zväčšené folikuly spontánne vymiznú počas dvoj- až trojmesačného pozorovania. Ak zväčšené folikuly spontánne nevymiznú, môže byť vhodné aj naďalej vykonávať kontroly ultrazvukom a urobiť ďalšie vhodné diagnostické/terapeutické opatrenia. Zriedkavo môže byť potrebné vykonať chirurgický zákrok.
4.5 Liekové a iné interakciePoznámka: Na identifikovanie potenciálnych interakcií, sa musia vziať do úvahy odborné informácie o súbežne užívaných liekoch.
·
Účinky ďalších liekov na používanie KyleenyInterakcie sa môžu vyskytnúť s liečivami, ktoré indukujú mikrozomálne enzýmy, čo môže viesť k zvýšenému klírensu pohlavných hormónov
Látky, ktoré zvyšujú klírens levonorgestrelu,napr.:Fenytoín,barbituráty, primidón, karbamazepín, rifampicín a pravdepodobne aj oxkarbazepín, topiramát, felbamát, grizeofulvín a produkty obsahujúce rastlinný prípravok ľubovník bodkovaný. Vplyv týchto liekov na anikoncepčnú účinnosť Kyleeny nie je známy, ale z dôvodu miestneho pôsobenia sa nepredpokladá závažnejší význam.
Látky s premenlivým vplyvom na klírens levonorgestrelu,napr.:Mnoho inhibítorov HIV/HCV proteáz a nenukleozidových inhibítorov reverznej transkriptázy, môže v prípade súbežného podávania s pohlavnými hormónmi zvyšovať alebo znižovať plazmatické koncentrácie gestagénu.
Látky, ktoré znižujú levonorgestrelu (inhibítory enzýmov): Silné a stredne silné inhibítory CYP3A4 ako azolové antimykotiká (napr.: flukonazol, itrakonazol, ketokonazol, vorikonazol), verapamil, makrolidy (napr.: klaritromycín, erytromycín), diltiazém a grapefruitový džús môžu zvyšovať plazmatickú koncentráciu gestagénu.
Zobrazenie magnetickou rezonanciou (MRI)Neklinické testovanie iného IUS s obsahom levonorgestrelu so strieborným krúžkom rovnakej veľkosti a tvarom T preukázalo, že pacientky môžu bezpečne podstúpiť vyšetrenie po zavedení Kyleeny (bezpečná pri zachovaní špecifických podmienok MR) za nasledovných podmienok:
· statické magnetické pole o intenzite 3T alebo menej,
· priestorový gradient magnetického poľa 3600 gauss/cm (360 T/m) alebo menej,
· maximálna celotelová priemerná špecifická miera absorpcie (SAR)s hodnotou 4,0 W/kg v nastavení „First Level Controlled mode“ počas 15 minút nepretržitého snímkovania.
V mimoklinickom testovaní, vyššie uvedené IUS s obsahom levonorgestrelu spôsobilo teplotný nárast rovný alebo nižší 1,8°C pri maximálnej celotelovej priemernej špecifickej miere absorpcie (SAR) s hodnotou 2,9W/kg, počas 15 minút snímkovania s použitím systému MR s hodnotou 3T a vysielacej/prijímacej telovej cievky.
Ak je skúmané miesto na tom istom mieste alebo relatívne blízko umiestnenia Kyleeny môže sa objaviť malé množstvo obrazových artefaktov.
4.6 Fertilita, gravidita a laktáciaFertilitaPoužívanie levonorgestrel uvoľňujúceho vnútromaternicového inzertu neovplyvňuje ďalšiu fertilitu. Po odstránení vnútromaternicového inzertu sa fertilita ženy vráti do normálu (pozri časť 5.1).
GraviditaZavedenie Kyleeny je u gravidných žien kontraindikované (pozri časť 4.3).
Ak žena otehotnie počas používania Kyleeny, treba vylúčiť ektopickú graviditu a odporúča sa včasné odstránenie inzertu, pretože akákoľvek intrauterinná antikoncepcia ponechaná
in situ môže zvýšiť riziko potratu a predčasného pôrodu. Odstránenie Kyleeny alebo sondáž maternice môže spôsobiť spontánny potrat. Ak si žena želá pokračovanie v gravidite a inzert nemožno odstrániť, má byť informovaná o rizikách a možných dôsledkoch predčasného pôrodu pre dieťa. Priebeh takejto gravidity sa má dôkladne sledovať. Ženu je potrebné poučiť, aby hlásila všetky príznaky, ktoré by mohli znamenať komplikácie gravidity, napr. kŕčovitá bolesť brucha s horúčkou.
Vzhľadom na vnútromaternicové podanie a lokálne vystavenie účinkom levonorgestrelu sa musí zohľadniť možný výskyt virilizačných účinkov na plod ženského pohlavia. Klinické skúsenosti s výsledkami gravidít pri zavedenej Kyleene sú obmedzené z dôvodu jej vysokej antikoncepčnej účinnosti. Ženy majú byť informované, že doteraz nie je dôkaz o vrodených chybách spôsobených používaním levonorgestrel uvoľňujúceho vnútromaternicového inzertu (LNG-IUS) v prípadoch, keď gravidita pokračovala do predpokladaného termínu spolu s LNG-IUS v maternici.
DojčenieVo všeobecnosti sa zdá, že nie sú známe žiadne škodlivé účinky na rast alebo vývin dojčiat, ak sa po šiestich týždňoch po pôrode používa akákoľvek antikoncepcia obsahujúca len gestagén. Vnútromaternicový inzert uvoľňujúci levonorgestrel neovplyvňuje množstvo ani kvalitu materského mlieka. Do materského mlieka dojčiacich žien prechádzajú malé množstvá gestagénu (približne 0,1 % dávky levonorgestrelu).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeKyleena nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinkySúhrn bezpečnostného profiluU väčšiny žien sa po zavedení Kyleeny objavili zmeny v charaktere menštruačného krvácania. Postupom času sa frekvencia amenorey a zriedkavého krvácania zvyšuje a frekvencia predĺženého, nepravidelného a častého krvácania sa znižuje. V klinických skúšaniach sa pozorovali nasledovné typy menštruačného krvácania:
Tabuľka 2 Typy menštruačného krvácania hlásené v klinických skúšaniach s Kyleenou
Kyleena
| Prvých 90 dní
| Druhých 90 dní
| Koniec 1. roku
| Koniec 3. roku
| Koniec 5. roku
|
Amenorea
| < 1%
| 5%
| 12%
| 20%
| 23%
|
Zriedkavé krvácanie
| 10%
| 20%
| 26%
| 26%
| 26%
|
Časté krvácanie
| 25%
| 10%
| 4%
| 2%
| 2%
|
Predĺžené krvácanie*
| 57%
| 14%
| 6%
| 2%
| 1%
|
Nepravidelné krvácanie
| 43%
| 25%
| 17%
| 10%
| 9%
|
*Pacientky s predĺženým krvácaním môžu byť zaradené aj do jednej z ďalších kategórií (okrem amenorey).
Tabuľkový súhrn nežiaducich udalostíFrekvencie nežiaducich liekových reakcií hlásených pri Kyleene sú zhrnuté do tabuľky uvedenej nižšie. V rámci skupiny frekvencie sú nežiaduce účinky zoradené v poradí klesajúcej závažnosti. Frekvencie sú definované ako:
veľmi časté (≥ 1/10),
časté (≥ 1/100 až < 1/10),
menej časté (≥ 1/1 000 až < 1/100),
zriedkavé (≥ 1/10 000 až < 1/1 000),
veľmi zriedkavé (< 1/10 000).
Trieda orgánových systémov
| Veľmi časté
| Časté
| Menej časté
| Zriedkavé
|
Psychické poruchy
|
| Depresívna nálada/ Depresia
|
|
|
Poruchy nervového systému
| Bolesť hlavy
| Migréna
|
|
|
Poruchy gastrointestinálneho traktu
| Abdominálna bolesť /bolesť panvy
| Nauzea
|
|
|
Poruchy kože a podkožného tkaniva
| Akné/ Seborea'
| Alopécia
| Hirzutizmus
|
|
Poruchy reprodukčného systému a prsníkov
| Zmeny charakteru menštruačného krvácania vrátane zvýšeného alebo zníženého menštruaćného krvácania, špinenia, zriedkavého krvácania a amenorey
Ovariálne cysty*
Vulvovaginitída
| Infekcia horného pohlavného traktu,
Dysmenorea,
Bolesť/pocit napätia v prsníkoch,
Vypudenie inzertu (úplné a čiastočné),
Výtok z pohlavných orgánov
|
| Perforácia maternice**
|
* V klinických skúšaniach sa ovariálne cysty museli hlásiť ako nežiaduce udalosti, ak boli abnormálne, cysty bez funkcie a/alebo mali pri ultrazvukovom vyšetrení priemer >3 cm.
** Táto frekvencia sa zakladá na klinických skúšaniach, ktoré nezahŕňali dojčiace ženy. Vo veľkej prospektívnej porovnávacej neintervenčnej kohortovej štúdii uskutočnenej na ženách používajúcich iný IUS s obsahom levonorgestrelu a medený IUD bola frekvencia výskytu perforácie u dojčiacich žien alebo u žien, ktorým bol systém zavedený do 36 týždňov od pôrodu „menej častá“ (pozri časť 4.4 „Perforácia“).
Popis vybraných nežiaducich reakciíPri používaní iného IUS s obsahom levonorgestrelu sa hlásili prípady precitlivenosti vrátane vyrážky, urtikárie a angioedému.
Ak počas používania Kyleeny žena otehotnie, je zvýšená relatívna pravdepodobnosť, že táto gravidita bude mimomaternicová (pozri v časti 4.4 časť Mimomaternicová gravidita)
Partner môže počas pohlavného styku cítiť vlákna na odstránenie inzertu.
Nasledovné nežiaduce účinky sa hlásili v súvislosti so zavedením alebo odstránením Kyleeny: bolesť počas výkonu, krvácanie počas výkonu, vazovagálna reakcia súvisiaca so zavedením sprevádzaná závratom alebo synkopou. Výkon môže u pacientok s epilepsiou vyvolať záchvat.
U iných IUD sa po zavedení hlásili prípady sepsy (vrátane sepsy, spôsobenej streptokokmi skupiny A) (pozri časť 4.4 „Infekcia panvy“).
Pediatrická populáciaPre adolescentky mladšie ako 18 rokov sa predpokladá sa rovnaký profil bezpečnosti Kyleeny ako pre používateľky vo veku 18 rokov a staršie.
Pre údaje o bezpečnosti u adolescentiek, pozri časť 5.1.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 PredávkovanieNevzťahuje sa.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Vnútromaternicové teliesko s progestínom,
ATC kód: G02BA03
Farmakodynamické účinkyKyleena má predovšetkým lokálne gestagénne účinky v dutine maternice.
Vysoká koncentrácia levonorgestrelu v endometriu inhibuje endometriálnu syntézu estrogénových a gestagénových receptorov. Endometrium sa stáva relatívne necitlivé na cirkulujúci estradiol a pozoruje sa silný antiproliferatívny účinok. Počas používania sa v endometriu pozorovali morfologické zmeny a slabá lokálna reakcia na cudzie teleso. Zahusťovanie cervikálneho hlienu bráni pohybu spermií cervikálnym kanálom. Lokálne prostredie vo vnútri maternice a vajcovodov inhibuje motilitu a funkciu spermií, čím zabraňuje oplodneniu. V klinických skúšaniach s Kyleenou sa ovulácia pozorovala u väčšiny používateliek v sledovanej podskupine. Prítomnosť ovulácie sa pozorovala u 23 z 26 žien v prvom roku, u 19 z 20 žien v druhom roku a u všetkých 16 žien v treťom roku. Vo štvrtom roku sa ovulácia pozorovala u jedinej zostávajúcej ženy v sledovanej podskupine a v piatom roku nebola v podskupine žiadna sledovaná žena.
Klinická účinnosť a bezpečnosťAntikoncepčná účinnosť Kyleeny sa hodnotila v klinickom skúšaní s 1 452 ženami vo veku 18‑35 rokov vrátane, z ktorých 39,5 % (574) nerodilo a z nich 84 % (482) boli ženy, ktoré nikdy pred zavedením Kyleeny neboli gravidné. 1-ročný Pearlov Index bol 0,16 (95% interval spoľahlivosti 0,02‑0,58) a 5-ročný Pearlov Index bol 0,29 (95% interval spoľahlivosti 0,16‑0,50). Miera zlyhania v 1. roku bola približne 0,2 % a miera kumulatívneho zlyhania bola približne 1,4 % po 5 rokoch. Miera zlyhaní zahŕňa aj gravidity v dôsledku nezisteného vypudenia inzertu a perforácie. Používanie, levonorgestrel uvoľňujúceho vnútromaternicového inzertu neovplyvňuje ďalšiu fertilitu. V 5-ročnom skúšaní s Kyleenou sa 116 z 163 (71,2 %) ženám, ktoré prestali používať Kyleenu z dôvodu želanej gravidity, podarilo otehotnelo počas obdobia 12 mesiacov.
Profil bezpečnosti iného IUS s nižším obsahom levonorgestrelu pozorovaný v štúdii s 304 adolescentkami sa zhodoval s tým, ktorý sa pozoroval u dospelých. Očakáva sa rovnaká účinnosť u adolescentiek do 18 rokov ako u používateliek vo veku 18 rokov a starších.
Pri Kyleene sú zmeny menštruačného cyklu výsledkom priameho pôsobenia levonorgestrelu na endometrium a nemusia odrážať ovariálny cyklus. U žien s rozdielnym charakterom menštruačného krvácania nie je zrejmá odlišnosť vo vývoji folikulov, v ovulácii alebo v tvorbe estradiolu a gestagénu. V procese inhibície proliferácie endometria sa môže v prvých mesiacoch používania počiatočne zvýšiť počet dní špinenia. Následne silná supresia endometria spôsobí skrátenie trvania a zníženie intenzity menštruačného krvácania počas používania Kyleeny. Slabé krvácanie sa často vyvinie až do oligomenorey alebo amenorey. Ovariálne funkcie zostávajú normálne a hladiny estradiolu sa udržiavajú dokonca aj u používateliek Kyleeny s amenoreou.
5.2 Farmakokinetické vlastnostiLevonorgestrel sa uvoľňuje lokálne do dutiny maternice. Krivka uvoľňovania
in vivo je charakterizovaná úvodným prudkým poklesom, ktorý sa postupne spomaľuje a vyústi do minimálnej zmeny po prvom roku až do konca zamýšľaného 5 - ročného obdobia použitia. Odhadované rýchlosti dodávania
in vivo v rôznych časoch sú uvedené v Tabuľke 3.
Tabuľka 3: Odhadované rýchlosti uvoľňovania
in vivo na základe pozorovaných údajov o reziduálnom obsahu
ex vivo.
Time
| Odhadovaná rýchlosť uvoľňovania in vivo
[mikrogramov/24 hodín]
|
24 dní po zavedení
| 17.5
|
60 dní po zavedení
| 15.3
|
1 rok po zavedení
| 9.8
|
3 roky po zavedení
| 7.9
|
5 rokov po zavedení
| 7.4
|
Priemer počas 5 rokov
| 9.0
|
Po zavedení sa z IUS uvoľňuje levonorgestrel do dutiny maternice okamžite. Viac ako 90% uvoľneného levonorgestrelu je systémovo dostupného. Maximálne sérové koncentrácie levonorgestrelu sa dosiahnu počas prvých dvoch týždňov po zavedení Kyleeny. Sedem dní po zavedení sa stanovila priemerná koncentrácia levonorgestrelu 199 pg/ml. Následne sérové koncentrácie levonorgestrelu postupne klesajú a dosahujú priemerné koncentrácie 96,8 pg/ml po 3 rokoch a 83,1pg/ml po 5 rokoch používania. Pri používaní levonorgestrel uvoľňujúceho vnútromaternicového inzertu vedie vysoké lokálne vystavenie účinkom liečiva v dutine maternice k výraznému koncentračnému gradientu smerom z endometria do myometria (>100-násobný gradient smerom z endometria do myometria) a k nízkym sérovým koncentráciám levonorgestrelu (>1 000-násobný gradient smerom z endometria do séra).
DistribúciaLevonorgestrel sa nešpecificky viaže na sérový albumín a špecificky na SHBG (sex hormone binding globulin, globulín viažuci pohlavné hormóny). Menej ako 2 % cirkulujúceho levonorgestrelu sú prítomné vo forme voľného steroidu. Levonorgestrel sa viaže s vysokou afinitou na SHBG. Zmeny v sérovej koncentrácii SHBG následne vedú k zvýšeniu (pri vyšších koncentráciách SHBG) alebo k poklesu (pri nižších koncentráciách SHBG) celkovej sérovej koncentrácie levonorgestrelu. Počas prvých troch mesiacov po zavedení Kyleeny klesne koncentrácia SHBG priemerne o približne 30 % a pretrváva stabilná počas 5-ročného obdobia používania. Priemerný zdanlivý distribučný objem levonorgestrelu je približne 106 litrov.
BiotransformáciaLevonorgestrel sa vo veľkej miere metabolizuje. Najdôležitejšie metabolické dráhy sú redukcia Δ4 - 3 oxo skupiny a hydroxylácie na pozíciách 2α, 1β a 16β, nasledované konjugáciou. Enzým CYP3A4 je hlavným enzýmom podieľajúcim sa na metabolizme levonorgestrelu. Dostupné
in vitro údaje naznačujú, že biotransformačné reakcie sprostredkované enzýmom CYP v prípade levonorgestrelu môžu v porovnaní s redukciou a konjugáciou byť menšieho významu.
ElimináciaCelkový klírens levonorgestrelu z plazmy je približne 1,0 ml/min/kg. V nezmenenej forme sa vylučujú len stopové množstvá levonorgestrelu. Metabolity sa vylučujú stolicou a močom v exkrečnom pomere približne 1. Polčas vylučovania je približne 1 deň.
Linearita/nelinearitaFarmakokinetika levonorgestrelu závisí od koncentrácie SHBG, ktorá je pod vplyvom estrogénov a androgénov. Pokles koncentrácie SBHG vedie k poklesu celkového levonorgestrelu v sére, čo naznačuje nelineáritu vo farmakokinetike levonorgestrelu s ohľadom na čas. Na základe predovšetkým lokálneho účinku Kyleeny sa neočakáva žiadny vplyv na jej účinnosť.
Pediatrická populáciaV jednoročnej štúdii fázy III u adolescentiek po menarché ( priemerný vek 16,2, rozsah 12 až 18 rokov) používajúcich iný IUS s nižším obsahom levonorgestrelu ukázala farmakokinetická analýza 283 jedincov odhadované sérové koncentrácie levonorgestrelu mierne vyššie (10 %) u adolescentov v porovnaní s dospelými. Toto súvisí so všeobecne nižšou telesnou váhou u adolescentov. Rozsahy odhadované pre adolescentov sú však vrámci rozsahov odhadovaných pre dospelých, javiac vysokú podobnosť.. Vo farmakokinetike sa pre Kyleenu nepredpokladajú u adolescentiek a dospelých používateliek žiadne rozdiely.
Etnické rozdielyV ázijsko-tichomorskej oblasti (93% žien ázijského pôvodu, 7% žien inej etnickej príslušnosti) sa vykonalo trojročné klinické skúšanie fázy III s použitím iného IUS s nižším obsahom levonorgestrelu. Porovnanie farmakokinetických vlastností levonorgestrelu z ázijskej populácie v tomto skúšaní a údajov z iného skúšania fázy III s kaukazskou populáciou nepreukázalo klinicky významný rozdiel v systémovej expozícii a iných farmakokinetických charakteristikách. Okrem toho, denná rýchlosť uvoľňovania IUS s obsahom levonorgestrelu bola u oboch populácií zhodná. Farmakokinetické rozdiely sa u žien s inou etnickou príslušnosťou pri používaní Kyleeny nepredpokladajú.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje na základe obvyklých štúdií farmakologickej bezpečnosti, farmakokinetiky a toxicity vrátane genotoxicity a karcinogénneho potenciálu levonorgestrelu neodhalili žiadne osobitné riziko pre ľudí. Štúdie na opiciach s intrauterinne podávaným levonorgestrelom počas 9 až 12 mesiacov potvrdili lokálny farmakologický účinok s dobrou lokálnou znášanlivosťou bez znakov systémovej toxicity. U králikov sa po intrauterinnom podaní levonorgestrelu nepozorovala žiadna embryotoxicita.
Hodnotenie bezpečnosti elastomérových súčastí rezervoáru hormónu, polyetylénových a polypropylénových materiálov, strieborného krúžku inzertu a kombinácie elastoméru a levonorgestrelu, na základe hodnotenia genetickej toxikológie v štandardných testovacích systémoch
in vivo a
in vitro a na základe testov biologickej kompatibility u myší, potkanov, morčiat, králikov v testovacích systémoch
in vitro, neodhalilo biologickú inkompatibilitu.
Hodnotenie environmentálneho rizika (ERA)Štúdie hodnotiace environmentálne riziko preukázali, že levonorgestrel môže predstavovať riziko pre vodné prostredie (časť 6.6).
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokpolydimetylsiloxánový elastomér
bezvodý koloidný oxid kremičitý
polyetylén
síran bárnatý
polypropylén
ftalocyanín medi
striebro
6.2 InkompatibilityNeaplikovateľné
6.3 Čas použiteľnosti2 roky.
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie..
6.5 Druh obalu a obsah baleniaLiek je zabalený jednotlivo v teplomformovanom blistrovom balení (PETG) s odlepovacou fóliou (PE).
Veľkosti balenia:
1 x 1 intrauterinný inzert
5 x 1 intrauterinný inzert
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciua iné zaobchádzanie s liekomLiek sa dodáva v sterilnom obale, ktorý sa má otvoriť až tesne pred zavedením. S každým inzertom sa má manipulovať aseptickým spôsobom. Ak je sterilný obal porušený, inzert vo vnútri sa má zlikvidovať v súlade s miestnymi nariadeniami o manipulácii s biologicky nebezpečným odpadom. Rovnakým spôsobom sa má zlikvidovať odstránená Kyleena a zavádzač.
Inzert má zaviesť zdravotnícky pracovník pomocou aseptickej metódy (pozri časť 4.2).
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Tento liek môže predstavovať riziko pre životné prostredie (pozri časť 5.3).
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBayer, spol. s r.o.
Einsteinova 25
851 01 Bratislava
8. REGISTRAČNÉ ČÍSLOReg.č.: 17/0500/16-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUNovember 2016
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Štátneho ústavu pre kontrolu liečiv (
www.sukl.sk).