
mg
Súčasná hladina draslíka v sére (mmol/l)
| ≤4,8
| Zvýšte dávku na 20 mg
finerenónu jedenkrát denne*.
| Udržiavajte dávku 20 mg jedenkrát
denne.
|
>4,8 až 5,5
| Udržiavajte dávku 10 mg
jedenkrát denne.
| Udržiavajte dávku 20 mg jedenkrát denne.
|
>5,5
| Prerušte podávanie finerenónu. Zvážte opätovné podávanie dávky
10 mg jedenkrát denne, ak je hladina draslíka v sére
≤5,0 mmol/l.
| Prerušte podávanie finerenónu. Opätovne začnite podávať dávku
10 mg jedenkrát denne, ak je
hladina draslíka v sére ≤5,0 mmol/l.
|
* udržiavajte dávku 10 mg jedenkrát denne, ak sa hodnota eGFR znížila o >30 % v porovnaní s predchádzajúcim meraním
Vynechaná dávka
Vynechaná dávka sa má užiť hneď, ako si na to pacient spomenie, ale len v ten istý deň. Pacient nemá užiť 2 dávky, aby nahradil vynechanú dávku.
Osobitné skupiny pacientov
Starší pacienti
U starších pacientov nie je potrebná žiadna úprava dávky (pozri časť 5.2).
Porucha funkcie obličiek
Začatie liečby
U pacientov s eGFR <25 ml/min/1,73 m2 sa z dôvodu obmedzených klinických údajov nemá začínať liečba finerenónom (pozri časti 4.4 a 5.2).
Pokračovanie v liečbe
U pacientov s eGFR ≥15 ml/min/1,73 m2 sa môže pokračovať v liečbe finerenónom s dávkou upravenou na základe hladiny draslíka v sére. 4 týždne po začatí liečby sa má zmerať hodnota eGFR
aby sa stanovilo, či sa môže počiatočná dávka zvýšiť na odporúčanú dennú dávku 20 mg (pozri
„Dávkovanie, Pokračovanie v liečbe a tabuľku 2).
U pacientov, u ktorých choroba pokročila do terminálneho štádia ochorenia obličiek
(eGFR <15 ml/min/1,73 m2), sa má, z dôvodu obmedzených klinických údajov, liečba finerenónom ukončiť (pozri časť 4.4).
Porucha funkcie pečene
Pacienti s
- ťažkou poruchou funkcie pečene:
Liečba finerenónom sa nemá začínať (pozri časti 4.4 a 5.2). K dispozícii nie sú žiadne údaje.
- stredne ťažkou poruchou funkcie pečene:
Nie je potrebná žiadna úprava počiatočnej dávky. Má sa zvážiť dodatočné sledovanie hladiny draslíka v sére a nastavenie sledovania podľa charakteristík pacienta (pozri časti 4.4 a 5.2).
- miernou poruchou funkcie pečene:
Nie je potrebná žiadna úprava počiatočnej dávky.
Súbežne užívané lieky
Ak pacienti užívajú finerenón súbežne so stredne silnými alebo slabými inhibítormi CYP3A4, doplnkami draslíka, trimetoprimom alebo trimetoprimom/sulfametoxazolom, má sa zvážiť dodatočné sledovanie hladiny draslíka v sére a nastavenie sledovania podľa charakteristík pacienta (pozri
časť 4.4). Rozhodnutia týkajúce sa liečby finerenónom sa majú urobiť podľa pokynov v tabuľke 2
(„Dávkovanie, Pokračovanie v liečbe“).
Ak musia pacienti užívať trimetoprim alebo trimetoprim/sulfametoxazol, môže byť potrebné dočasné prerušenie liečby finerenónom. Viac informácií nájdete v častiach 4.4 a 4.5.
Telesná hmotnosť
Na základe telesnej hmotnosti nie je potrebná žiadna úprava dávky (pozri časť 5.2).
Pediatrická populácia
Bezpečnosť a účinnosť finerenónu u detí a dospievajúcich vo veku do 18 rokov neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Spôsob podávania
Perorálne použitie
Tablety sa môžu užívať s pohárom vody a s jedlom alebo bez jedla (pozri časť 5.2). Tablety sa nemajú užívať s grapefruitom ani grapefruitovou šťavou (pozri časť 4.5).
Drvenie tabliet
Pre pacientov, ktorí nie sú schopní prehltnúť tablety, sa môžu tablety Kerendia tesne pred perorálnym použitím rozdrviť a zmiešať s vodou alebo mäkkým jedlom, ako napríklad jablkovým pretlakom
(pozri časť 5.2).
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Súbežná liečba so silnými inhibítormi CYP3A4 (pozri časť 4.5), napr.
- itrakonazol
- ketokonazol
- ritonavir
- nelfinavir
- kobicistát
- klaritromycín
- telitromycín
- nefazodón
- Addisonova choroba.
4.4 Osobitné upozornenia a opatrenia pri používaní
Hyperkaliémia
U pacientov liečených finerenónom sa pozorovala hyperkalémia (pozri časť 4.8).
Niektorí pacienti majú vyššie riziko rozvoja hyperkalémie.
Rizikové faktory zahŕňajú nízku hodnotu eGFR, vyššie hladiny draslíka v sére a predchádzajúce epizódy hyperkaliémie. U týchto pacientov sa musí zvážiť častejšie sledovanie.
Začatie liečby a pokračovanie v liečbe (pozri časť 4.2)
Ak je hladina draslíka v sére >5,0 mmol/l, nemá sa začínať liečba finerenónom.
Ak je hladina draslíka v sére >4,8 až 5,0 mmol/l, môže sa zvážiť začatie liečby finerenónom v dávke
10 mg jedenkrát denne s dodatočným sledovaním draslíka v sére počas prvých 4 týždňov, a to na základe charakteristík pacienta a hladín draslíka v sére.
Ak je hladina draslíka v sére >5,5 mmol/l, má sa liečba finerenónom prerušiť. Majú sa dodržiavať lokálne odporúčania na liečbu hyperkaliémie.
Keď je hladina draslíka v sére ≤5,0 mmol/, môže sa opätovne začať liečba finerenónom v dávke 10 mg
jedenkrát denne.
Sledovanie
Hladiny draslíka v sére a hodnoty eGFR sa musia u všetkých pacientov znovu zmerať 4 týždne po začatí liečby, opätovnom začatí liečby alebo zvýšení dávky finerenónu. Potom sa majú hladiny draslíka v sére pravidelne a podľa potreby vyhodnocovať, a to na základe charakteristík pacienta
a hladín draslíka v sére (pozri časť 4.2).
Súbežne užívané lieky
Riziko hyperkaliémie sa môže tiež zvýšiť pri súbežnom užívaní liekov, ktoré môžu zvýšiť hladinu draslíka v sére (pozri časť 4.5). Pozri tiež „Súbežné používanie látok, ktoré môžu ovplyvniť expozíciu finerenónu“.
Finerenón sa nemá podávať súbežne s
- diuretikami šetriacimi draslík (napr. amilorid, triamterén) a
- inými antagonistami mineralokortikoidných receptorov (MRA), napr. eplerenón, esaxerenón, spironolaktón, kanrenón.
Finerenón sa má používať s opatrnosťou a hladiny draslíka v sére sa majú sledovať pri súbežnom užívaní s
- doplnkami draslíka,
- trimetoprimom alebo trimetoprimom/sulfametoxazolom. Môže byť potrebné dočasné prerušenie liečby finerenónom.
Porucha funkcie obličiek
Riziko hyperkaliémie sa zvyšuje so znižujúcou sa funkciou obličiek. Podľa potreby sa má v súlade so
štandardnou praxou priebežne sledovať funkcia obličiek (pozri časť 4.2).
Začatie liečby
Liečba finerenónom sa nemá začínať u pacientov s eGFR <25 ml/min/1,73 m2 z dôvodu obmedzených klinických údajov (pozri časti 4.2 a 5.2).
Pokračovanie v liečbe
U pacientov, u ktorých choroba pokročila do terminálneho štádia ochorenia obličiek
(eGFR <15 ml/min/1,73 m2), sa má, z dôvodu obmedzených klinických údajov, liečba finerenónom ukončiť.
Porucha funkcie pečene
Liečba finerenónom sa nemá začínať u pacientov s ťažkou poruchou funkcie pečene (pozri časť 4.2).
Títo pacienti sa neskúmali (pozri časť 5.2), očakáva sa však významné zvýšenie expozície finerenónu.
U pacientov so stredne ťažkou poruchou funkcie pečene môže byť potrebné dodatočné sledovanie
z dôvodu zvýšenia expozície finerenónu. Musí sa zvážiť dodatočné sledovanie hladiny draslíka v sére a nastavenie sledovania podľa charakteristík pacienta (pozri časti 4.2 a 5.2).
Srdcové zlyhávanie
Pacienti s diagnostikovaným srdcovým zlyhávaním so zníženou ejekčnou frakciou v NYHA triede
II-IV (New York Heart Association) boli vylúčení z klinickej štúdie fázy III (pozri časť 5.1).
Súbežné používanie látok, ktoré môžu ovplyvniť expozíciu finerenónu
Stredne silné a slabé inhibítory CYP3A4
Pri súbežnom používaní finerenónu so stredne silnými alebo slabými inhibítormi CYP3A4 sa má sledovať hladina draslíka v sére (pozri časti 4.2 a 4.5).
Silné a stredne silné induktory CYP3A4
Finerenón sa nemá používať súbežne so silnými alebo stredne silnými induktormi CYP3A4 (pozri časť 4.5).
Grapefruit
Počas liečby finerenónom sa nemajú konzumovať grapefruity ani grapefruitová šťava (pozri časti 4.2. a 4.5).
Embryofetálna toxicita
Finerenón sa nemá používať počas gravidity, pokiaľ sa dôkladne nezvážil prínos pre matku a riziko
pre plod. Ak žena počas užívania finerenónu otehotnie, je potrebné informovať ju o možných rizikách pre plod.
Ženy vo fertilnom veku je potrebné poučiť o tom, aby počas liečby finerenónom používali účinnú antikoncepciu.
Ženy je potrebné poučiť o tom, aby počas liečby finerenónom nedojčili. Viac informácií nájdete v častiach 4.6. a 5.3.
Informácie o pomocnýchlátkach
Kerendia obsahuje laktózu
Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, celkovým deficitom laktázy alebo glukózo-galaktózovou malabsorpciou nesmú užívať tento liek.
Kerendia obsahuje sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v tablete, t.j. v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Interakčné štúdie sa uskutočnili len u dospelých.
Finerenón sa vylučuje výlučne prostredníctvom oxidatívneho metabolizmu sprostredkovaného cytochrómom P450 (CYP) (hlavne CYP3A4 [90 %] s malým podielom CYP2C8 [10 %]).
Súbežné používanie je kontraindikované
Silné inhibítory CYP3A4
Súbežné používanie Kerendie s itrakonazolom, klaritromycínom a ďalšími silnými inhibítormi CYP3A4 (napr., ketokonazol, ritonavir, nelfinavir, kobicistat, telitromycín alebo nefazodón) je kontraindikované (pozri časť 4.3), pretože sa očakáva výrazné zvýšenie expozície finerenónu.
Súbežné používanie sa neodporúča
Silné a stredne silné induktory CYP3A4
Kerendia sa nemá používať súbežne s rifampicínom a ďalšími silnými induktormi CYP3A4 (napr. karbamazepín, fenytoín, fenobarbital, ľubovník bodkovaný) alebo s efavirenzom a ďalšími stredne
silnými induktormi CYP3A4. Pre tieto induktory CYP3A4 sa očakáva, že výrazne znížia plazmatické koncentrácie finerenónu, čo vedie k zníženému terapeutickému účinku (pozri časť 4.4).
Určité lieky, ktoré zvyšujú hladinu draslíka v sére
Kerendia sa nemá používať súbežne s diuretikami šetriacimi draslík (napr. amilorid, triamterén)
a inými MRA (napr. eplerenón, esaxerenón, spironolaktón, kanrenón). Predpokladá sa, že tieto lieky zvyšujú riziko hyperkaliémie (pozri časť 4.4).
Grapefruit
Počas liečby finerenónom sa nemajú konzumovať grapefruity ani grapefruitová šťava, pretože sa prostredníctvom inhibície CYP3A4 predpokladá zvýšenie plazmatickej koncentrácie finerenónu (pozri časti 4.2 a 4.4).
Súbežné používanie s opatreniami
Stredne silné inhibítory CYP3A4
V klinickej štúdii viedlo súbežné používanie erytromycínu (500 mg trikrát denne) k 3,5-násobnému zvýšeniu hodnoty AUC a 1,9-násobnému zvýšeniu hodnoty Cₘₐₓ finerenónu. V inej klinickej štúdii viedlo používanie verapamilu (240 mg tableta s riadeným uvoľňovaním jedenkrát denne)
k 2,7-násobnému a 2,2-násobnému zvýšeniu hodnôt AUC a Cₘₐₓ finerenónu, v uvedenom poradí. Hladina draslíka v sére môže byť zvýšená a preto sa odporúča sledovanie hladín draslíka v sére, a to
hlavne na začiatku liečby alebo pri zmene dávkovania finerenónu alebo inhibítora CYP3A4 (pozri
časti 4.2 a 4.4).
S
labé inhibítory CYP3A4
PBPK simulácie naznačujú, že fluvoxamín (100 mg dvakrát denne) zvyšuje hodnoty AUC (1,6-násobne) a Cₘₐₓ (1,4-násobne) finerenónu.
Hladina draslíka v sére môže byť zvýšená a preto sa odporúča sledovanie hladín draslíka v sére, a to hlavne na začiatku liečby alebo pri zmene dávkovania finerenónu alebo inhibítora CYP3A4 (pozri časti 4.2 a 4.4).
Určité lieky, ktoré zvyšujú hladinu draslíka v sére (pozri časť 4.4)
Pre súbežné používanie Kerendie s doplnkami draslíka, a trimetoprimom alebo trimetoprimom/sulfametoxazolom sa predpokladá zvýšené riziko hyperkaliémie. Je potrebné sledovanie hladín draslíka v sére.
Počas liečby trimetoprimom alebo trimetoprimom/sulfametoxazolom môže byť potrebné dočasné
prerušenie liečby Kerendiou.
Antihypertenzívne lieky
Pri súbežnom užívaní viacerých iných antihypertenzív sa zvyšuje riziko hypotenzie. U týchto pacientov sa odporúča monitorovanie krvného tlaku.
4.6 Fertilita, gravidita a laktácia
Antikoncepcia u žien
Ženy vo fertilnom veku musia počas liečby finerenónom používať účinnú antikoncepciu (pozri
časť 4.4).
Gravidita
Nie sú k dispozícii údaje o použití finerenónu u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3).
Kerendia sa nemá používať počas gravidity, pokiaľ klinický stav ženy nevyžaduje liečbu finerenónom. Ak žena počas užívania finerenónu otehotnie, je potrebné informovať ju o možných rizikách pre plod (pozri časť 4.4).
Dojčenie
Nie je známe, či sa finerenón/metabolity vylučujú do ľudského mlieka.
Dostupné farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie finerenónu a jeho metabolitov do mlieka. U mláďat potkanov vystavených účinku touto cestou sa preukázali nežiaduce reakcie (pozri časť 5.3).
Riziko u novorodencov/dojčiat nemôže byť vylúčené.
Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu Kerendiou sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu (pozri časť 4.4).
Fertilita
Nie sú k dispozícii údaje o účinku finerenónu na ľudskú fertilitu.
Štúdie na zvieratách preukázali poruchy fertility u samíc pri expozíciách považovaných za vyššie, ako je expozícia u ľudí, čo naznačuje nízky klinický význam (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Kerendia nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4
.8 Nežiaduce účinky
Súhrn profilu bezpečnostiNajčastejšie hlásená nežiaduca reakcia pri liečbe finerenónom bola hyperkaliémia (18,3 %). Pozri
„Popis nežiaducich reakcií,
Hyperkaliémia“ nižšie a časť 4.4.
Tabuľkový zoznam nežiaducich reakciíBezpečnosť finerenónu u pacientov s chronickou chorobou obličiek (
Chronic Kidney Disease, CKD)
a diabetes mellitus 2. typu (T2D) sa hodnotila v pivotnej štúdii fázy III FIDELIO-DKD (diabetická choroba obličiek). V tejto štúdii dostalo 2 827 pacientov finerenón (10 alebo 20 mg jedenkrát denne) s priemerným trvaním liečby 2,2 rokov.
Pozorované nežiaduce reakcie sú uvedené v tabuľke 3. Nežiaduce reakcie sú klasifikované podľa konvencie triedy orgánových systémov databázy MedDRA a frekvencie.
Nežiaduce reakcie sú zoskupené podľa ich frekvencií v poradí klesajúcej závažnosti. Frekvencie sú definované nasledovne:
Veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé
(≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
Tabuľka 3: Nežiaduce reakcie
Trieda orgánových systémov
(MedDRA)
|
Veľmi časté
|
Časté
|
Menej časté
|
Poruchy
metabolizmu a výživy
|
Hyperkaliémia
|
Hyponatriémia
|
|
Poruchy ciev
|
| Hypotenzia
|
|
Poruchy kože a podkožného tkaniva
|
|
Pruritus
|
|
Laboratórne
a funkčné vyšetrenia
|
| Znížená rýchlosť glomerulárnej filtrácie
|
Znížená hladina hemoglobínu
|
PopisvybranýchnežiaducichreakciíHyperkaliémiaV štúdii FIDELIO-DKD sa príhody hyperkaliémie hlásili u 18,3 % pacientov liečených finerenónom v porovnaní s 9,0 % pacientov, ktorí dostávali placebo. U pacientov liečených finerenónom bola väčšina príhod hyperkaliémie mierna až stredne závažná a vyriešila sa. Pre finerenón sa častejšie hlásili závažné príhody hyperkaliémie (1,6 %) ako pre placebo (0,4 %). Koncentrácie draslíka v sére
>5,5 mmol/l a >6,0 mmol/l sa hlásili u 21,7 % a 4,5 % pacientov liečených finerenónom a u 9,8 %
a 1,4 % pacientov, ktorí dostávali placebo, v uvedenom poradí.
Hyperkaliémia viedla k trvalému ukončeniu liečby u 2,3 % pacientov, ktorí dostávali finerenón oproti
0,9 % pacientov v skupine s placebom. Hospitalizácia z dôvodu hyperkaliémie bola u 1,4 % pacientov, ktorí dostávali finerenón oproti 0,3 % pacientov v skupine s placebom.
Pozorovalo sa zvýšenie z počiatočnej priemernej hladiny draslíka v sére v prvom mesiaci liečby finerenónom v porovnaní s placebom a v 4. mesiaci sa pozoroval maximálny rozdiel medzi skupinami
0,23 mmol/l. Rozdiel v hladinách draslíka v sére medzi finerenónom a placebom potom zostal
stabilný.
Ohľadne špecifických odporúčaní si prečítajte časti 4.2. a 4.4.
Hypotenzia
V štúdii FIDELIO-DKD sa príhody hypotenzie hlásili u 4,8 % pacientov liečených finerenónom v porovnaní s 3,4 % pacientov, ktorí dostávali placebo. U pacientov liečených finerenónom bola
väčšina príhod hypotenzie mierna až stredne závažná a vyriešila sa. U jedného pacienta (< 0,1 %) sa liečba finerenónom z dôvodu hypotenzie natrvalo ukončila. Hospitalizácia z dôvodu hypotenzie
v skupine s finerenónom bola 0,2 % oproti 0,2 % v skupine s placebom.
U pacientov liečených finerenónom sa priemerný systolický krvný tlak znížil o 2-4 mm Hg
a priemerný diastolický krvný tlak sa znížil o 1-2 mm Hg v 1. mesiaci, a potom zostal stabilný.
Znížená rýchlosť glomerulárnej filtrácie (eGFR)V štúdii FIDELIO-DKD sa príhody zníženia GFR hlásili u 6,3 % pacientov liečených finerenónom v porovnaní s 4,7 % pacientov, ktorí dostávali placebo. U pacientov liečených finerenónom bola väčšina príhod zníženia hodnoty GFR mierna až stredne závažná a vyriešila sa. Príhody zníženia
hodnoty GFR viedli k trvalému ukončeniu liečby u 0,2 % pacientov, ktorí dostávali finerenón oproti
0,3 % pacientov v skupine s placebom. Hospitalizácia z dôvodu zníženia hodnoty GFR bola v skupine s finerenónom 0,1 % oproti 0,1 % v skupine s placebom.
U pacientov liečených finerenónom sa v porovnaní s placebom vyskytlo počiatočné zníženie hodnoty eGFR (priemer 2 ml/min/1,73 m2), ktoré sa časom zmiernilo. Toto zníženie sa zdalo byť reverzibilné počas prebiehajúcej liečby.
Znížená hladina hemoglobínuPo 4 mesiacoch liečby bol finerenón spojený s placebom korigovaným absolútnym poklesom priemerného hemoglobínu o 0,14 g/dl a priemerného hematokritu o 0,46 %. Zmeny hemoglobínu a hematokritu boli prechodné a približne po 24 mesiacoch dosiahli porovnateľné hladiny s tými, ktoré sa
pozorovali v skupine liečenej placebom. U pacientov liečených finerenónom (7,4 %) bola mierne
zvýšená anémia v porovnaní s pacientmi liečenými placebom (6,7 %). Frekvencia závažných príhod anémie bola nízka a vyvážená (0,5 % u pacientov liečených finerenónom oproti 0,7 % u pacientov liečených placebom).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNajpravdepodobnejším prejavom predávkovania sa predpokladá byť hyperkaliémia. Ak sa vyvinie hyperkaliémia, má sa začať štandardná liečba.
Nie je pre pravdepodobné, že by sa finerenón účinne odstránil pomocou hemodialýzy, keďže jeho podiel naviazaný na plazmatické proteíny je približne 90 %.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: diuretiká, antagonisty aldosterónu, ATC kód: C03DA05
Mechanizmus účinkuFinerenón je nesteroidný, selektívny antagonista mineralokortikoidného receptora (MR), ktorý je
aktivovaný aldosterónom a kortizolom a reguluje génovú transkripciu. Jeho väzba na MR vedie
k špecifickému komplexu receptora-ligandu, ktorý blokuje zapojenie transkripčných koaktivátorov zapojených do exprimácie prozápalových a profibrotických mediátorov.
Farmakodynamické účinky
V štúdii FIDELIO-DKD, randomizovanej, dvojito zaslepenej, placebom kontrolovanej,
multicentrickej štúdii fázy III u dospelých pacientov s CKD a T2D bolo relatívne zníženie pomeru močového albumínu/kreatinínu (Urinary Albumin-to-Creatinine Ratio, UACR) upravené podľa placeba u pacientov randomizovaných na liečbu finerenónom 31 % v 4. mesiaci.
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej, multicentrickej štúdii fázy IIb ARTS-DN u dospelých pacientov s CKD a T2D bolo relatívne zníženie UACR upravené podľa placeba v 90. dni 25 % a 38 % u pacientov liečených finerenónom 10 mg a 20 mg jedenkrát denne, v uvedenom poradí.
Elektrofyziológia srdca
Štúdia zameraná na interval QT s 57 zdravými účastníkmi ukázala, že finerenón nemá žiadny účinok na repolarizáciu srdca. Nepreukázal sa žiadny účinok finerenónu predlžujúci interval QT/QTc po podaní jednorazových dávok 20 mg (terapeutická dávka) alebo 80 mg (supraterapeutická dávka).
Klinická účinnosť a bezpečnosť
Štúdia FIDELIO-DKD skúmala účinok finerenónu v porovnaní s placebom na obličky
a kardiovaskulárne (KV) výsledky u dospelých pacientov s CKD a T2D. Pacienti boli spôsobilí na základe dôkazu pretrvávajúcej albuminúrie (>30 mg/g až 5 000 mg/g), hodnoty eGFR 25 až
75 ml/min/1,73 m2, hladiny draslíka v sére ≤4,8 mmol/l pri skríningu a vyžadovalo sa, aby dostávali
štandardnú liečbu vrátane maximálnej tolerovanej registrovanej dávky inhibítora angiotenzín- konvertujúceho enzýmu (Angiotensin-Converting Enzyme inhibitor, ACEi) alebo blokátora angiotenzínového receptora (Angiotensin Receptor Blocker, ARB). Pacienti s diagnostikovaným srdcovým zlyhávaním so zníženou ejekčnou frakciou a triedou II-IV podľa asociácie New York Heart Association boli vylúčení z dôvodu odporúčaní triedy 1A pre liečbu MRA.
Primárnym cieľovým ukazovateľom bol kompozit času do prvého výskytu zlyhania obličiek (definovaného ako chronická dialýza alebo transplantácia obličky alebo trvalé zníženie hodnoty eGFR na <15 ml/min/1,73 m2 počas najmenej 4 posledných týždňov), trvalé zníženie hodnoty eGFR o 40 % alebo viac v porovnaní s počiatočnou hodnotou počas najmenej 4 posledných týždňov alebo renálne úmrtie. Kľúčovým sekundárnym cieľovým ukazovateľom bol kompozit času do prvého výskytu KV úmrtia, nefatálneho infarktu myokardu (IM), nefatálnej cievnej mozgovej príhody alebo hospitalizácie z dôvodu srdcového zlyhávania.
Celkovo bolo 5 674 pacientov náhodne priradených na podávanie buď finerenónu (N=2 833) alebo placeba (N=2 841) a zaradených do analýzy. Medián času sledovania bol 2,6 roka. Dávka finerenónu alebo placeba sa mohla v priebehu štúdie upraviť medzi 10 mg a 20 mg jedenkrát denne, hlavne na základe koncentrácie draslíka v sére. V 24. mesiaci bolo z osôb liečených finerenónom 67 % liečených
20 mg jedenkrát denne, 30 % bolo liečených 10 mg jedenkrát denne a 3 % prerušili liečbu.
Po ukončení štúdie sa vitálny stav získal od 99,7 % pacientov. Populáciu štúdie tvorilo 63 % belochov,
25 % Ázijcov a 5 % černochov. Priemerný vek pri zaradení do štúdie bol 66 rokov a 70 % pacientov boli muži. Na začiatku štúdie bola priemerná hodnota eGFR 44,3 ml/min/1,73 m2, s 55 % pacientov
s hodnotou eGFR <45 ml/min/1,73 m2, medián UACR bol 852 mg/g a priemerná hodnota HbA1c bola
7,7 %, 46 % pacientov malo v anamnéze aterosklerotické KV ochorenie, 30 % malo v anamnéze ochorenie koronárnych artérií, 8 % malo v anamnéze srdcové zlyhávanie a priemerný krvný tlak bol
138/76 mm Hg. Priemerné trvanie T2D na začiatku štúdie bolo 16,6 rokov a u 47 % a 26 % pacientov
sa na začiatku štúdie hlásila diabetická retinopatia a diabetická neuropatia v anamnéze, v uvedenom poradí. Na začiatku štúdie boli skoro všetci pacienti liečení ACEi (34 %) alebo ARB (66 %) a 97 % pacientov používalo jeden alebo viacero antidiabetík (inzulín [64 %], biguanidy [44 %], agonisty receptorov glukagónu podobného peptidu-1 [GLP-1] [7 %], inhibítory sodíko-glukózového kotransportéra 2 [SGLT2] [5 %]). Ďalšími často užívanými liekmi na začiatku štúdie boli statíny
(74 %) a blokátory vápnikového kanála (63 %).
Štatisticky významný rozdiel v prospech finerenónu sa ukázal pre primárny kompozitný cieľový ukazovateľ a hlavný sekundárny kompozitný cieľový ukazovateľ (pozri obrázok 1/tabuľku 4 nižšie). Pre sekundárny cieľový ukazovateľ zmeny UACR od počiatočnej hodnoty do 4. mesiaca sa v skupine s finerenónom pozorovalo relatívne zníženie o 31,2 % v porovnaní s placebom. Účinok liečby bol pre primárne a sekundárne cieľové ukazovatele vo všeobecnosti konzistentný vo všetkých podskupinách, vrátane regiónu, hodnoty eGFR, UACR, systolického krvného tlaku a HbA1c na začiatku štúdie.
Tabuľka 4: Analýza primárnych a sekundárnych cieľových ukazovateľov času do výskytu príhody
(a ich jednotlivých komponentov) v štúdii fázy III FIDELIO-DKD
| Kerendia* (N=2 833)
| Placebo (N=2 841)
| Účinok liečby
|
N (%) Príhody
/100-pr
| N (%) Príhody
/100-pr
| HR (95 % CI)
|
Primárny renálny kompozitný cieľový ukazovateľ a jeho komponenty
Kompozit zlyhania obličiek, trvalého zníženia eGFR ≥ 40 % alebo renálneho úmrtia
504 (17,8) 7,59 600 (21,1) 9,08 0,82 (0,73; 0,93)

p=0,0014
Zlyhanie obličiek 208 (7,3) 2,99 235 (8,3) 3,39 0,87 (0,72; 1,05) Trvalé zníženie eGFR o 40 % 479 (16,9) 7,21 577 (20,3) 8,73 0,81 (0,72; 0,92) Renálne úmrtie 2 (<0,1) - 2 (<0,1) - -
Kľúčový sekundárny KV kompozitný cieľový ukazovateľ a jeho komponenty 367 (13,0)
| 5,11
| 420 (14,8)
| 5,92
| 0,86 (0,75; 0,99)
|
|
|
|
| p=0,0339
|
128 (4,5)
|
1,69
|
150 (5,3)
|
1,99
|
0,86 (0,68; 1,08)
|
70 (2,5)
|
0,94
|
87 (3,1)
|
1,17
|
0,80 (0,58; 1,09)
|
90 (3,2)
|
1,21
|
87 (3,1)
|
1,18
|
1,03 (0,76; 1,38)
|
139 (4,9)
|
1,89
|
162 (5,7)
|
2,21
|
0,86 (0,68; 1,08)
|
|
|
Kompozit KV úmrtia, nefatálneho IM, nefatálnej cievnej mozgovej príhody alebo hospitalizácie z dôvodu srdcového zlyhávania
KV úmrtie

Nefatálny IM
Nefatálna cievna mozgová
príhoda
Hospitalizácia z dôvodu
srdcového zlyhávania
Sekundárne cieľové ukazovatele účinnostiMortalita zo všetkých príčin 219 (7,7) 2,90 244 (8,6) 3,23 0,90 (0,75; 1,07)**
Hospitalizácia zo všetkých

príčin 1 263 (44,6) 22,56 1 321 (46,5) 23,87 0,95 (0,88; 1,02)**
Zlyhanie obličiek, trvalé zníženie eGFR ≥57% alebo
renálne úmrtie
252 (8,9) 3,64 326 (11,5) 4,74 0,76 (0,65; 0,90)**'
* Liečba 10 mg alebo 20 mg jedenkrát denne dodatočne k maximálnej tolerovanej registrovanej dávke ACEi alebo ARB.
** p=nie je štatisticky významné po úprave o multiplicitu
CI: Interval spoľahlivosti
HR: Pomer rizík
pr: pacientorokov
Obrázok 1: Čas do prvého výskytu zlyhania obličiek, trvalého zníženia eGFR o ≥ 40 % od počiatočnej hodnoty alebo renálne úmrtie v štúdii FIDELIO-DKD
0,50
0,45
0,40
Plánovaná liečba1: Finerenón (N = 2 833)2: Placebo (N = 2 841)
0,35
0,30
0,25

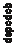
0,20
0,15
0,10
0,05
0,00
Počet subjektov v riziku
h
o výskytu príhody (mesiace)
Pediatrická
popu
lácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Kerendiou v jednej
alebo vo viacerých podskupinách pediatrickej populácie pre liečbu chronickej choroby obličiek
(informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Finerenón sa po perorálnom podaní takmer úplne absorbuje. Absorpcia je rýchla s maximálnymi
plazmatickými koncentráciami (Cₘₐₓ) objavujúcimi sa medzi 0,5 a 1,25 hodinami po užití tablety nalačno. Absolútna biologická dostupnosť finerenónu je 43,5 % a je sprostredkovaná metabolizmom prvého prechodu v stene čriev a pečeni. Finerenón je substrátom efluxného transportéra
P-glykoproteínu in vitro, ktorý sa však z dôvodu vysokej permeability finerenónu nepovažuje za významný pre jeho absorpciu in vivo.
Účinok jedla
Užívanie s vysokokalorickým jedlom s vysokým obsahom tukov zvýšilo expozíciu AUC finerenónu o 21 %, znížilo hodnotu Cₘₐₓ o 19 % a predĺžilo čas do dosiahnutia Cₘₐₓ na 2,5 hodiny. Keďže sa to nepovažuje za klinicky významné, finerenón sa môže užívať s jedlom alebo bez jedla.
Distribúcia
Objem distribúcie finerenónu v ustálenom stave (Vₛₛ) je 52,6 l. Väzba finerenónu na ľudské
plazmatické proteíny in vitro je 91,7 %, so sérovým albumínom ako hlavným väzbovým proteínom.
Biotransformácia
Približne 90 % metabolizmu je sprostredkovaných CYP3A4 a 10 % CYP2C8. V plazme sa našli štyri
hlavné metabolity. Všetky metabolity sú farmakologicky inaktívne.
Eliminácia
Eliminácia finerenónu z plazmy je rýchla s eliminačným polčasom (t½) približne 2 až 3 hodiny.
Systémový krvný klírens finerenónu je približne 25 l/h. Približne 80 % podanej dávky sa vylúčila
v moči a približne 20 % dávky sa vylúčila v stolici. Vylučovanie bolo skoro výlučne vo forme metabolitov, zatiaľ čo vylučovanie nezmeneného finerenónu predstavuje menej významnú cestu (<1 % dávky v moči prostredníctvom glomerulárnej filtrácie, <0,2 % v stolici).
Linearita
Farmakokinetické vlastnosti finerenónu sú lineárne v rámci skúmaného rozsahu dávky od 1,25 až
80 mg podávanej ako tablety s jednorazovou dávkou.
Osobitné skupiny pacientov
Starší pacienti
Z 2 827 pacientov, ktorí v štúdii FIDELIO-DKD dostávali finerenón, bolo 58 % pacientov vo veku
65 rokov a starších a 15 % bolo vo veku 75 rokov a starších. Medzi týmito pacientmi a mladšími pacientmi sa nepozorovali žiadne celkové rozdiely v bezpečnosti ani účinnosti.
V štúdii fázy I (N=48) vykazovali starší pacienti (vo veku ≥65 rokov) vyššie plazmatické koncentrácie finerenónu v porovnaní s mladšími pacientmi (vo veku ≤45 rokov), s priemernými hodnotami AUC
a Cₘₐₓ o 34 % a 51 % vyššími u starších pacientov (pozri časť 4.2). Populačné farmakokinetické analýzy neidentifikovali vek ako kovariát pre hodnoty AUC alebo Cₘₐₓ finerenónu.
Porucha funkcie obličiek
Mierna porucha funkcie obličiek (klírens kreatinínu [CLCR] 60 až <90 ml/min) nemala žiadny účinok na hodnoty AUC a Cₘₐₓ finerenónu.
V porovnaní s pacientmi s normálnou funkciou obličiek (CLCR ≥90 ml/min) bol účinok stredne ťažkej (CLCR 30 to <60 ml/min) alebo ťažkej (CLCR <30 ml/min) poruchy funkcie obličiek na hodnotu AUC finerenónu podobný, s nárastom o 34-36 %. Stredne ťažká až ťažká porucha funkcie obličiek nemala
žiadny účinok na hodnotu Cₘₐₓ (pozri časť 4.2).
Z dôvodu vysokej väzby na plazmatické proteíny sa pre finerenón neočakáva, že sa bude dať odstrániť dialýzou.
Porucha funkcie pečene
U pacientov s cirhózou s miernou poruchou funkcie pečene sa nevyskytla žiadna zmena v expozícii finerenónu (pozri časť 4.2).
U pacientov s cirhózou so stredne ťažkou poruchou funkcie pečene bola hodnota AUC pre celkový a nenaviazaný finerenón zvýšená o 38 % a 55 %, v uvedenom poradí, zatiaľ čo pre hodnotu Cₘₐₓ sa nepozorovala žiadna zmena v porovnaní so zdravými kontrolnými účastníkmi (pozri časť 4.2).
Nie sú k dispozícii žiadne údaje u pacientov s ťažkou poruchou funkcie pečene (pozri časti 4.2 a 4.5).
Telesná hmotnosť
Populačné farmakokinetické analýzy identifikovali telesnú hmotnosť ako kovariát pre hodnotu Cₘₐₓ
finerenónu. Hodnota Cₘₐₓ osoby s telesnou hmotnosťou 50 kg sa určila na 43 % až 51 % vyššiu
v porovnaní s osobou s telesnou hmotnosťou 100 kg. Úprava dávky na základe telesnej hmotnosti sa nestanovila (pozri časť 4.2).
Farmakokinetický/farmakodynamický vzťah
Vzťah účinku koncentrácie v čase pre UACR bol charakterizovaný modelom maximálneho účinku,
ktorý naznačoval nasýtenie pri vysokých expozíciách. Modelom predpovedaný čas na dosiahnutie úplného (99 %) účinku lieku na UACR v ustálenom stave bol 138 dní. Farmakokinetický polčas bol
2-3 hodiny a farmakokinetický ustálený stav sa dosiahol po 2 dňoch, čo naznačuje nepriamy a oneskorený účinok na farmakodynamické odpovede.
Klinické štúdie so žiadnymi významnými liekovými interakciami
Súbežné používanie gemfibrozilu (600 mg dvakrát denne), silného inhibítora CYP2C8, zvýšilo
priemerné hodnoty AUC a Cₘₐₓ finerenónu 1,1-násobne a 1,2-násobne, v uvedenom poradí. Nepovažuje sa to za klinicky významné.
Predliečba a súbežná liečba inhibítorom protónovej pumpy omeprazolom (40 mg jedenkrát denne)
nemala žiadny účinok na priemerné hodnoty AUC a Cₘₐₓ finerenónu.
Súbežné používanie s antacidami, hydroxidom hlinitým a hydroxidom horečnatým (70 mval), nemala žiadny účinok na priemernú hodnotu AUC a znížila priemernú hodnotu Cₘₐₓ finerenónu o 19 %. Nepovažuje sa to za klinicky významné.
In vivo nemal režim s viacnásobnou dávkou 20 mg finerenónu podávaného jedenkrát denne po dobu
10 dní žiadny významný účinok na hodnotu AUC skúšobného substrátu CYP3A4 midazolamu. Preto sa môže vylúčiť klinicky významná inhibícia alebo indukcia CYP3A4 finerenónom.
Jednorazová dávka 20 mg finerenónu tiež nemala žiadny klinicky významný účinok na hodnoty AUC
a Cₘₐₓ skúšobného substrátu CYP2C8 repaglinidu. Finerenón teda neinhibuje CYP2C8.
Nepreukázali sa žiadne vzájomné farmakokinetické interakcie medzi finerenónom a substrátom
CYP2C9 warfarínom a medzi finerenónom a substrátom p-gp digoxínom.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po jednorazovom podaní, toxicity po opakovanom podávaní, genotoxicity, fototoxicity, karcinogénneho potenciálu a samčej a samičej fertility neodhalili žiadne osobitné riziko pre ľudí.
Toxicita po opakovanom podávaní
U psov sa zistila znížená hmotnosť a veľkosť prostaty pri približne 10 až 60-násobne vyššej hodnote
AUCnenaviaz. ako u ľudí. Dávka bez akýchkoľvek nálezov poskytovala bezpečnostné rozpätie približne
2-násobnej hodnoty.
Karcinogénny potenciál
V 2-ročných štúdiách karcinogenity nepreukázal finerenón karcinogénny potenciál u samcov a samíc
potkanov ani samíc myší. U samcov myší viedol finerenón k zvýšeniu výskytu adenómu Leydigových buniek v dávkach predstavujúcich 26-násobok hodnoty AUCnenaviaz. u ľudí. Dávka predstavujúca
17-násobok hodnoty AUCnenaviaz. u ľudí nespôsobila vznik žiadnych nádorov. Na základe známej
citlivosti hlodavcov na rozvoj týchto nádorov a farmakologických mechanizmov pri supraterapeutických dávkach ako aj primeraného bezpečnostného rozpätia nie je zvýšenie výskytu nádorov Leydigových buniek u samcov myší klinicky významné.
Vývojová toxicita
V štúdii embryofetálnej toxicity u potkanov viedol finerenón k zníženým placentálnym hmotnostiam
a prejavom fetálnej toxicity, vrátane zníženej hmotnosti plodov a oneskorenej osifikácie pri dávke toxickej pre matku 10 mg/kg/deň, zodpovedajúcej 19-násobným hodnotám AUCnenaviaz. u ľudí. Pri dávke 30 mg/kg/deň sa zvýšil výskyt viscerálnych a skeletálnych variácií (mierny edém, skrátená pupočná šnúra, mierne zväčšenie fontanely) a plody preukazovali komplexné malformácie vrátane zriedkavých malformácií (dvojitý aortálny oblúk) pri približne 25-násobne vyšších hodnotách AUCnenaviaz. ako u ľudí. Dávky bez akýchkoľvek nálezov (nízka dávka u potkanov, vysoká dávka
u králikov) poskytovali bezpečnostné rozpätie 10 až 13-násobnej hodnoty AUCnenaviaz. Preto nálezy u potkanov nenaznačujú zvýšené riziko poškodenia plodu.
Keď boli potkany vystavené lieku počas gravidity a laktácie v štúdiách toxicity pre- a postnatálneho vývoja, pozorovali sa zvýšená úmrtnosť mláďat a iné nežiaduce účinky (nižšia telesná hmotnosť mláďat, oneskorené rozvinutie ušnice) pri približne 4-násobnej hodnote AUCnenaviaz. očakávanej u ľudí. Okrem toho preukazovali mláďatá mierne zvýšenú pohybovú aktivitu, avšak žiadne iné neurobehaviorálne zmeny začínajúc približne 4-násobnou hodnotou AUCnenaviaz. očakávanou u ľudí.
Dávka bez akýchkoľvek nálezov poskytovala bezpečnostné rozpätie približne 2-násobnej hodnoty
AUCnenaviaz. Zvýšená pohybová aktivita mláďat môže naznačovať možné riziko pre plod. Okrem toho nemôže byť z dôvodu týchto nálezov u mláďat vylúčené riziko u dojčených novorodencov/dojčiat.
Samičia fertilita
Finerenón spôsoboval zníženú fertilitu u samíc (znížený počet corpora lutea a implantačných miest)
ako aj prejavy skorej embryonálnej toxicity (zvýšená poimplantačná strata a znížený počet životaschopných plodov) pri približne 21-násobnej hodnote AUCnenaviaz. u ľudí. Okrem toho sa zistila znížená hmotnosť vaječníkov pri približne 17-násobnej hodnote AUCnenaviaz. u ľudí. Pri 10-násobnej hodnote AUCnenaviaz. u ľudí sa nenašli žiadne účinky na fertilitu samíc ani skorý embryonálny vývoj. Preto majú nálezy u samíc potkanov len malý klinický význam (pozri časť 4.6).
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety
Celulóza, mikrokryštalická
Sodná soľ kroskarmelózy
Hypromelóza 2910
Monohydrát laktózy Stearát horečnatý Laurylsulfát sodný
Obal tablety
Hypromelóza 2910
Oxid titaničitý
Mastenec
Kerendia 10 mg filmom obalené tablety
Červený oxid železitý (E 172)
Kerendia 20 mg filmom obalené tablety
Žltý oxid železitý (E 172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
PVC/PVDC/hliníkové, priesvitné blistre s kalendárnymi údajmi obsahujúce 14 filmom obalených tabliet. Veľkosti balenia: 14, 28 alebo 98 filmom obalených tabliet.
PVC/PVDC/hliníkové, priesvitné, perforované blistre s jednotkovými dávkami obsahujúce
10 x 1 filmom obalenú tabletu. Veľkosť balenia: 100 x 1 filmom obalená tableta.
Biela, nepriehľadná HDPE fľaša s bielym nepriehľadným polypropylénovým detským bezpečnostným skrutkovacím viečkom s tesniacou vložkou. Veľkosť balenia: 100 filmom obalených tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Bayer AG
51368 Leverkusen
Nemecko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
Kerendia 10 mg filmom obalené tablety
EU/1/21/1616/001-005
Kerendia 20 mg filmom obalené tablety
EU/1/21/1616/006-010
9
. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.